通訊作者:張力 教授
第一作者:趙媛媛 教授
文章鏈接: www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00116-2
肺癌是全球最常見惡性腫瘤之一,是中國發病率、死亡率最高的惡性腫瘤。中國國家癌癥中心2024年發布最新報告顯示,2022年中國肺癌新發病例106.06萬例,死亡73.33萬例,遠超其他腫瘤類型。非小細胞肺癌(NSCLC)約占所有肺癌的80%-90%,約57%的患者診斷時已發生轉移。近年來免疫檢查點抑制劑在晚期非小細胞肺癌治療領域取得了進展,但患者的總體預后和遠期療效仍然亟待提高。
KN046-202是一項Ⅱ期、開放、多中心臨床研究,旨在評估KN046聯合化療一線治療轉移性非小細胞肺癌的療效、安全性和耐受性。入組患者在每個周期(3周為1個周期)第1天接受KN046+卡鉑+培美曲塞(非鱗狀NSCLC)/紫杉醇(鱗狀NSCLC)。4個周期后非鱗狀NSCLC采用 KN046+培美曲賽維持治療,鱗狀NSCLC采用KN046單藥維持治療。主要終點是確認的客觀緩解率(ORR)和緩解持續時間(DoR),由研究者根據 RECIST 1.1 進行評估。
研究共入組87例患者,其中 51例為非鱗狀NSCLC隊列,36例為鱗狀NSCLC隊列。中位年齡61歲(32-76歲),其中75.9%為男性。截止2022年3月15日,中位隨訪時間23.1個月。
療效:確認的客觀緩解率(ORR)為46.0%(95% CI:35.2%-57.0%),中位緩解持續時間(DoR)為8.1 (95% CI:4.14-13.90) 個月。中位無進展生存期(PFS)為5.8 (95% CI: 5.26-7.10)個月,中位總生存期(OS)為26.6 (95%CI:16.92-NR)個月,12個月OS率為74.2%(95% CI:63.46%-82.18%)。非鱗狀NSCLC隊列,確認的ORR為43.1%,中位DoR為9.7個月,中位PFS為5.8個月,中位生存期為27.2個月;在鱗狀NSCLC隊列,確認的ORR為50.0%,中位DoR為7.3個月,中位PFS為5.7個月,中位生存期為26.6月。
安全性:87例患者全部納入安全性分析。最常見的藥物相關不良事件(TRAE)是貧血(87.4%)、食欲減退(72.4%)和中性粒細胞計數降低(70.1%)。免疫相關不良事件(irAE)、3級及以上irAE和嚴重irAE發生例數分別為50例(57.5%)、11例(12.6%)和9例(10.3%)。最常見的irAE是瘙癢(28.7%)、天門冬氨酸氨基轉氨酶升高(24.1%)和皮疹(21.8%)。
結果表明,KN046聯合含鉑雙藥化療一線治療轉移性非小細胞肺癌療效可觀且耐受性好。研究有望為該患者群體提供有前景的治療方案。
關于KN046
KN046是康寧杰瑞研發的PD-L1/CTLA-4雙特異性抗體,具有自主知識產權。KN046創新設計包括:采用機制不同的CTLA-4與PD-L1單域抗體融合組成;可靶向富集于PD-L1高表達的腫瘤微環境及清除抑制腫瘤免疫的Treg細胞。
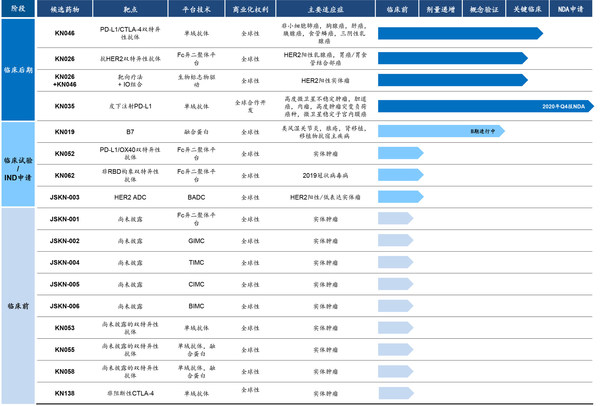
KN046在澳大利亞、美國和中國已開展覆蓋非小細胞肺癌、胰腺癌、胸腺癌、肝癌、食管鱗癌、三陰乳腺癌等10余種腫瘤的近20項不同階段臨床試驗,試驗結果顯示患者獲得生存獲益的優勢。美國FDA基于在澳大利亞和中國取得的臨床試驗結果,批準KN046在美國直接進入Ⅱ期臨床試驗,并于2020年9月授予KN046用于治療胸腺上皮腫瘤的孤兒藥資格。目前KN046多項注冊臨床試驗正在進行中,其中KN046聯合化療一線治療非小細胞肺癌的Ⅲ期臨床研究中期分析成功達到預設PFS終點。
關于康寧杰瑞
康寧杰瑞是一家創新型生物制藥公司,致力于發現、開發、生產和商業化世界一流的抗腫瘤藥物,為患者提供創新生物療法。2019年12月12日,公司在香港聯交所主板上市(股票代碼:9966.HK)。
康寧杰瑞創建了具有自主知識產權的蛋白質/抗體工程、抗體篩選、多模塊/多功能抗體修飾等生物大分子藥物研發和生產技術平臺。打造了具有顯著差異化優勢和強大國際競爭力的產品管線,涵蓋單域抗體/單抗、多功能抗體及抗體偶聯物等抗腫瘤創新藥:其中1個產品KN035(全球首個皮下注射PD-(L)1抑制劑,恩沃利單抗注射液,商品名:恩維達®)已于2021年在中國獲批上市,成為腫瘤患者廣泛可及的藥物; 3個產品處于后期臨床開發階段;HER2雙抗KN026獲中國NMPA突破性療法認定。并且公司擁有豐富的早期研發管線,其中2個新藥分子已進入臨床研究階段。
"康達病患,瑞濟萬家"。康寧杰瑞始終聚焦未滿足的臨床需求,不斷開發安全、負擔得起、具有全球競爭優勢的抗腫瘤藥物,惠及患者。
通訊作者:徐兵河 院士
第一作者:李俏 教授
文章鏈接:https://doi.org/10.1038/s41467-024-45160-y
本研究是一項開放、多中心、多隊列、單臂Ⅱ期臨床研究(KN046-203),旨在評估KN046聯合白蛋白結合型紫杉醇在晚期三陰乳腺癌患者中的有效性、安全性和耐受性。研究共入組27例初治局部晚期不可切除或轉移性三陰乳腺癌女性患者。
截至2022年8月21日,經過獨立影像委員會(IRC)的評估,25例可評估的三陰乳腺癌患者的客觀緩解率(ORR)為44.0%(95% CI:24.4~65.1%),疾病控制率(DCR)為96.0%(95% CI:79.7~99.9%),臨床獲益率(CBR)為52.0%(95% CI:31.1~72.2%),中位緩解持續時間(DOR)尚未達到。意向治療人群(ITT)的中位PFS為7.33個月(95%CI: 3.68~11.07),PD-L1陽性患者的中位PFS可達8.61個月(95% CI:1.61~NE)。意向治療人群的中位OS可達30.92個月(95% CI:14.75~NE),24個月OS率為60.1%(95% CI:37.2~76.9%),無論患者的PD-L1是否陽性,都可以從該療法中得到生存獲益。
納入安全性分析的27例患者中,18例患者(66.7%)發生≥3級的治療相關的不良事件(TRAE);6例患者(22.2%)發生治療相關的嚴重不良事件(TRSAE);13例患者(48.1%)發生免疫相關不良事件(irAEs),僅有3例患者發生3級irAEs,分別為2例3級免疫介導性肝病和1例3級皮疹。
結果表明,KN046聯合白蛋白結合型紫杉醇一線治療三陰乳腺癌顯示出令人欣喜的無進展生存期(PFS)和總生存期(OS)獲益,且耐受性良好,安全性可控。
關于KN046
KN046是康寧杰瑞研發的PD-L1/CTLA-4雙特異性抗體,具有自主知識產權。KN046創新設計包括:采用機制不同的CTLA-4與PD-L1單域抗體融合組成;可靶向富集于PD-L1高表達的腫瘤微環境及清除抑制腫瘤免疫的Treg細胞。
KN046在澳大利亞、美國和中國已開展覆蓋非小細胞肺癌、胰腺癌、胸腺癌、肝癌、食管鱗癌、三陰乳腺癌等10余種腫瘤的近20項不同階段臨床試驗,試驗結果顯示患者獲得生存獲益的優勢。美國FDA基于在澳大利亞和中國取得的臨床試驗結果,批準KN046在美國直接進入Ⅱ期臨床試驗,并于2020年9月授予KN046用于治療胸腺上皮腫瘤的孤兒藥資格。目前KN046多項注冊臨床試驗正在進行中,其中KN046聯合化療一線治療非小細胞肺癌的Ⅲ期臨床研究中期分析成功達到預設PFS終點。
關于康寧杰瑞
康寧杰瑞是一家創新型生物制藥公司,致力于發現、開發、生產和商業化世界一流的抗腫瘤藥物,為患者提供創新生物療法。2019年12月12日,公司在香港聯交所主板上市(股票代碼:9966.HK)。
康寧杰瑞創建了具有自主知識產權的蛋白質/抗體工程、抗體篩選、多模塊/多功能抗體修飾等生物大分子藥物研發和生產技術平臺。打造了具有顯著差異化優勢和強大國際競爭力的產品管線,涵蓋單域抗體/單抗、多功能抗體及抗體偶聯物等抗腫瘤創新藥:其中1個產品KN035(全球首個皮下注射PD-(L)1抑制劑,恩沃利單抗注射液,商品名:恩維達®)已于2021年在中國獲批上市,成為腫瘤患者廣泛可及的藥物; 3個產品處于后期臨床開發階段;HER2雙抗KN026獲中國NMPA突破性療法認定。并且公司擁有豐富的早期研發管線,其中2個新藥分子已進入臨床研究階段。
"康達病患,瑞濟萬家"。康寧杰瑞始終聚焦未滿足的臨床需求,不斷開發安全、負擔得起、具有全球競爭優勢的抗腫瘤藥物,惠及患者。
韓凈先生深耕中國醫藥市場二十多年,曾先后服務于包括默沙東、勃林格殷格翰、阿斯利康、拜耳、羅氏在內的全球知名跨國制藥企業,和君實生物等中國創新生物藥企,在組建和領導商業化團隊、制定和執行商業化策略等方面積累了豐富的經驗。在加入康寧杰瑞之前,韓凈先生在嘉和生物擔任高級副總裁,負責組建營銷團隊及上市前各項商業化工作。
康寧杰瑞董事長兼總裁徐霆博士表示:“歡迎韓凈先生加入康寧杰瑞。自公司創立以來,我們始終致力于打造一家全產業鏈的,具有國際競爭力的創新型生物制藥公司。目前公司即將迎來首個上市產品,我們的核心產品KN046也計劃于明年提交上市申請。韓凈先生在跨國和本土藥企擁有豐富的商業化經驗,多次帶領團隊將優秀的創新藥物成功推向市場,惠及廣大患者。我們相信他的加入將加速推進KN046和后續重磅產品的商業化進程。”
康寧杰瑞首席商務官韓凈先生表示:“在日新月異的中國生物制藥創新浪潮中,康寧杰瑞無疑是一顆璀璨的明星,公司在徐霆董事長的帶領下,開創了各種多功能抗體開發平臺,集卓越的研發和生產技術于一身。我非常認可董事長和公司‘讓腫瘤成為可控、可治的疾病’的使命,以及‘立足中國,放眼世界’的戰略,相信康寧杰瑞在不久的將來一定會有眾多‘First in class’、‘Best in class’的產品惠及海內外患者,我會和公司同仁攜手為之奮斗!”
韓凈先生1996年畢業于上海市第二醫科大學臨床醫學系,開始從事普外科醫生工作,直至1998年選擇加入默沙東,開啟此后20多年的藥企職業生涯。2018年,韓凈先生獲得中歐國際商學院EMBA學位。
關于康寧杰瑞
康寧杰瑞生物制藥專注于研發、生產和商業化創新抗腫瘤藥物。2019年12月12日,公司在香港聯合交易所主板上市,股票代碼:9966。
康寧杰瑞生物制藥在雙特異性抗體及蛋白質工程方面擁有全產業鏈的發現、研發和制造平臺。公司產品管線包括具有自主知識產權的、高度差異化的15種以雙抗為主的抗腫瘤候選藥物,和一種Covid-19的多功能抗體,其中四個產品在中國、美國、日本、澳大利亞處于Ⅰ-Ⅲ期臨床。恩沃利單抗注射液(KN035)上市申請已獲國家藥品監督管理局(NMPA)正式受理并納入優先審評。
公司擁有異二聚體及混合抗體等多個具有自主知識產權的技術平臺,和符合中國、美國和歐盟cGMP標準的大規模生產能力,并且通過包括歐盟QP在內多次審計的完整的質量體系。公司致力于建設國際領先的、多維度的藥物開發和產業化平臺,聚焦多功能生物大分子新藥,惠及中國和全球的患者。
歡迎訪問公司網站:www.alphamabonc.com
ENREACH-LUNG-01是一項KN046聯合含鉑化療在晚期不可切除或轉移性鱗狀非小細胞肺癌患者中開展的多中心、隨機、雙盲、安慰劑對照性Ⅲ期臨床研究,由上海市肺科醫院周彩存教授擔任主要研究者,在全國60多家研究中心開展,計劃招募約500例患者以評估KN046-5mg劑量下聯合化療的安全性和有效性。
會上,同濟大學附屬上海市肺科醫院腫瘤科主任周彩存教授致開場辭,從全球肺癌治療領域的學術研究角度,對KN046的ENREACH-LUNG-01試驗給予高度評價并寄予厚望,周彩存教授表示:“免疫療法是肺癌治療領域的重要研究進展,國際上眾多研究讓患者看到了曙光,但患者的總體預后和遠期療效仍然亟待提高。康寧杰瑞是中國腫瘤免疫治療藥企中的佼佼者,公司自主研發的雙特異性抗體KN046的ENREACH-LUNG-01試驗是全球首個雙抗Ⅲ期臨床試驗,其有潛力改變肺癌的治療格局。我們期待各位研究者共同努力,早日完成這項研究,推動中國原研的最前沿、高質量的免疫治療藥物走向世界,為全球肺癌治療增添中國力量。”
康寧杰瑞董事長兼總裁徐霆博士致歡迎辭,提綱挈領地概述了康寧杰瑞在抗腫瘤生物藥領域的研發情況。徐霆博士表示:“康寧杰瑞始終專注于創新抗腫瘤生物大分子藥物的研發、生產和商業化,并重點關注尚未滿足的腫瘤治療需求。KN046具有獨特抗腫瘤機制,在肺癌、胸腺癌、三陰乳腺癌等難治性腫瘤臨床項目中顯示出了令人印象深刻的患者生存獲益。ENREACH-LUNG-01試驗是全球范圍內第一個雙特異性抗體Ⅲ期臨床試驗,有潛力取得極具價值的臨床證據,為全球腫瘤治療帶來指導意義。我們期待在各地試驗中心各位專家的共同努力下早日完成試驗,為廣大腫瘤患者帶來生存福祉。”
康寧杰瑞首席醫學官Johannes Nippgen 博士重點介紹了臨床階段新藥的開發策略及臨床開發計劃。Johannes Nippgen 博士表示:“KN046在前期多個腫瘤適應癥超過600例患者參與的臨床研究中顯示出良好的安全性和療效,我們對這項全球首個啟動的PD-L1/ CTLA-4 雙特異性抗體大規模Ⅲ期臨床研究充滿期待,希望能夠通過這項研究不僅為全球肺癌患者提供新的治療選擇,也能夠為我們持續利用公司的技術平臺開發全新藥物提供新的思路和方向。”
會議由同濟大學附屬上海市肺科醫院腫瘤科主任周彩存教授、浙江大學第一附屬醫院腫瘤內科主任徐農教授主持,上海肺科醫院熊安穩教授、鄭州大學第一附屬醫院李醒亞教授分別分享了ENREACH-LUNG-01臨床研究的經驗和非小細胞肺癌研究進展,目前這一多中心Ⅲ期臨床研究已經在50多家研究中心啟動,入組進展順利,預計5月份全國約60家研究中心將全部啟動,預計今年年底將看到首次期中分析數據。
關于KN046
KN046是康寧杰瑞自主研發的PD-L1/CTLA-4雙特異性抗體,其創新設計包括:采用機制不同的CTLA-4與PD-L1單域抗體融合組成;可靶向富集于PD-L1高表達的腫瘤微環境及清除抑制腫瘤免疫的Treg。
KN046在澳大利亞和中國已開展覆蓋非小細胞肺癌、三陰乳腺癌、食管鱗癌、肝癌、胰腺癌等10余種腫瘤的近20項不同階段臨床試驗,試驗結果顯示患者獲得生存獲益的優勢。美國FDA基于在澳大利亞和中國取得的臨床試驗結果,批準KN046在美國直接進入Ⅱ期臨床試驗,并于2020年9月授予KN046用于治療胸腺上皮腫瘤的孤兒藥資格。目前KN046兩個注冊臨床試驗正在進行中。
關于康寧杰瑞
康寧杰瑞生物制藥專注于研發、生產和商業化創新抗腫瘤藥物。2019年12月12日,公司在香港聯合交易所主板上市,股票代碼:9966。
康寧杰瑞生物制藥在雙特異性抗體及蛋白質工程方面擁有全產業鏈的發現、研發和制造平臺。公司產品管線包括具有自主知識產權的、高度差異化的15種以雙抗為主的抗腫瘤候選藥物,和一種Covid-19的多功能抗體,其中四個產品在中國、美國、日本、澳大利亞處于Ⅰ-Ⅲ期臨床。恩沃利單抗注射液(KN035)上市申請已獲國家藥品監督管理局(NMPA)正式受理并納入優先審評。
公司擁有異二聚體及混合抗體等多個具有自主知識產權的技術平臺,和符合中國、美國和歐盟cGMP標準的大規模生產能力,并且通過包括歐盟QP在內多次審計的完整的質量體系。公司致力于建設國際領先的、多維度的藥物開發和產業化平臺,聚焦多功能生物大分子新藥,惠及中國和全球的患者。
徐偉豪先生在全球資本市場、股權投資和財務管理領域擁有10多年的經驗。徐先生在多家上市公司和國際投資機構擔任重要職位。他曾擔任CASI Pharmaceuticals和111 Inc.(1藥網)首席財務官;在投資領域,曾在Matthews International等多家國際投資機構擔任基金經理,負責全球股權投資。徐偉豪先生擁有哥倫比亞大學商學院金融會計碩士學位,并在哈佛大學醫學院完成了癌癥研究深造文憑。
康寧杰瑞董事長兼總裁徐霆博士表示:“歡迎偉豪加入康寧杰瑞。作為基金經理和首席財務官,徐偉豪先生對健康產業,尤其是生物制藥領域相關的資本運作、行業動態和發展趨勢有深入的了解。偉豪的加盟,會加強我們和投資人的溝通,協助公司發展戰略的制定和實施,以及我們核心產品全球開發和商務合作的推進。我們期待一起推動公司的成長進階,為腫瘤患者提供更多更有效的治療選擇,為股東帶來更高的價值。”
徐偉豪先生表示:“康寧杰瑞擁有全球領先的技術平臺和創新產品管線,并即將迎來公司的首個商業化產品。我非常高興能夠在公司價值成長的關鍵階段加入康寧杰瑞。作為公司IPO以來的主要投資者之一,我對公司的臨床和研發進展留下了深刻的印象。我希望能夠通過自己在全球市場、生物科技投資領域以及業務拓展戰略方面的經驗,進一步推動公司的成長。”
關于康寧杰瑞
康寧杰瑞生物制藥專注于研發、生產和商業化創新抗腫瘤藥物。2019年12月12日,公司在香港聯合交易所主板上市,股票代碼:9966。
康寧杰瑞生物制藥在雙特異性抗體及蛋白質工程方面擁有全產業鏈的發現、研發和制造平臺。公司產品管線包括具有自主知識產權的、高度差異化的15種以雙抗為主的抗腫瘤候選藥物,和一種Covid-19的多功能抗體,其中四個產品在中國、美國、日本、澳大利亞處于I-III期臨床。恩沃利單抗注射液(KN035)上市申請已獲國家藥品監督管理局(NMPA)正式受理并納入優先審評。
公司擁有異二聚體及混合抗體等多個具有自主知識產權的技術平臺,和符合中國、美國和歐盟cGMP標準的大規模生產能力,并且通過包括歐盟QP在內多次審計的完整的質量體系。公司致力于建設國際領先的、多維度的藥物開發和產業化平臺,聚焦多功能生物大分子新藥,惠及中國和全球的患者。
歡迎訪問公司網站:www.alphamabonc.com
康寧杰瑞董事長兼總裁徐霆博士表示:“2020年是康寧杰瑞發展史上具有里程碑意義的一年,公司多項業務均取得了關鍵進展。全球首個皮下注射PD-L1抑制劑恩沃利單抗遞交上市申請,于春節前獲得優先審評資格;4項關鍵臨床研究啟動,3個在研產品獲得美國FDA授予孤兒藥資格,9項IND獲批;雙特異性抗體KN046、KN026在全球多項臨床研究中獲得積極的數據;公司與輝瑞、賽諾菲、中科院上海巴斯德研究所等10個國內外合作伙伴達成戰略合作;設計總產能超過3萬升的新生產基地一期生產線獲得了藥品生產許可證。
2021年,公司預期將迎來第一個獲批上市的產品,這意味著我們將從研發創新的biotech正式步入商業化階段。目前公司自主研發的高度差異化管線產品已從9個擴展至16個。包括前默克中國研發中心負責人Johannes Nippgen博士在內的多名高管陸續加入公司,公司管理團隊進一步壯大。今年我們預期將看到KN046首個Ⅲ期臨床研究的中期分析數據,多項臨床研究數據將在今年召開的國際學術會議上公布,多項新的關鍵/注冊臨床研究將在今年啟動……公司全員已經做好充分的準備,迎接新的機遇和挑戰,持續用我們的創新成果為患者、股東和社會創造新的價值,為踐行公司使命、助力健康美好的未來而前行。”
公司業務發展亮點
一、產品管線
公司高度差異化的內部管線由十六種候選藥物組成,其中一種已提交BLA、三種處于臨床后期階段,并計劃于2021年提交2至3項IND申請。
KN035(恩沃利單抗注射液)
全球第一個可皮下注射的PD-L1抑制劑,具有安全性、便利性、依從性、適用于不適合靜脈輸液的患者以及較低的醫療成本等優點。KN035的首個BLA獲中國國家藥品監督管理局受理并獲得優先審評,預計在今年獲批上市。
報告期間內進展
- 公司在2020年ASCO年會上公布KN035針對錯配修復功能缺陷晚期腫瘤患者及KN035和化療聯合療法用于治療晚期胃或胃食管結合部腫瘤(GC/GEJ)的臨床試驗結果。
- 2020年7月16日,公司幫助美國合作伙伴TRACON提交關于KN035用于兩種軟組織肉瘤亞型(ENVASARC)(分別為未分化多形性肉瘤及粘液纖維肉瘤)關鍵試驗的IND申請。8月14日,TRACON收到FDA關于該研究可在美國進行的批準通知。
- 2020年12月,在美國的ENVASARC注冊臨床試驗完成首例患者給藥。
- 2020年12月17日,KN035的BLA獲中國國家藥監局受理,申請的適應癥為標準治療失敗的微衛星不穩定(MSI-H)/錯配修復功能缺陷(dMMR)晚期結直腸癌、胃癌及其他晚期實體瘤。
報告期間后進展
- 2021年1月,KN035獲中國國家藥監局藥品審評中心授予優先評審。
KN046
一種雙特異性抗體,同時靶向兩個臨床驗證的免疫檢查點PD-L1及CTLA-4,為具有潛在突破性的新一代腫瘤免疫重磅藥物。目前,中國、美國及澳大利亞有約20項涵蓋10多類腫瘤、處于多個階段的臨床試驗正在進行中,包括非小細胞肺癌(NSCLC)、肝癌(HCC)、胰腺癌、三陰乳腺癌(TNBC)、食管癌(ESCC)及胸腺癌等。臨床試驗的結果顯示了KN046良好的安全性及初步有效性。
報告期間內進展
- 2020年4月15日,江蘇康寧杰瑞收到FDA的批準通知,批準KN046可在美國針對NSCLC進行Ⅱ期臨床試驗。
- 2020年5月12日,江蘇康寧杰瑞兩項IND申請獲得CDE批準,包括:評估KN046聯合KN026治療HER2陽性或HER2表達實體腫瘤的有效性、安全性及耐受性的Ⅰb期臨床研究;對甲苯磺酸寧格替尼聯合KN046治療晚期HCC的多中心、開放式標簽Ⅰb/Ⅱ期臨床試驗。
- 公司在2020年ASCO年會上公布KN046在中國針對之前ICI(免疫檢查點抑制劑治療)失效的患者的劑量遞增及擴展Ⅰa/Ⅰb期臨床試驗的初步療效和安全性數據。結果顯示耐受性良好,KN046對以往ICI治療失敗的晚期實體腫瘤患者表現出良好的安全性及前景良好的臨床益處。
- 2020年9月2日,FDA授予KN046孤兒藥資格,用以治療胸腺上皮腫瘤(TET)。
- 2020年9月3日,江蘇康寧杰瑞正式在中國和美國啟動KN046治療胸腺癌的關鍵性Ⅱ期臨床試驗。
- 2020年9月,江蘇康寧杰瑞完成ENREACH-LUNG-01首例患者給藥。ENREACH-LUNG-01是一項評估KN046聯合鉑基化療在晚期不可切除或轉移性鱗狀NSCLC患者中的療效與安全性的多中心、隨機、雙盲、安慰劑對照Ⅲ期臨床試驗。
報告期間后進展
- 2021年1月,ENREACH-Thymic注冊臨床試驗完成首例患者給藥。ENREACH-Thymic是一項評估KN046用于晚期胸腺癌的療效、安全性和耐受性的關鍵性Ⅱ期、開放式標簽、多中心臨床研究。
- 2021年1月,公司在2021 ASCO胃腸道腫瘤研討會年會上展示KN046聯合放化療治療復發和轉移性ESCC的初步療效及安全性的數據。
- 2021年2月,KN046聯合澤璟研發的口服多重激酶抑制劑多納非尼片治療晚期或轉移性HCCⅠ/Ⅱ期臨床試驗完成首例患者給藥。
- 公司在WCLC 2020上展示KN046治療晚期NSCLC患者的Ⅱ期臨床研究數據。中位隨訪期為13個月,中位PFS為3.68個月(95% CI:3.35,7.29),其中鱗狀NSCLC和非鱗狀NSCLC分別為7.29個月(3.68,9.23)和3.58個月(2.46,5.52),優于中國患者采用PD-1療法的歷史數據。其表明KN046具有良好的耐受性,用于晚期NSCLC的二線治療有效,在NSCLC中顯示出PFS及OS獲益。
- 公司在WCLC 2020上展示KN046治療罕見胸部腫瘤患者的Ⅰ期臨床研究的初步安全性及療效數據。在胸腺上皮腫瘤中的已確認ORR為50%,未確認ORR為75%,DCR為100%。
KN026
新一代抗HER2雙特異性抗體,可以同時結合兩種不同的經臨床驗證的HER2表位,從而產生潛在的卓越療效。
報告期間內進展
- 2020年5月12日,江蘇康寧杰瑞兩項IND申請獲得CDE批準,包括:評估KN026聯合KN046治療HER2陽性或HER2表達實體腫瘤的有效性、安全性及耐受性的Ⅰb期臨床研究;評估KN026作為單一療法或聯合治療HER2低表達或HER2陽性復發/轉移性乳腺癌(mBC)有效性及安全性的Ⅱ期臨床研究。
- 公司在2020年ASCO年會上公布KN026在中國針對HER2陽性轉移性乳腺癌(mBC)患者的Ⅰ期臨床試驗數據。結果顯示,KN026耐受性良好,在標準抗HER2治療失敗的HER2陽性乳腺癌患者中顯示出令人鼓舞的抗腫瘤活性。
- 公司在SITC 2020上展示初步臨床數據。KN026與KN046的聯合療法已于針對標準治療失敗的HER2陽性實體瘤患者的Ⅰb期臨床試驗取得初步正面結果。
- 2020年12月,江蘇康寧杰瑞KN026聯合KN046的Ⅱ期臨床試驗SEARCH-01研究完成首例患者給藥。SEARCH-01是一項開放式標簽、Ⅱ期、多中心臨床研究,旨在評估KN026聯合KN046治療HER2陽性實體瘤的有效性、安全性和耐受性。
- 2020年12月,FDA授予KN026及KN046聯合療法孤兒藥資格,用于治療HER2陽性或低表達胃癌及胃食管連接部癌(GC/GEJ)。這是FDA授予公司的第三個孤兒藥資格。
- 2020年12月,公司收到中國國家藥監局就KN026聯合愛博新®(哌柏西利)或KN026與愛博新®(哌柏西利)和氟維司群聯合療法的IND申報批準,用于曲妥珠單抗和紫杉類藥物治療失敗的HER2陽性局部晚期不可切除及/或轉移性乳腺癌的治療。
二、業務運營
報告期間內動態
- 2020年5月22日,江蘇康寧杰瑞與InxMed訂立一份合作伙伴協議,共同開展KN046與黏著斑激酶抑制劑IN10018作為聯合療法,以探索KN046與IN10018聯合用藥的協同增效作用。
- 2020年5月28日,江蘇康寧杰瑞與廣東東陽光訂立新合作協議以擴大原有合作,雙方同意共同開發多靶點小分子激酶抑制劑CT053(對甲苯磺酸寧格替尼)與KN046用于實體腫瘤領域的抗腫瘤聯合療法。
- 2020年6月9日,江蘇康寧杰瑞與賽諾菲訂立獨家選擇權協議以進行戰略合作,推進KN026與賽諾菲的產品泰索帝®聯合用于HER2陽性乳腺癌患者的臨床研究。
- 2020年6月10日,江蘇康寧杰瑞與上海巴斯德研究所訂立合作開發協議,就COVID-19多特異中和抗體的共同開發、生產及商業化進行合作。
- 2020年6月19日,江蘇康寧杰瑞與信諾維訂立一份合作伙伴協議,推動KN046與小分子抑制劑XNW7201作為聯合療法在腫瘤適應癥的開發。
- 2020年7月30日,江蘇康寧杰瑞與開拓藥業訂立一份合作伙伴協議,以共同開發KN046及GT90001治療HCC的聯合療法。
- 2020年7月,公司獲蘇州自由貿易區認定為首批高新技術企業;獲認定為江蘇省國際研發中心。
- 徐博士獲蘇州市政府授予第六屆“蘇州杰出人才獎”。
- 康寧杰瑞生物制藥(9966.HK)獲納入恒生綜合指數。
- 2020年11月底,公司在2020年中國醫藥企業家科學家投資家大會上獲授予“中國醫藥創新企業100強”。
- 公司獲納入深港通下的港股通股票名單,并自2020年12月28日起生效。
報告期間后動態
- 2021年1月6日,公司在深圳舉辦的第五屆金港股年度頒獎盛典上獲授予“最佳醫藥及醫療公司”獎。
- 康寧杰瑞管理團隊進一步擴充,包括委任Johannes Nippgen博士為首席醫學官。
三、生產基地
江蘇康寧杰瑞新生產基地Ⅰ期2x2,000L生產線(設計總產能超過30,000L)已于2020年7月取得江蘇省藥品監督管理局頒發的藥品生產許可證。生產線配備符合中國國家藥監局、FDA及歐洲藥品管理局有關GMP監管規定的世界一流的設備。
2020年全年財務摘要
- 截至2020年12月31日止年度,本集團錄得其他收入人民幣111.1百萬元(相比截至2019年12月31日止年度錄得人民幣34.4百萬元),主要包括利息收入、政府補助及其他雜項收入。
- 截至2020年12月31日止年度,錄得其他虧損人民幣117.6百萬元(相比截至2019年12月31日止年度錄得人民幣0.3百萬元)。截至2020年12月31日止年度,公司虧損及全面開支總額為人民幣427.8百萬元(相比截至2019年12月31日止年度為人民幣832.7百萬元)。
- 截至2020年12月31日止年度,研發開支為人民幣331.2百萬元(相比截至2019年12月31日止年度錄得人民幣166.7百萬元)。主要由于正在進行的臨床試驗數目增加;臨床研究規模的擴大;候選藥物的臨床試驗進展;研發人員增加令員工成本增加及薪酬增加所致。
- 截至2020年12月31日止年度的行政開支為人民幣78.2百萬元(相比截至2019年12月31日止年度錄得人民幣117.7百萬元)。
有關上述內容的更多信息,請參閱本公司在香港聯交所及公司官網上發布的2020年度業績公告。
關于康寧杰瑞
康寧杰瑞生物制藥專注于研發、生產和商業化創新抗腫瘤藥物。2019年12月12日,公司在香港聯合交易所主板上市,股票代碼:9966。
康寧杰瑞生物制藥在雙特異性抗體及蛋白質工程方面擁有全產業鏈的發現、研發和制造平臺。公司產品管線包括具有自主知識產權的、高度差異化的15種以雙抗為主的抗腫瘤候選藥物,和一種Covid-19的多功能抗體,其中四個產品在中國、美國、日本、澳大利亞處于Ⅰ-Ⅲ期臨床。恩沃利單抗注射液(KN035)上市申請已獲國家藥品監督管理局(NMPA)正式受理并納入優先審評。
公司擁有異二聚體及混合抗體等多個具有自主知識產權的技術平臺,和符合中國、美國和歐盟cGMP標準的大規模生產能力,并且通過包括歐盟QP在內多次審計的完整的質量體系。公司致力于建設國際領先的、多維度的藥物開發和產業化平臺,聚焦多功能生物大分子新藥,惠及中國和全球的患者。
歡迎訪問公司網站:www.alphamabonc.com
Johannes Nippgen 博士擁有25年臨床腫瘤、臨床開發和項目管理經驗。在多家國際生物制藥公司和生物技術公司擔任重要職位。加入康寧杰瑞前,他在默克生物制藥擔任中國研發中心負責人。Johannes Nippgen博士擁有德國維爾次堡大學博士學位、德國美因茨臨床醫學博士學位,在《新英格蘭醫學期刊》等多個國際學術期刊上發表過研究。
康寧杰瑞董事長兼總裁徐霆博士表示:“我們熱誠歡迎Johannes Nippgen 博士在公司發展的關鍵階段加入康寧杰瑞管理團隊。我相信Nippgen 博士在科研和管理上的遠見卓識,將促進公司全球視野的開拓,進一步豐富公司的差異化創新產品管線,推動公司已經開展和即將進行的全球多項關鍵臨床研究進入新的發展階段,讓我們的創新藥物能夠使全球有需求的腫瘤患者獲益。”
Johannes Nippgen 博士表示:“康寧杰瑞是中國生物制藥領域杰出的創新型公司,公司強大的自主創新技術平臺和極具全球First-in-class潛力的產品管線令我印象深刻,我和徐霆博士分享著共同的科學愿景,熱衷于不斷追求創新并始終致力于國際合作。很高興加入這個富有使命感并充滿活力的團隊,希望通過我們的共同努力,能夠在不久的將來給世界帶來更多臨床亟需的創新藥物,造福全球患者。”
關于康寧杰瑞
康寧杰瑞生物制藥專注于研發、生產和商業化創新抗腫瘤藥物。2019年12月12日,公司在香港聯合交易所主板上市,股票代碼:9966。
康寧杰瑞生物制藥在雙特異性抗體及蛋白質工程方面擁有全產業鏈的發現、研發和制造平臺。公司產品管線包括具有自主知識產權的、高度差異化的15種以雙抗為主的抗腫瘤候選藥物,和一種Covid-19的多功能抗體,其中四個產品在中國、美國、日本、澳大利亞處于Ⅰ-Ⅲ期臨床。恩沃利單抗注射液(KN035)上市申請已獲國家藥品監督管理局(NMPA)正式受理并納入優先審評。
公司擁有異二聚體及混合抗體等多個具有自主知識產權的技術平臺,和符合中國、美國和歐盟cGMP標準的大規模生產能力,并且通過包括歐盟QP在內多次審計的完整的質量體系。公司致力于建設國際領先的、多維度的藥物開發和產業化平臺,聚焦多功能生物大分子新藥,惠及中國和全球的患者。
歡迎訪問公司網站:www.alphamabonc.com