上海和香港2024年11月28日 /美通社/ -- 致力于研發,生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司–德琪醫藥有限公司(簡稱"德琪醫藥",香港交易所股票代碼:6996.HK)今日宣布,希維奧®(塞利尼索片)新增一項適應癥納入《國家基本醫療保險、工傷保險和生育保險藥品目錄(2024年)》(以下簡稱"國家醫保目錄"),醫保支付范圍為:既往接受過至少兩線系統性治療的復發或難治性彌漫性大B細胞淋巴瘤(R/R DLBCL)成人患者。新版國家醫保目錄將于2025年1月1日起正式生效。
2024年7月,繼首次被批準用于治療復發或難治性多發性骨髓瘤(R/R MM)之后,希維奧®在中國獲批第二項適應癥,用于治療R/R DLBCL。截至目前,希維奧®在中國累積獲批的兩項適應癥均已被納入國家醫保目錄,醫保覆蓋人群進一步擴大。
值得一提的是,希維奧®在半年之內,實現了新適應癥從獲批、上市到納入醫保的"三級跳",以高效的"德琪速度"快速、切實地為我國DLBCL患者帶來了更有效、便捷、可負擔的創新解決方案,也充分體現出國家醫保局對這款創新藥物的認可。在提高患者生存獲益的同時,大幅減輕患者及其家庭的治療負擔,這無疑表明了德琪醫藥"改善腫瘤患者生活質量"的愿景與目標正在逐步實現。
北京大學腫瘤醫院朱軍教授表示:"DLBCL是成人非霍奇金淋巴瘤(NHL)最常見類型,且發病率正逐年遞增,復發或難治性患者更是承受著極大的疾病和經濟負擔。希維奧®作為全新機制的核輸出蛋白抑制劑,以獨特的機制(MOA),療效明確,用藥便利,可自行在家口服,減輕住院負擔和費用,為中國患者提供了一種新的治療選擇。此次希維奧®DLBCL適應癥被納入醫保目錄,將大幅提高患者對這款創新藥物的用藥可及性,對復發或難治性DLBCL患者意義重大。"
希維奧®是全球首個全新機制的口服選擇性XPO1抑制劑,已在亞太市場的9個國家和地區獲批用于治療多項適應癥,并在其中4個市場(中國大陸、澳大利亞、新加坡和韓國)實現醫保收錄。未來,公司預計其將在更多亞太市場獲得醫保收錄。
在持續推進亞太市場布局的同時,公司也正努力擴充希維奧®的適應癥范圍。基于其獨特的作用機制,公司正在開發希維奧®在骨髓纖維化(MF)和子宮內膜癌等不同疾病領域的多種聯合療法。
關于希維奧®(塞利尼索)
希維奧®是全球首個全新機制的口服選擇性核輸出蛋白(XPO1)抑制劑,具有"全新機制、協同增效、快速起效、持久緩解"四大特點。
通過抑制核輸出蛋白XPO1,希維奧®可促使腫瘤抑制蛋白和其他生長調節蛋白的核內儲留和活化,并下調細胞漿內多種致癌蛋白水平。希維奧®發揮抗腫瘤作用機制的三條通路為:1)使抑癌蛋白在細胞核中明顯聚集,再激活發揮抗腫瘤作用;2)使致癌基因mRNA滯留在細胞核,降低胞漿內致癌蛋白水平;3)激活糖皮質激素受體(GR)通路,恢復激素敏感性。基于其獨特的作用機制,希維奧®在不同疾病領域的多種聯合療法正在進行開發。目前,德琪醫藥正在中國大陸地區開展多項(其中三項全球臨床試驗由德琪醫藥與Karyopharm Therapeutics Inc.[納斯達克交易所股票代碼:KPTI] 共同開展)針對復發/難治性血液及實體腫瘤的臨床研究。
關于德琪醫藥
德琪醫藥有限公司(簡稱"德琪醫藥",香港交易所股票代碼:6996.HK)是一家以研發為驅動,并已進入商業化階段的生物制藥領先企業,以"醫者無疆,創新永續"為愿景,德琪醫藥專注于血液及實體腫瘤領域的同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,致力于通過提供突破性療法,改善全球患者生活質量。
自2017年以來,德琪醫藥現已建立起一條擁有9款從臨床延展至商業化階段的腫瘤藥物資產研發管線,其中,6款產品具有全球權益,3款產品具有亞太權益。公司已在美國及多個亞太市場獲得31個臨床批件(IND),并遞交了10個新藥上市申請(NDA)。目前,希維奧®(塞利尼索片)已獲得中國大陸、中國臺灣、中國香港、中國澳門、韓國、新加坡、馬來西亞、泰國和澳大利亞的新藥上市批準。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們截至2023年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

- 這是繼復發/難治性多發性骨髓瘤(R/R MM)之后,希維奧®在中國獲批的第二項適應癥,用于單藥治療復發/難治性彌漫性大B細胞淋巴瘤(R/R DLBCL)成人患者。
- 中國注冊性臨床試驗SEARCH研究的試驗數據顯示,60例接受治療的中國受試者的總體緩解率(ORR)達到試驗預設的主要終點。
- 希維奧®是一種全新機制的口服藥物,公司正在開發希維奧®在骨髓纖維化(MF)、T細胞非霍奇金淋巴瘤(T-NHL)和子宮內膜癌等不同疾病領域的多種聯合療法。
- 希維奧®已在中國大陸、澳大利亞、新加坡和韓國實現醫保收錄。產品還在泰國、馬來西亞和印尼等多個東盟市場提交了新藥上市申請(NDA),并預計于今年下半年陸續獲批。
上海和香港2024年7月5日 /美通社/ -- 致力于研發,生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司–德琪醫藥有限公司(簡稱"德琪醫藥",香港交易所股票代碼:6996.HK)今日宣布,希維奧®(塞利尼索片)的新適應癥正式獲得國家藥品監督管理局(NMPA)批準,用于單藥治療復發或難治性彌漫性大B細胞淋巴瘤(R/R DLBCL)成人患者。
打破復發難治治療窘境 DLBCL治療新利器
DLBCL是成人非霍奇金淋巴瘤(NHL)中最常見的一種類型,并且是一種在臨床表現和預后等多方面具有很大異質性的惡性腫瘤。DLBCL患者若采用目前標準免疫化療方案,5年無進展生存率可達60-65%,40-50%患者可以獲得治愈,但仍然有約10%-15%患者對一線標準方案原發難治,20-25%患者緩解后疾病復發,這部分患者預后非常差,亟需新藥滿足治療需求。
經臨床驗證療效顯著 口服便利惠及廣大患者
這項新適應癥的獲批是基于一項中國注冊性臨床試驗SEARCH研究的數據支持。該研究共入組60例中國DLBCL患者,所有受試者由中心放射影像實驗室評估的總體緩解率(ORR)達到試驗預設的主要終點。研究結果表明,希維奧®單藥口服在中國受試者中具有明確的臨床療效,包括顯著的緩解率、持久的緩解時間和生存期。
SEARCH研究的主要研究者、北京大學腫瘤醫院朱軍教授指出:"DLBCL是成人NHL最常見類型,在中國約占NHL的40%,且發病率正逐年遞增,三線及以上復發或難治性患者缺少有效便捷的治療方案。塞利尼索作為全新機制的核輸出蛋白抑制劑,以獨特的機制(MOA),療效明確,用藥便利,可自行在家口服,減輕住院負擔和費用,為中國患者提供了一種新的治療選擇。新適應癥的獲批對中國R/R DLBCL患者意義重大。"
全球40多國獲批上市 逐步實現亞太醫保覆蓋
希維奧®是全球首個全新機制的口服選擇性XPO1抑制劑,已在全球40多個國家和地區獲批上市。截至目前,希維奧®已在中國大陸、澳大利亞、新加坡和韓國實現醫保收錄。公司還在泰國、馬來西亞和印度尼西亞等多個東盟市場提交了希維奧®的NDA,這些申請預計將于2024年下半年獲得批準。
關于希維奧®(塞利尼索)
希維奧®是全球首個全新機制的口服選擇性核輸出蛋白(XPO1)抑制劑,具有"全新機制、協同增效、快速起效、持久緩解"四大特點。
通過抑制核輸出蛋白XPO1,希維奧®可促使腫瘤抑制蛋白和其他生長調節蛋白的核內儲留和活化,并下調細胞漿內多種致癌蛋白水平。希維奧®發揮抗腫瘤作用機制的三條通路為:1)使抑癌蛋白在細胞核中明顯聚集,再激活發揮抗腫瘤作用;2)使致癌基因mRNA滯留在細胞核,降低胞漿內致癌蛋白水平;3)激活糖皮質激素受體(GR)通路,恢復激素敏感性。基于其獨特的作用機制,希維奧®在不同疾病領域的多種聯合療法正在進行開發。目前,德琪醫藥正在中國大陸地區開展多項(其中三項全球臨床試驗由德琪醫藥與Karyopharm Therapeutics Inc.[納斯達克交易所股票代碼:KPTI] 共同開展)針對復發/難治性血液及實體腫瘤的臨床研究。
關于德琪醫藥
德琪醫藥有限公司(簡稱"德琪醫藥",香港交易所股票代碼:6996.HK)是一家以研發為驅動,并已進入商業化階段的生物制藥領先企業,以"醫者無疆,創新永續"為愿景,德琪醫藥專注于血液及實體腫瘤領域的同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,致力于通過提供突破性療法,改善全球患者生活質量。
自2017年以來,德琪醫藥現已建立起一條擁有9款從臨床延展至商業化階段的腫瘤藥物資產研發管線,其中,6款產品具有全球權益,3款產品具有亞太權益。公司已在美國及多個亞太市場獲得29個臨床批件(IND),并遞交了10個新藥上市申請(NDA)。目前,希維奧®(塞利尼索片)已獲得中國大陸、中國臺灣、中國香港、中國澳門、韓國、新加坡和澳大利亞的新藥上市批準。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們截至2023年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000
]]>

- 公司將于AACR 2022(4月8日至13日)公布五個創新管線品種的臨床前數據。
- 所涉及的管線品種包括ATG-037、ATG-018、ATG-022、ATG-012和ATG-008。
上海和香港2022年4月11日 /美通社/ -- 致力于研發,生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布公司將于4月8日至13日在新奧爾良以線下和線上形式舉行的2022年美國癌癥研究協會(AACR 2022)年會上展示五篇摘要壁報。
(https://www.aacr.org/professionals/meetings/myaacr-support/)
德琪醫藥首席科學官單波博士表示:“我們即將在AACR 2022上公布的臨床前數據展現了德琪醫藥五個創新管線品種的進展。這些品種靶向作用于腫瘤藥物研發中的幾個熱點機制,它們包括腫瘤微環境(TME)調節劑ATG-037;通路抑制劑ATG-018、ATG-022和ATG-008;以及抗體偶聯藥物(ADC)ATG-022。這些研究數據對我們臨床開發方案的制訂起到了至關重要的指導作用,并將幫助我們選擇可有效預示療效的生物標志物和擴大目標患者范圍的聯用藥物。我們很高興能與腫瘤領域的同行們分享這些成果。”
以下為壁報及摘要的詳細信息:
強效CD73小分子抑制劑ATG-037較抗CD73抗體藥物可更加有效的逆轉在高AMP的微環境中的免疫抑制
摘要編號:2576
分會場:細胞周期、增殖抑制劑和免疫治療藥物
日期和時間:2022年4月12日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區21
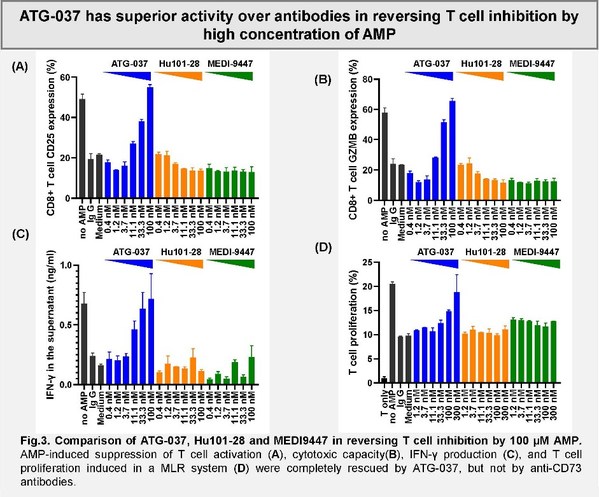
該項研究旨在比較強效選擇性口服CD73小分子抑制劑ATG-037和兩款抗CD73抗體藥物的T細胞活性。CD73是一種在腫瘤微環境中高表達的酶,它可將AMP降解為腺苷,從而導致免疫抑制和腫瘤惡化。本研究通過體外試驗評估了每個藥物對CD73酶活性抑制作用和逆轉由AMP/adenosine介導的T細胞功能抑制的能力。相較于另外兩款抗體藥物,ATG-037展現出更強的,完全的細胞表面CD73的抑制活性。
同時,如圖所示,文章作者發現ATG-037較其它已經進入臨床的抗CD73抗體藥物,可在較高AMP環境中更有效地恢復T細胞功能。這些數據表明CD73小分子抑制劑較CD73阻斷型抗體具有潛在的治療優勢。德琪醫藥正在開展一項ATG-037單藥及聯合抗PD-1抗體用于治療局部晚期/轉移性實體瘤患者的I期臨床試驗。
新型ATR抑制劑ATG-018在臨床前腫瘤模型中的療效
摘要編號:2604
分會場:DNA損傷反應和修復
日期和時間:2022年4月12日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區22
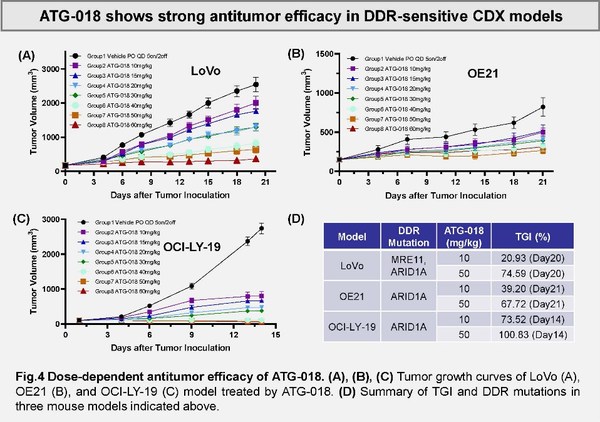
該臨床前研究總結了支持ATG-018這款ATR小分子抑制劑開發的藥理學數據。靶向抑制ATR激酶(共濟失調性毛細血管擴張和Rad3-相關激酶)可增加雙鏈斷裂的存積,這對依賴于DNA損傷應答(DDR)的腫瘤細胞具有重要意義。研究在一組包含142個腫瘤細胞系和3個CDX小鼠模型中評估了ATG-018的抗腫瘤活性,同時鑒別了潛在的預測性生物標志物。在體外試驗中,ATG-018顯示了對于ATR酶活性的強大抑制作用和對多種實體瘤以及血液瘤癌細胞增殖的強效抑制,且對正常外周血單核細胞(PBMCs)的存活無顯著影響。
此外,研究還發現了多個與ATG-018敏感性相關的基因表達變化,這些差異基因具有成為預測性生物標志物的潛力。如圖所示,文章作者發現ATG-018在多個具有特定DDR相關突變的實體瘤/血液腫瘤的CDX小鼠模型中顯示出良好的抗腫瘤活性。以上研究結果均提示了ATG-018具有與同源重組缺陷的合成致死潛力,以及廣泛的適應癥潛力。ATG-018對腫瘤細胞良好的增殖抑制活性預示著該藥物單藥及聯合療法對于多種依賴DDR的腫瘤具有治療潛力。同時,對于特定預測性生物標志物的開發也將支持該藥物作為靶向藥物的應用。德琪醫藥計劃在2022年內提交ATG-018的首個臨床試驗申請(IND)。
靶向作用于Claudin 18.2的抗體偶聯藥物ATG-022在胃癌患者的異種移植模型中顯示了優異的體內療效
摘要編號:1143
分會場:臨床前和臨床藥物學
日期和時間:2022年4月11日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區25
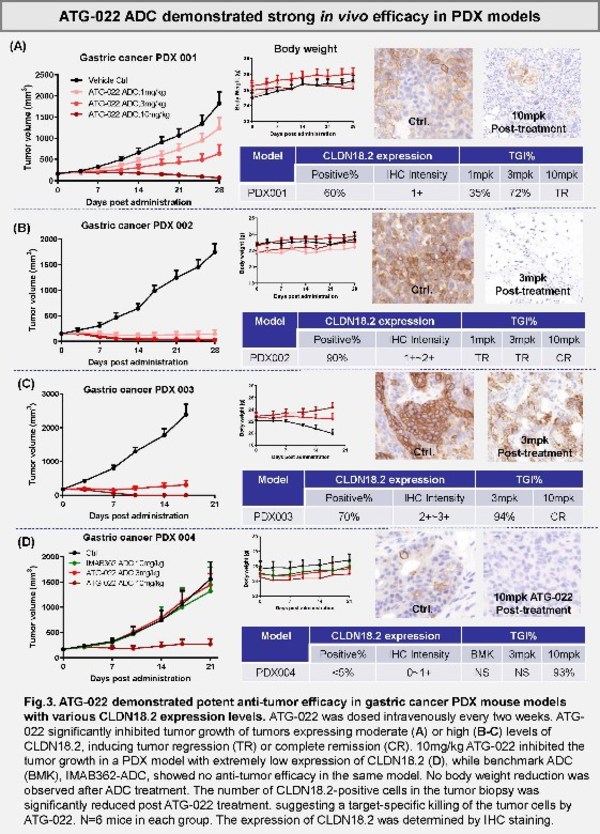
該項臨床前研究在多個胃癌的異種移植模型(PDX)中對靶向作用于Claudin18.2(CLDN18.2)的ADC藥物ATG-022進行了評估,以判斷其在不同CLDN18.2表達水平腫瘤中的治療潛力。有相當比例的胃癌和胰腺癌存在CLDN18.2異常表達。針對CLDN18.2的單克隆抗體藥物的研究顯示,盡管該藥物聯合化療顯示了積極的臨床獲益,但它在CLDN18.2低表達的患者中療效并不理想。
這項在此次AACR大會上發布的臨床前研究顯示:ATG-022以極高的親和力(低于納摩爾級別)與CLDN18.2結合,顯示了強效的體內和體外抗腫瘤活性,并在CLDN18.2高表達和低表達的模型中顯示了極高的劑量依賴的體內活性。此外,該研究還在CLDN18.2低表達的PDX腫瘤模型中觀察到了顯著的體內療效,尤其是在低表達的模型中。如圖所示,ATG-022較另外一款靶向作用與CLDN18.2的ADC藥物顯示了優越性。另外ATG-022可實現與CLDN18.2的高特異性結合,且不影響具有CLDN18.1表達的細胞。此外,ATG-022對動物體重幾乎沒有影響,這進一步預示了該藥物良好的安全性。文章作者在結論中指出,ATG-022顯示了為具有不同CLDN18.2表達水平的胃癌患者帶來臨床獲益的潛力。目前,德琪醫藥正在推進ATG-022的臨床前研究。
Kras(G12C)抑制劑聯合SHP2、ERK1/2、mTORC1/2或XPO1 抑制劑在攜帶Kras(G12C)變異的腫瘤中的協同效應
摘要編號:2679
分會場:信號通路抑制劑
日期和時間:2022年4月12日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區25
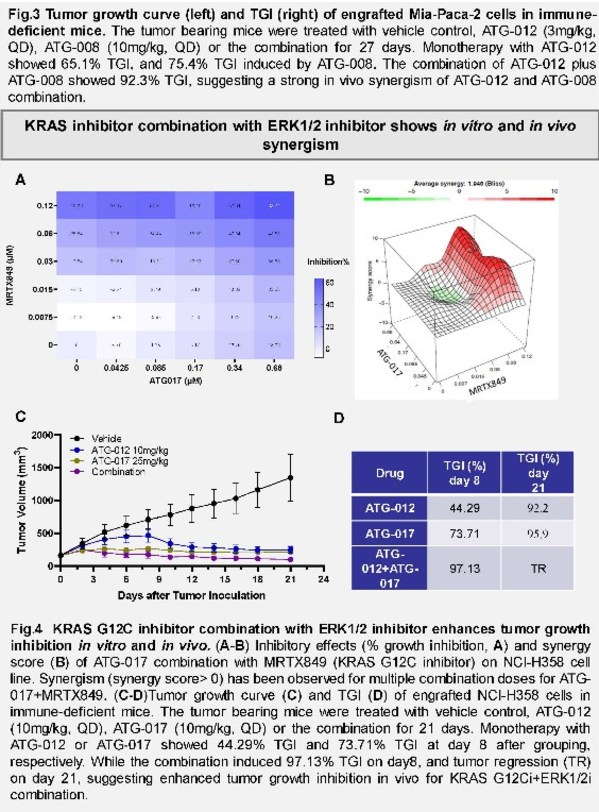
該項臨床前研究旨在尋找可克服KRAS G12C抑制劑治療中常見的無進展生存期較短(與獲得性耐藥相關)這一臨床困境的聯合療法。該研究在實體腫瘤CDX模型中評估了KRAS G12C抑制劑ATG-012分別聯合作用于受RASi影響的多個腫瘤通路的四款藥物的抗腫瘤活性,這些藥物是:1)SHP2抑制劑,ET0038;2)ERK 1/2激酶抑制劑,ATG-017;3)TORC1/2激酶抑制劑,ATG-008;及4)XPO-1抑制劑,塞利尼索。
ATG-012單藥不僅在治療的第27天顯示了具有劑量依賴的腫瘤生長抑制,同時,如圖所示,文章作者還發現 ATG-012與其他所研藥物的雙藥組合在研究中顯示了體內協同作用。尤其值得一提的是,ATG-012與德琪臨床階段的ERK抑制劑ATG-017具有良好的體內和體外協同效果,未來在臨床上可應用于解決KRAS抑制劑快速耐藥的問題。這些數據揭示了多個潛在的ATG-012聯合療法,這些聯合療法經進一步開發后可用于治療存在耐藥的患者,并針對性的治療患有特定類型腫瘤或具有特定組織學特征的攜帶KRAS G12C突變的患者。目前,德琪醫藥正在推進ATG-012的臨床前研究。
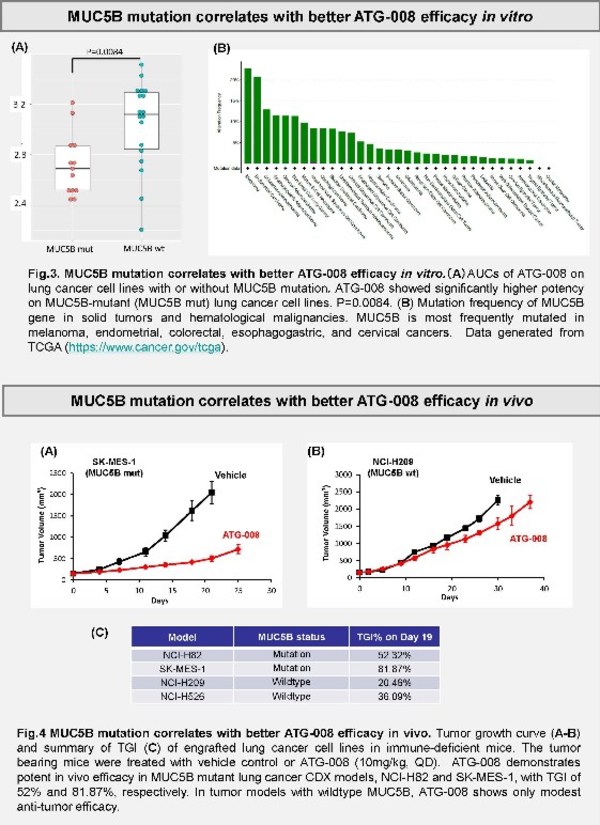
MUC5B突變可以作為肺癌治療中預測mTORC1/2 抑制劑ATG-008療效的生物標志物
摘要編號:4032
分會場:分子藥物學
日期和時間:2022年4月13日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區26
該研究旨在評估MUC5B突變作為生物標志物在正向預測mTORC1/2抑制劑ATG-008(Onatasertib)在肺癌治療中的療效潛力。ATG-008是一款mTOR復合物1/2的雙重激酶抑制劑。mTOR復合物對于細胞的生長、代謝、增殖和存活具有調節作用。雖然腫瘤通常存在mTOR通路下調,但mTOR抑制劑在肺癌治療中的療效有限。本研究使用ATG-008體外處理了31個不同肺癌細胞系,以確定劑量反應并尋找和ATG-008敏感度相關聯的基因突變、擴增和表達。
如圖所示,文章作者發現,在體外或肺癌小鼠模型中,MUC5B突變與ATG-008更為強效的抗腫瘤活性相關。粘蛋白MUC5B在正常的肺細胞中起著關鍵的保護作用, 并在多種腫瘤中被報道和預后相關。文章還特別指出,黑色素瘤、子宮內膜癌,結腸癌、食管癌和宮頸癌等癌癥種類中也存在高比例的MUC5B突變,這就極大地擴展了MUC5B這一ATG-008藥效的預測性生物標志物的臨床應用潛力。目前,德琪醫藥正在開展多項ATG-008的I期和II期臨床試驗。
關于德琪醫藥
德琪醫藥有限公司(簡稱"德琪醫藥",香港聯交所股票代碼:6996.HK)是一家以研發為驅動并已進入商業化階段的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得23個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索/ATG-010/ XPOVIO®已獲得中國、韓國、新加坡和澳大利亞新藥上市申請的獲批。德琪醫藥將以"醫者無疆,創新永續"為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為"風險因素"的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

- 研究結果顯示所有接受治療的患者的總體緩解率(ORR)為29.3%。
- 研究在所有風險類型的患者中觀察到一致的臨床緩解,其中包括既往接受過三類藥物治療、CAR-T療法及細胞遺傳學異常的患者。
- 塞利尼索將于2022年第二季度在中國商業化上市。
中國上海和香港2022年4月6日 /美通社/ -- 致力于研發,生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,塞利尼索用于治療復發/難治性多發性骨髓瘤(R/R MM)的關鍵性橋接研究(MARCH研究)數據獲《BMC醫學》雜志發表。
(https://bmcmedicine.biomedcentral.com/articles/10.1186/s12916-022-02305-4)
MARCH研究是一項在中國展開的單臂、開放性研究,旨在評估塞利尼索聯合低劑量地塞米松(Sd方案)用于治療已經接受過深度治療且對一種免疫調節劑(IMiD)及一種蛋白酶抑制劑(PI)難治的R/R MM患者。此外,該研究還對包括三類藥物難治 [PI、IMiD及抗CD38單克隆抗體藥物(mAb)] 的患者在內的多個高危亞組進行了評估。
該研究的主要終點為經獨立評審委員會確認的ORR。該研究的數據顯示,所有接受了治療的患者的ORR為29.3% [95%置信區間(CI):19.7,40.4]。此外,德琪醫藥還公布了其它幾個高危亞組的ORR,它們包括:
- 三類藥物難治的患者:ORR=25.0%(95% CI:8.7,49.1)
- 既往接受過CAR-T療法治療的患者:ORR=50.0%(95% CI:18.7,81.3)
- 攜帶高危細胞遺傳學異常的患者:ORR=25.5%
MARCH研究是一項旨在驗證全球性II期STORM研究數據的確認性橋接試驗。該研究依照中國監管部門的要求,在中國的R/R MM患者中對STORM研究的結果進行了確認。
塞利尼索在美國的上市許可正是基于STORM研究的數據。該研究的數據顯示,Sd方案為對至少兩種PI、至少兩種IMiD及一種抗CD38單克隆抗體藥物難治的R/R MM患者帶來了顯著的臨床獲益。
德琪醫藥首席醫學官Kevin Lynch博士表示:“MARCH研究確認了在美國開展的STORM研究的結果,是塞利尼索用于R/R MM在中國加速獲批的基石。德琪醫藥已為塞利尼索在今年第二季度的商業化上市做好準備,我們很高興能在這個時候向醫學界公布MARCH關鍵性研究的完整數據。德琪醫藥期待盡快將這款全新療法帶給中國的R/R MM患者,以改善這些患者的臨床現狀。”
分布在中國的17個研究單位參與了這項關鍵性MARCH研究。研究中,患者在每周第1天和第3天接受了80mg塞利尼索和20mg地塞米松的口服給藥。治療以四周為一個周期,持續多個周期。
該研究的次要終點包括對于緩解持續時間(DOR)、無進展生存期(PFS)、總生存期(OS)、安全性和藥代動力學(PK)特征的評估。
研究共在中國入組82例R/R MM患者,他們的中位年齡為60歲。這82例患者中有55例(67.1%)攜帶高危細胞遺傳學異常,18例(22.0%)存在腎功能異常。入組患者已經接受了深度治療,曾接受過中位5種既往療法。全部82例(100%)患者都為PI和IMiD難治,其中20例(24.4%)為三類藥物難治。10例(12.2%)患者曾接受過CAR-T療法治療。
結果顯示,ORR為29.3%(95% CI:19.7,40.4),中位DOR為4.7個月。中位PFS和OS分別為3.7個月和13.2個月。三類藥物難治亞組的ORR為25.0%。在多個亞組中觀察到的療效一致。PK特征根據藥動學參數和族裔敏感性分析確定。研究在多次給藥后未觀察到明顯的藥物蓄積,也未在中國和西方患者中觀察到族裔間的PK特征差異。
研究觀察到的不良事件(AEs)與預期一致,且均可通過支持治療和劑量調整得到控制。最常見的3/4級AEs包括貧血(57.3%)、血小板減少癥(51.2%)、淋巴細胞減少癥(42.7%)、中性粒細胞減少癥(40.2%)、低鈉血癥(29.3%)和肺部感染(26.8%)。54.9%的患者報告了嚴重不良事件。
關于多發性骨髓瘤
多發性骨髓瘤(MM)是血液系統第二大常見的惡性腫瘤,中國每年新增約15,000至20,000例MM患者及10,300例相關死亡。[1]
關于ATG-010/塞利尼索/ XPOVIO®
塞利尼索是目前首款且唯一一款被美國食品藥品管理局(FDA)批準的口服XPO1抑制劑,用于治療復發/難治性多發性骨髓瘤(R/R MM)和復發/難治性彌漫性大B細胞淋巴瘤(R/R DLBCL)。通過抑制核輸出蛋白XPO1,塞利尼索可促使腫瘤抑制蛋白和其他生長調節蛋白的核內儲留和活化,并下調細胞漿內多種致癌蛋白水平。基于其獨特的作用機制,多個塞利尼索聯合療法正在接受評估,以探索這些療法提高療效的潛力。
德琪醫藥于2021年12月在中國獲得塞利尼索用于治療R/R MM的上市許可并計劃在2022年第二季度正式推出該款藥物。此外,德琪醫藥于2021年7月及2022年3月分別在韓國和新加坡獲得塞利尼索用于治療R/R MM和R/R DLBCL的上市許可,并于2022年3月在澳大利亞獲得塞利尼索用于治療R/R MM的上市許可。德琪醫藥目前正在中國大陸開展10項(其中3項由德琪醫藥與Karyopharm公司聯合開展)針對復發難治性血液腫瘤和晚期實體瘤的臨床研究。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動并已進入商業化階段的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得23個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索/ATG-010/ XPOVIO®已獲得中國、韓國、新加坡和澳大利亞新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
參考資料
[1]. 國際骨髓瘤基金會公布的統計數據,基金會官網https://www.myeloma.org/
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

上海和香港2022年3月30日 /美通社/ -- 致力于研發,生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司–德琪醫藥有限公司(簡稱"德琪醫藥",香港聯交所股票代碼:6996.HK)今日宣布,中國國家藥品監督管理局(NMPA)已正式批準一項旨在評估核輸出抑制劑(SINE)ATG-016用于治療高危骨髓增生異常綜合征(MDS)的安全性、耐受性及有效性的開放性II期臨床研究。
ATG-016正被開發用于治療MDS和實體瘤。ATG-016及其它SINE藥物可抑制核輸出蛋白Exportin 1(XPO1),而這種蛋白可通過清除核內腫瘤抑制蛋白促進腫瘤的生長。ATG-016是一款口服、高選擇性的下一代XPO1抑制劑,它較第一代SINE藥物ATG-010/塞利尼索/ XPOVIO®具有更好的藥理特性,從而可實現更高頻次的給藥以及更高的耐受劑量。
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:"德琪醫藥致力于為腫瘤患者,尤其是患有復發難治性腫瘤的患者提供突破性的‘同類首款'藥物。我們是亞太區首個開發核輸出抑制劑的公司。ATG-016在中國大陸的臨床開發包含三項臨床研究,用于治療晚期MDS及實體瘤。之前公布的用于治療MDS患者的I期臨床數據令人振奮,我們將盡快推進此項研究,并希望該項臨床開發能為中國的高危MDS患者帶來臨床獲益。"
KCP-8602-801研究是一項由Karyopharm公司發起的旨在評估ATG-016在6個復發難治性腫瘤隊列的安全性、耐受性和有效性的開放性I/II期臨床試驗,目前正在開展中。德琪醫藥將在中國為ATG-016單藥用于治療高危MDS的"隊列F"II期部分招募患者。MDS是一種源于骨髓造血干細胞的惡性疾病,其發病率隨年齡增長顯著升高。中危、高危或極高危的MDS患者的中位總生存期(OS)分別為3年、1.6年和0.8年,并極有可能轉化為急性髓系白血病(AML)。根據Karyopharm公司此前在美國血液學會(ASH)年會上公布的該項研究"隊列F"I期部分 [ATG-016單藥治療去甲基化藥物(HMA)難治的高危MDS] 數據顯示,接受ATG-016治療且療效可評估的患者的總緩解率(ORR)為53%,OS達9.86個月。相較HMA難治的MDS患者通常僅為4-6個月的生存期,該研究數據顯示了生存期的有效改善。
]]>
中國上海和香港2022年3月10日 /美通社/ -- 致力于研發、生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,中國國家藥品監督管理局(NMPA)已正式批準ATG-101用于治療晚期或轉移性實體瘤及B細胞非霍奇金淋巴瘤(B-NHL)的I期臨床試驗(PROBE-CN)申請。
ATG-101作為一款新型PD-L1/4-1BB雙特異性抗體,可阻斷免疫抑制性的PD-L1/PD-1結合,同時條件性激活4-1BB共刺激信號,從而激活抗腫瘤免疫效應細胞,在增強藥效的同時,增強安全性。臨床前研究表明,ATG-101在免疫檢查點抑制劑耐藥或復發的動物模型中顯示了顯著的抗腫瘤活性,并在GLP毒理研究中展現了極佳的安全性。
該項臨床研究以上海市東方醫院為牽頭單位,計劃在國內4家研究中心開展。本研究是一項中國晚期或轉移性實體瘤和B-NHL受試者接受ATG-101作為單藥靜脈注射/滴注的多中心、開放性、I期臨床研究,旨在評估ATG-101單藥治療晚期或轉移性實體瘤和B-NHL患者的安全性及耐受性。研究設計包括劑量遞增階段和劑量擴展階段。
主要研究者上海市東方醫院腫瘤醫學部副主任、一期臨床中心主任郭曄教授表示:“目前很多惡性腫瘤患者存在對現有治療方法(包括化療、靶向治療和免疫治療等)耐藥或難治的現象,此類患者群體的醫療需求尚未得到滿足。越來越多的證據表明,雙特異性抗體有望成為治療惡性腫瘤的新型有效策略之一。ATG-101是一款新型PD-L1/4-1BB雙特異性抗體,它的設計結合了與 PD-L1的高親和力結合以及對 4-1BB 的條件性激活,以降低與 4-1BB 相關的肝毒性風險。我很高興能夠領導ATG-101在中國的首個臨床研究(PROBE-CN),我們研究團隊將和其他研究者以及德琪研發團隊緊密合作。我們期待ATG-101能夠為晚期惡性腫瘤患者提供一種新型、有效且安全的治療方法。”
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“ATG-101捷報頻傳,繼在澳大利亞和美國獲批臨床后,又獲國家藥品監督管理局批準在中國開展ATG-101用于治療晚期或轉移性實體瘤及B-NHL的臨床研究。我們非常高興并期待通過啟動并推進這一重要研究,為既往接受過抗PD-1/L1治療后復發或耐藥的實體腫瘤和NHL患者,提供更新和更有效的治療選擇。”
關于ATG-101
ATG-101是一款新型PD-L1/4-1BB雙特異性抗體,正被開發用于治療轉移性/晚期實體瘤及B細胞非霍奇金淋巴瘤 (B-NHL)。ATG-101可同時阻斷PD-L1/PD-1結合以及激活4-1BB共刺激信號,從而激活抗腫瘤免疫效應細胞。在PD-L1過表達腫瘤細胞存在時,ATG-101表現出顯著的PD-L1交聯依賴的4-1BB激動劑活性,能在提高治療效果的同時減輕肝毒性。截至目前,ATG-101已在澳大利亞,美國和中國獲批開展用于治療轉移性或晚期實體瘤及非霍奇金淋巴瘤的Ⅰ期臨床試驗,其中PROBE研究已在澳大利亞順利啟動。同時,該研究也即將在美國啟動。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動并已進入商業化階段的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得22個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索/ATG-010/XPOVIO®已獲得中國、韓國、新加坡和澳大利亞新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

- 五篇摘要入選2022 AACR。
- 這些壁報將介紹公司早期臨床和臨床前管線的進展。
- 所涉及的管線品種包括ATG-037、ATG-018、ATG-022、ATG-012和ATG-008。
上海和香港2022年3月9日 /美通社/ -- 致力于研發,生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,公司將于4月8日至13日在新奧爾良以線下和線上形式舉行的2022年美國癌癥研究協會(AACR 2022)年會上展示五篇摘要壁報。
德琪醫藥首席科學官單波博士表示:“我們將在AACR 2022大會上展示的臨床前研究將讓外界了解5個管線品種的靶點以及支持進一步臨床開發的體內和體外研究數據。這些研究數據對我們臨床開發方案的制訂起到了至關重要的指導作用,同時也揭示了一些具有潛力的聯合療法以及可用于預判療效并提升治療應答率的一些全新的生物標志物和基因變異。我們很高興能有機會與腫瘤領域的同行們分享這些數據。”
以下為摘要壁報的詳細信息:
標題:強效CD73小分子抑制劑ATG-037較抗CD73抗體藥物可更加有效的逆轉在高AMP的微環境中的免疫抑制
摘要編號:2576
分會場:細胞周期、增殖抑制劑和免疫治療藥物
日期和時間:2022年4月12日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區21
該項研究旨在比較強效選擇性口服CD73小分子抑制劑ATG-037和兩款抗CD73抗體藥物的抗腫瘤活性。CD73是一種在腫瘤微環境中高表達的酶,它可將AMP降解為腺苷,從而導致免疫抑制和腫瘤惡化。通過試驗,研究評估了每個藥物在抑制CD73作用和逆轉由AMP/adenosine介導的T細胞抑制方面的能力。相對于另外兩款抗體,ATG-037展現出更強的,可完全地抑制細胞表面CD73的活性。此外,文章作者的結論指出,ATG-037較其它已經進入臨床的抗CD73抗體藥物,可在高AMP環境中更有效的恢復T細胞功能。這些數據顯示小分子抑制劑較阻斷型抗體具有潛在的治療優勢。德琪醫藥正在進行一項ATG-037單藥及聯合抗PD-1抗體在晚期/轉移性實體瘤患者中的I期臨床試驗。
標題:新型ATR抑制劑ATG-018在臨床前腫瘤模型中的療效
摘要編號:2604
分會場:DNA損傷反應和修復
日期和時間:2022年4月12日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區22
該臨床前研究回顧了支持ATG-018這款ATR小分子抑制劑開發的數據。ATR激酶(共濟失調性毛細血管擴張和Rad3-相關激酶)在DNA損傷應答(DDR)中具有一定的作用。研究在一組包含143個腫瘤細胞系和3個CDX小鼠模型中評估了ATG-018的抗增殖活性,同時鑒別了潛在的預測性生物標志物。ATG-018顯示了對于癌細胞增殖的強效抑制,且未影響正常外周血單核細胞的存活。在CDX模型中,ATG-018顯示了劑量依賴性的腫瘤生長抑制。文章作者在結論中指出,ATG-018在多個具有同源重組缺乏的實體瘤/血液腫瘤體內和體外試驗中顯示了單藥療效。此外,研究還發現了多個與ATG-018敏感性相關的基因變異,這些變異具有成為預測性生物標志物的潛力。這些數據顯示,對于存在同源重組缺乏/基因突變的患者,ATG-018可能是一款具有治療潛力的藥物。
標題:靶向作用于Claudin 18.2的抗體偶聯藥物ATG-022在胃癌患者的異種移植模型中顯示了優異的體內療效
摘要編號:1143
分會場:臨床前和臨床藥物學
日期和時間:2022年4月11日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區25
該項臨床前研究在多個胃癌患者的異種移植模型中對靶向作用于Claudin 18.2(CLDN18.2)的抗體偶聯藥物ATG-022進行了評估,以判斷其在不同CLDN18.2表達水平下的治療潛力。有相當數量的胃癌和胰腺癌都存在CLDN18.2過度表達。針對CLDN18.2的單克隆抗體藥物(IMAB362)研究顯示,盡管該藥物聯合化療顯示了積極的臨床獲益,但它在低表達CLDN18.2的病人中療效并不理想。這項將在AACR大會上發布的臨床前研究顯示:ATG-022以極高的親和力(低于納摩爾級別)與CLDN18.2結合,并顯示了強效的體內和體外抗腫瘤活性。此外,該研究還在CLDN18.2低表達的腫瘤模型中觀察到了顯著的體內療效。文章的作者在結論中指出,ATG-022顯示了為具有不同CLDN18.2表達水平的胃癌患者帶來臨床獲益的潛力。目前,德琪醫藥正在推進ATG-022的臨床前研究。
標題:Kras (G12C)抑制劑聯合SHP2、ERK1/2、mTORC1/2或XPO1 抑制劑在攜帶Kras (G12C)變異的腫瘤中的協同效應
摘要編號:2679
分會場:信號通路抑制劑
日期和時間:2022年4月12日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區25
該項臨床前研究旨在尋找可克服KRAS G12C抑制劑治療中常見的無進展生存期較短這一臨床困境的聯合療法。該研究在實體腫瘤CDX模型中評估了KRAS G12C抑制劑ATG-012分別聯合作用于多個腫瘤通路的四款藥物的抗腫瘤活性,這些藥物是:1)SHP2抑制劑,ET0038;2)ERK 1/2激酶抑制劑,ATG-017;3)TORC1/2激酶抑制劑,ATG-008;4)XPO-1抑制劑,塞利尼索。不僅ATG-012單藥可以使腫瘤生長受到明顯抑制,文章作者同時指出這四種藥物與ATG-012組成的雙藥組合在研究中全程持續顯示了明顯的體內協同作用。這些數據揭示了多個潛在的ATG-012聯合療法,未來可在攜帶KRAS G12C突變的腫瘤患者中進行進一步臨床驗證。
標題:MUC5B突變可以作為肺癌治療中預測mTORC1/2 抑制劑ATG-008療效的生物標志物
摘要編號:4032
分會場:分子藥物學
日期和時間:2022年4月13日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區26
該研究旨在發現mTORC1/2抑制劑ATG-008(Onatasertib)用于肺癌治療中的預測性生物標志物。該研究表明MUC5B突變與ATG-008的療效正相關,可潛在提升肺癌患者對該藥物的治療應答率。ATG-008是一款mTOR復合物1/2的雙重激酶抑制劑,mTOR復合物對于細胞的生長、代謝、增殖和存活具有調節作用。雖然腫瘤通常存在mTOR通路下調,但mTOR抑制劑在肺癌治療中的療效有限。研究中31個肺癌細胞系接受了ATG-008治療,以確定劑量反應并尋找和ATG-008敏感度相關聯的基因突變、擴增和表達,并在攜帶和不攜帶MUC5B突變的小鼠CDX肺癌模型中對該結果進行驗證。ATG-008在攜帶MUC5B突變的小鼠CDX模型中觀察到較野生型模型更為強效的腫瘤生長抑制。文章作者在結論中指出,在肺癌小鼠模型中,MUC5B突變與ATG-008更為強效的抗腫瘤活性相關。這些數據為ATG-008的臨床試驗提供了支持。目前,德琪醫藥正在多項I期和II期臨床試驗中對ATG-008進行評估。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動并已進入商業化階段的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得22個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索/ATG-010/XPOVIO®已獲得中國、韓國、新加坡和澳大利亞新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

- XPOVIO®聯合硼替佐米及地塞米松(XBd方案)給復發難治性多發性骨髓瘤患者帶來了一個新的可選療法。
- XPOVIO®聯合地塞米松(Xd方案)給患有三類藥物難治的多發性骨髓瘤患者帶來了一個新的可選療法,這些患者通常面臨著較差預后和可選療法有限的困境。
- XPOVIO®是首款選擇性核輸出(SINE)藥物。
- 在澳大利亞,多發性骨髓瘤占所有血液腫瘤的10%,所有腫瘤的1.6%[1]。
- 在澳大利亞,多發性骨髓瘤患者亟需更多的可選療法,目前這部分患者確診后的5年生存率僅為53%[2]。
- 在澳大利亞,每年有約2,400例多發性骨髓瘤病例,帶病生存的多發性骨髓瘤患者總數約為20,000[3]。不幸的是,每年有超過1,000例患者被這種血液腫瘤奪去生命。因此,這些患者亟需一款XPOVIO®這樣具有全新機制的藥物。
上海和香港2022年3月9日 /美通社/ -- 致力于研發,生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司 - 德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,澳大利亞衛生部下屬的藥品管理局(TGA)已經批準XPOVIO®(塞利尼索)用于兩個適應癥的治療:(1)聯合硼替佐米及地塞米松塞(XBd方案)治療接受過至少1種既往治療的多發性骨髓瘤(MM)成人患者;(2)聯合地塞米松(Xd方案)用于治療接受過至少3種既往治療且對至少1種蛋白酶體抑制劑(PI)、1種免疫調節藥物(IMiD)和1種抗CD38單克隆抗體藥物(mAb)耐藥的復發難治性多發性骨髓瘤(R/R MM)成人患者。
XPOVIO®是首款且唯一一款獲TGA批準的SINE藥物,它可幫助患者恢復自身的腫瘤抑制通路[4]。
墨爾本圣文森特醫院的血液科專家Hang Quach教授表示:“做為研究者團隊的一員,我有幸參與了BOSTON研究,并參與起草了多篇有關XBd方案的臨床研究文章。我認為在目前來那度胺耐藥高發的情況下,這個三藥聯用方案對于早期復發的患者來說無疑是最有效的療法。亞組分析顯示,該三藥聯用方案對于所有年齡的患者都有效,無論他們的身體是否虛弱,且在具有低肌酐清除的患者中同樣具有療效。需要強調的是,XBd方案對于具有高細胞遺傳學風險的患者療效尤為顯著。”
Hang Quach教授補充道:“我認為最初的三線治療方案可在很大程度上決定MM患者的總體生存,因為在臨床實踐中,大部分患者的生存期都無法達到四線及后線治療。此外,在復發初期使用最有效的療法可帶來最大的臨床獲益。因此,對于處于一至三線治療期的患者來說,有更多的可選策略是非常重要的,這能讓醫生根據患者的臨床特征選擇最優的治療方案。在澳大利亞,對來那度胺耐藥出現早期復發的MM患者亟需更多的治理方案,XBd方案的獲批無疑可以滿足這個臨床需求。”
墨爾本艾爾弗雷德醫院的血液科專家Andrew Spencer教授表示:“在澳大利亞,對蛋白酶體抑制劑、免疫調節藥物和抗CD38單克隆抗體這三類藥物難治的骨髓瘤患者迫切需要有效的治療方案。XPOVIO®的優勢在于它是一款具有全新作用機制的口服型藥物,這讓它非常適合用于治療對三類藥物難治患者的治療。在臨床中,XPOVIO®可以為患者帶來顯著的緩解和生存期獲益。”
澳大利亞骨髓瘤聯盟的臨時聯席首席執行官Hayley Beer表示:“能為多發性骨髓瘤患者帶來一個新的可用于前線和后線治療的全新方案,這意義重大。XPOVIO®是一款新型藥物,擁有獨特的作用機制,這就意味著患者可以嘗試新的聯合療法,而不是重復使用既往使用過的藥物。”
德琪醫藥亞太區集團副總裁Thomas Karalis表示:“此次獲批對于德琪醫藥和澳大利亞的MM患者來說都是一個重要的里程碑。我們非常高興能有機會將XPOVIO®帶給澳大利亞的醫生和患者們,給R/R MM的治療帶來一個全新的治療策略。作為我們在澳大利亞首個成功注冊上市的產品,這標志著德琪醫藥在澳大利亞不斷發展。我們將繼續致力為澳大利亞的腫瘤及其它威脅生命疾病患者開發和商業化具有突破性的藥物。”
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“近半年內,XPOVIO®在中國、韓國、新加坡及此次在澳大利亞的獲批都凸顯了其未來的潛力。澳大利亞每年有約2,400例MM病例,MM的治療在澳大利亞仍存在著顯著的未滿足醫療需求。澳大利亞藥品管理局對XPOVIO®的批準將為這些飽受疾病困擾的患者建立起全新的治療標準。未來我們將繼續努力,將創新的藥品和療法以‘德琪速度’帶給亞太區乃至全球的患有腫瘤及其它危及生命疾病的患者。現在,我們的商業化團隊已經就位,他們將結合XPOVIO®在中國,韓國和新加坡的上市經驗,把這款新型藥物帶給盡可能多的MM患者。”
德琪醫藥正將XPOVIO®盡快帶給澳大利亞的患者。公司還將與多方密切配合,以保證該藥物的可及性。
關于希維奧®/ATG-010/塞利尼索
塞利尼索是目前首款且唯一一款被美國食品藥品管理局(FDA)批準的口服XPO1抑制劑,也是首款可用于治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤的藥物。通過抑制核輸出蛋白XPO1,促使腫瘤抑制蛋白和其他生長調節蛋白的核內儲留和活化,并下調細胞漿內多種致癌蛋白水平。基于其獨特的作用機制,塞利尼索可與其他多個藥物聯用以提高療效。
塞利尼索已獲得美國FDA批準,用于治療復發難治性多發性骨髓瘤(R/R MM)和復發難治性彌漫性大B細胞淋巴瘤 (R/R DLBCL)。
德琪醫藥于2021年12月在中國獲得塞利尼索用于治療R/R MM的上市許可并計劃在2022年第二季度正式推出該款藥物。此外,公司于2021年7月及2022年3月分別在韓國和新加坡獲得塞利尼索用于治療R/R MM和R/R DLBCL的上市許可,并于2022年3月在澳大利亞獲得塞利尼索用于治療R/R MM的上市許可。德琪醫藥目前正在中國開展10項(其中3項由德琪醫藥與Karyopharm公司聯合開展)針對復發難治性血液腫瘤和晚期實體瘤的臨床研究。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動并已進入商業化階段的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得22個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索/ATG-010/XPOVIO®已獲得中國、韓國、新加坡和澳大利亞新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性描述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
參考資料 |
[1]. Joshua, D.E., et al., Biology and therapy of multiple myeloma. Med J Aust, 2019. 210(8): p. 375-380. |
[2]. Australian Government Cancer Australia. Myeloma in Australia statistics. 2020 [cited March 2022]; Available from: https://myeloma-cancer.canceraustralia.gov.au/statistics |
[3]. Australian Government Cancer Australia. Myeloma in Australia statistics. 2020 [cited March 2022]; Available from: https://myeloma-cancer.canceraustralia.gov.au/statistics |
[4]. Azmi AS, Uddin MH, Mohammad RM. The nuclear export protein XPO1 - from biology to targeted therapy. Nat Rev Clin Oncol.2021;18(3):152-169. |
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

- 這是在新加坡獲批上市的首款和唯一一款XPO1抑制劑
- XPOVIO®獲批用于治療復發難治性多發性骨髓瘤以及復發難治性彌漫性大B細胞淋巴瘤
上海和香港2022年3月2日 /美通社/ -- 致力于研發,生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,XPOVIO®(塞利尼索)已獲得新加坡衛生科學局(HSA)的上市許可,用于以下三個適應癥的治療:
- 復發難治性多發性骨髓瘤(R/R MM)– 塞利尼索聯合硼替佐米和地塞米松治療接受過至少1種既往治療的R/R MM患者
- 復發難治性多發性骨髓瘤(R/R MM) – 塞利尼索聯合地塞米松治療接受過至少4種既往治療且對至少兩種蛋白酶體抑制劑、兩種免疫調節劑及一種抗CD38單克隆抗體藥物存在難治的R/R MM成人患者
- 復發難治性彌漫性大B細胞淋巴瘤(R/R DLBCL)– 塞利尼索單藥用于治療接受過至少2種既往治療且無法接受造血干細胞移植的R/R DLBCL成人患者
德琪醫藥亞太地區市場負責人Thomas Karalis表示:“近年來,盡管對于R/R MM和R/R DLBCL的治療已經獲得了長足進步,但是患有這兩種危及生命疾病的患者仍需進一步延長他們的生存期。此次XPOVIO®獲批為新加坡的醫生和患者提供了一款全新療法,我們期待未來幾個月內在更多亞太市場實現XPOVIO®的成功上市”。
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“我很高興新加坡衛生科學局已經批準德琪醫藥將XPOVIO®這款唯一獲批上市的XPO1抑制劑帶給新加坡的R/R MM和R/R DLBCL患者。一次獲批三個適應癥是對我們的極大鼓舞,德琪醫藥將繼續努力,把同類首款/同類最佳療法帶給亞太區乃至全球患有腫瘤及其它危及生命疾病的患者。塞利尼索已經接受了十余項臨床研究的評估,并獲得全球多個權威腫瘤學會指南的廣泛推薦。在過去的幾年里,我們有幸通過指定患者藥物使用計劃將塞利尼索帶給亞太區的390名患者。現在,我們的商業化團隊已經做好準備,他們將結合XPOVIO®在中國和韓國的上市經驗,開始在新加坡全面推廣這款新型藥物。”
關于SINE藥物
選擇性核輸出抑制劑(SINE)靶向作用于主要核輸出蛋白Exportin 1(XPO1)。目前,有三款口服SINE藥物正處于臨床開發階段,它們是ATG-010(塞利尼索)、ATG-016(eltanexor)和ATG-527(verdinexor)。德琪醫藥已經從Karyopharm Therapeutics Inc.(“Karyopharm”)公司獲得了這三款藥物在亞太區多個市場的獨家開發和商業化權益。
關于希維奧®/ATG-010/塞利尼索
塞利尼索是目前首款且唯一一款被美國食品藥品管理局(FDA)批準的口服XPO1抑制劑,也是首款可用于治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤的藥物。通過抑制核輸出蛋白XPO1,促使腫瘤抑制蛋白和其他生長調節蛋白的核內儲留和活化,并下調細胞漿內多種致癌蛋白水平,誘導腫瘤細胞凋亡。基于其獨特的作用機制,塞利尼索可與其他多個藥物聯用以提高療效。
塞利尼索已獲得美國FDA批準,用于治療復發難治性多發性骨髓瘤(R/R MM)和復發難治性彌漫性大B細胞淋巴瘤 (R/R DLBCL)。
德琪醫藥于2021年12月在中國獲得塞利尼索用于治療復發難治性多發性骨髓瘤的上市許可并計劃在2022年第二季度正式推出該款藥物。此外,公司還于2021年7月及2022年3月分別在韓國和新加坡獲得塞利尼索用于治療復發難治性多發性骨髓瘤和復發難治性彌漫性大B細胞淋巴瘤的上市許可。德琪醫藥目前正在中國開展10項(其中3項由德琪醫藥與Karyopharm公司聯合開展)針對復發難治性血液腫瘤和晚期實體瘤的臨床研究。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動并已進入商業化階段的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得21個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得中國、韓國和新加坡新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

-Selinexor治療組與安慰劑組相比無進展生存期顯著提高(HR=0.7;p = 0.0486)
-p53野生型亞組患者的無進展生存期顯著延長(HR=0.38, p=0.0006)
-Selinexor耐受性良好,未發現新的安全性信號,且因不良事件停藥發生率低至10.5%
-Karyopharm計劃于2022上半年向美國食品和藥物管理局遞交補充新藥申請,并在即將召開的醫學會議上公布研究詳細結果
上海和香港2022年2月10日 /美通社/ -- 近日,德琪醫藥合作伙伴Karyopharm Therapeutics Inc.(Nasdaq: KPTI,以下簡稱“Karyopharm”)宣布Selinexor在治療晚期或復發性子宮內膜癌的III期臨床研究(SIENDO/ENGOT-EN5/GOG-3055)中獲得陽性臨床試驗結果(N=263),該研究評估了口服Selinexor用于晚期或復發性子宮內膜癌一線維持治療的有效性和安全性。
SIENDO研究達其主要終點,即Selinexor治療組患者無進展生存期(PFS) 與安慰劑組相比有顯著的統計學改善。
Selinexor治療組患者的中位PFS為5.7個月,安慰劑組為3.8個月,顯著延長50%;PFS風險比(HR)為0.70 (p=0.0486),疾病進展或死亡風險降低30%。與未接受治療或仍處于“觀察和等待”的患者相比,Selinexor組患者在治療12個月后無疾病進展可能性增加了37%,顯示出持續且穩定的獲益。在本研究中,Selinexor耐受性良好,未發現新的安全性信號,且由于不良事件停藥發生率低至10.5%。
初步數據顯示,在p53野生型亞組(被稱為“基因組的守護者”[1])中(n=103)Selinexor治療組患者發生疾病進展或死亡的風險明顯降低。在該亞組中,Selinexor治療組中位PFS為13.7個月,安慰劑組為3.7個月,其HR為0.38 (p=0.0006),發生疾病進展或死亡風險降低62%。Selinexor抑制XPO1促使腫瘤抑制蛋白p53在細胞核中累積[2],[3],使p53能夠充分發揮其腫瘤抑制功能。
Karyopharm將與研究者及美國食品和藥物管理局(FDA)合作,共同完成SIENDO數據的全面評估。Karyopharm計劃于2022年上半年向美國FDA遞交補充新藥申請(sNDA),并在2022年上半年的醫學會議上提交詳細研究結果。
“作為一種口服、無化療治療,Selinexor具備改變晚期或復發性子宮內膜癌的治療模式的潛力,我對p53野生型患者的情況非常感興趣。”主要研究者,來自比利時Leuven大學癌癥研究所Luxembourg婦科腫瘤學家Ignace Vergote教授表示,“這項研究使子宮內膜癌患者更加接近一種全新的治療選擇,讓患者有更多的時間與家人和朋友們在一起。”
“晚期或復發性子宮內膜癌女性患者預后差,”主要研究者,Memorial Sloan Kettering癌癥中心醫學腫瘤學家Vicky Makker博士表示,“按照目前的標準診療、以鉑類為基礎的化療后,僅觀察等待復發的情況,是完全不充分的。因此,迫切需要一種創新并具有全新機制的治法治療這種發病率和疾病相關死亡率不斷上升的異質性惡性腫瘤。”
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“我們很高興地看到,SIENDO III期研究在無進展生存期方面取得了顯著改善,這對患者意義重大。如果獲得批準,XPOVIO®將成為化療緩解后第一個也是唯一一個晚期或復發性子宮內膜癌的維持療法。我們相信,塞尼利索將會在子宮內膜癌領域發揮重要作用,為患者提供優質的治療選擇。同時,德琪醫藥期待與研究中心、合作伙伴一起開展這項試驗,也希望這項創新療法能盡快地面向中國和全球的患者。”
SIENDO是一項國際多中心III期臨床研究,旨在評估塞利尼索(XPOVIO®,Selinexor)用于晚期或復發性子宮內膜癌一線維持治療的有效性和安全性。國家藥品監督管理局(NMPA)已于2021年5月批準開展臨床,德琪醫藥將基于全球數據及中國亞組數據向NMPA遞交此項新適應癥的申請。
關于ATG-010/塞利尼索/ XPOVIO
塞利尼索是目前全球首款且唯一被美國FDA批準的口服XPO1抑制劑,也是首款可用于治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤的XPO1抑制劑。通過抑制核輸出蛋白XPO1,促使腫瘤抑制蛋白和其他生長調節蛋白的核內儲留和活化,并下調細胞漿內多種致癌蛋白水平,誘導腫瘤細胞凋亡,且正常細胞不受影響。基于其獨特的作用機制,塞利尼索可與其他多個藥物聯用以提高療效。
塞利尼索已獲得美國FDA批準用于治療復發/難治性多發性骨髓瘤(RRMM)和復發/難治性彌漫性大B細胞淋巴瘤(RRDLBCL)。
德琪醫藥已在中國和韓國通過優先評審程序獲得了塞利尼索的上市許可。公司目前正在中國大陸開展10項塞利尼索用于治療復發/難治/晚期實體瘤和血液腫瘤的臨床試驗(其中三項研究由德琪醫藥與Karyopharm公司聯合開展)。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動并已進入商業化階段的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得21個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得中國、韓國新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
參考文獻 |
1. Nature, p53 Guardian of the Genome. July 1992. https://www.nature.com/articles/358015a0 |
2. Subhash VV, Yeo MS, Wang L, Tan SH, Wong FY, Thuya WL, Tan WL, Peethala PC, Soe MY, Tan DSP, Padmanabhan N, Baloglu E, Shacham S, Tan P, Koeffler HP, Yong WP. Sci Rep. 2018 Aug 16;8(1):12248. doi: 10.1038/s41598-018-30686-1. PMID: 30115935 |
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

上海和香港2022年2月7日 /美通社/ -- 致力于研發,生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,澳大利亞Bellberry人類研究倫理委員會(HREC)已批準ATG-037用于治療局部晚期或轉移性實體瘤患者的I期臨床試驗STAMINA。該研究的主要目的為評估ATG-037單藥及聯合免疫檢查點抑制劑(CPI)的安全性和耐受性,以確認II期試驗的使用劑量,并評估該療法的初步療效。次要目的為確認ATG-037的藥理特征。
ATG-037是一款口服CD73小分子抑制劑。CD73可產生在腫瘤微環境中具有高度免疫抑制作用的腺苷。在臨床前研究中,ATG-037單藥以及與CPI或化療藥物的聯用顯示了良好的抗腫瘤活性。臨床前研究還顯示該藥物具有克服抗CD73抗體藥物治療中常見的“鉤狀效應”。此外,GLP藥物毒理學研究顯示該藥物的治療窗口較寬。
德琪醫藥首席醫學官Kevin Lynch博士表示:“對于德琪醫藥來說,開發可顯著改善腫瘤臨床治療現狀的新型藥物是一項極為重要的使命。臨床前毒理學研究顯示ATG-037的治療窗口較寬,臨床前數據還顯示,ATG-037與其它CD73抑制劑相比,具有差異化的藥物特性。我們對ATG-037的單藥研究抱有濃厚的興趣,ATG-037聯合CPI或化療藥物的潛在協同作用更是可能為晚期和轉移性腫瘤患者帶來深遠的獲益。此外,ATG-037也具有與公司管線內的多款候選藥物聯用的潛力,其中包括公司自主研發的雙特異性抗體ATG-101,這再一次彰顯了公司自有管線之間的聯用潛力。我很高興該臨床研究項目能夠得以啟動并期待看到該藥物的更多臨床進展。”
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動并已進入商業化階段的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得21個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得中國、韓國新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

上海和香港2022年1月5日 /美通社/ -- 致力于研發和商業化同類首款及/或同類最優血液及實體腫瘤療法的領先創新生物制藥公司 -- 德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,公司將會在1月份出席第40屆摩根大通年度健康醫療大會。
大會的詳情如下:
第40屆摩根大通年度健康醫療大會
發言時間: |
美國東部標準時間2022年1月10日周一下午4:30 |
|
發言人: |
創始人、董事長、首席執行官 梅建明博士 |
|
網絡直播: |
||
回放: |
回放將于活動結束后不久在德琪醫藥網站投資者關系頁面中的“公司介紹及Webcast”找到 |
|
一對一和小組會議: |
公司歡迎投資者于美國東部時間1月18日星期二上午7點至美國東部時間1月20日星期四下午9點參與線上一對一和小組會議,與公司管理層交流。 |
如需了解更多信息,請聯系摩根大通代表。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得20個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得中國、韓國新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

上海和香港2021年12月29日 /美通社/ -- 致力于研發和商業化同類首款及/或同類最優血液及實體腫瘤療法的領先創新生物制藥公司 -- 德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,旨在評估ATG-016 (eltanexor) 單藥治療在KRAS突變、P53野生型、HPV相關、EBV陽性及其他晚期實體腫瘤患者的開放性、多中心Ib/II期REACH臨床研究已完成首例患者給藥。
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“對德琪醫藥而言,REACH研究的啟動是一個重要的里程碑。作為ATG-016在中國大陸開展的第二項臨床研究,它彰顯了德琪醫藥通過在中國大陸自主開展臨床研究,從而拓展合作產品適應癥以擴充管線的開發策略。此外,該研究也顯示了德琪醫藥對于中國相對高發腫瘤在臨床開發中的高度關注。”
ATG-016(eltanexor)及其他選擇性核輸出抑制劑(SINE)藥物可抑制核輸出蛋白Exportin 1(XPO1),而這種蛋白可通過清除核內腫瘤抑制蛋白促進腫瘤的生長。ATG-016是一款口服、高選擇性的下一代XPO1抑制劑,它較第一代藥物ATG-010(selinexor)具有更好的藥理特性和較低的血腦屏障滲透性,從而實現更高頻次的給藥以及更高的耐受劑量。ATG-016已在治療晚期實體瘤和血液瘤的I期臨床試驗中顯示了初步的抗腫瘤活性。SINE藥物對于XPO1機制相關的病毒復制具有抑制作用。臨床前數據顯示,ATG-016對于由EBV和HPV等病毒誘發的腫瘤的生長具有抑制效應。
德琪醫藥首席醫學官Kevin Lynch博士表示:“REACH研究旨在評估ATG-016(eltanexor)單藥在攜帶特定基因型或存在已知病毒誘因的進展或耐藥腫瘤患者中的安全性、藥代動力學和初步療效。這項研究是基于已經公布的I期研究積極數據,重點關注那些我們認為最可能明顯獲益的患者。針對70%的腫瘤患者無法從現有治療中得到緩解,或在緩解后出現新的疾病進展的情況,德琪醫藥將側重于對耐藥機制的深入了解和耐藥型腫瘤治療的研究。此外,我想對參與此次臨床試驗的所有醫務人員、研究人員、患者及其家屬表示衷心的感謝。”
關于REACH研究
REACH研究是一項開放性、多中心、Ib/II期劑量探索研究。Ib期研究分為劑量遞增階段和劑量擴展階段。在劑量遞增階段,德琪醫藥將在晚期實體腫瘤受試者中開展ATG-016劑量遞增研究。在確定ATG-016的最大耐受劑量(MTD)、II期研究推薦劑量(RP2D)或生物有效劑量后,研究將進入劑量擴展階段。同時,在復發或轉移性陰莖鱗狀細胞癌和鼻咽癌(中國和東南亞地區高發腫瘤)受試者中開展II期臨床研究,以進一步評估ATG-016單藥治療的有效性和安全性。研究者根據實體瘤療效評價標準(RECIST1.1)每6周進行一次腫瘤評估。
關于SINE藥物
選擇性核輸出抑制劑(SINE)靶向作用于主要核輸出蛋白Exportin 1(XPO1)。目前,有三款口服SINE藥物正處于臨床開發階段,它們是ATG-010(selinexor)、ATG-016(eltanexor)和ATG-527(verdinexor)。德琪醫藥已經從Karyopharm Therapeutics(Karyopharm)公司獲得了這三款藥物在亞太區多個市場的獨家開發和商業化權益。
關于 ATG-010 (Selinexor,XPOVIO®)
ATG-010 (塞利尼索, XPOVIO®) 是Karyopharm公司開發的第一代SINE藥物,已經獲得美國FDA批準用于治療復發難治性多發性骨髓瘤(RRMM)以及復發難治性彌漫性大B細胞淋巴瘤(RR DLBCL)。
德琪醫藥已經通過優先審評程序在韓國和中國獲得了ATG-010的上市許可。目前,德琪醫藥正在中國大陸對ATG-010開展另外10項臨床研究(其中3項由德琪醫藥與Karyopharm公司聯合開展)。
關于 ATG-016 (Eltanexor)
德琪醫藥正在開展評估ATG-016/eltanexor單藥用于治療經去甲基化藥物治療失敗的高危MDS患者的I/II期注冊性研究。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得20個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得中國、韓國新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

上海和香港2021年12月20日 /美通社/ -- 致力于研發和商業化同類首款及/或同類最優血液及實體腫瘤療法的領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,在澳大利亞進行的ATG-101用于治療轉移性/晚期實體瘤和B細胞非霍奇金淋巴瘤(B-NHL)的I期首次人體試驗(PROBE研究)已經完成首例患者給藥。該研究的主要目的為評估ATG-101的安全性和耐受性,并確定ATG-101的最大可耐受劑量(MTD)和/或II期推薦使用劑量(RP2D)。次要目的為評估ATG-101的初步抗腫瘤活性。
ATG-101作為一款新型PD-L1/4-1BB雙特異性抗體,可阻斷免疫抑制性的PD-L1/PD-1結合,同時條件性激活4-1BB共刺激信號,從而激活抗腫瘤免疫效應細胞,在增強藥效的同時,增強安全性。ATG-101已在耐藥和在接受抗PD-1/L1治療后復發的動物腫瘤模型中顯示出強效的抗腫瘤活性。另外,在針對該藥物的GLP毒理學研究中,也未在給藥劑量高達100 mg/kg的食蟹猴中觀察到肝毒性。
位于澳大利亞悉尼的Scientia臨床研究中心的醫學主任Charlotte Lemech博士表示:“由于很多患有惡性腫瘤的患者都存在對現有的化療藥物、靶向藥物和單克隆抗體藥物存在耐藥或在接受治療后復發的現象,所以這些患者亟需可以改變治療現狀的創新藥物。越來越多的證據顯示,雙特異抗體將成為在腫瘤治療中舉足輕重的創新療法。我們很高興能有機會開展ATG-101這款新型PD-L1/4-1BB雙特異抗體的首個臨床研究,并將在研究中與多位資深的研究者通力合作。ATG-101具有PD-L1高親和力,并可實現對于4-1BB的條件激活,有望帶來更低的肝毒性風險。希望這款雙特異抗體藥物能展現更好的療效和安全性,在不久的將來為這些患者帶來一個新的治療方案。”
德琪醫藥首席醫學官Kevin Lynch博士表示:“ATG-101 是為了將PD-1抑制的效應與4-1BB的免疫激活效應相結合而專門設計和開發的藥物。其目的是通過將腫瘤由“冷”轉“熱”,強化腫瘤免疫療法的療效,從而讓無法從抗PD-1/L1單藥治療中獲益的患者得到更好的治療效果,并幫助已經對這些藥物產生耐藥的患者達到有效的疾病控制。PROBE是德琪醫藥首項針對其自主研發的創新藥物而開展的全球性研究。目前,該研究已在澳大利亞和美國兩地獲批,并在澳大利亞啟動患者入組,之后是美國。同時,我們正在中國推進一項名為PROBE-CN研究的臨床申報。首例患者給藥是重要的里程碑,再次彰顯了公司跨區域進行藥物研發和執行臨床研究的實力。很感謝所有受試者、研究人員以及研究中心的工作人員對這項研究的支持和付出。希望ATG-101能為腫瘤治療現狀帶來突破。”
關于PROBE研究
PROBE是一項針對ATG-101用于治療轉移性/晚期實體瘤和B細胞非霍奇金淋巴瘤(B-NHL)患者的I期首次人體試驗。該研究分為劑量爬坡和劑量擴展兩個階段,其主要目的為評估ATG-101的安全性和耐受性,并確定ATG-101的MTD及/或RP2D。次要目的為評估ATG-101的初步抗腫瘤活性。此外,該研究還將評估多項藥理學、免疫學和生物標志物指標。
關于ATG-101
ATG-101是一款新型PD-L1/4-1BB雙特異性抗體,正被開發用于治療多種腫瘤。ATG-101可形成一種基于細胞-抗體-細胞結構的三聚體,阻斷PD-L1/PD-1結合以及激活4-1BB共刺激信號,從而激活抗腫瘤免疫效應細胞,并有效降低肝毒性。ATG-101在體外研究中可激活枯竭的免疫細胞,顯示了其逆轉T細胞功能異常和細胞枯竭的潛力(在PD-1交聯條件下)。對于存在PD-L1過度表達的腫瘤細胞,ATG-101在接受抗PD1/L1治療后復發的動物腫瘤模型中顯示了顯著的抗腫瘤活性,并在GLP毒理學研究中展現了極佳的安全性。德琪醫藥在近期舉行的腫瘤免疫治療學會(SITC)年會上報告了這些研究的結果以及一項獨特的計算性半機械藥理學模型的開發項目。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得20個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得中國、韓國新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

上海和香港2021年12月17日 /美通社/ -- 致力于研發和商業化同類首款及/或同類最優血液及腫瘤學療法的領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,國家藥品監督管理局(NMPA)批準了希維奧®(塞利尼索,ATG-010)的新藥上市申請(NDA),通過與地塞米松聯用,治療既往接受過治療且對至少一種蛋白酶體抑制劑,一種免疫調節劑以及一種抗CD38單抗難治的復發或難治性多發性骨髓瘤(rrMM)。
希維奧®是德琪醫藥在全球范圍內首個商業化上市的產品,其在中國大陸市場獲批上市標志著德琪醫藥向商業化階段邁向了新臺階,也使得中國大陸成為繼美國、以色列、歐盟和韓國之后,全球第5、亞太第2個批準這款核輸出蛋白(XPO1)抑制劑創新藥物的地區。澳大利亞、新加坡和中國香港多個市場也預期將于2022年陸續獲批上市,標志著這一創新治療選擇對于造福全球血液腫瘤患者更近了一步。
多發性骨髓瘤(Multiple Myeloma,MM)是血液系統的第二大常見惡性腫瘤,約占中國血液系統惡性腫瘤的 10% ,且發病率呈逐年增高狀態和年輕化趨勢。 據GLOBOCON最新數據統計,中國 MM 2020年新發病例數高達21,116例,死亡病例數為16,182例。MM屬于不可治愈性疾病,大部分患者最終都會復發,其治療仍然面臨很大挑戰。
作為全球首款且唯一一款口服型XPO1抑制劑,塞利尼索作用于唯一經過臨床驗證的核輸出蛋白靶點,可與其他多個藥物聯用以提高療效,對于多個血液腫瘤疾病極具治療前景。此外,公司豐富的研發管線更讓管線內藥物之間的聯合開發成為可能,目前德琪醫藥正在中國大陸開展10項塞利尼索用于治療復發或難治性血液腫瘤和晚期實體瘤的臨床研究(其中3項研究由德琪醫藥與Karyopharm公司共同開展),主要進展如下:
- 3項針對復發難治性多發性骨髓瘤(rrMM)和復發難治性彌漫性大B細胞淋巴瘤(rrDLBCL),已獲美國FDA批準的適應癥的中國橋接研究:MARCH研究、BENCH研究和SEARCH研究。
- MARCH研究:MARCH研究首要分析結果證實,在既往接受過治療且對IMiD、PI和末線治療難治,包括對IMiD、PI和抗CD38單克隆抗體都難治的中國RRMM患者中,Sd(塞利尼索、地塞米松)方案均具有良好的有效性及可控的安全性
- BENCH研究:針對既往接受過1至3種抗多發性骨髓瘤治療方案的中國rrMM患者,比較SVd(塞利尼索,硼替佐米,地塞米松)與Vd(硼替佐米,地塞米松)的有效性和安全性
- SEARCH研究:評估塞利尼索單藥治療中國rrDLBCL患者的療效、安全性和耐受性
- 3項針對新增適應癥的全球性研究:
- XPORT-DLBCL-030研究:一項全球性、隨機、關鍵性II/III期研究,旨在評估塞利尼索聯合利妥昔單抗、吉西他濱、地塞米松和順鉑(R-GDP方案)用于治療接受過1-2種既往治療的復發難治性彌漫性大B細胞淋巴瘤患者
- SIENDO研究:這項旨在比較塞利尼索與安慰劑用于晚期或復發性子宮內膜癌的維持治療的隨機、雙盲、III期研究有望帶來一個全新的標準治療策略
- XPORT-MF-035研究:一項旨在比較塞利尼索與醫師選擇的治療方案用于治療既往接受過治療的骨髓纖維化患者的II期臨床研究
- 1項針對現有療法無法滿足臨床需求的亞洲區域高發疾病的TOUCH研究:ATG-010聯合化療用于治療復發難治性T和NK細胞淋巴瘤
- 2項用于治療B細胞非霍奇金淋巴瘤(B-NHL)的新型聯合療法:
- MATCH研究:ATG-010聯合ATG-008用于治療復發難治性彌漫性大B細胞淋巴瘤
- SWATCH研究:ATG-010聯合來那度胺和利妥昔單抗用于治療復發難治性彌漫性大B細胞淋巴瘤和惰性淋巴瘤
- 1項聯合標準化療方案針對復發或轉移性宮頸癌、子宮內膜癌及卵巢癌的PORCH研究
截至目前,塞利尼索多個治療血液腫瘤的方案獲得指南/循證研究重磅推薦和支持:4個治療骨髓瘤和1個治療淋巴瘤的方案被納入美國國家綜合癌癥網絡(NCCN)指南;4個治療骨髓瘤和淋巴瘤的方案被納入中國臨床腫瘤協會(CSCO)診療指南;2個治療骨髓瘤的方案被納入歐洲腫瘤內科學會(ESMO)指南。
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“德琪醫藥自2017年投入運營以來,5年不到的時間迎來了公司首個、在亞太2個市場進入商業化階段的產品,本次獲批對于公司來講具有重要歷史意義。德琪人將秉懷“以患者為中心”的初心,始終踐行“醫者無疆,創新永續”的使命,以卓越的“德琪速度”研發、制造出更多創新藥物,為全世界的血液腫瘤患者創造更多生命奇跡。”
關于希維奧®(塞利尼索,ATG-010)
塞利尼索是目前首款且唯一一款被美國FDA批準的口服XPO1抑制劑,也是首款可用于治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤的藥物。通過抑制核輸出蛋白XPO1,促使腫瘤抑制蛋白和其他生長調節蛋白的核內儲留和活化,并下調細胞漿內多種致癌蛋白水平,誘導腫瘤細胞凋亡。基于其獨特的作用機制,塞利尼索可與其他多個藥物聯用以提高療效。
塞利尼索已獲得美國FDA批準用于治療復發難治性多發性骨髓瘤(rrMM)和復發難治性彌漫性大B細胞淋巴瘤(rrDLBCL);2021年7月,德琪醫藥已在韓國通過優先評審程序獲得了塞利尼索的上市許可;2021年12月,希維奧®被國家藥品監督管理局批準,與地塞米松聯用,治療既往接受過治療且對至少一種蛋白酶體抑制劑,一種免疫調節劑以及一種抗CD38單抗難治的復發或難治性多發性骨髓瘤(rrMM)。
關于MARCH試驗
該研究是一項開放性、單臂、II期臨床研究,旨在評估塞利尼索聯合地塞米松治療方案(Sd)治療對免疫調節劑(IMiD)、蛋白酶抑制劑(PI)和末線治療方案難治的RRMM患者的有效性和安全性。其主要研究終點為基于獨立審查委員會(IRC)評估的總體緩解率(ORR)。研究入組82例復發難治性多發性骨髓瘤患者,Sd方案獲得良好療效,在這些高度難治患者中達到29.3%的總體緩解率,中位總生存時間為13.2個月;在既往接受過治療且對至少一種IMiD,一種PI以及一種抗CD38單抗難治的患者中ORR仍達到25%, 中位OS為11.9個月。MARCH研究結果證實,在對IMiD和PI兩藥難治及三藥(+CD38單抗)難治的中國RRMM患者中,Sd方案具有良好的有效性及可控的安全性。該研究結果與STORM研究(支持塞利尼索在美國獲批的臨床研究)基本一致。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得20個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得中國、韓國新藥上市申請的獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

上海和香港2021年12月16日 /美通社/ -- 德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK),一家致力于研發和商業化同類首款及/或同類最優血液及實體腫瘤療法的領先創新生物制藥公司和晶泰科技,一家致力于實現藥物研發行業革新的量子物理與人工智能賦能的藥物研發公司,今日共同宣布雙方達成一項長期研發合作。
根據該協議, 德琪醫藥將與晶泰科技強強聯合,利用晶泰科技人工智能驅動的in silico工具及高效的濕實驗室在內的一體化人工智能藥物研發技術平臺,助力德琪醫藥的藥物發現與開發。
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“這項合作是德琪醫藥在為治療腫瘤及其它致命疾病而開發同類首款及/或同類最優藥物方面邁出的又一大步。我們很高興有機會與晶泰科技一起利用in silico方法進行藥物的合成與檢測。相信這個技術平臺將助力我們探索更為廣闊的分子化學空間,加速推動德琪醫藥對于新型靶點的開發工作。 ”
晶泰科技首席執行官馬健博士表示:“晶泰科技和德琪醫藥兩家公司之間已有的良好信任為該項合作及未來更長期的合作奠定了基礎。我相信,晶泰科技領先的人工智能藥物研發平臺將幫助德琪醫藥的新藥研發達到傳統方法無法實現的速度和規模。晶泰科技和德琪醫藥的科研人員在藥物研發上的積極協作構建了雙贏的合作關系,這對于我們雙方而言都是極具價值的。”
]]>
上海和香港2021年12月14日 /美通社/ -- 致力于研發和商業化同類首款及/或同類最優血液及實體腫瘤療法的領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,公司在2021年12月11至14日在美國亞特蘭大以線下結合線上的形式舉行的2021年美國血液學會(ASH)年會上以壁報形式公布了塞利尼索(ATG-010)用于治療復發或難治T和NK細胞淋巴瘤的開放性Ib期TOUCH研究的數據(研究注冊號NCT04425070,關于該研究的更多詳情請見下文)。會議網址:https://www.hematology.org/meetings/annual-meeting
TOUCH研究入組既往接受過至少一線系統性治療的復發或難治性T和NK細胞淋巴瘤患者。主要研究終點為總體緩解率(ORR)和安全性。在中國入組了26例患者接受ATG-010聯合GemOx治療。其中,50%患者診斷為外周T細胞淋巴瘤-非特指型(PTCL-NOS),26.9%患者為結外NK/T細胞淋巴瘤(ENKTL);50%患者既往接受過至少3線治療,57%患者既往接受過含吉西他濱方案的治療。
ATG-010聯合GemOx治療呈現較好療效,其中PTCL-NOS和ENKTL患者的緩解率和PFS表現更突出。總人群ORR為46.2%,CR率26.9%,中位PFS 2.7個月。對PTCL-NOS和ENKTL兩個亞型而言,ORR分別為53.8%和57.1%、CR率分別為30.8%和28.6%,中位PFS分別為4.4個月和4.7個月。
ATG-010聯合GemOx治療安全性可控。常見的≥3級治療期不良事件(TEAEs)主要為血液學毒性事件(血小板計數降低、中性粒細胞計數降低和貧血)。非血液學不良事件通常為低級別且可逆轉,大部分為胃腸道事件。經過積極的支持治療和藥物調整,這些不良事件總體可控。
中山大學腫瘤醫院淋巴瘤中心黃慧強教授表示:“PTCL和NKTCL具有高度異質性和高侵襲性,在國內的發病率明顯高于西方國家,但現有的治療方案效果欠佳,特別是對于難治復發的患者,預后較差,往往只能選擇常規的化療藥物進行挽救治療,但緩解率較低且維持時間較短,尤其是對于大多數年齡較大和/或伴有多種合并癥且不適合移植的患者,有大量未滿足的臨床需求。TOUCH研究為我們提供了一種新的思路,塞利尼索是一款同類第一且同類唯一的口服選擇性核輸出蛋白抑制劑,與化療作用機制不同,聯合使用可起到協同增效的結果,臨床數據表明聯合GemOx方案后的療效和安全性令人鼓舞,更加難能可貴的是研究為中國人群的數據,對中國患者有著更加切實的指導意義,相信塞利尼索會成為這類患者治療的新的利器,為這部分患者帶來新的治療希望!”
德琪醫藥首席醫學官Kevin Lynch博士表示:“Ib期TOUCH研究顯示的積極有效性和安全性數據令人振奮。目前,已經接受過多線治療的T和NK細胞淋巴瘤患者對于新的治療藥物存在亟待滿足的臨床需求。我們將積極推進這些研究,并期待啟動ATG-010聯合GemOx方案的擴展研究,從而進一步探索該聯合療法的安全性和有效性。”
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“ATG-010是德琪醫藥首個進入商業化階段的創新藥。ATG-010已在韓國獲得上市許可,并有望于今年年底左右在中國獲批上市。TOUCH研究是德琪醫藥目前圍繞ATG-010正在開展的10項臨床研究中的一項,這些研究代表著德琪醫藥在為亟需有效治療藥物的腫瘤患者開發新型聯合療法方面所作出的不懈努力。我們在期待ATG-010的臨床開發取得更多進展的同時需要向所有參與研究的合作伙伴、研究人員和患者表示由衷的感謝。”
摘要詳情:
XPO1抑制劑(ATG-010)聯合研究者選擇的化療方案治療既往接受過多線治療的復發難治性(R/R)外周T細胞淋巴瘤(PTCL)和結外NK/T細胞淋巴瘤(NKTL)患者:一項多中心、單臂Ib期研究(TOUCH研究)的初步結果(摘要編號#2452)
分會場:霍奇金淋巴瘤及T/NK細胞淋巴瘤:臨床及流行病學進展:壁報展示II
日期及時間:美國東部時間2021年12月12日,星期日;6:00 PM – 8:00 PM
地點:喬治亞國際會議中心B5大廳
關于在2021年ASH年會上公布的有關ATG-010和其他SINE藥物的摘要
德琪醫藥的合作伙伴Karyopharm Therapeutics公司還在今年的ASH年會上發布了另外17篇關于塞利尼索和eltanexor的摘要。(詳情見Karyopharm公司于2021年11月4日發布的新聞稿)
關于SINE藥物
SINE(選擇性核輸出蛋白抑制劑)藥物是作用于核輸出蛋白Exportin 1(XPO1)的激動劑。目前,有ATG-010(塞利尼索)、ATG-016(eltanexor)和ATG-527(verdinexor)三款口服SINE藥物正在接受用于治療相關適應癥的臨床開發。德琪醫藥通過與Karyopharm Therapeutics公司(Karyopharm)的獨家授權協議獲得了這三款藥物在多個亞太市場的開發和商業化權益。
關于ATG-010/塞利尼索/ XPOVIO®
塞利尼索是目前首款且唯一一款被美國FDA批準的口服XPO1抑制劑,也是首款可用于治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤的藥物。通過抑制核輸出蛋白XPO1,促使腫瘤抑制蛋白和其他生長調節蛋白的核內儲留和活化,并下調細胞漿內多種致癌蛋白水平,誘導腫瘤細胞凋亡,而正常細胞不受影響。基于其獨特的作用機制,塞利尼索可與其他多個藥物聯用以提高療效。
塞利尼索已獲得美國FDA批準用于治療復發/難治性多發性骨髓瘤(RRMM)和復發/難治性彌漫性大B細胞淋巴瘤(RRDLBCL)。
德琪醫藥已在韓國通過優先評審程序獲得了塞利尼索的上市許可。公司目前正在中國大陸開展10項塞利尼索用于治療復發/難治/晚期實體瘤和血液腫瘤的臨床試驗(其中三項研究由德琪醫藥與Karyopharm公司聯合開展)。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得20個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得韓國新藥上市申請的優先獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

- ATG-017是一款口服的小分子ERK1/2抑制劑;歐狄沃®是一款PD-1檢查點抑制劑
- 該項聯合療法研究將于2022年上半年啟動
上海和香港2021年12月13日 /美通社/ -- 致力于研發和商業化同類首款及/或同類最優血液及實體腫瘤療法的領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,公司與百時美施貴寶公司達成了一項臨床合作協議,將共同開展一項旨在評估ATG-017聯合百時美施貴寶的PD-1檢查點抑制劑歐狄沃®(納武利尤單抗)用于治療晚期實體瘤的安全性、藥代動力學和初步療效的開放性1/2期臨床研究。
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“與百時美施貴寶公司達成的這項臨床合作彰顯了德琪醫藥將管線品種與不同機制療法相結合,從而探索可明顯改進腫瘤治療的新型療法的開發策略。我們很高興與百時美施貴寶公司達成這項臨床協議,并期待在2022年上半年開展這項極具潛力的聯合療法研究的患者入組工作。”
ATG-017是一款作用于細胞外信號調節激酶1和2(ERK1/2)的選擇性口服抑制劑。歐狄沃®是一款可與活性T細胞表面的人程序性細胞死亡蛋白受體-1(PD-1)結合的抗PD-1抗體藥物。該研究基于德琪醫藥已有的臨床前數據,其中部分數據已在近期舉行的腫瘤免疫治療學會(SITC)年會上公布。數據顯示,ERK1/2抑制劑聯合免疫檢查點抑制劑(CPI)在CPI耐藥的腫瘤模型中具有協同療效。
德琪醫藥首席醫學官Kevin Lynch博士表示:“我們相信,靶向藥物與腫瘤免疫療法的有效聯合具有巨大的治療潛力,很有可能為腫瘤治療帶來新的突破。我們認為 ATG-017具有與多種藥物聯用的潛力。在臨床前研究中,ATG-017聯合免疫檢查點抑制劑在耐藥或難治性腫瘤的小鼠模型中顯示了良好的協同作用。在這項1/2期臨床研究中,我們將對之前的發現進行臨床驗證。該研究的數據將支持后續研究的設計,如果數據積極,還將進一步揭示ATG-017聯合腫瘤免疫治療藥物的協同療效和將腫瘤由”冷“變“熱”的潛力。強效的ERK抑制可逆轉腫瘤微環境中的腫瘤抑制,并阻止由ERK介導的CPI抗藥性腫瘤復發和高度惡性腫瘤進展。這是目前腫瘤治療中一大亟待滿足的臨床需求。”
ATG-017目前正在一項用于治療攜帶RAS-MAPK通路突變患者的名為ERASER的開放性、多中心、1/2期劑量探索試驗中接受評估。該試驗包含劑量爬坡和劑量擴展兩個階段,將同時評估ATG-017單藥及聯合療法,其中PD-1檢查點抑制劑為首個組合藥物。
根據該協議,德琪醫藥將負責該臨床試驗的開展,并提供資金支持。百時美施貴寶公司將提供聯合療法的劑量爬坡和劑量擴展研究中所需的歐狄沃®。德琪醫藥擁有ATG-017的全球商業化和開發權益。歐狄沃®是屬于百時美施貴寶公司的商標。
關于ATG-017
ATG-017是一款作用于細胞外信號調節激酶1和2(ERK1/2)的強效、選擇性小分子抑制劑。ERK1/2是一類絲氨酸/蘇氨酸蛋白激酶,其作用是作為RAS-MAPK信號轉導級聯通路的終端激酶。該級聯通路調節細胞增殖等多種細胞進程。RAS-MAPK通路失調發于30% 以上的癌癥患者,最為常見的變化為多個腫瘤類型的RAS或BRAF基因突變。ERK抑制劑可同時靶向RAS和BRAF突變疾病。
德琪醫藥在近期召開的2021年腫瘤免疫治療學會(SITC)年會上公布了相關臨床前研究數據。該數據顯示,ATG-017聯合抗PD-L1單抗(阿特朱單抗)在對免疫檢查點抑制劑抗藥的小鼠腫瘤模型中達到腫瘤由“冷“至“熱”的轉化。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得20個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已在韓國通過優先審評獲批上市。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。

上海和香港2021年12月6日 /美通社/ -- 在剛剛過去的11月份,德琪醫藥再次揭開歷史新篇章。公司在北京、武漢、廣州、南京、杭州、海口的六個區域運營中心陸續正式投入啟用和人員正式到崗,并舉行了各運營中心啟動的開張典禮,各屬地的同事齊聚在當地,見證了這一歷史時刻。同時,為期十天的以“筑夢德琪,迎戰未來”為主題的全體商業化團隊“起航會議”不久前也在成都順利舉行。這一系列的“組合拳”,不僅僅對于商業化團隊建設,也對公司在中國的布局具有十分重要的戰略意義。
公司首個商業化的產品“塞利尼索”,預計2022年一季度在中國獲批上市。產品在韓國較計劃提前獲得上市許可,已拉開德琪醫藥在亞太商業化進程的序幕。作為全球首款且唯一一款口服型XPO1抑制劑,塞利尼索對于多個血液腫瘤疾病極具治療前景,除已獲批多發性骨髓瘤和彌漫性大B細胞淋巴瘤適應癥外,有多項治療血液腫瘤的方案獲指南/循證研究重磅推薦和支持:5項治療方案被納入美國國家綜合癌癥網絡(NCCN)指南,4項治療方案被納入中國臨床腫瘤協會(CSCO)診療指南,2項治療方案被納入歐洲腫瘤內科學會(ESMO)指南。
商業化之路任重道遠,作為一家以研發為驅動的生物制藥領先企業,德琪正在以堅定的步伐夯實“雙輪驅動”戰略,將研發和商業化的建設同步大力推進。以塞利尼索作為第一個切入的產品,德琪醫藥的商業化戰略是清晰的,步伐是穩健的。未來,公司將圍繞未滿足醫療需求、醫保支付能力、經濟發展水平這三個維度的綜合考量,落地公司創新與商業化發展戰略具體舉措。
始終將團隊建設作為構建商業化體系的核心關鍵因素。截止目前,德琪醫藥圍繞商業化開展工作的運營團隊近200人,短短6個月內全部集結完畢,建立了覆蓋市場、準入和定價、醫學事務、政府事務、醫學推廣團隊。這是一支“年輕”的團隊,因為大部分團隊成員在半年內集結完畢,但這也是一支成熟的團隊,80%以上的成員均擁有血液腫瘤領域工作背景,這更是一支充滿熱情和執行力的團隊,組建以來,以患者的臨床需求為己任,不斷深入學習,扎實拓展,通過海南NPP項目等積累了豐富的前期工作經驗。
始終將醫學信息推廣的深度和廣度作為構建商業化體系的基礎。只有把專業的醫學信息傳達給醫師和患者,才能真正指導用藥,讓患者受益,讓產品發揮價值。德琪醫藥實現了團隊組建和信息網絡構建兩條腿一起走路,在過去短短不到一年的時間,公司的醫學信息溝通網絡遍布全國30個省、直轄市、自治區、298個地級市,覆蓋174個縣、市、區和500家以上的二級以上醫院。在未來,隨著產品商業化的臨近,將會覆蓋更多地區和醫院。
始終將全產業鏈覆蓋作為構建商業化體系的重要組成部分。商業化的成功與否,藥品的質量和產能是關鍵,德琪醫藥緊抓住供應鏈環節,以創新藥物“符合全球標準的規模化生產”為目標,高質量完成了位于浙江紹興的總投資1億元人民幣、建筑面積16300平方米的固定制劑廠房的建設和設備安裝,為塞利尼索乃至更多產品從研發邁向產業化提供保障。
隨著產品在亞太地區的逐步上市,德琪醫藥商業化團隊逐步擴大,德琪將始終以患者為先,打造一支有體系、有張力、有紀律的商業化鐵軍。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在多個亞太市場獲得20個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得韓國新藥上市申請的優先獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
更多信息,敬請垂詢:
投資者聯系人:龍振國
郵箱:Donald.Lung@antengene.com
媒體聯系人:錢偉
郵箱:Peter.Qian@antengene.com

上海和香港2021年11月26日 /美通社/ -- 致力于研發和商業化同類首款及/或同類最優血液及實體腫瘤療法的領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,根據全球領先的指數公司MSCI的最新半年度指數評估結果,德琪醫藥已被納入MSCI全球小型股指數-MSCI中國小型股指數。相關調整將于2021年11月30日收盤后生效。
德琪醫藥被納入MSCI全球小型股指數-MSCI中國小型股指數,是繼恒生綜合指數(HSCI)、富時全球股票指數系列(GEIS)等指數之后,再次被納入國際知名股票指數,充分體現了國際資本市場對企業發展前景及公司在全球醫療健康行業影響力的認可。有望進一步提升德琪醫藥在國際資本市場的知名度,引入更多多元化的投資者群體。
]]>