- 公司將于AACR 2022(4月8日至13日)公布五個創新管線品種的臨床前數據。
- 所涉及的管線品種包括ATG-037、ATG-018、ATG-022、ATG-012和ATG-008。
上海和香港2022年4月11日 /美通社/ -- 致力于研發,生產和銷售同類首款及/或同類最優血液及實體腫瘤療法的商業化階段領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布公司將于4月8日至13日在新奧爾良以線下和線上形式舉行的2022年美國癌癥研究協會(AACR 2022)年會上展示五篇摘要壁報。
(https://www.aacr.org/professionals/meetings/myaacr-support/)
德琪醫藥首席科學官單波博士表示:“我們即將在AACR 2022上公布的臨床前數據展現了德琪醫藥五個創新管線品種的進展。這些品種靶向作用于腫瘤藥物研發中的幾個熱點機制,它們包括腫瘤微環境(TME)調節劑ATG-037;通路抑制劑ATG-018、ATG-022和ATG-008;以及抗體偶聯藥物(ADC)ATG-022。這些研究數據對我們臨床開發方案的制訂起到了至關重要的指導作用,并將幫助我們選擇可有效預示療效的生物標志物和擴大目標患者范圍的聯用藥物。我們很高興能與腫瘤領域的同行們分享這些成果。”
以下為壁報及摘要的詳細信息:
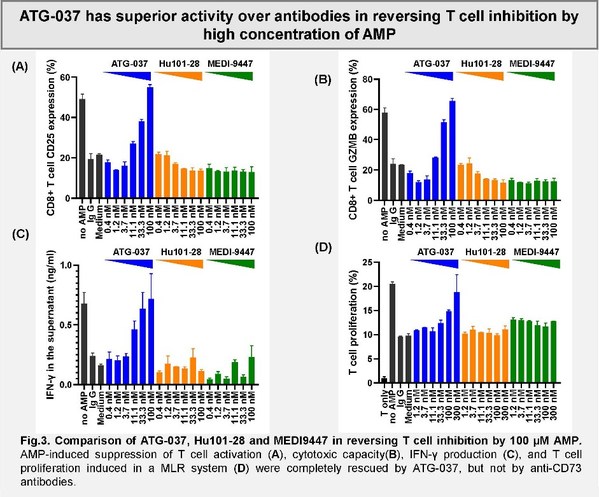
強效CD73小分子抑制劑ATG-037較抗CD73抗體藥物可更加有效的逆轉在高AMP的微環境中的免疫抑制
摘要編號:2576
分會場:細胞周期、增殖抑制劑和免疫治療藥物
日期和時間:2022年4月12日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區21
該項研究旨在比較強效選擇性口服CD73小分子抑制劑ATG-037和兩款抗CD73抗體藥物的T細胞活性。CD73是一種在腫瘤微環境中高表達的酶,它可將AMP降解為腺苷,從而導致免疫抑制和腫瘤惡化。本研究通過體外試驗評估了每個藥物對CD73酶活性抑制作用和逆轉由AMP/adenosine介導的T細胞功能抑制的能力。相較于另外兩款抗體藥物,ATG-037展現出更強的,完全的細胞表面CD73的抑制活性。
同時,如圖所示,文章作者發現ATG-037較其它已經進入臨床的抗CD73抗體藥物,可在較高AMP環境中更有效地恢復T細胞功能。這些數據表明CD73小分子抑制劑較CD73阻斷型抗體具有潛在的治療優勢。德琪醫藥正在開展一項ATG-037單藥及聯合抗PD-1抗體用于治療局部晚期/轉移性實體瘤患者的I期臨床試驗。
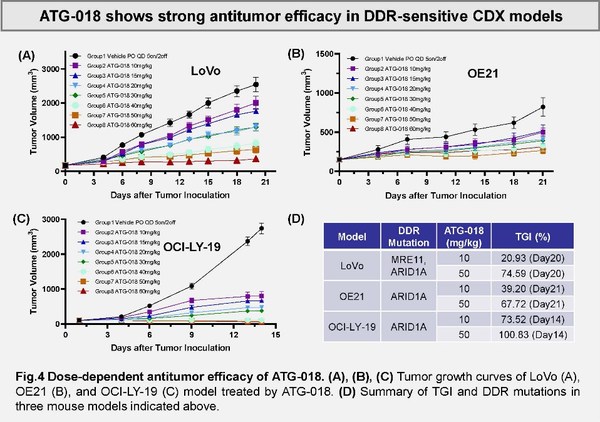
新型ATR抑制劑ATG-018在臨床前腫瘤模型中的療效
摘要編號:2604
分會場:DNA損傷反應和修復
日期和時間:2022年4月12日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區22
該臨床前研究總結了支持ATG-018這款ATR小分子抑制劑開發的藥理學數據。靶向抑制ATR激酶(共濟失調性毛細血管擴張和Rad3-相關激酶)可增加雙鏈斷裂的存積,這對依賴于DNA損傷應答(DDR)的腫瘤細胞具有重要意義。研究在一組包含142個腫瘤細胞系和3個CDX小鼠模型中評估了ATG-018的抗腫瘤活性,同時鑒別了潛在的預測性生物標志物。在體外試驗中,ATG-018顯示了對于ATR酶活性的強大抑制作用和對多種實體瘤以及血液瘤癌細胞增殖的強效抑制,且對正常外周血單核細胞(PBMCs)的存活無顯著影響。
此外,研究還發現了多個與ATG-018敏感性相關的基因表達變化,這些差異基因具有成為預測性生物標志物的潛力。如圖所示,文章作者發現ATG-018在多個具有特定DDR相關突變的實體瘤/血液腫瘤的CDX小鼠模型中顯示出良好的抗腫瘤活性。以上研究結果均提示了ATG-018具有與同源重組缺陷的合成致死潛力,以及廣泛的適應癥潛力。ATG-018對腫瘤細胞良好的增殖抑制活性預示著該藥物單藥及聯合療法對于多種依賴DDR的腫瘤具有治療潛力。同時,對于特定預測性生物標志物的開發也將支持該藥物作為靶向藥物的應用。德琪醫藥計劃在2022年內提交ATG-018的首個臨床試驗申請(IND)。
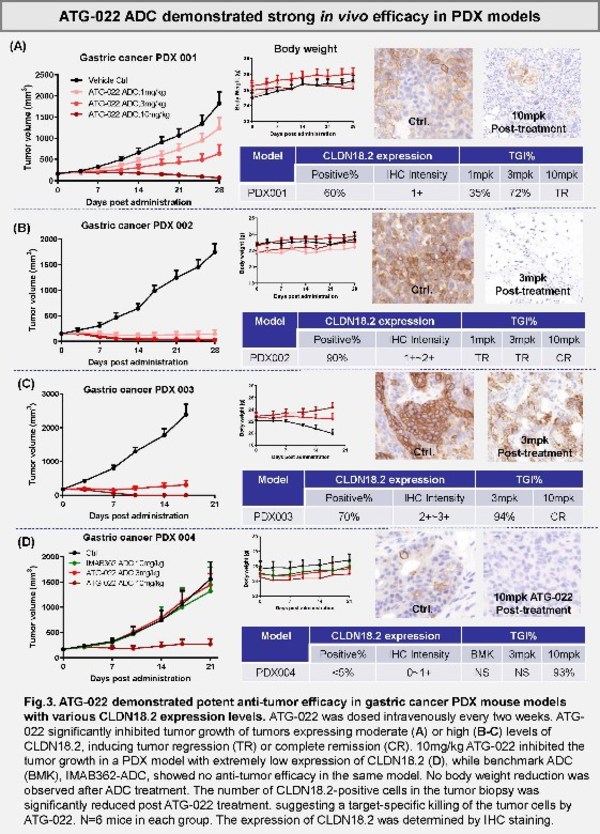
靶向作用于Claudin 18.2的抗體偶聯藥物ATG-022在胃癌患者的異種移植模型中顯示了優異的體內療效
摘要編號:1143
分會場:臨床前和臨床藥物學
日期和時間:2022年4月11日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區25
該項臨床前研究在多個胃癌的異種移植模型(PDX)中對靶向作用于Claudin18.2(CLDN18.2)的ADC藥物ATG-022進行了評估,以判斷其在不同CLDN18.2表達水平腫瘤中的治療潛力。有相當比例的胃癌和胰腺癌存在CLDN18.2異常表達。針對CLDN18.2的單克隆抗體藥物的研究顯示,盡管該藥物聯合化療顯示了積極的臨床獲益,但它在CLDN18.2低表達的患者中療效并不理想。
這項在此次AACR大會上發布的臨床前研究顯示:ATG-022以極高的親和力(低于納摩爾級別)與CLDN18.2結合,顯示了強效的體內和體外抗腫瘤活性,并在CLDN18.2高表達和低表達的模型中顯示了極高的劑量依賴的體內活性。此外,該研究還在CLDN18.2低表達的PDX腫瘤模型中觀察到了顯著的體內療效,尤其是在低表達的模型中。如圖所示,ATG-022較另外一款靶向作用與CLDN18.2的ADC藥物顯示了優越性。另外ATG-022可實現與CLDN18.2的高特異性結合,且不影響具有CLDN18.1表達的細胞。此外,ATG-022對動物體重幾乎沒有影響,這進一步預示了該藥物良好的安全性。文章作者在結論中指出,ATG-022顯示了為具有不同CLDN18.2表達水平的胃癌患者帶來臨床獲益的潛力。目前,德琪醫藥正在推進ATG-022的臨床前研究。
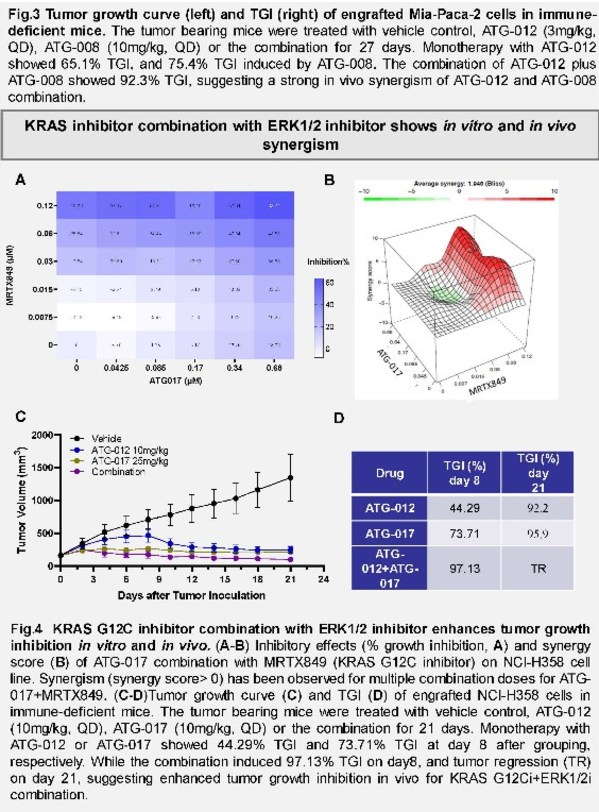
Kras(G12C)抑制劑聯合SHP2、ERK1/2、mTORC1/2或XPO1 抑制劑在攜帶Kras(G12C)變異的腫瘤中的協同效應
摘要編號:2679
分會場:信號通路抑制劑
日期和時間:2022年4月12日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區25
該項臨床前研究旨在尋找可克服KRAS G12C抑制劑治療中常見的無進展生存期較短(與獲得性耐藥相關)這一臨床困境的聯合療法。該研究在實體腫瘤CDX模型中評估了KRAS G12C抑制劑ATG-012分別聯合作用于受RASi影響的多個腫瘤通路的四款藥物的抗腫瘤活性,這些藥物是:1)SHP2抑制劑,ET0038;2)ERK 1/2激酶抑制劑,ATG-017;3)TORC1/2激酶抑制劑,ATG-008;及4)XPO-1抑制劑,塞利尼索。
ATG-012單藥不僅在治療的第27天顯示了具有劑量依賴的腫瘤生長抑制,同時,如圖所示,文章作者還發現 ATG-012與其他所研藥物的雙藥組合在研究中顯示了體內協同作用。尤其值得一提的是,ATG-012與德琪臨床階段的ERK抑制劑ATG-017具有良好的體內和體外協同效果,未來在臨床上可應用于解決KRAS抑制劑快速耐藥的問題。這些數據揭示了多個潛在的ATG-012聯合療法,這些聯合療法經進一步開發后可用于治療存在耐藥的患者,并針對性的治療患有特定類型腫瘤或具有特定組織學特征的攜帶KRAS G12C突變的患者。目前,德琪醫藥正在推進ATG-012的臨床前研究。
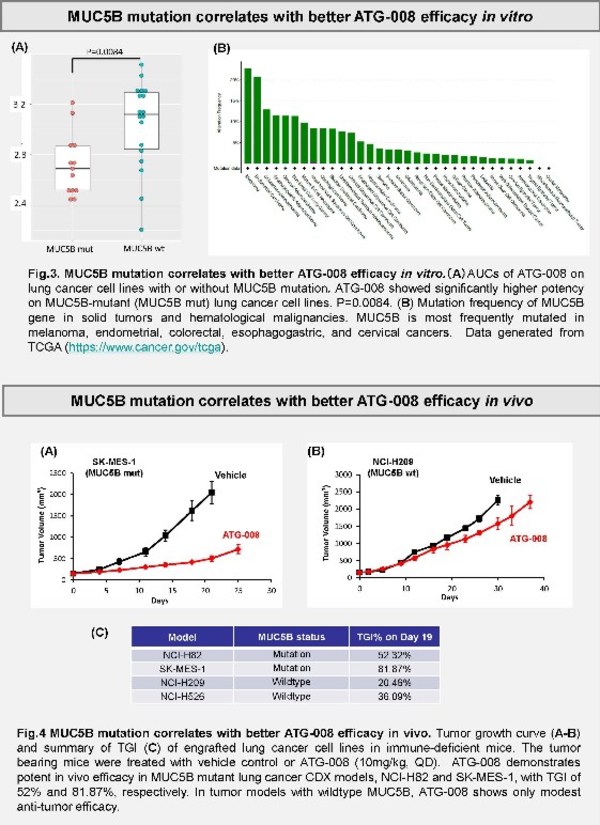
MUC5B突變可以作為肺癌治療中預測mTORC1/2 抑制劑ATG-008療效的生物標志物
摘要編號:4032
分會場:分子藥物學
日期和時間:2022年4月13日上午9:00至下午12:30(美國中部時間)
地點:壁報展示區26
該研究旨在評估MUC5B突變作為生物標志物在正向預測mTORC1/2抑制劑ATG-008(Onatasertib)在肺癌治療中的療效潛力。ATG-008是一款mTOR復合物1/2的雙重激酶抑制劑。mTOR復合物對于細胞的生長、代謝、增殖和存活具有調節作用。雖然腫瘤通常存在mTOR通路下調,但mTOR抑制劑在肺癌治療中的療效有限。本研究使用ATG-008體外處理了31個不同肺癌細胞系,以確定劑量反應并尋找和ATG-008敏感度相關聯的基因突變、擴增和表達。
如圖所示,文章作者發現,在體外或肺癌小鼠模型中,MUC5B突變與ATG-008更為強效的抗腫瘤活性相關。粘蛋白MUC5B在正常的肺細胞中起著關鍵的保護作用, 并在多種腫瘤中被報道和預后相關。文章還特別指出,黑色素瘤、子宮內膜癌,結腸癌、食管癌和宮頸癌等癌癥種類中也存在高比例的MUC5B突變,這就極大地擴展了MUC5B這一ATG-008藥效的預測性生物標志物的臨床應用潛力。目前,德琪醫藥正在開展多項ATG-008的I期和II期臨床試驗。
關于德琪醫藥
德琪醫藥有限公司(簡稱"德琪醫藥",香港聯交所股票代碼:6996.HK)是一家以研發為驅動并已進入商業化階段的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在美國及多個亞太市場獲得23個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索/ATG-010/ XPOVIO®已獲得中國、韓國、新加坡和澳大利亞新藥上市申請的獲批。德琪醫藥將以"醫者無疆,創新永續"為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為"風險因素"的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。
更多信息,敬請垂詢:
投資者聯系人:
龍振國
郵箱:Donald.Lung@antengene.com
手機:+86 18420672158
媒體聯系人:
錢偉
郵箱:Peter.Qian@antengene.com
手機:+86 13062747000

上海和香港2021年12月6日 /美通社/ -- 在剛剛過去的11月份,德琪醫藥再次揭開歷史新篇章。公司在北京、武漢、廣州、南京、杭州、海口的六個區域運營中心陸續正式投入啟用和人員正式到崗,并舉行了各運營中心啟動的開張典禮,各屬地的同事齊聚在當地,見證了這一歷史時刻。同時,為期十天的以“筑夢德琪,迎戰未來”為主題的全體商業化團隊“起航會議”不久前也在成都順利舉行。這一系列的“組合拳”,不僅僅對于商業化團隊建設,也對公司在中國的布局具有十分重要的戰略意義。
公司首個商業化的產品“塞利尼索”,預計2022年一季度在中國獲批上市。產品在韓國較計劃提前獲得上市許可,已拉開德琪醫藥在亞太商業化進程的序幕。作為全球首款且唯一一款口服型XPO1抑制劑,塞利尼索對于多個血液腫瘤疾病極具治療前景,除已獲批多發性骨髓瘤和彌漫性大B細胞淋巴瘤適應癥外,有多項治療血液腫瘤的方案獲指南/循證研究重磅推薦和支持:5項治療方案被納入美國國家綜合癌癥網絡(NCCN)指南,4項治療方案被納入中國臨床腫瘤協會(CSCO)診療指南,2項治療方案被納入歐洲腫瘤內科學會(ESMO)指南。
商業化之路任重道遠,作為一家以研發為驅動的生物制藥領先企業,德琪正在以堅定的步伐夯實“雙輪驅動”戰略,將研發和商業化的建設同步大力推進。以塞利尼索作為第一個切入的產品,德琪醫藥的商業化戰略是清晰的,步伐是穩健的。未來,公司將圍繞未滿足醫療需求、醫保支付能力、經濟發展水平這三個維度的綜合考量,落地公司創新與商業化發展戰略具體舉措。
始終將團隊建設作為構建商業化體系的核心關鍵因素。截止目前,德琪醫藥圍繞商業化開展工作的運營團隊近200人,短短6個月內全部集結完畢,建立了覆蓋市場、準入和定價、醫學事務、政府事務、醫學推廣團隊。這是一支“年輕”的團隊,因為大部分團隊成員在半年內集結完畢,但這也是一支成熟的團隊,80%以上的成員均擁有血液腫瘤領域工作背景,這更是一支充滿熱情和執行力的團隊,組建以來,以患者的臨床需求為己任,不斷深入學習,扎實拓展,通過海南NPP項目等積累了豐富的前期工作經驗。
始終將醫學信息推廣的深度和廣度作為構建商業化體系的基礎。只有把專業的醫學信息傳達給醫師和患者,才能真正指導用藥,讓患者受益,讓產品發揮價值。德琪醫藥實現了團隊組建和信息網絡構建兩條腿一起走路,在過去短短不到一年的時間,公司的醫學信息溝通網絡遍布全國30個省、直轄市、自治區、298個地級市,覆蓋174個縣、市、區和500家以上的二級以上醫院。在未來,隨著產品商業化的臨近,將會覆蓋更多地區和醫院。
始終將全產業鏈覆蓋作為構建商業化體系的重要組成部分。商業化的成功與否,藥品的質量和產能是關鍵,德琪醫藥緊抓住供應鏈環節,以創新藥物“符合全球標準的規模化生產”為目標,高質量完成了位于浙江紹興的總投資1億元人民幣、建筑面積16300平方米的固定制劑廠房的建設和設備安裝,為塞利尼索乃至更多產品從研發邁向產業化提供保障。
隨著產品在亞太地區的逐步上市,德琪醫藥商業化團隊逐步擴大,德琪將始終以患者為先,打造一支有體系、有張力、有紀律的商業化鐵軍。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在多個亞太市場獲得20個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得韓國新藥上市申請的優先獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
更多信息,敬請垂詢:
投資者聯系人:龍振國
郵箱:Donald.Lung@antengene.com
媒體聯系人:錢偉
郵箱:Peter.Qian@antengene.com

- 深入介紹了公司的研發策略以及包含15個品種的研發管線,其中10個為全球權益品種
- ATG-010在亞太區獲得的首個上市許可標志著德琪醫藥已經成功轉型為一家具有商業化能力的生物醫藥公司,公司正在中國大陸開展10項針對ATG-010的臨床研究
- 積極的ATG-008 (mTORC1/2 inhibitor) 早期數據,ATG-017(ERK1/2 inhibitor) 的臨床進展,以及在SITC年會上展示的ATG-101(PD-L1/4-1BB bispecific antibody)臨床前數據標志著研發管線正在繼續壯大
- 下一批IND申請所涉及的藥物將主要作用于導致腫瘤耐藥的靶點
上海和香港2021年11月19日 /美通社/ -- 致力于研發和商業化同類首款及/或同類先進血液及實體腫瘤療法的領先創新生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)于本周為投資者成功舉行了兩場研發日活動,并向與會人員深入介紹了公司的研發理念、策略、實力及Xpovio®(塞利尼索)的上市準備工作。活動期間,公司領導團隊詳細介紹了公司強大的藥物發現和早期開發管線、具有巨大潛力的臨床開發管線、以及Xpovio®(塞利尼索/ATG-010)這個率先進入商業化階段的核心品種。
該活動包括于2021年11月16日在線上舉行的英文場和11月18日在上海舉行的中文場。
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“德琪醫藥自2017年投入運營以來,在打造一家以研發為驅動的國際腫瘤藥物企業方面所取得了一系列卓越成績。今年對于德琪醫藥來說意義非凡,因為在這一年里我們迎來了公司的首個進入商業化階段的產品,同時還在早期研發、臨床研究、生產和商業化能力的建設上獲得了突出進展。至今,公司一共獲得了19項臨床批件,并有望在今年年底至2022年一季度獲得更多。這些成績,以及我們在2020年的成功上市和截至2021年6月30日~4.3億美元的賬面現金都是對德琪醫藥的優秀的運營能力、運營效率和執行能力的有力證明。”
梅建明博士還表示:“腫瘤這個疾病的進展是不等人的,所以緊迫感時刻伴隨著我們。德琪醫藥目前正在努力將多款突破性藥物盡快帶給患者。我對德琪醫藥的前景充滿信心。我們對于最新腫瘤生物學機制和靶點,尤其是針對耐藥腫瘤的開發;公司強大的研發管線、豐富的內部研發項目、諸多高價值的合作伙伴、堅實的專家關系和具有豐富經驗的管理團隊讓德琪醫藥有能力開發多款具有同類最佳和同類首款潛力的新型腫瘤藥物。同時,德琪不斷壯大的內部研發團隊和正在建設中的杭州大分子生物新藥研發中心將為公司的發展提供所需的關鍵支持。”
以下是對于研發日重點內容的回顧。如需瀏覽報活動所用幻燈片或觀看線上會議的重播(分別于2021年11月16日和11月18日舉行線上英文和線下中文兩場),請訪問:https://www.antengene.cn/en/event#investorBox
以ATG-010(塞利尼索)為切入點,推進商業化布局
聚焦醫療需求,鎖定潛在市場 -- 德琪醫藥在活動中詳細介紹了其目標市場的具體情況,這些市場是在綜合考慮了當地未被滿足的醫療需求、醫保的覆蓋狀況和GDP增長等重要因素后選出的。XPOVIO®在韓國較計劃提前獲得上市許可,拉開了德琪醫藥在亞太商業化進程的序幕。公司分享了塞利尼索在中國獲得的積極反饋,以及在今年年底前后獲得上市許可的預期。此外,公司預計塞利尼索將在年底至2022年期間在包括中國大陸在內的多個國家和地區獲得上市許可。
包括10項由德琪醫藥開展的臨床研究的ATG-010臨床開發計劃將不斷產生新的研究數據(三項研究由德琪醫藥與Karyopharm公司共同開展)。德琪醫藥強調,公司龐大的研發管線讓管線內藥物之間的聯合開發成為可能。關于ATG-010的主要進展包括:
- 針對復發難治性多發性骨髓瘤(R/R MM)和復發難治性彌漫性大B細胞淋巴瘤(R/R DLBCL)共三個已獲美國FDA批準的疾病的中國橋接試驗包括:MARCH研究、SEARCH研究和BENCH研究
- 針對現有療法無法滿足臨床需求的亞洲區域高發疾病的臨床開發:TOUCH研究:ATG-010聯合化療用于治療復發難治性T細胞和NK細胞淋巴瘤
此外還介紹了多個用于治療B細胞非霍奇金淋巴瘤(B-NHL)的新型聯合療法:針對ATG-010聯合ATG-008用于治療復發難治性彌漫性大B細胞淋巴瘤的MATCH研究;針對ATG-010聯合來那度胺和利妥昔單抗用于治療復發難治性彌漫性大B細胞淋巴瘤和惰性淋巴瘤的SWATCH研究(聯合標準治療方案)。
- 多項針對新增適應癥的全球性研究:
XPORT-DLBCL-030研究:一項全球性、隨機、關鍵性II/III期研究,旨在評估塞利尼索聯合利妥昔單抗、吉西他濱、地塞米松和順鉑(R-GDP方案)用于治療接受過1-2種既往治療的復發難治性彌漫性大B細胞淋巴瘤患者。
SIENDO研究:這項旨在比較塞利尼索/安慰劑用于維持治療晚期或復發性子宮內膜癌的隨機、雙盲、III期研究有望帶來一個全新的標準治療策略。
XPORT-MF-035研究(骨髓纖維化):一項旨在比較塞利尼索和醫師選擇的治療方案用于治療接受過既往治療的骨髓纖維化患者的II期臨床研究。
強大的臨床開發管線
德琪醫藥對其臨床開發管線中的靶向藥物和創新免疫治療藥物進行了詳細的介紹。公司展示的臨床及臨床前研究結果顯示,管線品種具有將“冷腫瘤”轉化為“熱腫瘤”的能力。此外,這些產品還在耐藥、復發和處于疾病進展階段腫瘤的小鼠模型中顯示了明顯的抗腫瘤活性和極低的臨床前毒性。公司還在會上介紹了從現在至2025年期間每年獲得2至3項臨床申請的目標。公司在活動中著重介紹的臨床品種包括:
- ATG-101(PD-L1/4-1BB雙特異性抗體):公司回顧了近期在SITC年會上公布的差異性臨床前數據,數據顯示了該品種在PD-L1耐藥和PD-L1治療后復發的活體模型中具有活性,且未顯示肝毒性。公司正在澳大利亞開展一項針對ATG-101用于治療實體瘤和惡性血液腫瘤的I期多中心劑量爬坡研究,該項研究的IND也已獲FDA批準。
- ATG-008(Onatasertib, MTORC1/2抑制劑):公司回顧了針對聯合PD-1單抗的I/II期TORCH-2劑量探索研究的數據。最新數據顯示,20例療效可評估的患者中1例達到CR,5例達到PR(ORR=30%),9例達到SD(DCR=75%)。尤其值得一提的是,在5例療效可評估的宮頸癌患者中,1例達到CR,3例達到PR(全部經過確認)。這些積極的初步數據支持對該聯合療法的進一步探索。德琪醫藥表示,公司將盡快推進該項研究并探索快速的審批路徑。
- ATG-037(口服CD73小分子抑制劑):可逆轉由腺苷介導的免疫抑制:會議上,公司回顧了多項比較小分子藥物和基準單抗藥物的研究。臨床前研究顯示,ATG-037可扭轉腫瘤微環境中CD8+T細胞缺乏的情況,并具有單藥活性和在聯合療法中增強其它藥物療效的能力。德琪醫藥表示,公司計劃于年底在澳大利亞完成試驗計劃的提交,以推進關于該藥物的單藥和聯合療法研究。
- ATG-017(ERK1/2抑制劑):德琪醫藥介紹了這個具有同類最佳潛力的品種,該品種還與免疫檢查點抑制劑和其它靶向RAS/MAPK通路的抑制劑具有很高的聯用潛力。在澳大利亞開展的I期ERASER劑量爬坡研究已進入劑量爬坡階段。
豐富多樣的早期開發管線
德琪醫藥表示,公司計劃每年提交2-3項臨床研究申請,在適應癥方面公司將重點關注對免疫療法耐藥腫瘤這一日益棘手的臨床瓶頸。
公司還公布了來自三項臨床前研究的積極數據,并介紹了三款高差異性藥物:ATG-022(靶向Claudin 18.2的抗體偶聯藥物)、ATG-018(ATR 抑制劑)、ATG-012(KRAS G12C抑制劑)。公司計劃在未來12個月內提交這幾個藥物的臨床試驗申請。
藥物發現項目的進展令人振奮
德琪醫藥表示,相信巨噬細胞將很快成為腫瘤免疫療法的下一個研發熱點,此外公司還重申了對于免疫微環境這一高潛力領域的關注。
公司隨后介紹了兩款早期品種:靶向LILRB這一巨噬細胞表達的關鍵免疫檢查點蛋白的單克隆抗體ATG-032,以及具有高特異性腫瘤滅殺和調節免疫微環境雙重機制的Axl-Mer小分子雙重抑制劑ATG-041。將在2023年開始提交的下一波臨床試驗申請也會涵蓋這兩個品種。
ASH2021大會上發布的數據
德琪醫藥還提示,公司將于12月12日ASH大會期間發布最新研究數據。
摘要2452(關于ATG-010/塞利尼索的Ib期TOUCH研究)將于當天下午6:00至8:00 在喬治亞州亞特蘭大舉行的美國血液病學會(ASH,https://www.hematology.org/meetings/annual-meeting)2021年年會的壁報展示環節發布。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥擁有15款在研產品,其中 5款產品擁有包括大中華市場在內的亞太權益,10款產品具有全球權益。德琪醫藥已在多個亞太市場和美國獲得19個臨床批件(IND),并遞交了6個新藥上市申請(NDA),其中塞利尼索已獲得韓國新藥上市申請的優先獲批。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。有關這些因素和其他可能導致未來業績與任何前瞻性聲明存在重大差異的因素的進一步討論,請參閱我們提交給香港證券交易所的定期報告中標題為“風險因素”的章節以及我們截至2020年12月31日的公司年報中描述的其他風險和不確定性,以及之后向香港證券交易所提交的文件。

上海和香港2021年8月13日 /美通社/ -- 2021年8月12日,德琪醫藥與上藥控股就全球首款口服型選擇性核輸出抑制劑塞利尼索(美國食品藥品管理局批準的專用英文商品名:XPOVIO®,英文通用名:selinexor),在國內的進口授權、分銷業務、供應鏈服務和創新增值等多個層面達成戰略合作意向并簽署戰略協議。當日出席簽約儀式的有德琪醫藥創始人、董事長、首席執行官梅建明;德琪醫藥首席科學官單波;德琪醫藥首席運營官劉翼騰;德琪醫藥血液腫瘤事業部負責人于立新;上海醫藥執行董事、副總裁、上藥控股總經理李永忠;上藥控股副總經理宋潞潞等。
本次戰略合作中,上藥控股將作為德琪醫藥塞利尼索的國內進口總經銷,通過發揮其進口清關、渠道分銷、招標掛網、市場準入等方面的優勢和成熟經驗,為德琪醫藥提供一站式進口分銷服務。并且雙方將借助上藥控股優質高效的供應鏈服務及合作渠道下的DTP藥房網絡,致力于直接服務患者的DTP藥店、支持患者援助項目PAP藥店及創新金融、商業保險等創新領域的共同深入探索。
塞利尼索是全球同類首款且唯一一款口服型選擇性核輸出抑制劑(SINE)化合物,已于2021年2月24日,獲得中國國家藥品監督管理局(NMPA)的新藥上市申請(NDA)優先審評資格,用于治療難治復發性多發性骨髓瘤(rrMM)患者。此外,塞利尼索在復發難治性彌漫性大B細胞淋巴瘤、子宮內膜癌、非小細胞肺癌、骨髓纖維化以及外周T細胞和NK/T細胞淋巴瘤等多項臨床試驗也均在中國開展,且大部分試驗已處于臨床后期。德琪醫藥始終在與監管機構保持密切溝通和合作,以期推進塞利尼索的盡快上市,使創新療法盡早惠及中國患者。上藥控股是一家以藥品分銷為核心的全國性現代醫藥供應鏈服務企業,其醫藥分銷規模位居中國大型醫藥分銷企業前列,已在全國建立了覆蓋20000余家的醫療機構終端網絡。此次德琪醫藥和上藥控股的強強聯合,標志著德琪醫藥在商業化布局方面的全面提速。
“塞利尼索為難治復發性多發性骨髓瘤患者的治療提供了全新療法,我們很高興能與上藥控股達成合作。通過上藥控股的業務網絡和渠道優勢,結合德琪醫藥自身的領先研發實力和專業學術能力,推進塞利尼索產品能夠盡早、盡快地惠及中國大陸患者。” 德琪醫藥創始人、董事長、首席執行官梅建明表示:“與此同時,我們也期待日后有更多合作,發揮各方優勢資源,推動更多同類首款和同類最優療法的高品質創新藥惠及有需要的患者。”
“此次上藥控股與德琪醫藥的深度合作意義非凡,雙方將攜手在多個領域全力助力塞利尼索的商業化進程,為血液腫瘤患者提供保障。”上海醫藥執行董事、副總裁、上藥控股總經理李永忠表示,“上藥控股將秉承“服務為榮”的理念,為德琪提供全方位的服務。期待雙方可以充分發揮各自領域的資源優勢,共同加速中國創新藥發展,造福更多患者。”
]]>
上海和香港2021年8月2日 /美通社/ -- 2021年8月2日,由中國醫藥工業研究總院指導,中國醫藥工業信息中心專家小組評選的“2021年中國醫藥新銳創新力量”榜單于第38屆全國醫藥工業信息年會上正式揭曉。基于對企業創新、競爭、布局、發展、戰略五大維度客觀數據的研究與分析,研發能力、核心競爭力、市場潛力、投資價值、團隊能力五個層次的綜合審評,德琪醫藥獲得專家團隊的一致認可,榮膺“2021年中國醫藥新銳創新力量”企業。
隨著我國“創新驅動發展戰略”和“健康中國戰略”的深入推進,創新力量正成為護航中國人民身心健康的核心動能。政策環境、創新生態、技術突破、人才發展和資本格局的多重利好驅動下,中國新藥碩果頻出,健康產業穩步發展。中國創新藥發展已迎來黃金時期,德琪醫藥不僅僅是見證者,更是參與者和貢獻者。
具備專業的管理團隊和治理結構,基于自身可持續發展能力進行企業管理戰略部署,是保證企業穩定發展增長的基石。集智創新,以變革謀發展,合理布局產品研發的技術側重及管線體系,維持產品的新穎性和創新性,才能在激烈的市場競爭中領跑向前。這便是“2021年中國醫藥新銳創新力量”五大維度衡量標準的要義所在。
秉承“醫者無疆,創新永續”的發展使命,德琪醫藥致力于通過發現、開發及商業化全球同類首款、同類唯一和同類最優療法,為亞太乃至全球患者提供國際最領先的診療方案和創新產品。現已通過自主研發及合作引進,建立了一條擁有13款在研產品(其中5款產品擁有包括大中華市場在內的亞太權益,8款產品具有全球權益)的從臨床前到臨床階段不斷延展的豐富產品管線。
- 目前,德琪醫藥已在多個亞太市場獲得15個臨床批件(IND),并遞交了6個新藥上市申請(NDA)。與美國Karyopharm合作開發的塞利尼索(selinexor)作為第一款也是唯一一款用于治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤的藥物已在美國獲批上市,德琪醫藥在韓國的新藥上市申請也已優先獲批。此外,塞利尼索在國內的兩項注冊性臨床試驗也已推進至臨床后期。
- 德琪新藥研發中心已落戶上海張江,依托中國“藥谷”的技術及人才優勢建立靶點篩選和先導藥物開發平臺,基于園區完整的上下游產業鏈,重點開發具有同類第一或同類最優潛質的抗腫瘤創新藥物。現共計6款自主藥物研發在有序開展。其中,ATG-101(PD-L1/4-1BB雙抗)成為第一款德琪醫藥研發團隊開發進入臨床,并且具有全球權益的創新藥產品, 并且是澳大利亞第一款進入臨床的PD-L1/4-1BB雙抗產品。
- 2021年05月14日,德琪醫藥產業化基地在紹興落成,主要用于抗腫瘤小分子固體制劑的商業化生產,這是德琪醫藥走向集早期研發、臨床研究、生產及商業化于一體的全產業鏈創新型藥企的一大里程碑。
“監管、人才、資本,是構建高能創新生態的三大核心要素。創新必定是前沿的,具有前瞻性的監管,建設“管理+科學”復合型人才隊伍,疊加以“改善人類生命健康”為出發點的長期資本投入,三者相輔相成,缺一不可。”德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“非常榮幸德琪醫藥能夠入選“2021年中國醫藥新銳創新力量”企業,我們將繼續懷揣“醫者無疆,創新永續”理念,堅持研發驅動,發揮“自主研發+合作引進”雙引擎驅動模式優勢,植根中國,邁入亞太,走向全球,讓更多患者享受創新進步帶來的健康成果。”
]]>
上海和香港2021年7月26日 /美通社/ -- 2021年6月,由德琪醫藥、美國生物制藥公司Karyopharm Therapeutics、美國佐治亞大學獸醫學院合作,題目為“Selinexor, a novel selective inhibitor of nuclear export, reduces SARS-CoV-2 infection and protects the respiratory system in vivo”(“塞利尼索,全球首創選擇性核輸出抑制劑,可減少新型冠狀病毒 (SARS-CoV-2) 感染并在體內保護呼吸系統”)的最新抗COVID-19新冠病毒治療研究結果,于病毒學領域權威學術期刊《抗病毒研究》(Antiviral Research,192(2021),105-115)發表。研究證實核輸出受體XPO1對嚴重急性呼吸系統綜合癥冠狀病毒2 (以下簡稱“SARS-CoV-2”)感染和2019冠狀病毒病(COVID-19)病理學有直接作用,口服選擇性XPO1抑制劑塞利尼索(selinexor,美國商品名XPOVIO®)在體外和體內均顯示出顯著的抗新冠病毒效果。這個結果表明,塞利尼索可能是一種可行的新冠病毒治療方案。
SARS-CoV-2造成了于2019年爆發的全球大流行的冠狀病毒病COVID-19。本研究及之前的研究結果證實,核輸出蛋白1(exportin 1,以下簡稱“XPO1”)在SARS-CoV蛋白的復制和發病機制中具有直接的作用:XPO1負責某些SARS-CoV蛋白的核輸出,包括ORF3b、ORF9b和核衣殼,這些蛋白幫助病毒逃避固有免疫。此外,冠狀病毒感染導致XPO1依賴的GLTSCR2的細胞質定位,進而造成IFN-β減弱,從而更利于病毒進行復制。因此,抑制XPO1對于阻止病毒的復制和傳播,預防和治療COVID-19具有潛在的積極作用。
塞利尼索對于SARS-CoV-2病毒在體外的繁殖和傳播具有抑制作用
本研究通過將被SARS-CoV-2感染的Vero E6細胞與不同濃度的塞利尼索,分別在病毒感染前6小時(預防性)、病毒感染時(治療性)、感染后0、24、36和48小時進行孵育,實驗結果表明,塞利尼索在體外具有強大的抗SARS-CoV-2的活性,在濃度為10nM時對SARS-CoV-2的繁殖有50%的抑制作用,濃度為100nM時有高達90%的抑制作用。研究證明在SARS-CoV-2病毒感染后的48小時,使用塞利尼索依舊能夠抑制SARS-CoV-2病毒在體外的復制。
塞利尼索證明對雪貂體內的SARS-CoV-2感染具有療效
文中雪貂新冠病毒感染模型的體內實驗結果顯示,經鼻感染SARS-CoV-2后的動物在感染后4小時平行使用塞利尼索(5mg/kg)和安慰劑(空白對照)對比治療,三天后,經塞利尼索治療動物的平均體內病毒滴度顯著低于安慰劑治療組,同時,與安慰劑組相比,塞利尼索顯著降低了呼吸系統的炎癥水平。
塞利尼索降低內毒素引起的人外周血單核細胞炎性因子分泌
炎性細胞因子大量分泌是新冠病毒感染的重要表現和致死因素,本文發現塞利尼索可以在體外模型中顯著降低內毒素引起的人外周血單個核細胞炎性因子分泌。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥已在多個亞太市場獲得15個臨床批件(IND),并遞交了6個新藥上市申請(NDA)。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
關于塞利尼索(XPOVIO®)
塞利尼索是目前首款且唯一一款被美國FDA批準的口服SINE化合物,也是首款同時可用于治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤的藥物。此外,塞利尼索針對多個實體腫瘤適應癥開展了多項中期和后期臨床試驗,包括脂肪肉瘤和子宮內膜癌。德琪醫藥正在中國開展塞利尼索治療多發性骨髓瘤、彌漫性大B細胞瘤、子宮內膜癌、非小細胞肺癌以及外周T細胞和NK/T細胞淋巴瘤等多項臨床試驗,5項試驗處于臨床后期。
參考文獻
Kashyap T, Murray J, Walker CJ, Chang H, Tamir S, Hou B, Shacham S, Kauffman MG, Tripp RA, Landesman Y. Selinexor, a novel selective inhibitor of nuclear export, reduces SARS-CoV-2 infection and protects the respiratory system in vivo. Antiviral Res. 2021 Jun 19;192:105115. |

上海和香港2021年7月19日 /美通社/ -- 7月17日,由《臨床血液學雜志》主辦、德琪醫藥承辦的首屆中國血液東方峰會暨德琪血液高峰論壇在上海拉開帷幕,來自全國血液腫瘤領域的近200名頂級專家、學者齊聚一堂,聚焦血液腫瘤領域最新診療進展和實踐熱點話題,共話前沿趨勢及發展。
華中科技大學同濟醫學院附屬協和醫院院長胡豫教授;北京大學血液病研究所所長黃曉軍教授;中華醫學會血液學分會常委李建勇教授;南方醫科大學血液病研究所所長劉啟發教授;哈爾濱血液病腫瘤研究所所長馬軍教授;中國醫學科學院血液病醫院淋巴瘤診療中心主任邱錄貴教授;上海交通大學附屬瑞金醫院內科學終身教授沈志祥教授;中國醫學科學院血液病醫院副所院長王建祥教授;蘇州大學附屬第一醫院血液科主任吳德沛教授;上海交通大學醫學院附屬瑞金醫院副院長趙維蒞教授(以姓氏漢語拼音為序)共同擔任本次大會主席,并負責各環節的主持。
第一篇章:多發性骨髓瘤的復發不可避免,鞏固和維持治療是重中之重
在中國,多發性骨髓瘤(Multiple Myeloma,以下簡稱“MM”)是血液系統的第二大常見惡性腫瘤,約占血液系統惡性腫瘤的 10%[1]。據最新數據統計,中國 MM 發病率為 1.6/10 萬[2],死亡人數為 146554 ,且發病率呈逐年增高狀態和年輕化趨勢[3]。目前國內以傳統治療方式“化療”為主,面臨難以治愈、患者預后并不理想、復發不可避免的治療困境,亟需有效治療方式和新型藥物提高治愈率和臨床效果。
目前,多發性骨髓瘤的復發仍不可避免,其早期復發是由細胞遺傳學因素、生化因素、MRD狀態等共同決定的,基因突變在疾病復發中有驅動作用;但是很多復發是由于治療不規范引起,比如達到緩解后沒有進行鞏固和維持,這也是影響預后的重要因素。反復多次地復發,預后則會越來越差。因此,即便疾病得到控制,強化患者“長期用藥,定期復查”理念也是重中之重,盡可能減少復發和復發次數,讓更多患者通過鞏固和維持中達到長期的無病生存。蘇州大學附屬第一醫院血液科主任吳德沛教授和中國醫學科學院血液病醫院副所院長王建祥教授于復發難治多發性骨髓瘤診療現狀分析環節表示。
上海交通大學附屬瑞金醫院內科學終身教授沈志祥教授指出,“在中國,接受過多種藥物治療仍復發的多發性骨髓瘤患者,面臨無藥可用的臨床困境。面對這一類人群,更多、更便利治療藥物的出現成為臨床醫生與患者的共同迫切期待。”
塞利尼索是全球首款且唯一一款被美國FDA批準的口服型選擇性核輸出抑制劑化合物,不同組合方案的研究數據顯示,塞利尼索不僅能夠克服老年、高危、腎功能不全患者的不良預后,而且多線治療甚至耐藥患者也能從中獲益。華中科技大學同濟醫學院附屬協和醫院院長胡豫教授對于塞利尼索未來獲批上市后,即將為中國MM患者帶來全新有力的治療選擇,實現更長的生存時間,收獲更高生活質量表示非常期待。
第二篇章:新型藥物或是B細胞淋巴瘤診療的突破口
據中國腫瘤登記中心2018年發布的淋巴瘤年報數據顯示,中國淋巴瘤發病人群總數高達近9萬,發病率約為6.41/10萬,我國淋巴瘤每年約有10萬名新發淋巴瘤患者[4],彌漫性大B細胞淋巴瘤發病率占所有淋巴瘤的33.27%[5]。北京大學血液病研究所所長黃曉軍教授、中華醫學會血液學分會常委李建勇教授、中國醫學科學院血液病醫院淋巴瘤診療中心主任邱錄貴教授和上海交通大學醫學院附屬瑞金醫院副院長趙維蒞教授一致指出,難治復發性彌漫性大B細胞淋巴瘤患者的二線標準治療是挽救化療,隨后接受自體干細胞移植,但仍有一半以上的復發/難治的患者不適合做移植或移植后復發,這些患者的治療是目前臨床上所面臨的難題。
哈爾濱血液病腫瘤研究所所長馬軍教授表示:“目前國內大型中心醫院正在不斷探索淋巴瘤規范化診療的新模式,進一步推進多學科專科化的發展,越來越多的新型藥物也從基礎進入臨床,帶來了非常好的療效。對于不適合做移植或移植后復發的60%左右的復發/難治患者,新型藥物的突破或許是解決這一臨床困境重要抓手。”南方醫科大學血液病研究所所長劉啟發教授補充道:“現今小分子靶向藥的問題就是價格比較昂貴,而病人需要持續用藥,由于經濟情況基本用不起。所以,更多的藥物國產化、本土化,能夠實現‘可負擔持續用藥’是患者最大的期望。作為一名血液科醫生,希望有越來越多用得起、療效好的新藥可以給病人帶來驚喜。”
“為向患者提供更可及、可負擔的藥品及服務,德琪醫藥始終堅持以研發驅動,打造集早期研發、臨床研究、藥物生產及商業化于一體的全產業鏈。”德琪醫藥董事長梅建明博士分享道:“德琪醫藥目前已擁有的本土化產業基地和研發中心,包括:浙江產業化基地,上海新藥研發中心和杭州新藥研發中心。期望藥物能夠通過本土化生產,為患者提供高質高效、可負擔的藥物供應。我們正在積極推動塞利尼索在中國的臨床研究和上市,以期盡快地造福更多患者。”
希望通過本次會議的成功舉辦,能夠有力推動國內血液學領域的學術交流與合作,鞏固和擴大已有專業領域的交流平臺,實現專業科研與臨床治療的信息共享與成果對接,促進規范化綜合治療和學科建設與發展,使我國骨髓瘤和淋巴瘤等疾病的診治登上新的臺階。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥已在多個亞太市場獲得15個臨床批件(IND),并遞交了6個新藥上市申請(NDA)。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
關于塞利尼索
塞利尼索是目前首款且唯一一款被美國FDA批準的口服SINE化合物,也是首款可用于治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤的藥物。通過抑制核輸出蛋白XPO1,促使腫瘤抑制蛋白和其他生長調節蛋白的核內儲留和活化,并下調細胞漿內多種致癌蛋白水平,誘導腫瘤細胞凋亡,而正常細胞不受影響。基于其獨特的作用機制,塞利尼索可與其他多個藥物聯用以提高療效。
當前正在進展中的血液腫瘤相關臨床試驗包括:
- 塞利尼索聯合地塞米松治療多藥難治的多發性骨髓瘤的II期臨床試驗在中國大陸開展(MARCH)
- 塞利尼索單藥治療難治復發彌漫性大B細胞淋巴瘤的II期臨床試驗在中國大陸開展(SEARCH)
- 塞利尼索聯合R-GDP治療難治復發彌漫性大B細胞淋巴瘤的III期全球多中心臨床試驗在中國大陸開展(XPORT-DLBCL-030)
- 塞利尼索單藥治療子宮內膜癌的III期全球多中心臨床試驗在中國大陸開展(SINEDO)
- 塞利尼索單藥治療非小細胞肺癌的II期臨床試驗在中國大陸開展(TRUMP)
- 塞利尼索聯合ICE/GEMOX治療難治復發外周T細胞和NK/T細胞淋巴瘤I期臨床試驗在中國大陸開展(TOUCH)
- 塞利尼索聯合硼替佐米、地塞米松治療難治復發多發性骨髓瘤III期臨床試驗在中國大陸開展(BENCH)
- 塞利尼索單藥治療既往接受過治療的骨髓纖維化的II期全球多中心臨床試驗在中國大陸開展(XPORT-MF-035)
- Eltanexor單藥治療去甲基化藥物治療失敗的中高危骨髓增生異常綜合征的I/II期臨床試驗在中國大陸開展(HATCH)
[1] 來自:管楠楠等. 腫瘤防治研究. 2019;46(4):547-550. |
[2] 來自:PUPH and Peking University Health Science Centre’s unpublished data (have authorized). Based on UEBMI and URBMI database, from 2012 to 2016 in Chinese 23 provinces. |
[3] 來自:Jin Lu, et al. Blood Cancer J. 2014 Aug 15;4:e239. |
[4] 2018 年最新《全球癌癥報告》 |
[5] 李小秋, 李甘地, 高子芬,等. 中國淋巴瘤亞型分布:國內多中心性病例10002例分析[J]. 診斷學理論與實踐, 2012(2):111-115. |

上海和康涅狄格州哈特福德2021年5月25日 /美通社/ -- 致力于研發和商業化創新腫瘤療法的領先生物制藥公司–德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,公司正式任命Kathryn Gregory女士為副總裁兼商務拓展負責人,并向德琪醫藥首席商務官John F. Chin先生匯報。入職后,Kathryn將負責領導公司對外的商務拓展,包括授權許可、合作開發與商業化、企業并購及其他合作,以支持公司既定的發展目標。
Kathryn在全球生物制藥領域擁有超過25年的管理經驗,在公司戰略、談判、并購、合作項目管理等全球商務拓展方面積累深厚。同時,她還擁有市場營銷和戰略采購的實戰經驗。在加入德琪醫藥之前,Kathryn曾在Aileron Therapeutics擔任首席商務官,負責歐洲和亞洲地區抗腫瘤和化療保護劑藥物項目的談判,以及拓展公司與大型生物科技及制藥企業的重點合作項目。在這之前,她曾擔任戰略咨詢公司KG BioPharma Consulting LLC的總裁,協助生物制藥公司開展一系列企業戰略及商務拓展活動。在投身咨詢之前,Kathryn曾任Seneb BioSciences的聯合創始人、首席執行官兼首席商務官。
基于“合作引進”和“自主研發”雙輪驅動的產品開發策略,德琪醫藥成立四年已擁有13款具有同類首款或同類最優潛力的候選藥物,覆蓋腫瘤、自身免疫和病毒感染3大疾病領域。本月,德琪醫藥與Calithera Biosciences, Inc.達成協議,引入了一款高效、高選擇性CD73抑制劑(ATG-037)。
“在對外合作方面,依托我們‘聯合、互補、全球化’的合作戰略,專業的臨床研發和臨床轉化的能力,并通過高效的運營和執行,德琪正快速地從臨床研究走向商業化,也在亞太地區建立了廣泛布局。過去四年間,我們在管線中引進和開發了13款候選藥物,獲得15個臨床批件,并在5個亞太市場遞交了新藥上市申請。”德琪醫藥創始人、董事長兼首席執行官梅建明博士說:“ Kathryn是生物制藥領域非常優秀的領導型人才。相信在她的帶領下,德琪醫藥能進一步拓展產品管線,讓我們能早日向亞太和全球患者分享世界前沿的療法。”
德琪醫藥首席商務官John F. Chin先生表示:“德琪醫藥已建立一條以抗腫瘤為主的研發管線,擁有13款實力強勁且高度協同的候選藥物。目前,我們正在為塞利尼索在亞太市場的商業化作準備,預計今年第四季度及明年第一季度迎來產品上市。很高興看到Kathryn加入我們的團隊,相信她的經驗將為我們商務拓展項目提供極大的助力。”
“非常高興能夠加入德琪醫藥。在德琪的團隊中,不僅有專業于研發的高精尖科學家,還有在抗腫瘤領域中經驗豐富的國際化管理團隊。我期待為德琪達成更多同類首款或同類最優創新藥物的戰略合作,進一步加速德琪的成長。” Kathryn Gregory女士說。
Kathryn在佩珀代因大學獲得工商管理碩士學位,并在加州大學伯克利分校獲得文學學士學位。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段的不斷延展的豐富產品管線。目前,德琪醫藥已在多個亞太市場獲得15個臨床批件(IND),并遞交了5個新藥上市申請(NDA)。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求,欲了解更多,請訪問www.antengene.com。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。

上海和香港2021年5月6日 /美通社/ -- 致力于研發和商業化創新腫瘤療法的領先生物制藥公司 -- 德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)今日宣布,中國腫瘤學權威機構中國臨床腫瘤學會(CSCO)發布2021年診療指南,塞利尼索片(selinexor)有多項治療骨髓瘤和淋巴瘤的方案獲指南推薦。其中,指南新增塞利尼索片用于骨髓瘤的三項治療方案,包括:(i)塞利尼索片+地塞米松;(ii)塞利尼索片+地塞米松+硼替佐米;(iii)塞利尼索片+地塞米松+泊馬度胺,用于治療復發骨髓瘤。此外,指南還推薦使用塞利尼索片治療復發難治性彌漫性大B細胞淋巴瘤(rrDLBCL)。CSCO指南作為中國臨床醫生指導腫瘤臨床診斷和治療的金標準,是國內最具有學術影響力的診療指南之一。
多發性骨髓瘤是一種克隆漿細胞異常增殖的惡性疾病,在很多國家是血液系統第二常見的惡性腫瘤。多發性骨髓瘤難以治愈且易復發,而且復發后缺乏標準的治療方案。隨著越來越多的新藥應用于臨床,如何選擇合適的治療方案也是臨床上面臨的難題。彌漫性大B細胞淋巴瘤是一種高侵襲性的惡性腫瘤,近半數患者經一線治療后無法治愈,60%的rrDLBCL患者治療選擇有限。
塞利尼索片作為全球首個針對腫瘤治療全新機制的口服選擇性核輸出抑制劑(SINE),與核輸出蛋白XPO1緊密結合,抑制癌蛋白及其他GR通路,致癌蛋白失活,從而達到抗腫瘤作用。
骨髓瘤
復發骨髓瘤
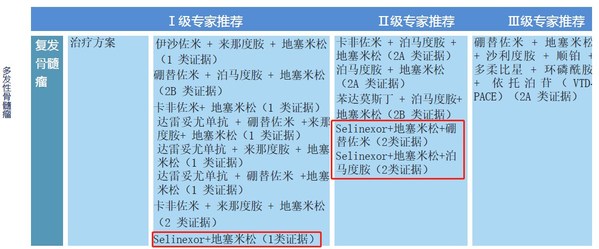
塞利尼索片+地塞米松治療方案獲I級專家推薦(1類證據)
塞利尼索片+地塞米松+硼替佐米治療方案獲II級專家推薦(2類證據)
塞利尼索片+地塞米松+泊馬度胺治療方案獲II級專家推薦(2類證據)
STORM試驗為多中心、單臂、開放標簽試驗,旨在探索塞利尼索片+地塞米松(Xd)在多線復發難治性多發性骨髓瘤(rrMM)中的療效,結果顯示對前期已接受中位7線治療的rrMM患者,Xd方案可以取得26%的客觀緩解率(ORR)。
STOMP試驗為多中心開放標簽隨機的I/II期試驗,探索不同Xd聯合方案在rrMM中的療效和安全性,試驗結果顯示:塞利尼索片+泊馬度胺+地塞米松組所有患者的中位無進展生存期(PFS)達12.2個月,對于II期推薦劑量(RP2D)組的患者,ORR達60%;對于蛋白酶體抑制劑(PI)非難治的患者,塞利尼索片+硼替佐米+地塞米松的ORR達84%。
淋巴瘤
淋巴瘤診療指南中也對塞利尼索片做了相應推薦。注釋中提到:rrDLBCL患者推薦選擇其他與CHOP(環磷酰胺、阿霉素、長春新堿和潑尼松龍)無交叉耐藥的藥物即二線方案化療或個體化方案。西達本胺、伊布替尼、澤布替尼、奧布替尼、維布妥昔單抗、PD-1單抗、XPO抑制劑(selinexor)、BCL-2抑制劑等新藥單用或聯合治療也體現出初步療效。
SADAL試驗為塞利尼索片治療rrDLBCL的注冊試驗,試驗結果顯示所有患者ORR達28.3%,完全緩解率(CR)達12%,生發中心B細胞(GCB)樣型患者ORR達34%。
中華醫學會血液學分會主任委員、蘇州大學附屬第一醫院血液科主任吳德沛教授表示:“彌漫性大B細胞淋巴瘤是一種異質性很強的血液腫瘤,涵蓋一組大細胞、轉化B細胞為表型的異質性、侵襲性淋巴瘤,導致正常淋巴結結構的彌散性破壞。XPO1在DLBCL患者中高表達,且預示著不良預后。塞利尼索是全球首個口服選擇性XPO1抑制劑,已被NCCN指南推薦用于至少接受過2線治療(包括移植和CAR-T治療后疾病進展)的彌漫性大B細胞淋巴瘤患者。2021年版CSCO淋巴瘤指南將塞利尼索納入推薦,為淋巴瘤提供新的治療選擇,相信塞利尼索可以惠及更多患者。”
中國醫藥教育協會血液學專業委員會主任委員、首都醫科大學附屬北京朝陽醫院血液科主任陳文明教授表示:“多發性骨髓瘤是一種常見的血液系統惡性疾病,隨著新藥的研發與應用,患者生存期逐漸延長,但患者無法治愈,患者終將耐藥復發。全新作用機制藥物塞利尼索可以克服多發性骨髓瘤的多藥耐藥,聯合化療可以使各種疾病狀態的骨髓瘤患者獲得快速、深度地緩解。塞利尼索納入本次CSCO指南推薦,為臨床帶來了更多選擇,期待它為更多患者帶來福音。”
關于塞利尼索(XPOVIO®)
塞利尼索是同類首款且唯一一款口服型選擇性核輸出抑制劑(SINE),由Karyopharm Therapeutics Inc.(納斯達克股票代碼:KPTI)研發,德琪醫藥進行研究。德琪醫藥在包括大中華區、南韓、澳大利亞、新西蘭和東盟國家的多個亞太市場獲得了塞利尼索的獨家開發和商業化權利。
2019年7月,美國FDA批準塞利尼索聯合低劑量地塞米松用于治療難治復發性多發性骨髓瘤患者。2020年6月,美國 FDA再次批準塞利尼索作為單藥治療難治復發性彌漫性大B細胞淋巴瘤患者。2020年12月,美國FDA批準了塞利尼索聯合硼替佐米和地塞米松治療既往接受過至少一種治療方案的多發性骨髓瘤患者。2021年2月,以色列衛生部批準塞利尼索治療難治復發性多發性骨髓瘤和難治復發性彌漫性大B細胞淋巴瘤。2021年3月,歐洲聯盟委員會(EC)批準塞利尼索治療難治復發性多發性骨髓瘤。
塞利尼索是目前首款且唯一一款被美國FDA批準的口服SINE化合物,也是首款可用于治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤的藥物。此外,塞利尼索針對多個實體腫瘤適應癥開展了多項中期和后期臨床試驗,包括脂肪肉瘤和子宮內膜癌。2020年11月,德琪醫藥合作伙伴Karyopharm在2020 年結締組織腫瘤學年會(CTOS 2020)上報告了III期SEAL試驗的積極數據。SEAL是一項隨機、雙盲、安慰劑對照交叉試驗,旨在比較口服單藥塞利尼索與安慰劑在脂肪肉瘤患者中的療效。另外,Karyopharm公布了塞利尼索用于治療子宮內膜癌患者的正在進行的III期SIENDO試驗已完成計劃的中期無效性分析,數據安全監查委員會(DSMB)推薦該試驗無需作任何修改按計劃繼續進行。SIENDO試驗的首要數據結果預計在2021年下半年公布。
德琪醫藥正在中國開展塞利尼索治療多發性骨髓瘤、彌漫性大B細胞瘤、外周T細胞和NK/T細胞淋巴瘤、子宮內膜癌和非小細胞肺癌等多項臨床試驗,5項試驗處于臨床后期。此外,德琪醫藥已在中國大陸、澳大利亞、韓國、新加坡等多個亞太市場遞交了新藥上市申請(NDA),并獲得國家藥品監督管理局(NMPA)授予的優先審評資格以及韓國食品醫藥品安全部(MFDS)授予的孤兒藥資格。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家以研發為驅動的生物制藥領先企業,致力于為亞太乃至全球患者提供最領先的療法,治療腫瘤及其他危及生命的疾病。自2017年正式運營以來,德琪醫藥通過合作引進和自主研發,建立了一條從臨床前到臨床階段不斷延展的豐富產品管線。目前,德琪醫藥已在多個亞太市場獲得13個臨床批件(IND),并遞交了5個新藥上市申請(NDA)。德琪醫藥將以“醫者無疆,創新永續”為愿景,專注于同類首款和同類最優療法的早期研發、臨床研究、藥物生產及商業化,解決亟待滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。
*XPOVIO®為KaryopharmTherapeutics Inc.注冊商標。

上海和香港2021年4月29日 /美通社/ -- 隨著《海南自由貿易港建設總體方案》的發布與落實,全球創新藥物的引進不斷取得新突破。近日,德琪醫藥全球首創選擇性核輸出抑制劑塞利尼索(selinexor, XPOVIO®)在海南博鰲樂城先行區博鰲超級醫院開出中國大陸首張處方,并獲準帶離使用。該處方是用于治療復發難治性多發性骨髓瘤患者。塞利尼索在中國大陸的處方落地,使國內患者能與全球同步分享這一全新機制的抗腫瘤藥物,對提高國內血液腫瘤治療現狀具有里程碑意義。
人民網、澎湃新聞、海南新聞聯播等多家媒體先后對塞利尼索首張處方落地及帶離進行了報道,表示該首創藥物的引進對國內患者的治療具有積極的臨床意義。人民網指出:“首例復發難治多發性骨髓瘤患者服用塞利尼索后,病情得到了有效控制。塞利尼索通過抑制腫瘤的‘源頭’控制腫瘤細胞‘作惡’,其治療機制與現有其它治療藥物完全不同,國際腫瘤創新藥塞利尼索迅速引進博鰲樂城,為國內多發性骨髓瘤患者的治療,創造了更多選擇”。
落地海南博鰲前,塞利尼索在香港地區開展了指定患者藥物使用計劃(NPP),已經用于治療數十名復發難治性多發性骨髓瘤患者和復發難治性彌漫性大B細胞淋巴瘤患者。隨著首例患者在博鰲超級醫院完成給藥,塞利尼索也同步在中國大陸開啟了真實世界研究。
多發性骨髓瘤和彌漫性大B細胞淋巴瘤是全球常見的兩大血液惡性腫瘤。多發性骨髓瘤是一種腫瘤性漿細胞疾病。近年來,自體干細胞移植和來那度胺等藥物的應用改變了骨髓瘤的傳統治療方式,取得了一些治療進展,但原發耐藥和疾病復發仍舊是多發性骨髓瘤無法治愈的主要原因。在國內,多發性骨髓瘤患者面對著診斷不足、難以治愈,復發后缺乏有效治療方式的臨床困境。彌漫性大B細胞淋巴瘤是一種高侵襲性的惡性腫瘤,發病率約占淋巴瘤的50%~60%,近半數患者經一線治療后無法治愈,60%的難治復發性彌漫性大B細胞淋巴瘤患者治療選擇有限。
塞利尼索是全球首款選擇性核輸出XPO1抑制劑,獲美國食品藥品監督管理局(FDA)批準用于多發性骨髓瘤和彌漫性大B細胞淋巴瘤,目前共有5種治療血液瘤的方案被納入美國國家綜合癌癥網絡(NCCN®)指南。作為一款低給藥頻率的口服藥,塞利尼索服用便利、治療依從性高。在《海南博鰲樂城國際醫療旅游先行區臨床急需進口藥品管理暫行規定》的指導下,塞利尼索成功應用于中國內地患者,成為了首款中國內地與全球患者同步使用并獲準帶離使用的XPO1抑制劑。德琪醫藥作為項目引進的牽頭單位,通過與博鰲超級醫院和海南成美藥業的合作,為國內急需用藥的患者提供了一條便利、可信賴的治療途徑。
海南省腫瘤醫院血液病臨床研究中心姚紅霞主任表示:“這是塞利尼索在博鰲超級醫院開展的首次臨床治療,見證了海南博鰲樂城國際醫療旅游先行區的政策優勢,最重要的是患者能夠獲益。經歷多線治療的難治復發多發性骨髓瘤患者,面對中國內地無藥可用的現狀,不用出國門就能用上國外上市的新藥,還可以申請帶藥離園。這得益于海南的特殊政策支持,為我們的患者,帶來了希望。”
]]>試驗結果顯示,ATG-010聯合ATG-008在體內體外均體現出抗腫瘤和協同作用,在三重打擊彌漫性大B細胞淋巴瘤細胞株中也具有強大的協同性。同時,在DLBCL異種腫瘤移植模型中,ATG-010和ATG-008的聯合治療同樣增強了對腫瘤生長的抑制效果,顯示出協同的抗腫瘤作用。
ATG-010是一款單藥口服XPO1抑制劑,也是同類首款且唯一一款選擇性核輸出抑制劑(SINE),已被美國食品藥品監督管理局(FDA)批準治療二線以上的彌漫性大B細胞淋巴瘤患者。ATG-008是一款mTORC1/2雙靶點抑制劑,根據臨床前及臨床試驗數據,ATG-008對彌漫性大B細胞淋巴瘤有抑制作用。德琪醫藥正在開展一項ATG-010聯合ATG-008治療難治復發性彌漫性大B細胞淋巴瘤的臨床試驗(MATCH)。
臨床前數據顯示:
- ATG-008、ATG-010在體外均對彌漫性大B細胞淋巴瘤細胞株的生長有抑制作用。
- ATG-008聯合ATG-010增強了對三重打擊彌漫性大B細胞淋巴瘤生長的抑制作用。
- ATG-008聯合ATG-010在體外對三重打擊彌漫性大B細胞淋巴瘤具有協同的抑制作用。
- ATG-008聯合ATG-010在體內對三重打擊彌漫性大B細胞淋巴瘤細胞株的異種移植腫瘤模型具有協同的抑制作用。
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“ATG-010已經獲批治療難治復發性彌漫性大B細胞瘤,而ATG-008對該瘤種也顯示出了臨床活性。通過對體外及體內DLBCL模型的評估,我們發現一定濃度下的ATG-010與ATG-008聯合,在三重打擊DLBCL中達到了1+1>2的腫瘤抑制效果。ATG-008與ATG-010強大的協同作用,對DLBCL患者的治療顯示出一定的應用前景,包括對有巨大臨床需求的三重打擊疾病。我們將通過MATCH試驗繼續發掘該聯合方案的臨床潛力。”
]]>Kevin在制藥行業從事研發工作近30年。在諾華和新基任職期間,他負責多個地區、國家及全球的臨床事務,建立了臨床研發和醫學事務團隊。Kevin曾任新基亞太地區副總裁兼臨床研發和醫學事務負責人,在此之前,他曾任新基歐洲地區臨床研發項目副總裁。
Kevin曾負責管理多個創新藥物的整個臨床研發流程,包括晚期臨床研發及上市后研發等階段。此外,他密切參與了多種突破性癌癥療法的臨床研發,包括格列衛®,達希納®,擇泰®,弗隆®,瑞復美®,Pomalyst®和維達扎®。
Kevin Lynch先生表示:“德琪醫藥過去取得的成績有目共睹,我對梅建明博士和德琪團隊的使命感和專業性感觸頗深。很高興能夠再次與梅博士和他身后這支精英團隊合作,專注于開發臨床上亟需、注冊法規支持的創新藥物,解決未滿足的醫療需求。除了在中國、澳大利亞及其他亞太市場的臨床研究,我們將在全球更廣泛地進行臨床探索,同時,我們將與其他制藥和生物技術公司建立伙伴關系,通過合作取得更大的發展。”
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“非常高興能夠見證德琪管理團隊的日漸壯大。Kevin具備出色的專業能力和豐富的行業經驗,他的加入對于德琪醫學團隊意義重大,期待他為德琪的醫學研究及企業發展作出重要貢獻。”
Kevin曾在許多核心期刊上發表過廣泛著作并曾參加大量學術會議,包括《內科學年鑒》、《自然癌癥綜述》、《英國癌癥雜志》、《臨床腫瘤學雜志》、《血液》等,并與他人合作完成了上百篇的期刊論文和論文摘要。
]]>單博士擁有近20年的全球醫藥行業經驗,在他整個職業生涯中,他曾帶領跨職能團隊完成多個IND和NDA項目的申報。單博士目前是德琪醫藥集團副總裁,負責早期研發及CMC。任職期間,他幫助德琪建立了一支高質量的早期研發、CMC和生產團隊,并啟動了臨床前項目(現有6款資產),為公司做出了諸多杰出貢獻。
單波博士表示:“德琪醫藥近年來取得了令人矚目的進展,德琪也將持續擴充研發管線和產品組合。目前,我們已建立起擁有12款臨床及臨床前創新藥物的豐富資產,公司核心產品ATG-010(selinexor)的新藥上市申請(NDA)也獲得了國家藥品監督管理局(NMPA)的優先審評。十分高興能與團隊并肩作戰,繼續見證它的繁榮壯大。”
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“通過自主研發和授權引進的雙輪驅動,德琪醫藥已擁有豐富的產品管線,相信在單博士的領導下,德琪的研發團隊和研發能力會越來越強大。”
單博士在英國阿斯頓大學獲得藥物化學博士學位。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家專注于創新抗腫瘤藥物的亞太地區臨床階段生物制藥公司,旨在為中國、亞太地區及全球各地的患者提供最前沿的抗腫瘤創新療法。自成立以來,德琪醫藥已建立起擁有12款臨床及臨床前創新藥物的豐富產品管線,并在亞太地區取得12個臨床試驗批件。德琪醫藥以“醫者無疆,創新永續”為愿景,力爭通過對同類首款/同類最優療法的專研與市場化,解決亞太乃至全球患者未滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。
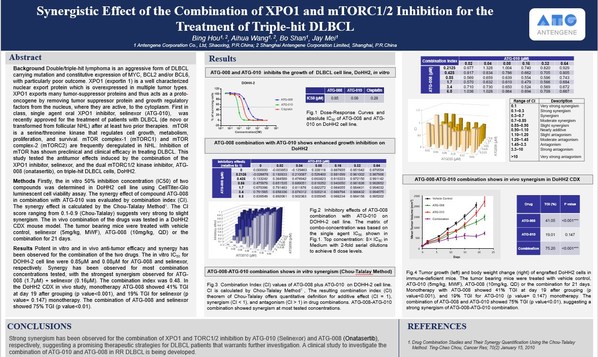
題目: 聯合XPO1和mTORC1/2抑制治療三重打擊彌漫性大B細胞淋巴瘤中的協同效果
摘要海報編號: 1380
摘要鏈接:https://www.abstractsonline.com/pp8/#!/9325/presentation/2406
AACR年會是世界上規模最大最重要的癌癥研究會議之一,也是全球腫瘤研究的焦點,匯集了腫瘤領域最前沿的研究成果。“聯合XPO1和mTORC1/2抑制治療三重打擊彌漫性大B細胞淋巴瘤的協同效果”的摘要內容已在AACR官網公布,這是德琪醫藥ATG-010(XPO1抑制劑)和ATG-008(mTORC1/2抑制劑)臨床前研究的首次公開亮相。
ATG-010又稱selinexor,是全球首款選擇性核輸出蛋白XPO1抑制劑。ATG-010通過靶向核輸出蛋白XPO1,引起腫瘤抑制蛋白和其他生長調節蛋白的核內儲留和活化,同時下調細胞漿內多種致癌蛋白水平,從而誘導腫瘤細胞凋亡,正常細胞不受影響。
ATG-008又稱onatasertib,是新一代mTORC1/2雙靶點抑制劑。mTORC1和mTORC2是PI3K-AKT信號通路的關鍵調控因子,該通路經常在多種癌癥中發生突變,從而導致mTOR信號過度激活。ATG-008可同時阻斷mTORC1及mTORC2,抑制腫瘤細胞增殖并促使腫瘤細胞凋亡。
ATG-010(selinexor)在美國和以色列已獲批治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤,并有5種血液瘤的治療方案被納入美國國家綜合癌癥網絡(NCCN ®)指南。多項臨床研究顯示,ATG-010的獨特作用機制使其可以與抗PD-L1抗體等多種抗腫瘤藥物聯用,在提高治療效果的同時降低治療的副作用。德琪醫藥進行的其他研究表明,同時抑制XPO1及mTOR信號可提升抗癌效果。
目前,德琪醫藥正在中國開展ATG-010治療多發性骨髓瘤、彌漫性大B細胞淋巴瘤、非小細胞肺癌(NSCLC)、子宮內膜癌、外周T細胞淋巴瘤和NK/T細胞淋巴瘤等多項臨床試驗。另外,德琪醫藥在中國、澳大利亞、新加坡及韓國等多個亞太市場提交了ATG-010的新藥上市申請。與此同時,德琪醫藥已在中國及部分亞太地區開展了ATG-008治療晚期肝細胞癌(HCC)、晚期NSCLC、特異性基因變異晚期實體瘤(包括NFE2L2、STK11、RICTOR變異)以及與抗PD-1抗體聯合治療晚期實體瘤及HCC等多項臨床試驗。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家專注于創新抗腫瘤藥物的亞太地區臨床階段生物制藥公司,旨在為中國、亞太地區及全球各地的患者提供最前沿的抗腫瘤創新療法。自成立以來,德琪醫藥已建立起擁有12款臨床及臨床前創新藥物的豐富產品管線,并在亞太地區取得12個臨床試驗批件。德琪醫藥以“醫者無疆,創新永續”為愿景,力爭通過對同類首款/同類最優療法的專研與市場化,解決亞太乃至全球患者未滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。
作為德琪韓國總經理,Minyoung將以公司愿景為引領,建立一流的專業團隊并與當地的健康組織積極合作,以推進創新產品的商業化進程,為韓國患者提供新的治療選擇。Minyoung將直接向德琪醫藥集團副總裁兼亞太地區負責人Thomas Karalis先生匯報。
Minyoung是一位備受行業認可的領導者,她在生物制藥領域深耕30余年,在產品上市、渠道拓展方面成績突出,另外,她曾與團隊一同制定了行之有效的“以患者為中心”的發展戰略。加入德琪前,Minyoung在Ipsen Korea擔任總經理,通過推動產品商業化及組織轉型,實現了公司業務的顯著增長。Minyoung曾在禮來韓國及亞洲工作了13年,在市場推廣、營銷及市場準入方面擔任重要職務,并參與了腫瘤等多個疾病領域的新產品上市。加入禮來之前,Minyoung曾在IMS Health(現為艾昆緯)和首爾大學醫院(Seoul National University Hospital)擔任藥劑師。
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:“Minyoung是一位具有豐富醫藥行業經驗的領導者,她在建立高效的組織與推動業務的增長方面成績亮眼。我們相信,她的豐富經驗將為德琪團隊注入新的活力,為公司創造新的成就。德琪韓國將在她的帶領下獲得快速地成長與發展,更好地造福韓國的腫瘤患者。”
德琪醫藥集團副總裁、亞太地區市場負責人Thomas Karalis先生表示:“德琪在亞太市場擴展迅速,公司在韓國的業務建立是一個重要里程碑。很高興Minyoung這樣的杰出領導者加入德琪,成為韓國市場的總經理。相信她在韓國及亞洲豐富的領導經驗,將成功地為韓國患者帶來創新療法并逐步建立起公司的聲譽。”
Minyoung Kim女士表示:“我非常欣賞德琪富有前景的產品管線和卓越的團隊。十分高興能與德琪團隊一同開發韓國業務,將創新藥物帶給韓國患者。”
Minyoung在首爾大學藥學專業獲得理學學士,并在赫爾辛基經濟學院(現為阿爾托大學)獲得工商管理碩士。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家專注于創新抗腫瘤藥物的亞太地區臨床階段生物制藥公司,旨在為中國、亞太地區及全球各地的患者提供最前沿的抗腫瘤創新療法。自成立以來,德琪醫藥已建立起擁有12款臨床及臨床前創新藥物的豐富產品管線,并在亞太地區取得12個臨床試驗批件。德琪醫藥以“醫者無疆,創新永續”為愿景,力爭通過對同類首款/同類最優療法的專研與市場化,解決亞太乃至全球患者未滿足的臨床需求。
前瞻性陳述
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。
在《海南自由貿易港建設總體方案》的有效推行下,德琪醫藥攜手成美藥業將在海南博鰲樂城國際醫療旅游先行區引進多發性骨髓瘤治療藥物selinexor,為中國患者搭建一條便捷高效的用藥渠道。隨著《海南博鰲樂城國際醫療旅游先行區臨床急需進口藥品帶離先行區使用管理暫行辦法》的發布和落實,Selinexor將成為首個中國與全球多發性骨髓瘤患者同步使用的選擇性核輸出抑制劑。
多發性骨髓瘤是第二大血液惡性腫瘤,現有的治療選擇有限且難以治愈。在中國,接受過多種藥物治療仍復發的多發性骨髓瘤患者,面臨無藥可用的臨床困境。Selinexor(ATG-010)是全球首款經過臨床驗證的選擇性核輸出抑制劑,在一年內相繼獲批用于血液腫瘤的兩大適應癥 -- 多發性骨髓瘤和彌漫大B 細胞淋巴瘤(DLBCL)。作為全球首款且唯一一款治療這兩大血液瘤適應癥的選擇性核輸出抑制劑,Selinexor 的五種治療方案被納入NCCN指南。去年12月,FDA再次批準selinexor用于前線的多發性骨髓瘤患者,進一步拓寬該產品的臨床應用前景。受益于海南自貿港政策,中國的多發性骨髓瘤患者得以同步使用這一全球領先的血液瘤創新療法。
樂城先行區管理局副局長符祝表示:
“樂城先行區非常歡迎德琪醫藥這樣的國際先進制藥企業將國內患者臨床急需的藥品引進海南,讓患者盡快享受到國際化的醫療服務,用上國際化的先進藥品。我們希望與德琪醫藥保持長期合作,將更多國外獲批的新藥,同步在海南博鰲樂城使用,為中國患者提供更多、更先進、更及時的國際一流藥械服務,造福中國患者。”
海南省藥品監督管理局副局長黎運達表示:
“樂城先行區作為全國唯一的‘醫療特區’,已經逐步建立具備特色優勢的診療專科,初步實現了醫療技術、藥品、裝備與國際先行水平的‘三同步’。我們非常希望社會責任感突出的海南第一投資集團、海南成美藥業與德琪醫藥這樣的優質企業在未來引進更多的全球新藥,為中國患者提供更及時、一流的醫療服務,造福更多的中國患者,也為深入推進海南自貿港建設,做出新的貢獻。”
哈爾濱血液病腫瘤研究所所長、中國臨床腫瘤學會(CSCO)監事會監事長馬軍表示:
“引進創新藥來挽救更多的患者,這與我們國家所倡導的‘生命至上’相契合,依托新政策,國內患者能通過引進創新藥挽救和延續生命,而不用等到它在國內批準上市。Selinexor是一種口服藥物,患者使用方便且依從性強。此次通過多方合力,能為中國患者帶來更快、更優、更及時的治療新選擇,大大提高患者的藥物可及性。基于博鰲樂城先行區的特殊醫療政策,相信會大大惠及廣大的腫瘤患者。‘醫藥不分家’,產品的引進也為臨床醫生帶來了更多的武器,在治療方案的選擇上逐步與國際接軌。”
海南醫學會血液專業委員會主委、海南血液醫師學會首任會長姚紅霞表示:
“作為在醫療旅行先行區的一名醫務工作者,我很榮幸能夠參與并見證更多新藥引入國內,得益于國務院、海南省政府的支持,博鰲樂城特殊的醫療政策讓我有機會更早地接觸這些新藥。而我也愿意貢獻自己的一份力量,讓中國血液病患者更早、更及時地獲得有效的治療。Selinexor是一種全新的作用機制,已在美國獲批MM、DLBCL適應癥并顯示出了不錯的療效,相信此次selinexor的引進對患者來說是一個福音,我也非常期待看到它在中國人群中發揮效用。”
成美醫療集團董事長、海南省腫瘤醫院執行理事長、博鰲超級醫院有限公司總經理林士泉表示:
“《海南自由貿易港建設總體方案》的正式發布,讓全球創新療法在海南先行先試的政策得到進一步突破。Selinexor是目前首款獲FDA批準可用于治療多發性骨髓瘤與彌漫性大B細胞淋巴瘤的藥物,這款新藥的引進是對先行區特許政策的又一次成功實踐。成美藥業將與德琪醫藥等國內外一流醫藥企業共同努力,持續引進更多的國際創新藥品、醫療器械,為廣大患者帶來治病、救命的福音。”
德琪醫藥創始人、董事長和首席執行官梅建明表示:
“Selinexor作為臨床急需藥物引入海南自貿港,意味著中國患者將與全球患者同步分享這一前沿療法。作為一款全球首創的選擇性核輸出抑制劑,Selinexor將在更多元更廣泛的群體中發揮臨床效用。德琪將秉承‘醫者無疆,創新永續’的使命,增強自主研發與臨床研究能力,瞄準中國和亞太高發疾病進一步發掘產品潛力。此外,德琪還將與政府、醫院及社會各界保持密切合作,共同打造多元化、開放式的醫藥創新生態圈,將全球前沿的創新療法早日應用于中國患者。”
發布會現場,“多發性骨髓瘤(MM)治療藥物selinexor引進博鰲簽約儀式”同步舉行。德琪醫藥董事長梅建明博士和海南成美藥業總經理姚莉君女士簽署了戰略合作協議。
未來,德琪將依托自貿港政策以及先行區醫療資源和技術手段,為有迫切需求的多發性骨髓瘤患者提供便捷的治療渠道與可負擔的治療方式。通過規范化的項目管理、系統性的患者教育以及多渠道聯動的培訓方式,確保患者安全用藥,安心用藥。
關于Selinexor(ATG-010,XPOVIO®)
Selinexor(ATG-010,XPOVIO®)是全球首款且唯一一款口服型SINE化合物,由Karyopharm Therapeutics Inc.(納斯達克股票代碼: KPTI)開發。德琪醫藥與Karyopharm達成獨家合作和授權,獲得了selinexor在多個亞太市場包括大中華區、韓國、澳大利亞、新西蘭和東盟國家的獨家開發和商業化權益。
2019年7月,美國食品藥品監督管理局(FDA)批準selinexor聯合低劑量地塞米松用于治療復發難治性多發性骨髓瘤(rrMM)患者。2020年6月,美國FDA再次批準selinexor作為單藥口服療法用于治療復發難治性彌漫性大B細胞淋巴瘤(rrDLBCL)患者。此外,selinexor的一項上市許可申請(MAA)已經遞交歐洲藥品管理局(EMA),要求有條件地批準selinexor用于rrMM。2020年12月,美國FDA批準了selinexor擴展適應癥的補充新藥申請(sNDA),用于治療既往接受過至少一線治療的多發性骨髓瘤患者。Selinexor是目前首款且唯一一款被美國FDA批準的口服SINE化合物,可用于治療多發性骨髓瘤和彌漫性大B細胞淋巴瘤。此外,selinexor針對多個實體腫瘤適應癥開展了多項中期和后期臨床試驗,包括脂肪肉瘤和子宮內膜癌。2020年11月,德琪醫藥合作伙伴Karyopharm在2020年結締組織腫瘤學年會(CTOS 2020)上報告了3期SEAL試驗的積極數據。SEAL是一項隨機、雙盲、安慰劑對照交叉試驗,旨在比較口服單藥selinexor與安慰劑在脂肪肉瘤患者中的療效。另外,Karyopharm近期公布了selinexor用于治療子宮內膜癌患者的3期SIENDO試驗已完成計劃的中期無效性分析,數據安全監查委員會(DSMB)推薦SIENDO試驗無需作任何修改按計劃繼續進行。SIENDO試驗的首要數據結果預計在2021年下半年公布。
德琪醫藥正在中國進行selinexor針對復發難治性多發性骨髓瘤的2期注冊性臨床試驗(代號MARCH)以及針對復發難治性彌漫性大B細胞淋巴瘤2期注冊性臨床試驗(代號SEARCH)。同時,德琪醫藥針對亞太高發瘤種啟動了selinexor用于治療外周T細胞淋巴瘤、NK/T細胞淋巴瘤(代號TOUCH)及KRAS突變的非小細胞肺癌的臨床試驗(代號TRUMP)。
關于德琪醫藥
德琪醫藥有限公司(簡稱“德琪醫藥”,香港聯交所股票代碼:6996.HK)是一家專注于創新抗腫瘤藥物的亞太地區臨床階段生物制藥公司,旨在為中國、亞太地區及全球各地的患者提供最前沿的抗腫瘤創新療法。自成立以來,德琪醫藥已建立起擁有12款臨床及臨床前創新藥物的豐富產品管線,并在亞太地區取得11個臨床試驗批件。德琪人以“醫者無疆,創新永續”為愿景,力爭通過對同類首款/同類最優療法的專研與市場化,解決亞太乃至全球患者未滿足的臨床需求。
前瞻性聲明
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內有關任何董事或本公司意向的陳述或提述乃于本文章刊發日期作出。任何該等意向均可能因未來發展而出現變動。
作為一家領先的亞太地區臨床階段生物制藥公司,德琪醫藥以延長患者壽命,提高患者生活質量為目標,集新藥開發、臨床研究于一體,致力于為中國、亞太乃至全球的患者提供前沿的抗腫瘤創新療法。上海張江高科技園區是是浦東改革開放歷史上一道亮麗的風景線,研發資源高度集聚、創新成果快速涌現,憑借不斷鞏固的人才優勢和平臺優勢,正成為我國生物醫藥產業發展的高地。
德琪新藥研發中心落戶上海張江,將依托中國“藥谷”的技術及人才優勢建立靶點篩選和先導藥物開發平臺,基于園區完整的上下游產業鏈,重點開發具有同類第一或同類最優潛質的抗腫瘤創新藥物。目前,研發中心配備了小分子制劑研發實驗室,常規大分子研發實驗室和細胞培養室等功能間,并引進了光譜流式細胞儀、自動化蛋白純化系統、高分辨率熒光顯微鏡等先進的儀器設備。
“德琪新藥研發中心落戶張江,將依托張江醫藥產業的優勢,繼續重點研發具有同類第一或同類最優潛質的腫瘤創新藥物,繼續加強管線的互補性及發揮聯合用藥的潛力。”德琪醫藥創始人、董事長兼首席執行官梅建明博士表示,“研發沒有國界,創新沒有止境。在張江這片熱土,我們通過自主研發,通過與高端人才、優秀企業的零距離接觸,將共同探索建立高效率、強創新的研發與合作體系。相信德琪專業且經驗豐富的科學家團隊,一定能發現更新、更早、更多的創新療法。通過我們的攜手努力,早日造福患者。”
]]>近年來,中國惡性腫瘤發病、死亡數持續走高。預后差、成本高仍是國內癌癥治療亟待克服的難題。德琪醫藥以“醫者無疆,創新永續”為使命,致力為中國、亞太乃至全球各地的患者提供先進的治療理念及前沿的抗腫瘤療法。憑借差異化的臨床開發戰略及突出的臨床研發能力,公司已建立一條高選擇性與高協同性兼具的研發管線,擁有12款實力強勁且高度創新的臨床及臨床前產品,形成了以腫瘤治療為重點,覆蓋病毒感染、自身免療等疾病領域的產品布局。藥明生物作為全球領先的開放式、一體化生物制藥能力和技術賦能平臺,基于其成熟的研發體系和技術平臺為生物制藥公司提供全方位的端到端研發服務,加速推動藥物研發從概念到商業化生產的全過程。此次合作,德琪醫藥與藥明生物將充分運用各自的優勢資源及專業能力,加速腫瘤領域同類第一與同類最優創新療法的研發進程,早日為患者提供優質的、可負擔的治療方案。
德琪醫藥創始人,董事長兼首席執行官梅建明博士表示:“我們很高興同藥明生物啟動戰略合作,此次合作正當其時。藥明生物擁有一流的生物制藥能力,能為德琪提供強大的技術賦能。目前,德琪對腫瘤新藥的研發進行了全方位的布局,正以科學為導向,持續推進小分子、單克隆和雙特異性抗體等腫瘤藥物的研發。期待雙方通過優勢互補,更扎實地提升新藥研發的質量,最終惠及更廣泛的腫瘤患者。”
藥明生物首席執行官陳智勝博士表示:“我們很高興與德琪醫藥建立戰略合作伙伴關系。通過多元化、一體化的生物制藥能力和技術平臺,藥明生物將持續賦能德琪醫藥,加速其腫瘤新藥的研發進程。期待雙方攜手共進,基于各自的能力和優勢,實現創新療法研發領域的合作共贏,為造福中國乃至全球病患貢獻積極力量。”
]]>本輪融資由Fidelity Management & Research Company LLC領投,其他新引進投資者包括高瓴創投、新加坡政府投資公司(GIC)及一家大型知名長線機構投資者,現有投資者中啟明創投、博裕資本繼續參投。
“非常感謝各家知名投資機構的認可與信任。本輪融資得到了全球最大資產管理公司之一的投資人,以及醫療行業知名的頂尖投資者的支持,也得到了現有投資者的支持。本次融資是德琪醫藥重要的一個里程碑,在此助力下,面對嚴重危及生命的疾病,德琪醫藥將進一步為亞太地區乃至全球的患者帶來更多前沿的創新療法。”德琪醫藥創始人、董事長兼首席執行官梅建明博士說。
本次融資的資金將主要用于鞏固和加強公司扎實的研發管線,推動血液腫瘤和實體腫瘤產品的持續臨床開發,繼續提升早期藥物自主研發的能力,并進一步增強公司在亞太市場的商業化運營實力。目前,德琪醫藥已建立了一條豐富的研發管線,涵蓋6個臨床階段的產品和6個臨床前階段的項目,并取得了多項重大進展:
- ATG-010(selinexor)是全球首個口服選擇性核輸出蛋白抑制劑(SINE)。美國FDA于2019年7月批準selinexor與低劑量地塞米松聯合治療難治復發性多發性骨髓瘤適應癥(RRMM),并于2020年6月批準selinexor單藥治療難治復發性彌漫性大B細胞淋巴瘤(R/R DLBCL)。目前,ATG-010正在中國進行難治復發性多發性骨髓瘤和難治復發性彌漫性大B細胞淋巴瘤的注冊臨床研究。該藥物用于其他多種實體腫瘤(包括KRAS突變的實體腫瘤)和血液腫瘤的治療方案也已推進到臨床后期。臨床前研究表明核輸出蛋白(XPO1)抑制劑能有效治療攜帶KRAS突變的多種腫瘤。
- ATG-008(onatasertib)是第二代mTORC1/2抑制劑,目前正在開展多項以單藥或聯用抗PD-1抗體形式治療晚期肝癌(HCC)、非小細胞肺癌(NSCLC)、婦科腫瘤和其他多種腫瘤的多中心臨床研究。
- ATG-016(eltanexor)是第二代口服選擇性核輸出蛋白XPO1抑制劑,目前正進行針對骨髓增生異常綜合癥(MDS)的臨床研究。ATG-016針對結直腸癌(CRC)、前列腺癌(PrC)等多種實體腫瘤的臨床研究也在同步開展。
- ATG-019是全球首個PAK4/NAMPT雙靶點抑制劑,正在開展包括非霍奇金淋巴瘤(NHL)、結直腸癌、非小細胞肺癌、黑色素瘤等腫瘤領域的多項臨床研究。此外,臨床前研究表明,ATG-019聯合抗PD-1抗體的療法可有效提高抗腫瘤療效并對抗PD-1抗體耐藥的患者有效。
- ATG-527(verdinexor)是一個在研的抗病毒及治療自身免疫疾病的創新產品,目前正在進行針對人類皰疹病毒第四型(EBV)感染、呼吸道合胞病毒(RSV)感染、巨細胞病毒(CMV)感染、系統性紅斑狼瘡(SLE)等病毒感染的臨床研究。ATG-527已完成I期健康受試者臨床試驗。
- ATG-017是一款作用于ERK1/2的高特異性小分子抑制劑,目前正在開展針對多種實體瘤、非霍奇金淋巴瘤、急性髓系白血病(AML)和多發性骨髓瘤的臨床研究。
此外,德琪醫藥早期藥物研發團隊正在持續推進小分子、單克隆和雙特異性抗體等抗腫瘤藥物的臨床前研究與開發。
關于德琪
德琪醫藥是一家植根中國、面向亞太、布局全球,集新藥開發、臨床研究、藥物生產和市場銷售于一體的綜合性生物醫藥公司,專注于為中國和亞太其他國家和地區,以及全球各地的患者提供前沿的全新作用機制的抗腫瘤創新療法。2017年4月,全球新藥領導企業新基(Celgene,現已被百時美施貴寶正式收購,合并后成為世界前十大制藥公司)成為德琪醫藥的創始合作伙伴并投資德琪。成立三年來,德琪醫藥已建立起一條擁有12款臨床及臨床前創新藥物的豐富產品管線,取得7個臨床批件,并在亞太各地開展10項跨區域臨床試驗。德琪人以“醫者無疆,創新永續”為愿景,力爭通過對全球首創和同類最優的專研與市場化,解決亞太乃至全球患者未滿足的臨床需求。欲知更多詳情,請訪問www.antengene.com。
About Fidelity
Fidelity’s mission is to inspire better futures and deliver better outcomes for the customers and businesses we serve. With assets under administration of $8.1 trillion, including discretionary assets of $3.3 trillion as of May 31, 2020, we focus on meeting the unique needs of a diverse set of customers: helping more than 32 million people invest their own life savings, 22,000 businesses manage employee benefit programs, as well as providing more than 13,500 institutions with investment and technology solutions to invest their own clients’ money. Privately held for more than 70 years, Fidelity employs more than 40,000 associates who are focused on the long-term success of our customers. For more information about Fidelity Investments, visit https://www.fidelity.com/about-fidelity/our-company.
關于高瓴創投
高瓴創投是高瓴資本旗下專注于創新型公司的風險投資基金,主要專注于生物醫藥及醫療器械、軟件服務和原發科技創新、消費互聯網及科技、新興消費品牌及服務四大領域的風險投資。生物醫藥和醫療器械領域一直是高瓴的重點投資方向,已有近15年的深入研究,投資了160多家優秀醫藥、器械企業,包括百濟神州、信達生物、君實生物、天境生物、方達醫藥、納微科技、麥科田醫療、品馳醫療、普蕊斯醫藥、沛嘉醫療、微創心通、啟明醫療等。我們希望與投資企業一起,做時間的朋友,共同推動大健康領域企業的創新和發展,惠及更多患者。
關于新加坡政府投資公司(GIC)
新加坡政府投資公司(GIC) 是全球頂尖的投資公司。成立于1981年,GIC旨在管理新加坡的外匯儲備,使國家和人民長久受益。身為長期價值投資者,GIC以其獨特的優勢廣泛投資于各大資產類別,包括房地產、私募股權、股票及固定收益。在私募股權領域,GIC與其基金管理人及企業管理團隊合作,通過基金或直接投資國際一流企業,助力企業發展。GIC在全球40多個國家均有投資,在新興市場投資更擁有超過20年的經驗。分布在全球十個主要金融中心城市的辦事處及位于新加坡的總部,公司員工超過1,500人。欲了解更多,請瀏覽www.gic.com.sg。
關于啟明創投(Qiming Venture Partners)
啟明創投成立于2006年,先后在上海、北京、蘇州、深圳、香港,西雅圖、波士頓和舊金山灣區設立辦公室。目前,啟明創投旗下管理九只美元基金,五只人民幣基金,管理資產總額超過53億美元。自成立至今,專注于投資TMT、醫療健康(Healthcare)等行業早期和成長期的優秀企業。截至目前,啟明創投已投資超過350家高速成長的創新企業,其中有超過110家分別在美國紐交所、納斯達克,香港聯交所,臺灣柜買中心,上交所及深交所等交易所上市,及合并等退出,有30多家企業成為行業公認的獨角獸和超級獨角獸企業。啟明創投投資企業中,很多已經成長為各自領域中最具影響力的公司,包括小米集團(01810.HK)、美團點評(03690.HK)、嗶哩嗶哩(NASDAQ:BILI)、石頭科技(688169.SH)、甘李藥業(603087.SH)、泰格醫藥(300347.SZ)、再鼎醫藥(NASDAQ:ZLAB)、啟明醫療(02500.HK)、康希諾生物(06185.HK)、Schrödinger(NASDAQ:SDGR)、三友醫療(688085.SH)、艾德生物(300685.SZ)、貝瑞基因(000710.SZ)、神州細胞(688520.SH)、微醫集團、優必選等。
關于博裕資本
博裕資本是中國最大的私募股權投資公司之一。博裕在北京、上海和香港設有辦事處,為媒體/技術、醫療、消費/零售和金融服務行業中管理最好、最具創新精神的公司提供長期資本和運營建議。
前瞻性聲明
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內所有陳述乃本文章刊發日期作出,可能因未來發展而出現變動。
]]>作為亞太地區醫學事務及早期臨床發展負責人,Dirk負責建立公司醫學事務的職能、結構和工作流程,并為公司多個處于早期階段的項目和小分子化合物制定臨床發展策略。
Dirk在臨床研究、轉化醫學研究以及學術與制藥產業深耕20余年,期間領導了多個臨床項目,其中包括首次在血液瘤和實體瘤患者中應用新型抗體形式。此外,他在澳大利亞地區啟動的首次CAR-T研究(針對LewisY抗原)中發揮了關鍵作用。Dirk多次在生物制藥產業擔任高管,在新基任職期間,Dirk負責領導亞太地區早期臨床發展項目,并成功推進來那度胺、泊馬度胺與阿扎胞苷在該地區上市。
“ATG-010治療復發難治性彌漫性大B細胞淋巴瘤患者的療法成功在美國上市后,我們又迎來了Dirk加入德琪這一振奮人心的消息,他在全球性轉化醫學研究與臨床發展的深度耕耘,將為團隊的迅速發展再添火力。Dirk是位碩果頗豐的腫瘤研究者,面對醫學工作的重大責任,他表現出的對優秀團隊的領導力,讓我們印象深刻。我相信他將在德琪亞太版圖的拓展過程中發揮至關重要的作用,實現我們‘醫者無疆,創新永續’的使命,最終為亞太地區的癌癥患者帶來新希望。”德琪醫藥創始人、首席執行官梅建明博士表示。
Dirk Hoenemann博士表示:“很高興成為德琪的一員,德琪醫藥是一家專注于前沿創新藥物研發的生物制藥公司,作為公司醫學事務及早期臨床發展事務的負責人,我深感責任重大。希望能憑借自己的經驗與力量,推動公司強大的產品管線的臨床進展,滿足亞太乃至全球患者的治療需求。”
Dirk擁有柏林大學附屬夏里特醫院醫學博士學位,并于維爾茨堡大學獲得內科學博士學位。
]]>