- SNUBH、CurePSP和GemVax就建立國際PSP研究與治療中心簽署諒解備忘錄
- 致力成為罕見神經退行性疾病的全球研究和治療中心,應對老齡化時代的全球挑戰
韓國首爾2024年12月9日 /美通社/ -- 韓國首爾國立大學盆唐醫院(簡稱"SNUBH")、CurePSP, Inc.(簡稱"CurePSP")和GemVax & KAEL Co., Ltd.(簡稱"GemVax";KOSDAQ:082270)聯合宣布成立韓國首個國際進行性核上性麻痹(簡稱"PSP")研究與治療中心。

Representatives from Seoul National University Bundang Hospital, CurePSP and GemVax took a photo after signing an MOU for the establishment of the International PSP Research and Treatment Center. (From left) Dr. Junghan Song, President & CEO of SNUBH; Dr. Kristophe Diaz, Executive Director & CSO of CurePSP; and Mr. Sukjoon Lee, CEO of GemVax.
12月6日,這三家組織簽署了一份三方諒解備忘錄(簡稱"MOU"),旨在共同建立一個綜合性中心,推進對PSP和其他神經系統疾病以及與成癮相關的各種疾病的研究和治療。此舉旨在通過推動研究、教育、醫療護理、治療和商業化進程來應對老齡化社會中此類疾病帶來的全球性緊迫挑戰。
簽約儀式于上午11時在SNUBH主會議室舉行,出席簽約儀式的主要人士包括SNUBH院長兼首席執行官Junghan Song博士、Sanghoon Jheon教授、CurePSP執行董事兼首席科學官Kristophe Diaz博士和GemVax首席執行官Sukjoon Lee先生。
國際PSP研究與治療中心(簡稱該"中心")將整合三方的基礎設施和專業知識,以執行一系列綜合職能,包括教育、研究和治療,以及PSP和其他神經系統疾病療法的潛在商業化。此外,該中心還將關注共存或相關疾病,包括與成癮有關的行為和神經障礙,尤其是藥物濫用問題。
SNUBH將為該中心的穩定運營提供支持,并引領醫療、教育和研究領域的進步。CurePSP是一家總部位于美國的非營利性慈善組織,憑借其30年的全球經驗,將以顧問、聯絡人和主題專家的身份,協助該中心在各個方面的發展,并將為PSP護理、教育和研究計劃的最佳實踐提供指導,同時利用其廣泛的全球網絡為該中心的成功建立必要的國際聯系。GemVax將為該中心的建立提供資金并監督相關的必要流程,同時帶頭進行PSP療法的研發和商業化。
通過整合參與機構的基礎設施和專業知識,該中心有望在國際競爭中占據一席之地。該中心旨在為公眾利益,特別是為社會邊緣化群體做出重大貢獻,同時提升韓國在神經退行性疾病和神經系統治療領域的全球領導地位。
SNUBH院長兼首席執行官Junghan Song博士表示:"國際PSP研究與治療中心的成立有望成為一個重要轉折點,為罕見病和頑疾患者提供切實的支持。SNUBH將與CurePSP和GemVax合作,竭盡全力在研究和療法開發方面發揮主導作用,以攻克神經退行性疾病。"
SNUBH的Sanghoon Jheon教授指出:"SNUBH致力于提高教育、研究和醫療護理領域的全球標準,確保人類能夠享受更健康、更幸福的生活。國際PSP研究與治療中心將全力以赴,立志成為培養優秀專業人才和推動研究進步以攻克罕見病和頑疾的國際中心。"
CurePSP執行董事Kristophe Diaz博士說:"此次訪問期間,我見到了韓國的PSP患者、他們的家人以及為他們提供護理的醫護人員,以評估當前的患者支持和治療情況。我還與國會議員和政府官員討論了克服罕見病和頑疾以及開發有效治療方法的國際體系和支持措施。"他補充道:"我們非常感謝韓國企業和政府為攻克PSP提供的大力支持,CurePSP將積極合作,通過我們的全球網絡和專業知識,加強韓國新成立的國際PSP研究與治療中心的能力。"
CurePSP是一家領先的非營利組織,致力于提高人們對三種神經退行性疾病的認識、護理和治療:PSP、皮質基底節變性(CBD)和多系統萎縮(MSA)。致力于推動新療法和治愈方法的CurePSP在國際范圍內建立了重要的合作伙伴關系,并為關鍵研究提供資金。通過宣傳和支持工作,CurePSP加強了對PSP、CBD和MSA患者及其家人的教育、護理和生活質量。科學、社區和希望代表著CurePSP的使命及其所有服務的核心。CurePSP是一家在美國注冊的501(c)(3)慈善機構(雇主識別號(EIN):52-1704978)。
GemVax首席執行官Sukjoon Lee樂觀地表示:"國際PSP研究與治療中心將使韓國在罕見病醫療護理、專業培訓和新藥開發方面的能力達到全球標準。"他補充說:"我們希望該中心能夠成為一個為國內外罕見神經退行性疾病患者快速帶來安全有效的治療,同時提供世界級醫護服務的中心"。Lee進一步強調:"我們公司還將重點關注即將開展的PSP臨床試驗和ALS研究,以確保新療法能夠盡快上市。"
PSP是一種難治性帕金森綜合征,即一種神經退行性疾病,癥狀與帕金森病相似,但病情進展迅速,且無法根治。主要癥狀包括步態障礙、姿勢不穩、認知能力下降、眼球運動障礙和睡眠障礙,病因至今不明。
今年10月,GemVax在加拿大舉行的Neuro2024會議上公布了針對PSP的GV1001 2期臨床試驗的頂線結果。該公司計劃適時啟動針對PSP的全球3期臨床試驗。
關于PSP 2a期臨床試驗(NCT05819658)
PSP 2a期臨床試驗是一項為期24周的多中心、隨機、雙盲、安慰劑對照、前瞻性2a期探索性臨床試驗,旨在評估與安慰劑相比,使用0.56毫克或1.12毫克劑量的GV1001治療PSP患者的安全性和有效性。此研究的主要終點是GV1001給藥24周后,PSP評定量表總分與基線相比的變化。次要終點包括3個月時PSP評定量表總分,以及3個月和6個月時MoCA-K(蒙特利爾認知評估量表韓國版)、K-FAB(額葉功能評定表韓國版)和ES-ADL(日常生活活動能力量表)與基線相比的變化。此外,該研究還評估了GV1001給藥的整體安全性。
關于GV1001
GV1001是一種基于端粒酶關鍵序列、由16個氨基酸組成的合成肽。GV1001已被研究用于治療包括阿爾茨海默病和PSP在內的神經退行性疾病的潛力。在神經退行性疾病中,GV1001已被證明可調節膠質細胞表型,并調控神經炎癥。除了正在進行的PSP 2a期臨床試驗外,GV1001阿爾茨海默病2期臨床試驗目前也在美國和歐洲進行(NCT05189210)。
關于PSP
進行性核上性麻痹是一種罕見的、進行性發展的成人起病型神經退行性疾病,尚無可改善病情的藥物。全世界大約每十萬人中就有七人患有該病,男性更為常見。患者主要是60歲以上的人群。PSP的癥狀包括失去平衡、性格改變、眼球運動無力(尤其是向下運動)、吞咽困難、口齒不清和認知障礙。
關于GemVax & KAEL
GemVax & KAEL Co., Ltd.是一家位于韓國的臨床階段生物制藥先鋒企業,致力于開發治療神經退行性疾病(包括PSP和阿爾茨海默病)的專有療法。關于PSP,GemVax目前正在韓國開展一項2a期研究,以評估GV1001對PSP患者的療效和安全性。全球PSP臨床試驗的準備工作也在進行中。此外,GemVax目前還在美國和歐洲開展阿爾茨海默病2期臨床試驗。欲了解更多信息,請訪問www.gemvax.com并在Linkedin上關注我們。
前瞻性陳述
文中信息包含或基于1995年《證券訴訟改革法案》定義的"前瞻性陳述"。前瞻性陳述可能包含也可能不包含"計劃"、"將要"、"預計"、"預期"、"打算"、"相信"、"潛在"、"繼續"等識別性詞語以及類似措辭。這些陳述會受到已知或未知風險和不確定因素的影響,可能導致實際結果與這些陳述中明示或暗示的結果存在重大差異,包括但不限于:藥物研發過程中固有的挑戰;我們為研發活動和其他公司目的獲得融資的能力;我們合作活動的成功;我們獲得監管部門批準的能力;我們獲得、維護和實施知識產權保護的能力;網絡攻擊或對我們技術系統的其他干擾;我們吸引、激勵和留住關鍵員工以及管理公司發展的能力;通貨膨脹和其他宏觀經濟問題;以及其他風險和不確定性。所有前瞻性陳述均基于管理層當前的估計、預測和假設。除非適用法律要求,否則GemVax不承擔因新信息、未來發展或其他原因而更正或更新任何此類陳述的義務。

——頂線數據支持進入3期試驗,且顯示GV1001有望成為全球首款PSP治療藥物
韓國首爾2024年10月30日 /美通社/ -- 當地時間10月24日下午4點45分,GemVax & KAEL Co., Ltd.(簡稱"GemVax";KOSDAQ股票代碼:082270)在加拿大多倫多舉辦的"Neuro2024:PSP和CBD國際研究研討會"上公布了其治療進行性核上性麻痹(PSP)的研究用多肽藥物GV1001的2a期臨床試驗(簡稱"2a期PSP臨床試驗")的頂線結果。
PSP是一種退行性疾病,與帕金森病一樣,也會導致步態障礙、早期跌倒、垂直性凝視麻痹、僵直、震顫和認知能力下降等癥狀,但其病程進展更快,目前尚無根治手段。PSP分為多種類型,包括PSP-理查森綜合征(PSP-RS)和PSP-帕金森綜合征(PSP-P)。相較于其他類型,PSP-RS型表現出更為顯著的tau蛋白聚集,且影響范圍更廣,涉及小腦、齒狀核、橋腦核、額葉及頂葉等區域。
2a期PSP臨床試驗是一項為期24周的隨機、雙盲、安慰劑對照前瞻性探索性臨床試驗,在韓國5個研究中心共招募了78名PSP患者。參與者按1:1:1的比例隨機分配,分別接受安慰劑、0.56毫克GV1001或1.12毫克GV1001治療。治療方案為前4周(1個月)每周一次皮下注射,隨后每2周注射一次,持續20周(5個月),總共為期24周(6個月)。該試驗面向PSP-RS和PSP-P兩種類型的患者開放。試驗結果顯示,低劑量組(0.56毫克)療效更為顯著,尤其對PSP-RS型患者效果更佳。
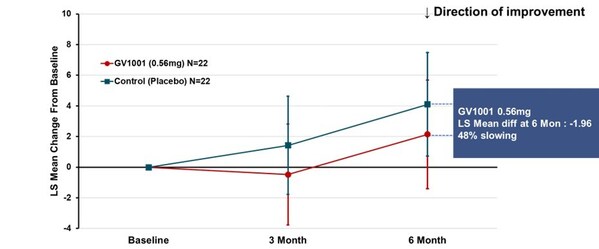
試驗的主要終點是使用GV1001治療24周后PSP評分量表總分(采用MMRM法計算的最小二乘均數)較基線的變化。結果顯示,0.56毫克劑量組病情惡化2.14分,而安慰劑組4.10分,說明疾病進程減緩了48%(見圖1)。盡管未達統計學顯著差異,但這些發現仍揭示了GV1001治療目前無法治愈的PSP的潛力,并為推進GV1001至更高級別臨床試驗提供了依據。
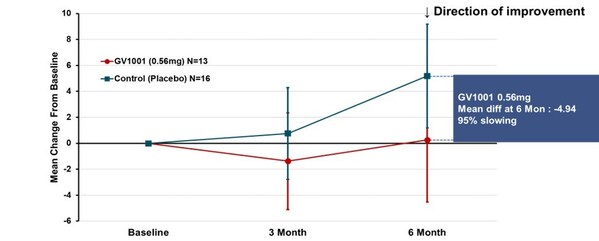
臨床上,多數PSP患者屬于典型的PSP-RS型,這一類型較其他PSP類型病程進展更快,平均生存期也更短。試驗專門針對PSP-RS型患者進行了分組分析。在服用GV1001二十四周后,采用簡單平均法計算PSP評分量表總分均值的變化,結果顯示,0.56毫克劑量組病情惡化平均分為0.25分,而安慰劑組為5.19分,兩組相差4.94分,說明疾病惡化程度降低了95%(見圖2)。
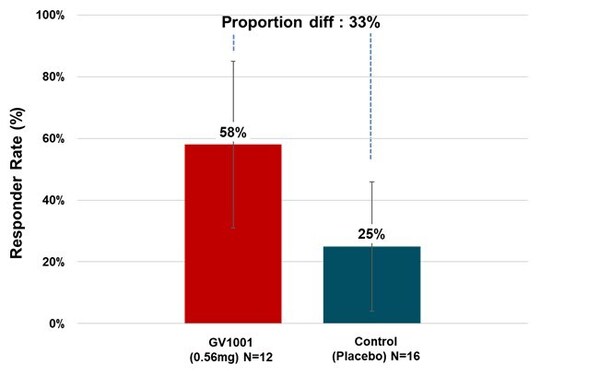
治療組中多數PSP-RS型患者在試驗期間癥狀保持穩定甚至有所改善。以治療6個月后PSP評分量表總分與基線相比有所改善或保持穩定的患者比例來計算緩解率,0.56毫克GV1001組有58.33%的PSP-RS型患者癥狀得到了改善或穩定(見圖3)。
在2a期PSP臨床試驗中,GV1001的安全性表現與之前的數據相符,整體耐受性良好,未觀察到與藥物相關的嚴重不良事件。
GemVax首席戰略官Hyungsik Moon指出:"本次2a期試驗屬于探索性研究,旨在確定最優劑量及多肽對不同分組的效果。盡管頂線結果未達到統計學顯著性,但所提供的證據已充分支持我們考慮推進至關鍵性試驗,同時表明GV1001有望成為全球首個PSP治療方案。"
出席Neuro2024會議的專家對PSP試驗結果表示歡迎,認為成果振奮人心,并對該藥即將邁入全球3期臨床試驗進行更深入的研發感到高興。
全球CRO ICON藥物開發高級副總裁、醫學博士Peter Schüler表示:"這項試驗性研究并非完全有效,且6個月的治療周期相對較短,因此無法預期獲得具有統計學意義的確證結果。不過,在運動表現和認知功能這兩個領域,我們觀察到的趨勢既合理又一致,均顯示出低劑量組的優勢。"
Schüler博士表示:"本次試驗確定了最佳劑量,這也是2a期研究的主要目標之一,并展現了與安慰劑組相比,病情完全穩定這一具有臨床意義的好處。這些頂線數據為推進至3期研究提供了有力的依據。"
慕尼黑大學附屬醫院(LMU Hospital)神經科主任、全球知名PSP專家Günter U. Höglinger博士評價道:"在全新作用機制的新藥研究中,我們獲得了極為振奮的2期臨床數據。盡管數據尚屬初步,但前景廣闊,且與[GV1001]在阿爾茨海默病中的臨床數據相契合。我對接下來的研發充滿期待,并很榮幸能參與并領導[PSP]的3期研究。"
CurePSP主任Kristophe Diaz博士表示:"GemVax最近的臨床試驗結果令人振奮,為整個PSP群體,包括目前尚無治療選擇的患者、家屬及治療他們的醫生,帶來了希望。我們祝賀GemVax成功完成試驗,并期待其能繼續為PSP社群帶來更多福祉。"他還強調:"CurePSP將一如既往地致力于合作,支持為這一毀滅性疾病患者帶來希望與成果的各項工作。"
下載PDF:https://mma.prnewswire.com/media/2542940/2024_10_29__GemVax_Announces_Topline_Results.pdf
關于2a期PSP臨床試驗(NCT05819658)
2a期PSP臨床試驗是一項為期24周的多中心、隨機、雙盲、安慰劑對照前瞻性探索性臨床研究,旨在評估0.56毫克或1.12毫克GV1001與安慰劑相比在治療PSP患者上的安全性和療效。主要終點為使用GV1001治療24周后,PSP評分量表總分相對于基線的變化。次要終點則包括3個月時PSP評分量表總分以及3個月和6個月時MoCA-K、K-FAB和ES-ADL評分相對于基線的變化。此外,研究還全面評估了GV1001的總體安全性。
關于GV1001
GV1001是一種合成肽,由16個氨基酸構成,以端粒酶的關鍵序列為基礎。它已被研究用于治療包括阿爾茨海默病和PSP在內的神經退行性疾病。研究顯示,GV1001能夠調節神經膠質細胞的表型并減輕神經炎癥。除了正在進行的2a期PSP臨床試驗外,針對阿爾茨海默病的2期臨床試驗也正在美國和歐洲同步推進(NCT05189210)。
關于PSP
進行性核上性麻痹是一種罕見的、成年后發病的進行性神經退行性疾病,目前尚無藥物能改變其病程。全球發病率約為每十萬人中有七例,且男性更為常見。患者多為60歲以上的老年人。PSP的癥狀包括平衡感喪失、性格變化、眼球活動無力(尤其是向下看時)、吞咽困難、言語不清以及認知功能受損。
關于GemVax & KAEL
GemVax & KAEL Co., Ltd.是韓國一家處于臨床階段的生物制藥先鋒企業,專注于研發治療神經退行性疾病(如進行性核上性麻痹和阿爾茨海默病)的專利療法。針對PSP,GemVax正在韓國進行2a期研究,以評估GV1001對PSP患者的療效與安全性,同時也在籌備全球性的PSP臨床試驗。此外,公司目前還在美國和歐洲同步開展阿爾茨海默病的2期臨床試驗。欲了解更多信息,請訪問www.gemvax.com并在Linkedin上關注我們。
前瞻性陳述
本文件所含信息包括或基于《1995年證券訴訟改革法案》界定的"前瞻性陳述"。這些陳述可能使用"計劃"、"將要"、"預計"、"預測"、"打算"、"相信"、"潛力"、"繼續"等明確標識詞,或其他類似表述,也可能不使用。此類陳述受已知和未知風險及不確定性的影響,可能導致實際結果與陳述中明示或暗示的結果有重大出入。這些風險和不確定性包括但不限于:藥物研發的固有挑戰(如臨床前和臨床項目的時間安排和結果,這些項目因高風險而可能在任何階段失敗,包括監管審批前后因療效不佳、安全性問題或其他因素導致的失敗);我們利用和加強藥物發現平臺的能力;我們為開發活動和其他企業目的籌集資金的能力;我們合作項目的成敗;我們獲得監管批準并最終實現藥物候選產品商業化的能力;我們獲取、維持和落實知識產權保護的能力;我們的技術系統遭受網絡攻擊或其他干擾的風險;我們吸引、激勵和留住關鍵人才以及管理增長的能力;通貨膨脹和其他宏觀經濟問題;以及其他風險和不確定性。所有前瞻性陳述均基于管理層當前的估計、預測和假設,除非法律另有要求,GemVax不承擔更正或更新這些陳述的義務,無論是因為新信息的出現、未來事態的發展還是其他原因。