蘇州2022年4月1日 /美通社/ -- 在后疫情時代下,醫療服務有望迎來邊際改善,隨著板塊已跌入歷史低位之時,這其中或將顯露值得關注的細分賽道及標的。
近段時間以來,國家“三孩政策”、北京“16項輔助生殖技術項目納入醫保報銷”等措施的出臺,無一不在支持著輔助生殖領域的大力發展。同時,在行業的加速增長和市場集中度提升的背景下,兩相疊加也將利好輔助生殖領域中的頭部企業。
3月30日,輔助生殖檢測領域頭部企業貝康醫療發布2021年業績財報,總營業收入為1.1億元,毛利為5115萬元,公司現金充沛,截至2021年末,公司賬面資金為15.39億元,總資產18億,凈資產17.15億。
除了現金流充沛,貝康醫療還展現了良好的造血能力,這主要得益于核心產品PGT系列的強勢增長趨勢。根據數據顯示,2018-2021年四年間PGT系列銷售額的復合增長率達到73%。在“三胎政策”的時代背景下,PGT系列產品有望持續保持增長勢頭。此外,公司造血能力逐年提升,同時擁有充沛的資金儲備,意味著貝康醫療在瞬息萬變的市場環境下將有足夠的實力和資本在行業中處于領先的優勢。
PGT系列收入增長41%
2021年貝康醫療商業化進展初見成效,公司核心業務實現大幅增長。
貝康醫療在PGT賽道中開創了中國三代試管檢測試劑盒領域及細分市場,是中國首家在輔助生殖基因檢測試劑盒領域獲得NMPA批準的創新醫療器械公司,填補了輔助生殖領域胚胎基因檢測試劑盒的臨床空白。
公司核心產品PGT系列試劑盒于2021年4月開始進行商業化銷售,不足一年的時間,取得了靚麗的銷售業績。據業績報告顯示,核心產品PGT系列試劑盒銷售收入4584萬元,同比增長41%,對銷售增長貢獻超過50%;PGT-A毛利達2373萬元,毛利率上升至70%,核心產品市場拓荒成效顯著。
2021年公司全面推動商業化進程,營銷費用投入達6,262萬,主要用于營銷團隊的擴充和市場的宣傳推廣。公司建立銷售大區,采取下沉的銷售網絡戰略,對每一個地級市都實現渠道覆蓋。公司搭建了強大的營銷團隊,極大提升了本地化的服務能力,相應的也增加了人工成本支出;同時收入增長導致了渠道費用的大幅增長,學術研討會和市場推廣活動的費用也同比增長了50%,商業化進程穩步推進,銷售渠道壁壘基本形成。在80家頭部輔助生殖中心,實現合作簽約55家,本年新增簽約18家,本地化實驗室48家,頭部客戶市場占有率高達70%;在全國設立了4處辦事處,以點帶面構建了區域聯盟,實現了下沉銷售網絡,全面覆蓋了500多家輔助生殖中心。
創新研發驅動加速升級
貝康醫療在核心產品銷售情況如此亮眼的情況下,依舊不斷加大研發投入,進一步擴張公司在輔助生殖領域的產品管線。
2021年,貝康醫療研發投入為7371萬元,同比增長114%。在過去一年取得顯著的研發成果,截至年末,公司擁有專利數達53項。
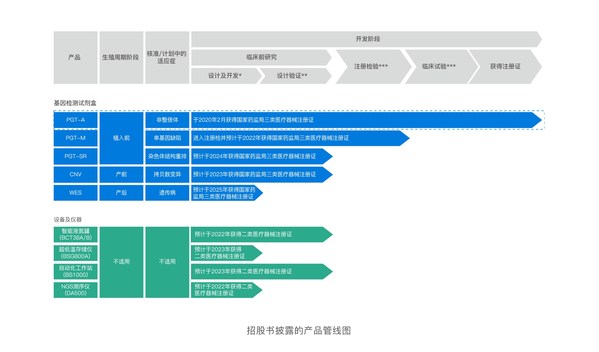
在輔助生殖檢測領域中,貝康醫療持續開發植入前基因檢測(PGT)產品,包括PGT-M和PGT-SR試劑盒,將會與PGT-A構成一個完整的檢測試劑盒系列,以進一步占據PGT領域。兩款試劑盒擁有靈敏度高、特異性高等多種優勢,且公司的臨床進展大幅領先于競爭對手,預計PGT-M及PGT-SR試劑盒將分別在2022年和2024年獲NMPA注冊批準,將進一步鞏固貝康醫療在中國三代試管嬰兒基因檢測試劑盒市場的主導地位。
在儀器管線方面,貝康醫療自主研發的DA500基因測序儀實現了樣本處理、高通量測序、數據分析三合一,預計2022年可以獲得醫療器械注冊證。BCT38智能液氮罐預計2022年可以獲得醫療器械注冊證,將成為臨床第一款有注冊證的智能化液氮罐產品。BSG800A超低溫存儲儀完成了產品定型,并在2021年實現了儀器系統的商業化銷售。
貝康醫療與重慶婦幼保健院建立了全國首個智能化胚胎存儲臨床樣板實驗室,包括超低溫存儲儀、智能液氮罐及胚胎管理系統。胚胎存儲臨床樣板實驗室能夠促進國內的全自動胚胎存儲和管理系統的推廣,以支持IVF實驗室中心提高臨床成功率和效率,提高活產率,降低移植失敗率,惠及醫生、胚胎學家及患者。
在男科領域中,公司自主研發的智能精子質量分析儀,第一次實現了不需通過化學試劑對精子進行染色,即可對活精子進行實時形態和活力的有效檢測,填補了臨床對于活精子的無損、快速和自動檢測的迫切需求。2021年,公司聯合16家國內頭部輔助生殖中心開展臨床前驗證,取得了非常好的臨床結果和報告,預計2022年完成國家注冊檢定。
除此之外,在蘇州園區政府的大力支持下,貝康醫療位于蘇州的生產基地與研發大樓也于去年正式動工,旨在打造上游試劑、耗材和儀器的先進制造的生產基地和先進技術的國際孵化中心,實現輔助生殖領域上游產品的國產化,建立全球領先的規模化產業制造基地,產業化能力進入新量級。
收購星博生物 多渠道產品管線布局
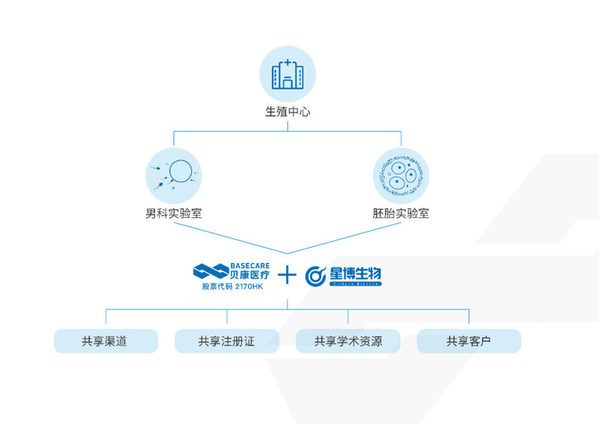
貝康醫療基于其強大的創新研發實力和高壁壘競爭優勢的商業化產品,正在通過收購、合作等方式逐步打造男科實驗室、胚胎實驗室、冷凍保存實驗室三大產品組合,構建全生殖周期產業鏈。同時通過銷售渠道和專家資源的共享互補,實現產業規模的外延和多渠道產品管線的布局。
貝康醫療于2021年11月收購了國內布局較早、規模較大的男科IVD診斷公司星博生物,旨在實現國內男科與胚胎IVD領域強強聯合。此次雙方的合作打通了從輔助生殖領域到男科領域的產品管線,通過銷售渠道和專家資源的共享互補,實現了貝康醫療產業規模的外延和多渠道產品管線的布局。
科技惠民、積極履行社會責任
值得一提的是,在公司獲得長足發展的同時,貝康醫療積極履行社會責任,聯合中國優生優育協會發起并開展了“圓 1000 個罕見病家庭健康生育夢”公益行動,貝康醫療為該項目免費捐贈檢測試劑盒。
活動目前已取得了諸多階段性成果,貝康醫療與國內44家具有三代資質的醫療機構簽訂了合作協議,覆蓋全國21個省份,將對罕見病的防治工作輻射至全國范圍,惠及眾多患者家庭。
政策紅利,未來市場發展潛力巨大
自“三孩政策”實施以來,鼓勵生育的政策已成為我國政府工作的長遠戰略部署之一,這也奠定了輔助生殖行業發展的基本面趨勢。
2月21日,北京作為首批城市把16項輔助生殖服務納入醫保。據相關專家表示,預計第二批出臺政策的將會是上海、廣東等其他經濟發達的省市。在各項政策配套措施逐步完善的政策趨勢下,輔助生殖行業有望在未來2到3年內迎來高速發展期。
良好的業績表現以及強勢的增長趨勢,奠定了貝康醫療輔助生殖器械龍頭的行業地位。在政策傾斜和需求擴張的行業背景下,貝康醫療的發展是值得期待的。商業化進展優秀、穩健的財務結構、領先同業的布局和超強的管理層團隊已經成為了貝康醫療的資本市場標簽。隨著賽道的逐步成熟,作為領先的國產輔助生殖領域的綜合解決方案商,貝康醫療有望引領輔助生殖行業的浪潮。
]]>從“能生”到“優生”,80后海歸破解生育密碼
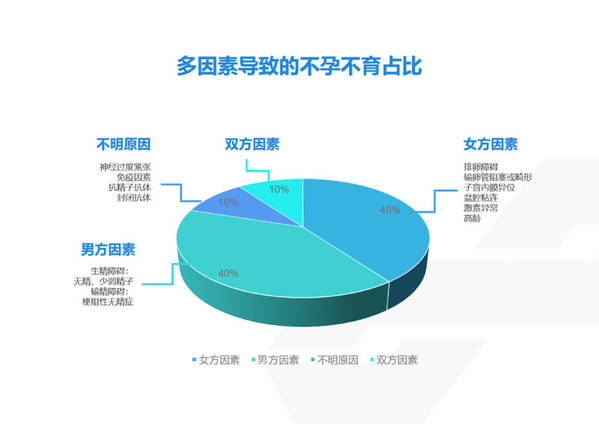
《2020年我國衛生健康事業發展統計公報》數據顯示,我國2020年總出生人口1200萬人,相比2019年總出生人口1465萬人,減少265萬。受環境污染、生育年齡推遲、生活壓力等因素影響,不孕人數還在不斷增加,超過1000萬的患者需借助輔助生殖技術實現生育。
梁波認為,試管嬰兒技術發展到今天,每一代的試管嬰兒技術皆有其歷史使命,“一代針對女性不孕,解決了卵子的問題;二代針對男性不育,解決了精子的問題;三代技術是在一代、二代基礎上真正實現了對胚胎的擇優選擇,而貝康醫療主攻的正是第三代試管嬰兒基因檢測試劑盒。”
三代試管嬰兒技術是通過在胚胎植入前進行基因檢測來輔助生殖,減少因胚胎缺陷造成流產或者其他遺傳病,尤其對于高齡、有異常懷孕史或攜帶家族遺傳病基因的夫婦來說,PGT的價值重大。“廣東和廣西地區,地中海貧血基因的攜帶率超過20%,如果通過三代試管嬰兒選擇不攜帶致病基因的胚胎孕育,可能整個家族就再也沒有地中海貧血了。”
首款PGT-A試劑盒獲批,試管嬰兒技術“持證上崗”
根據meta分析文獻報道,胚胎染色體異常率隨著女性年齡的增長而上升,當女性年齡>42歲時,胚胎染色體異常率可達到50%以上,流產率也會大幅上升,所以采取相應措施保障生殖健康至關重要。
在美國,PGT技術應用廣泛,與之相關的單基因遺傳病攜帶者篩查已作為科學備孕的常規檢測項目。目前三代試管嬰兒技術更多的是通過精準篩查來實現優生優育,這也是我國各大生殖中心都在突破和應用的創新技術。
2020年,貝康醫療自主研發的PGT-A試劑盒獲批上市,成為當時國內唯一一款獲得國家藥監局批準的三代試管嬰兒基因檢測試劑盒。該款產品的獲批,標志著我國三代試管嬰兒技術開始“持證上崗”,填補了國內在該項技術的空白。2016年,貝康醫療PGT-A試劑盒進入國家綠色通道后,在國內6家生殖中心展開了持續4年的臨床實驗。通過驗證,確認試劑盒靈敏性、特異性均達到100%。綜合隨訪結果顯示,臨床妊娠率由我國平均妊娠率46%提升至72%,流產率由20%以上降低至6.9%,“這是非常大的突破”。
貝康醫療還有另外兩款PGT-M和PGT-SR試劑盒,預計將分別在2022年和2024年獲得國家藥監局的注冊批準,未來貝康醫療還將繼續利用基因檢測技術,去做更加精準的植入和醫療,“這不會是一條急功近利賺快錢的道路,但有利于輔助生殖行業的良性發展。用我們這一代的努力為下一代創造更美好的生活,這也是我們為之不斷奮斗的初心。”
2021年2月,貝康醫療在港交所敲鐘上市。
作為“輔助生殖第一股”,貝康醫療積極推動頭部資源的整合,加大研發投入,為患者提供更加全面的全生育周期解決方案;同時聯合中國優生優育協會推出了“圓1000個罕見病家庭的生育健康夢”的公益資助活動,支持“童心圓”兒童慈善救助基金項目和“熊孩兒”救助計劃,助力“健康中國”戰略。
人民日報健康客戶端稿件原文:https://m.peopledailyhealth.com/articleDetailShare?articleId=7ae8ff16a5f74df69413a0f0cbb8b74c
從技術創新走向產業合并,強強聯合打造行業巨頭
男科實驗室和胚胎實驗室是輔助生殖中最重要的兩個實驗室。胚胎實驗室主要是進行體外受精、胚胎培養、凍存、胚胎植入前遺傳學診斷等,通過體外受精結合遺傳學檢測,篩選優質胚胎植入到女性子宮,從而提高輔助生殖的成功率。男科實驗室主要是對男性不育癥患者開展相關的實驗室檢測,除了常規的精液量、精子數量、活動率、畸形率等檢測指標,更多的精子功能性的檢測被納入到男科檢測中,包括精子核完整性檢測、精子尾部中段線粒體膜電位檢測、精子頂體反應能力檢測,精子功能缺陷是導致生育障礙的主要因素之一,且更能客觀的反映精子的受精能力,通過精液常規檢測和功能性檢測的結合,能夠為男性生育能力評估提供更全面的信息,更好地指導臨床治療。因此,在胚胎植入前遺傳學診斷的基礎上,增加精子質量的全面篩查,使得不孕不育的治療又向前推進了一步,對臨床輔助生殖方案的選擇和妊娠成功率的提升將有極大的促進作用。
當前,不孕不育癥在中國的發病率已攀升到12%-15%左右,其中由男方因素導致的不孕不育約占40%,國內男性不育檢測市場規模預計超過78億元,而當前市場規模僅5億,現階段的男性不育檢測市場與理論市場總容量之間尚存在較大差距,前者僅相當于后者的6.41%,在未來仍有較大的增長空間。目前,國內輔助生殖市場發展還在初級階段,且行業缺乏規范性,競爭格局尚未形成,此時正是優化自身結構,擴大產能,布局未來市場的最佳時機。收購并進行優勢資源的整合優化則是最有效的方式之一。
此次貝康醫療對星博生物的收購,是行業頭部公司的整合,將成為男科精子篩選解決方案公司與胚胎精準篩選解決方案公司的強強聯合,打通了完整的輔助生殖篩選的解決方案,通過優勢互補與協同創新,優化產業結構,加速產業化。
國內最早、規模最大的男科IVD診斷公司之一
星博生物是一家生殖醫學領域的以精子細胞功能學檢測為核心業務,具備強大的科研實力與產學研轉化服務能力的高新技術企業,曾獲“中國國家科學進步二等獎”等獎項。星博生物是國內布局最早、規模最大的男科IVD診斷公司之一,也是國內最大的流式細胞檢測試劑盒供應商之一。其研發的精子核完整性(DFI)檢測能夠針對全精子及活精子進行準確的 DFI 檢測,并獲得國內主流臨床工作者的認可,推動DFI 檢測納入《男性生殖遺傳學檢查專家共識》、《男性不育癥診斷與治療指南》,承擔13項科研課題、其中包括7項國家級課題,獲得13項專利、3項軟件著作權。其中,星博DFI試劑盒獲得國家藥監局認定的醫療器械備案證、試劑配套分析軟件的軟件著作權以及活精子分選的專利技術證書。星博生物與中科院、中華醫學會、中國性學會、生殖醫學國家重點實驗室、國家輔助生殖與優生工程技術中心、北京大學、同濟大學、南京醫科大學、哈工大保持著密切的技術合作,并開展了一系列卓有成效的產業化工作。星博生物的業務范圍覆蓋30個省、直轄市、自治區,與超400家臨床醫療機構建立合作關系,共計為200余萬備孕夫婦提供檢測服務。
星博生物創始人薛志剛教授表示,貝康醫療在輔助生殖IVD領域具有深厚的實力,此次的收購,能充分發揮星博生物在男科方面的優勢,幫助貝康醫療在男科領域的技術研發創新再上一層樓,輔以人工智能技術,徹底突破貝康醫療目前在男科方面的技術瓶頸。同時,星博生物也能借助貝康醫療的優勢資源,繼續深耕輔助生殖行業,形成全新的“硬件+軟件”產業模式,構建從孕前到產前到新生兒的全生育周期產業鏈。
貝康醫療創始人梁波博士表示,目前國內生物醫藥已經進入產業規模階段,需要對頭部企業進行產業化整合,實現強強聯合,形成1+1>2的效應。星博生物在男科行業布局多年,有非常高的產品認可度與知名度。星博生物與貝康醫療的聯合,將對星博生物男科產業以及貝康醫療的資源進行整合,實現渠道、學術、技術等資源共享,共同研發、注冊、生產試劑盒和儀器,加速國產化平臺與儀器替代,不斷在男科領域拓展業務,為不孕不育患者打造一個更加全面的全生育周期解決方案。希望能將星博生物打造成不僅是國內最大的、也能成為國際領先的男科專業化平臺,共同促進輔助生殖行業的健康發展。
過去十年,是生物醫藥技術創新的十年;未來十年,是行業頭部企業整合收購、走向規范化發展的十年。此次輔助生殖領域兩家頭部公司的合并是IVD領域的重大事件,輔助生殖行業的發展也需要頭部公司持續的市場投入與技術設備研發。貝康醫療將致力于構建更大的研發創新平臺,打造全生育周期解決方案,促進科技成果的轉化,加速產業化進程,不僅要在國內領先,也要做到國際領先,將貝康醫療的輔助生殖技術惠及全球患者。
期內,集團錄得收入為人民幣50.2百萬元,較2020年同期增加56.0%,主要由于PGT-A試劑盒、儀器及CNV試劑盒的銷量較2020年同期分別增加168%、126%及139%,同時NIPT的銷量亦大幅增加(約占總收益的27%)。毛利為人民幣22.2百萬元,較2020年同期大幅增加94.3%;整體毛利率從2020年上半年的35.5%提升至2021年上半年的44.2%。貝康醫療作為中國輔助生殖基因檢測的龍頭企業,是中國首家擁有涵蓋生殖周期所有關鍵階段產品組合的公司,集團已經將涉獵范圍從植入前階段擴展至產前和產后階段。
積極推動產品商業化 擴大市場覆蓋范圍
自2021年2月通過18A上市后,貝康醫療憑借先發優勢致力推動產品商業化,集團維持一支精簡的內部銷售及營銷團隊,專注于向獲三代試管嬰兒許可證的醫院及生殖診所等關鍵客戶提供服務。集團的內部銷售及營銷團隊亦負責通過學術營銷活動,與KOL及其他行業專業人士交流,向醫院及生殖診所推廣產品。
由于擁有中國首個也是唯一獲國家藥監局批準的PGT試劑盒,集團在打造及鞏固銷售管道及客戶基礎方面享有先發優勢。目前,集團的業務已覆蓋全國41家生殖中心,并與50%以上的領先客戶建立業務關系。集團將加強對領先客戶進行深度滲透,以實現從現有6%的比率逐步提升。同時,集團將推動全國性學術會議及公益項目,進一步提升集團品牌的公信力以及公眾對第三代IVF基因檢測試劑盒的認知度和接受度,及推動生殖中心實驗室硬設備升級,專注于胚胎冷凍保存設備產業鏈布局,為臨床試驗提供智能化、自動化綜合解決方案,以提升集團競爭力。
在研產品有序推進 支撐中長期業績增長
貝康醫療是迄今唯一獲批的試劑盒生產商,其PGT-A試劑盒可以在植入前篩查胚胎中的非整倍體(一種經常與試管嬰兒(IVF)植入失敗相關的染色體疾病),是首個也是唯一已獲國家藥監局批準的三代試管嬰兒基因檢測試劑盒。借助于PGT-A試劑盒,集團于臨床試驗中錄得的妊娠率及流產率分別為72.0%和6.9%。根據各類獨立研究,未進行非整倍體篩查的試管嬰兒的妊娠率及流產率分別為45.0%和32.0% (Schoolcraft et al. 2010, Wang et al. 2010) 。期內,集團從銷售PGT-A試劑盒錄得收入人民幣14百萬元,毛利率為71%。
集團正在開發另外兩款植入前基因檢測(PGT)產品,即PGT-M和PGT-SR試劑盒。集團的PGT-M試劑盒用于在胚胎植入母體前檢測單基因缺陷,不僅可以幫助降低嬰兒出生時患相關遺傳疾病的機率,還可有效阻止這些特征在患者家族中遺傳給后代。迄今,集團的PGT-M試劑盒是中國同類產品中首個也是唯一已完成注冊檢驗的產品。集團已于2021年7月就PGT-M試劑盒獲得倫理許可,并開始進行臨床試驗,預計于2022年獲得國家藥監局的注冊批準。
PGT-SR試劑盒用于檢測染色體結構重排,這是反復流產的常見原因。集團的PGT-SR試劑盒采用專有ReTSeq技術,該技術利用靶標捕獲技術專注于對關鍵基因組區域進行測序,并進行單倍型連鎖分析,以確定染色體的親源及檢測染色體易位的攜帶者。相關的自主研發專利已于國家知識產權局("CNIPA")注冊。集團已于2021年7月就PGT-SR試劑盒提交創新醫療器械申請,預計于2024年獲得國家藥監局注冊批準。
與曠博達成戰略合作 進一步推動生態圈建設
8月,集團與北京曠博生物技術股份有限公司訂立戰略合作框架協議,雙方同意在(其中包括)精子檢測、多因子檢測和傳染性物質檢測等領域,就開發、注冊、制造和銷售流式細胞儀及其配套產品開展戰略合作。根據戰略合作協議,輔助生殖領域產品及技術服務的共同開發將建基于曠博的流式細胞儀平臺,而該合作可能通過獨家授權及推廣、原設計制造(ODM)模式或原設備制造(OEM)模式進行。
蘇州貝康醫療股份有限公司創始人、執行董事兼總經理梁波博士表示:“2020年以來,在新冠肺炎疫情沖擊之下,無論是行業發展還是集團運營都面臨著很大挑戰;但近期國家出臺一系列鼓勵‘三孩’及輔助生殖行業相關政策,為集團未來發展營造了很好的政策環境,可謂機遇與挑戰并存。作為中國輔助生殖基因檢測的龍頭企業,貝康醫療已在商業化方面取得令人鼓舞的成績,未來還將以更加務實的態度,不斷加大研發投入加強自主創新研發實力,同時通過外延擴張進一步補充產品管線,進入更多生殖遺傳相關細分領域,打造生態閉環,成為全球領先的基因科技公司。我們希望通過科技革新,為更多家庭提供可負擔的輔助生殖包括基因檢測在內的解決方案,助力更多家庭生育健康嬰兒,并為中國生殖遺傳市場貢獻更大的力量。”
關于蘇州貝康醫療股份有限公司
蘇州貝康醫療股份有限公司是中國輔助生殖基因檢測解決方案的創新平臺,集團的PGT-A試劑盒可以在植入前篩查胚胎中的非整倍體(一種經常與試管嬰兒(IVF)植入失敗相關的染色體疾病),是首個也是唯一已獲國家藥監局批準的三代試管嬰兒基因檢測試劑盒。公司的PGT-A試劑盒于2020年2月作為三類“創新醫療器械”獲國家藥監局注冊,標志著中國受監管的三代試管嬰兒市場的誕生,而集團是迄今唯一獲批的試劑盒生產商。
]]>貝康醫療入選“2021福布斯中國·婦幼行業系列評選-輔助生殖產業企業TOP10”的三大特征:
01:創新研發 先人一步
作為輔助生殖領域龍頭企業,貝康醫療將持續走創新發展道路,未來五年內完成覆蓋全生命周期產品線的注冊報證。貝康醫療自主研發的PGS(植入前染色體非整倍體檢測)是第一個獲得國家藥監局批準上市的三代試管產品。PGD(植入前單基因遺傳病檢測,植入前染色體結構異常檢測)試劑盒預計分別在2022年和2024年通過注冊審批。
此外,貝康醫療打造了從檢測試劑到存儲的一體化整體實驗平臺解決方案,全面實現輔助生殖領域自動化、國產化的硬件升級,打造高端生育設備研發制造中心,目前正在開發多款智能儀器,預計NGS測序儀(DA500)、超低溫存儲儀(BSG800A),將分別在2022年和2023年通過注冊審批。未來5年內,貝康醫療將完成全生育周期產業線的注冊報證。
02:黃金賽道 前景廣闊
隨著“三孩政策”的落地,貝康醫療迎來生殖健康發展大機遇。而具備經濟實力、有意愿生育二孩甚至多個孩子的夫婦,往往大多數已經錯過了生育的黃金期,生育能力不及年輕夫婦,更需要輔助生殖服務。提升生育成功率和生育質量同樣是這部分人群的關注重點,輔助生殖基因檢測恰好能夠同時滿足這兩方面的意愿。由此可見,能夠提升生育質量的輔助生殖基因檢測,有望成為輔助生殖產業鏈上最有市場前景的的賽道之一。根據弗若斯特沙利文報告,中國生殖遺傳學醫療器械市場預計于2024年達到人民幣112億元,三代試管嬰兒的市場預計于2024年達到250億元。
03:精英團隊 開啟優生時代
作為中國第一家生殖領域基因產業上市公司,自2021年2月8日上市以來,貝康醫療搭建了以行業資深銷售總監王輝帶領的營銷團隊作為主體,海歸博士徐浩帶領的市場團隊以及遺傳專家胡濤濤帶領的臨床團隊作為輔助的“一體兩翼”的黃金組合,全力推動PGT(胚胎植入前遺傳學檢測)技術在臨床的普及和應用。未來,貝康醫療將加速產業化布局,圍繞“一體兩翼”的架構,引進更多全球優質人才,打造出一個超200人的國際一流營銷團隊,服務于臨床,助推中國輔助生殖市場加速發展。除此之外,在人才團隊建設方面,公司計劃引進多個院士團隊,建立全球知名KOL科學顧問團隊。
政策和市場的利好推動,生殖健康迎來發展大機遇。貝康醫療未來也將繼續推動生育健康基因科技的發展,注重技術突破和顛覆性技術的創新,幫助不孕不育患者“能生”,讓攜帶家族遺傳病基因患者“優生”。貝康醫療期望通過技術創新改變生活,讓中國沒有難生的孩子,為國家及民族優生貢獻力量。
曠博生物董事長蘭寶石先生表示:“作為中國臨床和健康預警管理領域的生物試劑領軍企業,曠博生物始終堅持以技術創新驅動發展,承擔了12項國家重大專項項目及轉化任務,堅持中國質造,在臨床診斷生物試劑領域擁有豐富的產品線和經驗。我們充分相信,此次與中國輔助生殖領域的頭部領軍企業貝康醫療牽手,將通過雙方優勢互補,協同創新,讓流式細胞術在輔助生殖領域開拓出更廣闊的應用前景,讓技術創新在臨床實踐中實現其真正價值,為促進輔助生殖技術高水平發展、提升人口出生率這一關鍵國策做出重大貢獻。我祝愿雙方合作成功,再創輝煌。”
貝康醫療董事長梁波博士表示:“根據世界衛生組織數據估計,在中國有超過3億的人群患有男科疾病,男科領域需求巨大。而貝康醫療作為生殖領域的領軍企業,自成立以來,致力于通過高通量測序技術在生殖健康領域的研發和臨床應用。此刻,我們非常榮幸能夠通過攜手中國最大的流式細胞領軍企業曠博生物,在基因檢測技術之后,開拓流式細胞檢測技術,貝康醫療的產線也得以從輔助生殖擴展到男科生殖健康,構建生殖大生態。貝康醫療將重度投入渠道建設,預計投入2000萬用于流式細胞技術的臨床市場推廣,打造男科領域國產頭部品牌,為中國患者服務”。
曠博生物擁有近40年的抗體研發與生產歷史,目前,全球很多知名品牌都在使用曠博研發克隆的抗體。曠博打破了流式診斷試劑長期被國外公司壟斷的局面,實現高端流式診斷試劑國產化。流式細胞術(Flow Cytometry,FCM)經過近四十年的發展和完善,今天已被廣泛的運用于從基礎研究到臨床實踐的各個方面,涵蓋了細胞生物學、免疫學、血液學、腫瘤學及遺傳學等領域。貝康醫療和曠博生物將在以下方向進行布局:
1. 生殖免疫流式檢測,主要用于預防流產以及輔助治療中的交叉配型。可用于男科、婦產科、生殖中心等;
2. 精子流式檢測,能夠全面地分析男性不育的精子功能進行全面分析,可以鑒別細菌感染和病毒感染。可用于男科、泌尿科、生殖中心等;
3. 調節性T細胞檢測,用于判斷機體的免疫能力。可用于婦產科、生殖中心、兒科、體檢科等。
貝康醫療2010年成立,于2021年在香港聯交所主板上市,擁有國內首個獲得三類醫療器械注冊證的三代試管檢測產品,目前已與250多家醫療機構展開合作。目前,貝康醫療圍繞男性生育市場打造了從遺傳基因測序平臺,精子流式細胞檢測平臺和精子生育力保存全自動化存儲平臺的一體化解決方案。貝康醫療非常重視本次合作,通過與曠博生物合作,將對貝康醫療現有渠道進行有力擴充,在未來拓展男科領域10億級市場,并持續鞏固和加強貝康醫療在生殖領域的競爭優勢。
兩大領域龍頭企業的進行強強聯合,響應政府號召,在國家級生物藥技術創新中心蘇州工業園區共同打造的全國規模最大的基于男科的流式細胞檢測技術研發區域創新中心,將圍繞流式細胞儀在男科這一細分領域的應用進行深入挖掘和探究,共同研發立足患者需求的男性生殖創新技術,實現1+1>2的效果,更好的為國家三胎政策貢獻力量。
罕見病又稱“孤兒病”,根據世界衛生組織的定義,是指患病率低于0.65‰-1‰的一類疾病[1],一般發病于生命早期階段、診斷過程漫長、通常危及生命,僅有5%的罕見病存在治療方法。統計數據顯示,中國罕見病患者總數約有2000萬,且每年新增人數超過20萬[2] 。
蘇州2021年7月30日 /美通社/ -- 為助力健康中國戰略的實施,倡導科學優育,提升對預防罕見病的關注和支持力度。秉承呼喚真情、傳遞關愛的初衷,中國優生優育協會聯合蘇州貝康醫療股份有限公司開展“圓1000個罕見病家庭健康生育夢”公益行動,這也是我國首個定向幫助罕見病夫婦實現健康生育夢想的公益項目。
“圓1000個罕見病家庭健康生育夢”公益行動將為全國1000個罕見病家庭提供免費胚胎植入前單基因遺傳病診斷,并借助先進的PGD技術阻斷罕見病致病基因,助力夫妻雙方有基因缺陷的家庭生育健康的孩子。同時,通過科普宣傳及項目實施,在全社會普及罕見病一級預防理念和科學技術,筑牢罕見病防治醫學保障網絡,致力于提高全民族人口素質。
中國優生優育協會表示:“少年強則中國強,優生優育關系到千家萬戶的幸福和中華民族的未來,在人口少子化的背景下已經成為重要的國家戰略。隨著醫學技術的不斷進步和醫療健康服務水平的高速發展,我們注意到罕見病家庭對于健康生育的迫切需求,并擁有了解決這一需求的先進技術,此次‘圓夢’公益項目的啟動,就是希望能夠聚合政府、醫院、企業、社會各界的資源和力量,降低出生缺陷率,減輕公共衛生系統的負擔,同時幫助更多的罕見病家庭實現生育健康寶寶的心愿。”
困局與破局
研究顯示,約72%的罕見病是遺傳物質的結構改變或調控異常造成的[2],具有遺傳性。一旦配偶雙方存在相同缺陷基因,下一代就有可能患罕見病。那么,罕見病夫婦是否應該生育?已經生育了一個出生缺陷患兒的夫婦是否還能再擁有一個健康的孩子?這些問題困擾著所有的罕見病家庭。
近年來,全社會對罕見病的關注日益提升。2019年政府報告指出,加強癌癥、罕見病等重大疾病防治事關億萬群眾福祉,要保障約2000萬罕見病患者用藥。從鼓勵罕見病用藥研發列入規劃,到《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》等文件出臺,支持罕見病藥品研發上市的措施,再到頒布第一批罕見病目錄、成立罕見病聯盟、組建罕見病診療協作網,集中展示了我國政府高度重視并正在積極推進罕見病的防治工作,并取得了巨大的突破與發展。
“一邊是國家對生育政策的不斷優化以積極應對老齡化趨勢,一邊是這些罕見病患者渴望生育的困境。”上海交通大學醫學院附屬仁濟醫院孫贇主任對此表示:“罕見病患者和正常人一樣也擁有健康生育的期待與權利,我們要做的就是用先進的醫學技術去幫助他/她們生育一個健康的孩子。”
“產前診斷和第三代試管嬰兒技術來助力。”上海交通大學醫學院附屬仁濟醫院孫贇主任進一步解釋到,罕見病里大部分為遺傳病,尤其是單基因遺傳病,如果醫生能從單基因層面確診患者的疾病,那么現絕大部分查明病因的遺傳病都可以通過技術手段避免代際傳遞。其中,三代試管嬰兒技術“胚胎植入前遺傳學診斷(PGD)”是一種在胚胎植入前對胚胎進行檢測,可以選擇完全不攜帶致病基因的胚胎進行植入的技術,是幫助罕見病家庭徹底擺脫疾病遺傳的有效途徑,也是目前對阻斷罕見病最有效的一級預防措施。
“國家衛生健康委員會在《中國罕見病防治與保障事業發展》中要求,為有優生需求的罕見病高風險家庭提供胚胎植入前遺傳學診斷技術服務,阻斷遺傳病代際傳遞。”中國優生優育協會表示,“此次公益項目,正是響應國家要求,向全國范圍內有健康生育需求的罕見病家庭免費提供胚胎植入前的單基因遺傳病檢測。”
技術護航,讓夢想走進現實
在目前的三類輔助生殖技術中,第三代試管嬰兒(PGD胚胎植入前單基因遺傳病診斷技術)是在胚胎植入前,對早期胚胎進行單基因遺傳病的檢測,分析胚胎是否有遺傳物質異常的一種早期孕前篩查方法。通過挑選正常的胚胎植入子宮,以獲得正常的妊娠,不但實現了“能生”,還能夠在一定程度上做到“優生”,幫助那些有缺陷基因的夫妻生育健康的后代。除此之外,對于有生育問題需要體外受精的夫婦,提供健康生育的選擇。
蘇州貝康醫療將為此次公益項目提供1000個總計約合1500萬元人民幣的免費檢測試劑。與此同時,為了更好的普及胚胎植入前檢測技術,在蘇州貝康醫療的支持下,中國優生優育協會生殖遺傳培訓中心也同步在蘇州成立,后續將助力整個公益項目的開展和推進,為醫院的相關醫護人員提供覆蓋遺傳咨詢、胚胎活檢、檢測技術、操作規范流程等全方位的培訓。
蘇州貝康醫療股份有限公司董事長梁波博士表示:“我們非常榮幸能夠攜手中國優生優育協會,加入到為罕見病夫婦圓健康生育夢想的公益項目中。同時,作為國內首個獲批三類醫療器械注冊證的三代試管嬰兒PGS檢測試劑盒的研發和生產者,我們更加意識到自己所肩負的歷史使命。未來,貝康醫療將一如既往地專注創新研發,在提供先進技術和產品的同時,不斷推動輔助生殖技術的公眾認識水平,幫助更多有輔助生殖需求的夫婦生育健康的孩子,以實際行動支持國家的優生優育政策落地,為實現以人民的健康為宗旨的健康中國2030目標貢獻貝康醫療的力量。”
關于貝康醫療
貝康醫療是中國輔助生殖領域領先的三代試管嬰兒臨床解決方案提供商,是香港聯交所主板上市企業(股票代碼:2170HK),致力于高通量測序技術在生育健康領域的研發和臨床應用,旨在幫助不孕不育的患者“能生”,讓攜帶家族遺傳病基因的患者“優生”,讓更多家庭生育健康的孩子。更多信息,敬請訪問 https://www.basecare.cn。
[1] 2019年-3月9日,新華社客戶端報道《罕見病,你了解多少?》https://baijiahao.baidu.com/s?id=1627480665822685783&wfr=spider&for=pc |
[2] 《中國罕見病行業觀察》(2021)統計數據 |
值得注意的是,期內公司經營業務虧損為5346.8萬元;公司權益股東應占年內虧損8.77億元,其中8.27億元系向投資者發行的金融工具的賬面值變動,這部分虧損并非是經營、業務所造成,而是屬于賬面虧損。
公司已就A輪、B輪和C輪投資向一群首次公開發售前投資者發行股份,因為這些金融工具對公司而言不符合權益的定義,故這些金融工具被確認為金融負債。這些金融工具截至2019年及2020年12月31日的賬面總值分別為10.44億元和零。截至2019年及2020年12月31日止年度,這些金融工具的賬面值變動分別為5.20億元和8.27億元。
于2020年7月23日,公司與首次公開發售前投資者訂立補充投資協議,據此,首次公開發售前投資者放棄了部分優先權。這些協議可令這些金融工具在2020年7月23日分類為權益,此后公司不再于公司的損益表中確認這些金融工具為金融負債或該等金融負債賬面值的任何變動。
產品方面
相較基于熒光原位雜交(FISH)及定量聚合酶鏈反應(qPCR)技術的其他PGT-A產品,公司的PGT-A試劑盒可以在植入前篩查胚胎中的非整倍體(一種經常與試管嬰兒(IVF)植入失敗相關的染色體疾病),是首個也是唯一已獲國家藥監局批準的三代試管嬰兒基因檢測試劑盒。公司的PGT-A試劑盒于2020年2月作為三類“創新醫療器械”獲國家藥監局注冊,標志著中國受監管的三代試管嬰兒市場的誕生,而公司是迄今唯一獲批的試劑盒生產商。中國還有其他PGT-A試劑盒正在申請國家藥監局注冊證,并出售作有限的科學研究用途。
正在開發另外兩款植入前基因檢測(PGT)產品,即PGT-M和PGT-SR試劑盒。這些試劑盒與公司的PGT-A試劑盒一起,會構成一個完整的檢測試劑盒系列以占據PGT領域,所有這些產品均基于二代測序(即NGS)技術。PGT-M檢測植入前試管嬰兒胚胎中的單基因缺陷。公司已開發敏感度和特異性更高的PGT-M試劑盒。其無需進行患者特定的預實驗生產流程驗證,提供了具有大規模臨床吸引力的標準化解決方案,從而將結果生成時間從約兩個月大大縮短為約兩周,因此也能為患者減少檢測費用。迄今,公司的PGT-M試劑盒是中國同類產品中首個也是唯一已完成注冊檢驗的產品。公司預期PGT-M及PGT-SR試劑盒將分別在2022年和2024年獲得國家藥監局的注冊批準,而公司預計這將進一步鞏固公司在中國三代試管嬰兒基因檢測試劑盒市場的主導地位,于潛在競爭中占據領先。
制造方面
公司在蘇州的生產廠房生產和組裝所有內部開發的產品。公司的生產廠房按照中國GMP要求設計,產能為每年400,000人份。根據ISO13485:2016質量標準(醫療器械行業的國際質量控制標準)獲得認證。公司擁有兩間符合國際清潔等級劃分標準ISO14644–1清潔等級標準的ISO7級清潔車間。公司于從國家藥監局獲得三類醫療器械注冊證后開始優化公司的生產流程以籌備對PGT-A試劑盒進行商業化規模生產。公司的生產線設計為高度自動化。
商業化方面
公司大部分產品直接售向醫院及生殖診所。其次,公司亦向經銷商出售基因檢測試劑盒,而經銷商再將公司的產品出售予醫院及生殖診所。公司維持一支精簡的內部銷售及營銷團隊,專注于向獲三代試管嬰兒許可證的醫院及生殖診所等關鍵客戶提供服務,此類客戶是公司客戶基礎的主要組成部分。公司的內部銷售及營銷團隊亦負責通過學術營銷活動,與KOL及其他行業專業人士交流,向醫院及生殖診所推廣產品。
由于擁有中國首個也是唯一獲國家藥監局批準的PGT試劑盒,公司認為,公司在打造及鞏固銷售渠道及客戶基礎方面享有先行者優勢。公司計劃將商業化戰略重點放在各大醫院及生殖診所。公司將利用就PGT-A與這些醫院及診所建立的關系,擴大覆蓋范圍的寬度及深度。公司旨在擴大對持牌進行PGT業務的醫院及生殖診所的覆蓋面及滲透率,并與其建立更穩固的關系,以增強客戶黏度并為日后向其提供其他產品奠定基礎。公司計劃努力全面覆蓋中國的持牌醫院及生殖診所。此外,公司計劃通過提供全面的解決方案,提高這些醫院及診所所在公司銷售額的比例,并針對該等機構中的其他醫學專業(例如新生兒及兒科)提供新產品。公司還計劃與持牌第三方醫檢所合作,以擴大公司在中國覆蓋的客戶群。
研發方面
研發開支從2019年度的人民幣1990萬元增加73.4%至2020年度的人民幣3450萬元,主要是由于:公司主要就PGT-M試劑盒的臨床前驗證費而向技術服務供應商支付的服務費增加人民幣500萬元;員工成本因研發人員人數增加而增加人民幣370萬元;及PGT-SR、WES、PGT-M及CNV試劑盒的開發及注冊檢驗的耗材開支增加人民幣400萬元所致。
發展策略方面
為實現成為一家全球性的基因技術公司的愿景,公司擬實施以下業務戰略:繼續獲取及鞏固PGT-A的銷售渠道及客戶基礎;快速商業化產品組合,以涵蓋整個生殖周期;開發下一代自動及智能硬件,升級行業基礎設施;及通過利用全球領先公司的技術進步,保持技術領先地位。
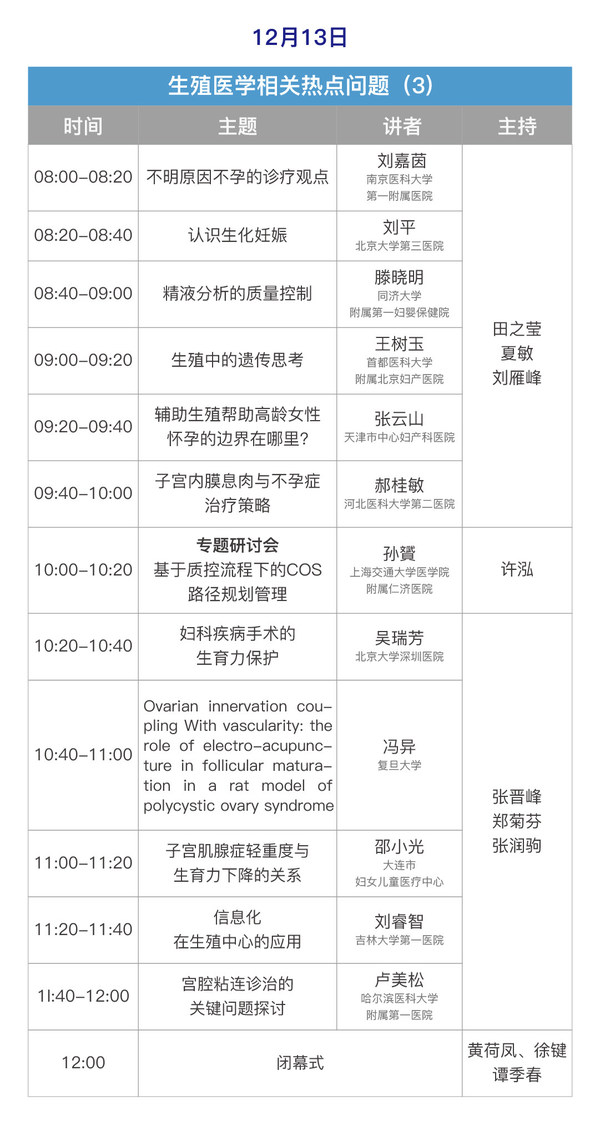
會議信息
會議時間:2020年12月12日-13日
會議形式:網絡直播,可點擊鏈接查看:http://live.91huayi.com/splash/1997465
注冊信息
會議注冊:本次會議全體參會代表免注冊費
學分授予:注冊會議學員線下或線上掃描二維碼授予學分,本次會議授予國家級繼續教育學分6分。
組織架構
大會主席:黃荷鳳院士
執行主席:譚季春教授
大會秘書長:許泓教授
主辦單位:中國中西醫結合學會生殖醫學專業委員會
承辦單位:
遼寧省中西醫結合學會生殖醫學專業委員會
中國醫科大學附屬盛京醫院
學術委員會(按拼音字母排序):
陳亞瓊 陳子江 杜惠蘭 馮 異 管一春 韓延華
郝桂敏 胡曉華 黃荷鳳 金莉萍 李 蓉 李 文
李 錚 連 方 林 元 劉嘉茵 劉 平 劉睿智
劉雁峰 盧美松 羅頌平 馬 堃 馬黔紅 齊 聰
喬 杰 邵小光 沈 嶸 孫 斐 談 勇 譚季春
滕曉明 田之瑩 王 華 王克華 王鷺霞 王樹玉
吳瑞芳 吳小華 夏 敏 徐叢劍 徐 鍵 許 泓
俞超芹 張 丹 張晉峰 張云山 鄭菊芬 朱依敏
組織委員會(按拼音字母排序):
蔡 婕 常秀峰 陳露婷 陳 萍 陳其華 陳希婧
鄧 姍 丁國蓮 董佳晨 段彥蒼 范麗潔 馮曉玲
馮玉蓉 付金榮 郜 潔 谷欣權 郭廷超 郝桂敏
侯海燕 胡春秀 黃筱金 黃學鋒 黃艷紅 黃仲英
蔣學祿 金富銳 金 麗 金志春 康志媛 匡延平
臘曉琳 賴毛華 黎燕玲 李 佶 李偉莉 李香娟
李新玲 李艷青 李 燕 梁 瑩 林 潔 林 嵐
劉 麗 劉睿智 劉文娥 劉昱磊 羅頌平 馬華剛
孟慶霞 莫鳳媚 倪亞莉 聶曉偉 龐 敏 彭冬梅
邱曉曉 曲 凡 沈衛東 施惠娟 斯建新 宋學茹
孫 偉 孫永忠 孫振高 滕曉明 王瑞霞 王世鄂
王希波 翁雙燕 伍娟娟 夏 天 謝 萍 徐向榮
徐曉宇 許麗綿 許小鳳 閆 穎 顏耀華 楊成志
楊麗娟 尹巧芝 張 斌 張 弘 張利梅 張勤華
張潤駒 張淑芬 張婷婷 章漢旺 趙 娟 趙 琰
鄭備紅 鄭崇勇 鄭 潔 鄭英如 周 閣 周 瑾
周 容 朱小琳 朱芝玲
秘書組:張潤駒 陳露婷 李萍萍 趙馨揚 張斯文
會議日程
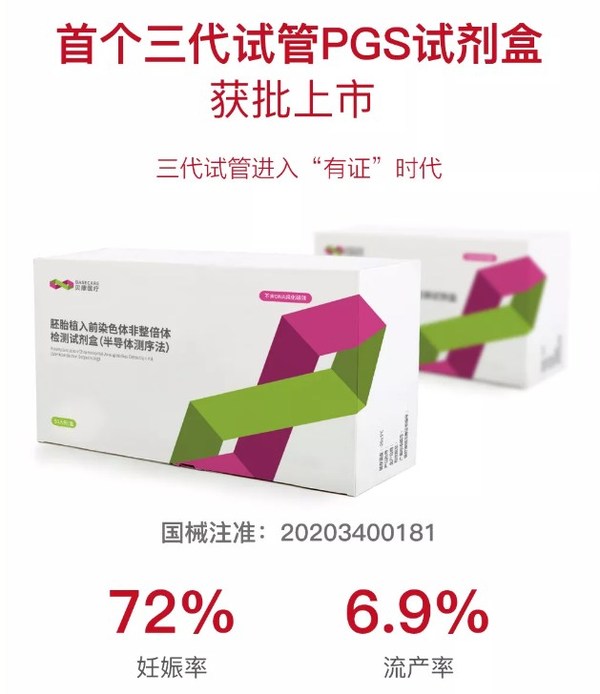
1. 國內唯一“有證”三代試管PGS試劑盒亮相中華醫學會生殖年會
本次大會國內輔助生殖領域龍頭企業蘇州貝康醫療器械有限公司攜國內首個“有證”三代試管PGS產品亮相會議現場。該產品可針對胚胎進行植入前染色體篩查,從而大幅提高試管嬰兒臨床妊娠率,降低流產率,也是目前唯一能夠實現胚胎全染色體精準篩查的Ⅲ類醫療器械注冊產品。
從2016年開始,歷經4年時間,經過3萬多例胚胎臨床樣本的PGS檢測,數據統計顯示,PGS試劑盒將試管嬰兒臨床妊娠率由原來的46%提高至72%,流產率由33%降低到6.9%。該檢測試劑盒也于今年獲得了行業內首個醫療器械注冊證(國械注準:20203400181),填補了我國三代試管臨床應用的技術空白,標志著三代試管PGS檢測正式進入“有證”時代。
2. 醫患糾紛頻繁的今天,使用無證醫療器械,如履薄冰
2014年3月,國家藥監局發布的《醫療器械監督管理條例》(以下簡稱《條例》)第四十條明確規定,“醫療器械、使用單位不得經營、使用未依法注冊的醫療器械”,第六十三條、第六十六條明確規定“對于經營和使用未注冊醫療器械的處罰條款”。同時,國家藥監局還發文表示,將切實加強醫療器械使用監管,進一步規范生產、經營和使用秩序,嚴厲打擊生產、經營和使用無注冊證體外診斷試劑行為,保障患者用械安全、有效。使用無證醫療器械產品,不但有損患者利益,對醫院自身也帶來極高的違法成本。
3. 三代試管嬰兒檢測產品屬于最高級別的醫療器械,院內及外送檢測須謹慎
2014年2月,國家藥監局和衛健委聯合發布《關于加強臨床使用基因測序相關產品和技術管理通知》,明確了基因測序診斷產品屬于醫療器械,基因測序需要應用的檢測儀器、診斷試劑和相關醫用軟件等產品,需要經過國家藥監部門審批注冊,并經衛生計生行政部門批準技術準入。PGS試劑盒屬于III類醫療器械,按照國家醫療器械相關法律強制性規定,任何醫療機構(包括醫院、醫學檢驗所、醫學檢驗中心等)在開展臨床應用項目時,均應當使用有注冊證的醫療器械,產品開發依托的平臺也必須獲得三類醫療器械注冊證。
自PGS試劑盒獲批上市后,國家藥品監督管理局緊接著發布公告,2020年8月1日起,PGS試劑盒被納入強制性醫藥行業標準。《條例》第六條規定“醫療器械產品應當符合醫療器械強制性國家標準;尚無強制性國家標準的,應當符合醫療器械強制性行業標準”。各有關單位要充分認識強制性行業標準的法律地位,切實維護強制性行業標準的權威性,確保強制性行業標準規范、有效實施。
4. 展望
據弗若斯特沙利文的調研資料顯示,中國輔助生殖市場規模大約1000億元,三代試管嬰兒的市場由2015年約3億元增加至2019年的25億元,復合增長率達到70.8%,預計2024年達到250億元。三代試管嬰兒的創新技術給不孕不育夫婦提供了新的選擇,為攜帶遺傳性疾病的備孕夫婦帶來了新的希望,三代試管PGS試劑盒將成為臨床的剛需。正是由于市場的不斷發展,醫療器械的經營和使用也面臨越來越嚴格的法律規范要求及合規挑戰,未來有證醫療器械的使用也是必然的發展趨勢。醫療機構及醫務人員也應加強醫療安全意識和風險防范意識,合法合規使用藥械,避免因使用無證產品帶來的各種風險。
作為“國家創新”醫療器械,PGS試劑盒的上市讓我國走出了三代試管缺乏有證國產試劑的窘境。在2015年,貝康醫療申報國家標管中心將PGS試劑盒界定為“三類醫療器械”,并獲得了國內首個 “國家創新醫療器械特別審批”PGS產品,填補了我國在胚胎基因檢測中的臨床空白。經過4年多的臨床試驗,今年該產品正式獲得國內首個PGS三類醫療器械注冊證,標志著三代試管進入“合規”國產試劑盒的新時代。
老百姓可以在國內醫療機構使用國產的PGS試劑盒完成三代試管檢測,求子心切的不孕不育患者不必再耗費大量人力物力遠赴海外做三代試管嬰兒。未來將幫助中國5000萬不孕不育夫婦能以更低的成本、更高的質量、更好的保障應用三代試管嬰兒技術。
貝康醫療運營總監芮茂社表示,該技術是在胚胎發育早期選擇幾個細胞進行遺傳物質的全基因組檢測,挑選正常的胚胎進行植入,以期提高妊娠成功率,生育健康的寶寶。本產品是首個實現23對染色體全部篩查的臨床注冊產品,而且檢測周期由1周縮短至1天。根據臨床統計,該技術將臨床妊娠成功率由原來的46%提高至72%,流產率由33%降低到6.9%,可見PGS試劑盒的上市,將幫助更多患者實現生育健康寶寶的心愿。
據弗若斯特沙利文的調研資料顯示,中國輔助生殖市場規模大約1000億元,三代試管嬰兒的市場由2015年約3億元增加至2019年的25億元,復合增長率達到70.8%,預計2024年達到250億元。三代試管嬰兒的創新技術給不孕不育夫婦提供了新的選擇,為攜帶遺傳性疾病的備孕夫婦帶來了新的希望,三代試管PGS試劑盒將成為臨床的剛需。
]]>