國內首項老視藥物臨床試驗啟動
- ARVN003用于暫時性改善老視患者的近視力的臨床試驗是中國批準的第一項老視藥物臨床試驗
- 本次臨床試驗首例患者入組,也是國內首例老視藥物III期臨床試驗患者入組
- ARVN003有望成為中國首個獲批的老視藥物療法
上海2022年7月4日 /美通社/ -- 專注于眼科創新療法的生物技術公司極目生物("極目生物")今天宣布,公司核心產品之一ARVN003 -- 基于Optejet®微量給藥裝置開發的鹽酸毛果蕓香堿微量眼用溶液用于暫時性改善老視患者近視力的國內III期臨床試驗,已經完成首例患者入組,這也是國內首例老視藥物III期臨床試驗患者入組。
2020年8月,極目生物與美國臨床階段生物制藥公司Eyenovia達成合作,獲得ARVN003 (MicroLine)在大中華區和韓國開發和商業化的獨家許可。2021年5月,Eyenovia宣布MicroLine在美國的第一項III期臨床試驗VISION-1中使用2%毛果蕓香堿的試驗組成功達到了給藥2小時后獲得3行DCNVA(最佳矯正遠視力下的近視力)改善的主要療效終點。
本項獲批的臨床試驗是一項隨機、多中心、雙盲、安慰劑對照的III期臨床研究,主要目的是在成人老視患者中評估使用ARVN003給藥以暫時性改善近視力的有效性和安全性,這是目前國內獲批的首項老視藥物臨床試驗。
隨著年齡增長,人眼晶狀體逐漸硬化、彈性減弱,睫狀肌的功能逐漸減低,從而引起眼的調節功能逐漸下降,出現閱讀等近距離工作困難,這種生理性現象稱為老視(老花眼)。一般而言,老視前期是指年齡在35-45歲,老視早期是指45-52歲,老視晚期或絕對性老視是指年齡大于52歲,目前全球有近四分之一人口受老視的影響[1]。近年來隨著我國人口老齡化加速,老視患病人數正呈逐年增長趨勢。相關數據顯示,2021年中國老視人口超3.9億[2]。
目前矯正老視的治療方案主要包括閱讀用老花鏡、隱形眼鏡和手術等。由于治療方案有限、疾病科學認知不足等原因,我國許多老視患者并沒有采取及時應對或視力矯正。然而老視不僅會影響中老年群體視覺健康、工作生活質量和心理健康,也將成為造成家庭和社會經濟負擔的潛在因素。
本項III期臨床試驗的主要研究者,中國眼視光學學術帶頭人——溫州醫科大學眼視光中心主任、眼視光醫院集團總院長瞿佳教授表示:"隨著我國老齡化加劇,老視患者年輕化等趨勢,對于有效、安全且便捷的老花眼治療藥物有著巨大的需求。很高興參與主導這一國內首項老視藥物臨床研究,期待極目生物ARVN003這款藥物早日獲批上市。"
極目生物共同創始人兼首席醫療官劉清博士表示:"此次ARVN003的臨床進展讓我們備受鼓舞。這也是繼鋒脈®糖尿病性黃斑水腫(DME)臨床試驗完成首例亞洲DME患者給藥后,公司核心MAP?微矩陣藥膜平臺技術在大眾眼健康領域做出的積極行動,達成的又一個臨床應用里程碑。我們將繼續穩步前進,努力推動ARVN003成為中國首款獲批上市的老視治療藥物,從而令現有治療方案有更多樣的選擇和突破性的進展,惠及眾多老視患者。"
關于ARVN003
ARVN003是一款基于Optejet®微量給藥裝置開發的專利匹羅卡品(毛果蕓香堿)微量眼用溶液,用于"按需"改善老視患者近視力。匹羅卡品眼用溶液通過縮瞳而改善近距視力的作用廣為人知,其機制為通過小孔效應形成擴大的焦深。ARVN003采用專利Optejet®給藥裝置,可提供高精度微量給藥,有效解決傳統滴眼液給予相同藥物時的耐受性和生物利用度等問題。
關于創新給藥系統Optejet®
用于眼科治療的Optejet®微量藥物制劑和遞送平臺,使用高精度壓電打印技術來實現約8μL的給藥,這與人眼的淚膜體積一致。使用Optejet®給藥的眼藥液量比常規滴眼液給藥量降低80%,不僅可以避免給藥過量,還可降低因過量用藥造成的藥物或防腐劑暴露風險。Eyenovia的專利微流體噴射技術專為快速、溫和的眼表給藥設計,可在約80毫秒內將藥液遞送至眼表,不受瞬目反射影響。Optejet®的成功應用已得到證實,在各種臨床環境中,經過基本培訓后Optejet®的成功給藥率超過了85%,而傳統滴眼液的成功給藥率僅為40%-50%[3]。此外,其智能電子裝置和移動電子醫療技術還可記錄并提高患者的依從性。
[1] 中國醫師協會眼科醫師分會屈光手術學組.中國伴年齡相關性調節不足屈光不正患者激光角膜屈光手術專家共識(2021年)[J].中華眼科雜志,2021,57(9):651-657.DOI:10.3760/cma.j.cn112142-20210523-00246. |
[2] 《愛爾眼科睛新Lens手術臨床應用專家共識》 |
[3] Pasquale LR, Lin S, Weinreb RN, et al. Latanoprost with high precision, piezo-print microdose delivery for IOP lowering: clinical results of the PG21 study of 0.4 µg daily microdose. Clin Ophthalmol. 2018 Nov 28; 12:2451-2457. |

- 全球首創的脈絡膜上腔微注射(SCS Microinjection)給藥療法
- 國內針對葡萄膜炎性黃斑水腫的首項臨床試驗及潛在的首款獲批藥物
- 新藥上市申請已獲美國FDA批準用于葡萄膜炎性黃斑水腫治療
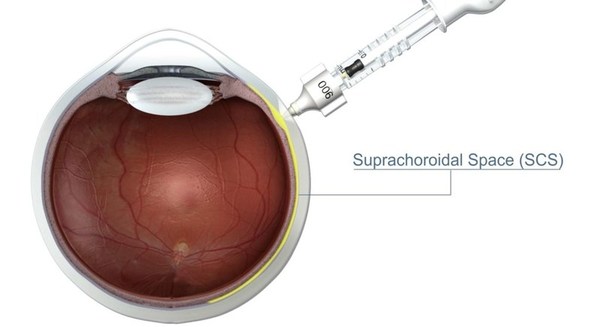
上海2021年11月19日 /美通社/ -- 專注于眼科創新療法的生物技術公司Arctic Vision極目生物(“極目生物”)宣布,公司首個管線產品ARVN001(曲安奈德脈絡膜上腔注射混懸液,在美國稱為XIPERE?)針對葡萄膜炎性黃斑水腫治療的國內III期臨床試驗順利完成首例患者給藥。XIPERE?是全球首創的脈絡膜上腔微注射(SCS Microinjection)給藥在研療法,在美國針對葡萄膜炎性黃斑水腫治療的新藥上市申請已于10月25日獲得FDA批準,即將上市。
極目生物在國內開展的ARVN001研究是一項隨機、雙盲、安慰劑對照的III期臨床試驗,主要研究目的為:在因繼發于非感染性葡萄膜炎的黃斑水腫(Uveitic Macular Edema, UME)患者中,評估曲安奈德脈絡膜上腔注射混懸液(ARVN001)的有效性和安全性。這是我國第一項針對葡萄膜炎性黃斑水腫的注冊臨床試驗,也是脈絡膜上腔微針注射療法在中國患者的首次應用。ARVN001在美國的關鍵性III期臨床研究PEACHTREE1結果顯示,接受ARVN001治療后24周,患者視力得到顯著提升,黃斑水腫快速顯著改善且作用持久,同時眼壓升高及白內障發生率較低,展示出藥物良好的療效和安全性。
本項臨床試驗的主要研究者為中華醫學會眼科學分會副主任委員、重慶市眼科學市級重點實驗室主任、重慶醫科大學附屬第一醫院眼科主任楊培增教授。楊教授表示:“糖皮質激素的局部給藥是目前葡萄膜炎的常用治療方法之一,但治療過程中容易出現白內障、眼壓升高、青光眼等不良反應,為患者帶來困擾和負擔。極目生物的創新療法ARVN001將藥物直接遞送到脈絡膜上腔,同時阻隔藥物向眼前節的彌散,有望大幅度提高藥物的生物利用率、降低副作用風險。我們很高興將這種療法應用于臨床實踐,并期待早日為葡萄膜炎性黃斑水腫患者帶來這一新的治療選擇。”
極目生物首席醫學官劉清博士提到:“我們非常高興在ARVN001的臨床開發上又邁進了里程碑式的一步。脈絡膜上腔注射療法經證實的高效性、安全性及微創操作的便利性讓我們對這項試驗的順利開展充滿信心。目前國內還沒有用于葡萄膜炎性黃斑水腫的治療藥物獲批,我們希望盡快填補這一空白,在解決未滿足的患者需求同時,也為脈絡膜上腔注射技術在臨床上的應用打好基礎,未來將其應用于更多眼底疾病治療領域,造福更多患者,為眼健康事業的發展帶來意義深遠的改變。”
關于葡萄膜炎性黃斑水腫(UME)
葡萄膜炎(Uveitis)是一組累及葡萄膜的高致盲性眼部炎癥性疾病,嚴重危害患者的視力和生活質量,給患者及其家庭和社會帶來了沉重的負擔。黃斑水腫是葡萄膜炎最常見、最嚴重的并發癥之一,也是葡萄膜炎引起永久性視力損害的首要因素。患者視網膜中視力最敏銳的區域黃斑出現積液形成水腫,從而引起視力嚴重下降甚至致盲。ARVN001為全球首個且唯一獲批的葡萄膜炎繼發黃斑水腫治療藥物。
關于ARVN001
ARVN001為一款專為脈絡膜上腔注射給藥的糖皮質激素曲安奈德專利混懸液,在美國已獲得FDA批準用于治療葡萄膜炎性黃斑水腫(UME),同時也正被開發用于糖尿病黃斑水腫(DME)等其他眼底疾病。此創新的脈絡膜上腔給藥方式可以使藥物快速并充分地彌散至眼后節且作用持久,并能大幅降低對眼內正常組織的不良影響。
2020年3月,極目生物獲得了XIPERE?在大中華區(中國大陸,香港,澳門和臺灣)和韓國的開發和商業化獨家權益,項目代號ARVN001。2021年8月,極目生物獲得ARVN001在東盟十國及印度的獨家權益。2021年9月,極目生物再次擴大ARVN001權益地區,獲得澳大利亞、新西蘭獨家授權。
2021年9月,極目生物獲得ARVN001國內第二個臨床試驗申請批準,適應癥為糖尿病性黃斑水腫,目前正在準備開展臨床試驗。
關于極目生物
極目生物是一家總部位于中國、專注于眼科創新療法的生物技術公司,擁有覆蓋從早期發現階段到商業化階段的一系列突破性眼科治療技術產品組合。公司的愿景是,通過在中國、亞洲乃至全球提供創新療法,解決眼科疾病領域未滿足的臨床需求,惠及廣大眼科患者群體。極目生物在生命科學領域專業投資方的支持下創立,并由一支擁有豐富的全球眼科產品研發和商業化經驗的行業精英團隊管理。有關更多信息,請訪問www.arcticvision.com。
投資者和媒體聯系:
Communications@arcticvision.com
1 Yeh S, Khurana RN, Shah M, et al. Efficacy and Safety of Suprachoroidal CLS-TA for Macular Edema Secondary to Noninfectious Uveitis: Phase 3 Randomized Trial. Ophthalmology. 2020 Jul;127(7):948-955.
拓展閱讀:
1. 極目生物合作伙伴Clearside Biomedical葡萄膜炎性黃斑水腫治療藥物XIPERE? (ARVN001)美國獲批上市
2. 極目生物宣布再次擴大脈絡膜上腔注射療法ARVN001權益地區,獲得澳大利亞、新西蘭獨家授權
3. 突破UME治療瓶頸,SCS脈絡膜上腔注射新型療法助力精彩視界
4. 脈絡膜上腔新型制劑ARVN001——葡萄膜炎性黃斑水腫克星
極目生物創始人、首席執行官及董事,胡海迪 (Eddy Wu) 博士對此表示:“Clearside公司創新的專利脈絡膜上腔注射平臺有望為全球患者提供治療獲益。我們很高興看到XIPERE?實現這個重要的注冊里程碑,并熱烈祝賀Clearside團隊取得這一重大進展。同時,作為極目生物引進的首個產品,我們對XIPERE? (ARVN001) 在中國等亞洲地區的后續臨床開發也抱有強大信心,同時我們作為Clearside值得信賴的合作伙伴,也將繼續保持雙方的密切合作。”
“XIPERE?的新藥上市申請再提交獲得受理對于Clearside而言是一個重要的里程碑。”Clearside總裁兼首席執行官George Lasezkay 博士說,“作為通過脈絡膜上腔給藥治療眼底疾病的先驅,我們相信XIPERE?的大量臨床應用經驗表明該產品是一種可靠的、非手術的、診室內即可操作的可及性療法,未來可應用在眾多眼底疾病治療領域。在此非常感謝我們的合作伙伴極目生物 (Arctic Vision)一直以來的支持和他們取得的進展,期待在未來看到XIPERE?為全球葡萄膜炎性黃斑水腫患者的生活帶來有益改善。”
關于XIPERE? / ARVN001
XIPERE?為一款專為脈絡膜上腔注射給藥的糖皮質激素曲安奈德專利混懸液,正被開發用于治療葡萄膜炎性黃斑水腫。此創新的脈絡膜上腔給藥方式可以使藥物快速并充分地彌散至眼后節且作用持久,并能大幅降低對眼內正常組織的不良影響。
2019年10月,博士康(Bausch Health Companies Inc.)旗下子公司獲得了XIPERE?在美國和加拿大開發及商業化的獨家許可。極目生物于2020年3月與Clearside Biomedical簽署獨家合作協議,獲得了XIPERE?在大中華區(中國大陸,香港,澳門和臺灣)和韓國的開發和商業化權益。XIPERE?在極目生物的項目代號為ARVN001。同年12月,極目生物獲得了中國國家藥品監督管理局藥品審評中心(CDE)對該產品用于治療葡萄膜炎性黃斑水腫的三期臨床試驗申請批準。
XIPERE?目前尚未在任何國家或地區獲批上市。
關于葡萄膜炎性黃斑水腫
葡萄膜炎是一組累及葡萄膜的高致盲性眼部炎癥性疾病。黃斑水腫(ME)是葡萄膜炎患者中最常見并發癥之一,其特征為視網膜中視力最敏銳的區域黃斑出現積液形成水腫。葡萄膜炎性黃斑水腫可繼發于累及眼部任一解剖部位的葡萄膜炎(前,中,后,全葡萄膜炎),也是葡萄膜炎患者視力損失和失明的首要因素。
關于極目生物
極目生物是一家臨床開發階段的眼科生物技術公司,擁有一系列突破性眼科治療技術產品組合。公司的愿景是,通過在中國、亞洲乃至全球提供創新療法,解決眼科疾病領域未滿足的醫療需求。極目生物在頂級生命科學投資方的支持下創立,并由一支擁有在全球及中國研發和商業化眼科產品豐富卓越經驗的行業精英團隊領導管理。有關更多信息,請訪問https://arcticvision.com。
極目生物媒體聯系:
communications@arcticvision.com
拓展閱讀:
1. Clearside Biomedical Announces Resubmission of New Drug Application for XIPERE? for Treatment of Macular Edema Associated with Uveitis
2. 極目生物宣布與 Clearside Biomedical 就 XIPERE?(曲安奈德脈絡膜上腔注射混懸液)達成大中華區和韓國授權許可協議
3. 極目生物獲得國內首個治療UME臨床試驗批件! 脈絡膜上腔給藥注射給患者帶來更多福音
VISION-1研究達到了給藥2小時后獲得3行遠矯近視力(DCNVA)改善的主要終點。最常見的不良反應為輕微結膜充血,僅在約1/5受試者中一過性出現。完整研究結果將在后續的眼科醫學會議上公布。Eyenovia目前正在準備進行第二項3期臨床試驗VISION-2,并計劃未來以這兩項臨床研究為基礎向美國FDA提交新藥上市申請。
極目生物創始人、首席執行官及董事胡海迪博士(Dr. Eddy Wu)表示:“我們為合作伙伴Eyenovia在MicroLine臨床開發上所取得的進展感到驕傲。這款創新產品有望為希望獲得脫鏡自由的老視患者提供一種全新治療選擇。作為Eyenovia值得信賴的合作伙伴,我們祝賀他們取得這一成就,同時也會繼續努力把這款創新產品帶到大中華地區和韓國市場。”
“我們對VISION-1研究的成功感到非常高興,這標志著我們微矩陣藥膜(MAP)技術開發應用的又一個重要里程碑,”Eyenovia首席執行官兼首席醫學官Sean Ianchulev博士說。“未來幾個月,除了VISION-2計劃外,我們還將繼續另外兩款基于MAP技術平臺研制產品的開發,包括為用于擴瞳的MydCombi?在第四季度獲得FDA批準做準備,以及兒童進展性近視的CHAPERONE三期臨床研究入組完成。”
極目生物于2020年8月與Eyenovia簽署獨家合作協議,獲得了MicroLine和MicroPine(用于治療進展性近視,極目生物項目代號ARVN002)在大中華區(中國大陸、中國香港、中國澳門和中國臺灣)及韓國的開發和商業化權益。
關于VISION臨床試驗
VISION系列臨床試驗為3期、雙盲、以安慰劑為對照、交叉設計的優效性臨床試驗,將招募老視患者,主要終點是雙眼遠矯近視力。
關于MicroLine / ARVN003
ARVN003是一款基于Optejet®微量給藥裝置開發的專利匹羅卡品(毛果蕓香堿)微量眼用制劑,用于“按需”改善老視患者近視力。Optejet®可提供高精度微量給藥,給藥量約為傳統滴眼液的1/5,與傳統滴眼液相比更精準、高效、便利。
關于老視(老花眼)
老視無法預防,由于眼內晶狀體隨年齡增長硬化而導致眼聚焦近處物體的能力逐漸下降而發生。全球有近18億人受此困擾[1]。當前的治療措施主要基于器械或手術,如老花鏡、隱形眼鏡、角膜手術及多焦人工晶體植入等。
[1] 世界視覺報告 [World report on vision]。日內瓦:世界衛生組織;2020 年。許可協議:CC BY-NC-SA 3.0 IGO。 |
]]>