維立志博首席醫學官蔡勝利博士表示:"此前LBL-024已經取得了CDE突破性療法認定,用于治療晚期肺外神經內分泌癌,此次再獲FDA孤兒藥資格認定進一步凸顯了 LBL-024 在解決該治療領域臨床治療空白方面的巨大潛力。迄今為止我們的臨床數據非常令人鼓舞,表明 LBL-024 可以顯著改善患有這種極度惡性疾病的患者預后。獲得孤兒藥資格認定的相關政策支持將極大地促進LBL-024的商業化進程,有望改變晚期神經內分泌癌患者無藥可用的困境。"
維立志博創始人、董事長、CEO康小強博士表示:"LBL-024獲得FDA授予的孤兒藥資格認定是我們全球布局的重要里程碑。這不僅意味著LBL-024能夠在研發過程中獲得更多的政策扶持與資源傾斜,加速產品上市進程,讓LBL-024有望成為全球首個靶向4-1BB的治療性抗體藥物,還將為我們在全球范圍內爭取到更多的市場空間和發展機遇。"
關于LBL-024
LBL-024是一種靶向PD-L1與 4-1BB的雙特異性抗體,可通過靶向PD-L1,解除PD-1/PD-L1免疫抑制,同時通過4-1BB共刺激作用,在腫瘤微環境中有效聚集、激活和擴增T細胞,協同增強抗腫瘤的免疫反應。除了具有與PD-1/L1抑制劑相當的廣譜腫瘤治療潛力外,LBL-024獨特的分子設計使其可以有條件地激活4-1BB介導的免疫應答,從而定位腫瘤微環境中的4-1BB激活,減少了長期以來阻礙4-1BB激動劑療法發展的系統性毒性。
LBL-024分別于2021年7月30日和2021年9月9日先后在美國和中國獲批開展臨床研究,現已取得了亮眼的成果。LBL-024單藥治療晚期惡性腫瘤患者的耐受性、安全性、PK及有效性的Ⅰ/Ⅱ臨床研究結果顯示,LBL-024耐受性良好,安全性可控,與當前已批準免疫治療方案比較,未見新的安全性信號。截至目前的臨床數據與現有治療相比,LBL-024單藥治療晚期肺外神經內分泌癌(EP-NEC)的客觀緩解率(ORR)、總生存期(OS)均提高了2倍以上。這項研究由北京腫瘤醫院著名專家沈琳教授牽頭,并在全國多中心開展。基于當前治療現狀及已獲得的顯著臨床療效和良好安全性數據,LBL-024于2024年4月30日獲中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)批準開展單臂關鍵注冊臨床研究,并于2024年10月9日獲CDE突破性治療藥物認定。
關于神經內分泌癌
神經內分泌癌(NEC)是一類分化不良的、高級別的神經內分泌腫瘤(NEN),起源于彌漫性神經內分泌細胞系統,可能存在許多不同的發病部位,其分子特征與神經內分泌瘤(NET)顯著不同。NEC主要可分為肺部NEC和肺外NEC,其中肺部NEC包括小細胞肺癌(SCLC)和肺大細胞神經內分泌癌(p-LCNEC)。根據前期搜集資料測算,在美國,SCLC每年新發病例數約為98,193例,p-LCNEC約為19,639例,肺外NECs約為9,820例。因此,NECs在美國每年新發估計為127,652例,符合FDA對罕見病的定義標準。
NEC的癥狀會因腫瘤的類型、在體內發病的位置和釋放的激素而異。NEC的存活率因癌癥類型和是否擴散而異,具體來說,肺部NECs的5年生存率為5.6%,消化道NECs為13.1%,而其他原發性NECs為26.0%。NEC整體存活率較低,亟需更為有效的新型治療方案。
關于孤兒藥資格認定
孤兒藥是指用于預防、治療、診斷罕見病的藥品。獲得FDA孤兒藥資格認定后,藥物在美國的后續研發及商業化等方面將會享受一系列加速審評及特別扶持政策,包括臨床試驗費用稅收減免、免除新藥申請費用、獲得FDA對臨床研究各階段的特別指導、獲批上市后7年市場獨占權等。
]]>中國南京和加利福尼亞州奧克蘭2024年11月7日 /美通社/ -- 南京維立志博生物科技股份有限公司(以下簡稱"維立志博")與風險投資公司Aditum Bio(以下簡稱"Aditum")宣布基于維立志博全球首創CD19xBCMAxCD3三特異性T細胞銜接器抗體LBL-051成立新藥研發公司Oblenio Bio(以下簡稱"Oblenio")并達成了獨家選擇權及許可協議。Aditum 將為Oblenio提供資金,雙方將合作迅速推進LBL-051進入臨床研究。
CD19和BCMA靶向療法的最新臨床數據已證明其在難治性自身免疫疾病中具有良好的療效,然而,在提升療效和持久緩解方面仍存在未滿足的臨床需求。LBL-051通過同時靶向CD19和BCMA,有望在多種抗體介導的自身免疫性疾病中清除更廣泛的病理性B細胞,從而激發更強效且持久的療效。
LBL-051是應用維立志博自主研發并具有知識產權的技術平臺LeadsBody?開發的新型三特異性T細胞銜接器,其每個靶標CD19、BCMA、CD3的結合域均經過精心設計與優化,以實現療效與安全性的最佳平衡。
根據協議條款,維立志博將授予Oblenio在全球范圍內開發、生產和商業化LBL-051的獨家選擇權和許可,并有權獲得3500萬美元的首付款和近期付款,在達成開發、監管注冊、銷售里程碑事件后,維立志博還將有權獲得最高達5.79億美元的總交易額款項,以及未來產品的銷售分成。此外,維立志博還將有權獲得Oblenio的股權。
維立志博創始人、董事長、CEO康小強博士表示:"LBL-051為某些自身免疫性疾病提供了一種差異化的治療選擇,有望成為"Pipeline in a Product"的革命性藥物,我們很高興能與Aditum 的高水平團隊合作,將這一創新療法帶給全球患者。"
Aditum 聯合創始人兼董事總經理Joe Jimenez表示:"與單靶點療法相比,LBL-051通過同時靶向CD19和BCMA,旨在實現"免疫重置",為自身免疫性疾病患者提供了更深層次的應答和更持久的療效。"
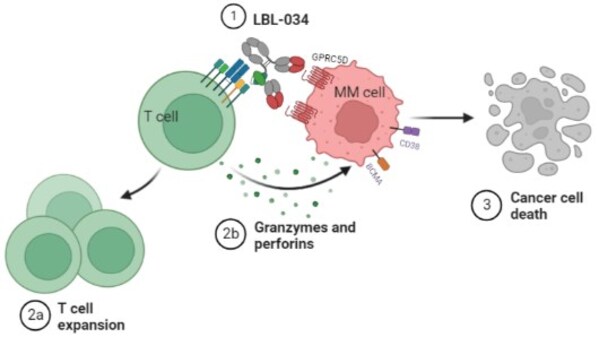
]]>LBL-034是應用維立志博自主研發并具有知識產權的CD3雙抗技術平臺"LeadsBodyTM"開發的新一代靶向GPRC5D及CD3的人源化雙特異性T細胞銜接抗體,是全球第三個進入臨床階段的靶向GPRC5D的CD3 T細胞連接器。LBL-034僅在GPRC5D+細胞存在時選擇性地與T細胞結合,從而在GPRC5D表達的腫瘤微環境中條件性地激活T細胞。在高、中及低GPRC5D表達的細胞中,LBL-034始終表現出優異的靶向腫瘤細胞殺傷作用,以及強大的劑量依賴性抗腫瘤活性,顯示有成為同類抗腫瘤藥最佳選擇的潛力。
LBL-034于2023年7月分別在中國和美國獲準開展臨床研究,并于2023年11月在中國啟動了在復發/難治性多發性骨髓瘤(RRMM)患者中開放標簽、多中心、劑量遞增/擴展的I/II期研究。這項由北京大學人民醫院路瑾教授牽頭、多中心參與的臨床研究展現了良好的安全性和有效性,并將在2024年第66屆美國血液學會年會(ASH)展示其初步臨床數據。
孤兒藥資格認定是FDA對維立志博LBL-034在MM治療領域顯著潛力的高度認可。孤兒藥資格認定是FDA為鼓勵開發罕見病治療藥物而設立的,可為新藥開發提供一系列的激勵措施,包括但不限于:(1)臨床試驗費用的稅收抵免?;(2)FDA對臨床研究各階段的特別指導;(3)免除新藥注冊申請費用;(4)上市后享有7年的市場獨占權。這將有助于加快推進LBL-034在全球的后續臨床開發和上市進程。
維立志博首席醫學官蔡勝利博士表示:"很高興我們在開發新藥造福罕見病患者的道路上取得積極進展。MM目前仍是無法治愈的惡性腫瘤,隨著多線用藥,復發的間隙會越來越短,最終演變為RRMM,嚴重威脅患者的生命健康,開發新的、更有效的治療方案迫在眉睫。LBL-034采用了獨特的分子設計,非臨床研究結果顯示其具有良好的抗腫瘤效果及安全性。我們將加速LBL-034的臨床開發進程,力求早日將安全、有效的治療方案帶給全球MM患者。"
維立志博創始人、董事長、CEO康小強博士表示:"LBL-034是維立志博首個獲得FDA孤兒藥認定的產品,標志著我們在這條充滿挑戰但又意義非凡的道路上邁出了成功的第一步,我們也將以此為契機,進一步優化管線布局,拓寬在生物醫藥領域的探索邊界,為更多未被滿足的醫藥需求提供創新解決方案。"
關于多發性骨髓瘤
多發性骨髓瘤(MM)是一種克隆漿細胞異常增殖引起的惡性漿細胞疾病,約占血液系統惡性腫瘤的10%,約占全部腫瘤性疾病的1%。SEER的最新數據顯示,2021年美國約有MM患者179,000例,符合FDA對罕見病的定義標準。近年來,隨著蛋白酶體抑制劑(PI)、免疫調節藥物(IMiD)、選擇性核輸出抑制劑、CD38靶向抗體、雙特異性抗體和CAR-T細胞療法等成功開發,已顯著改善MM腫瘤反應率和生存預后,但依然存在未滿足臨床需求,根據SEER數據庫,2024年美國預計新發病例約為35,780例,占所有新發癌癥病例的1.8%,預計死亡人數約為12,540人,占所有癌癥死亡人數的2.0%,亟需更有效的治療方案。
]]>百凱醫藥是一家專注于ADC新藥研發的生物技術公司,已成功開發多個具有自主知識產權的ADC(抗體藥物偶聯物)平臺。維立志博是一家立足中美的臨床階段的具有自主知識產權的生物科技公司,聚焦于第二代腫瘤免疫治療抗體新藥的研發和商業化。
維立志博和百凱醫藥分別在抗體新藥研發生產和ADC創新設計與開發領域具有豐富的經驗和專業積累。雙方通過強強聯合將共同開發具有世界領先水平的ADC新藥,旨在為癌癥患者提供更好的治療方法。雙方希望通過這一合作,為患者帶來更多選擇和機會,并提高治療效果。
"我們非常高興能與維立志博展開合作,共同研發ADC新藥,"百凱醫藥的CEO包海峰博士表示,"我們期待通過雙方的協作,加快ADC領域的創新和發展,為患者提供更好的治療選擇。"
維立志博的創始人兼董事長康小強博士也表示:"百凱醫藥具有領先的ADC技術平臺,所開發的項目已在臨床階段。維立志博是臨床階段抗體新藥研發公司,具有多個抗體開發平臺, 雙方的技術具有極強互補性。我深信這是一個雙贏的合作,會極大推動雙方的研發和產品開發能力。"
通過雙方的協作,百凱醫藥和維立志博將在ADC領域取得更多進展,為推動生物醫藥領域的創新和發展不懈努力。
]]>蔡博士是腫瘤領域和轉化醫學領域的臨床科學家、外科醫生,在醫藥行業深耕超過20年,在國際著名科研機構和全球頂尖制藥企業研發部門擁有豐富的工作經歷。成功地建立并領導全球團隊完成了多個腫瘤領域的IND,BLA/NDA申報,包括免疫治療、抗體、抗體偶聯藥物、小分子藥物聯用例如庫潘尼西copanlisib和馬卡替尼capmatinib (INC280) 以及基因/細胞治療。
蔡博士師從北京大學人民醫院院長、中華外科學會主任杜如昱教授,于2000年獲北京大學外科醫學博士學位。 隨后赴美在德克薩斯安德森癌癥中心(UT MD Anderson Cancer Center)開始博士后培訓,師從現任貝勒醫學院精準環境健康中心主任、美國毒理學會前任副主席Dr. Cheryl Walker。蔡博士在科學和藥物開發方面的成就多次獲得了美國癌癥研究協會(AACR)年會獎,美國國家科學院院刊Cozzarelli獎,和拜耳(Bayer)公司最佳績效獎等學術和行業獎項。
加入維立志博前,蔡博士曾任恒瑞(美國)副總裁,負責全球腫瘤項目的臨床開發。在此之前,蔡博士先后在德國拜耳(Bayer)全球腫瘤臨床開發部、日本第一三共公司(Daiichi-Sankyo)、瑞士諾華(Novartis)腫瘤和美國Intrexon Corporation擔任臨床研發項目負責人。
維立志博創始人、董事長、CEO康小強博士表示:"我們非常榮幸能夠邀請到蔡博士加盟維立志博,公司全體員工熱烈歡迎蔡博士的加入。蔡博士具有豐富的臨床經驗、卓越的科研能力以及深厚的醫學背景。維立志博目前有5個項目在臨床I-II期,值此臨床開發的關鍵階段,蔡博士的加入極大程度上提高了公司臨床開發的能力和效率,也對公司的新藥研發和創新戰略實施起到關鍵性作用。我們期待與蔡博士共同努力,針對臨床需求,推動創新藥盡早惠及患者,把公司打造成國際一流的生物制藥公司。"
維立志博首席醫學官蔡勝利博士表示:"我非常高興加入維立志博擔任首席醫學官!這將是一次非常有趣的旅程。維立志博擁有良好的技術平臺,充滿活力和創新精神。我將與我的同道以解決腫瘤的醫藥需求為使命,以科學為指導,以戰略性,前瞻性和創新性的設計重點突破,合作開發,為人類健康做出貢獻。我期待在這個過程中迎接挑戰,并和我的同事通力合作,開發出創新的治療方案, 為那些在絕望和痛苦中掙扎的病人帶來生的希望!"
]]>維立志博是一家臨床階段的生物制藥公司。公司專注創新型抗體藥和融合蛋白藥物研發,聚焦新型癌癥免疫治療新藥研發及產業化,已經擁有十余個在研管線,包括免疫治療、靶向治療和雙特異性抗體。公司目前已有多個產品進入臨床,其中LBL-007(LAG-3單抗)項目已完成臨床Ia期驗證藥物安全性,并取得初步有效性臨床數據并已啟動與PD-1單抗聯合用藥的臨床Ib/II期試驗,另外LBL-003(TIM-3單抗)項目、LBL-015(PD-1/TGFβ雙抗)項目、LBL-024(PD-L1/4-1BB雙抗)項目均獲得美國FDA、NMPA臨床試驗許可,即將開展臨床研究。本輪融資資金將主要用于加速推進現已進入臨床階段抗體新藥項目的臨床試驗,以及其他項目早期研發及臨床前研究、江北7000平方米中試基地的建設。
“非常感謝新老投資人對我們的信任和支持。維立志博的創新研發能力、CMC開發能力及臨床開發能力獲得了國內外頂尖投資機構的認可。本輪融資將幫助我們加快推進產品管線的臨床開發,同時也為公司后續項目臨床前研究、為公司團隊建設提供了有力保障。”維立志博公司創始人、董事長康小強博士表示,“維立志博一直以來秉承著‘科學驅動,自主研發,以患者為中心’的理念,解決未滿足的臨床需求問題。我堅信維立志博獨特的產品管線、臨床開發策略和強勁的執行力,將為廣大腫瘤患者提供更有效的治療方案”。
維立志博此次融資領投方正心谷資本合伙人謝榕剛表示:“腫瘤免疫領域近幾年來進展迅猛,但以PD-1/L1為代表的第一代腫瘤免疫產品只對一部分腫瘤響應,臨床上仍存在巨大的未滿足需求。維立志博是一家平臺型的腫瘤免疫研發企業,具有創新程度很高的雙抗和新靶點單抗的研發管線,部分產品在中國乃至全球范圍內處于領先地位。在創始人康小強博士的領導下,團隊兼具強大的研發創新能力、臨床執行力和對外合作能力。我們期待維立志博在本輪融資后加快研發進展,正心谷也將持續支持公司的發展。”
]]>