KX-826治療男性脫發的中國II期臨床研究是由北京大學人民醫院張建中教授和復旦大學附屬華山醫院楊勤萍教授擔任主要研究者(leading PIs)。KX-826的最新詳細數據展示了其具有良好的有效性和安全性。
口頭報告要點
Efficacy and Safety of Topical KX-826 in Chinese Adult Male with Androgenetic Alopecia: Results of a Randomized, Double-blind, Placebo-controlled, Multi-center, Phase II Study
外用KX-826治療中國成年男性脫發的有效性和安全性:一項隨機、雙盲、安慰劑對照、多中心II期研究結果
時間:2023年10月12日9:30(歐洲中部夏令時間),即北京時間2023年10月12日15:30
報告人:北京大學人民醫院張建中教授
摘要編號:5712
雄激素性脫發作為皮膚科最常見的疾病之一,仍然是今年EADV年會的關注焦點。雄激素性脫發(AGA),又稱為脂溢性脫發,是一種常見的脫發性疾病,占整體脫發90%以上。男女均可罹患,但脫發模式和患病率不同。如今,脫發人群日益增多,脫發已然成為全球性的"難題"。根據第六屆亞洲毛發移植大會發布的數據,全球脫發患者高達20億,中國占據2.5億。而現有的治療藥物有限,廣大脫發群體急需更加安全有效的藥物解決脫發煩惱和改善生活質量。
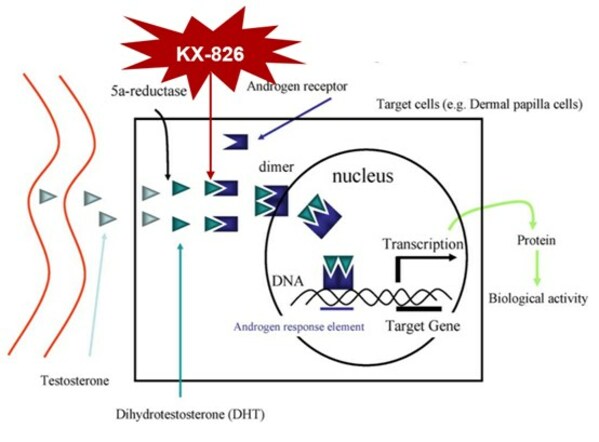
KX-826是開拓藥業自主研發的一款外用雄激素受體(AR)拮抗劑,是全球首個進入注冊性III期臨床試驗的用于脫發治療的AR拮抗劑。KX-826是通過與二氫睪酮(DHT)競爭與AR的結合,從而局部阻斷雄激素介導的信號傳遞,以限制毛囊的微型化,并促進末梢毛發的生長。KX-826達到循環系統后迅速代謝為失活代謝物,對全身AR信號通路的影響較小,安全性良好。
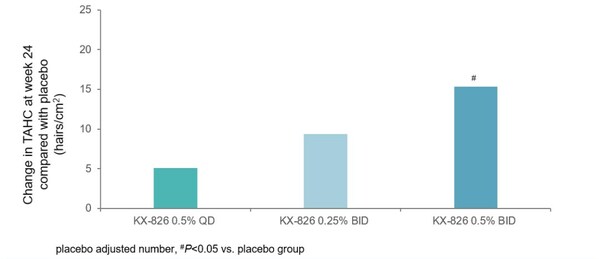
- 該項在中國開展的II期臨床試驗是一項多中心、隨機、雙盲、安慰劑對照的臨床研究,旨在評價KX-826治療成年男性脫發的有效性和安全性。試驗共納入120名符合Hamilton-Norwood分級IIIv到V的男性脫發受試者。其中,90名受試者被隨機分配至KX-826 0.25%濃度每日兩次(BID)組、KX-826 0.5%濃度每日一次(QD)組和KX-826 0.5%濃度BID組,其余30名受試者被隨機分配至安慰劑組(QD組和BID組)。試驗的主要終點為治療24周與安慰劑相比目標區域內非毳毛數量(TAHC)較基線的平均變化。
- 經過24周的治療,KX-826 0.5%濃度BID組在目標區域內非毳毛數量呈現明顯的改善。與基線相比,每平方厘米增加22.73根(P<0.001)。與安慰劑組相比,每平方厘米增加15.34根(P=0.024)。KX-826 0.5%濃度BID為男性脫發中國III期臨床試驗的推薦給藥劑量。
- KX-826的整體安全性良好可控。未發生嚴重不良事件(SAE)、不良藥物反應(ADR)及死亡。局部外用14天后,KX-826的全身性暴露量及其體內代謝物達到穩態,各劑量組在血液的藥物濃度較低。
- KX-826對于男性脫發治療具有良好的療效和安全性,是一種潛在的創新治療新選擇。目前,KX-826正在進行或計劃進行5項III期臨床試驗(2項在中國,3項在美國)。其中,KX-826治療男性脫發的中國III期臨床試驗已完成最后一例受試者末次訪視(LPLV),公司正在全力推進該項臨床試驗的數據整理、鎖庫揭盲以及數據統計分析工作。
三項壁報展示
除了上述口頭報告外,開拓藥業的KX-826治療女性脫發的中國II期臨床研究、GT20029治療脫發和痤瘡的中國I期臨床研究以及GT20029治療脫發和痤瘡的美國I期臨床研究的結果也以壁報(E-poster)形式亮相本屆EADV年會。
壁報一:Efficacy and Safety of Different Doses of Topical KX-826 on Female Pattern Hair Loss: Results of a Randomized, Double-blind, Placebo-controlled, Multi-center, Phase II Study
不同劑量外用KX-826治療女性脫發的有效性和安全性:一項隨機、雙盲、安慰劑對照、多中心II期研究結果
摘要編號:690
壁報編號:P1622
壁報二:Safety, Tolerability and Pharmacokinetics (PK) of GT20029 Following Topical Single Ascending Dose (SAD) Administration in Healthy Volunteers and Multiple Ascending Dose (MAD) Administration in Subjects with Androgenetic Alopecia (AGA) or Acne
GT20029在健康受試者局部單次遞增劑量(SAD)和雄激素性脫發(AGA)或痤瘡患者局部多次遞增劑量(MAD)給藥后的安全性、耐受性和藥代動力學(PK)
摘要編號:5710
壁報編號:P2745
壁報三:Safety and Pharmacokinetics of GT20029 Gel and GT20029 Solution in Healthy Subjects
GT20029凝膠和GT20029酊在健康受試者中的安全性和藥代動力學
摘要編號:5711
壁報編號:P2746
開拓藥業的KX-826和GT20029此次登上EADV國際權威學術會議的舞臺,標志著公司的創新能力以及脫發和痤瘡產品管線的潛力在國際行業范圍內獲得認可。
]]>在2023年美國皮膚病學會年會上,美國Bosley集團總裁兼首席醫療官、紐約大學格羅斯曼醫學院Ronald O. Perelman皮膚科臨床助理教授Ken Washenik博士在題為"外用雄激素調節劑在雄激素性脫發中的新興潛力"演講中分享了福瑞他恩和GT20029治療雄激素性脫發的作用機制和研究數據。Ken Washenik博士強調外用雄激素受體調節劑在雄激素性脫發中的新興潛力。他表示,有效且安全的外用雄激素受體拮抗劑的治療潛力值得期待。
此外,美國德克薩斯大學休斯頓健康科學中心麥戈文醫學院兒科皮膚科主任Adelaide Hebert博士在題為"痤瘡中涉及雄激素的局部治療作用:現有和未來的治療方法"演講中分享了福瑞他恩治療痤瘡的作用機制和試驗設計。Adelaide Hebert博士表示,雄激素和雄激素受體在痤瘡發病機制中起著關鍵作用,是重要的治療靶點。
福瑞他恩是開拓藥業在研的一款外用雄激素受體(AR)拮抗劑。福瑞他恩治療雄激素性脫發的作用機制是通過與二氫睪酮(DHT)競爭局部阻斷雄激素介導的信號,限制毛囊的微型化,并促進末梢毛發的生長。福瑞他恩達到循環系統后迅速代謝為失活代謝物,對全身AR信號通路的影響最小,安全性良好。福瑞他恩治療男性雄激素性脫發中國II期臨床試驗結果顯示,治療24周后,5mg(0.5%濃度)每日兩次(BID)福瑞他恩組非毳毛數量(TAHC)較安慰劑組顯著增加15.34根/平方厘米,且具有統計學差異(P=0.024)。目前福瑞他恩針對男性雄激素性脫發的中國III期臨床試驗和美國II期臨床試驗正在進行,計劃開展針對女性雄激素性脫發中國III期臨床試驗以及針對男女性雄激素脫發的全球多中心III期臨床試驗。
福瑞他恩治療痤瘡的作用機制是與DHT競爭結合AR,抑制基因表達,從而減少皮脂產生和炎癥。目前福瑞他恩正在中國開展治療痤瘡的II期臨床試驗,已于2022年10月完成所有受試者入組。
GT20029是開拓藥業在研的一款外用AR-PROTAC。臨床前研究顯示,GT20029通過降解AR蛋白,能夠有效阻斷AR信號通路激活導致的毛囊萎縮微型化作用,抑制毛發變細、變軟和脫落,同時能夠有效抑制皮脂腺發育和皮脂分泌。GT20029可以減少全身藥物暴露,以達到更好的安全性。GT20029治療雄激素性脫發和痤瘡的中國、美國I期臨床試驗已完成。
關于開拓藥業
開拓藥業成立于2009年,專注發展潛在"best-in-class"和"first-in-class"創新藥物的研發及產業化,致力成為創新療法研究、開發及商業化的領軍企業。公司經過多年的發展,以雄激素受體(AR)相關疾病為核心,研發多通道產品組合,產品覆蓋全球高發病率癌癥及其它未滿足臨床需求的疾病領域,包括新冠、前列腺癌、脫發、痤瘡、肝癌和乳腺癌等。開拓藥業前瞻性布局了包含小分子創新藥、生物創新藥及聯合療法的多元化產品管線,包括7款正在開展臨床研究的產品,如兩款雄激素受體(AR)拮抗劑、AR-PROTAC化合物、ALK-1單抗、Hedgehog抑制劑、mTOR激酶靶向抑制劑和PD-L1/TGFβ雙靶點抗體,以及正在進行臨床前研究的ALK-1/VEGF雙抗和c-Myc抑制劑等。公司在全球擁有已獲得及申請中的110多項專利,多個項目被列為國家十二五、十三五"重大新藥創制"專項。2020年5月22日,開拓藥業正式在香港聯合交易所有限公司主板掛牌上市,股票代碼:9939.HK。歡迎訪問公司網站:www.kintor.com.cn
滬深港通為香港聯合交易所和上海證券交易所、深圳證券交易所的合作計劃,使香港和內地投資者可以通過本地交易所的交易和結算系統來交易對方市場的證券。2023年3月3日,港交所公告,自2023年3月13日起,互聯互通股票標的范圍將進一步擴大。此次滬深港通南北向交易股票范圍的同時擴容,是互聯互通機制不斷發展和優化的又一重要里程碑,將進一步加強兩地資本市場聯系,推動資本市場雙向開放水平。開拓藥業作為本次新增調入滬港通下港股通的生物科技企業,充分展示出專業機構、資本市場對公司投資價值的認同,以及對公司創新實力和未來發展前景的看好。此次公司股票獲納入滬港通下港股通,將進一步擴大公司內地投資者的基礎,持續提升公司股票的流動性和市場影響力。展望未來,公司將繼續發揮研發優勢,加速推進現有產品管線臨床開發和合作,期待通過公司長期可持續的發展,不斷為社會、患者、員工和投資者創造價值。
關于開拓藥業
開拓藥業成立于2009年,專注發展潛在“best-in-class”和“first-in-class”創新藥物的研發及產業化,致力成為創新療法研究、開發及商業化的領軍企業。公司經過多年的發展,以雄激素受體(AR)相關疾病為核心,研發多通道產品組合,產品覆蓋全球高發病率癌癥及其它未滿足臨床需求的疾病領域,包括新冠、前列腺癌、脫發、痤瘡、肝癌和乳腺癌等。開拓藥業前瞻性布局了包含小分子創新藥、生物創新藥及聯合療法的多元化產品管線,包括7款正在開展臨床研究的產品,如兩款雄激素受體(AR)拮抗劑、AR-PROTAC化合物、ALK-1單抗、Hedgehog抑制劑、mTOR激酶靶向抑制劑和PD-L1/TGFβ雙靶點抗體,以及正在進行臨床前研究的ALK-1/VEGF雙抗和c-Myc抑制劑等。公司在全球擁有已獲得及申請中的110多項專利,多個項目被列為國家十二五、十三五“重大新藥創制”專項。2020年5月22日,開拓藥業正式在香港聯合交易所有限公司主板掛牌上市,股票代碼:9939.HK。歡迎訪問公司網站:www.kintor.com.cn
開拓藥業創始人、董事長兼首席執行官童友之博士表示:“2020年,面對新冠疫情引發的全球公共衛生危機,開拓藥業全員上下齊心、迎難而上,在項目研發、臨床運營、上市融資和商業合作等多方面均取得突破。5月22日,公司嶄新亮相資本市場,正式在香港聯交所主板掛牌上市,融資規模約為2.4億美元,為公司的長遠發展注入全新動力。
全球新冠疫情肆虐之下,公司新藥普克魯胺拓展新冠適應癥,發現其對于治療輕中癥、重癥、危重癥新冠患者均有突出的療效,其中輕中癥新冠男性患者住院率降低100%,女性患者住院率降低90%;重癥住院患者的死亡率降低92%,住院天數縮短9天。普克魯胺治療輕中癥男性患者的III期臨床試驗已獲得美國食品藥品監督管理局(FDA)批準。此外,公司的ALK-1單克隆抗體(GT90001)與Nivolumab聯合用于治療轉移性肝細胞癌(HCC)的中國臺灣II期臨床試驗結果良好,顯示客觀緩解率(ORR)為40%。ALK-1單抗與Nivolumab聯合用藥二線治療HCC的II期臨床試驗已獲FDA批準,前景樂觀。
2020年,公司與6家公司建立起合作伙伴關系,其中包括獲得美國Gensun公司的雙靶點抗體PD-L1/TGF-β在大中華區研發和商業化的獨家許可,深入布局生物藥單抗和雙抗領域;與康寧杰瑞達成合作,共同推進ALK-1單抗聯合重組人源化PD-L1/CTLA-4雙特異性抗體KN046治療肝細胞癌等腫瘤在全球范圍內的臨床研究等。8月,開拓藥業第一個GMP工廠正式投入運營,為公司的產業化提供保障。
面對新冠疫情,開拓藥業作為中國創新藥研發企業,深感肩上責任之重,也非常欣慰地看到團隊歷時十年辛勤耕耘開發的普克魯胺能夠在新冠治療的臨床試驗中取得如此顯著的療效,同時非常高興美國FDA同意普克魯胺開展治療輕中癥新冠男性患者的III期臨床試驗,這是開拓藥業成立以來首個獲得美國FDA批準的III期臨床試驗。展望2021年,公司將全力推進普克魯胺新冠適應癥的商業化進程,早日使之成為臨床上使用的全方位的有效安全的新冠治療藥物,為新冠抗疫斗爭貢獻力量。未來,公司將繼續保持研發優勢,加速推進現有產品管線全球臨床開發進度,持續加強國際/國內合作,踐行‘專注于大量未獲滿足臨床需求的適應癥研究、開發及商業化’的使命,造福更多的患者,為股東創造長遠的價值,并實現公司的可持續發展。”
近期業務發展亮點
產品管線進展
公司目前擁有6款正在開展臨床研究的產品,各產品管線進展順利,多項臨床試驗取得重要進展:
普克魯胺(GT0918,AR拮抗劑),新一代AR拮抗劑
新冠(巴西和美國):2020年7月,公司與美國Applied Biology公司簽訂臨床試驗研究協議,在巴西合作開展普克魯胺治療新冠的臨床研究。2021年1月7日,公司公布普克魯胺治療輕中癥新冠男性患者試驗的最終臨床研究結果,顯示普克魯胺可顯著地阻止男性患者病情由輕癥向重癥惡化,住院率發生風險降低了100%,且短期服用安全性良好。2021年1月10日,公司公布的另一組數據顯示,普克魯胺對輕中癥新冠女性患者病情由輕癥向重癥惡化亦有顯著抑制效果,住院率發生風險降低了90%。2021年1月28日,巴西機構審查委員會(IRB)批準普克魯胺治療新冠重癥患者的臨床試驗,并予以醫療資源分配方面提供支持。2021年3月11日,公司公布普克魯胺治療新冠重癥患者臨床研究結果,采用普克魯胺治療的患者死亡率較控制組顯著下降92%,住院天數縮短了9天。2021年3月4日,FDA同意普克魯胺在美國開展治療輕中癥新冠男性的III期臨床試驗。
轉移性去勢抵抗性前列腺癌(中國):正在開展普克魯胺作為轉移性去勢抵抗性前列腺癌(mCRPC)二線療法、普克魯胺和阿比特龍聯用作為一線療法的兩項III期臨床試驗。普克魯胺單藥的III期臨床試驗于2020年8月4日完成患者招募。2021年2月,公司在ASCO GU大會上公布了普克魯胺單藥治療前列腺癌的中國II期臨床試驗數據。
轉移性去勢抵抗性前列腺癌(美國):2020年7月16日,美國II期臨床試驗完成患者招募,已完成的臨床研究結果顯示,普克魯胺在曾經接受恩扎盧胺及阿比特龍等現有藥物治療進展的mCRPC患者中普遍具有良好的安全性和有效性。2021年2月,公司在ASCO GU大會上公布普克魯胺治療前列腺癌的美國II期臨床試驗中期數據。
AR+轉移性乳腺癌(中國):正在中國開展開放、多中心的Ic期臨床試驗,以評估普克魯胺聯合依西美坦、來曲唑及氟維司群對AR+轉移性乳腺癌(mBC)患者的安全性、藥物動力學分析及初步療效。
預期里程碑
推進普克魯胺新冠適應癥的商業化進程。
推進普克魯胺治療mCRPC的單藥及與阿比特龍聯用在2021年底遞交上市申請。
福瑞他恩(KX-826),外用AR拮抗劑
雄激素性脫發(中國):2020年9月17日,公司福瑞他恩凝膠劑型針對雄激素性脫發適應癥的新藥研究申請獲得中國國家藥品監督管理局批準。2020年12月29日,已完成在中國開展的福瑞他恩II期臨床試驗的患者招募。
雄激素性脫發(美國):2020年8月,公司已在美國完成福瑞他恩Ib期臨床試驗,正在進行試驗數據的分析和評估。
痤瘡(中國):2020年9月17日,公司福瑞他恩凝膠劑型針對痤瘡適應癥的新藥研究申請獲得中國國家藥品監督管理局批準。
預期里程碑
于2021年第三季度完成福瑞他恩在中國針對雄激素性脫發II期臨床研究報告并發布數據。
于2021年上半年完成福瑞他恩在美國針對雄激素性脫發的Ib期臨床研究報告并發布數據。
于2021年第二季度初完成福瑞他恩在中國針對痤瘡的I期臨床試驗首例受試者入組,該I期臨床試驗預計將于2021年完成。
ALK-1(GT90001),新型抗血管生成抑制劑
轉移性肝細胞癌(中國臺灣):公司正在中國臺灣開展ALK-1單抗與Nivolumab聯合用于治療轉移性肝細胞癌的II期臨床試驗。2021年1月,公司在ASCO GI上公布ALK-1單抗與Nivolumab聯合二線治療轉移性肝細胞癌的臺灣臨床試驗數據,結果顯示客觀緩解率為40%,且安全性良好。
轉移性肝細胞癌(美國):2021年2月11日,美國FDA批準ALK-1單抗聯合Nivolumab用于二線治療晚期肝細胞癌II期臨床試驗。
迪拓賽替(GT0486),PI3K/mTOR信號途徑抑制劑
轉移性實體瘤(中國):已于2019年8月獲得中國的IND批準,迪拓賽替是第二代 mTOR抑制劑,可同時抑制 mTORC1和 mTORC2,目前正處于I期臨床試驗劑量爬坡階段。
預期里程碑
于2021年完成GT0486在中國的I期臨床試驗。
GT1708F(Hedgehog/SMO抑制劑),hedgehog信號轉導途徑抑制劑
白血病和基底細胞癌(中國):已于2020年2月獲得中國的IND批準,目前正處于I期臨床試驗劑量爬坡階段。
基底細胞癌(美國):2020年11月獲得美國FDA的受理,用于基底細胞癌適應癥。
預期里程碑
于2021年完成GT1708F在中國針對白血病的I期臨床試驗。
GT20029,PROTAC-AR降解劑
雄激素性脫發和痤瘡(中國):已于2021年2月IND獲CDE受理,用于雄激素性脫發和痤瘡的治療,是全球首個基于PROTAC技術開發的外用AR降解劑。
預期里程碑
于2021年啟動GT20029在中國的I期臨床試驗。
除上述臨床階段在研藥物之外,公司正在開發多款臨床前階段藥物,包括用于治療血癌的c-Myc抑制劑和治療多種實體瘤的PD-L1/TGF-β雙靶點抗體等。
生產基地
蘇州:公司的第一個GMP工廠位于江蘇省蘇州市工業園區淞北路20號,占地約2萬平方米,于2020年8月正式運營,用于普克魯胺商業化生產和福瑞他恩臨床藥品的生產。2020年11月,工廠獲得《藥品生產許可證》。
平湖:位于浙江省平湖縣的原料藥和制劑生產基地項目,約占地4萬平方米。項目設計已經啟動,預計2021年第三季度開工,2022年年底前完成建設。
商業化合作
福瑞他恩商業化合作
2020年6月,公司與京東健康簽署戰略合作框架協議,雙方就福瑞他恩在京東健康運營的線上藥品零售平臺京東大藥房的營銷展開深入合作。
2020年3月,公司與國藥控股股份有限公司簽署了合作協議,將在產品設計、商業渠道拓展、終端服務等方面開展全方位合作。
與康寧杰瑞合作
2020年7月,公司與康寧杰瑞達成合作,共同推進ALK-1單抗聯合重組人源化PD-L1/CTLA-4雙特異性抗體KN046治療肝細胞癌等腫瘤在全球范圍內的臨床研究。
與美國Gensun合作
2020年8月,公司與美國 Gensun公司就PD-L1/ TGF-β雙靶點抗體GS19簽署獨家許可協議,開拓藥業獲得GS19在大中華區進行臨床開發及商業化的獨家權利。
與邁百瑞合作
2020年9月,公司與邁百瑞國際生物醫藥有限公司簽署戰略合作協議,雙方就生物大分子藥物的研發與生產展開全方位合作。
與普米斯合作
2020年10月,公司與普米斯生物技術(珠海)有限公司就生物藥開發達成戰略合作協議。
全球化布局
*新設北京子公司:臨床及政府事務
*新設廣東子公司:大分子研發及生產基地
2020年全年財務業績
截至2020年12月31日,公司的研發成本由截至2019年12月31日止十二個月的人民幣214百萬元增加人民幣114.8百萬元或53.6%至截至2020年12月31日止十二個月的人民幣328.8百萬元。研發開支增加的主要原因是公司持續加大研發投入,產品管線的多項臨床試驗已推進到后期,即將遞交上市申請;此外,公司還擴大研發和臨床運營人員的規模,以及股權激勵計劃支出。
截至2019年12月31日,公司的現金及現金等價物為人民幣195.5百萬元,截至2020年12月31日為人民幣1389.0百萬元,增加人民幣1193.5百萬元,該增加主要來自于IPO募集資金和銀行貸款。
截至2020年12月31日,我們的已動用銀行融資為人民幣218.5百萬元,未動用銀行融資為人民幣101.0百萬元。
關于開拓藥業
開拓藥業成立于2009年,專注發展潛在“best-in-class”和“first-in-class”創新藥物的研發及產業化,致力成為創新療法研究、開發及商業化的領軍企業。公司經過多年的發展,以雄激素受體(AR)相關疾病為核心,研發多通道產品組合,產品覆蓋全球高發病率癌癥及其它未滿足臨床需求的疾病領域,包括新冠肺炎、前列腺癌、乳腺癌、肝癌、脫發和痤瘡等。開拓藥業前瞻性布局了包含小分子創新藥、生物創新藥及聯合療法的多元化產品管線,包括6款正在開展臨床研究的產品雄激素受體(AR)拮抗劑、ALK-1單抗、mTOR激酶靶向抑制劑、Hedgehog抑制劑和AR-Degrader,以及正在進行臨床前研究的PD-L1/TGF-β雙靶點抗體和c-Myc抑制劑等。公司在全球擁有已獲得及申請中的60多項專利,多個項目被列為國家十二五、十三五“重大新藥創制”專項。2020年5月22日,開拓藥業正式在香港聯合交易所有限公司主板掛牌上市,股票代碼:9939.HK。歡迎訪問公司網站:www.kintor.com.cn