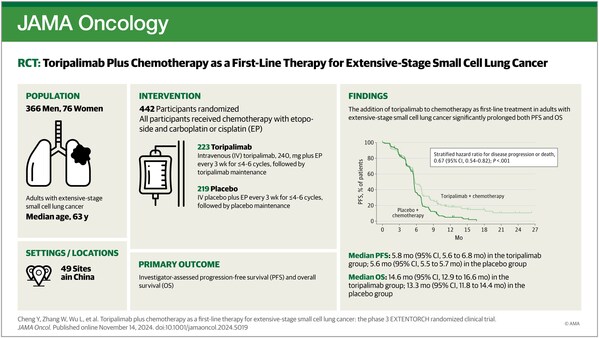
EXTENTORCH研究(NCT04012606)是一項多中心、隨機、雙盲、安慰劑對照的III期臨床研究,旨在比較特瑞普利單抗或安慰劑聯合依托泊苷及鉑類一線治療ES-SCLC的有效性和安全性。
EXTENTORCH研究主要研究者,吉林省腫瘤醫院程穎教授表示:"EXTENTORCH研究作為ES-SCLC領域全球首個成功達到預設雙主要研究終點陽性結果的抗PD-1單抗的Ⅲ期臨床研究,是ES-SCLC治療的又一次關鍵突破。 試驗組1年PFS率提升近4倍,所有亞組患者均有獲益,主要終點之一的OS取得陽性結果,成功通過了臨床‘金標準’的考核,為患者帶來確切生存獲益。本次EXTENTORCH研究見刊不僅公布了特瑞普利單抗聯合化療一線治療ES-SCLC的療效數據,更重要的是,這項研究進行了分子層面的探索,對篩選接受免疫治療的患者具有重要的指導意義。"
2023年5月,EXTENTORCH研究主要終點無進展生存期(PFS)和總生存期(OS)均達到方案預設的優效邊界,特瑞普利單抗由此成為全球首個在ES-SCLC一線治療III期研究中取得預設雙重主要終點陽性結果的PD-1抑制劑。
2024年6月,基于該研究的積極結果,特瑞普利單抗獲國家藥品監督管理局(NMPA)正式批準聯合依托泊苷和鉑類用于ES-SCLC一線治療,并獲中國臨床腫瘤學會(CSCO)兩大指南推薦為ES-SCLC一線治療優選方案,為中國ES-SCLC患者提供了治療新選擇。
此前,EXTENTORCH研究以口頭報告的形式在2023年ESMO大會上首次公布了研究數據,此次全文發表于國際期刊,彰顯了國際學者對這項研究及特瑞普利單抗的肯定,結果顯示:
- 與單純化療相比,特瑞普利單抗聯合化療顯著改善患者PFS和OS,將疾病進展或死亡風險降低33%(HR=0.67;95% CI, 0.54-0.82),死亡風險降低了20%(HR=0.80;95% CI, 0.65-0.98)。亞組分析顯示,所有關鍵亞組均顯示出一致的PFS和OS獲益。
- 生物標志物探索分析顯示,在特瑞普利單抗聯合化療組中,具有低腫瘤內異質性(ITH),HLA-A11+ HLA-B62-單倍型,KMT2D 和COL4A4野生型,或CTNNA2/SCN4A序列變異的患者的臨床獲益更明顯。
- 特瑞普利單抗聯合化療的安全性良好,未發現新的安全信號。兩組在治療期間出現的不良事件(TEAE,99.5%vs100%)和≥3級TEAE(89.6%vs89.4%)的發生率相似。
君實生物總經理兼首席執行官鄒建軍博士表示: “此次EXTENTORCH的重磅研究成果獲得《美國醫學會雜志·腫瘤學》發表,體現了國際學術界對以特瑞普利單抗為代表的免疫治療在ES-SCLC患者一線治療中的價值認可。肺癌一直是公司重點關注的疾病領域,截至目前,特瑞普利單抗已成功獲批包括非小細胞肺癌(NSCLC)和小細胞肺癌(SCLC)在內的3項適應癥,覆蓋了早中期(圍手術期)至晚期人群,管線內也還有其他產品正處于攻關階段,我們會積極推進相關工作,期待能為全球肺癌患者帶來更多更優的創新方案。"
1. 本材料旨在傳遞前沿信息,無意向您做任何產品的推廣,不作為臨床用藥指導。
2. 若您想了解具體疾病診療信息,請遵從醫療衛生專業人士的意見與指導。
關于EXTENTORCH研究
EXTENTORCH研究(NCT04012606)是一項多中心、隨機、雙盲、安慰劑對照的III期臨床研究,旨在比較特瑞普利單抗或安慰劑聯合依托泊苷及鉑類一線治療ES-SCLC的有效性和安全性。研究納入既往未接受系統治療的ES-SCLC患者,以1:1的比例隨機接受特瑞普利單抗(240mg, Q3W)或安慰劑聯合依托泊苷(100mg/m2, Q3W)和鉑類(順鉑 75 mg/m2或卡鉑 AUC 5 mg/mL/min, Q3W)治療4~6個周期,之后接受特瑞普利單抗或安慰劑維持治療,直至疾病進展、出現不可耐受的毒性或完成2年治療。研究分層因素包括性別和基線ECOG體能狀況評分。主要終點為研究者根據RECIST v1.1評估的PFS和OS。次要終點包括盲態獨立中心審查(BICR)評估的PFS、客觀緩解率(ORR)、疾病控制率(DCR)、疾病緩解率(DOR)和安全性等。探索性終點包括PD-L1的表達、腫瘤突變負荷(TMB)和其他基于測序的與臨床療效相關的生物標志物。
自2019年9月至2021年5月,研究共納入442例ES-SCLC患者,隨機分配至特瑞普利單抗聯合化療組(n=223)或安慰劑聯合化療組(n=219)。該研究由程穎教授擔任主要研究者,在全國49家臨床中心聯合開展。
關于特瑞普利單抗注射液(拓益®)
特瑞普利單抗注射液(拓益®)作為我國批準上市的首個國產以PD-1為靶點的單抗藥物,獲得國家科技重大專項項目支持,并榮膺國家專利領域最高獎項"中國專利金獎"。
特瑞普利單抗至今已在全球(包括中國、美國、東南亞及歐洲等地)開展了覆蓋超過15個適應癥的40多項由公司發起的臨床研究。正在進行或已完成的關鍵注冊臨床研究在多個瘤種范圍內評估特瑞普利單抗的安全性及療效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、腎癌及皮膚癌等。
截至目前,特瑞普利單抗已在中國內地獲批10項適應癥:用于既往接受全身系統治療失敗的不可切除或轉移性黑色素瘤的治療(2018年12月);用于既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療(2021年2月);用于含鉑化療失敗包括新輔助或輔助化療12個月內進展的局部晚期或轉移性尿路上皮癌的治療(2021年4月);聯合順鉑和吉西他濱用于局部復發或轉移性鼻咽癌患者的一線治療(2021年11月);聯合紫杉醇和順鉑用于不可切除局部晚期/復發或遠處轉移性食管鱗癌患者的一線治療(2022年5月);聯合培美曲塞和鉑類用于表皮生長因子受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性、不可手術切除的局部晚期或轉移性非鱗狀非小細胞肺癌的一線治療(2022年9月);聯合化療圍手術期治療,繼之本品單藥作為輔助治療,用于可切除IIIA-IIIB期非小細胞肺癌的成人患者(2023年12月);聯合阿昔替尼用于中高危的不可切除或轉移性腎細胞癌患者的一線治療(2024年4月);聯合依托泊苷和鉑類用于廣泛期小細胞肺癌一線治療(2024年6月);聯合注射用紫杉醇(白蛋白結合型)用于經充分驗證的檢測評估PD-L1陽性(CPS≥1)的復發或轉移性三陰性乳腺癌的一線治療(2024年6月)。2020年12月,特瑞普利單抗首次通過國家醫保談判,目前已有6項獲批適應癥納入《國家醫保目錄(2023年)》,是目錄中唯一用于治療黑色素瘤的抗PD-1單抗藥物。2024年10月,特瑞普利單抗用于復發/轉移性鼻咽癌治療的適應癥在中國香港獲批。
在國際化布局方面,特瑞普利單抗已作為首款鼻咽癌藥物在美國和印度獲批上市,其用于晚期鼻咽癌和食管鱗癌的一線治療獲得歐盟委員會批準上市。此外,英國藥品和保健品管理局(MHRA)受理了特瑞普利單抗聯合順鉑和吉西他濱用于局部復發或轉移性鼻咽癌患者的一線治療以及聯合紫杉醇和順鉑用于不可切除局部晚期/復發或轉移性食管鱗癌患者的一線治療的上市許可申請,澳大利亞藥品管理局(TGA)和新加坡衛生科學局(HSA)分別受理了特瑞普利單抗聯合順鉑/吉西他濱作為轉移性或復發性局部晚期鼻咽癌成人患者的一線治療,以及作為單藥治療既往含鉑治療過程中或治療后疾病進展的復發性、不可切除或轉移性鼻咽癌的成人患者的上市許可申請。
關于君實生物
君實生物(688180.SH, 1877.HK)成立于2012年12月,是一家以創新為驅動,致力于創新療法的發現、開發和商業化的生物制藥公司。依托全球一體化源頭創新研發能力,公司已構建起涵蓋超過50款創新藥物的多層次產品管線,覆蓋惡性腫瘤、自身免疫、慢性代謝類、神經系統、感染性疾病五大治療領域,已有5款產品在國內或海外上市,包括我國首個自主研發、在中美歐等地超過30個國家和地區獲批上市的PD-1抑制劑特瑞普利單抗(拓益®),臨床開發階段的藥物超過30款。疫情期間,君實生物還參與開發了埃特司韋單抗、民得維®等多款預防和治療新冠的創新藥物,積極承擔本土創新藥企的責任。
君實生物以"用世界一流、值得信賴的創新藥普惠患者"為使命,立足中國,布局全球。目前,公司在全球擁有約2500名員工,分布在美國舊金山和馬里蘭,中國上海、蘇州、北京、廣州等。
官方網站:www.junshipharma.com
官方微信:君實生物
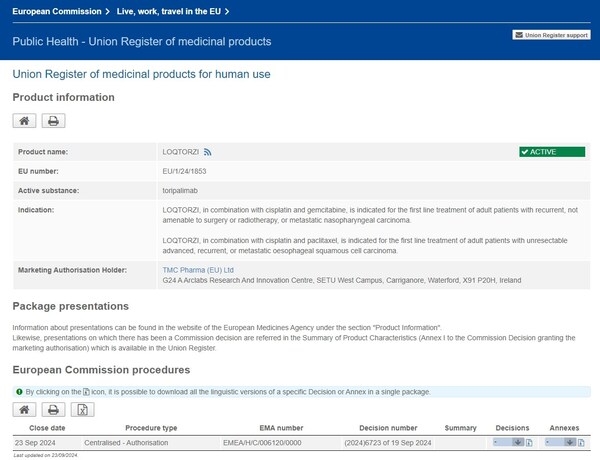
上海2024年9月24日 /美通社/ -- 北京時間2024年9月24日,君實生物(1877.HK,688180.SH)宣布,由公司自主研發的抗PD-1單抗藥物特瑞普利單抗(歐洲商品名:LOQTORZI®)于近日獲得歐盟委員會(EC)批準用于治療兩項適應癥:
- 特瑞普利單抗聯合順鉑和吉西他濱用于復發、不能手術或放療的,或轉移性鼻咽癌(NPC)成人患者的一線治療;
- 特瑞普利單抗聯合順鉑和紫杉醇用于不可切除的晚期/復發或轉移性食管鱗癌(ESCC)成人患者的一線治療。
2024年7月,歐洲藥品管理局(EMA)人用醫藥產品委員會(CHMP)發布積極審評意見,建議批準特瑞普利單抗用于以上兩項適應癥。此次獲批適用于歐盟全部27個成員國以及冰島、挪威和列支敦士登,使得特瑞普利單抗成為歐洲首個且唯一用于NPC治療的藥物,也是歐洲唯一用于不限PD-L1表達的晚期或轉移性ESCC一線免疫治療藥物。
本次EC對于NPC和ESCC適應癥的批準分別基于JUPITER-02(一項隨機、雙盲、安慰劑對照、國際多中心Ⅲ期臨床研究,NCT03581786)和JUPITER-06(一項隨機、雙盲、安慰劑對照、多中心的Ⅲ期研究,NCT03829969)的研究結果。
其中,JUPITER-02是鼻咽癌免疫治療領域首個國際多中心、樣本量最大的雙盲、隨機對照Ⅲ期臨床研究,也是全球首個鼻咽癌一線免疫聯合化療對比單純化療將總生存期(OS)預設有統計學檢驗(一類錯誤控制)并確證具有生存獲益的Ⅲ期臨床研究。其研究結果曾以口頭報告形式亮相2021年美國臨床腫瘤學會(ASCO)年會全體大會(#LBA2),隨后榮登《自然-醫學》(Nature Medicine,影響因子:58.7)雜志封面,并獲得《美國醫學會雜志》(Journal of the American Medical Association,JAMA,影響因子:63.1)全文發表。研究結果顯示,與單純化療相比,特瑞普利單抗聯合化療使患者的疾病進展風險降低48%,死亡風險降低37%。特瑞普利單抗聯合化療組的中位無進展生存期(PFS)對比單純化療延長了13.2個月,從8.2個月提升到21.4個月。此外,接受該聯合療法治療的患者可獲得更高的客觀緩解率(ORR),更長的持續緩解時間(DoR)和更高的疾病控制率(DCR),且未發現新的安全性信號。長期生存隨訪數據在2024年ASCO年會展示,特瑞普利單抗治療組5年生存率達到52.0%。
基于該項研究,特瑞普利單抗分別于2021年和2023年獲得國家藥品監督管理局(NMPA)和美國食品藥品監督管理局(FDA)批準用于晚期鼻咽癌的治療,是全球首個獲批鼻咽癌治療的免疫檢查點抑制劑(ICI)藥物,也是美國首個且唯一用于鼻咽癌治療的藥物。此外,特瑞普利單抗用于治療NPC相關適應癥的上市申請正在同步接受英國藥品和保健品管理局(MHRA)、澳大利亞藥品管理局(TGA)、新加坡衛生科學局(HSA)以及中國香港衛生署藥物辦公室(DO)等國家和地區監管機構的審評。
JUPITER-06是一項隨機、雙盲、安慰劑對照、多中心的Ⅲ期臨床研究(NCT03829969),旨在評估與安慰劑聯合化療相比,特瑞普利單抗聯合紫杉醇/順鉑(TP)用于晚期ESCC一線治療的療效及安全性。該研究結果首次在歐洲腫瘤內科學會年會(ESMO 2021)上以口頭匯報形式報告,隨后在國際頂尖腫瘤學雜志《Cancer Cell》(影響因子:48.8)和《臨床腫瘤學雜志》(Journal of Clinical Oncology,影響因子:42.1)發表。研究結果顯示,特瑞普利單抗聯合化療可使晚期或轉移性ESCC患者獲得更優的PFS和OS,其中中位OS延長6個月,達到17個月,并顯著降低患者的疾病進展或死亡風險達42%,顯著改善生存獲益,且無論PD-L1表達如何均可獲益。
基于該項研究,2022年5月,特瑞普利單抗用于治療ESCC的新適應癥上市申請在中國獲批。目前,特瑞普利單抗用于一線治療ESCC的上市申請正在接受MHRA的審評。
JUPITER-02、JUPITER-06主要研究者、中山大學腫瘤防治中心徐瑞華教授表示:"鼻咽癌和食管癌都具有亞洲區域高發的特點,歐美國家在此類瘤種領域的創新療法開發方面較為緩慢。JUPITER-02和JUPITER-06研究的出色的研究成果證明了在鼻咽癌和食管癌領域,中國學者的診療能力和臨床科研水平已經位列全球領先,期待這項‘中國方案'能夠切實改變國際上罹患這兩類瘤種且缺乏有效治療手段的患者境遇,為他們帶來更好的生存希望!"
君實生物總經理兼首席執行官鄒建軍博士表示:"‘立足中國,布局全球'是君實生物創立之初即確立的戰略發展目標,此次特瑞普利單抗獲得EC批準,意味著繼中國、美國之后,我們全球商業化布局的腳步正式邁向歐洲,也標志著我們在創新藥的研發和生產質量再次獲得國際權威監管機構的認可。未來,我們將繼續攜手合作伙伴,全力推動特瑞普利單抗在歐洲地區的商業化落地,為更多海外患者提供來自中國的高質量創新藥物。"
1. 本材料旨在傳遞前沿信息,無意向您做任何產品的推廣,不作為臨床用藥指導。 |
2. 若您想了解具體疾病診療信息,請遵從醫療衛生專業人士的意見與指導。 |
—— 完 ——
關于鼻咽癌
鼻咽癌是一種發生于鼻咽部黏膜上皮的惡性腫瘤,是常見的頭頸部惡性腫瘤之一。根據GLOBOCAN 2022發布的數據顯示,2022年鼻咽癌在全球范圍內確診的新發病例數超過12萬[1]。由于原發腫瘤位置的原因,很少采用手術治療。新近更新的ESMO指南推薦免疫治療聯合化療用于復發或轉移性鼻咽癌的一線治療[2]。
【參考文獻】 |
[1]. https://gco.iarc.who.int/media/globocan/factsheets/populations/160-china-fact-sheet.pdf. |
[2]. Bossi, P; Chan, AT; Even, C; Machiels, JP, et al.ESMO-EURACAN Clinical Practice Guideline update for nasopharyngeal carcinoma: adjuvant therapy and first-line treatment of recurrent/metastatic disease. Ann Oncol, 2023; 34 (3): 247. |
關于食管癌
食管癌是消化道領域最常見的惡性腫瘤之一。根據GLOBOCAN 2022發布的數據顯示,食管癌是2022年全球第十一大常見惡性腫瘤和第七大癌癥死亡原因,新發病例數超過51.1萬,死亡病例數超過44.5萬[1]。食管鱗癌(ESCC)和腺癌是食管癌的兩種主要組織學亞型。ESMO指南推薦PD-1阻斷性抗體聯合化療用于PD-L1表達陽性的晚期或轉移性ESCC的一線治療[2]。
【參考文獻】 |
[1]. https://gco.iarc.who.int/media/globocan/factsheets/populations/160-china-fact-sheet.pdf. |
[2]. Obermannova R,Alsina M, Cervantes A,Leong T,Lordick F, Nilsson M,van Greeken NCT, Vogel A,Smyth EC; ESMO Guidelines Committee. ESMO Clinical Practice Guidline for diagnosis,treatment and follow-up.Ann Oncol.2022 Oct;33(10):992-1004. |
關于特瑞普利單抗注射液(拓益®,LOQTORZI®)
特瑞普利單抗注射液(拓益®)作為我國批準上市的首個國產以PD-1為靶點的單抗藥物,獲得國家科技重大專項項目支持,并榮膺國家專利領域最高獎項"中國專利金獎"。
特瑞普利單抗至今已在全球(包括中國、美國、東南亞及歐洲等地)開展了覆蓋超過15個適應癥的40多項由公司發起的臨床研究。正在進行或已完成的關鍵注冊臨床研究在多個瘤種范圍內評估特瑞普利單抗的安全性及療效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、腎癌及皮膚癌等。
截至目前,特瑞普利單抗已在中國內地獲批10項適應癥:用于既往接受全身系統治療失敗的不可切除或轉移性黑色素瘤的治療(2018年12月);用于既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療(2021年2月);用于含鉑化療失敗包括新輔助或輔助化療12個月內進展的局部晚期或轉移性尿路上皮癌的治療(2021年4月);聯合順鉑和吉西他濱用于局部復發或轉移性鼻咽癌患者的一線治療(2021年11月);聯合紫杉醇和順鉑用于不可切除局部晚期/復發或遠處轉移性食管鱗癌患者的一線治療(2022年5月);聯合培美曲塞和鉑類用于表皮生長因子受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性、不可手術切除的局部晚期或轉移性非鱗狀非小細胞肺癌的一線治療(2022年9月);聯合化療圍手術期治療,繼之本品單藥作為輔助治療,用于可切除IIIA-IIIB期非小細胞肺癌的成人患者(2023年12月);聯合阿昔替尼用于中高危的不可切除或轉移性腎細胞癌患者的一線治療(2024年4月);聯合依托泊苷和鉑類用于廣泛期小細胞肺癌一線治療(2024年6月);聯合注射用紫杉醇(白蛋白結合型)用于經充分驗證的檢測評估PD-L1陽性(CPS≥1)的復發或轉移性三陰性乳腺癌的一線治療(2024年6月)。2020年12月,特瑞普利單抗首次通過國家醫保談判,目前已有6項獲批適應癥納入《國家醫保目錄(2023年)》,是目錄中唯一用于治療黑色素瘤的抗PD-1單抗藥物。2024年4月,香港衛生署藥物辦公室受理了特瑞普利單抗聯合順鉑/吉西他濱作為轉移性或復發性局部晚期鼻咽癌成人患者的一線治療,以及作為單藥治療既往含鉑治療過程中或治療后疾病進展的復發性、不可切除或轉移性鼻咽癌的成人患者的上市許可申請。
在國際化布局方面,2023年10月,特瑞普利單抗已作為首款鼻咽癌藥物在美國獲批上市。2024年9月,特瑞普利單抗用于晚期鼻咽癌和食管鱗癌的一線治療獲得歐盟委員會批準上市。此外,英國藥品和保健品管理局(MHRA)受理了特瑞普利單抗聯合順鉑和吉西他濱用于局部復發或轉移性鼻咽癌患者的一線治療以及聯合紫杉醇和順鉑用于不可切除局部晚期/復發或轉移性食管鱗癌患者的一線治療的上市許可申請,澳大利亞藥品管理局(TGA)和新加坡衛生科學局(HSA)分別受理了特瑞普利單抗聯合順鉑/吉西他濱作為轉移性或復發性局部晚期鼻咽癌成人患者的一線治療,以及作為單藥治療既往含鉑治療過程中或治療后疾病進展的復發性、不可切除或轉移性鼻咽癌的成人患者的上市許可申請。
關于君實生物
君實生物(688180.SH,1877.HK)成立于2012年12月,是一家以創新為驅動,致力于創新療法的發現、開發和商業化的生物制藥公司。依托全球一體化源頭創新研發能力,公司已構建起涵蓋超過50款創新藥物的多層次產品管線,覆蓋惡性腫瘤、自身免疫、慢性代謝類、神經系統、感染性疾病五大治療領域,已有4款產品在國內或海外上市,包括我國首個自主研發、在中美兩國獲批上市的PD-1抑制劑特瑞普利單抗(拓益®),臨床開發階段的藥物超過30款。疫情期間,君實生物還參與開發了埃特司韋單抗、民得維®等多款預防和治療新冠的創新藥物,積極承擔本土創新藥企的責任。
君實生物以"用世界一流、值得信賴的創新藥普惠患者"為使命,立足中國,布局全球。目前,公司在全球擁有約2500名員工,分布在美國舊金山和馬里蘭,中國上海、蘇州、北京、廣州等。
官方網站:www.junshipharma.com
官方微信:君實生物
肺癌是目前全球發病率第二、死亡率第一的惡性腫瘤[1],在中國的發病率和死亡率也位列第一[2]。根據世界衛生組織發布的數據,2020年中國的肺癌病例數占新發癌癥病例數的17.9%(81.6萬),癌癥死亡病例數的23.8%(71.5萬)[2]。
2022年9月,由中國生物醫藥創新"先行者"君實生物自主研發的抗PD-1單抗藥物拓益®(特瑞普利單抗)聯合培美曲塞和鉑類適用于表皮生長因子受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性、不可手術切除的局部晚期或轉移性非鱗狀非小細胞肺癌(NSCLC)的一線治療新適應癥獲得國家藥品監督管理局(NMPA)批準。作為一款廣譜抗癌藥物,這已是特瑞普利單抗在中國獲批的第六項適應癥,成功將治療領域從黑色素瘤、鼻咽癌、尿路上皮癌、食管癌拓展到肺癌。
大會主席于金明院士對拓益®(特瑞普利單抗)取得肺癌新適應癥表示祝賀,"隨著腫瘤免疫治療的迅速發展,免疫治療在肺癌治療實踐中的地位愈發重要。讓我們一起攜手以君實生物為代表的中國原研藥企共同推動中國肺癌診療發展,為廣大肺癌患者帶來新的生機和新希望。"
THE BETTER CHOICE:為肺癌患者帶來"益種選擇"
拓益®(特瑞普利單抗)肺癌適應癥的獲批主要基于一項隨機、雙盲、安慰劑平行對照、多中心III期臨床試驗CHOICE-01研究(NCT03856411),共納入465例未經治療的晚期NSCLC患者。
CHOICE-01主要研究者王潔教授在會上對試驗數據做精彩解讀。她表示:"當前,免疫聯合治療已成為晚期驅動基因陰性NSCLC的標準一線治療,面對眾多治療方案,臨床醫生時常困惑于‘The CHOICEs We can Make'。
CHOICE-01研究結果顯示,與單純化療方案相比,接受特瑞普利單抗聯合化療一線治療的無EGFR/ALK突變的晚期NSCLC患者的無進展生存期(PFS)和總生存期(OS)獲益顯著,且療效不受PD-L1表達影響;其中,非鱗癌患者PFS和OS獲益尤為突出,療效不亞于進口同類藥物,可降低進展風險和降低死亡風險均達52%,2年OS率高達62.6%。
此外,為了分析基因組改變與生存獲益之間的相關性,CHOICE-01是目前肺癌同類研究中唯一采用全外顯子組測序(WES)的大型III期研究。其全組WES結果顯示,與單獨化療相比,FA-PI3K-Akt、IL-7、SWI/SNF通路突變的患者接受特瑞普利單抗聯合化療方案獲益更顯著。我們期待CHOICE-01能夠引領精準治療,助力臨床醫生做出‘THE BETTER CHOICE'!"
集思廣益:"聯合、精準、圍手術期"開啟肺癌免疫治療新征程
眾多肺癌領域專家學者基于數據、立足臨床,在會上深入探討了肺癌研發進展和治療新策略,全方位解讀肺癌領域免疫治療熱點話題。
周彩存教授分享了對免疫聯合治療NSCLC新策略的思考,他表示:"免疫治療已成為早、中和晚期NSCLC重要治療手段,免疫聯合新型制劑也是臨床非常關注的熱點,目前有免疫治療藥物聯合抗血管生成劑、LAG3、TIGIT、CD73和共刺激分子等各種新型制劑已顯示出積極的療效。免疫療法被譽為攻克癌癥的希望,不管是新型免疫制劑還是癌癥疫苗,都只是免疫學冰山中的一角,期待免疫療法取得更多突破,給癌癥患者帶來更多奇跡!"
朱波教授介紹了肺癌免疫治療生物標志物(biomarker)的現狀,并重點闡述了未來的五大發展方向,包括:1)多種生物標志物聯合的應用;2)人工智能應用于免疫治療的生物標志物探索;3)免疫細胞亞群的精細分群;4)治療中(on-treatment)生物標志物;5)新的生物技術助力免疫治療生物標志物發現。
陸舜教授分享了他對圍手術期NSCLC免疫治療的進展與思考,他表示:"針對新輔助免疫治療,從生物標記物、對手術的影響、獲益人群、療效指標進行了思考,初步顯示在新輔助免疫治療中亞裔人群和IIIA期獲益更多,PD-L1表達是比較明確的biomarker,不增加手術難度和不影響手術,同時顯示MPR和pCR與EFS的相關性;針對輔助免疫治療,從生物標記物、獲益人群、安全性進行了討論,非鱗癌獲益更多,biomarker尚不明確,不同PD-L1表達患者療效不一致,ctDNA是潛在biomarker,期待后續圍術期免疫治療研究結果。未來發展,圍術期NSCLC免疫治療更多基于MDT和生物標記物的治療模式。"
據陸舜教授介紹,目前正在開展的NEOTORCH研究(特瑞普利單抗聯合化療)是首個在中國人群中進行的圍手術期NSCLC免疫治療的III期研究,預計將在2022年底完成,特瑞普利單抗有望開啟圍手術期免疫治療的新模式。
Roy S. Herbst教授分享了全球NSCLC免疫治療新趨勢,他表示:"未來,免疫治療的探索方向可能更多地聚焦在個體化治療。我們需要在生物標志物、聯合治療方面做更多的探索。同時,我們也需要做更多的創新研究設計和更廣泛的合作,從而獲得更充分的科學數據。免疫治療的未來已來!"
相得益彰:多元化腫瘤管線不斷改善患者生存
目前,君實生物的研發管線擁有超過50項候選藥物,包括特瑞普利單抗在內約75%為腫瘤產品。值得注意的是,其中近1/3的產品并非靶向腫瘤細胞,而是靶向免疫細胞(常為T細胞)、免疫微環境(如靶向微血管,增加微血管循環、淋巴細胞浸潤)等,以期通過探索各種機制的聯合用藥,解決腫瘤免疫治療面臨的"三大問題",不斷擴大受益人群。
君實生物全球研發總裁鄒建軍博士表示:"基于公司在腫瘤免疫治療(I-O)領域的長期積累,我們針對‘PD-1治療后耐藥'、‘冷腫瘤'、‘源頭缺乏腫瘤特異性T細胞'三大問題,建立起一條以特瑞普利單抗為‘基石類藥物'的差異化腫瘤管線,覆蓋了廣泛的腫瘤類型。其中在肺癌領域,我們正在探索特瑞普利單抗、tifcemalimab(抗BTLA單抗)、JS006(抗TIGIT單抗)、JS007(抗CTLA-4單抗)、JS009(抗CD112R單抗)、JS014(IL-21融合蛋白)、JS111(EGFR exon 20插入等非常見突變抑制劑)、JS112(Aurora A抑制劑)、JS113(第四代EGFR抑制劑)等產品的單藥/聯合療法在不同亞型、不同治療階段的療效,希望能夠持續為患者帶來效果更好的治療選擇!"
君實生物聯席首席執行官李聰先生表示:"作為一家創新型生物制藥公司,君實生物一直將解決臨床未滿足之需作為前行使命,聚焦first-in-class或best-in-class藥物的研發。肺癌是我國發病率和死亡率最高的惡性腫瘤,我們將與臨床專家一同研發更多更好的產品,共同助力中國肺癌患者的生存改善!"
1. 本材料旨在傳遞前沿信息,無意向您做任何產品的推廣,不作為臨床用藥指導。
2. 若您想了解具體疾病診療信息,請遵從醫療衛生專業人士的意見與指導。
【參考文獻】
[1] https://gco.iarc.fr/today/data/factsheets/cancers/15-Lung-fact-sheet.pdf
[2] https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf
關于特瑞普利單抗注射液(拓益®)
特瑞普利單抗注射液(拓益®)作為我國批準上市的首個國產以PD-1為靶點的單抗藥物,獲得國家科技重大專項項目支持,并榮膺國家專利領域最高獎項"中國專利金獎"。
特瑞普利單抗至今已在全球(包括中國、美國、東南亞及歐洲等地)開展了覆蓋超過15個適應癥的30多項由公司發起的臨床研究。正在進行或已完成的關鍵注冊臨床研究在多個瘤種范圍內評估特瑞普利單抗的安全性及療效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、腎癌及皮膚癌等。
截至目前,特瑞普利單抗已在中國獲批6項適應癥:用于既往接受全身系統治療失敗的不可切除或轉移性黑色素瘤的治療(2018年12月);用于既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療(2021年2月);用于含鉑化療失敗包括新輔助或輔助化療12個月內進展的局部晚期或轉移性尿路上皮癌的治療(2021年4月);聯合順鉑和吉西他濱用于局部復發或轉移性鼻咽癌患者的一線治療(2021年11月);聯合紫杉醇和順鉑用于不可切除局部晚期/復發或遠處轉移性食管鱗癌患者的一線治療(2022年5月);聯合培美曲塞和鉑類用于表皮生長因子受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性、不可手術切除的局部晚期或轉移性非鱗狀非小細胞肺癌的一線治療(2022年9月)。2020年12月,特瑞普利單抗首次通過國家醫保談判,目前已有3項適應癥納入《2021年藥品目錄》,是國家醫保目錄中唯一用于治療黑色素瘤和鼻咽癌的抗PD-1單抗藥物。
在國際化布局方面,特瑞普利單抗已在黏膜黑色素瘤、鼻咽癌、軟組織肉瘤、食管癌、小細胞肺癌領域獲得FDA授予2項突破性療法認定、1項快速通道認定、1項優先審評認定和5項孤兒藥資格認定,并在鼻咽癌領域獲得歐盟委員會授予的孤兒藥資格認定。2022年7月,FDA受理了重新提交的特瑞普利單抗聯合吉西他濱/順鉑作為晚期復發或轉移性鼻咽癌患者的一線治療和單藥用于復發或轉移性鼻咽癌含鉑治療后的二線及以上治療的生物制品許可申請(BLA),處方藥用戶付費法案(PDUFA)的目標審評日期定為2022年12月23日。
關于君實生物
君實生物(688180.SH,1877.HK)成立于2012年12月,是一家以創新為驅動,致力于創新療法的發現、開發和商業化的生物制藥公司。公司具有由超過50項在研產品組成的豐富的研發管線,覆蓋五大治療領域,包括惡性腫瘤、自身免疫系統疾病、慢性代謝類疾病、神經系統類疾病以及感染性疾病。
憑借蛋白質工程核心平臺技術,君實生物身處國際大分子藥物研發前沿,獲得了首個國產抗PD-1單抗NMPA上市批準、國產抗PCSK9單抗NMPA臨床申請批準、全球首個治療腫瘤抗BTLA阻斷抗體在中國NMPA和美國FDA的臨床申請批準,目前正在中美兩地開展多項Ib/II期臨床試驗。
自2020年疫情爆發之初,君實生物迅速反應,與國內外科研機構及企業攜手抗疫,利用技術積累快速開發了多款治療COVID-19的創新藥物,積極承擔中國制藥企業的社會責任。其中包括:國內首個進入臨床階段并參與全球抗疫的新冠病毒中和抗體埃特司韋單抗(JS016)于2021年在超過15個國家和地區獲得緊急使用授權,新型口服核苷類抗新冠病毒藥物VV116(JT001)已進入國際多中心III期注冊臨床研究階段,以及其他多種類型藥物,持續為全球抗疫貢獻中國力量。
目前君實生物在全球擁有超過3100名員工,分布在美國舊金山和馬里蘭,中國上海、蘇州、北京、廣州等。
官方網站:www.junshipharma.com
官方微信:君實生物
上海2022年6月27日 /美通社/ -- 2022年6月25日,"食力領先,拓啟新生"君實生物拓益®(特瑞普利單抗注射液)一線食管癌適應癥全國上市會圓滿召開。本次上市會以廣州為主會場,并在北京、鄭州、成都、南京設分會場,通過五城連線互動,匯聚全國消化道腫瘤領域專家,圍繞新興免疫治療在食管癌領域的成果與前景展開學術分享與討論,共同見證拓益®(特瑞普利單抗)"食管鱗癌OS17生命系統"的正式發布!
本次大會邀請到中山大學腫瘤防治中心徐瑞華教授、北京大學臨床腫瘤醫院沈琳教授和中國醫學科學院腫瘤醫院深圳醫院王綠化教授擔任大會主席;中國醫學科學院腫瘤醫院李印教授、北京大學腫瘤醫院陳克能教授、河南省腫瘤醫院羅素霞教授、河南科技大學第一附屬醫院高社干教授、四川省腫瘤醫院韓泳濤教授、空軍軍醫大學唐都醫院姜濤教授、江蘇省腫瘤醫院曹國春教授、上海胸科醫院李志剛教授分別擔任分會場主席。
"OS17生命系統"引領食管癌治療新格局
2022年5月,由中國本土創新藥企君實生物自主研發的抗PD-1單抗藥物拓益®(特瑞普利單抗)聯合紫杉醇和順鉑(TP化療)用于不可切除局部晚期/復發或遠處轉移性食管鱗癌(ESCC)患者的一線治療新適應癥獲得國家藥品監督管理局(NMPA)批準。這項"中國方案"刷新了中國晚期食管鱗癌患者一線治療的中位總生存期,將以超強"食力",為患者開啟全新的生命系統!
大會主席徐瑞華教授表示:"作為我國自主研發的抗PD-1單抗,拓益®食管癌一線適應癥的獲批具有多重意義,這是新的突破、新的選擇,為患者帶來了新的希望!同時,也是‘中國方案'對國際免疫治療領域的重大貢獻!"
大會主席沈琳教授表示:"食管癌是一個比較特殊的腫瘤類型,全球范圍內來看,我國是絕對的高發地區。而值得自豪的是,在這一領域,中國創新藥企業已經跟上了發達國家的腳步。希望越來越多像君實生物這樣的中國創新藥企業能繼續投入研發創新,開發出更多創新藥物,改善我國癌癥患者的生存!"
大會主席王綠化教授表示:"本次拓益®食管癌一線適應癥的獲批是中國食管癌治療領域一件非常值得慶賀的里程碑事件,標志著一個全新時代的到來,晚期食管癌的治療格局將也被徹底改變,17個月的生存記錄在中國勢必也將成為標桿!"
長生存久獲"益","中國方案"譜寫未來可期
拓益®(特瑞普利單抗)一線食管癌適應癥的獲批主要基于一項隨機、雙盲、安慰劑對照、多中心的III期臨床試驗(JUPITER-06研究),由徐瑞華教授擔任主要研究者。該研究在全國72家單位聯合開展,共納入514例既往未接受過對復發或轉移腫瘤的系統性抗腫瘤治療的晚期或轉移性ESCC患者,創新性地采用更貼合本土臨床實踐的TP化療方案與我國原研的PD-1抑制劑特瑞普利單抗進行聯用,取得了突破性的成果。
中山大學腫瘤防治中心王峰教授對JUPITER-06研究進行了亮點解讀,她表示:"晚期食管鱗癌患者一線標準治療多采用以鉑類為基礎的化療方案,但臨床獲益有限,迫切需要新的藥物和治療方案來延長患者的生存期。而JUPITER-06研究徹底打破了該領域多年停滯不前的治療格局。
研究顯示,與單純化療相比,特瑞普利單抗聯合含鉑化療讓更多晚期食管鱗癌患者獲得了更好的生存獲益,其中中位總生存期(mOS)大幅延長至17個月,對比對照組單純化療延長了6個月,疾病進展或死亡風險降低42%,且無論患者PD-L1表達如何,均可獲益。在安全性方面,在化療基礎上加入特瑞普利單抗進行治療,未發現新的安全性信號。"
值得一提的是,JUPITER-06的研究成果還曾多次獲得國際學術界的認可,包括獲得國際頂尖腫瘤學雜志《Cancer Cell》(影響因子:31.743)發表,并以口頭匯報形式榮登歐洲腫瘤內科學會年會(ESMO 2021)和癌癥免疫治療學會年會(SITC 2021),這是"中國方案"在國際學術舞臺上的又一次精彩呈現。
此外,基于JUPITER-06研究,"特瑞普利單抗+順鉑+紫杉醇"這一療法還獲得《2022年中國臨床腫瘤學會(CSCO)食管癌診療指南》和《2022年CSCO免疫檢查點抑制劑臨床應用指南》"雙"推薦,將為中國晚期食管鱗癌患者帶來更好的生存獲益。
不忘初心 患者需求驅動前行力量
以往國際上以抗PD-1單抗為代表的免疫檢查點抑制劑的適應癥開發主要圍繞歐美主流病癥,像食管癌這類亞洲高發瘤種的新藥研發則相對緩慢。作為本土創新藥企,君實生物積極攜手中國專家學者,大膽探索創新,不斷拓寬免疫療法在本土高發瘤種新適應癥上的應用,旨在滿足中國患者長期未被滿足的臨床需求。
君實生物聯席首席執行官李聰先生表示:"我們很高興拓益®能夠在晚期食管鱗癌一線治療領域獲批新適應癥,為更廣泛的患者帶來我們的腫瘤免疫療法,其中也包括過往對于免疫檢查點抑制劑療效有限的PD-L1低表達腫瘤患者。關于拓益®的創新還在譜寫。我們前瞻性布局了多元化的研究探索,使拓益®在食管癌中的臨床探索進一步前移,是最早布局食管癌新輔助治療的國產抗PD-1單抗之一,有望為中國乃至全球的食管癌患者帶來更多獲益!"
在海外市場方面,特瑞普利單抗用于治療食管癌已獲得美國食品藥品監督管理局(FDA)授予的孤兒藥資格認定(Orphan-drug Designation),有助于加快推進該藥物在美國的臨床試驗及上市注冊的進度。
君實生物全球研發總裁鄒建軍博士表示:"君實生物持續關注國人中高發,且臨床急需治療的瘤種。除了特瑞普利單抗,公司正在同步開發近40款基于新平臺、新靶點的抗腫瘤新藥,致力打造出具有協同互補效應的研發管線。我們非常期待繼續與中國專家攜手,為患者提供更多效果更好、花費更優的治療選擇,同時也為全球腫瘤治療領域貢獻‘中國答案'和‘中國方案'。"
關于食管癌
食管癌是消化道領域最常見的惡性腫瘤之一。據統計,2020年中國的食管癌新發病例數高達32萬,死亡病例數達到30萬,均占到全球的一半以上,發病率和死亡率分別位居國內所有惡性腫瘤中的第五和第四位[1][2]。食管鱗癌和腺癌是食管癌的兩種主要組織學亞型,中國患者以食管鱗癌為主要亞型,約占總體發病率的90%[3]。對于晚期食管鱗癌患者,當前一線標準治療多采用以鉑類為基礎的化療方案,但臨床獲益有限,5年總生存率不足20%,迫切需要新的藥物和治療方案來延長患者的生存期[4]。
關于特瑞普利單抗注射液(拓益®)
特瑞普利單抗注射液(拓益®)作為我國批準上市的首個國產以PD-1為靶點的單抗藥物,獲得國家科技重大專項項目支持,并榮膺國家專利領域最高獎項"中國專利金獎"。本品獲批的第一個適應癥為用于既往接受全身系統治療失敗的不可切除或轉移性黑色素瘤的治療。2020年12月,特瑞普利單抗首次通過國家醫保談判,目前已有3項適應癥納入《2021年藥品目錄》。2021年2月,特瑞普利單抗獲得國家藥品監督管理局(NMPA)批準,用于既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療。2021年4月,特瑞普利單抗獲得NMPA批準,用于含鉑化療失敗包括新輔助或輔助化療12個月內進展的局部晚期或轉移性尿路上皮癌的治療。2021年11月,特瑞普利單抗聯合順鉑和吉西他濱用于局部復發或轉移性鼻咽癌患者的一線治療的新適應癥獲得NMPA批準。2022年5月,特瑞普利單抗聯合紫杉醇和順鉑用于不可切除局部晚期/復發或遠處轉移性食管鱗癌患者的一線治療的新適應癥獲得NMPA批準。此外,特瑞普利單抗還獲得了《中國臨床腫瘤學會(CSCO)黑色素瘤診療指南》、《CSCO頭頸部腫瘤診療指南》、《CSCO鼻咽癌診療指南》、《CSCO尿路上皮癌診療指南》、《CSCO食管癌診療指南》及《CSCO免疫檢查點抑制劑臨床應用指南》推薦。
2021年3月,特瑞普利單抗用于晚期黏膜黑色素瘤的一線治療被NMPA納入突破性治療藥物程序。2021年12月,特瑞普利單抗聯合標準一線化療用于未經治療、驅動基因陰性的晚期非小細胞肺癌的新適應癥上市申請獲得NMPA受理。在國際化布局方面,特瑞普利單抗已在黏膜黑色素瘤、鼻咽癌、軟組織肉瘤、食管癌、小細胞肺癌領域獲得FDA授予2項突破性療法認定、1項快速通道認定、1項優先審評認定和5項孤兒藥資格認定。
特瑞普利單抗自2016年初開始臨床研發,至今已在全球開展了覆蓋超過15個適應癥的30多項臨床研究,積極探索本品在黑色素瘤、鼻咽癌、尿路上皮癌、肺癌、胃癌、食管癌、肝癌、膽管癌、乳腺癌、腎癌等適應癥的療效和安全性,與國內外領先創新藥企的聯合療法合作也在進行當中,期待讓更多中國以及其它國家的患者獲得國際先進水平的腫瘤免疫治療。
關于君實生物
君實生物(688180.SH,1877.HK)成立于2012年12月,是一家以創新為驅動,致力于創新療法的發現、開發和商業化的生物制藥公司。公司具有由超過50項在研產品組成的豐富的研發管線,覆蓋五大治療領域,包括惡性腫瘤、自身免疫系統疾病、慢性代謝類疾病、神經系統類疾病以及感染性疾病。
憑借蛋白質工程核心平臺技術,君實生物身處國際大分子藥物研發前沿,獲得了首個國產抗PD-1單抗NMPA上市批準、國產抗PCSK9單抗NMPA臨床申請批準、全球首個治療腫瘤抗BTLA阻斷抗體在中國NMPA和美國FDA的臨床申請批準,目前正在中美兩地開展多項Ib/II期臨床試驗。
自2020年疫情爆發之初,君實生物迅速反應,與國內外科研機構及企業攜手抗疫,利用技術積累快速開發了多款治療COVID-19的創新藥物,積極承擔中國制藥企業的社會責任。其中包括:國內首個進入臨床階段并參與全球抗疫的新冠病毒中和抗體埃特司韋單抗(JS016)于2021年在超過15個國家和地區獲得緊急使用授權,新型口服核苷類抗新冠病毒藥物VV116(JT001)已進入國際多中心III期注冊臨床研究階段,以及其他多種類型藥物,持續為全球抗疫貢獻中國力量。
目前君實生物在全球擁有兩千八百多名員工,分布在中國上海、蘇州、北京和廣州,以及美國舊金山和馬里蘭。
官方網站:www.junshipharma.com
官方微信:君實生物
[1] https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf.
[2] https://gco.iarc.fr/today/data/factsheets/cancers/6-Oesophagus-fact-sheet.pdf.
[3] Abnet, C.C., Arnold, M., and Wei, W.Q. (2018). Epidemiology of Esophageal Squamous Cell Carcinoma. Gastroenterology 154, 360-373.
[4] Wang et al., Toripalimab plus chemotherapy in treatment-naive, advanced esophageal squamous cell carcinoma (JUPITER-06): A multi-center phase 3 trial, Cancer Cell. 2022.
拓益®鼻咽癌一線適應癥全國上市會啟動&拓益®治療鼻咽癌納入國家醫保目錄慶祝儀式 線下儀式嘉賓:馬駿教授、盧泰祥教授、李聰先生; 線上儀式嘉賓:陳傳本教授(福建省腫瘤醫院)、陳曉鐘教授、胡超蘇教授、金風教授、李金高教授(江西省腫瘤醫院)、林少俊教授、潘建基教授、王穎教授(重慶大學附屬腫瘤醫院)
特瑞普利單抗是由中國生物醫藥創新“先行者”君實生物自主研發的重組人源化抗PD-1單克隆抗體注射液,是全球首個獲批鼻咽癌治療的免疫檢查點抑制劑,實現了鼻咽癌治療領域免疫治療零的突破。此次上市的拓益®鼻咽癌一線適應癥為特瑞普利單抗聯合順鉑和吉西他濱用于局部復發或轉移性鼻咽癌患者的一線治療,這也是拓益®在鼻咽癌領域獲批上市的第二項適應癥,不但為該領域患者帶來了前沿的腫瘤免疫療法,助力中國創新成果造福國人,也在國際上引領了鼻咽癌領域的診療發展。
“鼻咽癌是一個比較特殊的腫瘤類型,全球范圍內來看,我國是絕對的高發地區。在這個領域,目前我國的診療和研究水平均處在世界前列,讓中國患者率先受益于創新療法,也是我們研究者義不容辭的責任。”大會名譽主席徐瑞華教授致辭稱。
大會名譽主席潘建基教授表示:“隨著抗腫瘤新藥的研發和臨床治療新技術的出現,鼻咽癌治療格局在近年來迎來了變革性的突破。希望君實生物能繼續投入研發創新,推動我國抗腫瘤事業的不斷發展,提高臨床醫生的腫瘤診治水平,改善我國癌癥患者的生存。”
與上市會一同舉辦的,還有拓益®治療鼻咽癌納入國家醫保目錄慶祝儀式。2022年1月1日,新版國家醫保藥品目錄實施,特瑞普利單抗成為目錄中唯一用于鼻咽癌治療的抗PD-1單抗,有望讓更廣大患者受益于創新療法。
大會名譽主席盧泰祥教授致辭道:“此次拓益®在鼻咽癌一線治療‘再下一城’,將為處于不同疾病階段的患者帶來創新的治療方案和更長的生存獲益。目前拓益®治療晚期鼻咽癌已納入2021版國家醫保目錄,可及性更高,將造福更多中國患者!”
定義晚期鼻咽癌全線免疫治療新標準
拓益®鼻咽癌一線適應癥獲批基于的JUPITER-02研究,是一項隨機、雙盲、安慰劑對照、國際多中心的免疫治療聯合標準化療一線治療復發/轉移性鼻咽癌的Ⅲ期臨床研究,由徐瑞華教授擔任主要研究者,在中國、美國兩地同時注冊,共納入289例未接受過化療的復發/轉移性鼻咽癌患者。
會上,麥海強教授對JUPITER-02研究亮點著重進行了介紹:“目前臨床應用的局部復發或轉移性鼻咽癌患者一線治療手段,療效不夠理想,因此,亟需探索更為有效的治療方案。JUPITER-02研究有人群涵蓋更廣,P值、HR值雙認證,療效指標全面獲益三大特點。通過JUPITER-02研究,我們欣喜地看到,與單純化療相比,特瑞普利單抗聯合吉西他濱和順鉑(GP化療)一線治療復發/轉移性鼻咽癌可獲得更優的無進展生存期(PFS)、更高的客觀緩解率(ORR)和更長的緩解持續時間(DoR),安全性可管理。”
麥海強教授具體分析道,研究結果顯示,特瑞普利單抗組主要研究終點PFS(BIRC評估)達11.7個月,比化療組延長3.7個月,死亡風險或疾病進展風險比化療組降低48%;兩組的OS數據尚未成熟,但特瑞普利單抗組OS顯著延長,死亡風險降低了40%。
值得一提的是,此項研究多次獲得國際學界高度認可,曾以“重磅研究摘要”(#LBA2)形式入選美國臨床腫瘤學會年會(ASCO 2021)全體大會,并榮登國際頂尖期刊《自然-醫學》雜志(Nature Medicine,影響因子:53.440)封面,這也是《自然-醫學》創刊26年來首次在封面上推薦中國創新藥物研究。
歷經5年時間,從Ib/II期的小樣本量探索性研究、II期免疫單藥二線及后線治療的POLARIS-02研究,到首創全球迄今為止規模最大的國際多中心“免疫治療+化療”一線治療的JUPITER-02研究,研發團隊實現了對晚期鼻咽癌后線至一線臨床布局的“全線貫穿”。“特瑞普利單抗改寫了2021版《CSCO鼻咽癌診療指南》,在一線、二線及以上、三線及以上治療中均得到專家推薦。目前,特瑞普利單抗的多項研究都在全力推進。在鼻咽癌治療領域,‘中國力量’改變了世界,重塑了鼻咽癌治療標準,我們期待特瑞普利單抗在鼻咽癌領域發出更多的好聲音。”麥海強教授表示。
讓“中國方案”造福全球患者
以往國際上以PD-1為代表的免疫治療藥物適應癥的開發主要圍繞歐美主流病癥,像鼻咽癌這類亞洲高發瘤種則長期被忽視。作為本土創新藥企,君實生物積極攜手中國專家學者,大膽探索創新,旨在滿足中國患者長期未被滿足的臨床需求。
君實生物高級副總裁姚盛博士在上市會上表示:“君實生物持續關注國人中高發,且對免疫治療有較好響應、臨床急需治療的瘤種。全球近半數的鼻咽癌新發病例在中國,但治療手段的開發在全球層面長期滯后。我們先后開展POLARIS-02和JUPITER-02兩項研究,力求改變復發轉移性鼻咽癌患者的境遇。讓我們感到欣慰的是,特瑞普利成功驗證了免疫單藥與化療聯合治療在該領域的有效性,為患者提供了更好的治療選擇。”
在“立足中國,布局全球”戰略指引下,君實生物正努力讓“中國方案”造福全球患者。基于特瑞普利單抗在POLARIS-02和JUPITER-02兩項研究中取得的卓越成果,美國食品藥品監督管理局(FDA)已授予該藥品2項突破性療法認定,旨在加速其開發和審評程序。目前,君實生物已向FDA提交了特瑞普利單抗聯合吉西他濱/順鉑作為晚期復發或轉移性鼻咽癌患者的一線治療和單藥用于復發或轉移性鼻咽癌含鉑治療后的二線及以上治療的兩項適應癥的生物制品許可申請(BLA)并獲受理,特瑞普利單抗也是首個向FDA提交上市申請的國產抗PD-1單抗。
君實生物聯席首席執行官李聰先生表示:“在鼻咽癌領域,特瑞普利單抗已相繼取得兩項適應癥上市,其中后線治療適應癥已通過2021年國談被納入醫保,這必將滿足更多中國鼻咽癌患者的需求。與此同時,我們也正在全球層面積極推進特瑞普利單抗等創新藥物的研發與商業化工作,推動中國本土創新藥物走向世界,普惠全球患者。”
關于鼻咽癌
鼻咽癌是一種發生于鼻咽部黏膜上皮的惡性腫瘤,是常見的頭頸部惡性腫瘤之一。據世界衛生組織統計,2020年鼻咽癌在全球范圍內確診的新發病例數超過13萬。對于復發或轉移性鼻咽癌,目前的治療手段有限,一線標準治療方案是吉西他濱聯合順鉑化療,患者的總體生存亟待改善。對于一線含鉑類化療失敗的患者目前仍缺乏標準的后線治療方案。
關于特瑞普利單抗注射液(拓益®)
特瑞普利單抗注射液(拓益®)作為我國批準上市的首個國產以PD-1為靶點的單抗藥物,獲得國家科技重大專項項目支持。本品獲批的第一個適應癥為用于既往接受全身系統治療失敗的不可切除或轉移性黑色素瘤的治療。2020年12月,特瑞普利單抗首次通過國家醫保談判,目前已有3項適應癥納入《2021年藥品目錄》。2021年2月,特瑞普利單抗獲得國家藥品監督管理局(NMPA)批準,用于既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療。2021年4月,特瑞普利單抗獲得NMPA批準,用于含鉑化療失敗包括新輔助或輔助化療12個月內進展的局部晚期或轉移性尿路上皮癌的治療。2021年11月,特瑞普利單抗聯合順鉑和吉西他濱用于局部復發或轉移性鼻咽癌患者的一線治療的新適應癥獲得NMPA批準。此外,特瑞普利單抗還獲得了《中國臨床腫瘤學會(CSCO)黑色素瘤診療指南》、《CSCO頭頸部腫瘤診療指南》、《CSCO鼻咽癌診療指南》、《CSCO尿路上皮癌診療指南》及《CSCO免疫檢查點抑制劑臨床應用指南》推薦。
2021年3月,特瑞普利單抗用于晚期黏膜黑色素瘤的一線治療被國家藥監局納入突破性治療藥物程序。2021年7月,特瑞普利單抗聯合含鉑化療一線治療局部晚期或轉移性食管鱗癌的新適應癥上市申請獲得NMPA受理。2021年12月,特瑞普利單抗聯合標準一線化療用于未經治療、驅動基因陰性的晚期非小細胞肺癌的新適應癥上市申請獲得NMPA受理。在國際化布局方面,特瑞普利單抗在美國食品藥品監督管理局(FDA)的首個上市申請(BLA)已獲受理并被授予優先審評,特瑞普利單抗也是首個向FDA提交BLA的國產抗PD-1單抗。目前,特瑞普利單抗已在黏膜黑色素瘤、鼻咽癌、軟組織肉瘤、食管癌領域獲得FDA授予2項突破性療法認定、1項快速通道認定、1項優先審評認定和4項孤兒藥資格認定。
特瑞普利單抗自2016年初開始臨床研發,至今已在全球開展了覆蓋超過15個適應癥的30多項臨床研究,積極探索本品在黑色素瘤、鼻咽癌、尿路上皮癌、肺癌、胃癌、食管癌、肝癌、膽管癌、乳腺癌、腎癌等適應癥的療效和安全性,與國內外領先創新藥企的聯合療法合作也在進行當中,期待讓更多中國以及其它國家的患者獲得國際先進水平的腫瘤免疫治療。
關于君實生物
君實生物(688180.SH,1877.HK)成立于2012年12月,是一家以創新為驅動,致力于創新療法的發現、開發和商業化的生物制藥公司。公司具有由45項在研產品組成的豐富的研發管線,覆蓋五大治療領域,包括惡性腫瘤、自身免疫系統疾病、慢性代謝類疾病、神經系統類疾病以及感染性疾病。
憑借蛋白質工程核心平臺技術,君實生物身處國際大分子藥物研發前沿,獲得了首個國產抗PD-1單克隆抗體NMPA上市批準、國產抗PCSK9單克隆抗體NMPA臨床申請批準、全球首個治療腫瘤抗BTLA阻斷抗體在中國NMPA和美國FDA的臨床申請批準,在中美兩地進行I期臨床研究。2020年,君實生物還與國內科研機構攜手抗疫,共同開發的JS016已作為國內首個抗新冠病毒單克隆中和抗體進入臨床試驗,目前已在全球超過15個國家和地區獲得緊急使用授權,用本土創新為中國和世界疾病預防控制貢獻力量。目前君實生物在全球擁有兩千五百多名員工,分布在美國舊金山和馬里蘭,中國上海、蘇州、北京和廣州。
官方網站:www.junshipharma.com
官方微信:君實生物
黎明前的山巒煙霧繚繞,映出一張沉睡的側臉。隨著一輪旭日噴薄升起,清晨的嵐氣徐徐褪去,結伴的飛鳥打破了靜謐。朝陽煦潤著宛如鼻尖的山頂,昭示了鼻咽癌的治療進入了全新紀元,也象征著鼻咽癌的新療法為患者們帶來了希望與新生。
在今年6月召開的美國臨床腫瘤學會(ASCO)年會上,JUPITER-02研究初次亮相即登頂這一全球頂級腫瘤領域學術大會,入選主會場“重磅研究摘要”(編號:LBA2),被認為是本年度最重要、有望改變臨床診療實踐、具有轟動性的研究成果之一。徐瑞華教授在ASCO年會的全體大會上對JUPITER-02研究結果進行全球直播匯報,獲得廣泛關注。同時,JUPITER-02研究也是ASCO年會官方記錄中首個入選全體大會的本土創新藥物研究。
此次,JUPITER-02研究的期中分析結果以封面發表形式被SCI影響因子排名前20位的國際頂尖期刊收錄,再度彰顯出這項“中國學者+本土新藥”組合在國際臨床研究領域的引領地位。
“特瑞普利單抗聯合GP化療方案一線治療復發/轉移性鼻咽癌有望改寫全球治療標準。”徐瑞華教授表示,“JUPITER-02研究承載著我們致力于攻克中國高發腫瘤的使命。隨著中國科技創新實力的提升,期待有越來越多的中國方案能夠引領世界癌癥治療的標準。”
JUPITER-02研究期中分析結果顯示:
- 與安慰劑聯合化療組相比,特瑞普利單抗聯合化療組的無進展生存期(PFS)顯著延長(11.7個月 vs. 8.0個月,HR = 0.52 ,p = 0.0003),疾病進展風險降低48%;
- 各關鍵亞組的分析發現,在特瑞普利單抗聯合化療組均能觀察到PFS改善;
- 截至期中分析后9個月,中位總生存期(OS)仍未成熟,但觀察到與安慰劑聯合化療組相比,特瑞普利單抗聯合化療組死亡風險降低40%(HR = 0.603,p= 0.0462);
研究結論認為,相比安慰劑聯合化療,特瑞普利單抗聯合化療一線治療復發或轉移性鼻咽癌可獲得更長的PFS,且安全性可管理。
鼻咽癌是一種起源于鼻咽部黏膜上皮的惡性腫瘤,2020年全球鼻咽癌新發病例數約為133,000例[1],中國南方和東南亞地區高發[2]。約10%鼻咽癌患者經調強放療(IMRT)±化療后出現局部、區域復發,4%-10%初診和15%-30%根治性治療后鼻咽癌出現遠處轉移[3]。疾病負擔仍然明顯,雖然復發或轉移性鼻咽癌患者的標準一線治療方案為含鉑雙藥化療[4],但其持續緩解時間往往不足6個月[5]。亟需由新的治療方案來打破治療瓶頸。
鑒于這一嚴峻的現實和晚期鼻咽癌患者未被滿足的臨床需求,自2016年起,徐瑞華教授團隊就與君實生物合作,大膽嘗試新興免疫療法與傳統化療相結合的創新型臨床方案,迅速推動晚期鼻咽癌領域的治療變革。從Ib/II期的小樣本量探索性研究(NCT02915432)、II期免疫單藥二線及后線治療研究(POLARIS-02研究),再到首創全球規模最大的“免疫治療+化療”國際多中心一線治療的JUPITER-02研究,經過徐瑞華教授團隊和新藥研發人員的持續創新,JUPITER-02研究交出了一份漂亮的答卷。
JUPITER-02研究是一項旨在探索特瑞普利單抗聯合化療一線治療復發或轉移性鼻咽癌(RM-NPC)患者的療效和安全性的國際多中心(中國大陸、中國臺灣、新加坡)、雙盲、隨機、安慰劑對照、III期臨床注冊研究(NCT03581786),研究自2018年11月至2019年10月間,在35家研究中心納入289例未接受過化療的RM-NPC患者,隨機(1:1)分配患者至特瑞普利單抗(240mg,Q3W)聯合GP化療(吉西他濱和順鉑)組(n=146)或安慰劑聯合GP化療組(n=143)接受治療,最多6個周期后,繼續分別接受特瑞普利單抗(Q3W)或安慰劑單藥維持治療,直至出現疾病進展、或出現無法耐受的毒性、撤回知情同意或治療已達2年。
研究主要終點為盲態獨立評審委員會(BIRC)根據RECIST v1.1標準評估的意向性分析(ITT)人群的無進展生存期(PFS)。次要終點包括研究者評估的PFS、客觀緩解率(ORR)、緩解持續時間(DoR)、疾病控制率(DCR)、總生存期(OS)和1年、2年PFS率及OS率和安全性。研究將在約130例PFS事件時執行PFS的期中分析。
特瑞普利單抗聯合化療組的PFS顯著延長,疾病進展風險降低48%,生存獲益明顯
截至期中分析日(2020年5月30日),特瑞普利單抗聯合化療組的中位持續治療時間為38.7周,安慰劑聯合化療組為36周。
- 根據獨立評審委員會的評估,與安慰劑聯合化療組相比,特瑞普利單抗聯合化療組的PFS顯著延長,中位PFS分別為11.7和8.0個月,疾病進展或死亡風險降低48%(HR = 0.52 ,95%CI:0.36-0.74,雙側p = 0.0003);
- 根據研究者的評估,特瑞普利單抗聯合化療組的PFS仍未成熟(NE vs 8.0個月,HR=0.41,95% CI 0.28-0.59;p<0.0001),疾病進展風險下降近60%;
- 根據獨立評審委員會的評估,特瑞普利單抗聯合化療組預估1年PFS率為49.4%,近半數患者超1年未發生疾病進展,比安慰劑聯合化療組提高了21.5%,有更多患者獲益;
- 亞組分析顯示,不論性別、ECOG狀態、復發或轉移、EB病毒載量情況以及PD-L1表達陰性或陽性,在特瑞普利單抗聯合化療組均能觀察到PFS改善。在PD-L1表達陰性亞組,相較安慰劑聯合化療組的6.0個月,特瑞普利單抗聯合化療組的中位PFS為11.0個月,疾病進展或死亡HR為0.35(95% CI: 0.15–0.81);
截至2021年2月18日(PFS期中分析后約9個月),特瑞普利單抗聯合化療組和安慰劑聯合化療組中位隨訪時間分別為17.9個月和17.4個月,中位OS仍未成熟,不過已觀察到特瑞普利單抗聯合治療組有總生存的獲益趨勢,其死亡風險降低了40%。
特瑞普利單抗聯合化療組和安慰劑聯合化療組1年OS率分別為91.6%和87.1%,預估2年OS率分別為77.8%和63.3%,生存差異逐漸增大。
抗腫瘤活性方面,特瑞普利單抗聯合化療可顯著提高客觀緩解率,并獲得更為持久的緩解時間
根據BIRC的評估:相比安慰劑聯合化療組的66.4%,特瑞普利單抗聯合化療組的ORR為77.4%,具有顯著統計學差異(p=0.0335);兩組的中位DoR分別為10.0個月vs 5.7個月(HR=0.5,p=0.0014),特瑞普利單抗聯合化療組的DoR延長近1倍,獲得了更持久的緩解。
根據研究者的評估:特瑞普利單抗聯合化療組中位DoR仍未成熟,安慰劑聯合化療組為5.8個月,HR為0.37(95% CI: 0.24–0.56)。
安全性方面,特瑞普利單抗聯合化療組和安慰劑聯合化療組中≥3級治療期間出現的不良事件(TEAE)的發生率相似,分別為89.0%和89.5%,特瑞普利單抗聯合化療組未觀察到新的安全性信號。
值得一提的是,JUPITER-02研究是一項在中國、美國兩地同時注冊的III期臨床試驗。該研究中納入的NPC患者均為亞洲人,其病理類型主要是非角化性癌(285/289,99%),此類型是亞洲的主要病理亞型,也是北美最常見的亞型。研究者認為在JUPITER-02研究中觀察到的結果可以外推至西方人群,因為不論在中國、東南亞還是西方國家,NPC最主要的病理亞型均為非角化性癌,在NPC的結局、生存獲益和指南推薦方面都十分相似。
今年第一季度,君實生物向中國國家藥品監督管理局(NMPA)提交了特瑞普利單抗聯合化療用于晚期一線未接受過系統性治療的復發轉移性鼻咽癌適應癥上市申請并獲得受理。而在海外商業化方面,君實生物也憑借在鼻咽癌治療領域的成果率先“出海”。2021年3月,基于一項美國食品藥品監督管理局(FDA)授予的突破性療法認定(Breakthrough Therapy Designation),君實生物宣布向FDA滾動提交特瑞普利單抗治療復發或轉移性鼻咽癌的生物制品許可申請(BLA)。近日,FDA基于JUPITER-02研究的臨床證據授予特瑞普利單抗第二項突破性療法認定,君實生物在9月1日宣布已完成向美國FDA滾動提交關于特瑞普利單抗聯合吉西他濱/順鉑作為晚期復發或轉移性鼻咽癌患者的一線治療和單藥用于復發或轉移性鼻咽癌含鉑化療后的二線及以上治療的BLA。特瑞普利單抗成為首個向美國FDA提交上市申請的國產抗PD-1單抗,也標志著君實生物向著“立足中國、布局全球”的戰略目標邁出了重要的一步。
君實生物高級副總裁姚盛博士表示:“JUPITER-02研究為患者帶來的切實的療效改善,多次受到全球權威學術機構的高度認可,讓我們備受鼓舞。針對國人未被滿足的治療需求開發新藥和新的臨床方案,是我們中國學者和本土創新藥企的責任。君實生物將繼續遵循‘立足中國、布局全球’的戰略,為中國高發腫瘤的治療探索新的方向,為世界臨床研究貢獻中國創新力量。我們也將積極推進特瑞普利單抗在中國、美國和其他國家的商業化進程,造福更多鼻咽癌患者。”
綜上,JUPITER-02研究提示,與單純GP化療方案相比,特瑞普利單抗聯合GP化療一線治療復發或轉移性非角化性NPC患者可獲得更優的PFS、OS、ORR以及DoR,且治療方案的安全性可管理。特瑞普利單抗聯合GP化療有望成為RM-NPC患者一線治療的新的標準方案。
參考文獻:
[1]. Cancer, I.A.F.R., Estimated number of incident cases from 2020 to 2040, nasopharynx, both sexes, all ages. 2020. https://gco.iarc.fr/tomorrow/en/dataviz/isotype?cancers=4&single_unit=5000 |
[2]. Chen, Y. P. et al. Nasopharyngeal carcinoma. Lancet. 2019;394:64-80. |
[3]. 中國抗癌協會鼻咽癌專業委員會. 中華放射腫瘤學雜志. 2018;27(1):7-15. |
[4]. Zhang L, et al. Lancet 388:1883-1892, 2016. |
[5]. Jin Y, et al. J Cancer Res Clin Oncol. 2012 Oct;138(10):1717-25. |
關于特瑞普利單抗注射液(拓益®)
特瑞普利單抗注射液(拓益®)作為我國批準上市的首個國產以PD-1為靶點的單抗藥物,獲得國家科技重大專項項目支持。本品獲批的第一個適應癥為用于既往接受全身系統治療失敗的不可切除或轉移性黑色素瘤的治療。2020年12月,特瑞普利單抗成功通過國家醫保談判,被納入新版醫保目錄。2021年2月,特瑞普利單抗獲得國家藥品監督管理局(NMPA)批準,用于既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療。2021年4月,特瑞普利單抗獲得NMPA批準,用于含鉑化療失敗包括新輔助或輔助化療12個月內進展的局部晚期或轉移性尿路上皮癌的治療。此外,特瑞普利單抗還獲得了《中國臨床腫瘤學會(CSCO)黑色素瘤診療指南》、《CSCO頭頸部腫瘤診療指南》、《CSCO尿路上皮癌診療指南》和《CSCO鼻咽癌診療指南》推薦。
2021年2月,特瑞普利單抗聯合順鉑和吉西他濱用于局部復發或轉移性鼻咽癌患者的一線治療新適應癥上市申請獲得NMPA受理。2021年3月,特瑞普利單抗用于晚期黏膜黑色素瘤的一線治療被國家藥監局納入突破性治療藥物程序。2021年7月,特瑞普利單抗聯合含鉑化療一線治療局部晚期或轉移性食管鱗癌的新適應癥上市申請獲得NMPA受理。在國際化布局方面,特瑞普利單抗在美國食品藥品監督管理局(FDA)的第一項上市申請(BLA)已完成提交,特瑞普利單抗也是首個向FDA提交BLA的國產抗PD-1單抗。目前,特瑞普利單抗已在黏膜黑色素瘤、鼻咽癌、軟組織肉瘤領域獲得FDA授予2項突破性療法認定、1項快速通道認定和3項孤兒藥資格認定。
特瑞普利單抗自2016年初開始臨床研發,至今已在全球開展了覆蓋超過15個適應癥的30多項臨床研究,積極探索本品在黑色素瘤、鼻咽癌、尿路上皮癌、肺癌、胃癌、食管癌、肝癌、膽管癌、乳腺癌、腎癌等適應癥的療效和安全性,與國內外領先創新藥企的聯合療法合作也在進行當中,期待讓更多中國以及其它國家的患者獲得國際先進水平的腫瘤免疫治療。
關于君實生物
君實生物(688180.SH,1877.HK)成立于2012年12月,是一家以創新為驅動,致力于創新療法的發現、開發和商業化的生物制藥公司。公司具有由44項在研產品組成的豐富的研發管線,覆蓋五大治療領域,包括惡性腫瘤、自身免疫系統疾病、慢性代謝類疾病、神經系統類疾病以及感染性疾病。
憑借蛋白質工程核心平臺技術,君實生物身處國際大分子藥物研發前沿,獲得了首個國產抗PD-1單克隆抗體NMPA上市批準、國產抗PCSK9單克隆抗體NMPA臨床申請批準、全球首個治療腫瘤抗BTLA阻斷抗體在中國NMPA和美國FDA的臨床申請批準,在中美兩地進行I期臨床研究。2020年,君實生物還與國內科研機構攜手抗疫,共同開發的JS016已作為國內首個抗新冠病毒單克隆中和抗體進入臨床試驗,目前已在全球超過12個國家和地區獲得緊急使用授權,用本土創新為中國和世界疾病預防控制貢獻力量。目前君實生物在全球擁有兩千五百多名員工,分布在美國舊金山和馬里蘭,中國上海、蘇州、北京和廣州。
官方網站:www.junshipharma.com
官方微信:君實生物
特瑞普利單抗由君實生物自主研發,是一款重組人源化抗PD-1單克隆抗體注射液,自面世以來就不斷刷新著“第一”。2018年12月,特瑞普利單抗作為我國首個國產抗PD-1單抗藥物獲批上市,用于既往接受全身系統治療失敗的不可切除或轉移性黑色素瘤的治療。2021年2月,特瑞普利單抗“再下一城”,獲得國家藥品監督管理局(NMPA)批準,用于既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療,成為全球首個獲批鼻咽癌治療的抗PD-1單抗藥物,實現了該領域內免疫治療零的突破。緊接著2021年3月,君實生物又再接再厲,向美國食品藥品監督管理局(FDA)滾動提交了特瑞普利單抗用于治療復發或轉移性鼻咽癌的生物制品許可申請。特瑞普利單抗成為首個向美國FDA提交上市申請的國產抗PD-1單抗。
此次獲批基于一項多中心、開放標簽、II期關鍵注冊臨床研究(POLARIS-02研究,NCT02915432),共納入190例既往接受系統治療失敗的復發/轉移性鼻咽癌患者,是迄今為止全球范圍內已完成的最大規模的免疫檢查點抑制劑單藥治療復發或轉移性鼻咽癌的臨床試驗。POLARIS-02研究成果曾頻頻亮相國際學術舞臺,先后入選歐洲腫瘤內科學會(ESMO)年會、美國臨床腫瘤學會(ASCO)年會,并最終收錄在《臨床腫瘤學雜志》(Journal of Clinical Oncology,IF: 32.956)。特瑞普利單抗還憑借這項研究獲得了美國FDA授予的孤兒藥資格和突破性療法認定,這也是中國抗體類藥物第一次獲得FDA的突破性療法認定。
POLARIS-02的主要研究者中山大學腫瘤防治中心院長徐瑞華教授在大會致辭中對特瑞普利單抗新適應癥的上市表示祝賀,充分肯定了我國研發人員、研究者和患者為全球鼻咽癌治療的發展做出的貢獻。
“中國是全球鼻咽癌患者最多的國家,雖然早期鼻咽癌治療效果尚可,但復發/轉移性鼻咽癌的整體臨床預后不佳,因此尋求更好的治療手段是晚期鼻咽癌治療的當務之急。”徐瑞華教授表示,“針對復發/轉移性鼻咽癌患者的單藥免疫治療POLARIS-02研究為全球鼻咽癌治療的發展貢獻了中國方案。目前,特瑞普利單抗已向美國監管部門提交了上市申請。相信再過不久,不論是中國還是全球層面,首個在鼻咽癌領域獲批適應癥的抗PD-1單抗都將是中國‘智造’。”
在鼻咽癌治療領域,特瑞普利單抗已在臨床布局方面實現了從一線至后線的“全線貫穿”,包括覆蓋后線患者的POLARIS-02研究和針對一線治療患者的JUPITER-02(NCT03581786)研究。會上,中山大學腫瘤防治中心麥海強教授介紹了這兩項研究所取得的進展。
“特瑞普利單抗的新適應癥獲批開創了中國乃至全球鼻咽癌免疫治療的新紀元。”麥海強教授表示,“POLARIS-02研究結果顯示,特瑞普利單抗為接受過一線、二線,甚至三線治療的患者帶來了更長生存獲益。這部分患者長期以來都處于缺乏有效藥物治療的境地,特瑞普利單抗為他們帶來了新的希望。”
在POLARIS-02研究的92例接受過至少二線系統化療失敗的復發/轉移性鼻咽癌患者中,特瑞普利單抗單藥治療的客觀緩解率(ORR)為23.9%,中位緩解持續時間(mDOR)達到14.9個月,疾病控制率(DCR)為41.3%,中位總生存時間(mOS)達到15.1個月[1]。
此外,在一線治療領域,同樣由徐瑞華教授擔任主要研究者的JUPITER-02研究也已達到主要研究終點。JUPITER-02研究是一項隨機、雙盲、安慰劑對照、國際多中心的III期臨床研究,也是迄今為止全球范圍內規模最大的免疫檢查點抑制劑聯合化療一線治療復發或轉移性鼻咽癌的III期臨床研究。根據期中分析結果,特瑞普利單抗聯合吉西他濱/順鉑一線治療復發或轉移性鼻咽癌患者,較吉西他濱/順鉑的標準一線治療,可顯著延長患者的無進展生存期。基于JUPITER-02研究,君實生物于今年2月向國家藥品監督管理局(NMPA)提交了特瑞普利單抗聯合化療用于晚期一線未接受過系統性治療的復發轉移性鼻咽癌的新適應癥上市申請并獲受理。
麥海強教授表示,“特瑞普利單抗作為中國創新型藥企生產的藥物,引領國際治療方案,通過全球多中心臨床研究定義全新的鼻咽癌治療方法,為鼻咽癌免疫一線治療做出了突出貢獻。”
君實生物首席運營官馮輝博士在會上介紹了君實生物的研發布局和未來展望。“我們針對鼻咽癌治療制定了‘全線貫穿’的研發布局,目前已獲得該領域的一項適應癥獲批,我們也將繼續努力向前推進,期待為更多晚期鼻咽癌患者提供更好的治療選擇。”
馮輝博士表示,作為君實生物腫瘤免疫領域的核心產品,君實生物正在全球層面同步推進特瑞普利單抗的研發與商業化布局,涉及黑色素瘤、鼻咽癌、尿路上皮癌、肺癌、食管癌、肝癌、乳腺癌等十多個瘤種、30多項單藥和聯合療法研究。特瑞普利單抗在美國獲得FDA授予的突破性療法、快速通道以及孤兒藥資格認定,也將加速君實生物的海外商業化進程。馮輝博士表示,“未來,君實生物將繼續遵循‘立足本土,布局全球’的戰略規劃,持續關注國人中高發,且對免疫治療有較好響應、臨床急需治療的瘤種,為中國患者乃至全球患者提供世界一流、值得信賴的生物源創藥,貢獻中國力量。”
[1] 特瑞普利單抗注射液(拓益®)產品說明書 |
關于特瑞普利單抗注射液(拓益®)
特瑞普利單抗注射液(拓益®)作為我國批準上市的首個國產以PD-1為靶點的單抗藥物,獲得國家科技重大專項項目支持。本品獲批的第一個適應癥為用于既往接受全身系統治療失敗的不可切除或轉移性黑色素瘤的治療,并獲得2019年和2020年版《中國臨床腫瘤學會(CSCO)黑色素瘤診療指南》推薦。2020年12月,拓益®成功通過國家醫保談判,被納入新版目錄。2021年2月,拓益®獲得國家藥品監督管理局(NMPA)批準,用于既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療。
2020年5月,特瑞普利單抗適用于既往接受系統治療失敗或不可耐受的局部進展或轉移性尿路上皮癌患者的治療的新適應癥上市申請獲得國家藥品監督管理局NMPA受理,并于2020年7月被NMPA納入優先審評程序。2020年9月,特瑞普利單抗用于治療鼻咽癌獲得美國食品藥品監督管理局(FDA)突破性療法認定。2021年2月,特瑞普利單抗聯合化療用于晚期一線未接受過系統性治療的復發轉移性鼻咽癌的新適應癥上市申請獲得NMPA受理。2021年3月,君實生物開始向美國FDA滾動提交特瑞普利單抗上市申請。目前,特瑞普利單抗已在黏膜黑色素瘤、鼻咽癌、軟組織肉瘤領域獲得FDA授予1項突破性療法認定、1項快速通道認定和3項孤兒藥資格認定。
特瑞普利單抗自2016年初開始臨床研發,至今已在全球開展了30多項臨床研究,積極探索本品在黑色素瘤、鼻咽癌、尿路上皮癌、肺癌、胃癌、食管癌、肝癌、膽管癌、乳腺癌、腎癌等適應癥的療效和安全性,與國內外領先創新藥企的聯合療法合作也在進行當中,期待讓更多中國以及其它國家的患者獲得國際先進水平的腫瘤免疫治療。
關于君實生物
君實生物(1877.HK,688180.SH)成立于2012年12月,是一家以創新為驅動,致力于創新療法的發現、開發和商業化的生物制藥公司。公司具有豐富的在研產品管線,包括28個創新藥,2個生物類似物,覆蓋五大治療領域,包括惡性腫瘤、自身免疫系統疾病、慢性代謝類疾病、神經系統類疾病以及感染性疾病。
憑借蛋白質工程核心平臺技術,君實生物身處國際大分子藥物研發前沿,獲得了首個國產抗PD-1單克隆抗體NMPA上市批準、國產抗PCSK9單克隆抗體NMPA臨床申請批準、全球首個治療腫瘤抗BTLA阻斷抗體在中國NMPA和美國FDA的臨床申請批準,在中美兩地進行I期臨床研究。2020年,君實生物還與國內科研機構攜手抗疫,共同開發的JS016已作為國內首個抗新冠病毒單克隆中和抗體進入臨床試驗,目前已在美國、意大利獲得緊急使用授權,用本土創新為中國和世界疾病預防控制貢獻力量。目前君實生物在全球擁有兩千多名員工,分布在美國舊金山和馬里蘭,中國上海、蘇州、北京和廣州。
]]>在創新科技館中心展區(6.2H),一個實驗室操作臺上擺放著各類試劑瓶。小瓶子里有大乾坤,這里展示的是君實生物的抗疫創新藥物項目成果 -- 中國自主研發的、全球首個在健康受試者中開展臨床試驗的新冠病毒中和抗體藥物。在當前依然嚴峻的全球抗疫形勢下,中和抗體被國內外科學界普遍認為具有對抗新冠疫情的潛力,受到廣泛關注。從疫情暴發之初,君實生物和中科院微生物所啟動中和抗體合作開發項目,到啟動中、美兩國臨床試驗,僅4個多月的時間,JS016正致力于滿足全球抗疫需求。這是驚人的速度,也是一次產學研攜手聯動創新的成功范例。
中國速度,造就全球進展領先的新冠中和抗體
自2020年初暴發至今,新冠肺炎已在全球造成近三千萬例感染,超92萬例死亡,存在極大的未被滿足的臨床需求。君實生物與中科院微生物所響應國家號召,在疫情暴發之初便迅速達成合作,利用各自的優勢平臺攜手抗疫,共同開發針對新冠病毒的潛在預防與治療性療法 -- 中和抗體。
這是一場本土醫藥人與病毒的“賽跑”。中科院微生物首先利用單B細胞抗體篩選平臺,從康復期患者體內分離并篩選出多個抗體,并于2月初將抗體序列交到君實生物手中。接棒后,君實生物的研發和產業化團隊基于公司自身優秀的抗體研發全生命周期技術平臺,迅速對候選抗體進行多路并行開發和規模化生產。
經過雙方團隊夜以繼日的努力,以往需要18個月的抗體臨床前開發時間被壓縮到短短4個月。JS016通過體外和體內的活性和有效性評價、動物實驗、臨床前毒理研究、工藝開發與質量研究、臨床樣品制備等重重考驗,被確認為最終的臨床候選物,于今年6月初,在復旦大學附屬華山醫院進入I期臨床試驗,成為國內最早進入臨床階段的新冠病毒中和抗體。
強強聯手,研究成果令人振奮
今年5月,國際權威期刊《自然》雜志(Nature,IF 43.070)在線發表了君實生物和中科院微生物所合作開發的中和抗體臨床前研究成果,首次在全球范圍內報告了抗新冠病毒中和抗體的非人靈長類動物實驗結果。研究顯示,重組全人源單克隆中和抗體JS016能夠特異性結合新冠病毒表面刺突蛋白受體結構域,并能有效阻斷病毒與宿主細胞表面受體ACE2的結合,在恒河猴動物實驗中能夠顯著抑制病毒感染,顯示出治療和預防效果,具有進行臨床轉化的價值。
在安全性方面,JS016抗體基因來源于康復病人單個B細胞,是全人源天然抗體,經人體免疫系統篩選,不結合人體自身抗原,預期有較好的安全性。
為了避免既往SARS病毒研究中出現的抗體依賴性增強(ADE)效應(如急性呼吸道損傷),君實生物的研發人員憑借抗體工程化改造的經驗積累,對候選抗體進行Fc段改造,引入LALA突變,消除潛在風險。在動物實驗中,治療組或預防組動物均具有完整的肺泡結構,表現出有限的病理肺損害,表明經過工程化改造的抗體在顯著抑制新冠病毒的同時,減少了感染相關的肺損傷。
本土創新,商業化合作造福全球
今年5月初,君實生物與美國禮來制藥公司簽署新冠抗體藥物的合作協議,共同研發及商業化潛在的預防與治療性抗體療法,禮來制藥被授予在大中華地區外對JS016開展研發及商業化的獨占許可,旨在加速JS016在全球范圍內的臨床研究。
目前,JS016已于今年6月在中、美兩國啟動臨床試驗,并在7月初完成I期試驗的全部受試者入組。君實生物正在開展針對輕型/普通型新冠肺炎患者的Ib期國際多中心臨床研究,預計將盡快開展針對重型及危重型患者的II/III期臨床研究。同時,后續也將針對高危人群開展抗體預防作用的研究。美國的臨床試驗也由君實生物的海外合作伙伴全速推進,目前已進入II期階段。JS016有望為中國和世界疾病預防控制貢獻力量。
君實生物首席執行官李寧博士表示:“JS016的開發是產學研攜手攻關的成果,展現了本土創新的君實速度、中國速度。這次君實生物能夠作為本土科技創新企業的代表,受邀參加中國工博會并獲得‘CIIF創新引領獎’我們倍感榮幸,同時感到責任重大。創新是企業發展之源,也是國家發展之源。中國正處在科技創新的黃金發展時期,一方面創新企業面臨更好的發展環境,另一方面也對創新能力提出了更高的要求。君實生物將繼續努力,讓更多的中國和全球患者受益于中國創新,為全球抗疫和健康事業做出中國貢獻。”
關于JS016(重組全人源抗新冠病毒單克隆抗體注射液)
JS016是一款重組全人源單克隆中和抗體,特異性結合SARS-CoV-2表面刺突蛋白受體結構域,并能有效阻斷病毒與宿主細胞表面受體ACE2的結合。該項目由君實生物與中國科學院微生物研究所共同開發。
在新冠肺炎疫情暴發之初,君實生物迅速啟動了中和抗體的研發工作以抗擊疫情。公司利用自身的工藝平臺完成了IND所需的臨床前研究,用于GLP毒理研究的抗體工藝開發和生產,以及臨床批次的抗體GMP生產。目前,JS016已作為國內首個新冠病毒中和抗體進入臨床階段。君實生物的合作伙伴禮來制藥也于第二季度啟動了JS016在美國的臨床試驗。
關于君實生物
君實生物(1877.HK,688180.SH)成立于2012年12月,是一家以創新為驅動,致力于創新療法的發現、開發和商業化的生物制藥公司。公司具有豐富的在研產品管線,包括22個創新藥,2個生物類似物,覆蓋五大治療領域,包括惡性腫瘤、自身免疫系統疾病、慢性代謝類疾病、神經系統類疾病以及感染性疾病。
憑借蛋白質工程核心平臺技術,君實生物身處國際大分子藥物研發前沿,獲得了首個國產抗PD-1單克隆抗體NMPA上市批準、國產抗PCSK9單克隆抗體NMPA臨床申請批準、全球首個治療腫瘤抗BTLA阻斷抗體在中國NMPA和美國FDA的臨床申請批準。今年,君實生物還與國內科研機構攜手抗疫,共同開發的JS016已作為國內首個抗新冠病毒單克隆中和抗體進入臨床試驗,用本土創新為中國和世界疾病預防控制貢獻力量。目前君實生物在全球擁有近兩千名員工,分布在美國舊金山和馬里蘭,中國上海、蘇州、北京和廣州。
官方網站:www.junshipharma.com
官方微信:君實生物