這標志著埃及、沙特阿拉伯及其他地區白血病患者個性化基因治療新時代的開始。
根據諒解備忘錄,雙方將優先開展高質量慢病毒載體的開發和大規模生產—這是白血病及其他血液瘤的CAR-T細胞療法的關鍵成分。博騰生物將充分發揮其在病毒載體和細胞療法的工藝開發與GMP生產優勢,助力EVA Pharma提供安全、有效且可規模化的治療方案。
此次合作實現了優勢互補:博騰生物在病毒載體及細胞療法生產方面擁有前沿技術和豐富經驗,而EVA Pharma不僅在高科技生物制藥領域持續擴張,還在中東和非洲地區建立了完善的區域基礎設施和市場領先地位。通過這一合作,雙方將推動創新癌癥療法的技術轉移和本土化生產,同時確保符合高質量標準。
EVA Pharma首席執行官Riad Armanious表示:"癌癥患者需要的不僅是希望,更應獲得曾經遙不可及的創新療法。EVA Pharma與博騰生物正強強聯手,推動創新療法的規模化、本土化生產,讓更多患者公平受益。"
博騰股份副總經理,博騰生物首席財務官陳暉表示:"我們很高興與EVA Pharma達成合作,共同提高變革性細胞療法的可及性。這一合作不僅開創了新興市場先進療法生產的可持續模式,更踐行了我們'讓好藥更早惠及大眾'的使命,充分展現了博騰生物在推動全球先進療法發展中的獨特價值。
該合作響應了全球擴大先進免疫治療可及性的號召,尤其惠及細胞和基因治療基礎設施有限的市場。通過在埃及和沙特阿拉伯建立本地化生產中心,雙方將有效降低成本、縮短治療時間,并為中東和非洲(MEA)地區的腫瘤治療樹立全新標桿。"
關于EVA制藥
EVA制藥致力于改善全球可負擔、高質量藥品的可及性,重點關注三大核心支柱:創新、開發和可持續可及性。該公司在兩個研究中心利用尖端技術,為中東和非洲帶來首創的能力,包括從AI預測到生物產品的mRNA研發。
EVA制藥擁有5000名專業人員,在四個國際公認的創新制造設施中每天生產超過一百萬件醫療產品,這些設施已獲得多個監管機構的批準。
公司致力于確保對緊迫且未滿足的疾病領域的可持續可及性,其產品組合專注于十二個治療領域:抗感染、代謝健康、骨骼、神經科學、腫瘤學、呼吸系統、婦科、泌尿學和男科學、兒科、眼科、胃腸道、家庭醫學,以滿足本地和國際需求。
EVA制藥是中東和非洲地區增長最快的醫療保健公司之一,擁有廣泛的泛非業務,同時在70多個國家運營。
更多信息,請訪問:http://www.evapharma.com
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018年12月,立足蘇州,以上市公司-博騰股份(股票代碼:300363)為依托,為全球客戶提供基因與細胞治療藥物從臨床前研究到藥品上市全生命周期所需的一站式服務解決方案。
博騰生物建立了質粒、病毒載體、細胞治療、基因治療、核酸療法等CRO和CDMO平臺,擁有總面積超過20000m2的研發與生產基地、10條病毒載體生產線、12條GMP細胞治療生產線(含2個陽性生產車間),以及上百個潔凈車間。截至目前,博騰生物已助力客戶在全球范圍內獲得18個臨床批件,覆蓋中國、美國、新西蘭等國家,已有6個臨床I期/II期的細胞治療項目,并成功幫助多個海外項目轉化到中國。
我們致力于以客戶為中心,為客戶提供卓越的全球化、端到端CDMO服務,讓好藥更早惠及大眾。
更多信息,請訪問:https://www.portonbio.com
 ]]>
]]>青藜風云論壇(CGCT)是由博騰生物發起,并聯合眾多合作伙伴打造的專注于CGT領域的品牌峰會,已成功舉辦五屆,我們與近5000參會者共享青藜盛況 , 共同探索 CGT 藥物從研發、注冊申報到臨床轉化的各個環節。青藜論壇旨在推動基因與細胞治療行業生態圈的建設,本屆大會設1場主論壇和2場主題論壇,邀請了40+國內外頂尖專家、學者和臨床醫生,匯聚500+位同仁加盟,共同探討技術創新、臨床應用以及產業發展趨勢,推動細胞與基因治療技術的臨床轉化和產業化進程。
深圳市鹽田區科技創新局副局長楊婷、中國研究型醫院學會醫工轉化與健康產業融合專業委員會、副主委兼秘書長張蘇華為大會致辭,向各位與會嘉賓表示誠摯的歡迎,預祝大會圓滿成功。
博騰股份副總經理、博騰生物首席財務官陳暉為大會作開幕致辭。細胞與基因療法是極具前景的新型治療藥物,在技術、資本和政策、臨床需求等的驅動下依然呈現積極態勢,2024年全球CGT市場規模突破300億美元,同比增長35%。從國家到地方層面,政府機構紛紛出臺措施,大力支持細胞治療技術的研發與應用。作為行業的重要參與者,博騰生物不斷提升端到端的CDMO服務能力。截至目前,累計為幫助客戶在全球范圍內獲得18個IND批件,管線類型包括CAR-T,MSC、TIL、NK和mRNA等。尤其在細胞治療領域,博騰生物積累了豐富的經驗且具有顯著的行業優勢,已有5個臨床期的項目訂單在執行中,并成功幫助多個海外項目轉化到國內。歷經五年的沉淀和成長,青藜風云論壇一直堅持和與會嘉賓一起用心賦能基因細胞治療產業,一起推動創新藥在中國乃至全球的快速發展。期待與在座的各位專家、企業家攜手,共譜華章,共謀發展。
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018年12月,立足蘇州,以上市公司-博騰股份(股票代碼:300363)為依托,為全球客戶提供基因與細胞治療藥物從臨床前研究到藥品上市全生命周期所需的一站式服務解決方案。
博騰生物建立了質粒、病毒載體、細胞治療、基因治療、核酸療法等CRO和CDMO平臺,擁有總面積超過20000m2的研發與生產基地、10條病毒載體生產線、12條GMP細胞治療生產線(含2個陽性生產車間),以及上百個潔凈車間。截至目前,博騰生物已助力客戶在全球范圍內獲得18個臨床批件,覆蓋中國、美國、新西蘭等國家,已有5個臨床I期/II期的細胞治療項目,并成功幫助多個海外項目轉化到中國。
我們致力于以客戶為中心,為客戶提供卓越的全球化、端到端CDMO服務,讓好藥更早惠及大眾。
 ]]>
]]>iPSC來源的RPE細胞治療在年齡相關性黃斑變性(AMD)等致盲性眼病治療中展現出巨大潛力,有望為眼科疾病患者帶來新的治療希望。濟視同光聚焦眼科細胞治療的前沿和突破,在重要視網膜疾病的發病機制和創新療法研發領域積累了豐厚的成果,已建立具有自主知識產權的高效誘導分化技術平臺。此次合作將充分發揮博騰生物在iPSC和細胞治療領域豐富的項目經驗和技術優勢,為濟視同光提供包括iPSC重編程及建庫,RPE定向分化的工藝優化,RPE終產品的GMP生產,質量研究及IND申報支持等全方位服務。
濟視同光創始人創始人兼首席科學家徐國彤博士表示:"我們很高興能與博騰生物這樣的專業CDMO企業達成合作。博騰生物在iPSC領域的技術實力和豐富的項目經驗,將幫助我們加速創新眼科細胞治療藥物的研發進程,早日造福患者。"
博騰股份副總經理、博騰生物首席財務官陳暉表示:"濟視同光的研發團隊憑借深厚的技術積累,已建立高效穩定的RPE分化工藝,并在臨床前研究中證實了其產品的安全性和功能性。我們期待通過此次深度合作,充分發揮博騰生物在iPSC-CMC開發方面的專業能力,共同攻克iPSC細胞治療藥物開發中的關鍵技術挑戰。博騰生物將整合國際化研發團隊和嚴格的質量管理體系,為合作伙伴提供全方位的技術支持,讓這一創新療法早日惠及全球患者。"
關于濟視同光
濟視同光醫藥科技(寧波)有限公司成立于2023年10月,已完成天使輪和天使+輪融資。公司以治療眼科疾病的細胞藥物開發與生產為主,有多條研發管線。其中,重點項目iPSC衍生的獨特的年輕態RPE細胞移植治療干性視網膜變性在動物模型中獲得明顯好于已報道的其他RPE細胞的療效,所創立的具有自主知識產權的高效誘導分化方法將傳統需要120-150天的分化周期縮短到25天,獲得高質量細胞的同時能顯著降低成本、提高可及性,為全球數億干性視網膜變性患者的視力改善帶來希望。
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018年12月,立足蘇州,以上市公司-博騰股份(股票代碼:300363)為依托,為全球客戶提供基因與細胞治療藥物從臨床前研究到藥品上市全生命周期所需的一站式服務解決方案。
博騰生物建立了質粒、病毒載體、細胞治療、基因治療、核酸療法等CRO和CDMO平臺,擁有總面積超過20000m2的研發與生產基地、10條病毒載體生產線、12條GMP細胞治療生產線(含2個陽性生產車間),以及上百個潔凈車間。截至目前,博騰生物已助力客戶在全球范圍內獲得18個臨床批件,覆蓋中國、美國、新西蘭等國家,已有5個臨床I期/II期的細胞治療項目,并成功幫助多個海外項目轉化到中國。
我們致力于以客戶為中心,為客戶提供卓越的全球化、端到端CDMO服務,讓好藥更早惠及大眾。
 ]]>
]]>華隆生物團隊作為研究者發起的多項MATC治療相關的前瞻性和回顧性臨床研究,涵蓋了MATC細胞在多種實體瘤治療中的創新應用并取得顯著性的臨床獲益。博騰生物作為國內細胞治療CDMO領軍企業,將憑借其完善的工藝開發平臺、符合GMP標準的生產體系以及豐富的IND申報經驗,為華隆生物提供全流程的CMC優化服務,加快MATC細胞治療藥物從實驗室邁向臨床應用。
華隆生物董事長黃明光表示:"我們非常高興與博騰生物達成戰略合作。博騰生物在細胞治療CDMO領域擁有深厚的技術積累和成熟的合規經驗,此次合作將極大提升我們MATC管線的研發效率,加速IND申報進程。我們期待通過雙方的緊密協作,早日推動這一創新療法進入臨床,造福廣大患者。"
博騰股份副總經理、博騰生物首席財務官陳暉表示:"華隆生物在細胞免疫治療領域具有扎實的研發實力,此次合作也是博騰生物在細胞治療CDMO服務領域的又一重要里程碑。我們非常榮幸能夠為華隆生物提供符合法規的高質量MATC細胞CMC服務,并助力其完成IND申報。未來,博騰生物將繼續發揮技術平臺和項目經驗優勢,與行業伙伴攜手推動更多創新細胞治療藥物的開發,讓前沿療法更快惠及患者。"
關于華隆生物
河南省華隆生物技術有限公司成立于2012年,是一家專注于新型細胞技術研發與產業化應用的國家高新技術企業。秉持存、研、藥、用的發展戰略,公司主要開展細胞儲存、細胞產品研發及相關細胞技術服務,在免疫細胞和干細胞的分離存儲技術中各項關鍵指標均達到同行業先進水平,涵蓋目前所有主流細胞治療開發的技術產品,部分產品核心技術指標處于行業前列。通過平臺建設、技術體系打造、人才隊伍培養、市場網絡布局、新型技術產品儲備、細胞治療藥品轉化及前瞻性臨床試驗開展等方面的不懈努力,現公司已成為河南省內細胞治療技術研發和應用領域的龍頭企業,市場份額逐年增長,力爭打造本行業具有影響力的知名企業。
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018年12月,立足蘇州,以上市公司-博騰股份(股票代碼:300363)為依托,為全球客戶提供基因與細胞治療藥物從臨床前研究到藥品上市全生命周期所需的一站式服務解決方案。
博騰生物建立了質粒、病毒載體、細胞治療、基因治療、核酸療法等CRO和CDMO平臺,擁有總面積超過20000m2的研發與生產基地、10條病毒載體生產線、12條GMP細胞治療生產線(含2個陽性生產車間),以及上百個潔凈車間。截至目前,博騰生物已助力客戶在全球范圍內獲得18個臨床批件,覆蓋中國、美國、新西蘭等國家,已有5個臨床I期/II期的細胞治療項目,并成功幫助多個海外項目轉化到中國。
我們致力于以客戶為中心,為客戶提供卓越的全球化、端到端CDMO服務,讓好藥更早惠及大眾。
 ]]>
]]>膠質母細胞瘤(GBM)是中樞神經系統最常見的原發性惡性腫瘤,具有侵襲性強、復發率高、預后差等特點。P134細胞注射液是一款靶向CD44和(或)CD133的自體CAR-T產品,其作用機制為特異性識別并結合在原發性和復發性膠質母細胞瘤(GBM)中呈現特異性互斥高表達抗原靶標,高效激活并延長T細胞壽命,從而殺傷腫瘤細胞。
作為天士力的CDMO合作伙伴,博騰生物為該項目提供了從質粒、病毒到CAR-T細胞生產的工藝開發及生產服務,并完成了數十例研究者發起臨床試驗(IIT) 樣品的生產,在項目推進過程中,所有生產批次均一次性成功,且申報資料零發補通過CDE審評,充分體現了質量體系的高度合規性和生產穩定性。
服務優勢加速項目推進
- 質粒生產:穩健的兩步法層析工藝,快速完成了質粒工程批及注冊批生產,極大的縮短了周期并降低項目成本;
- 病毒生產:采用自主研發的LV-SMART®慢病毒懸浮生產平臺,實現物料國產率90%以上,且無動物源成分、批間差異小、低成本、低殘留、高產量、高活性。
- 細胞生產:制備高轉染效率的CAR-T細胞,各項放行指標均符合要求。面對客戶靈活的臨床方案,高質量交付數10例IIT樣品且臨床效果明顯。
博騰生物憑借其端到端的CDMO平臺優勢,與天士力建立了深度合作關系。我們衷心祝愿P134細胞注射液的臨床試驗順利推進,早日為復發膠質母細胞瘤患者帶來新的治療希望,期待未來繼續深化合作,讓好藥更早惠及大眾。
關于天士力
天士力醫藥集團股份有限公司(證券代碼:600535),是現代中藥國際化領軍企業,始終秉承"創造健康,人人共享"的企業使命,推動中醫藥與現代醫學融合發展,持續聚焦中國市場容量最大、發展最快的心腦血管、消化代謝、腫瘤三大疾病領域,致力于提供臨床急需甚至填補中國臨床市場空白的藥物研發,利用現代中藥、生物藥、化學藥協同發展優勢進行創新藥物的戰略布局,繼續保持行業領先優勢與研發創新的發展動力。
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018年12月,立足蘇州,以上市公司-博騰股份(股票代碼:300363)為依托,為全球客戶提供基因與細胞治療藥物從臨床前研究到藥品上市全生命周期所需的一站式服務解決方案。
博騰生物建立了質粒、病毒載體、細胞治療、基因治療、核酸療法等CRO和CDMO平臺,擁有總面積超過20000m2的研發與生產基地、10條病毒載體生產線、12條GMP細胞治療生產線(含2個陽性生產車間),以及上百個潔凈車間。截至2024年12月,博騰生物已助力客戶在全球范圍內獲得18個臨床批件,覆蓋中國、美國、新西蘭等國家,已有5個臨床I期/II期的細胞治療項目,并成功幫助多個海外項目轉化到中國。
我們致力于以客戶為中心,為客戶提供卓越的全球化、端到端CDMO服務,讓好藥更早惠及大眾。
博騰圍繞XDC偶聯藥物為奧金提供中國和美國兩地申報IND的CMC藥學研究與GMP生產整包CDMO服務,博騰將依托近20年端到端一體化CDMO服務經驗,組建原液制劑技術融合和大小分子學科交叉的復合型項目團隊,全方位賦能和加速推進客戶項目獲批進入臨床。此次戰略合作,標志著博騰與奧金在XDC偶聯藥物領域展開全方位和深層次合作,攜手助力全球XDC偶聯藥物的蓬勃發展,共推讓好藥更早惠及大眾。
關于奧金生命科學:
奧金生命科學(宜興)有限公司是一家致力于通過XDC偶聯藥物的方式,開發藥物精準遞送技術平臺和藥物的生物科技公司,由江蘇金絲利藥業股份有限公司和香港奧迪曼藥業科技有限公司聯合創辦,核心技術管理團隊擁有30多年MNC和Biotech公司藥物開發經驗。奧金生命科學擁有自主知識產權的獨創平臺技術,致力于開發在體內能定點、定時、定量按需釋放的偶聯藥物,以全新的技術,從根本上改善藥物的安全性和有效性,解決臨床急需解決的問題,滿足未被滿足的臨床需求。
關于博騰股份:
博騰股份(股票代碼:300363)為全球藥企、生物科技公司、科研機構等提供從臨床前研究到藥品上市全生命周期所需的小分子藥物、多肽與寡核苷酸藥物、蛋白與偶聯藥物以及細胞與基因治療藥物等一站式服務解決方案,研發、生產、運營場地覆蓋中國(重慶、上海、四川、江蘇、江西和湖北)、美國、斯洛文尼亞、比利時、瑞士和丹麥等地。我們致力于以客戶為中心,為客戶提供卓越的全球化、端到端CDMO服務,讓好藥更早惠及大眾。
關于博騰蛋白與偶聯藥物CDMO服務平臺:
博騰蛋白與偶聯藥物(Conjugates) CDMO服務平臺,在中國上海、美國新澤西設有多個研發中心和GMP生產基地,能為全球藥企與新藥研發機構提供從臨床前開發至商業化上市所需的蛋白及偶聯藥物端到端一體化CDMO 解決方案。主要服務內容包括:Payload-Linker制備、偶聯藥物成藥性研究、細胞株構建、上下游工藝開發、偶聯工藝開發、制劑開發、分析方法開發、生物及偶聯藥物原液(DS)和制劑(DP)GMP生產、穩定性研究、偶聯藥物臨床用藥的生產、以及申報所需的藥學資料支持等一站式CMC服務。
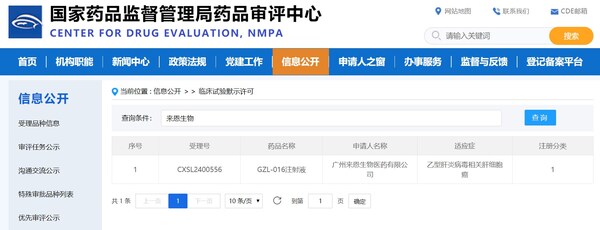
GZL-016注射液通過mRNA編碼T細胞受體(TCR), 靶向乙肝病毒表面抗原,因此經體外改造的T細胞被賦予了特異性識別并殺傷HBV相關肝細胞癌的能力。這款自體T細胞療法利用mRNA瞬時表達的特性,結合多次輸注的臨床治療方案,旨在保證患者用藥安全性的同時帶來了令人期待的療效。在治療前,患者無需進行清淋,這進一步提高了治療的安全性和可及性。本次IND獲批,進一步證明了來恩生物的研發與創新實力。
博騰生物作為來恩生物的CDMO合作伙伴,和來恩生物密切合作,為該項目提供了藥學研究相關的服務,最大限度的保證了項目交付質量和周期。雙方團隊緊密合作,極大地加快了GZL-016注射液的IND申請進程。
來恩生物擁有的這款自體T細胞治療產品是全球首款(First-in-Class)針對乙肝病毒表面抗原,用于治療乙肝相關肝細胞癌的TCR-T細胞治療產品。這款產品此前已經獲得美國FDA批準的全球第一個1b/2期IND臨床試驗批件,并且獲得了FDA的快速通道認定。博騰生物祝愿來恩生物未來在mRNA編碼TCR-T療法領域取得更多新進展,惠及更多患者。
關于來恩生物
來恩生物 (Lion TCR) 是一家已進入臨床階段的生物科技公司,專注于TCR療法的開發和商業化。公司前瞻性地使用了mRNA來編碼TCR,應用于臨床試驗治療肝癌,展現了良好的安全性和顯著的療效,并通過AI賦能的TCR發現平臺,拓展靶點及適應癥,為尚未解決的臨床問題提供創新療法。同時公司已布局了除了自體細胞療法以外的現貨型療法產品平臺,包含依托mRNA-LNP遞送的體內TCR-T療法等。
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018 年12月,立足于蘇州工業園區,以上市公司-重慶博騰制藥科技股份有限公司(股票代碼:300363)為依托,搭建了質粒、病毒載體、細胞治療、基因治療、核酸療法等CRO和CDMO平臺,提供從科研包裝,建庫,工藝開發,分析方法開發,cGMP生產到制劑灌裝的端到端服務,貫穿藥物的不同研發階段,幫助客戶加快藥物研發與上市進程。
博騰生物聚焦基因與細胞治療,在博騰股份的成功經驗之上,以國際一流的專業人才為核心,秉承"客戶第一"的服務宗旨,以"合規、專業、專注、開放協作"為品牌理念,延續母公司強大的IP保護和項目管理機制以及完善的質量管理體系,充分利用核心團隊將基因和細胞治療產品推向臨床直至上市的成功經驗,為全球客戶提供優質和高效的服務,讓好藥更早惠及大眾。
博騰作為全球領先的CDMO服務平臺,積極響應市場需求,通過布局新分子能力,投入資源以擴展自身在這一前沿領域的服務能力。自博騰Tides CDMO服務平臺成立以來,在小核酸藥物、多肽藥物、偶聯藥物方向持續為客戶提供從工藝開發、優化,毒理批生產,臨床樣品生產,以及結構表征、分析方法開發與驗證、穩定性研究、全球新藥注冊申報等 "一站式"服務。隨著本次多肽、寡核苷酸、Payload-Linker三個GMP生產車間在奉賢工廠投入運營,特別是OEB 5高活區域的啟用,標志著博騰多肽與寡核苷酸藥物,偶聯藥物CDMO服務平臺真正具備了為全球客戶提供各類新型藥物從臨床前開發到商業化的一體化CMC解決方案能力。
活動上,相關領導及嘉賓上臺發表講話,并共同完成了啟動儀式。
"此次博騰奉賢生產基地的升級和擴展,不僅是生產效率的提升,更為各類新型藥物的開發提供了強大的支持動力。杭州灣開發區也將繼續支持,共同助力打造高質量發展的產業新高地。"上海杭州灣經濟技術開發區副總經理翁俊表示。
"此次奉賢生產基地產能升級,是博騰在多肽與寡核苷酸藥物領域持續深耕的又一重要里程碑。博騰將繼續強化自身的技術能力,不斷探索新分子領域,以支持全球客戶的創新藥物開發。"博騰股份高級副總經理、首席運營官白銀春表示。
"本次升級將為博騰在全球市場提供更強的競爭力,博騰將繼續堅定信心,搶抓新機遇,加速新分子產品的研發生產以及業務發展,為客戶提供更具競爭力的產品和服務,為區域生物科技發展做出貢獻。"博騰股份副總經理、董事會秘書皮薇表示。
最后,小分子新藥研發中心合成大分子服務部負責人謝立華先生的帶領下,共同參觀了奉賢生產基地新分子產能車間。
此次博騰股份完成New Modality產能升級,不僅彰顯了博騰在多肽、寡核苷酸及ADC等新分子藥物領域的技術實力,更是借助此次布局促進博騰在歐美市場實現重要商機和新客戶突破,進一步推動博騰的全球化進程。
]]>博騰生物建立了端到端的基因與細胞治療CDMO平臺,覆蓋質粒、病毒載體、mRNA以及各類自體和異體免疫細胞。同時,博騰生物也非常注重研發和技術平臺的建設投入,依托特有的CRISPR/Cas基因編輯體系以及高效穩定的細胞轉染系統,已經成功幫助客戶在不同細胞系實現基因編輯。微光基因已開發國際領先且全面的底層自主知識產權的基因編輯/表觀遺傳工具包和結構獨創且具備底層專利的VLP遞送系統,可實現體外/體內的高效目的基因編輯或長效目的基因抑制以及高效且特異的蛋白、mRNA或RNP蛋白復合物遞送。
本次雙方達成戰略合作,這將進一步拓展博騰生物的技術平臺能力,借助微光基因強大的基因編輯工具及VLP遞送系統,從平臺創新到項目交付,從CRO到CDMO,拓展基因編輯技術在細胞與基因療法的應用,讓好藥更早惠及大眾。
微光基因首席執行官胡洋博士表示:"我們很高興與博騰生物達成合作。微光基因自主專利的CRISPR/Cas編輯器及VLP遞送系統在細胞基因治療領域上呈現出優秀的效率及優良的安全性。雙方的合作將發揮協同效應,加速微光自主專利的CRISPR/Cas編輯器、堿基編輯器、表觀編輯器和VLP遞送系統的研究和應用,為中國細胞基因治療的研發和產業化做出貢獻。"
博騰股份副總經理、博騰生物首席財務官陳暉表示:"我們非常高興能與微光基因達成戰略合作。微光基因在新型基因編輯工具及遞送系統方面擁有Cas蛋白、堿基編輯器、表觀編輯器和VLP遞送系統等基礎知識產權,平臺與技術的創新給我們留下了深刻的印象。博騰生物致力于在基因與細胞治療領域為全球客戶提供端到端的CDMO服務,并協同產業鏈上下游企業實現合作共贏。我們相信博騰生物和微光基因能夠達成良好的伙伴關系,并將新型基因編輯技術的合作擴展到尚被滿足的新領域,共同賦能細胞與基因療法的開發和商業化。"
關于微光基因
微光基因于2021年在蘇州成立,以基因編輯工具和細胞基因治療方法開發為核心,致力于針對罕見病、難治性疾病及衰老相關疾病的藥物研發與產業化。公司團隊在基因編輯、蛋白質科學及衰老、罕見病等研究領域有深厚積累,并已開發出具有底層自主知識產權、可在全球自由實施的新型基因編輯工具包。公司產品管線均使用新型基因編輯工具,產品管線在同步、快速、有效地推進臨床前工作,公司核心管線具備全球稀缺性。
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018 年12月,立足于蘇州工業園區,以上市公司-重慶博騰制藥科技股份有限公司(股票代碼:300363)為依托,搭建了質粒、病毒載體、細胞治療、基因治療、核酸療法等CRO和CDMO平臺,提供從科研包裝,建庫,工藝開發,分析方法開發,cGMP生產到制劑灌裝的端到端服務,貫穿藥物的不同研發階段,幫助客戶加快藥物研發與上市進程。
博騰生物聚焦基因與細胞治療,在博騰股份的成功經驗之上,以國際一流的專業人才為核心,秉承"客戶第一"的服務宗旨,以"合規、專業、專注、開放協作"為品牌理念,延續母公司強大的IP保護和項目管理機制以及完善的質量管理體系,充分利用核心團隊將基因和細胞治療產品推向臨床直至上市的成功經驗,為全球客戶提供優質和高效的服務,讓好藥更早惠及大眾。
博騰生物致力于提供端到端的基因與細胞治療CDMO服務,在核酸治療領域擁有豐富的工藝開發和生產經驗,覆蓋mRNA, saRNA, circRNA等不同類型,可提供從IIT、IND到臨床生產全流程服務。吉賽生物突破circRNA成藥底層技術瓶頸,且擁有自主知識產權的環化專利核心技術。雙方本次將形成全面的戰略合作伙伴關系,深度拓展在circRNA領域的技術合作與資源共享,這也將進一步強化博騰生物端到端的CDMO平臺建設,從研發技術創新到項目優質交付,為客戶提供更有價值的服務。
吉賽生物創始人兼CEO劉明表示:"我們非常高興與博騰生物達成戰略合作。circRNA因其獨特的穩定結構,被認為將成為制藥行業的首選RNA平臺,并可能開啟下一代疫苗、罕見疾病治療、抗癌藥物等產品的出現。吉賽生物是引領circRNA科學研究與應用轉化的領先企業,博騰生物在CGT領域擁有豐富的服務經驗和深厚的技術積淀。我們雙方在產業鏈合作上非常契合,可以充分發揮各自專業與資源優勢,加速推進管線進展,讓circRNA藥物早日惠及患者。"
博騰生物首席財務官陳暉表示:"協同產業鏈上下游企業實現合作共贏,并為客戶提供更有價值的服務,這是博騰生物構建CGT生態圈的重要意義。我們非常高興能與吉賽生物這樣優秀的CRO企業達成戰略合作。吉賽生物擁有扎實穩健的RNA合成創新技術,在circRNA科學研究與應用轉化方面積累了豐富的項目經驗和平臺優勢。通過整合雙方的技術優勢與平臺資源,進一步完善和提升博騰生物的平臺能力,從早期研究到臨床及商業化生產,為RNA創新療法的開發提供CRDMO全流程解決方案,賦能全球客戶。"
]]>藥輔協同工藝(co-processing)的主要目標是提高藥品制造工藝的可靠性和效率,支持直接壓片或連續化生產技術。協同處理的 APIs能夠解決粉體流動不足、堆積密度低、粒度分布寬和可壓縮性等問題,從而促進直接壓片技術的發展。當傳統的方法進行 API 結晶(如通過溶劑選擇、過飽和度控制、晶種引入或研磨技術)不足以解決這些問題時,API 與賦形劑的協同處理可以顯著改善其功能特性,從而克服這些挑戰。
ETC 聯盟成員希望通過開發藥輔協同工藝平臺技術來解決API 結晶工藝中的各種挑戰,并尋求與第三方合作。為此ETC 公開征集并篩選了藥輔協同工藝技術平臺解決方案的建議和提案。在對行業服務提供商和學術機構提交的大量提案進行廣泛而嚴格的評估后,ETC 委員會最后選擇了 Porton J-STAR向行業和科學界提供商業化的藥輔協同工藝平臺技術解決方案。根據合同條款,ETC聯盟成員公司將與 Porton J-STAR合作開發這一技術平臺。
"隨著 Porton J-STAR 與 ETC 合作啟動后,我們將利用前沿技術、加速藥物開發、建立行業標準,幫助客戶藥物開發進程,讓好藥更早惠及大眾。" Porton J-STAR總經理Renee Miao博士表示。
與此同時,博騰J-Star將成立"藥輔協同工藝平臺",該平臺將由全球藥輔協同工藝專家——博騰J-Star首席技術官San Kiang博士領導。
關于ETC
ETC 由行業頂尖的多家制藥和生物技術公司組成,共同致力于應對藥物化學、制造和控制 (CMC)方面的挑戰。我們的目標是識別、評估、開發和改進科學工具和技術,以支持高效的藥物開發和生產。聯盟的使命是在強有力商業案例的支持下,主動探索推動和賦能創新技術發展的高價值機會,并與更多行業公司開展深度合作。
關于博騰股份
博騰股份為全球藥企、生物科技公司、科研機構等提供從臨床前研究到藥品上市全生命周期所需的小分子藥物、多肽與寡核苷酸、生物大分子(mAb, ADC等)以及基因與細胞治療藥物等一站式服務解決方案,研發、生產、運營場地覆蓋中國(重慶、上海、四川、江蘇、江西、湖北)、美國、斯洛文尼亞、比利時、瑞士和丹麥等地。我們致力于以客戶為中心,為客戶提供卓越的全球化、端到端CDMO服務,讓好藥更早惠及大眾。
CONTACT
For Porton J-STAR: Keith Dodson, J-STAR Research Inc., a subsidiary of Porton Pharma Solutions. Email: kdodson@portonusa.com;
For ETC: James Vergis, ETC Secretariat and Principal Faegre Drinker Biddle and Reath, LLP Email: james.vergis@faegredrinker.com or info@etconsortium.org
博騰生物具備完善的細胞治療工藝設備,能夠滿足不同類型的細胞生產,包括細胞建庫、自體及異體細胞治療生產,并支持多種工藝路線如病毒載體轉染、非病毒載體電轉和基因編輯等。通過引入MaxCyte技術平臺,博騰生物進一步加強了其在非病毒電轉工藝開發與臨床生產方面的能力。目前博騰生物已使用MaxCyte為多個細胞治療項目提供IIT產品生產、IND申報藥學研究及臨床項目生產服務。
對于不同細胞治療類型的電轉工藝開發與臨床生產,博騰生物將聯合MaxCyte強大的技術與合規團隊,應用MaxCyte ExPERT GTX與現有平臺其他類型電轉設備持續為基因與細胞治療藥物加速轉化賦能。
]]>博騰生物作為專業的基因與細胞治療CDMO,建立了質粒、病毒載體、細胞治療、基因治療、核酸療法等CRO和CDMO平臺,積累了豐富項目經驗。本次戰略合作,鯤石生物將借助博騰生物的成熟經驗和相關資源,推進管線RR-M01的IND申報,是利他、利家、利國之舉,為惡性實體腫瘤尤其是復發、難治性實體瘤的治療帶來了新的希望。
鯤石生物CEO尹秀山表示:“我們非常高興與博騰生物達成戰略合作,博騰生物是一家非常成熟的CDMO企業,尤其在細胞治療領域積累了豐富的項目經驗。我們相信博騰生物優秀的技術團隊可以助力鯤石生物快速高效地推進RR-M01新藥的研發,加快細胞治療藥物臨床注冊及上市進程。"
博騰股份聯合創始人,博騰生物首席執行官陶榮表示:"很高興此次能與鯤石生物這樣優秀的巨噬細胞藥物研發企業達成深度戰略合作。去年,鯤石生物自主研發的第三代CAR-M藥物RR-M01注射液完成全球首例臨床受試者給藥及評估,并取得了良好的效果;加速推進該管線的臨床試驗注冊,盡快造福癌癥患者,是我們的共同目標。非常感謝鯤石生物的信任,博騰生物也將依托國際化技術標準、嚴謹的實驗設計、規范的質量管理以及豐富的項目經驗,為鯤石生物新藥研發保駕護航,期望在雙方的共同努力下,加快鯤石生物CAR-M藥物的開發進程,讓好藥更早惠及大眾。"
]]>NK010具有受體譜較優化、靶點多樣化、高純度、普適性等高抗癌優勢,使其具有治療多類型腫瘤的潛力。NK010也存在擴展至非腫瘤疾病治療的潛在空間,還是后續一系列合成NK細胞藥物(SynNK)的最佳底盤細胞。此次I期臨床首選卵巢癌適應癥進行探索,臨床前研究表明,NK010細胞注射液在卵巢癌、肝癌等實體腫瘤以及急性髓系白血病等動物模型中都表現出強大的抗腫瘤活性。
博騰生物作為恩凱賽藥的合作伙伴,為該項目提供產品制備及相關注冊資料的支持服務,全力支持NK010項目獲美國FDA IND批準。值得一提的是,NK010項目是博騰生物參與的首個NK細胞治療制劑項目。
據中國工程院&歐洲科學院雙院士、恩凱賽藥創始人田志剛教授介紹,"對于NK010項目獲得臨床試驗許可,我感到由衷地高興和自豪。與此同時,我們要探索的東西還很多,團隊已經著手對下一階段項目進行更多、更深入的研究,以滿足臨床之急需。恩凱賽藥堅持自主研發的創新路線,在NK細胞領域,我們還有數項產品管線在推進,希望為全球患者帶來更多的新型療法。"
博騰生物首席執行官王泱洲博士表示:"祝賀恩凱賽藥NK細胞治療產品NK010注射液獲得FDA IND批準,我們很榮幸能夠支持該項目。NK010治療實體瘤的適應癥在美國FDA獲批,是對恩凱賽藥研發創新實力及國際化發展的認可。我們忠心祝愿NK010產品后續的臨床試驗進展順利,也期待未來與恩凱賽藥持續深度合作,賦能恩凱賽藥更多研發管線取得新進展,實現NK細胞治療產品在實體瘤及血液瘤領域的突破。"
關于恩凱賽藥
上海恩凱細胞技術有限公司(恩凱賽藥)是一家聚焦研發免疫細胞治療創新性技術的生物技術公司。基于團隊30年以上對NK細胞基礎生物學、臨床前和臨床轉化探索研究,恩凱賽藥致力于成為對NK細胞治療及其前沿技術有深度理解的世界領先細胞治療公司。恩凱賽藥擁有獨有的異體外周血NK細胞擴增與凍存,基因修飾,臨床"現貨"級的ABCDE-NK®工業化生產平臺(單一供血一次NK細胞產量可達萬億級),并通過邏輯門基因線路等合成免疫學底盤技術,實現對NK細胞的智能化編輯,使之能精準靶向癌細胞,精準適應腫瘤微環境,精準匹配供受者的效應/靶細胞。恩凱賽藥將以解決臨床重大疾病治療難題為導向,實現精準免疫治療為目標,開發了一系列原創智能化NK細胞產品,力圖打造不斷突破核心技術和持續國際領先的免疫細胞藥物企業,建設成全球新一代NK細胞治療技術和產品的策源地。恩凱賽藥已完成A輪融資,由華蓋資本領投,股東包括中科院創投、乾道基金、呈益資本、天狼星資本、喬景資本等多家知名投資機構。目前公司正在積極開放對外合作及融資,以推進核心產品的臨床試驗和更多新產品開發。
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018 年12月,立足于蘇州工業園區,以上市公司-重慶博騰制藥科技股份有限公司(股票代碼:300363)為依托,搭建了質粒、病毒載體、細胞治療、基因治療、核酸療法等CRO和CDMO平臺,提供從科研包裝,建庫,工藝開發,分析方法開發,cGMP生產到制劑灌裝的端到端服務,貫穿藥物的不同研發階段,幫助客戶加快藥物研發與上市進程。
博騰生物聚焦基因與細胞治療,在博騰股份的成功經驗之上,以國際一流的專業人才為核心,秉承"客戶第一"的服務宗旨,以"合規、專業、專注、開放協作"為品牌理念,延續母公司強大的IP保護和項目管理機制以及完善的質量管理體系,充分利用核心團隊將基因和細胞治療產品推向臨床直至上市的成功經驗,為全球客戶提供優質和高效的服務,讓好藥更早惠及大眾。
博騰生物致力于提供端到端的基因與細胞治療CDMO服務,覆蓋質粒、細胞治療、基因治療、溶瘤病毒、核酸治療及活菌療法等領域,目前已成功幫助客戶完成多個基因與細胞治療藥物的CMC和全球申報服務。阿思科力專注于突破性免疫細胞治療產品研發與生產,主要聚焦NK/CAR-NK抗腫瘤免疫細胞治療藥物領域,并搭建了完善的免疫細胞治療研發生產體系,具有通用型CAR-NK、異體NK/CAR-NK和mRNA-LNP三大技術平臺。據協議,博騰生物將為阿思科力NK細胞項目提供開發與生產及中國申報服務,支持其在防癌抗衰美容等領域的應用。
阿思科力創始人兼董事長李華順博士表示:"CAR-NK細胞療法在抗癌方面具有潛力。這種療法通過利用基因工程修飾NK細胞,使其能夠更好地識別和殺傷腫瘤細胞,同時降低對正常細胞的傷害。在實體瘤治療領域,CAR-NK細胞療法具有優勢。此外,NK細胞在抗衰方面,單劑量20億年輕健康細胞可以降低循環中衰老細胞高達80%-100%[1] ,且持續效率超過3個月到18個月之久。阿思科力在NK領域具有深厚積淀和工藝優勢,我們打造了Ascle-NK平臺培養出卓越超能的NK細胞。與此同時,博騰生物在基因與細胞治療藥物的研發、生產以及項目申報方面取得了令人矚目的成就。我相信憑借其豐富的經驗和專業技術,博騰生物能夠為阿思科力推動NK細胞在抗衰美容防癌等領域的應用提供重要支持。"
博騰生物CEO王泱洲博士表示:"我們非常高興與阿思科力達成戰略合作。阿思科力的研發管線,尤其在NK領域具有深厚積淀和優勢。博騰生物建立端到端的基因與細胞治療CDMO平臺,具備優秀的工藝開發能力和無菌藥品生產車間,高質量GMP細胞產品的生產能力和經驗,能夠根據客戶需求進行定制化生產。同時博騰生物還擁有國際先進的分析方法開發技術和平臺,確保未來產品的質量和安全性,以國際化的生產檢測放行標準賦能支持阿思科力的研發和生產項目。我們非常期待與阿思科力的緊密合作,強強結合,共同推動NK細胞項目的CMC及中國申報。通過博騰生物的CDMO平臺,快速助力阿思科力在NK細胞抗衰美容防癌領域取得新進展。"
[1] Yousefzadeh, M. J., Flores, R. R., Zhu, Y., Schmiechen, Z. C., Brooks, R. W., Trussoni, C. E., Cui, Y., Angelini, L., Lee, K. A., McGowan, S. J., Burrack, A. L., Wang, D., Dong, Q., Lu, A., Sano, T., O'Kelly, R. D., McGuckian, C. A., Kato, J. I., Bank, M. P., Wade, E. A., … Niedernhofer, L. J. (2021). An aged immune system drives senescence and ageing of solid organs. Nature, 594(7861), 100–105. https://doi.org/10.1038/s41586-021-03547-7 |
在過去十年中,基于腺相關病毒載體的基因療法的發展,極大推動了新一輪生物技術革命。盡管關于AAV載體構建和組裝的研究取得了許多重要成就,但實現其治療潛力的關鍵步驟——組織特異性AAV外殼蛋白的創建,仍然是一個長期存在的挑戰。而天然血清型 AAV 在滿足臨床需求方面的局限性,也激發了科學家們通過人工智能技術尤其是AI大模型來推動創新 AAV 開發的興趣。
"我們十分看好基因治療領域的未來發展,并且很榮幸能夠和博騰生物合作,共同開發人工設計的基因遞送體系,助力更多行業伙伴。"百圖生科高級副總裁瞿佳潤表示,"百圖生科所擁有的大型預訓練基礎模型xTrimo,能夠快速基于合作方的多樣化數據開發各個領域內表現最佳的任務模型。而博騰生物高質量的腺相關病毒載體技術平臺及研究數據,將極大提高我們的模型表現,使得AAV的高性能創新設計成為可能。"
博騰生物首席執行官王泱洲博士表示:"我們非常高興能和百圖生科達成合作,借助AI模型為基因治療領域的研究提供更優質的解決方案。博騰生物在搭建完善的CDMO平臺的同時,還建立了具有自主知識產權的技術平臺,如AAVantage®新型AAV衣殼變體和文庫,以及其他基因編輯的工具平臺。基于百圖生科前沿的 AI 和生物技術,雙方攜手構建生命科學領域的大模型,加速可規模化的實驗平臺與大數據智能分析平臺的有機融合,滿足從研發到生產的多樣化需求,加速藥物研發的進程,實現更大的產業化價值。"
隨著基因傳遞載體領域數據的不斷增長,以及大型蛋白質語言模型的出現,我們相信在可預見的未來,人工智能將在基因傳遞載體研究中發揮關鍵作用,并為人類健康的新時代創新和重大突破提供推動力。
]]>本次沙龍活動邀請了7位嘉賓和現場參會的近百名行業精英一起,圍繞基因與細胞治療藥物的研發、生產和注冊申報等不同環節展開深入討論,現場反響熱烈,各專家的專業分享也給現場觀眾帶來全新的思路和解決方案。
三卿生物聯合創始人趙靜作為本次沙龍的主持人,代表主辦方向現場參會者表示熱烈歡迎,同時介紹了目前基因與細胞治療行業的進展。希望通過本次沙龍的經驗交流與深入溝通,共同探討產業備受關注的話題,為基因與細胞治療藥物領域的發展貢獻智慧和力量。
博騰生物營銷副總經理閻宇分享了博騰生物獨特的CGT藥物研發生產及注冊申報一體化服務。在CMC方面,博騰生物專注基因與細胞治療CDMO,覆蓋質粒、細胞治療、基因治療、溶瘤病毒、核酸治療及活菌療法等,已為9個IND申報項目提供CMC和全球申報服務,管線類型包括CAR-T,TIL和mRNA。在建設CGT生態圈方面,博騰生物致力于整合優質資源,聯合上下游合作伙伴為研發藥企提供一站式服務;同時,博騰生物也注重行業生態圈的構建,成功打造了專注在CGT領域的青藜風云論壇,我們期望各界人士的積極參與,共同為推動基因與細胞治療產業的發展貢獻力量。
博騰生物細胞治療生產總監李華分享了"不同細胞治療產品工藝放大及優化策略",圍繞CAR-T、TCR-T、UCAR-T、MSC、TIL等不同典型細胞治療產品進行講解。針對不同細胞類型,需要分析每種細胞類型在目的細胞分離、細胞的激活及改造、細胞的大規模擴增以及細胞的濃縮灌裝等各個工藝階段的考量點,根據考量點初步確定工藝放大的路徑。選擇自動化設備匹配工藝放大的需求,以及密閉化流程的設計。在產品檢測項方面,需要根據確定的工藝放大的流程以及不同細胞類型的特點,確定中間品檢測的方案,關鍵參數的控制以及質量標準。
軍科正源科學指導部科學家王亞楠介紹了"基于AAV載體基因治療藥物臨床評價策略探討"。不同于傳統的大小分子藥物,rAAV載體介導的基因治療藥物具有自身的結構和功能特點,其臨床評價策略也更具特殊性和復雜性,需要綜合考慮風險獲益,采取具體問題具體分析的基本原則,開展臨床試驗評價。其中生物分析涉及分子、細胞、免疫學等多平臺生物分析技術,軍科正源建立了包括基因、分子、細胞等多個水平的生物分析方法對臨床生物樣本中的某rAAV載體藥物的生物分布和載體脫落、生物標志物及免疫原性等指標進行生物分析,為該藥物臨床有效性及安全性評價提供堅實的數據支持。
三卿生物聯合創始人李丹分享了"CGT藥物注冊申請與審評審批政策解析"的主題報告。如何加快CGT產品從研發走向上市的進程一直是大家關注的焦點。通過對藥物研發生命周期中涉及到的不同注冊節點進行合理規劃,可以很大程度上加速產品獲批上市。本次從注冊的角度對藥物研發生命周期中涉及到的溝通交流政策及加快上市注冊程序的申請時間點、申請流程及資料準備等相關內容進行了介紹,同時對國內已上市及已遞交上市申請的CAR-T產品的注冊申報流程進行了案例分享。通過此次對溝通交流及加快上市注冊程序相關內容的分享,希望對各位同仁的藥品注冊過程有所幫助。
昆拓項目管理與運營負責人李文婷介紹了"自體細胞產品注冊臨床運營管理的挑戰與機遇",自體細胞產品注冊臨床運營管理是挑戰和機遇共存的。從IIT/POC走向注冊IND進一步走向多中心試驗,面臨著研究的中心標準制定與執行統一、臨床執行監控與風險管理、有限臨床資源的綜合管理的多種挑戰。臨床CRO公司,是很好的臨床研究策略和管理服務的解決途徑,可以助力和輔導CGT賽道中的申辦方對自體細胞類產品完成品種定制化、可市場化的臨床應用管理。在挑戰的應對中,能進一步與臨床試驗帶來的機遇"輔導醫生執行醫學轉化計劃、基于臨床試驗參與者利益的臨床運營、競爭與共贏帶來的行業快速發展"實現握手。
博騰生物分析檢測&基因治療工藝開發副總經理陳慧介紹了"細胞治療產品的藥學研究與變更的一般考量"。在過去的十多年里,CAR-T細胞療法在臨床上得到了越來越多的突破,多款產品獲批上市。該治療領域技術迭代速度快,工藝復雜,生產用原材料種類繁多,可能帶來后期藥學上的頻繁變更。報告從細胞產品的特性,應用及關鍵質量屬性研究層面對CAR-T產品做了整體性的介紹,同時介紹了細胞治療產品藥學變更計劃、設計原則和變更前后的可比性研究方案。通過引用已經上市的CAR-T產品發生的藥學變更案例,與大家共同探討了如何執行藥學變更及通過哪些可比性研究數據來獲得監管機構的認可。
賽賦醫藥藥理藥效(京南)副總經理陳海寧圍繞"細胞治療產品非臨床有效性評價的一般考慮"進行了分享,針對細胞產品雙軌制申報(IIT與IND)模式下,為了做好細胞治療藥物的有效性研究,符合FDA\NMPA申報的要求,必須熟悉細胞治療品種的特點和了解非臨床有效性研究關注重點。從概念驗證試驗的角度開展非臨床有效性研究,并分享了干細胞制劑和免疫細胞制劑臨床前研究疾病動物模型以及取得的有效性結果。
11月博騰生物將走進上海,為生物醫藥產業園區企業分享"基因與細胞治療藥物研發生產及注冊申報一體化服務主題沙龍",共同探討當前基因與細胞治療藥物研發、生產及注冊申報相關問題,促進生物醫藥產業發展。
軍科正源(北京)藥物研究有限責任公司商務副總裁譚海濱作為本次沙龍主持人,代表主辦方向現場參會者表示熱烈歡迎,同時介紹了目前基因與細胞治療行業的進展。希望大家能夠通過本次活動,一起探討CGT領域的技術難點和問題,從不同階段助力企業加快CGT藥物研發進程,讓新藥更早惠及大眾。
高新科控副總經理、兼凱得科技產業園董事長堯子致開場辭。生物醫藥產業是廣州市重點產業,2022年全市生物醫藥與健康產業增加值2108億元,擁有超過6500家生物醫藥企業,位居全國第三,廣州開發區更是聚焦了大分子、小分子、醫療器械和細胞治療等眾多領域的優秀藥企。高新科控先后投資了百濟神州、諾誠健華、賽納生物、創景醫療等區內外企業,收購了IVD行業老牌上市公司利德曼,為區內生物醫藥行業發展做出了一份貢獻。希望通過該活動一起探討CGT領域存在的難點與解決方案,共同推動細胞和基因療法的升級與發展,并預祝活動沙龍取得圓滿成功。
博騰生物營銷部副總經理閻宇分享了博騰生物獨特的GCT藥物研發生產及注冊申報一體化服務。在CMC方面,博騰生物專注基因與細胞治療CDMO,覆蓋質粒、細胞治療、基因治療、溶瘤病毒、核酸治療及活菌療法等,已為7個IND申報項目提供CMC和全球申報服務,管線類型包括CAR-T,TIL和mRNA。在建設GCT生態圈方面,博騰生物致力于整合優質資源,聯合上下游合作伙伴為研發藥企提供一站式服務;同時,博騰生物也注重行業生態圈的構建,成功打造了專注在GCT領域的青藜風云論壇,我們期望各界人士的積極參與,共同為推動基因與細胞治療產業的發展貢獻力量。
博騰生物細胞治療工藝開發副總經理胡迪超分享了"慢病毒載體的臨床研究進展及CMC考慮要點",介紹了慢病毒載體的臨床研究進展、慢病毒載體的大規模生產及質量控制、慢病毒載體的法規要求及分子設計考慮、慢病毒載體工藝開發的考慮要點。慢病毒載體是所有基因治療臨床試驗中發展最快的病毒載體工具,臨床應用廣泛,具有臨床安全性可靠、有效性好等優勢,但仍存在產能和生產成本等痛點以及臨床安全性擔憂。隨著生物工藝技術不斷發展,慢病毒載體大規模生產工藝不斷改進,懸浮細胞生產慢病毒載體的工藝逐漸成為主流,以LV-SMART等為代表的慢病毒載體懸浮生產系統具有生產物料無動物源性成分、易于放大、產量高、成本大幅降低等優勢。隨著產業鏈和行業體量不斷增加,慢病毒載體生產成本有望降低至每例CAR-T慢病毒成本10000元以下。此外,分子設計對于慢病毒載體的臨床安全性和有效性至關重要,同時對病毒載體滴度也有重要影響。
昆拓項目管理與運營負責人李文婷介紹了"自體細胞產品注冊臨床運營管理的挑戰與機遇",自體細胞產品注冊臨床運營管理是挑戰和機遇共存的。從IIT/POC走向注冊IND進一步走向多中心試驗,面臨著研究的中心標準制定與執行統一、臨床執行監控與風險管理、有限臨床資源的綜合管理的多種挑戰。臨床CRO公司,是很好的臨床研究策略和管理服務的解決途徑,可以助力和輔導CGT賽道中的申辦方對自體細胞類產品完成品種定制化、可市場化的臨床應用管理。在挑戰的應對中,能進一步與臨床試驗帶來的機遇"輔導醫生執行醫學轉化計劃、基于臨床試驗參與者利益的臨床運營、競爭與共贏帶來的行業快速發展"實現握手。
軍科正源生物標志物分析部門總監王芳分享了"細胞治療產品臨床評價中生物分析關注要點",她指出細胞治療產品具有多樣性、技術更新迭代快等特點,從早期不同來源、不同分化功能的干細胞,到體內免疫細胞的體外擴大培養、特異性免疫細胞的修飾改造等等,這些產品的研發態勢是積極令人鼓舞的,但是也為研發中臨床的評價工作帶來很大的挑戰。細胞治療產品由于成分的復雜性,作用機制未充分描述,多種生物活性、分析方法技術限制等因素決定了每一個研究目的中會有多種分析需求,比如PK研究涉及多技術、多組分,PD/biomarker研究涉及多指標、多平臺,免疫原性研究涉及多結構、多機制等。本次分享就近年來細胞治療產品臨床評價中生物分析中上述方向檢測方法選擇、影響因素、可能遇到的挑戰及注意問題等申辦者關注的問題進行討論。
國科賽賦(深圳)總經理韋娜圍繞"細胞制劑的IIT與IND的雙軌制融合下的臨床前研究"進行了分享,針對細胞產品雙軌制申報(IIT與IND)模式下,臨床前研究的關鍵點、研究策略進行介紹。分享了研究者發起的臨床研究(IIT)的發展情況,美國、歐盟及中國IIT研究及監管現狀;針對細胞制劑,從IIT備案、IND申請兩方面進行了對比,并針對兩個申報模式下,分享了細胞制劑如何進行臨床前研究以及真實的研究案例。
博騰生物核酸研發總監黃學基介紹了"規模化質粒制備CMC主要關注點"。質粒作為CGT領域用途最廣泛的基因遞送載體,在病毒包裝、細胞基因改造和mRNA生產等過程中起到無可替代的作用。穩定高效、成本可控的質粒工藝在當前的市場需求下顯得尤為重要。演講內容圍繞著質粒產量、超螺旋比例、序列穩定性等幾個關注點進行,闡述了質粒在分子設計、菌種構建、發酵純化工藝優化的思路,以及當前成熟工藝條件下,質粒生產放大過程可能存在的不穩定點。
三卿生物聯合創始人李丹介紹了"細胞治療藥物IND注冊申報要點"。近年來細胞和基因治療產業飛速發展,相關監管政策及指導原則不斷發布,按照藥品理念進行細胞產品開發的路徑逐漸完善。但是關于藥學、非臨床、臨床等不同模塊在藥品注冊申報時的合規性仍是大家關注的焦點。此次匯報對細胞治療藥物IND注冊申報及資料準備要點兩部分內容進行了介紹。首先,結合當前法律、法規、規章、標準、規范、相關指導原則的要求以及相關項目申報經驗,對不同細胞治療產品(以CAR-T、干細胞為例)立項、早期研發、藥學研究、非臨床研究、臨床設計、臨床試驗申請、臨床研究、上市申請等不同階段的關注點進行了介紹。隨后對pre-IND及IND申請時的資料要求、關注點及常見問題進行了講解。通過此次講演,與大家分享我們在細胞治療藥物IND申報過程中的相關經驗,以期對各位同仁在藥物開發過程中有所啟發及幫助。
后續,博騰生物還將走進杭州、南京、上海等城市,為生物醫藥產業園區企業分享"基因與細胞治療藥物研發生產及注冊申報一體化服務主題沙龍",共同探討當前基因與細胞治療藥物研發、生產及注冊申報相關問題,促進生物醫藥產業發展。
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018 年12月,立足于蘇州工業園區,以上市公司-重慶博騰制藥科技股份有限公司(股票代碼:300363)為依托,搭建了質粒、細胞治療、基因治療、溶瘤病毒、核酸治療及活菌療法等CDMO平臺,提供從建庫,工藝方法及分析方法開發,cGMP生產到制劑灌裝的端到端服務,貫穿藥物不同研發階段,幫助客戶加快藥物研發與上市進程。
博騰生物聚焦基因與細胞治療,在博騰股份的成功經驗之上,以國際一流的專業人才為核心,秉承"客戶第一"的服務宗旨,以"合規、專業、專注、開放協作"為品牌理念,延續母公司強大的IP保護和項目管理機制以及完善的質量管理體系,充分利用核心團隊將基因和細胞治療產品推向臨床直至上市的成功經驗,為全球客戶提供優質和高效的服務,讓好藥更早惠及大眾。
邦耀生物依托深厚的基因編輯技術、雄厚的研發實力以及前瞻性的管線布局,在GCT領域深耕多年并實現了快速發展,目前已有多個產品進入IND申報階段,且有3個核心產品已獲批國內IND,其中基于自主研發的造血干細胞平臺(ModiHSC®)開發的基因治療產品BRL-101,非病毒定點整合CAR-T平臺(Quikin CART®)開發的CAR-T產品BRL-201已在臨床試驗中取得出色的效果,并獲Nature、Nature Medicine等多個國際學術期刊的權威認可。博騰生物擁有端到端的基因與細胞治療CDMO服務平臺,覆蓋質粒、細胞治療、基因治療、溶瘤病毒、核酸治療及活菌療法等領域,積累了豐富的細胞治療CMC經驗。此次雙方達成戰略合作,將加速推進細胞治療藥物的商業化,讓創新療法惠及更多患者。
邦耀生物CEO鄭彪博士表示:"很高興此次能與國際CGT領域擁有豐富CDMO服務經驗的博騰生物展開深度的戰略合作,目前邦耀生物已有3個新藥項目獲批國內IND,正處于加速產品上市和緊張的藥品產能需求階段,期望通過未來多樣化的合作模式,加速邦耀生物多個創新藥物的臨床試驗轉化與落地,以造福全球遺傳疾病、惡性腫瘤及自身免疫系統疾病等患者;也期望此次的攜手合作,能進一步推動中國生物技術行業的繁榮發展。"
博騰生物首席執行官王泱洲博士表示:"我們非常高興與邦耀生物達成戰略合作。邦耀生物擁有強大的技術平臺和持續的創新能力,目前多個研發管線已取得可喜的成績。期待博騰生物端到端的基因與細胞治療CDMO平臺,支持邦耀生物快速推進細胞治療產品的臨床試驗及將來的商業化生產,成功推出更安全、更有效、更可及的創新藥。期望在雙方的共同努力下,助力中國CGT領域的發展,讓好藥更早惠及大眾。"
關于邦耀生物
上海邦耀生物科技有限公司致力于成為新商業文明時代全球領先的細胞基因藥企,邦耀生物以"以基因編輯技術引領創新,開發突破性療法,造福全人類"為使命,依托自主研發中心及與高校共建的"上海基因編輯與細胞治療研究中心",目前已產生100多項專利成果,有5個項目在8所知名醫院開展研究者發起的臨床試驗,3個項目已獲批IND,正式進入注冊臨床試驗階段,還有多個項目進入IND申報階段。其中,基因編輯治療β-地中海貧血癥、非病毒PD1定點整合CAR-T、以及UCART等項目已經取得優異臨床效果,具有全球領先性,并在Nature、Nature Medicine、Nature biotechnology等知名學術期刊上發表多篇學術論文。邦耀生物已搭建基因編輯技術創新平臺、造血干細胞平臺、非病毒定點整合CAR-T平臺、通用型細胞平臺、增強型T細胞平臺五大具有自主知識產權的技術平臺,擁有7000平米GMP中試基地及近200人的運營團隊,有力保障創新的研究成果能夠快速轉化與應用。邦耀生物通過患者需求和臨床反饋不斷推動研發產品快速更新迭代。并秉持開放、共享、共贏的態度,與全球創新生物醫藥生態鏈企業一起,加快推進創新藥物的轉化與落地,造福全球遺傳疾病、惡性腫瘤及自身免疫系統疾病等患者!
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018年12月,立足于蘇州工業園區,以上市公司-重慶博騰制藥科技股份有限公司(股票代碼:300363)為依托,搭建了質粒、細胞治療、基因治療、溶瘤病毒、核酸治療及活菌療法等CDMO平臺,提供從建庫,工藝方法及分析方法開發,cGMP生產到制劑灌裝的端到端服務,貫穿藥物不同研發階段,幫助客戶加快藥物研發與上市進程。
博騰生物聚焦基因與細胞治療,在博騰股份的成功經驗之上,以國際一流的專業人才為核心,秉承"客戶第一"的服務宗旨,以"合規、專業、專注、開放協作"為品牌理念,延續母公司強大的IP保護和項目管理機制以及完善的質量管理體系,充分利用核心團隊將基因和細胞治療產品推向臨床直至上市的成功經驗,為全球客戶提供優質和高效的服務,讓好藥更早惠及大眾。
博騰生物營銷副總經理閻宇作為愛心企業代表出席活動并發言,表達了博騰生物參與罕見病兒童公益活動的初心,博騰生物作為基因與細胞治療CDMO,一直積極關注罕見病藥物研發及患者保障,未來將繼續發揮自身的技術和平臺優勢,加快罕見病藥物的落地,惠及更多罕見病患者,與此同時博騰生物也呼吁社會關注罕見病群體,共同推動罕見病藥物。
活動現場南京摯愛與省婦兒基因會領導為愛心企業包括博騰生物頒發了愛心公益證書。博騰生物倍感榮幸,今后博騰生物也會持續支持罕見病公益事業,讓好藥更早惠及患者。
博騰生物作為基因與細胞治療CDMO企業,自8月起參加南京摯愛罕見病兒童關愛中心發起“為罕奔跑,點燃生命”公益「一塊走」捐步活動,號召了眾多行業伙伴加入活動,共同助力罕見病公益活動,為罕見病兒童群體的健康未來而奔走。
同時,博騰生物也參加了線上公益捐款活動,號召大家一起關愛DMD(杜氏肌營養不良癥)患者群體,傳遞愛的希望。活動捐贈的款項將用于DMD兒童罕見病開展科普宣傳,多學科義診,康復培訓,助學助貧活動,旨在聯結罕見病患者及患者家屬、醫藥企業、醫院臨床專家、公益組織,以及廣泛的社會大眾,匯集每一份愛心力量,為罕見病兒童及家庭筑起期望的橋梁。
關于博騰生物
蘇州博騰生物制藥有限公司成立于2018年12月,立足于蘇州工業園區,以上市公司-重慶博騰制藥科技股份有限公司(股票代碼:300363)為依托,搭建了質粒、細胞治療、基因治療、溶瘤病毒、核酸治療及活菌療法等CDMO平臺,提供從建庫,工藝方法及分析方法開發,cGMP生產到制劑灌裝的端到端服務,貫穿藥物不同研發階段,幫助客戶加快藥物研發與上市進程。
博騰生物聚焦基因與細胞治療,在博騰股份的成功經驗之上,以國際一流的專業人才為核心,秉承“客戶第一”的服務宗旨,以“合規、專業、專注、開放協作”為品牌理念,延續母公司強大的IP保護和項目管理機制以及完善的質量管理體系,充分利用核心團隊將基因和細胞治療產品推向臨床直至上市的成功經驗,為全球客戶提供優質和高效的服務,讓好藥更早惠及大眾。
國科易賽總經理、賽賦醫藥注冊總監李鵬作為本次沙龍的主持人,代表主辦方向現場參會者表示熱烈歡迎,同時介紹了目前基因與細胞治療行業的進展。希望通過本次沙龍的經驗交流與深入溝通,幫助解決藥物研發、生產及注冊申報中遇到的問題,促進產業快速發展,為病患提供更好的治療選擇。
博騰生物營銷部副總經理閻宇分享了博騰生物獨特的GCT藥物研發生產及注冊申報一體化服務。在CMC方面,博騰生物專注基因與細胞治療CDMO,覆蓋質粒、細胞治療、基因治療、溶瘤病毒、核酸治療及活菌療法等,已為7個IND申報項目提供CMC和全球申報服務,管線類型包括CAR-T,TIL和mRNA。在建設GCT生態圈方面,博騰生物致力于整合優質資源,聯合上下游合作伙伴為研發藥企提供一站式服務;同時,博騰生物也注重行業生態圈的構建,成功打造了專注在GCT領域的青藜風云論壇,我們期望各界人士的積極參與,共同為推動基因與細胞治療產業的發展貢獻力量。
賽賦醫藥集團CEO兼CSO王全軍從申報角度解析CGT藥物非臨床研究關注要點及案例解析。為了做好CGT藥物非臨床評價研究,符合FDA\NMPA申報的要求,首先必須熟悉CGT品種的特點和風險等特殊考慮,比如基因治療產品通常單次給藥,持續發揮療效,需要評估長期有效性和安全性,需要關注延遲毒性風險等。在關注CGT非臨床評價中藥理學和毒理學的一般科學原則的基礎上,應case by case逐案分析,最終形成基于風險,采用科學驅動的非臨床研究策略,達到基于科學數據,證明在擬用患者人群中具有可接受的獲益-風險比的基本理念。接著,從非臨床有效性及概念驗證試驗、非臨床藥代動力學試驗和非臨床安全性評價研究三方面講述了CAR-T和AAV基因治療產品非臨床研究關注要點及案例解析,賽賦醫藥擁有多種CAR-T、AAV病毒、溶瘤病毒以及LNP-mRNA等CGT藥物非臨床研究成功申報FDA和NMPA的經驗及研發案例。
博騰生物細胞治療生產總監李華分享了“不同細胞治療產品工藝放大及優化策略”,圍繞CAR-T、TCR-T、UCAR-T、MSC、TIL等不同典型細胞治療產品進行講解。針對不同細胞類型,需要分析每種細胞類型在目的細胞分離、細胞的激活及改造、細胞的大規模擴增以及細胞的濃縮灌裝等各個工藝階段的考量點,根據考量點初步確定工藝放大的路徑,選擇自動化設備匹配工藝放大的需求,以及密閉化流程的設計。在產品檢測項方面,需要根據確定的工藝放大的流程以及不同細胞類型的特點,確定中間品檢測的方案,關鍵參數的控制以及質量標準。
三卿生物聯合創始人李丹介紹了“細胞治療藥物IND注冊申報要點”。近年來細胞和基因治療產業飛速發展,相關監管政策及指導原則不斷發布,按照藥品理念進行細胞產品開發的路徑逐漸完善。但是關于藥學、非臨床、臨床等不同模塊在藥品注冊申報時的合規性仍是大家關注的焦點。
此次匯報對細胞治療藥物IND注冊申報及資料準備要點兩部分內容進行了介紹。首先,結合當前法律、法規、規章、標準、規范、相關指導原則的要求以及相關項目申報經驗,對不同細胞治療產品(以CAR-T、干細胞為例)立項、早期研發、藥學研究、非臨床研究、臨床設計、臨床試驗申請、臨床研究、上市申請等不同階段的關注點進行了介紹。隨后對pre-IND及IND申請時的資料要求、關注點及常見問題進行了講解。通過此次講演,與大家分享我們在細胞治療藥物IND申報過程中的相關經驗,以期對各位同仁在藥物開發過程中有所啟發及幫助。
軍科正源上海子公司負責人馬克為現場觀眾分享了“基于CRISPR-cas9基因編輯療法的生物分析策略”。CRISPR技術自問世以來,為生物制藥的發展提供了一個強有力的工具,基于CRISPR/Cas9的基因編輯已經成為治療人類遺傳疾病(包括心血管疾病、神經疾病和癌癥)最有前途的工具之一。生物分析作為開發這類藥物的關鍵環節,為科學家更好的理解CRISPR/Cas9的作用方式、治療效果和安全性,提供了有效工具。基于CRISPR/Cas9的基因治療,尤其是體內基因編輯,作用機理復雜,為生物分析帶來了很高的挑戰,應依據不同成分的作用機理和檢測要求,制定符合科學性的測試方案。
昆拓腫瘤醫學負責人任輝分享了“細胞療法治療實體瘤的挑戰和臨床開發”。在國家政策的大力支持下,細胞類產品蓬勃發展,中國已經成為全球第二大細胞類研發大國,但目前已上市和pre-NDA產品主要集中在血液瘤領域。實體瘤領域的細胞研發,除了TCR-T Afami-cel和TIL Lifileucel已遞交上市申請,其他同類細胞產品和CAR-T等依然處于早期臨床階段,但已顯示出較好的療效和安全性。
細胞療法攻克實體瘤面臨很多臨床困境,包括腫瘤異質性和逃逸、細胞歸巢浸潤、免疫抑制微環境、細胞耗竭、安全性(on-target, off-tumour)等。未來研發重點在于如何提高療效、改善安全性,各種細胞療法需要揚長避短,開發現貨型、低成本的產品,并完善工藝流程。從臨床開發路徑看,IIT做多不如做深,旨在支持IND申報、優化I期,從IIT→I期→II期→NDA,需要在臨床開發過程中保持與監管機構的及時、高效溝通。
博騰生物質量部高級總監何海英分享了“GCT產品不同研究階段的GMP要求、案例分析與審計要點”。根據質量風險管理和科學,依據PDA56及ICH Q10分享基因細胞治療產品不同階段的質量要求,包括研發階段、臨床階段和商業化階段的不同GMP要求,分享了基因細胞治療產品不同階段的物料管理控制策略,以及如何迎接官方和客戶審計,就FDA 2007-2020年檢查過的17個基因細胞廠房35次檢查的高頻缺陷項和GLP、GCP審計關注點和缺陷項進行分享。