生活質量改善和急性加重風險降低趨勢與ENHANCE-1/2一致
耐受性良好
計劃2025年下半年提交新藥申請
上海 2025年5月20日 /美通社/ -- 優銳醫藥("Nuance Pharma")近日公布其評估恩司芬群(Ensifentrine)用于慢性阻塞性肺疾病(COPD)維持治療的三期臨床試驗ENHANCE-CHINA(NCT05743075)頂線結果。該試驗成功達到主要終點及多項次要終點,顯示出肺功能改善。
研究藥物恩司芬群(Ensifentrine)是一款全球首創的磷酸二酯酶3、4雙靶點抑制劑(PDE3,PDE4),憑借單個化合物同時實現支氣管擴張以及抗炎作用,可通過普通霧化器直接遞送到肺部,不需要復雜的手口協調操作。
研究亮點
- 研究人群(n=526例隨機受試者):
- 治療組間受試者人口統計學和疾病特征均衡
- 約46%受試者接受COPD背景治療(長效毒蕈堿拮抗劑LAMA或長效β2受體激動劑LABA),約38%同時使用吸入性糖皮質激素(ICS)
- 主要終點(FEV1 AUC 0-12h):
- 第12周時,恩司芬群組較安慰劑組的基線校正平均FEV1曲線下面積(0-12小時)改善110 mL(p<0.0001)
- 在年齡、吸煙狀態、COPD嚴重程度、背景用藥、ICS使用、慢性支氣管炎、FEV1可逆性等關鍵亞組中均顯示統計學顯著且具臨床意義的改善
- 肺功能次要終點:
- 第12周峰值FEV1較安慰劑增加174 mL(p<0.0001)
- 第12周晨間谷值FEV1和晚間谷值FEV1分別較安慰劑增加36 mL(p=0.0533)和65 mL(p=0.0038),證實每日兩次給藥方案
- 第12周給藥后0-4小時和6-12小時平均FEV1較安慰劑分別增加162 mL(p<0.0001)和77 mL(p=0.0003)
- COPD癥狀與生活質量:
- 通過呼吸困難變化指數(TDI)評估的呼吸困難改善結果提示,恩司芬群組在所有時間點(第6、12、24周)的改善均具臨床意義,第24周較安慰劑顯著改善0.8個單位且具有統計學意義
- 通過圣喬治呼吸問卷(SGRQ)衡量的患者生活質量結果提示,恩司芬群組第24周從基線改善超過最小臨床重要差異(MCID)-4個單位,較安慰劑顯著改善-2.9個單位
- 呼吸癥狀評分(E-RS)結果提示,恩司芬群組從第6周起持續改善至12周及24周,在各時間點數值均優于安慰劑
- 急性加重率降低:
- 恩司芬群組24周內中重度COPD急性加重率較安慰劑組降低28%(RR=0.72,95% CI:0.43-1.22)
- 首次中重度急性加重時間風險降低25%(HR=0.75,95% CI:0.44-1.28)
- 良好的安全性:
- 恩司芬群耐受性良好,治療相關不良事件發生率與安慰劑相似
優銳醫藥創始人兼首席執行官Mark Lotter先生表示:"我們非常高興ENHANCE-CHINA三期研究取得積極結果,這使我們距離為中國COPD患者提供這一急需的創新療法更近一步。這些數據進一步驗證了恩司芬群作為全球首創兼具支氣管擴張和抗炎效應的COPD治療方案的潛力。我們計劃于2025年下半年向國家藥品監督管理局(NMPA)提交新藥申請,感謝所有參與ENHANCE-CHINA研究的患者和研究人員。"
優銳醫藥首席運營官Charlie Chen博士補充道:"ENHANCE臨床研究數據提示了恩司芬群在肺功能、癥狀、生活質量及急性加重風險方面的全面改善,結合其良好的安全性,印證了這項新的治療手段將有機會改變COPD治療范式。繼積極推動中國澳門獲批,及海南博鰲和大灣區的先行先試項目后,我們期待盡快將這一藥物帶給中國患者。"
Verona Pharma總裁兼首席執行官David Zaccardelli博士表示:"我們期待優銳醫藥持續推進,讓Ohtuvayre®惠及數百萬需要更多治療手段的COPD患者。"
優銳醫藥計劃在后續學術會議上公布ENHANCE-CHINA更多數據。
2025年2月,恩司芬群(Ensifentrine,Ohtuvayre?)獲澳門特別行政區藥物管理局批準用于成人COPD維持治療。2024年11月,恩司芬群(Ensifentrine,Ohtuvayre?)通過海南博鰲樂城先行先試項目落地中國。2024年9月,完成ENHANCE-CHINA三期臨床試驗受試者入組。
2024年6月,合作伙伴Verona Pharma(納斯達克:VRNA)宣布Ensifentrine,Ohtuvayre?獲美國FDA批準用于成人COPD維持治療。
2021年,優銳醫藥與Verona Pharma簽署協議,Verona Pharma授予優銳醫藥在大中華區(中國大陸、香港、澳門和臺灣)臨床開發與商業化恩司芬群(Ensifentrine,Ohtuvayre?)的獨家權利。
]]>全球首創吸入型COPD治療藥物,同時實現支氣管擴張以及抗炎效應
上海2025年2月7日 /美通社/ -- 今日,優銳醫藥("Nuance Pharma")宣布,恩司芬群(Ensifentrine,Ohtuvayre?)已獲得中國澳門特別行政區藥物管理局的批準,用于成人慢性阻塞性肺病(COPD)的維持治療。
2024年6月,恩司芬群(Ensifentrine,Ohtuvayre?)在美國獲批,并于2024年8月底在美國商業上市。恩司芬群(Ensifentrine,Ohtuvayre?)是一款全球首創的吸入型磷酸二酯酶3、4雙靶點抑制劑(PDE3 & PDE4),雙重抑制機理使其能夠憑借單個化合物同時實現支氣管擴張以及抗炎效應。恩司芬群(Ohtuvayre?)可通過普通霧化器直接遞送到肺部,使用簡便,不需要復雜的手口協調操作。
恩司芬群(Ensifentrine,Ohtuvayre?)在中國澳門特別行政區的獲批基于包括全球三期ENHANCE臨床試驗在內的廣泛數據,其結果發表于《美國呼吸與危重癥醫學雜志》。在ENHANCE臨床試驗中,恩司芬群(Ensifentrine,Ohtuvayre?)無論單獨使用還是與其他維持療法聯合使用,均顯示出臨床益處。恩司芬群(Ensifentrine,Ohtuvayre?)在中度至重度COPD患者中耐受性良好。
優銳醫藥創始人兼首席執行官Mark Lotter先生表示:"我們很高興宣布澳門監管機構批準了恩司芬群(Ensifentrine,Ohtuvayre?)的新藥申請,這標志著該藥物首次在美國以外地區獲批。我們很期待為澳門患者提供這種極具創新性的COPD治療方案,并通過粵港澳大灣區(GBA)的創新政策惠及更廣泛患者群體。呼吸系統疾病是優銳醫藥的核心關注領域之一,在2025年完成ENHANCE-CHINA臨床試驗并在中國大陸提交新藥申請之前,通過在澳門特別行政區的獲批以及在海南博鰲和大灣區的先行先試項目,優銳醫藥期待將這種首創的創新治療方案提供給中國患者。"
Verona Pharma總裁兼首席執行官David Zaccardelli博士表示:"我們很高興恩司芬群(Ensifentrine,Ohtuvayre?)能夠幫助那些仍受COPD日常癥狀困擾的患者。我們對恩司芬群(Ensifentrine,Ohtuvayre?)的上市后初步效果感到鼓舞,并相信其獨特的藥物特性能夠重新定義COPD的治療范式。"
2024年11月,優銳醫藥獲批落地中國海南博鰲樂城先行區使用恩司芬群(Ensifentrine,Ohtuvayre?)。2024年9月,優銳醫藥完成了恩司芬群(Ensifentrine,Ohtuvayre?)用于COPD維持治療的中國三期臨床試驗ENHANCE-CHINA的患者招募工作。
2021年,優銳醫藥與Verona Pharma簽署協議,Verona Pharma授予優銳醫藥在大中華區(中國大陸、香港、澳門和臺灣)臨床開發與商業化恩司芬群(Ensifentrine,Ohtuvayre?)的獨家權利。
關于恩司芬群(Ensifentrine,Ohtuvayre?)
恩司芬群(Ensifentrine,Ohtuvayre?)是首款用于維持治療慢阻肺的吸入療法,雙重抑制機理使其能夠憑借單個化合物同時實現支氣管擴張和抗炎效應。Verona Pharma通過三期臨床項目ENHANCE("Ensifentrine as a Novel inHAled Nebulized COPD thErapy")評估了吸入型恩司芬群(Ensifentrine,Ohtuvayre?)用于COPD維持治療的效果。恩司芬群(Ensifentrine,Ohtuvayre?)在ENHANCE-1和ENHANCE-2三期臨床試驗中均達到了主要終點,顯示出具有統計學意義和臨床意義的肺功能改善。
關于Verona Pharma
Verona Pharma是一家生物制藥公司,專注于開發和商業化用于治療亟待滿足醫療需求的慢性呼吸系統疾病的創新療法。恩司芬群(Ensifentrine,Ohtuvayre?)是Verona Pharma首款商業化產品,也是首款用于維持治療慢阻肺的吸入療法,雙重抑制機理使其能夠憑借單個化合物同時實現支氣管擴張和抗炎效應。恩司芬群(Ensifentrine,Ohtuvayre?)在非囊性纖維化支氣管擴張、囊性纖維化、哮喘和其他呼吸系統疾病中具有潛在的應用前景。更多信息,請訪問www.veronapharma.com。
關于優銳醫藥
優銳醫藥是一家注重創新的生物制藥公司,擁有研發后期管線和商業化產品組合。優銳醫藥專注于專科護理,在呼吸、疼痛管理、急救護理和缺鐵性貧血等領域建立了差異化的商業化產品和創新產品管線組合。致力于解決亞太地區關鍵的未滿足醫療需求,優銳醫藥憑借"商業+研發"雙輪驅動模式,已成功孵化全球領先的研發后期管線,同時在中國和亞太地區保持自我可持續的商業化運營。更多信息,請訪問www.nuancepharma.com。
前瞻性聲明
本新聞稿可能包含前瞻性聲明,這些聲明涉及公司或其管理層對公司業務運營和財務狀況的意圖、信念或當前預期。此類前瞻性聲明并非對未來表現的保證,而是涉及風險和不確定性,或受其他因素影響,其中一些因素可能超出公司的控制范圍且難以預測。因此,由于各種因素和假設,實際結果可能與前瞻性聲明中的結果存在差異,例如我們業務的未來發展和變化、競爭環境、政治、經濟、法律和社會狀況。公司或其任何關聯公司、董事、管理人員、顧問或代表均無義務且不承諾在本新聞稿發布日期之后根據新信息、未來事件或情況修訂前瞻性聲明,除非法律要求。
]]>上海2024年9月23日 /美通社/ -- 優銳醫藥今日宣布與Altamira Therapeutics的子公司Altamira Medica Ltd.簽署獨家協議,授權優銳在部分東亞及東南亞市場開發和商業化百暢悠(Bentrio)鼻噴劑。根據修訂后的協議約定,優銳的授權范圍將從大中華區(中國大陸、香港、澳門)和韓國拓展至新加坡、馬來西亞、泰國、菲律賓、印度尼西亞、越南和臺灣等地區,覆蓋超過6.3億人口。自2022年起,優銳已在中國香港成功上市發售用于防護空氣傳播的病毒和過敏原的百暢悠鼻噴劑,并已在中國大陸提交上市許可申請。
"我們對于加深和拓展與Altamira公司就百暢悠(Bentrio)鼻噴劑的成功合作感到高興,"優銳醫藥創始人兼首席執行官Mark Lotter表示。"百暢悠具有一些獨特的產品特點,可以即時、長效地防護空氣傳播的病毒和過敏原顆粒物,同時其不含藥物成分、無防腐劑的配方具有良好的功效和耐受性。醫護人員與消費者對使用百暢悠鼻噴劑的體驗反響很好,我們期待著在更多的國家推出這款產品,并通過我們高效的銷售團隊與不斷拓展的合作伙伴網絡進行營銷,滿足更廣泛的過敏與病毒防護的患者需求。"
"我們非常滿意與優銳醫藥的授權合作,欣喜地看到他們致力于在香港和其他地區上市發售百暢悠鼻噴劑,"Altamira Medica董事會主席兼首席執行官Thomas Meyer評論道。"我們期待與優銳一起,將Bentrio從現有的授權區域拓展至更多的國家,為日益增長的東亞與東南亞地區的過敏性鼻炎患者群體帶來創新的藥械產品。"
]]>恩司芬群(Ohtuvayre?)是一款全球同類首創的磷酸二酯酶蛋白吸入型雙靶點PDE 3/4抑制劑,雙重抑制機理使其能夠憑借單個化合物同時實現支氣管擴張和抗炎效應。恩司芬群(Ohtuvayre?)可通過霧化器直接輸送到肺部,不需要復雜的協調操作。
2024年6月,優銳醫藥合作伙伴Verona Pharma plc (Nasdaq: VRNA)宣布,美國食品藥品監督管理局(FDA)已批準恩司芬群(Ohtuvayre?)用于維持治療中重度COPD成人患者的新藥上市許可申請。
優銳醫藥創始人、首席執行官Mark Lotter先生表示:"我們很高興地宣布,關鍵的三期試驗患者招募已經完成,這意味著我們最快將于2025年公布研究結果。我們欣喜于能夠在今年早些時候獲得美國FDA的成功批準后,有望為中國的COPD患者群體提供新的治療方法。
Ohtuvayre?的推出將為中國COPD患者提供一個新的治療選擇,這是一個重要的里程碑。衷心地感謝試驗的主要研究者鐘南山教授和所有站點為完成試驗、將創新藥物進一步帶給中國患者所做的貢獻。"
Verona Pharma總裁兼首席執行官David Zaccardelli博士表示:"我們對優銳醫藥開展的ENHANCE - CHINA研究進展和患者招募完成感到非常高興。我們期待將于2025年公布的研究結果以及將Ohtuvayre?帶給數以千萬的需要創新治療方式的COPD患者的持續進展。"
2021年,優銳醫藥與Verona Pharma簽訂協議,獲得在大中華區域(中國大陸、香港、澳門、臺灣)開發與商業化恩司芬群(Ohtuvayre?)的獨家權利。
關于恩司芬群(Ohtuvayre?)
恩司芬群(Ohtuvayre?)是一款全球同類首創的磷酸二酯酶蛋白吸入型雙靶點PDE 3/4抑制劑,雙重抑制機理使其能夠憑借單個化合物同時實現支氣管擴張和抗炎效應。恩司芬群在ENHANCE-1與ENHANCE-2三期臨床試驗中均達到了所有主要和關鍵次要終點,顯示出具有統計學意義和臨床意義的肺功能改善。恩司芬群在非囊性纖維化、支氣管擴張、囊性纖維化、哮喘和其他呼吸系統疾病中具有潛在的應用前景。
]]>Ohtuvayre是一款全球同類首創的磷酸二酯酶蛋白吸入型雙靶點PDE 3/4抑制劑,雙重抑制機理使其能夠憑借單個化合物同時實現支氣管擴張和抗炎效應。Ohtuvayre可通過霧化器直接輸送到肺部,不需要復雜的協調操作。
Ohtuvayre在美國獲批是基于Verona Pharma開展的ENHANCE三期臨床,該研究結果已發表刊登在《美國呼吸與重癥醫學雜志》(American Journal of Respiratory and Critical Care Medicine)。在兩項ENHANCE試驗中,Ohtuvayre證明了其單獨使用和與其他維持療法聯合使用的臨床益處。Ohtuvayre在廣泛的中度至重度COPD患者中耐受性良好。
"Ohtuvayre獲批上市是COPD治療領域的重大進步,我們相信Ohtuvayre的創新特性有望改變COPD的治療模式,"Verona Pharma總裁兼首席執行官David Zaccardelli博士表示:"我們計劃在2024年第三季度實現Ohtuvayre上市,確保Ohtuvayre能夠幫助數百萬COPD患者。"
優銳醫藥創始人兼首席執行官Mark Lotter先生表示:"我們很高興見證Ohtuvayre(恩塞芬汀)在美國獲批以及后續的商業化上市準備。我們對恩塞芬汀作為一流的創新療法在全球范圍內重新定義COPD治療方案的潛力感到非常興奮。中國擁有全球最大的COPD患者群體,對公眾來說是巨大的疾病負擔,我們致力于通過推動ENHANCE-China三期臨床研究以及區域的先行先試項目,盡快將這種首創的治療方法帶給大中華地區的患者。今天標志著一個分子的重要里程碑,我們對擴大包括新適應癥在內的機會潛力感到興奮。"
2021年,優銳醫藥與Verona Pharma簽訂協議,獲得在大中華區域(中國大陸、香港、澳門、臺灣)開發與商業化恩塞芬汀的獨家權利。2023年4月,優銳醫藥宣布ENHANCE–CHINA三期臨床試驗完成首例患者給藥。
]]>上海2024年4月25日 /美通社/ -- 優銳醫藥合作伙伴Altamira Therapeutics(納斯達克代碼:CYTO)宣布其在澳大利亞開展的評估Bentrio鼻噴劑針對季節性過敏性鼻炎(SAR)患者治療效果的NASAR隨機對照臨床試驗結果,在國際權威期刊《Allergy》四月刊的同行審評文章[1]發表,該期刊由歐洲過敏與臨床免疫學學會(European Academy of Allergy and Clinical Immunology,簡稱EAACI)出版發行,被公認為過敏學領域影響力排名最高的期刊之一。
Bentrio(AM-301)是一種不含藥物和防腐劑的鼻腔噴霧劑,用于幫助防護空氣傳播的過敏原,如花粉或室內塵螨。
NASAR試驗在澳大利亞招募了100名季節性過敏性鼻炎患者,以1:1的比例隨機分配接受Bentrio鼻噴劑與生理鹽水鼻噴劑,為期兩周、每天三次自行給藥。NASAR試驗的主要療效終點被定義為Bentrio(AM-301)與生理鹽水鼻噴劑(目前無藥物干預的季節性過敏性鼻炎管理的標準護理方式)在隨后兩周治療期間的平均基線反射性總體鼻癥狀評分(rTNSS; ANCOVA 模型)評分差異。
根據NASAR試驗結果,Bentrio受試組的rTNSS評分顯著低于生理鹽水組(LSmeans = -1.1,p = 0.013),且在所有單獨的鼻癥狀方面都有改善。通過鼻結膜炎生活質量問卷(RQLQ)測量的健康相關生活質量也顯著提高(p < 0.001)。受試患者與研究人員均評價Bentrio的療效明顯優于生理鹽水對照組(均p < 0.001)。兩種治療方法的安全性和耐受性相似。相較于生理鹽水對照組,Bentrio受試者使用緩解藥物的頻率更低,同時更多地享受了無過敏癥狀的天數。
"我們對在全球領先的過敏學醫學期刊上發表Bentrio澳大利亞關鍵試驗的研究結果感到興奮," Altamira Therapeutics的創始人、董事長兼首席執行官Thomas Meyer評論道。 "這項研究為Bentrio的防護效應提供了大量額外的證據,同時也證明了其良好的安全性和耐受性。此外,我們欣喜地看到Bentrio不僅有效緩解輕度過敏癥狀,也有助于緩解更嚴重的癥狀,同時有可能減少了患者對基于藥物的緩解治療的需求。"
優銳醫藥與Altamira Therapeutics達成獨家授權協議,在中國大陸、香港、澳門及韓國等重要亞太區域合作開發、注冊和商業化Bentrio鼻噴劑。2022年11月,優銳已率先在中國香港上市發售Bentrio鼻噴劑,并加速推進Bentrio在其他亞太地區的注冊與商業化。
"作為亞太區域領先的專注于呼吸系統疾病治療的生物醫藥公司,優銳對于在中國和亞太地區成功注冊Bentrio懷抱信心。"優銳醫藥創始人兼首席執行官Mark Lotter先生表示。"過敏性疾病有廣泛、重大的疾病負擔,而季節性過敏性鼻炎是過敏性疾病市場的核心組成。NASAR臨床試驗已經清晰地證明了Bentrio在這一適應癥中的臨床療效與安全性,在中國的成功上市將是優銳醫藥呼吸與過敏系列產品管線的一個重要里程碑。"
[1] Becker S, Deshmukh S, De Looze F, et al. AM-301, a barrier-forming nasal spray, versus saline spray in seasonal allergic rhinitis: A randomized clinical trial. Allergy. 2024;00:1-10. https://onlinelibrary.wiley.com/doi/10.1111/all.16116
]]>恩塞芬汀是一款磷酸二酯酶蛋白吸入型雙靶點PDE 3/4抑制劑,雙重抑制機理使其能夠憑借單個化合物同時實現支氣管擴張和抗炎效應。如果獲得批準,恩塞芬汀有望成為COPD領域10多年來批準的全新機制藥物。
優銳醫藥創始人兼首席執行官Mark Lotter先生表示:"我們對于恩塞芬汀向FDA提交新藥申請的進展感到無比自豪。這個令人激動的里程碑也讓我們更加堅定恩塞芬汀有望在全球范圍內重新定義COPD治療方式。正如我們的合作伙伴Verona Pharma,優銳堅定地致力于為大中華地區的COPD患者引入這款潛在的First in Class創新療法,幫助數千萬上億深受COPD疾病困擾的患者顯著改善生命質量。"
"美國有數百萬計的COPD患者迫切需要新的治療選擇,"Verona Pharma總裁兼首席執行官David Zaccardelli表示"恩塞芬汀提交新藥申請是重大的里程碑,我們的目標是將這種潛在的全球同類首創(First-in-Class)療法帶給COPD患者,我們也期待審核期間與FDA緊密合作。"此次新藥申請包含約3,000名受試者在ENHANCE三期臨床研究與其它恩塞芬汀臨床研究中取得的積極試驗數據。
2021年,優銳醫藥與Verona Pharma簽訂協議,獲得恩塞芬汀在大中華區域開發與商業化的獨家權益。2023年4月,優銳醫藥宣布ENHANCE–CHINA 三期臨床試驗完成首例患者給藥。
關于恩塞芬汀
恩塞芬汀是一款磷酸二酯酶蛋白吸入型雙靶點PDE 3/4抑制劑,雙重抑制機理使其能夠憑借單個化合物同時實現支氣管擴張和抗炎效應。在COPD的二期臨床研究中,恩塞芬汀作為單一療法或被添加到維持性支氣管擴張劑中,對于患者的肺部功能、疾病癥狀與生命質量等方面均展現了有臨床意義的顯著改善。在ENHANCE-1與ENHANCE-2 三期臨床試驗中,恩塞芬汀展現出對肺部功能指標的有效改善,降低COPD的病情惡化率。迄今為止,恩塞芬汀已在約3,000名受試者的臨床試驗中一致展現了良好的耐受性。
關于Verona Pharma
Verona Pharma是一家臨床階段的生物醫藥公司,專注于具有顯著未滿足醫療需求的慢性呼吸系統疾病的創新療法開發及商業化。如果成功開發并獲批,Verona Pharma的候選藥物恩塞芬汀有望成為全球首款將支氣管擴張劑與抗炎效應結合在一種化合物中的非甾體類治療藥物。恩塞芬汀在其三期臨床試驗中成功達到主要終點,顯示出對肺部功能指標的有效改善,降低COPD的病情惡化率。恩塞芬汀用于治療COPD的二期臨床研究評估了另外兩種恩塞芬汀制劑:干粉吸入器(DPI)與加壓計量吸入器(pMDI)。恩塞芬汀還在囊性纖維化、哮喘與其他呼吸系統疾病中具有潛在的應用前景。更多信息,請訪問 www.veronapharma.com。
關于優銳醫藥
優銳醫藥是一家以患者為中心、注重創新的生物制藥公司,2014年由Mark Lotter先生創立于上海。致力于解決大中華和亞太地區尚未滿足的關鍵醫療需求,優銳醫藥擁有差異化的全球創新藥研發管線與成熟的商業化產品組合,專注于呼吸、疼痛、急救護理與缺鐵性貧血等治療領域。
致力于亞太區域的特效藥市場,優銳醫藥憑借"商業+研發"的雙輪驅動模式,已成功孵化全球領先的研發后期管線組合,同時保持自我持續的商業運營。更多信息,請訪問www.nuancepharma.com。
前瞻性陳述
本公告包括涉及風險、不確定性和其他因素的前瞻性陳述,其中許多因素超出了我們的控制范圍,可能導致實際結果與前瞻性陳述中討論的結果存在重大差異。前瞻性陳述包括有關我們的計劃、目的、目標、未來事件、業績和/或其他非歷史信息的陳述。所有此類前瞻性陳述均明確受到這些警示性陳述以及前瞻性陳述可能附帶的任何其他警示性陳述的限制。除非法律要求,否則我們沒有義務公開更新或修改前瞻性陳述以反映發布日期之后的后續事件或情況。
]]>上海2023年5月26日 /美通社/ -- 2023年5月24日,優銳醫藥合作伙伴Altamira Therapeutics Ltd.(Nasdaq: CYTO),宣布其在澳大利亞開展的評估Bentrio鼻噴霧劑對季節性過敏性鼻炎(SAR)患者治療效果的NASAR隨機對照臨床試驗具有顯著統計意義的頂線數據積極。Bentrio鼻噴霧劑是一種不含藥物成分且無防腐劑的凝膠乳液,用于幫助防護空氣傳播的過敏原,如花粉或室內塵螨。
NASAR試驗在澳大利亞招募了100名SAR患者,以1:1的比例隨機分配接受Bentrio鼻噴霧劑與生理鹽水鼻噴霧劑為期兩周、每天三次或按需給藥。受試者需滿足至少5分的基線反射性總體鼻癥狀評分(rTNSS),即在最近一周的無治療期內對鼻塞、打噴嚏、鼻癢和鼻漏(流鼻涕)等癥狀的平均最不適程度。
NASAR試驗的主要療效終點被定義為Bentrio與生理鹽水鼻噴霧劑(目前無藥物SAR管理的標準護理方式)在隨后2周治療期間的平均rTNSS評分差異。評估受試后兩周內rTNSS評分的平均數變化作為SAR試驗的主要療效終點已被普遍接受,也是FDA推薦的試驗結果評估方式。
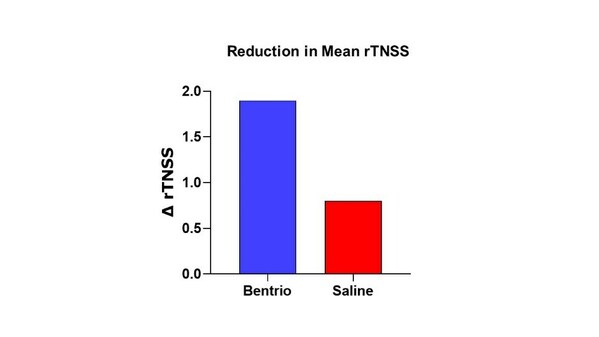
參考圖一平均rTNSS評分下降情況,Bentrio組的平均rTNSS評分從治療前的6.9分下降到14天治療期內的5.0分(下降1.9分);相對應的生理鹽水鼻噴劑對照組平均rTNSS評分從6.9分下降到6.2分(下降0.8分)。因此,Bentrio鼻噴霧劑對鼻腔癥狀的緩解效果是生理鹽水鼻噴霧劑的2.5倍。在ANCOVA模型中,Bentrio相較于生理鹽水鼻噴劑對照組,平均rTNSS評分下降1.1分的療效差異,具有顯著的統計學意義(LSmeans;P = 0.012;95%可信區間為-2.0 ~ -0.3),因此該研究已達到主要療效終點。
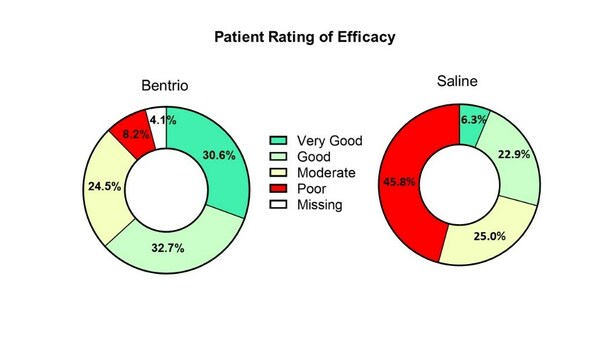
圖二中顯示的Bentrio組治療效果遠高于最小臨床重要差異0.28分。其中,63.3%的Bentrio受試者對治療效果評級"良好"或"非常好";對應僅有29.2%的生理鹽水對照組受試者給予了同樣評級。對于其他的受試患者,45.8%的生理鹽水對照組給予了療效差評,而Bentrio組僅有8.2%。
針對治療的耐受性評級,73.5%的Bentrio受試者認為治療耐受性"良好"或"非常好",對應85.5%的生理鹽水對照組受試者給予了同樣評級。10.4%的對照組患者評價生理鹽水的耐受性較差,而Bentrio組僅有6.1%。
Altamira Therapeutics創始人、董事長兼首席執行官Thomas Meyer評論道:"我們對于在澳大利亞過敏季節的真實條件下進行的NASAR試驗所取得的積極結果感到非常興奮。Bentrio鼻噴霧劑的無藥物治療,極有潛力幫助患者大幅減輕鼻部不適癥狀,并有效預防季節性過敏性鼻炎。藥物鼻噴霧劑的治療方式受眾程度尚待提高,主要因為療效不佳,或由防腐劑與其他成分帶來的耐受問題。我想要向所有參與NASAR試驗的患者與研究人員表示誠摯的感謝,幫助我們實現了這一重要的臨床研發里程碑。"
"NASAR試驗結果顯示,Bentrio鼻噴霧劑療效相較于目前標準生理鹽水鼻噴霧劑治療方式,取得了統計顯著與臨床高度相關的療效改善,"Meyer先生補充道,"生理鹽水鼻噴霧劑通過沖洗掉過敏原顆粒發揮療效,而Bentrio鼻噴霧劑能在鼻腔黏膜形成一層薄薄的保護層,防止過敏原顆粒觸達鼻黏膜,并通過自然的粘膜纖毛脫落來清除它們。正如在之前的試驗中已經證明的那樣,Bentrio在鼻腔內停留約3.5小時并持續發揮其保護作用。相比之下,鹽水噴霧持續時間僅約一小時,在鼻腔內提供更窄的分布和更少的覆蓋。
"NASAR試驗標志著Altamira已完成所有Bentrio季節性過敏性鼻炎臨床試驗項目。2023年,美國非處方過敏藥物的年銷售額預計將接近40億美元,這意味著無藥物成分、無防腐劑治療類別的重大機遇。Altamira將與其營銷和分銷合作伙伴一起,期待Bentrio作為一種有效和安全的治療選擇,幫助患者應對與過敏性鼻炎相關的日常負擔與不適。"
"我們很高興看到我們的合作伙伴Altamira Therapeutics在Bentrio臨床研究中取得了這一重要的里程碑。基于積極的頂線結果,我們認為Bentrio這一新型的非藥物、無防腐劑療法對于解決全球過敏性鼻炎患者的迫切需求極具潛力。"優銳醫藥創始人兼首席執行官Mark Lotter先生評論道,"我們期待與Altamira維持成功而強有力的合作伙伴關系,同時在更多的亞太地區提供這種創新的治療方法,以解決高度未滿足的醫療需求。"
2022年3月,優銳醫藥宣布與Altamira Therapeutics公司簽署獨家協議,在中國大陸、香港、澳門及韓國合作開發、注冊和商業化Bentrio鼻噴劑。2022年11月,Nuance Pharma宣布在中國香港上市發售Bentrio鼻噴霧劑。
關于Bentrio
Bentrio是一種不含藥物成份、無防腐劑的鼻噴劑,用于個人防護,預防空氣傳播的病毒和過敏原。應用于鼻腔后,Bentrio在鼻粘膜上形成保護性凝膠層。這種薄膜旨在防止病毒或過敏原與細胞接觸。此外,該成份組合可結合這些(病毒或過敏原)顆粒并促進其排出,以及濕潤鼻腔粘膜。Bentrio可降低上呼吸道病毒感染的風險并促進過敏癥狀的緩解。更多信息,請訪問:https://www.aurismedical.com/legacy-programs/bentrio。
關于Altamira Therapeutics
Altamira Therapeutics(NASDAQ: CYTO)致力于開發解決重要未滿足醫療需求的療法。該公司目前在三個領域積極開展:開發用于肝外治療靶點的RNA療法(OligoPhore? / SemaPhore?平臺,臨床前),用于預防經空氣傳播的病毒和過敏原的鼻噴劑(Bentrio?,商業化),治療眩暈的療法(AM-125,臨床2期)以及用于鼓室內治療耳鳴或聽力損失的療法(Keyzilen®和Sonsuvi®,臨床3期)。公司成立于2003年,總部位于百慕大哈密爾頓,主要運營位于瑞士巴塞爾。更多信息,請訪問:www.altamiratherapeutics.com。
關于優銳醫藥
優銳醫藥是一家以患者為中心、注重創新的生物制藥公司,2014年由Mark Lotter先生創立于上海。致力于解決大中華和亞太地區尚未滿足的關鍵醫療需求,優銳醫藥擁有差異化的全球創新藥研發管線與成熟的商業化產品組合,專注于呼吸、疼痛、急救護理與缺鐵性貧血等治療領域。
致力于亞太區域的特效藥市場,優銳醫藥憑借"商業+研發"的雙輪驅動模式,已成功孵化全球領先的研發后期管線組合,同時保持自我持續的商業運營。更多信息,請訪問www.nuancepharma.com。
前瞻性聲明
本文涉及的產品并未全部在大中華區域獲批,優銳醫藥不推薦任何未被批準上市的藥品器械使用。本公告包括涉及風險、不確定性和其他因素的前瞻性聲明,其中許多因素是我們無法控制的,可能導致實際結果與前瞻性聲明中討論的結果有實質性差異。前瞻性聲明包括有關我們的計劃、目的、目標、未來事件、業績和/或其他非歷史信息的聲明。所有這些前瞻性聲明都明確受到這些警示性聲明和可能伴隨前瞻性聲明的任何其他警示性聲明的限制。我們沒有義務公開更新或修訂前瞻性聲明以反映做出聲明后的后續事件或情況,除非法律要求。
合作協議約定,大昌華嘉(DKSH)醫療保健事業部將為BentrioTM鼻噴劑在香港與澳門的銷售運營提供關鍵客戶管理,市場營銷推廣,供應鏈與渠道分銷等全代理服務。
BentrioTM是一款不含藥物成份、無防腐劑的鼻噴劑,用于個人防護,預防空氣傳播的病毒和過敏原。BentrioTM目前已在歐洲和亞洲的數個國家上市,用于預防過敏性鼻炎。2022年6月,BentrioTM已獲得美國FDA批準的510(k)許可,用于治療過敏性鼻炎(花粉癥)。該產品旨在幫助防止空氣傳播的過敏原和病毒,在英國被認為是一類醫療器械。BentrioTM鼻噴劑也在包括德國的歐洲市場上市銷售,用于幫助預防和緩解由空氣傳播的過敏原如花粉、屋塵螨或動物皮屑引起的過敏癥狀。在新加坡等其他市場,BentrioTM被用于預防空氣傳播的病毒和過敏原。BentrioTM的療效和保護作用已通過多項臨床和體外研究得到證實。
2022年3月,優銳醫藥宣布與Altamira Therapeutics公司簽署獨家協議,在中國大陸、香港、澳門及韓國合作開發、注冊和商業化BentrioTM鼻噴劑。達到相應的里程碑后,優銳醫藥計劃實現BentrioTM產品的本地化生產。
"這是優銳醫藥亞太市場戰略的一個重要里程碑,標志著我們在兩個關鍵亞太市場建立了商業能力,同時向該地區提供創新、安全和有效的產品。"優銳醫藥創始人兼首席執行官Mark Lotter先生評論道,"香港是通往亞洲的重要門戶,代表著優銳在亞太區域拓展業務關鍵的第一步,公司后續準備引入其目前正在開發的創新管線。我們期待與該地區的商業領導者大昌華嘉建立緊密的伙伴關系,在未來幾年攜手提供更多的創新療法,以滿足該地區亟需的未滿足醫療需求。"
大昌華嘉醫療保健事業部管理總監兼副總裁Wai Ting Fong先生對此次合作表示熱烈歡迎:"大昌華嘉很高興與優銳醫藥合作,推出他們的創新產品BentrioTM。憑借我們擁有廣泛的商業渠道,我們致力于推動該產品在香港和澳門的商業拓展。我們的合作展現了我們通過提供醫療保健、商品、服務與見解,致力于為患者提供更好的健康和生活質量的承諾,符合大昌華嘉豐富人們生活的宗旨"。
]]>上海2022年7月26日 /美通社/ -- 優銳醫藥今日宣布與Neumentum聯合開發的非阿片類鎮痛藥物新型靜脈輸注酮咯酸(NTM-001)在香港大學一期臨床試驗中心實施的I期臨床試驗已完成所有志愿者藥物輸注。該I期研究共招募16名健康志愿者進行藥物試驗,迄今所有研究對象均已完成了96小時的樣本采集過程及15天的安全性觀察期。截至目前,所有志愿者均未出現嚴重不良事件或健康問題。據優銳醫藥研發負責人透露,臨床數據清理與統計分析正在進行中, NTM-001 I期臨床試驗研究有望于2022年底結束。
2020年末,優銳醫藥與Neumentum達成獨家合作協議,成功取得新型靜脈輸注酮咯酸(NTM-001)在大中華區域開發和商業化的專有權。該產品目前針對術后短期中至重度疼痛的全球臨床試驗研究已進入關鍵的III期臨床研發階段。
優銳醫藥首席執行官兼聯合創始人Mark G. Lotter先生表示:"我非常高興地宣布NTM-001香港I期臨床試驗的藥物輸注環節順利完成,這代表我們與Neumentum合作的一個重要里程碑的達成,也代表了優銳醫藥的中國臨床研究項目強勢開局。NTM-001為患者們提供了可注射的非阿片類鎮痛劑,將成為阿片類藥物鎮痛劑的最佳替代治療方案。我們期望成功地將這種新型藥物引入大中華區,為中國患者術后疼痛的平穩管理帶來新的選擇。"
Neumentum執行董事長Joseph Pergolizzi先生表示:"我們對NTM-001的這一重要臨床試驗成功完成感到非常激動。我們相信NTM-001,作為一款安全的藥物復合物,在顯著提升術后短期中至重度疼痛的標準治療方案方面有巨大潛力,此次臨床試驗結果也進一步展示出NTM-001有望成為阿片類藥物鎮痛劑的最佳替代治療方案,并為產品未來的研發進程提供了重要信息。"
參考文獻
1. https://www.statista.com/statistics/279392/number-of-surgery-procedures-in-chinese-hospitals-by-region, accessed July 2022
2. China analysis on the development of surgeries from 2015 – 2020, Ipsos MedTech, 2020 Sep 12
優銳醫藥將獲得otenaproxesul的獨家代理權,以推進otenaproxesul在中國大陸、香港、澳門和臺灣(約占全球醫藥市場份額的10%)[1] 等大中華地區的商業化。根據協議條款,除逾10%的特許權使用費之外,Antibe還將獲得1億美元的里程碑付款,其中包括2,000萬美元的首付款和8,000萬美元的開發與銷售類里程碑款項。大中華地區的相關臨床開發和管理費用將由優銳醫藥承擔。Antibe和優銳醫藥已建立起otenaproxesul亞太地區臨床開發合作架構,以確保該合作符合Antibe的全球監管策略。
優銳執行總裁馬克·羅特表示:“我們的團隊很高興能與Antibe合作,將otenaproxesul引進大中華地區并實現商業化。這項協議是我們全球戰略的關鍵組成部分,旨在將業內前沿最佳疼痛療法引進中國地區。隨著醫生和患者不斷尋求更安全且不致癮的慢性疼痛療法,我們十分看好otenaproxesul商業化后的發展潛力。”
Antibe的執行總裁丹·萊戈特(Dan Legault)表示:“優銳醫藥對中國醫藥市場的動態及機遇的戰略性把握十分透徹,給我們留下了深刻的印象。優銳醫藥具有全球化業務實踐和商業模式,以及深厚的商業、臨床和藥政注冊能力,是我們的理想合作伙伴,以應對局勢日益復雜的中國國內市場。馬克已組建了一支出色的團隊,我們堅信優銳醫藥可以充分實現otenaproxesul的潛力。”
]]>