南昌2025年5月23日 /美通社/ -- 2025 年 5 月 22日,濟民可信集團宣布,公司自主研發的化藥 4 類抗腫瘤藥物濟立安 ®(鹽酸伊立替康脂質體注射液)已獲國家藥品監督管理局批準上市。該產品為國內第二家批準上市并視同通過一致性評價的仿制藥,將為晚期胰腺癌患者帶來新的治療選擇。
胰腺癌素以"三高三低"著稱——發病率高,復發率高,死亡率高,早期診斷率低,手術切除率低,藥物有效率低,被稱為"癌中之王"。傳統伊立替康注射液具備胰腺癌的確切療效,但患者長期使用易出現骨髓抑制、嚴重腹瀉及肝腎毒性等副作用,嚴重影響治療依從性。濟立安®采用的脂質體技術憑借其生物相容性高、靶向性強、毒副作用低等優勢,可顯著提升藥物安全性及耐受性。國際研究顯示,伊立替康脂質體聯合5-FU/LV方案治療吉西他濱化療失敗的轉移性胰腺癌患者,中位無進展生存期(PFS)與總生存期(OS)均有顯著改善[1]。
2022年4月,原研施維雅易安達®獲得國家藥品監督管理局正式批準,與5-氟尿嘧啶和亞葉酸聯合用于接受吉西他濱治療后進展的轉移性胰腺癌患者 [2]。濟民可信研發的仿制藥濟立安®(鹽酸伊立替康脂質體注射液)在臨床實驗中表現出色,臨床試驗結果顯示,該產品與原研制劑對比人體生物等效性完全一致。值得一提的是,濟立安®(鹽酸伊立替康脂質體注射液)是濟民可信今年內第二個獲批上市的脂質體產品,充分彰顯了濟民可信在高端創新制劑研發領域的實力和積累。
濟立安®(鹽酸伊立替康脂質體注射液)由濟民可信集團創新技術藥物研究院研發,由無錫濟煜山禾藥業股份有限公司落地生產。創新技術藥物研究院聚焦國際領先的高端創新制劑研發,擁有高端制劑、特色原料藥、創新中藥三大平臺,涵蓋脂質體、微球、吸入劑、口服固體、創新中藥、特色原料藥等技術研發,覆蓋腫瘤、鎮痛、呼吸、關節炎、抗感染、心腦血管、腎病、肝病等多個領域。
參考資料
[1]. Bang YJ,Li CP,Lee KH,et al.Liposomal irinotecan in metastatic pancreatic adenocarcinoma in Asian patients: Subgroup analysis of the NAPOLI-1 study. Cancer Sci 2019.
[2]. 施維雅胰腺癌治療藥物易安達®在中國獲批. Retrieved from https://mp.weixin.qq.com/s/5SWFDyqLbUmSMeZK-_jXug
南昌 2025年4月28日 /美通社/ -- 4月23日,英中貿易協會會長沙遜勛爵率"投資中國—跨國公司江西行"代表團專程走訪了濟民可信集團。圍繞創新藥物研發、智能生產、質量管控以及國際化布局與全球合作成果等方面,雙方展開了深入交流,為濟民可信集團進一步開展國際合作、實現創新成果全球共享創造了新的契機。
近年來,濟民可信持續加速推進創新藥研發以及商業化、國際化進程,先后與羅氏集團旗下基因泰克、美國RAPT、芬蘭奧立安集團和美國滬亞簽署了產品對外授權獨家合作協議。實現出海的4個創新藥物,覆蓋腫瘤、呼吸、疼痛等重大領域,為濟民可信走向全球化打下堅實基礎,被業界認作中國傳統藥企轉型升級的典型范例。
此外,濟民可信集團還大力推動"5G+智慧工廠"的建設,已在江西、江蘇、浙江等地建成多個符合FDA及歐盟標準的智能化生產基地,全面推行QbD(質量源于設計)、TQM(全面質量管理)等國際標準體系,確保產品從研發到生產的全鏈條可追溯,實現了生產效率與產品質量的雙效提升,為全球客戶提供了"中國質造"保障。
在國際市場拓展上,濟民可信集團的制劑與原料藥已出口50余個國家和地區,并在多個高技術壁壘的藥物領域與跨國藥品經銷商開展技術轉移、知識產權授權、合作開發等多元化合作,推動更多自主研發和生產的藥品進入歐美及新興國家市場。
"基于自身國際化經驗,濟民可信推出‘全球合作伙伴計劃',開放我們在國外的市場網絡、臨床開發及國際準入資源,助力國內藥企‘抱團出海'。"濟民可信集團國際業務負責人表示,國際化的目標是創造生態共贏,希望能夠搭建"出海"生態平臺,助力行業協同發展。目前,該平臺已吸引多家國內藥企共同參與,正大力推動更多"中國方案"在全球主流市場的臨床轉化與商業化進程。
在堅持"走出去"同時,濟民可信集團還積極引進國際領先藥物進入中國市場,以滿足日益增長的中國臨床需求,"雙向合作"的模式不僅加速了自主創新能力的提升,更使國內患者同步受益于全球領先療法。濟民可信集團國際業務負責人表示:"國際化不僅是市場拓展,更是技術、人才與標準的深度融合。期待通過雙向合作,讓中國創新惠及全球,也讓國際領先療法更快服務中國患者。"
]]>南昌2025年4月10日 /美通社/ -- 2025年4月9日,濟民可信集團宣布,公司自主研發的哮喘治療用藥舒力杰®(吸入用丙酸倍氯米松混懸液,2ml:0.8mg)已獲國家藥品監督管理局批準上市,成為國內首家獲批并視同通過一致性評價的仿制藥。
哮喘是一種常見的慢性炎癥性氣道疾病,癥狀嚴重時可出現呼吸困難和低氧血癥,臨床亟需高效、安全的吸入制劑以改善患者預后。在全球范圍內,2021年哮喘患者約2.6億,年死亡病例高達43.6萬例。我國20歲及以上人群哮喘患病率高達4.2%,患者人數約4570萬,且呈上升趨勢[1]。
研究表明,吸入性糖皮質激素可顯著降低急性發作風險,當前已成為哮喘長期控制的核心藥物[2]。吸入用丙酸倍氯米松混懸液作為國際公認的高效局部抗炎糖皮質激素(ICS),其原研藥由意大利凱西制藥開發,通過霧化吸入直接作用于氣道,可有效控制炎癥、緩解癥狀,并減少全身性激素副作用[3]。該藥物于2013年進入中國市場,已被《兒童霧化中心規范化管理指南》[4]列為推薦用藥,并獲《支氣管哮喘防治指南》及全球權威的《哮喘防治全球指南》(GINA)認可[5]。
此次濟民可信集團舒力杰®(吸入用丙酸倍氯米松混懸液)國內首仿上市,將為國內哮喘患者提供高效、安全的治療新選擇,為基層醫療機構和兒童患者提供更便捷的治療方案,并有助于降低我國對哮喘藥物的進口依賴。
舒力杰®(吸入用丙酸倍氯米松混懸液)由濟民可信集團創新技術藥物研究院研發,由江西艾施特制藥有限公司落地生產。創新技術藥物研究院聚焦國際領先的高端創新制劑研發,擁有高端制劑、特色原料藥、創新中藥三大平臺,涵蓋脂質體、微球、吸入劑、口服固體、創新中藥、特色原料藥等技術研發,覆蓋腫瘤、鎮痛、呼吸、關節炎、抗感染、心腦血管、腎病、肝病等多個領域。
]]>靶向克菌 重塑抗真菌治療新標桿
近年來,隨著廣譜抗生素、抗腫瘤藥物、免疫抑制劑等的廣泛應用,以及造血干細胞移植、器官移植等技術的開展,侵襲性真菌病的發病率及死亡率呈明顯上升趨勢。研究顯示[1],全球每年有超過 655 萬人受到真菌疾病的影響,導致超過 375 萬人死亡,其中約 255 萬人的死亡可直接歸因于真菌疾病,給臨床帶來巨大挑戰。
現階段,抗真菌藥物中三唑類、棘白菌素類,抗菌譜相對窄且容易出現耐藥;另外,普通兩性霉素B(AmB-D),腎毒性高且容易出現輸注反應,都未能充分滿足臨床需求。面對當前耐藥真菌、少見/罕見真菌的感染挑戰,亟需新型抗真菌治療方案,幫助患者渡過難關。
其中,兩性霉素B脂質體(L-AmB)憑借革命性脂質體包裹技術,精準輸送藥物至感染組織部位,游離藥物釋放減少,突破性實現高效殺菌與安全性雙提升。研究顯示[2][3]:L-AmB因脂質體體積小,較少被腎臟過濾,避免AmB與遠端小管細胞的相互作用,明顯改善腎毒性;同時因能降低促炎細胞因子的上調,進而減弱輸液反應。作為一款高效低毒的抗真菌利器,可為臨床醫生提供更優選擇。
突破壁壘 為患者提供更多選擇
注射用兩性霉素B脂質體,已在全球范圍內廣泛使用近30年,被譽為侵襲性真菌病治療的"金標準"[3][4]。由于其技術壁壘高,面臨著活性成分水溶解性差、制備過程中易產生雜質、工藝多且復雜,周期長等眾多難題,研發挑戰巨大。
濟民可信集團創新技術藥物研究院利用脂質體技術平臺,突破關鍵技術,通過藥學、非臨床和臨床試驗研究證明了欣必松®(兩性霉素B脂質體)與參比制劑藥學和生物等效,并于2025年1月8日獲得國家藥品監督管理局核準簽發的《藥品注冊證書》。欣必松®按新4類注冊要求,以高標準研制,視同通過一致性評價,有望進一步降低臨床負擔,為中國侵襲性真菌病患者帶來更多獲益。
參考文獻
1. Denning DW. Lancet Infect Dis. 2024 Jul;24(7):e428-e438.
2. Adler-Moore J, et al. Clin Infect Dis. 2019,68(S4):S244-S259.
3. Aversa F, et al. J Chemother. 2017 Jun;29(3):131-143.
4. 中華內科雜志,2024,63(3):230-257.
注射用兩性霉素B脂質體(AmBisome®)已在全球范圍內廣泛使用近30年,被譽為侵襲性真菌病治療的"金標準",是世界首例被批準上市的納米脂質體藥物[1]。由于其技術壁壘高,此前國內仿制產品過評僅有一家。濟民可信集團創新技術藥物研究院利用脂質體技術平臺,突破關鍵技術,通過藥學、非臨床和臨床試驗研究證明了該產品與參比制劑AmBisome®藥學和生物等效,該產品的獲批上市可為患者帶來更多福音。
注射用兩性霉素B脂質體是兩性霉素B的小球型單層脂質體,擬用于系統性真菌治療。兩性霉素B與真菌細胞膜上的麥角固醇結合,形成跨膜離子通道,造成細胞膜通透性改變,最終導致真菌細胞死亡。與傳統兩性霉素B相比,兩性霉素B脂質體對真菌細胞的親和力高于哺乳動物細胞,增強了藥物靶向殺菌能力,能夠顯著提升藥物的安全性,有效降低不良反應率。臨床應用時無需劑量爬坡,可依據說明書足量給藥,將輸液時間自6h縮短至2h[2],使用更方便。
注射用兩性霉素B脂質體的研發、注冊申報由濟民可信高端制劑研發平臺完成,此平臺隸屬于濟民可信創新技術藥物研究院。該院聚焦國際領先的高端創新制劑研發,擁有高端制劑、創新中藥、特色原料藥三大平臺,涵蓋脂質體、微球、吸入劑、口服固體、創新中藥、特色原料藥等技術研發,覆蓋腫瘤、鎮痛、呼吸、關節炎、抗感染、心腦血管、腎病、肝病等多個領域。
]]>據《柳葉刀》最新數據顯示,目前中國成人慢性腎病(CKD)的患病率為10.8%,患者總數高達1.3億,截至2023年底中國大陸地區透析CKD患者數量已達到 106.8萬人,而高磷血癥正是此類患者最常見的并發癥之一[1][2]。高磷血癥可直接加速腎衰及死亡進程,血磷每升高約0.3mmol/L,腎衰竭風險增加36%,心血管死亡風險增加50%。
碳酸司維拉姆是目前唯一被FDA批準的既不含鈣、又不含其他金屬的新一代磷結合劑,并被國內外指南和規范一致推薦為降磷首選藥物[3]。米內網數據顯示,司維拉姆2021年在中國三大終端6大市場合計銷售規模接近6億元,同比增長48.54%,2023年突破10億元。
相較片劑產品,碳酸司維拉姆干混懸劑將適用人群擴增至兒童群體,在用藥口感和順應性方面均有優勢,將與濟民可信集團已上市的碳酸司維拉姆片形成雙劑型供應,為患者提供更多治療選擇,讓更多患者獲益。
碳酸司維拉姆干混懸劑的研發、申報由濟民可信復雜制劑研發平臺完成,此平臺隸屬于濟民可信研發中心創新技術藥物研究院。該院聚焦國際領先的高端創新制劑研發,擁有復雜制劑、高端制劑、創新中藥三大制劑平臺,涵蓋脂質體、微球、吸入劑、口服固體、創新中藥、特色原料藥等技術研發,覆蓋腫瘤、鎮痛、呼吸、關節炎、抗感染、心腦血管、腎病、肝病等多個領域。
參考文獻:
[1] Zhang L, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey . Lancet 2012; 379: 815–822. |
[2] 中國醫師協會腎臟內科醫師分會(CNA)2024年學術年會數據 |
[3] 中華腎臟病雜志(2022);38(5),453-464. |
上海2024年9月4日 /美通社/ -- 進入九月初,在云南省曲靖市富源縣黃泥河鎮這片土地上,20000 畝薏苡已進入灌漿期。農技人員正在指導農民以GAP基地標準進行科學管護,為薏苡產業提質增效提供技術支持。
薏苡仁有健脾利濕、清熱解毒、消腫散結等藥用功效,被譽為"植物珍珠",而黃泥河鎮年平均氣溫16℃,平均海拔1550米,降水豐富,無污染,是薏苡種植的理想地區。
多年前,濟民可信集團旗下浙江康萊特藥業有限公司運用現代制藥技術從薏苡仁中提取出了一種抗癌活性成分,并成功研制出一款中藥抗癌乳劑,經中、美等多國臨床試驗證明,該藥物對肺癌、肝癌、胰腺癌等中晚期惡性腫瘤具有顯著的治療效果[1]。
為保障該藥物的安全品質與市場供給,并響應國家鄉村振興戰略,2023年濟民可信集團與黃泥河鎮結緣,開始在當地打造薏苡種植基地,以GAP基地標準精耕細作,為當地農戶帶來實實在在的收益,奏響了一曲產業興農的動人樂章。
"最初,農戶的顧慮還比較多。"為了讓當地農戶安心踏上薏苡種植之路,濟民可信采購管理部員工劉志剛、萬文豪等人通過庭院會、進村入戶等多種方式對薏苡種植進行廣泛宣傳,并精選優質的薏苡種子免費發放給當地農戶。
這些種子如同希望的火種,點燃了農戶們致富的夢想。
從前期的土地規劃到精心的播種,從科學的田間管理到及時的病蟲害防治,每一個環節都凝聚著濟民可信與農戶們的共同心血。為了保障農戶和村合作社的利益,濟民可信集團還承諾薏苡保底收購、承諾收購價格隨行就市,并拿出了按量返利等一系列的惠農政策。
這些舉措,減少了農戶及合作社在面對市場波動時的后顧之憂,極大地提高了種植積極性。2年不到的時間,薏苡種植已經開始成為黃泥河鎮的支柱產業,為當地農民帶來了300-500元/畝的增收,越來越多的農民因此走上了致富的道路。
目前,黃泥河鎮12個村(居)委會81個自然村的薏苡種植戶、種植面積分別較2023年增長了107%、67%,增加至4259戶、20000畝;預計2025年的規模還將進一步擴大,分別增加至4800戶、22500畝。
在幫助黃泥河鎮不斷擴大薏苡種植規模的同時,濟民可信還積極探索產業發展的新模式,與當地企業合作建立了薏苡烘干廠。這不僅解決了農戶的銷售難題,還延長了產業鏈,提高了產品附加值,為當地村民就業增收創造了更多機會。
未來,濟民可信集團將繼續秉承"濟世惠民,信待天下"的企業使命,堅持"捍衛產品質量就是捍衛患者的生命"的質量方針,從種源、種植、施肥打藥到采收加工,每一道環節均以GAP基地標準在黃泥河這片土地上精耕細作,讓薏苡種植產業不斷發展壯大,為企業提供質量可靠的薏苡原料,實現企業與農戶的互利雙贏,共同書寫好鄉村振興大文章。
帕金森病是一種常見的老年神經系統退行性疾病,癥狀包括靜止性震顫、肌強直、運動遲緩、認知障礙等,病情隨著時間加重,給患者家庭和社會造成極大負擔。鹽酸羅匹尼羅作為新型多巴胺受體激動劑,可以進入中樞神經系統,作用于突觸后膜上的多巴胺能受體,通過發揮藥理學作用,可以改善患者的運動遲緩、肢體的震顫、肌張力增高等臨床表現,是治療帕金森病的常用藥之一[1]。
鹽酸羅匹尼羅緩釋片多用于與左旋多巴聯合治療帕金森病,可以延緩病情,顯著減少關期時間(帕金森病患者服用多巴胺替代藥物期間,癥狀會突然在緩解和加重之間波動,緩解期又叫做開期,加重期稱為關期),且安全性較好,相較于羅匹尼羅普通片,減少了服用次數,極大地增加了患者的用藥依從性[1] [2]。
據米內網數據,鹽酸羅匹尼羅緩釋片近5年全國公立醫療機構終端銷售額均超億元,占市場規模不足多巴胺激動劑總體銷售規模的1%。隨著我國老齡化程度的進一步加劇,羅匹尼羅緩釋片未來市場空間巨大,作為國內首仿產品,將幫助更多帕金森病患者受益。
該項目源于濟民可信高端口服固體制劑平臺,此平臺隸屬于濟民可信研發中心創新技術藥物研究院,涵蓋速釋制劑、緩釋制劑、難溶性藥物增溶(含熱熔擠出)及多顆粒給藥系統,研發設施配置先進完備,擁有豐富的制劑研發及產業化技術經驗及資源。近年來,依托這一平臺濟民可信已實現數項高端仿制藥的技術突破,多個產品獲批。在研項目中多個項目已完成放大生產與臨床BE,相關產品有望陸續獲批上市。
參考文獻
1. 中華醫學會神經病學分會帕金森病及運動障礙學組,中國醫師協會神經內科醫師分會帕金森病及運動障礙學組.中國帕金森病治療指南(第四版)[J].中華神經科雜志,2020,53(12):973-986.
2. 抗帕金森藥物-羅匹尼羅. Retrieved from https://m.haodf.com/neirong/wenzhang/7950574580.html
]]>血小板減少癥是一種出血性疾病,嚴重性血小板減少癥如慢性肝病(CLD)、慢性原發免疫性血小板減少癥(ITP)具有較高的自發性出血,嚴重者甚至可以危及生命。
作為全球首個經FDA、EMA批準,擁有CLDT、ITP雙適應癥的血小板生成素受體激動劑(TPO- RA),馬來酸阿伐曲泊帕片通過刺激巨核細胞從骨髓祖細胞的增殖分化,促進血小板的生成,可短時間內(治療后3-5天)快速提升血小板計數,安全且耐受性良好,口服用藥方式不受食物類型限制,大大提高了血小板減少癥患者的生活質量[1] [2]。
從近年來的臨床需求來看,該產品市場發展非常迅速且前景廣闊。根據米內網數據,2023年度馬來酸阿伐曲泊帕片銷售額為10.15億元,是2020年的58倍,上市三年以來平均年增長率為772%,且預計將繼續持續增長。本品的獲批上市,將有助于進一步擴大市場覆蓋率。依托"原料藥+制劑"一體化優勢,濟民可信集團馬來酸阿伐曲泊帕片和原料藥陸續獲批上市,將為患者提供更多治療選擇,并進一步豐富公司產品結構,有助于持續穩定市場份額。
該品種源于濟民可信高端口服固體制劑平臺,涵蓋速釋制劑、緩釋制劑、難溶性藥物增溶、以及多顆粒給藥系統,研發設施配置先進、完備,擁有豐富的制劑研發及產業化技術經驗及資源。近年來,依托這一平臺濟民可信已實現數項高端仿制藥的技術突破,目前已完成5個產品的注冊申報,BE試驗均為一次性通過,多個項目正在研發中。
]]>慢性腎臟病(CKD)是各種原因引起的慢性腎臟結構和功能障礙,根據《柳葉刀》最新研究數據,CKD在我國的患病率高達10.8%,患病人數超過1億。隨著疾病的進展,開始發生腎損害,腎功能不斷下降,嚴重危害生命健康。對于腎臟功能衰退的患者,就需要限制蛋白攝入,從而減輕參與腎單位的高負荷工作狀態,低蛋白飲食治療是CKD患者非透析治療的重要手段,但單獨限制蛋白飲食,則會導致營養不良,間接加重慢性腎臟病。
復方α-酮酸片使這一矛盾得以解決,能補充患者的營養,使低蛋白飲食得以維持,從而減輕腎臟負擔,延緩慢性腎臟病進展。它不僅是CKD患者營養治療的補充劑,更是CKD患者多種代謝紊亂(蛋白質、脂類和糖代謝,鈣磷代謝和代謝性酸中毒)的調節器。據米內網數據顯示,復方α-酮酸片2023年全國公立醫療機構終端銷售額近30億,5年增長21%。
該項目源于濟民可信高端制劑平臺,此平臺隸屬于濟民可信醫藥產業集團創新技術藥物研究院,涵蓋速釋制劑、緩釋制劑、難溶性藥物增溶(含熱熔擠出)、及多顆粒給藥系統,研發設施配置先進完備,擁有豐富的制劑研發及產業化技術經驗及資源。近年來,依托這一平臺濟民可信已實現數項高端仿制藥的技術突破,目前已完成多個項目的放大生產與臨床BE,相關產品有望在今年陸續獲批上市。
]]>多年來,濟民可信集團始終堅持"濟世惠民、信待天下"的企業使命,將履行社會責任和實現公共價值置于最優先事務。當下,濟民可信集團正持續打造新質生產力,致力于實現身心有所"醫"、空氣有所"益"、環境有所"宜"、人人有所"依"的品牌理想。
6月5日,濟民可信集團在"世界環境日"首次發布ESG報告——《濟民可信2018-2023環境、社會及治理報告》(以下簡稱ESG報告),圍繞恪守合規公平、造福人類健康、踐行公益慈善、助力員工發展、保護生態環境等五個維度,用嚴謹的數據說話,展現企業近年來在可持續發展領域的實踐經驗與成果,彰顯了濟民可信集團聚焦打造新質生產力,追求高質量可持續發展的決心。
創新研發守護人類健康
濟民可信專注于創新藥(化學藥和生物藥)、特色中藥、高端復雜仿制藥/改良創新藥等開發與創新,通過自主研發、產學研結合以及國際化科研合作,為患者提供"價格可及、療效顯著、安全可靠"的臨床亟需藥物。
ESG報告將創新研發作為企業打造新質生產力最重要的組成部分。報告顯示,截至2023年底,濟民可信醫藥產品研發投入近50億元,在研新藥項目70余個,累計獲批臨床試驗許可30個,累計9個產品獲批上市。2024—2028年濟民可信還將投入100億用于創新藥研發。
濟民可信現有醫藥研發相關科研人員超600人,設有1個國家級博士后科研工作站,1家獲CNAS認證的國家級實驗室,9個省級工程技術中心和3個中試平臺,并與多所知名院校共建制藥工業關鍵技術聯合實驗室。
截至2023年底,集團共申請國內專利140余項,其中38項已獲授權;申請海外專利合作條約(PCT)50余項。濟民可信現有產品批件700余個,均通過GMP認證,部分產品獲得FDA及歐盟認證,產品獲準進入美國、俄羅斯、以色列、西班牙等50多個國家和地區。
綠色發展助力"雙碳"目標
生態環境保護、清潔能源生產、綠色礦產開發是濟民可信在ESG報告中環境責任部分的重要內容。
報告顯示,濟民可信2018年起在江西高安市建設煤制清潔燃氣生產基地,以集中供氣模式改變原煤氣發生爐小、散、亂現狀。經過兩年的試運行,2022年濟民可信清潔能源項目全面供氣,通過40余公里的供氣管線,清潔的工業燃氣源源不斷地輸向建陶基地內陶瓷企業的85條生產線。使用清潔能源后,每年可為基地企業節約標準煤26.3萬噸,相當于82萬個家庭一年的用電量;每年減排二氧化碳70.3萬噸,相當于種植3800萬棵樹,并極大解決酚水、焦油等環境污染問題。
濟民可信還投身礦產資源開發的轉型升級,在上饒德興市投資建設"中國東部首個現代化石材產業基地",以綠色低碳、可持續發展為原則,努力打造綠色礦山的"江西樣板",構建集資源開采、產品加工、尾礦利用、物流運輸等一體化的循環經濟新模式。
公益善行彰顯責任擔當
ESG報告顯示,多年來濟民可信在抗震救災、抗擊疫情、鄉村振興、健康可及、支持教育等方面投入大量資金、物資與人力,捐贈累計近7億元,獲得中華慈善總會"中華慈善突出貢獻獎"。
濟民可信以健康民生為己任,積極開展健康科普與醫患教育,圍繞科學用藥和安全用藥與公眾開展良性互動,同時通過慈善藥物援助,進一步讓患者受益,以提升醫療可及性,為建設"健康中國"貢獻力量。
濟民可信以反不當競爭、反壟斷、財稅合規、產品推廣、數據安全與隱私保護、商業伙伴合規以及知識產權保護等為合規管理重點,建立了覆蓋事前、事中、事后的合規管理全流程,建立完整的合規管理架構以及合規管理機制,保障集團踐行良好的商業道德。
此外,濟民可信堅持以人才經營為核心發展戰略,構建多元化培訓體系,助力員工職業發展,實現員工培訓覆蓋率100%;其線上學習平臺發布培訓項目163個,覆蓋24961人次,人均培訓時長超過50小時。
作為一款在2015年獲批上市的乳腺癌新藥,哌柏西利是全球首個細胞周期蛋白依賴性激酶(CDK)一線療法,用于治療未曾接受過系統治療的雌激素受體陽性(ER+)、人表皮生長因子受體 2 陰性(HER2-)的絕經期女性晚期乳腺癌[1],2018年獲批進入中國市場,目前已在全球80多個國家上市,長期占據美國CDK抑制劑絕大部分市場份額,2022年全球銷售額達到51.2億美元[2]。
濟民可信集團充分發揮“原料藥+制劑”一體化優勢,哌柏西利原料藥和膠囊陸續獲批上市,將為患者提供更多治療選擇,并進一步豐富公司產品結構,有助于持續穩定市場份額。
該品種由集團旗下子公司上海濟煜醫藥科技有限公司承擔研發,旗下創新技術藥物研究院打造濟民可信高端口服固體制劑平臺,涵蓋速釋制劑、緩釋制劑、難溶性藥物增溶、以及多顆粒給藥系統,研發設施配置先進、完備,擁有豐富的制劑研發及產業化技術經驗及資源。近年來,依托這一平臺濟民可信已實現數項高端仿制藥的技術突破,目前已完成4個產品的注冊申報,BE試驗均為一次性通過,多個項目正在研發中。
- 關于上海濟煜醫藥科技有限公司
上海濟煜醫藥科技有限公司是濟民可信集團全資子公司,致力于成為具有全球影響力的藥物研發中心,其研發管線涵蓋生物大分子創新藥、化學小分子創新藥、創新中藥、復雜仿制及高端制劑。哌柏西利膠囊的研發申報由該公司創新技術藥物研究院完成,該院聚焦國際領先的高端創新制劑研發,覆蓋腫瘤、鎮痛、呼吸、關節炎、抗感染、心腦血管、腎病、肝病等多個領域,擁有脂質體、微球、吸入劑、口服固體、創新中藥和特色原料藥等六大創新技術研發平臺。
- 關于濟民可信集團
濟民可信集團創建于1999年,總部位于中國南昌,主要產品管線為腎病、腫瘤、心腦血管、呼吸抗感染、疼痛五大領域,致力于為患者提供高質量的藥品和創新醫藥解決方案。作為中國領先的大型現代制藥集團之一,濟民可信集團已連續多年位列中國醫藥工業百強前十。
參考文獻:
[1] 抗乳腺癌新藥palbociclib [J]. 劉恕,徐軍,崔毅. 藥學進展. 2015,39(08)
[2] Cortellis-Generics數據庫
我國目前20歲及以上人群哮喘患病率為4.2%,患者總人數達到4570萬[1]。此外,約1億人罹患慢性阻塞性肺病(COPD),已成為我國居民第三位主要死因[2],吸入藥物是治療哮喘和COPD的首選療法。
吸入用復方異丙托溴銨溶液活性成分為異丙托溴銨和硫酸沙丁胺醇,其中異丙托溴銨通過作用于氣道平滑肌M受體發揮氣道擴張作用,硫酸沙丁胺醇通過作用于氣道平滑肌β2受體發揮氣道擴張作用。一項為期85天的隨機、平行分組研究比較了霧化吸入3.0mg硫酸沙丁胺醇、0.5mg異丙托溴銨或復方制劑治療的療效,該項研究結果顯示,相較于單一成分的藥物作用于單一受體,吸入用復方異丙托溴銨溶液的兩個活性成分分別作用于肺部的M受體和β2受體,起到協同作用,擴張氣道作用更強[3]。
上海濟煜與艾施特制藥合作打造國內領先的吸入制劑研發生產平臺,覆蓋干粉吸入劑、吸入氣霧劑、吸入溶液/混懸液、以及其它粘膜給藥制劑等多種劑型,通過局部給藥的方式快速、直接進入肺部發揮藥效,降低給藥劑量,提高藥物療效,該平臺未來將有多個產品陸續進入注冊申報階段,造福更多患者。
參考文獻:
[1] Chen Wang, Jiangying Xu, Lan Yang, et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study) a national cross-sectional study. Lancet 2018 Vol 391 1706-1717.
[2] Kewu Huang, Ting Yang, Jiangying Xu, et al. Prevalence, risk factors, and management of asthma in China a national cross-sectional study. Lancet 2019 Vol 394 407-418.
[3] Routine nebulized ipratropium and albuterol together are better than either alone in COPD. Chest 1997, 1514-1521
哮喘是一種常見的慢性炎癥性呼吸道疾病,根據2019年中國成人肺部健康研究結果顯示,我國20歲及以上人群哮喘患病率為4.2%,總數達4570萬,且患病率逐年上升[1]。過敏性哮喘是哮喘的主要類型,在中度哮喘和重度哮喘中占比高達87% 和71%[2]。重癥哮喘通常需要使用大劑量吸入糖皮質激素(ICS),長期大劑量應用ICS或者口服糖皮質激素,給患者身體和經濟帶來極大壓力。
奧邁舒®是一種重組人源化抗IgE單克隆抗體,可通過特異性結合游離IgE,抑制IgE與效應細胞結合及釋放炎性介質,并且減少細胞表面高親和力受體(FcεRI)水平,達到治療過敏性哮喘之目的。奧邁舒®由邁博藥業自主研發,濟民可信集團在2023年4月13日與邁博藥業達成獨家商業化合作協議,獲得該藥物于中國市場的獨家推廣權。
目前,奧邁舒®被批準用于15歲及以上經吸入糖皮質激素與長效β2受體激動劑治療后,仍不能有效控制癥狀的中至重度持續性過敏性哮喘,為眾多過敏性哮喘患者帶來新的治療選擇。
奧邁舒®的安全性及療效已經由共4項臨床試驗,共824名受試者接受奧邁舒®給藥的結果所證實,該等試驗為中國規模最大的治療哮喘的單克隆抗體(mAb)臨床試驗。臨床試驗結果顯示,奧邁舒®能以較低劑量的吸入糖皮質激素改善哮喘病人的病情及降低急性哮喘發病的概率。
]]>注射用兩性霉素B脂質體(AmBisome®)已在全球范圍內廣泛使用近30年,被譽為侵襲性真菌病治療的"金標準",是世界首例被批準上市的納米脂質體藥物, 2023年02月28日在中國獲批上市[1]。由于其技術壁壘高,目前國內還未有仿制產品上市。濟民可信擁有脂質體復雜制劑的核心技術,臨床實驗結果表明該產品對比參比制劑AmBisome®在人體生物等效性完全一致,有望為患者帶來更多福音。
注射用兩性霉素B脂質體是兩性霉素B的小球型單層脂質體,擬用于系統性真菌治療。兩性霉素B與真菌細胞膜上的麥角固醇結合,形成跨膜離子通道,造成細胞膜通透性改變,最終導致真菌細胞死亡。與傳統兩性霉素B相比,兩性霉素B脂質體對真菌細胞的親和力高于哺乳動物細胞,增強了藥物靶向殺菌能力,能夠顯著提升藥物的安全性,有效降低不良反應率。臨床應用時無需劑量爬坡,可依據說明書足量給藥,將輸液時間自6h縮短至2h[2],使用更方便。
該項目源于濟民可信高端脂質體制劑平臺,此平臺隸屬于濟民可信研發中心創新技術藥物研究院,已構藥物載藥脂質體技術、藥械組合型脂質體和LNP等創新脂質體平臺,已有脂質體項目通過一致性評價,目前多個項目已處于臨床試驗、注冊申報階段,預計未來將有多個仿制和改良創新脂質體項目獲批上市。
參考資料
1. 安必素在國內獲批,為侵襲性真菌病患者帶來新選擇. Retrieved from https://www.cn-healthcare.com/articlewm/20230421/content-1539929.html
2. 王曼曼, 張雪媛, 祁歡歡等. 注射用兩性霉素B脂質體臨床藥理學研究[J]. 中國感染與化療雜志. 2021;21(3):362-368.
目前,我國20歲及以上人群哮喘患病率為4.2%,患者總人數達到4570萬[1]。此外,約1億人罹患慢性阻塞性肺病 (COPD),已成為我國居民第三位主要死因[2],吸入藥物是治療哮喘和COPD的首選療法。
硫酸特布他林屬于短效β受體激動劑,能夠選擇性激活氣道平滑肌細胞表面的β2 腎上腺素能受體,達到松弛氣道平滑肌的作用;還能通過肥大細胞膜保護作用,抑制肥大細胞脫顆粒、減少組胺和白三烯等炎癥遞質釋放,從而減輕氣道黏膜充血水腫、緩解氣道痙攣。相對于沙丁胺醇,特布他林對β2 受體選擇性更強,且對肥大細胞膜穩定作用大于沙丁胺醇。[3]
上海濟煜與艾施特制藥合作打造國內領先的吸入制劑研發生產平臺,覆蓋霧化吸入劑、干粉吸入劑、吸入氣霧劑、鼻用制劑、以及其它粘膜給藥制劑等多種劑型,通過局部給藥的方式快速、直接進入肺部發揮藥效,降低給藥劑量,提高藥物療效,該平臺未來將有多個產品陸續進入注冊申報階段,進一步造福更多患者。
參考文獻: |
[1] Chen Wang, Jiangying Xu, Lan Yang, et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study) a national cross-sectional study. Lancet 2018 Vol 391 1706-1717. |
[2] Kewu Huang, Ting Yang, Jiangying Xu, et al. Prevalence, risk factors, and management of asthma in China a national cross-sectional study. Lancet 2019 Vol 394 407-418. |
[3] 申昆玲,鄧力,李云珠,李昌崇等, 支氣管舒張劑在兒童呼吸道常見疾病中應用的專家共識[J],臨床兒科雜志2015,33(4):373 |
上海2023年4月7日 /美通社/ -- 近日,濟民可信集團收到國家藥品監督管理局核準簽發的《藥品補充申請批準通知書》,由旗下子公司南京生命能科技公司承擔研發、南京恒生制藥有限公司生產的嘉文®(間苯三酚注射液)一致性評價申請獲得批準,用于治療平滑肌痙攣所致疼痛。
間苯三酚注射液最早在法國原研上市,可直接作用于消化系統、泌尿系統和生殖系統平滑肌,使痙攣器官和組織的平滑肌細胞處于松弛狀態,以緩解腹痛和腎絞痛等癥狀。與其它解痙止痛藥相比,該品為非阿托品類非罌粟堿類唯一純平滑肌解痙止痛藥,循證證據充分,安全性高,得到多指南共識、《臨床路徑釋義》推薦使用,廣泛應用于消化科、泌尿科、急診科、婦產科等。據米內網數據,2022年上半年,該品占據中國公立醫療機構解痙藥注射劑藥品市場份額40.71%。
濟民可信集團間苯三酚注射液于2004年12月作為國內首家獲批上市,此次通過一致性評價有助于進一步穩定市場占有率,造福更多患者。
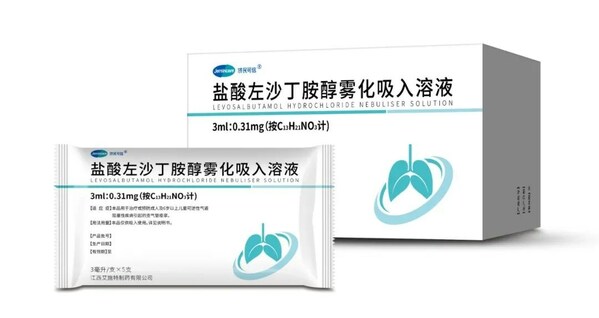
]]>目前,我國20歲及以上人群哮喘患病率為4.2%,患者總人數達到4570萬[1]。此外,約1億人罹患慢性阻塞性肺病(COPD),已成為我國居民第三位主要死因[2],吸入藥物是治療哮喘和COPD的首選療法。
鹽酸左沙丁胺醇霧化吸入溶液是一種舒張支氣管平滑肌的藥物,相較于普通的沙丁胺醇,去除了與β1受體選擇性更高且帶來副作用的右旋體,僅保留了與β2受體選擇性更高的左沙丁胺醇,具有副作用小、療效好、劑量小等特點。作為活性成分的左沙丁胺醇有很強的β2受體親和力,β2受體均勻分布在大中小氣道上,使得左沙丁胺醇對于大中小氣道平滑肌作用全面,從而起到了一致性舒張氣道平滑肌的作用[3][4]。
該藥物從立項到獲批共歷時三年時間,上海濟煜與艾施特制藥合作打造國內領先的吸入制劑研發生產平臺,覆蓋干粉吸入劑、吸入氣霧劑、鼻用制劑、以及其它粘膜給藥制劑等多種劑型,通過局部給藥的方式快速、直接進入肺部發揮藥效,降低給藥劑量,提高藥物療效,該平臺未來將有多個產品陸續進入注冊申報階段,進一步造福更多患者。
參考文獻:
[1] Chen Wang, Jiangying Xu, Lan Yang, et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study) a national cross-sectional study. Lancet 2018 Vol 391 1706-1717. |
[2] Kewu Huang, Ting Yang, Jiangying Xu, et al. Prevalence, risk factors, and management of asthma in China a national cross-sectional study. Lancet 2019 Vol 394 407-418. |
[3] Schreck DM. Asthma pathophysiology and evidence-based treatment of severe exacerbations. Am J Health Syst Pharm. 2006 May 15;63(10 Suppl 3):S5-13. doi: 10.2146/ajhp060127. PMID: 16679429. |
[4] Nelson HS. Clinical experience with levalbuterol. J Allergy Clin Immunol. 1999 Aug;104(2 Pt 2):S77-84. doi: 10.1016/s0091-6749(99)70277-0. PMID: 10452792. |
血小板減少癥是一種出血性疾病,嚴重性血小板減少癥如慢性肝病(CLD)、慢性原發免疫性血小板減少癥(ITP)具有較高的自發性出血,嚴重者甚至可以危及生命。
作為全球首個經FDA、EMA批準,擁有CLDT、ITP雙適應癥的血小板生成素受體激動劑(TPO- RA),馬來酸阿伐曲泊帕片由美國AkaRx公司研發生產, 通過刺激巨核細胞從骨髓祖細胞的增殖分化,促進血小板的生成,可短時間內(治療后3-5天)快速提升血小板計數,安全且耐受性良好,口服用藥方式不受食物類型限制,大大提高了血小板減少癥患者的生活質量[1] [2]。
據米內網數據,馬來酸阿伐曲泊帕片2021年銷售額為3.6億元,是2020年的20.7倍,銷售增長迅速,目前暫無仿制藥獲批。2022年9月,濟民可信馬來酸阿伐曲泊帕原料藥獲CDE受理,同年11月由此原料藥生產的制劑馬來酸阿伐曲泊帕片臨床BE等效通過,未來計劃進一步豐富公司產品線,提升市場競爭力。
該項目源于濟民可信高端口服固體制劑平臺,此平臺隸屬于濟民可信研發中心創新技術藥物研究院,涵蓋速釋制劑、緩釋制劑、難溶性藥物增溶(含熱熔擠出)、及多顆粒給藥系統,研發設施配置先進完備,擁有豐富的制劑研發及產業化技術經驗及資源。近年來,依托這一平臺濟民可信已實現數項高端仿制藥的技術突破,目前已完成多個項目的放大生產與臨床BE,相關產品有望在今年陸續獲批上市。
參考文獻
[1] 新型血小板生成素受體激動劑之阿伐曲泊帕 |
上海2022年9月22日 /美通社/ -- 濟民可信集團今天宣布,旗下子公司上海濟煜醫藥科技有限公司創新技術藥物研究院承擔研發的特色原料藥馬來酸阿伐曲泊帕已提交注冊并獲國家藥品監督管理局藥品審評中心(CDE)受理。該原料藥落地生產由南京恒生制藥有限公司承擔,這是濟民可信集團旗下兩家子公司合作申報的第一個原料藥項目。
馬來酸阿伐曲泊帕(Avatrombopag,AVA)是美國AkaRx公司研發生產的新一代血小板生成素(Thrombopoietin,TPO)受體激動劑,于2018年5月獲美國FDA批準上市,適應癥包括用于擇期行侵入性檢查或手術的成人慢性肝病相關血小板減少癥和用于對既往治療反應不佳的成年慢性免疫性血小板減少癥(ITP)患者的血小板減少癥。
2018年3月,該藥物進入中國大陸及香港特別行政區市場,并在2020年4月獲NMPA批準用于擇期行診斷性操作或手術的慢性肝病相關血小板減少癥的成年患者,商品名為蘇可欣/DOPTELET。[1]
作為全球首個獲美國FDA批準的口服血小板生成素受體激動劑(TPO-RA),第二代的阿伐曲泊帕屬于小分子非肽類化合物,其潛在血栓風險低且不受食物類型限制的口服用藥方式顯著改善了血小板減少癥患者的生活質量。[2]
2020年12月28日,蘇可欣®成功納入《國家基本醫療保險、工商保險和生育保險藥品目錄》,大大提升了中國慢性肝病相關血小板減少癥患者的用藥可及性。更多患者將受益于國際領先治療方案,降低經濟負擔,提高生活質量。[2]
目前該藥物在國內上市的僅為AkaRx公司原研進口制劑Doptelet。根據米內網數據,2021年度,馬來酸阿伐曲泊帕片銷售額為3.6億元,是2020年的20.7倍,銷售增長迅速。
依托特色原料藥研發平臺和產業化基地,濟民可信研發團隊順利完成該項目從實驗室研發到工廠的中試驗證,遞交原料藥申報資料并獲得受理。濟民可信將持續探索,努力為中國和全球患者帶來更高品質、更可及的治療藥物和解決方案。
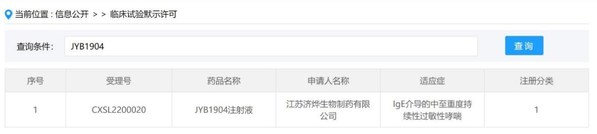
]]>上海2022年3月28日 /美通社/ -- 濟民可信集團宣布,旗下子公司江蘇濟燁生物制藥有限公司提交的新型抗IgE重組人源化單克隆抗體靶向治療藥物JYB1904注射液新藥臨床試驗申請(IND),已獲得中國國家藥監局藥品審評中心(CDE)批準。
JYB1904由濟民可信子公司上海濟煜醫藥科技有限公司自主研發,是擁有自主知識產權的生物制品1類新藥,臨床試驗申請于2022年1月14日獲CDE受理,僅70天即獲得臨床試驗默示許可。
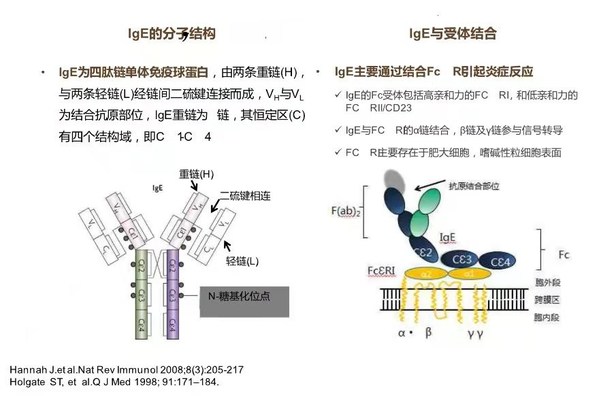
IgE 是介導Ⅰ型超敏反應疾病的主要免疫球蛋白,當機體接觸到過敏原后,過敏原可與結合在效應細胞表面FcεRI上的 IgE結合并相互交聯形成交聯物,引起炎癥介質的釋放,導致各種過敏癥狀[1,2]。濟民可信研究人員發現,JYB1904能與游離IgE特異性結合,從而阻斷IgE與其受體FcεRI結合,進而阻止其被過敏原活化,有望在臨床上迅速、有效緩解患者癥狀。
在與奧馬株單抗頭對頭對比的臨床前研究中,JYB1904表現出了更好的生物活性、成藥性和穩定性,在動物哮喘模型中起效快、藥效好,動物體內安全性好,藥物血清半衰期長[3]。這些研究結果表明,JYB1904注射液具有優良的臨床治療潛力,可為中重度哮喘等過敏性疾病的臨床治療提供潛在的新方案。
目前,濟民可信已完成JYB1904國內臨床研究計劃,以便快速推進臨床I期試驗。期待產品早日落地,為患者帶來福音。
關于上海濟煜醫藥科技有限公司
上海濟煜醫藥科技有限公司是濟民可信集團全資子公司,致力于成為具有全球影響力的藥物研發中心,其研發管線涵蓋生物大分子創新藥、化學小分子創新藥、創新中藥、復雜仿制及高端制劑,致力于在腎病、腫瘤、心腦血管、呼吸系統、抗感染、兒科、疼痛等治療領域取得突破性進展。JYB1904注射液的研發由該公司大分子創新藥物研究院主導完成,該院自建有700億級飛杰全人源抗體文庫,并自主開發完成飛泰抗體發現平臺,已有多個抗體藥物進入IND或IND申報準備階段。目前,該院自主開發的新冠中和抗體JMB2002已完成I期臨床,最新研究證實,其對新冠病毒Omicron變異株具有較好中和功能,相關成果已在《Science》發表。
關于濟民可信集團
濟民可信集團創建于1999年,總部位于中國南昌,主要產品管線為腎病、腫瘤、心腦血管、呼吸抗感染、疼痛五大領域,致力于為患者提供高質量的藥品和創新醫藥解決方案。作為中國領先的大型現代制藥集團之一,濟民可信集團已連續多年位列中國醫藥工業百強前十。
更多信息
請訪問:www.jemincare.com
或聯系:PR@jemincare.com
參考資料
1. Wright JD, Chu HM, Huang CH, Ma C, Chang TW, Lim C. Structural and Physical Basis for Anti-IgE Therapy. Scientific reports. 2015; 5:11581.
2. Palomares O, Akdis M, Martin-Fontecha M, Akdis CA. Mechanisms of immune regulation in allergic diseases: the role of regulatory T and B cells. Immunological reviews. 2017; 278(1):219-36.
3. Liu P, Pan Z, Gu C, Cao X. Liu X, Zhang J, Xiao Z, Wang X, Guo H, Ju D, Deng SJ. An omalizumab biobetter antibody with improved stability and efficacy for the treatment of allergic diseases. Frontiers in Immunology. 2020; 11:1-15.