- 康替唑胺替代利奈唑胺治療耐多藥/利福平耐藥結核病患者臨床研究[1]
本研究是一項納入2022年1月至2024年1月在山東大學附屬山東省公共衛生臨床中心使用含利奈唑胺方案發生不良反應而換用含康替唑胺方案的13例耐多藥/利福平耐藥結核病患者進行的回顧性研究。研究結果顯示,康替唑胺在骨髓抑制、神經毒性等方面優于利奈唑胺,并且在安全性和療效方面均表現良好。這些初步數據為康替唑胺在治療耐藥結核病患者中的潛力提供了初步支持,由于納入病例較少,未來需進一步擴大樣本量及完善臨床試驗,進一步證實康替唑胺在治療耐多藥/利福平耐藥結核病患者中的療效及安全性。
- 康替唑胺在脊柱感染患者中的應用[2]
本研究是一項單中心、回顧性研究,共納入了7例耐甲氧西林金黃色葡萄球菌(MRSA)所致脊柱感染性疾病患者,所有患者均經歷了使用利奈唑胺治療發生血小板下降而換用康替唑胺。研究發現,口服康替唑胺治療2周后患者血小板水平獲得恢復,并在治療結束后評估展示良好的臨床療效及安全性。康替唑胺有望成為脊柱感染性疾病患者的一種更為安全有效的治療方案,并需要更多的研究予以證實。
- β-磷酸三鈣/硫酸鈣負載康替唑胺磷酸鹽(MRX-4)對耐甲氧西林金黃色葡萄球菌生物膜的抗菌效力、預防和殺滅效果[3]
本研究對存在MRSA(ATCC43310)感染的情況下,對用β-磷酸三鈣/硫酸鈣(β-TCP/CS)或CS負載的康替唑胺磷酸鹽(C)和萬古霉素(V)與慶大霉素(G)聯合使用的藥物洗脫動力學進行了評估。結果顯示,C+G和V+G對MRSA生物膜的預防和殺滅效果相似,但C+G的抗菌效力持續時間要長于V+G。目前還需進一步開展臨床試驗,以確定康替唑胺磷酸鹽能否局部應用于骨關節感染的治療。
- 康替唑胺在大鼠異物骨髓炎模型中對耐甲氧西林金黃色葡萄球菌的作用[4]
本研究評估了康替唑胺在大鼠異物骨髓炎模型中的體內活性。結果表明,康替唑胺在大鼠異物骨髓炎模型中對MRSA有效,減少了骨中的細菌負荷。
關于康替唑胺與MRX-4
康替唑胺片(商品名:優喜泰®)是盟科藥業自主設計和開發的新一代噁唑烷酮類抗菌藥,可用于治療多重耐藥革蘭陽性菌引起的感染,于2021年6月1日通過國家藥品監督管理局優先審評審批程序批準上市,并于同年12月通過國家醫保談判納入2021年國家醫保目錄(乙類)。2023年康替唑胺片再次通過國家醫保評審,順利續約,納入2023年國家醫保目錄。
與此同時,盟科藥業持續推進康替唑胺前藥注射劑型MRX-4的臨床試驗,MRX-4在體內轉化為康替唑胺發揮療效,極大拓展了臨床使用場景,預期獲批上市后可以為重癥患者和不適宜口服給藥的患者提供更多用藥上的便利。
參考文獻: |
1. Tingting Chang, Yuxia Zhang, Yanming Sun, Zhiyuan Zhao, Fengxia Liu, Yu Xiong. Department of Tuberculous VII, Shandong Public Health Clinical Center Affiliated to Shandong, Jinan, Shandong, China. Safety and Efficacy of Replacement with Multidrug-Resistant/Rifampicin-Resistant Tuberculosis Who are Intolerant to Linezolid-Containing Regiments: a Retrospective Case Analysis |
2. Bo Wei, Xiucui Zhang, Jianrong Wang. Department of Infectious Diseases, Changzheng Hospital, Second Military Medical University. Contezolid in Patients with Spinal lnfections |
3. Nan Jiang, Peng Chen, Xin Zhang, Hao-yang Wan, Guan-qiao Liu, Qing-rong Lin, Bin Yu. Guangdong Institute of Orthopaedics & Traumatology, Nanfang Hospital, Southern Medical University, Guangzhou, 510515, PR China. β-tricalcium phosphate/calcium sulfate loaded with contezolid for antimicrobial potency, prevention and killing efficacy of MRSA biofilm |
4. Melissa J. Karau, Sebastian Herren, Christina Koscianski, Kerryl Greenwood-Quaintance, Jay Mandrekar, Robin Patel. Mayo Clinic. Contezolid is Active against Methicillin-Resistant Staphylococcus aureus in Experimental Rat Foreign Body Osteomyelitis. https://idweek2024.eventscribe.net/searchbyposterbucket.asp?f=PosterSessionName&pfp=BrowsebyPosterSession |
聲明:
1. 以上研究內容均來源于公開發表論文,不代表本平臺觀點或立場。本文旨在促進醫藥信息的溝通與交流,非廣告用途。相關信息并非針對患者,僅供醫療衛生專業人士參考之用。
2. 本文所包含的任何醫療醫藥信息只作為科學信息以供參考,不能取代向醫生或其他有資格的醫療衛生專業人士進行的咨詢,不能替代醫生或醫療衛生專業人士提供的醫療建議,也不應被視為診療建議。若您想了解具體疾病診療信息,請遵從醫生或其他醫療衛生專業人士的意見或指導。
3. 本公司不對任何藥品和/或適應癥作推薦。
4. 本公司對本文內容的準確性、時效性和完整性不做任何形式的保證或承擔任何責任。
前瞻性聲明:
本新聞稿中包含若干前瞻性陳述,該等前瞻性陳述并非歷史事實,為公司基于當前所掌握的數據和信息對未來事件所做的預測或期望。"預期"、"相信"、"繼續"、"可能"、"估計"、"期望"、"有望"、"打算"、"計劃"、"潛在"、"預測"、"預計"、"應該"、"將"、"擬"、"會"和類似表達旨在識別前瞻性陳述,但并非所有前瞻性陳述都包含這些識別詞。這些前瞻性陳述涉及已知和未知的不確定性和其他重要因素,可能因受到政策、研發、市場及監管等不確定因素或風險的影響,而導致實際結果與前瞻性陳述有重大差異。請現有或潛在的投資者審慎考慮可能存在的風險,并不能完全依賴本新聞稿中的前瞻性陳述。本新聞稿中包含的任何前瞻性陳述僅代表截至本新聞稿發布之日的情況。除非法律要求,本公司無義務因新信息、未來事件或其他情況而對本新聞稿中任何前瞻性陳述進行更新或修改。
澳大利亞I期臨床研究相關情況和主要結果
本次臨床試驗為MRX-5首次應用于人體的Ⅰ期臨床試驗,在澳大利亞Nucleus Network研究中心開展,旨在評估健康成人受試者單次和多次口服MRX-5片劑的安全性、耐受性和藥代動力學特征,以及探索食物效應。
本次臨床研究結果表明,MRX-5在健康成人群體中顯現出良好的安全性和耐受性。在本研究中,未發生導致提前退出或終止研究的與研究藥物相關的不良事件,未觀察到嚴重不良事件,亦未出現"常見不良反應事件評價標準"CTCAE 3級及以上的與研究藥物相關的不良事件。大多數不良事件為CTCAE 1級(輕度),無需干預即可自行恢復。同時,在50mg~1200mg劑量范圍內,健康受試者單次口服MRX-5后,其活性代謝物MRX-6038的藥代動力學呈線性且可預測。此外,食物影響研究初步數據顯示MRX-6038無食物效應。
本次臨床研究結果的影響及公司未來計劃
本次臨床試驗的成功不僅為后續臨床開發提供了有力的數據支持,也為MRX-5未來在治療NTM感染的應用前景增添了信心。
目前,全球范圍內NTM感染不斷增加,但針對這一領域的新藥研發相對匱乏。MRX-5作為一種專門針對NTM感染的抗菌藥物,具備針對性、特異性的作用機制,以及可口服、生物利用度高、耐藥率低和安全性好的潛在優勢。未來,公司將探索包含MRX-5的全口服治療策略,旨在為NTM感染的患者提供更安全、更高效的治療選擇。
關于MRX-5
MRX-5是一種新型苯并硼唑類抗生素,擬用于治療分枝桿菌屬,特別是由非結核分枝桿菌(non-tuberculous Mycobacteria,NTM)引起的感染。
非結核分枝桿菌種類繁多,NTM病的發病率和患病率持續增長。MRX-5屬于新型抗耐藥NTM感染新藥,對常見的NTM致病菌具有良好的抗菌活性,且在動物試驗和此次人體實驗中顯示出良好的安全性和藥代動力學特性。此外,該藥物具有相互作用少、不易耐藥、可口服的特點,使其適用于長期服用以治療慢性感染。
關于NTM及其市場需求
非結核分枝桿菌是指除結核分枝桿菌復合群和麻風分枝桿菌之外的一類分枝桿菌。迄今為止,已發現超過190種NTM菌種及其14個亞種,其中,最常見的致病性NTM包括鳥分枝桿菌復合群和膿腫分枝桿菌復合群。
近年來,NTM的發病率呈增長趨勢,已成為威脅人類健康的重要公共衛生問題之一。[1]人體感染NTM后,會引起相關組織、臟器的病變,以NTM肺病最為常見。目前NTM感染的治療主要依賴于多種抗生素的多藥聯合治療,藥物治療的療程長,且傳統藥物存在普遍的藥物耐藥、療效不佳、不良反應多等問題。
參考文獻:
[1]中華醫學會結核病學分會. 非結核分枝桿菌病診斷與治療指南(2020年版)[J]. 中華結核和呼吸雜志, 2020,43(11): 918-946. DOI:10.3760/cma.j.cn112147-20200508-00570.
聲明:
1. 本文僅作為盟科藥業新聞發布,旨在促進醫藥信息的溝通與交流,非廣告用途。相關信息并非針對患者,僅供醫療衛生專業人士參考之用。
2. 本文所包含的任何醫療醫藥信息只作為科學信息以供參考,不能取代向醫生或其他有資格的醫療衛生專業人士進行的咨詢,不能替代醫生或醫療衛生專業人士提供的醫療建議,也不應被視為診療建議。若您想了解具體疾病診療信息,請遵從醫生或其他醫療衛生專業人士的意見或指導。
3. 本公司不對任何藥品和/或適應癥作推薦。
4. 本公司對本文內容的準確性、時效性和完整性不做任何形式的保證或承擔任何責任。
前瞻性聲明:
本新聞稿中包含若干前瞻性陳述,該等前瞻性陳述并非歷史事實,為公司基于當前所掌握的數據和信息對未來事件所做的預測或期望。"預期"、"相信"、"繼續"、"可能"、"估計"、"期望"、"有望"、"打算"、"計劃"、"潛在"、"預測"、"預計"、"應該"、"將"、"擬"、"會"和類似表達旨在識別前瞻性陳述,但并非所有前瞻性陳述都包含這些識別詞。這些前瞻性陳述涉及已知和未知的不確定性和其他重要因素,可能因受到政策、研發、市場及監管等不確定因素或風險的影響,而導致實際結果與前瞻性陳述有重大差異。請現有或潛在的投資者審慎考慮可能存在的風險,并不能完全依賴本新聞稿中的前瞻性陳述。本新聞稿中包含的任何前瞻性陳述僅代表截至本新聞稿發布之日的情況。除非法律要求,本公司無義務因新信息、未來事件或其他情況而對本新聞稿中任何前瞻性陳述進行更新或修改。
]]>
上海2024年6月6日 /美通社/ -- 近日,上海盟科藥業股份有限公司("盟科藥業",688373.SH)自主研發的新型注射用多黏菌素類抗菌藥MRX-8在中國I期臨床試驗順利完成,并達到預期目標。MRX-8主要用于治療多重耐藥性革蘭陰性菌感染,這一突破性成果標志著公司在開發有效應對多重耐藥細菌感染的新藥領域中邁出了重要的一步。
與此同時,世界衛生組織(WHO)發布了2024最新細菌優先病原體預警清單(BPPL),強調了開發新型抗菌藥物的緊迫性。盟科藥業始終聚焦全球日益嚴重的細菌耐藥問題,將繼續秉持創新驅動的理念,加快推進抗菌藥物的研發和市場化進程。
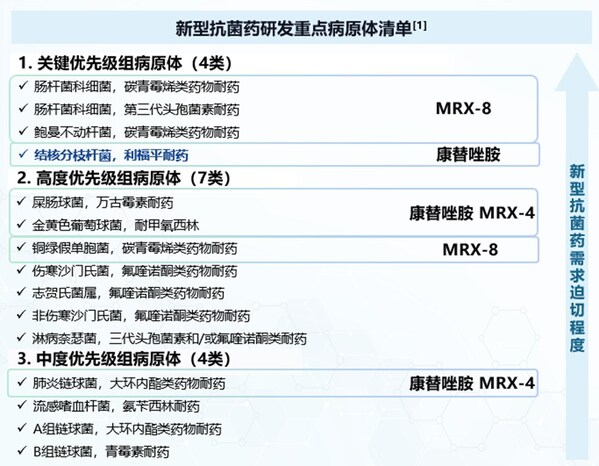
最新WHO"超級細菌"清單
根據世界衛生組織2024最新細菌優先病原體預警清單,全球范圍內的抗菌藥物研發需要集中應對一些最為緊迫的耐藥細菌。這份清單包含15類具有抗生素耐藥性的病原菌,根據研究與開發和公共衛生措施分為關鍵、高度、中等3個優先級組,以指導研究和開發新抗生素。
在此份清單中,關鍵優先級病原體包括對碳青霉烯類和第三代頭孢菌素等抗生素耐藥的革蘭陰性菌,如鮑曼不動桿菌和腸桿菌科細菌,這些細菌在醫院環境中尤其具有嚴重威脅。近日順利完成中國I期臨床試驗的MRX-8,在預計的臨床劑量下,能夠有效對抗鮑曼不動桿菌、綠膿桿菌以及腸桿菌科等多重耐藥菌引起的嚴重感染。
此次更新值得注意的還有,結核分枝桿菌(利福平耐藥)由2017年的"單獨提示"提升為"關鍵優先級組",急需新型有效的抗生素來應對這一全球性難題。結核病是全球重大公共衛生問題之一,尤其是在耐藥結核病的治療上,面臨著巨大挑戰。盟科藥業自主研發的康替唑胺片已被成功納入《結核病創新診療防治技術白皮書》,在結核病領域的多項臨床前研究提示康替唑胺具有良好的抗耐藥結核分枝桿菌活性,具有潛在的臨床應用價值,一系列研究者發起的臨床研究正在開展中。
關于康替唑胺
康替唑胺片(商品名:優喜泰®)是公司自主設計和開發的新一代噁唑烷酮類抗菌藥,可用于治療多重耐藥革蘭陽性菌引起的感染,于2021年6月1日通過國家藥品監督管理局優先審評審批程序批準上市,并于同年12月通過國家醫保談判納入2021年國家醫保目錄(乙類)。2023年康替唑胺片再次通過國家醫保評審,順利續約,納入 2023 年國家醫保目錄。憑借藥物良好的有效性及安全性優勢,康替唑胺片在復雜性皮膚和軟組織感染、血流感染、耐藥結核等領域的治療積累了大量成功的真實世界案例。
MRX-4為康替唑胺片的水溶性前藥,在體內轉化為康替唑胺發揮療效,極大拓展了使用場景,預期獲批上市后可以為重癥患者和不適宜口服給藥的患者提供更多用藥上的便利。
與此同時,康替唑胺在肺炎、血流感染、耐藥結核病、中樞神經系統感染、高齡患者在內的多個治療領域及患者人群,開展了一系列研究者發起的臨床研究,截至2024年6月5日,共計14項臨床研究在中國臨床試驗注冊中心(Chinese Clinical Trial Registry, ChiCTR)或ClinicalTrials.gov登記。
參考文獻:
[1] http://www.kangnaiyaopingjiawei.com/?p=1654
關于盟科
成立于2007年,是一家以治療感染性疾病為核心,擁有全球自主知識產權和國際競爭力的創新型生物醫藥企業,致力于發現、開發和商業化針對未滿足臨床需求的創新藥物。自成立之初,公司一直秉承"以良藥求良效"的理念,聚焦全球日益嚴重的細菌耐藥性問題,以解決臨床難題、差異化創新為核心競爭力,目標為臨床最常見和最嚴重的耐藥菌感染提供更有效和更安全的治療選擇。更多信息,敬請訪問盟科藥業官方網站www.micurxchina.com,或訂閱盟科藥業中國官方微信。
"對于生命,這是一場慘烈的戰爭。" 自抗生素被發現的那一天起,細菌耐藥性的問題也隨之而來,細菌一直在不斷進化,而人類發現抗生素的步伐在近十幾年卻出現了短暫的真空期。自2007年成立以來,盟科一直積極布局耐藥革蘭陽性菌、耐藥革蘭陰性菌、非結核分枝桿菌等多個重點領域,做感染領域的拓局者。
2021年6月,盟科藥業的核心產品康替唑胺片(優喜泰®)在國內上市,獲批僅半年后便被納入醫保目錄。2023年12月,優喜泰®成功以原價與醫保續約,時間為兩年。在這兩年半的時間里,康替唑胺片快速地覆蓋到有需要的患者,幫助醫生解決臨床上未被滿足的需求,在行業內積累了良好的口碑。
未來,盟科藥業將繼續秉持著"以良藥、求良效"的理念,加快推動新藥研發,讓更多患者用到新藥、好藥;與此同時,運用多種手段為公眾科普細菌、抗菌藥相關知識,承擔企業社會責任的同時,筑牢人類對抗耐藥菌的最后一道防線。
關于盟科
成立于2007年,是一家以治療感染性疾病為核心,擁有全球自主知識產權和國際競爭力的創新型生物醫藥企業,致力于發現、開發和商業化針對未滿足臨床需求的創新藥物。自成立之初,公司一直秉承"以良藥求良效"的理念,聚焦全球日益嚴重的細菌耐藥性問題,以解決臨床難題、差異化創新為核心競爭力,目標為臨床最常見和最嚴重的耐藥菌感染提供更有效和更安全的治療選擇。更多信息,敬請訪問盟科藥業官方網站www.micurxchina.com,或訂閱盟科藥業中國官方微信。
"VB-Focus 2023醫療健康科技創新獎"由聚焦于醫療健康產業的媒體平臺——動脈網發起評選,主要面向在科技創新、產業落地等方面有重要推動能力的CEO,以及在技術創新、研發、規劃、質量等方面有重要推動能力的CTO展開征集。經過組委會的評審,盟科藥業CEO ZHENGYU YUAN(袁征宇)和CTO王星海上榜。兩人都具備豐富的藥物研發經驗,深耕耐藥細菌這個問題日益嚴峻的領域,帶領盟科實現了技術上的突破,研發出了具有核心競爭力的產品——康替唑胺片。
成立十余年來,盟科始終秉持著"以良藥、求良效"的理念,不斷完善對抗耐藥細菌的管線,讓創新藥產品為患者帶來更多福音,筑牢人類的"最后一道防線"。
]]>
ESG是環境(Environmental)、社會(Social)、治理(Governance)三個英文單詞的首字母縮寫,是可持續發展理念在企業微觀層面的具體反映,也是對上市公司可持續發展及長期投資價值進行評價的重要衡量維度。隨著監管機構和證券交易所不斷出臺信息披露新規,ESG報告幾乎成了企業的第二份財報。當下,上市公司如何答好ESG"答卷",提升企業在全球市場中的競爭力,已成為日益關注的重要議題。
盟科藥業將ESG管理聚焦于5大領域,包括:筑牢治理根基、堅持守正創新、打造優質產品、構建溫暖職場及共建美好社區。盟科藥業心系患者,致力提供更優質的差異化治療產品;秉持"任人唯賢、就業機會平等、合法合規、公平和經濟"的原則,與員工共同成長;積極落實內部ESG管理,承擔企業社會責任,主動公開ESG相關信息,匯總成為年度報告進行披露。
未來,盟科將致力于通過技術創新和發展,滿足臨床上未被滿足的需求;同時,持續踐行企業社會責任,為健康產業做出更大貢獻。
]]>數據顯示,CZD/CZA在各亞組人群間臨床療效與安全性相似;與同類藥物相比,顯示出血液學相關安全性優勢。
其中一張壁報標題為"不同BMI分類和性別的患者使用CZD及CZA療效和安全性的II期和III期皮膚感染臨床試驗",對四項已完成的II期及III期皮膚及軟組織感染臨床試驗數據進行分析,結果顯示CZD/CZA在不同性別、不同BMI受試者中的主要療效和安全性相似,進一步支持對于目前正在開展的糖尿病足與急性細菌性皮膚及軟組織感染全球III期臨床研究招募受試者無需進行體重與性別限制。
對于任何一種治療方法而言,特殊人群的應用是臨床關心的重要問題。兩張壁報針對CZD/CZA在腎功能受損亞組人群的用藥結果方面做了分析及解讀。對四項已完成的II期及III期皮膚及軟組織感染臨床試驗數據進行分析,結果顯示輕度和中度腎功能損害的受試者與腎功能正常受試者主要療效和安全性相當,無需調整CZD/CZA劑量。對CZD III期復雜性皮膚及軟組織感染臨床試驗藥代動力學數據進一步分析顯示,輕中度腎功能損害的受試者與腎功能正常受試者藥代動力學指標結果相似。
該結果同樣支持正在開展進行的糖尿病足與急性細菌性皮膚及軟組織感染全球III期臨床研究招募腎功能受損受試者,且無需調整藥物劑量。
此外,一張壁報報告了2項CZD II期及III期復雜性皮膚及軟組織感染臨床試驗血小板安全性數據結果。在7-14天的治療中,CZD受試者的平均血小板計數沒有下降,而利奈唑胺受試者的平均血小板計數發生下降,差異具有顯著性。在對接受≥11天治療的亞組人群受試者數據進一步分析結果顯示,平均血小板計數差異更為顯著。血液學安全性也將是全球III期臨床研究關注的重點。
快速的推進、優秀的臨床數據不僅凸顯了盟科藥業制藥的"安全、可靠"優勢,同時也預示著其未來更多藥物獲批的可能性。
康替唑胺作為全球原創、 自主產權、 國際研發的新型"超級抗生素",已于2021年6月在中國獲批上市,并在同年進入國家醫保目錄,2022年1月1日正式執行。全球多中心臨床試驗滿足國際監管規定,產品未來有潛力進入中國、美國、歐盟以及全球市場,為更多多重耐藥菌感染患者提供更優化的治療選擇和更強有力的幫助。
]]>經過十余年發展與升華的“Venture50”,已成為高成長企業投資風向標。本屆評選由數百家投資機構、逾千位投資人評審,針對企業不同成長階段和細分賽道評選出了一批具備高成長潛力的優秀創業企業。盟科藥業從眾多企業中脫穎而出可謂實至名歸。
2021年,盟科藥業還榮獲“2021最佳原研小分子化學藥企業(TOP10)”,“2021年中國醫藥工業最具投資價值企業(非上市)”等獎項。
]]>