該標準可用于合理全面評估BRCA產品性能有效性、穩定性、安全性,確保測序數據的分析、解讀及報告的準確性與嚴謹性,提升機構間對于變異分級結果的一致性,最大化保障患者的利益,有助于醫療和遺傳咨詢工作的順利開展。
BRCA是評估乳腺癌、卵巢癌、胰腺癌、胰腺癌等多種腫瘤患病風險的重要基因,也是影響患者個體化治療方案的關鍵生物標志物。該標準全面整合了行業共識及國內外指南文獻,形成適用于我國的BRCA基因解讀行業標準,對BRCA基因突變檢測試劑盒及數據庫的術語和定義、試劑盒要求、數據庫的數據構成、數據庫的數據規范、數據庫的數據管理及變異分級解讀等多方面技術內容進行了指導規范。
泛生子在IVD和LDT領域豐富的產品研發與臨床實踐經驗為本次參與制定行業標準奠定了基礎。在本次標準協作制定過程中,泛生子利用自身優勢針對數據庫的數據規范和管理、BRCA基因解讀標準等方面內容提出了數十條專業性意見和建議,經與業內專家充分的溝通交流,最終納入到標準中。
作為行業領軍企業代表之一,泛生子始終深入踐行NGS全流程規范化標準化,具有嚴格的高標準的室內質控體系,以最大程度確保實驗室檢測結果可靠性達到國際領先水平,獲得國際權威機構認可。未來,泛生子將繼續拓展產品管線,堅持致力于產品標準的不斷升級,積極深度參與更多相關行業標準的制定,助力精準醫療更加標準化、規范化發展,惠及更多患者。
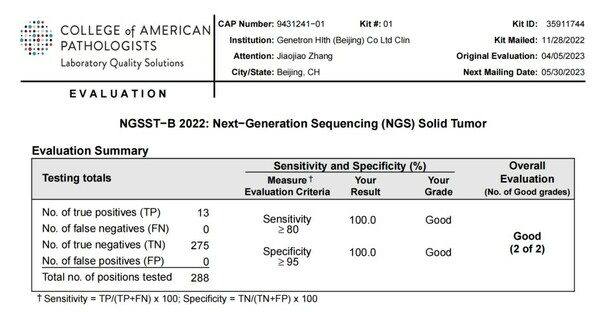
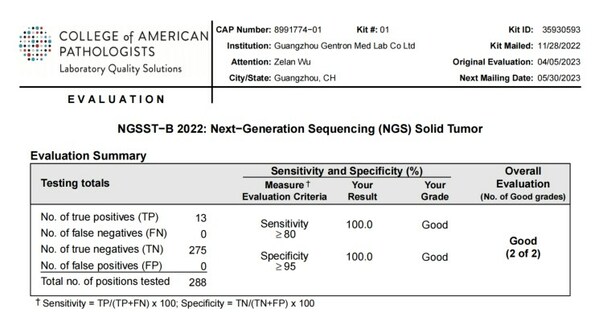
NGSST-B項目是2022年下半年CAP組織用于評估全球基因檢測實驗室使用二代測序(Next-Generation Sequencing, NGS)方法,檢測實體瘤組織基因變異能力的項目。本次項目共檢測三個樣本,樣本編號分別為NGSST-04、NGSST-05、NGSST-06,變異基因包括:BRAF、BRCA1、CDKN2A、EGFR、ERBB2、ESR1、GNA11、IDH1、IDH2、KIT、KRAS、MET、NRAS、PIK3CA、POLE、TP53,涉及SNV、Indel等突變類型。泛生子采用自主研發的Onco PanScanTM進行檢測,整個過程涵蓋實驗操作、生物信息分析、結果解讀等全流程,檢測結果與CAP所公布的標準結果完全一致。
CAP NGSST-B 2022項目成績單:
自成立以來,泛生子一次性滿分通過CAP(美國病理學家協會)、CLIA(美國臨床實驗室委員會)、A2LA(美國實驗室認可協會)三認證,積極參與并滿分通過CAP、NCCL等國內外權威機構開展的室間質評,證實了泛生子實驗室檢測各項目的準確性和可靠性。
泛生子秉持科學合規、持續創新、追求卓越品質,以客戶為中心,致力于為客戶提供優質產品和服務的質量價值觀,不斷精進質量管理。未來,泛生子將繼續秉承質量先行的管理理念,持續完善質量管理體系,為每份樣本負責,助力實現癌癥治療的技術突破。
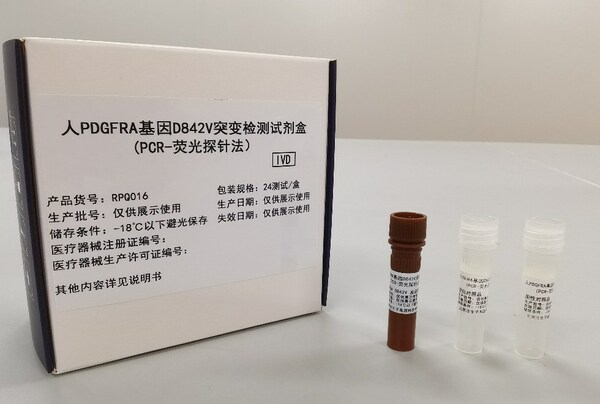
該試劑盒的上市,還實現了多項"首個":首個結合中國境內外藥效數據批準上市的國產伴隨診斷試劑盒;首個在《抗腫瘤藥物的非原研伴隨診斷試劑臨床試驗注冊審查指導原則》和《與抗腫瘤藥物同步研發的原研伴隨診斷試劑臨床試驗注冊審查指導原則》出臺后以完整橋接路徑上市的伴隨試劑盒;首個藥物和器械均獲得優先審評的伴隨試劑盒。
進入優先審評,新規后首個原研伴隨診斷試劑盒率先獲批
一直以來,我國都積極鼓勵和支持醫療器械創新技術和新產品的研發,以推動醫療技術進步。該試劑盒因"臨床急需,且在我國尚無同品種產品獲批的醫療器械"進入國家藥監局優先審批程序。從2019年底泛生子和基石宣布合作,面對新冠疫情帶來的多重挑戰,該試劑盒僅用三年時間便完成從研發到審批的落地。從中不難看出NMPA對該試劑盒臨床價值的權威考量,以及為使其及早進入市場,盡快讓患者獲益而做出的努力。同時,試劑盒快速獲批也反映出泛生子的研發與注冊報證能力、藥企合作服務能力。
此前,國家藥監局器械技術審評中心分別在2021年12月和2022年6月出臺《抗腫瘤藥物的非原研伴隨診斷試劑臨床試驗注冊審查指導原則》和《抗腫瘤藥物同步研發的原研伴隨診斷試劑臨床試驗注冊審查指導原則》兩個伴隨診斷試劑相關的審查指導原則。毫無疑問,新規的出臺有助于優化和高效審查伴隨診斷試劑的注冊申請,加快伴隨診斷試劑的上市進程。更對促進抗腫瘤藥物及其伴隨診斷試劑的研究、應用和上市有著重要的指導和推動作用,有助于提升我國抗腫瘤藥物相關領域的創新能力和競爭力。
這一系列政策落地,在規范伴隨診斷試劑盒注冊要求的同時,也提高了伴隨診斷企業的注冊門檻。而對行業來說,這也是新規實行以來,首個以橋接試驗方式獲批的試劑盒,具備了成功"過河"的經驗,為后來者提供了可參照的范本。
縱觀中美兩國,伴隨診斷試劑的開發晚于藥物臨床試驗開發的情況十分常見。也因此,橋接試驗成為大部分伴隨診斷試劑注冊上市的主要路徑。這種利用已有的藥物臨床試驗數據,通過分析已知藥物治療效果和伴隨診斷試劑預測結果之間的關聯,評估試劑準確性和可靠性的方式,可以很大程度上減少單獨開展臨床試驗的時間和資源成本,也能使伴隨診斷試劑盒更快進入市場,推動藥物的精準治療和個性化醫療發展。
無獨有偶,今年8月FDA批準了凱杰(Qiagen)公司的一款實時熒光PCR伴隨診斷產品,橋接了NAVIGATOR 臨床研究BLU-285-1101,該產品同樣可檢測PDGFRA基因中的D842V體細胞突變,以確定哪些患者可能適合接受阿伐替尼治療。這兩個預期用途一致的伴隨診斷試劑幾乎同時獲批,同時由于阿伐替尼片在國內的獲批是基于BLU-285-1101和BLU-285-1105兩個關鍵的臨床研究,因此,泛生子也是結合境內外藥效數據進行了兩項橋接試驗。這也有望同時支持到FDA和CE的批準,使其成為國內首個同步推進中美歐上市的原研伴隨診斷試劑。
值得注意的是,此前泛生子憑借原研肝癌早篩液體活檢技術,成為該領域國內首家獲得美國FDA"突破性醫療器械"認定的分子診斷企業,這也證明了其擁有通過FDA驗證的國際一流技術實力,為后續全球多中心臨床試驗保駕護航。
伴隨診斷是實現精準醫療的關鍵所在
一個不爭的業界共識是:當一款新藥上市時,越快匹配伴隨診斷試劑,越能幫助臨床醫生找到帶有特定靶位變化的患者,提高靶向藥物療效、治療安全性以及降低醫療成本,這是實現腫瘤精準醫療的關鍵所在。
以GIST為例,由于GIST引發的癥狀并沒有臨床特異性,因此早期很難發現,不少患者確診時已經是中晚期,手術無法根除,而阿伐替尼片是中國首個獲批用于治療 PDGFRA 外顯子 18 突變的GIST的高活性治療藥物。NAVIGATOR研究顯示,阿伐替尼片的客觀緩解率(ORR)為89%,中位持續緩解時間DOR≥6個月的患者比例為59%。隨著阿伐替尼片在中國的獲批,將切實為中國GIST患者帶來希望,精準治療將高效獲益,后線治療也將穩健獲益。
同時,根據泛生子伴隨診斷試劑盒臨床試驗結果顯示,經伴隨診斷橋接藥物療效ORR達到92.5%,與臨床檢測金標準Sanger測序法陽性符合率(PPA)/陰性符合率(NPA)分別達到100%和99.43%,總符合率(OPA)為99.46%。這個數字說明試劑盒篩出來的患者中,有92.5%使用阿法替尼有效,這無疑極大證明了此伴隨診斷試劑盒的有效性——伴隨診斷如同"瞄準鏡"一般,只有先精準瞄定,才能釋放出靶向藥的"狙擊步槍"威力。
征服伴隨診斷藍海,研發能力、檢測設計能力、報證能力是關鍵
伴隨診斷的重要性不言而喻。而在此基礎上,檢測結果準確、研發報證速度快,成為臨床與藥企的共同訴求。雖然前景一片廣闊,但要使伴隨診斷產品落地,則要求精準診斷企業必須具備集研發能力、檢測設計能力,以及報證能力于一身的綜合實力。特別是以下幾點:
檢測設計能力是確保伴隨診斷產品成功的基礎,這需要伴隨診斷開發企業具備相當的知識背景、研究實力和綜合判斷能力。伴隨診斷從立項到最終獲批通常需要3-4年時間,并且要經過復雜的試驗設計。全面、嚴謹、科學的設計方案,能夠確保高靈敏度和特異性,避免設計缺陷,可以從根本上確保整個試驗過程的流暢和高效,節約獲批時間。這也是在今年的CMAC年會上,基石藥業所談到的此次試劑盒成功落地的關鍵原因之一——泛生子伴隨診斷試劑檢測中高質量的引物設計,確保了伴隨診斷試劑臨床試驗的有效性。
強大的報證能力是伴隨診斷產品獲批的關鍵。從近兩年的新規可以看到,國內也開始鼓勵藥物和伴隨診斷共同開發。本次獲批的泛生子伴隨診斷試劑盒,既無成功先例可參照,又要拿到符合要求的境外樣本,橋接境內外的藥效數據,其難度可見一斑。這期間泛生子對政策的解讀能力、與監管部門的溝通能力,以及嚴謹準確提供數據的能力必定發揮了重要作用。而以上這三項無疑是報證能力的體現,是成功獲批的關鍵。
值得一提的是,跨境伴隨能力,是診斷企業的強勢加分項。不管是以基石為代表的中國醫藥企業引入境外藥,還是這兩年中國創新藥企在緊鑼密鼓地推進"出海"業務,對于藥企來說,如果用一款試劑盒能夠實現國內外的樣本同時檢測,銜接臨床試驗數據,將大大提高藥品在做全球多中心臨床試驗中的效率。此次泛生子的試劑盒橋接了境內外數據,表明其產品精準程度與國際水平一致。
但無論如何,借著政策的東風,期待未來能有更多像泛生子與基石藥業這樣的伴隨診斷合作,讓更多醫患能夠拿起精準醫療的武器,精準狙擊癌癥這個頑敵。
]]>該認定以"技術先進、產權明晰、質量可靠、市場前景廣闊"為評定標準。經認定后的新技術新產品(服務),在未來推廣過程中可享受政府采購、推廣應用等的政策和資金支持。獲得該認定,是對泛生子研發能力、檢測質量和服務水平的肯定,同時展現了HCCscreen肝癌早篩檢測的應用潛力,未來將幫助更多高危人群盡早發現癌癥。
此前泛生子與中國國家癌癥中心啟動的多中心前瞻性研究結果表明,本次被認定的HCCscreen肝癌早篩檢測,在1615名乙肝表面抗原陽性患者的前瞻性隊列實現了88%的靈敏度和93%的特異性,特別是對3cm以下的早期肝癌靈敏度達到85%。
HCCscreen于2020年獲得美國食品藥品監督管理局(FDA)的"突破性醫療器械"(Breakthrough Device Designation)認定,被廣泛引用于《中國抗癌協會原發性肝癌患者指南》《原發性肝癌診療規范》《中國人群肝癌篩查指南(2022,北京)》等多個共識及指南。
HCCscreen核心技術源于泛生子自主研發的創新技術Mutation Capsule (ZL201910983038.8)。2020年8月,憑借Mutation Capsule,泛生子加入了科技部主導的涉及肝癌、肺癌、消化道癌等多個癌種的國家重點專項,截至目前是唯一一家參與三大癌種(肝癌、肺癌、消化道癌癥)國家級早篩研發項目的企業。基于該技術開發的泛生子肺癌8基因試劑盒應用于與四川大學華西醫院深度合作的"肺癌早期精準診斷關鍵技術的建立與臨床應用"項目,獲得了2020年度國家科技進步二等獎。
目前,泛生子已有12項檢測產品及服務榮獲過該權威認可。
泛生子經過多年在技術創新領域的不斷探索,革命性早篩技術取得了突破性進展,填補了肝癌早篩領域的巨大空白,并打造了基于NGS和PCR平臺的早篩產品。未來HCCscreen肝癌早篩檢測將更廣泛地用于國內多個應用場景,幫助高危人群早診早治,以助力提高五年生存率,早日實現健康中國2030。
此次復審,CAP評審專家再次即給予泛生子高度肯定和贊揚。參與本次評審的專家Jinjuan Yao和Hong Hong一致表示,泛生子實驗室硬件配備完善、質量管理體系完善,人員管理專業、團隊能力過硬,完全符合CAP各項標準。
評審專家依據20221024版CAP checklist(包括All Common Checklist、Laboratory General Checklist、Molecular Pathology Checklist、Director Assessment(DRA) Checklist),對實驗室的質量管理、檢測及運營流程進行逐一提問和細致檢查,主要內容包括:分析前(pre-analysis)、分析中(analysis)、分析后檢測全流程(post-analysis)、PT/EQA、室內質量控制、性能確認報告、人員培訓及能力評估、實驗室安全管理、儀器設施管理、樣本管理、試劑儲存及質檢、QC指標、實驗室環境及交叉污染防治、實驗室主任資質等。過程中,泛生子滿足CAP提出的各項要求。
目前泛生子已獲得CAP、CLIA、ISO15189三項國際實驗室質量認可,是國內少數具備此三項認可的NGS醫學檢驗實驗室。優異的成績,源自于對質控的堅持,離不開泛生子精準的檢測和高標準的質量管理,以及旗下各實驗室嚴格遵守"9個質控節點、7大維度把控、3套質控策略"的全周期質控體系。未來,泛生子將繼續保持先進可靠的質控能力,以精準的高質量檢測服務于廣大醫患。
]]>今年下半年以來,促進民營經濟發展壯大的一系列舉措密集出臺。7月19日,《中共中央 國務院關于促進民營經濟發展壯大的意見》發布,針對民營企業的痛點、難點提出系列舉措,為民營經濟環境帶來利好,注入信心。
《意見》提出,要支持提升科技創新能力。國家發展改革委等部門聯合印發的《關于實施促進民營經濟發展近期若干舉措的通知》提出,支持民營企業參與重大科技攻關,牽頭承擔工業軟件、云計算、人工智能、工業互聯網、新型儲能等領域的攻關任務。
隨著政策支持力度的不斷加大,為民營企業創造了更為有利的營商環境。
泛生子擁有國家高新技術企業、國家級博士后科研工作站、北京民營企業科技創新百強等資質和榮譽。另外,泛生子此前參與了由科技部牽頭的"十三五"重大專項,在肺癌和消化系統癌癥領域啟動數據積累和產品研發,同時成為一家進入國家科技部肝癌、肺癌、消化道癌等多癌種早篩國家重大專項的精準醫療企業,其肺癌精準診療項目榮獲國家科技進步二等獎。
醫療健康產業既是國民經濟的重要組成部分,也是推進健康中國建設的重要內容。加快推進醫療健康產業高質量發展,對增進民生福祉、實現中國式現代化、共建人類衛生健康共同體具有重要意義。
在癌癥基因檢測領域,全球有龐大的未滿足的需求和市場潛力,以泛生子代表的科創企業在這些應用領域通過前期大量的科研投入積累了有壁壘的技術平臺和產品管線。
精準醫療企業將為實現將癌癥防治關口前移的目標而努力,并為提升國家科技創新實力貢獻力量。
]]>該試劑盒的上市,還實現了多項"首個":首個結合中國境內外藥效數據批準上市的國產伴隨診斷試劑盒;首個在《抗腫瘤藥物的非原研伴隨診斷試劑臨床試驗注冊審查指導原則》和《與抗腫瘤藥物同步研發的原研伴隨診斷試劑臨床試驗注冊審查指導原則》出臺后以完整橋接路徑上市的伴隨試劑盒;首個藥物和器械均獲得NMPA優先審評的伴隨試劑盒。
PDGFRA基因D842V突變的GIST患者一直缺乏有效治療藥物,而泰吉華®在PDGFRA基因外顯子18突變(包括D842V突變)的不可切除性或轉移性GIST中國患者中表現出優異的抗腫瘤活性,且安全性和耐受性良好,是中國首個獲批用于治療該疾病精準治療的藥物。該伴隨診斷試劑盒是國內首個針對人PDGFRA基因D842V突變的試劑盒,以科學有效的臨床數據作支撐,更精準的篩選出患者,匹配泰吉華®進行治療,使患者得到更精準、更大的生存獲益。
該試劑盒審批的整個流程數據充分、嚴謹,最終實現三年內審批落地。對此,泛生子聯合創始人、董事長及CEO王思振表示:"本著為患者負責的態度,泛生子與基石藥業秉持著同樣嚴格的品質、效率標準。我們可為藥企客戶提供高效的伴隨診斷服務,助力縮短藥物研發周期,促進高效獲批。在與合作伙伴聯手推進創新產品的報證及應用過程中,我們更希望攜手推動行業更規范,更標準,讓合規的精準醫療惠及更多患者。"
基石藥業首席科學官謝毅釗博士表示:"精準醫療是基石藥業的核心策略之一。泰吉華®伴隨診斷試劑盒的獲批展示了我們在中國精準醫療伴隨診斷開發方面的能力。此案例的成功歸功于基石藥業和我們經驗豐富的診斷合作伙伴泛生子,以及Blueprint Medicines的共同努力。相信此伴隨診斷試劑盒的獲批和商業化,會使更多中國GIST患者從泰吉華®的治療中獲益。"
泛生子成績單:
本次室間質評評價樣本主要包含肺癌及結直腸癌等靶向治療相關的基因突變,突變等位基因百分比在0.2%~8%,目的為評價實驗室準確進行ctDNA基因突變檢測的能力。
本次室間質評共收到完整、有效的檢測結果229份。根據不同突變檢測范圍類型可分為外顯子區域實驗室194家,熱點突變實驗室35家。
所有實驗室的總合格率為82.97%(190/229),全部正確的實驗室為74.23%(170/229)。外顯子區域實驗室的合格率為84.54%(164/194),全部正確的實驗室為78.35%(152/194)。熱點突變實驗室的合格率為74.29%(26/35),全部正確的實驗室為51.43%(18/35)。
泛生子連續通過NCCL質評項目,離不開精準的檢測和高標準的質量管理水平。目前泛生子是國內少數具備CAP、CLIA、ISO15189三項國際實驗室質量認證的NGS醫學檢驗實驗室,旗下各實驗室嚴格遵守"9個質控節點、7大維度把控、3套質控策略"的全周期質控體系。未來,泛生子將繼續保持先進可靠的質控能力,以精準的高質量檢測服務于廣大醫患。
該標準首次厘清了高通量基因測序檢測項目在臨床應用中的分類原則和分類類別,有望為高通量基因測序技術臨床應用分類監管和價格形成機制提供有益的參考,同時可為企業產品研發路線提供指引,促進高通量基因測序技術在腫瘤、產前、遺傳病和感染疾病等領域的研究和應用,為科技創新、產業發展和健康中國建設助力 。
在本次標準協作制定過程中,泛生子積極參與標準編寫,憑借其在高通量測序領域豐富的技術研發與產品注冊經驗,為廣東省高通量基因測序產品的分類,以及后續定價機制和監管評估提供了有效依據。
近年來,學科進步和產業創新推動了高通量基因測序平臺、技術、產品的長足發展,但高通量測序的項目分類尚存在缺乏統一標準的情況,這在一定程度上對行業監管產生了不利影響。
對此,國家衛健委醫政司副司長李大川認為,該標準在國內首次系統地梳理了高通量基因測序項目的分類,為下一步政府部門規范、推進高通量基因測序在臨床的應用提供了重要的基礎支撐,是一項具有里程碑意義的事件,也標志著中國高通量基因測序領域的技術標準化工作邁出了重要的一步。
中山大學孫逸仙紀念醫院細胞分子診斷中心主任、教授歐陽能太同樣認為,此次標準的推出,有利于政府監管部門對這一新技術分類監管,以及對高通量檢測進行分類的成本核算與合理的定價機制形成。此外還有助于研發企業部署產品研發線路,研發新技術、新產品,以此進一步引領、促進和規范高通量基因測序技術在臨床上的應用。
廣東省民營醫院和衛生社團組織聯合黨委專職副書記鄧林峰表示,此次標準的發布,是國內首次全面、系統化對高通量基因測序進行分類的標準,必將進一步規范高通量基因測序技術臨床應用,提升人民生命健康科技水平。
同時,廣東省精準醫學應用學會常務副會長、秘書長孫炳剛呼吁,參編的機構、專家應加強協作,共同協力推進價格機制項目研究,為高通量基因測序技術發展做出更大貢獻。
廣東省人民醫院總會計師鄭陽暉表示,本次標準的發布為高通量基因檢測的科學定價機制研究奠定了堅實基礎,將在廣東省精準醫學應用學會平臺的支撐下,正式開啟《高通量定價參考建議》的研究,聯合醫療衛生機構、政策研究機構、龍頭骨干企業的力量,根據高通量基因項目分類,研究、發布科學的定價參考,為政府部門高通量基因檢測技術收費定價提供參考,共助高通量基因測序技術的規范發展和健康發展。
一直以來,泛生子始終積極推動行業規范發展,并已在多個省市推進相關課題討論及標準制定。2022年7月,"山東省高通量基因測序收費及管理規范研究"課題結題及專家論證會提出了未來NGS測序的規范管理思路,泛生子作為企業方提供技術支持;同年9月,上海市衛生和健康發展研究中心發布了基于泛生子人類8基因突變聯合檢測試劑盒用于診斷非小細胞肺癌患者的成本效果,進行了衛生經濟學評估,為地方醫保部門和醫院采購決策提供科學依據。
泛生子副總裁張鳳玲表示,泛生子有能力、有義務推動精準醫療行業的規范有序化發展,本次標準的出臺無疑將在行業形成示范效應。未來,泛生子將持續秉承"抵抗癌癥、守護生命"的使命,積極參與各地新增醫療服務項目,使精準醫療更加規范,從而提高患者診療的可及性。
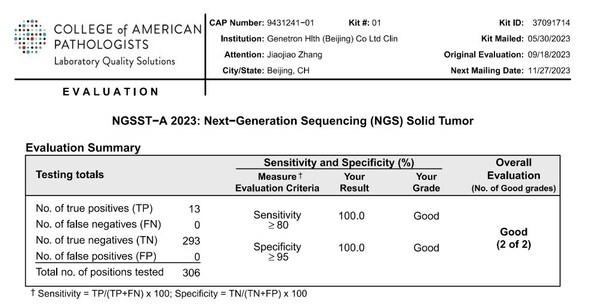
NGSST-A項目是2023年上半年CAP組織的,用于評估全球基因檢測實驗室使用二代測序(Next-Generation Sequencing, NGS)方法檢測實體瘤組織基因變異能力的項目。本次項目共檢測三個樣本,樣本編號分別為NGSST-01、NGSST-02、NGSST-03,變異基因包括:BRAF、BRCA1、CDKN2A、EGFR、ERBB2、ESR1、GNA11、IDH1、IDH2、KIT、KRAS、MET、NRAS、PIK3CA、POLE、TP53,涉及SNV、Indel等突變類型。泛生子采用自主研發的Onco PanScanTM進行檢測,整個過程涵蓋實驗操作、生物信息分析、結果解讀等全流程,檢測結果與CAP所公布的標準結果完全一致。
CAP NGSST-A 2023項目成績單:
自成立以來,泛生子一次性滿分通過CAP(美國病理學家協會)、CLIA(美國臨床實驗室委員會)、A2LA(美國實驗室認可協會)三認證,積極參與并滿分通過CAP、NCCL等國內外權威機構開展的室間質評。未來,泛生子將始終堅持質量第一的原則,持續完善質量管理體系,以最優的質量和最高的效率為更多的臨床醫生和患者提供服務。
泛生子CAP-PT大事記:
2023.09 CAP NGSST-A 2023突變檢測合格
2022.11 CAP NGSST-A 2022突變檢測合格
2022.09 CAP NGS-A 2022突變檢測合格
2021.12 CAP NGSST-B 2021突變檢測合格
2021.12 CAP NGS-B 2021突變檢測合格
2021.09 CAP NGSST-A 2021突變檢測合格
2021.08 CAP NGS-B 2020突變檢測合格
2021.01 CAP NGSST-B 2020突變檢測合格
2021.01 CAP NGS-A 2020突變檢測合格
2020.09 CAP NGSST-A 2020突變檢測合格
2020.04 CAP NGS-B 2019突變檢測合格
2020.03 CAP BRCA-B 2019突變檢測合格
2020.02 CAP CFDNA-B 2019突變檢測合格
2020.01 CAP NGSST-B 2019突變檢測合格
2019.12 CAP MSI-B 2019突變檢測合格
2019.11 CAP NGS-A 2019突變檢測合格
2019.09 CAP MSI-A 2019突變檢測合格
2019.08 CAP CFDNA-A 2019突變檢測合格
2019.08 CAP BRCA-A 2019突變檢測合格
2019.07 CAP NGSST-A 2019突變檢測合格
2019.04 CAP NGS-B 2018突變檢測合格
2019.01 CAP NGSST-B 2018 突變檢測合格
2018.07 CAP NGSST-A 2018突變檢測合格
2018.05 CAP NGS-B 2017突變檢測合格
2018.02 CAP NGSST-B 2017突變檢測合格
2017.11 CAP NGS-A 2017突變檢測合格
2017.08 CAP NGSST-A 2017突變檢測合格
2017.04 CAP NGSST-B 2016突變檢測合格
2017.04 CAP BRAF-B 2016突變檢測合格
2017.03 CAP KRAS-B 2016突變檢測合格
2016.12 CAP EGFR-B 2016突變檢測合格
隨著美國實驗室通過CAP認證,泛生子在美國的藥物開發服務能力將得到進一步增強,推動早期發現及轉化研究、臨床試驗服務、伴隨診斷產品研發等業務開展。
獲得CAP認證,將能有效確保實驗室檢測結果的準確性,以及患者診療方案的正確性,同時確保實驗室滿足監管標準與要求,并保持業務實踐的行業領先性。
泛生子首席醫療官胡云富博士表示:"我們很自豪成為少數在中美兩地均擁有CAP認證實驗室的精準醫療企業,這進一步驗證了泛生子實驗室可靠的質量管理水平,并將支持泛生子充分發揮藥物研發全球化服務的差異化優勢,更好地滿足國內外生物制藥合作伙伴的全球臨床試驗需求。"
泛生子為全球生物制藥公司提供全面的藥物研發服務,包括臨床前的分子標志物研究、臨床試驗中的患者入組和基因檢測、伴隨診斷產品開發及注冊申報等。目前,公司已與NeoGenomics(新極昊)、締脈生物醫藥等跨國公司合作,在中美兩地為其提供腫瘤藥物研究與開發支持。
關于泛生子
泛生子(納斯達克代碼:GTH)是全球前沿的癌癥精準醫療公司,專注于癌癥基因組學研究和應用,并致力依托先進的分子生物學及大數據分析能力改變癌癥診療方式。泛生子已打造了全面的產品及服務管線,覆蓋從癌癥早篩到診斷及治療建議,再到監測及預后管理的癌癥全周期,并與產業鏈上下游合作伙伴積極拓展分子檢測技術的更多創新應用方向和場景。更多公司信息請訪問:https://www.genetronhealth.com。
安全港聲明
本新聞稿包含泛生子對未來的預期、計劃和前瞻性陳述,具有相應風險及不確定性,可能導致實際結果與前瞻性陳述中描述的預期不符。此類陳述是根據1995年美國私有證券訴訟改革法案的"安全港"條款作出的。前瞻性陳述涉及固有風險、不確定性,以及許多可能導致實際結果與任何前瞻性陳述中所描述的內容產生重大差異的因素。其它包含有"預期"、"相信"、"期待"、"計劃"等措辭和類似表達也屬于前瞻性描述。更多有關這些內容及其他風險、不確定性因素的信息,已包含在公司向美國證券交易委員會提交的備案文件中。本新聞稿中提供的所有信息不應被視為本公告發布之日后任何時點的觀點。泛生子預計未來的事件和進展會導致公司的設想和假設發生變化,但無論是否出現了新的信息、未來事件或其它情況,除適用法律要求外,公司不承擔更新任何前瞻性描述的義務。
]]>這些研究包括在肺癌、胃癌等多癌種基因突變和融合圖譜特征,分子特征指導臨床診療,潛在免疫治療分子標志物篩選預測ICIs(免疫檢查點抑制劑)療效等領域的探索,是泛生子攜手10余家國內頂級醫院及科研院所,結合臨床數據,圍繞中國人群深入分析的集中呈現。
泛生子首席醫療官胡云富博士表示:“此次亮相ASCO2022的研究成果,基于泛生子專利技術及創新產品,探索了多癌種基因組學的特征及產品臨床應用。未來泛生子的產品與技術將不斷助力推動對患者的癌癥全周期管理和臨床精準診療。”
本次泛生子在ASCO2022發布的10項研究成果,主要涉及以下三個領域:
基因突變和融合圖譜研究助力癌癥發病機制研究及個性化治療提示
研究# e20530、# 8530、# e15124、# 3121基于二代基因測序(NGS)結果,分別對METex14跳躍、ALK融合及其共突變、ROS1融合等進行基因突變和融合圖譜繪制,研究基因融合與共驅動突變特征、融合模式等,助力闡述癌癥發病機制,提示TKIs類等個性化藥物治療的作用。
分子特征指導臨床診療
目前臨床對多發性結直腸癌(sMPCC)患者的分子特征知之甚少。研究#3601通過免疫熒光(IHC)和二代測序方法(Onco PanScanTM),揭示了sMPCC患者中dMMR/MSI-H的發生率顯著高于單原發結直腸癌(SPCRC)患者。因此,建議sMPCC 患者在治療前應檢查每個病灶的MMR(錯配修復)/MSI(腫瘤微衛星不穩定性)狀態,并據此將這些患者歸類到三個亞組,而具有不同MMR/MSI 狀態的sMPCC患者應當接受個性化的治療,以更好地管理他們的疾病。
對胃癌患者的藥物治療一直以來都面臨著挑戰。雖然HER2導向的治療和免疫檢查點抑制劑已經取得了巨大的成功,但其他有效的靶向藥物仍亟待開發。研究#e16061回顧性地分析了中國患者的胃癌組織樣本中的基因融合與驅動基因突變、MSI、TMB(腫瘤突變負荷)和MMR的關系,提示基因融合檢測或許能夠為標準治療失敗后的胃癌患者提供潛在的治療策略。
小腸腺癌(SBA)是一種罕見的胃腸道癌癥,預后不良,治療方案有限。研究# 4159應用泛生子Onco PanScanTM對84例中國小腸腺癌患者樣本進行全面的基因組學特征分析,發現至少39%患者攜帶臨床潛在治療靶點,為精準診療及匹配臨床試驗提供參考。
潛在免疫治療分子標志物篩選預測ICIs療效
研究#e14536、#e16083、#e14581通過對TCGA(癌癥基因組圖譜)隊列、MSKCC(紀念斯隆-凱特琳癌癥中心)隊列和中國人群隊列的數據研究,探索了PBRM1功能缺失突變、染色質重塑復合物的失活和TP53突變作為潛在ICIs療效或預后的生物標志物的價值。
編號 題目
e20530 Characterization of MET exon 14 skipping in pan-cancer
8530 Driver coexistence characteristics of ALK-fusion in Chinese lung cancer
15124 Analysis of ROS1 fusions in nonlung solid tumors
3121 Molecular characterization of cancers with ALK gene fusions in nonlung tumors
e14536 Pan-cancer analysis of PBRM1 mutation and their association with immunerelated biomarkers and prognosis
e16083 Genomic alteration in chromatin remodeling genes as a potential predictive biomarker for immunotherapy in gastric cancer
e16061 Detection of targetable fusion alterations in gastric cancer in the Chinese population
4159 Evaluation of somatic and germline variants in patients with small bowel adenocarcinoma reveals clinically actionable targets
3601 Molecular typing and clinical characteristics of synchronous multiple primary colorectal cancer
e14581 Investigating the various predictive values of TP53 mutations for response to immune checkpoint inhibitors (ICIs) in different solid tumors
關于泛生子
泛生子(納斯達克代碼:GTH)是全球前沿的癌癥精準醫療公司,專注于癌癥基因組學研究和應用,并致力依托先進的分子生物學及大數據分析能力改變癌癥診療方式。泛生子已打造了全面的產品及服務管線,覆蓋從癌癥早篩到診斷及治療建議,再到監測及預后管理的癌癥全周期,并與產業鏈上下游合作伙伴積極拓展分子檢測技術的更多創新應用方向和場景。更多公司信息請訪問:https://www.genetronhealth.com。
安全港聲明
本新聞稿包含泛生子對未來的預期、計劃和前瞻性陳述,具有相應風險及不確定性,可能導致實際結果與前瞻性陳述中描述的預期不符。此類陳述是根據1995年美國私有證券訴訟改革法案的"安全港"條款作出的。前瞻性陳述涉及固有風險、不確定性,以及許多可能導致實際結果與任何前瞻性陳述中所描述的內容產生重大差異的因素。其它包含有"預期""相信""期待""計劃"等措辭和類似表達也屬于前瞻性描述。更多有關這些內容及其他風險、不確定性因素的信息,已包含在公司向美國證券交易委員會提交的備案文件中。本新聞稿中提供的所有信息不應被視為本公告發布之日后任何時點的觀點。泛生子預計未來的事件和進展會導致公司的設想和假設發生變化,但無論是否出現了新的信息、未來事件或其它情況,除適用法律要求外,公司不承擔更新任何前瞻性描述的義務。
]]>
FusionScan Plus基于泛生子"一步法"建庫專利技術,檢測范圍覆蓋29個腫瘤相關突變基因及40個融合基因。該產品突破了傳統檢測方法的局限,使用低起始量樣本即可進行檢測,檢測快速,且可同時用于腫瘤組織樣本中DNA層面的敏感或耐藥基因突變檢測,以及RNA層面的已知和未知伴侶基因融合檢測,更好地發掘潛在獲益人群,可為臨床病理分型、靶向治療策略制定及新藥研發提供有效參考。
在美國分子病理學會舉辦的2021年會(AMP 2021)上,泛生子針對FusionScan Plus發表研究成果,對76例臨床FFPE樣本的檢測結果表明,FusionScan Plus在基因突變和5'端未知伴侶基因融合檢測上均顯示了高度的準確性,可在有限活檢樣本條件下實現對腫瘤患者用藥位點的精準檢測及對靶向藥物目標人群的精準篩選,提升患者臨床獲益。
泛生子積極推動多個IVD產品在國內、國際市場的臨床認證與業務布局,目前已有人IDH1基因突變檢測試劑盒(PCR-熒光探針法)(國械注準20173401602)、人TERT基因啟動子突變檢測試劑盒(PCR-熒光探針法)(國械注準20173401600)、人類8基因突變聯合檢測試劑盒(半導體測序法)(國械注準20203400072)、人825基因突變檢測試劑盒(聯合探針錨定聚合測序法)、人淋巴B細胞微小殘留病基因檢測試劑盒(可逆末端終止測序法)等產品相繼獲得歐盟CE資質,未來泛生子將緊貼分子檢測臨床需求,加速推動產品的市場轉化,為廣大患者提供更精準、更可及的醫療服務。
關于CE
CE標志(CE Marking)是按照法規要求,部分產品在部分歐洲國家上市時,必須帶有的產品安全標志。帶有CE標志的產品意味著產品符合歐盟相關產品法規基本/通用要求,適于預期用途,可以在要求CE標志的國家自由流通。
關于泛生子
泛生子(納斯達克代碼:GTH)是全球前沿的癌癥精準醫療公司,專注于癌癥基因組學研究和應用,并致力依托先進的分子生物學及大數據分析能力改變癌癥診療方式。泛生子已打造了全面的產品及服務管線,覆蓋從癌癥早篩到診斷及治療建議,再到監測及預后管理的癌癥全周期,并與產業鏈上下游合作伙伴積極拓展分子檢測技術的更多創新應用方向和場景。更多公司信息請訪問:https://www.genetronhealth.com。
安全港聲明
本新聞稿包含泛生子對未來的預期、計劃和前瞻性陳述,具有相應風險及不確定性,可能導致實際結果與前瞻性陳述中描述的預期不符。此類陳述是根據1995年美國私有證券訴訟改革法案的"安全港"條款作出的。前瞻性陳述涉及固有風險、不確定性,以及許多可能導致實際結果與任何前瞻性陳述中所描述的內容產生重大差異的因素。其它包含有"預期"、"相信"、"期待"、"計劃"等措辭和類似表達也屬于前瞻性描述。更多有關這些內容及其他風險、不確定性因素的信息,已包含在公司向美國證券交易委員會提交的備案文件中。本新聞稿中提供的所有信息不應被視為本公告發布之日后任何時點的觀點。泛生子預計未來的事件和進展會導致公司的設想和假設發生變化,但無論是否出現了新的信息、未來事件或其它情況,除適用法律要求外,公司不承擔更新任何前瞻性描述的義務。
]]>Seq-MRD®以新一代高通量測序(NGS)平臺為基礎,通過特異性檢測B淋巴細胞白血病(B-ALL/CLL)和多發性骨髓瘤(MM)患者治療前/后骨髓樣本中B細胞受體(BCR)IgH/K/L基因的CDR3區域序列,篩選出患者體內腫瘤細胞顯著而特異性的克隆重排形式,可在治療后對這些腫瘤細胞進行跟蹤,即進行微小殘留病的檢測,從而為癌癥幸存者后續治療方案提供參考。
通過泛生子“一步法”專利技術(中國發明專利ZL 201710218529.4)的優化,Seq-MRD®文庫構建過程可在一次PCR(聚合酶鏈反應)中完成,并將樣本污染和假陽性結果的風險極大降低。簡單的操作流程結合泛生子自動化生物信息學分析的解決方案,使Seq-MRD®具有高通量、快速便捷、穩定準確、高效經濟等核心優勢,應用前景廣闊。近期完成的性能實驗從靈敏度、準確性、特異度和精密度等多方面對產品性能進行了全面的確認,其中128例臨床確診樣本的對比研究顯示,Seq-MRD®與傳統流式細胞術(FCM)陽性檢出具有高度一致性。更重要的是,有10例樣本FCM檢測為陰性,而Seq-MRD®能檢出陽性,證明Seq-MRD®具有更高的靈敏度。
2021年10月,泛生子與江蘇復星醫藥簽訂Seq-MRD®獨家商業化合作協議,在中國指定地區的血液病重點醫院,通過復星醫藥規模龐大、經驗豐富的血液腫瘤專業營銷團隊,共同銷售和聯合推廣Seq-MRD®,滿足淋系血液腫瘤患者的臨床檢測需求。
除Seq-MRD®外,泛生子也在積極推動多個IVD產品在國內、國際市場的臨床認證與業務布局,目前已有人IDH1基因突變檢測試劑盒(PCR-熒光探針法)(國械注準20173401602)、人TERT基因啟動子突變檢測試劑盒(PCR-熒光探針法)(國械注準20173401600)、人類8基因突變聯合檢測試劑盒(半導體測序法)(國械注準20203400072)、人825基因突變檢測試劑盒(聯合探針錨定聚合測序法)等產品相繼獲得歐盟CE資質,未來泛生子將緊貼分子檢測臨床需求,加速推動產品的市場轉化,為廣大患者提供更精準、更可及的醫療服務。
]]>這些研究包括在肺癌、胃癌、結腸癌、膀胱癌、膠質瘤、肉瘤等多癌種基因突變和融合圖譜特征,遺傳易感基因和免疫治療分子標志物篩選,分子檢測指導臨床分型、診斷和治療等領域的探索。這些研究同時也是泛生子攜手20余家國內頂級醫院,結合臨床數據,圍繞中國人群深入分析的集中呈現。
泛生子首席醫療官胡云富博士表示:“此次亮相AACR2022的研究成果,基于泛生子創新技術及產品,探索了多癌種基因組學的特征及產品臨床應用。如通過泛生子DNA和RNA同檢的肉瘤全體系基因檢測產品,研究了兒童肉瘤和成人肉瘤在基因變異上的差異,同時揭示肉瘤中的遺傳變異和HRR基因變異,為肉瘤患者PARP抑制劑等的潛在使用提供了證據;通過泌尿Onco UrineTM產品發現在MIBC(肌層浸潤性膀胱癌)免疫新輔助治療的患者中,尿液無創基因檢測具有評估患者病理緩解潛力;通過Onco PanScanTM的產品研究了與免疫治療相關的POLE/POLD1,MMR,MSI,TMB 等相關指標,并發現ACVR2ALOF在胃癌和腸癌中與MSI的變異相關等。未來泛生子的產品與技術將不斷助力推動癌癥患者的早期診斷和臨床診療。”
本次泛生子在AACR2022發布的17項研究成果,主要涉及以下四個領域:
基因突變及融合圖譜研究助力臨床分型、個性化治療
五項研究(#5756、#5755、#5746、#5575、#5771)基于回顧性二代基因測序結果,分別對成人和兒童肉瘤基因組、肉瘤HRR基因、膠質瘤融合,實體瘤BRAF和RAF1融合以及肺癌RTK型融合進行基因突變和融合圖譜繪制,探尋與癌癥相關分子特征,對腫瘤分型、個性化治療進行判斷和指導。
分子檢測指導臨床診斷、治療
- 膠質母細胞瘤(GBM)是最常見的惡性腦腫瘤,GBM患者的預后很差,復發風險很高。研究#5264報告了一例罕見的GBM患者,在手術切除后兩年復發,根據組織病理學特征被診斷為低級別星形細胞瘤。然而,其分子特征顯示,該復發腫瘤應被診斷為高級別GBM,從而表明將組織病理學特征與分子特征結合診斷的臨床重要性。
- 根治性膀胱切除術(RC)是肌層浸潤性膀胱癌(MIBC)的標準治療方法,但即使尿路改道,也會極大影響患者的生活質量。研究#5101報告了一例接受RC治療的MIBC患者在免疫新輔助治療期間進行尿液動態監測的案例,表明尿液的動態監測可反映病理完全緩解,這將有助于幫助臨床選擇患者進行膀胱保全治療以及個性化護理。
- HER2抗體曲妥珠單抗聯合化療是HER2陽性乳腺癌/胃癌患者的一線治療方案,最近這一方案在HER2陽性的膽囊癌(GBC)患者中也顯示了抗腫瘤活性。然而,目前尚無有效手段應對HER2陽性GBC對HER2靶向治療的耐藥問題。研究#5517報告了一例HER2陽性轉移性GBC患者,對曲妥珠單抗聯合化療難治,但在加用PD-1抗體卡瑞利珠單抗后有明顯的臨床獲益,表明了免疫治療與HER2靶向治療相結合對HER2陽性GBC患者的治療意義。
遺傳易感基因研究指導腫瘤早篩早診
四項研究(#5840、#5875、#5777、#5778)探索膠質瘤、肉瘤和胃癌中致病胚系突變,包括HRR和MMR核心基因和其他關鍵的遺傳易感基因,對于疾病早期診斷、遺傳咨詢和治療具有重要指導意義。
免疫治療分子標志物篩選加碼免疫治療人群篩選
五項研究(#5292、#5774、#5751、#5197、#5752)探討了BRAF、POLE/POLD1、clock基因,以及ACVR2ALOF與MMR、TMB等的相關性,可作為潛在的免疫治療生物標志物。
編號 |
題目 |
5264 |
Glioblastoma degraded to low-grade astrocytoma two-years after surgical resection: A rare case report |
5292 |
Investigating the potential relationship between BRAF mutations and tumor mutation burden (TMB) in lung cancer (LC) |
5774 |
Investigating the characteristics of BRAF mutations and its potential relationship with therapy in a large Chinese lung cancer cohort |
5746 |
Analysis of molecular characteristics of gliomas harboring gene fusions |
5751 |
Comprehensive analysis of POLE/POLD1 variants, MMR deficient/MSI, and tumor mutational burden in Chinese population |
5752 |
Loss-of-function mutations in ACVR2A are correlated with microsatellite instability in gastric and colorectal cancer |
5755 |
Mutation profiling of homologous recombination-related (HRR) genes in Chinese sarcoma patients |
5840 |
The characteristics of TP53 germline mutations analyzed in a large-scale cohort of Chinese glioma patients |
5756 |
Next-Generation Sequencing (NGS) reveals differences in molecular profiles of pediatric sarcoma in children and adults |
5575 |
Landscape of BRAF and RAF1 fusions identified by next–generation sequencing in a Chinese multi-cancer retrospective analysis |
5875 |
Germline gene alterations in high grade and low grade gliomas: A multi-center, large scale study in China |
5517 |
Addition of PD-1 antibody camrelizumab overcame resistance to trastuzumab plus chemotherapy in a HER2-positive, metastatic gallbladder cancer patient |
5778 |
Early-onset of double germline mutations in homologous recombination deficiency (HRD)-mutated gastric cancer |
5777 |
Germline variants of cancer predisposition genes in a large cohort of Chinese sarcoma patients |
5101 |
Urine based dynamically monitoring reflect pathologic response in MIBC patients with neoadjuvant immunotherapy |
5771 |
The refined stratification of receptor tyrosine kinase fusions in lung cancer |
5197 |
Alterations of the circadian clock genes and their association with tumor mutation burden and response to immunotherapy in NSCLC |
關于泛生子
泛生子(納斯達克代碼:GTH)是全球前沿的癌癥精準醫療公司,專注于癌癥基因組學研究和應用,并致力依托先進的分子生物學及大數據分析能力改變癌癥診療方式。泛生子已打造了全面的產品及服務管線,覆蓋從癌癥早篩到診斷及治療建議,再到監測及預后管理的癌癥全周期,并與產業鏈上下游合作伙伴積極拓展分子檢測技術的更多創新應用方向和場景。更多公司信息請訪問:https://www.genetronhealth.com。
安全港聲明
本新聞稿包含泛生子對未來的預期、計劃和前瞻性陳述,具有相應風險及不確定性,可能導致實際結果與前瞻性陳述中描述的預期不符。此類陳述是根據1995年美國私有證券訴訟改革法案的“安全港”條款作出的。前瞻性陳述涉及固有風險、不確定性,以及許多可能導致實際結果與任何前瞻性陳述中所描述的內容產生重大差異的因素。其它包含有“預期”“相信”“期待”“計劃”等措辭和類似表達也屬于前瞻性描述。更多有關這些內容及其他風險、不確定性因素的信息,已包含在公司向美國證券交易委員會提交的備案文件中。本新聞稿中提供的所有信息不應被視為本公告發布之日后任何時點的觀點。泛生子預計未來的事件和進展會導致公司的設想和假設發生變化,但無論是否出現了新的信息、未來事件或其它情況,除適用法律要求外,公司不承擔更新任何前瞻性描述的義務。
]]>根據協議,雙方計劃基于泛生子已經獲批的肺癌8基因試劑盒進行沃瑞沙®的伴隨診斷驗證及注冊。肺癌8基因試劑盒基于泛生子“一步法”專利技術開發,于2020年獲中國國家藥品監督管理局(以下簡稱“國家藥監局”)批準上市。該試劑盒是國內首款獲批基于RNA水平檢測MET外顯子14跳躍變異的NGS產品,適應癥為非小細胞肺癌(NSCLC)。肺癌8基因試劑盒目前已在國內醫院展開應用,并于2021年獲得歐盟CE資質。
沃瑞沙®是一種強效、高選擇性的口服MET酪氨酸激酶抑制劑,在晚期實體瘤中表現出臨床活性,可阻斷基因突變(例如MET外顯子14跳躍突變)或基因擴增而導致的MET受體酪氨酸激酶信號通路的異常激活。2021年6月,國家藥監局宣布已通過優先審評審批程序附條件批準沃瑞沙®上市。
據了解,中國肺癌患者人數超過全世界肺癌患者總數的三分之一,而MET外顯子14跳躍突變作為MET基因的一種靶向突變,在NSCLC中的發生率約為2%-3%[1-3]。這種突變在肺肉瘤樣癌中較為常見(13%-22%),肺肉瘤樣癌是一種罕見的侵襲性NSCLC亞型,對傳統化療不敏感[4-5]。
和黃醫藥執行董事兼首席科學官蘇慰國博士表示:“很高興能與中國領先的癌癥精準醫療企業泛生子合作。在沃瑞沙®臨床應用過程中,伴隨診斷測試對MET外顯子14跳躍突變的NSCLC患者來說至關重要。我們期待與泛生子共同開發相應的伴隨診斷方案,盡可能讓用藥患者從創新治療方案中獲益。”
泛生子聯合創始人及首席執行官王思振表示:“沃瑞沙®為中國NSCLC患者提供了重要的治療路徑,作為和黃醫藥的合作伙伴,很高興我們的肺癌8基因試劑盒(組織版)能夠成為沃瑞沙®首個基于RNA層面的NGS伴隨診斷產品。這是泛生子在伴隨診斷服務領域的又一次重要合作,此舉將有助于推動肺癌8基因試劑盒在國內重點醫院的臨床應用。隨著精準醫療、靶向治療在國內的關注度日益提升,伴隨診斷領域也在不斷發展、跟進,前景可期。未來伴隨診斷服務仍將是泛生子的業務重點,我們將繼續探索實踐推進創新產品的應用,惠及更多患者。”
參考資料
[1] Vuong HG, et al. Clinicopathological implications of MET exon 14 mutations in non-small cell lung cancer – A systematic review and meta-analysis. Lung Cancer 2018; 123: 76-82. doi: 10.1016/j.lungcan.2018.07.006.
[2] World Health Organization. International Agency for Research on Cancer. Lung Fact Sheet. Available at https://gco.iarc.fr/today/data/factsheets/cancers/15-Lung-fact-sheet.pdf. Accessed June 2021.
[3] World Health Organization. International Agency for Research on Cancer. Globocan China Fact Sheet 2020. Available at http://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf. Accessed June 2021.
[4] Liu X, et al. Next-generation sequencing of pulmonary sarcomatoid carcinoma reveals high frequency of actionable MET gene mutations. J Clin Oncol 2016; 34: 794-802. doi: 10.1200/JCO.2015.62.0674.
[5] Lu S, et al. Once-daily savolitinib in Chinese patients with pulmonary sarcomatoid carcinomas and other non-small-cell lung cancers harbouring MET exon 14 skipping alterations: a multicentre, single-arm, open-label, phase 2 study. Lancet Respir Med. 2021 Jun 21:S2213-2600(21)00084-9. doi: 10.1016/S2213-2600(21)00084-9.
關于沃瑞沙®(賽沃替尼)
沃瑞沙®是一種強效、高選擇性的口服MET酪氨酸激酶抑制劑,在晚期實體瘤中表現出臨床活性。沃瑞沙®可阻斷因突變(例如MET外顯子14跳躍突變)或基因擴增而導致的MET受體酪氨酸激酶信號通路的異常激活。
沃瑞沙®在中國獲附條件批準上市用于治療接受全身性治療后疾病進展或無法接受化療的MET外顯子14跳躍突變的NSCLC患者。2011年,和黃醫藥與阿斯利康達成一項全球許可協議,共同開發賽沃替尼并促進其商業化。和黃醫藥負責賽沃替尼在中國的上市許可、生產和供應,而阿斯利康則負責實現賽沃替尼在中國乃至全球范圍內的商業化。目前,沃瑞沙®正作為單藥療法或與其他藥物的聯合療法,開發用于治療包括肺癌、腎癌和胃癌在內的多種腫瘤類型。
關于肺癌8基因試劑盒及“一步法”專利技術
泛生子人類8基因突變聯合檢測試劑盒(半導體測序法)(國械注準20203400072,簡稱“肺癌8基因試劑盒”)搭載了泛生子專利技術“一步法快速構建擴增子文庫的方法”(中國發明專利 ZL201710218529.4,簡稱“一步法”專利技術),曾應用于泛生子與四川大學華西醫院深度合作的“肺癌早期精準診斷關鍵技術的建立與臨床應用”項目,并獲得國家科技進步二等獎。肺癌8基因試劑盒可一次性檢測與NSCLC患者靶向治療密切相關的8個基因突變和融合(包括EGFR、BRAF、KRAS、HER2和PIK3CA的突變,ALK和ROS1的易位,以及MET外顯子14的跳躍突變,其中7個基因是2018年NCCN指南推薦給NSCLC患者的生物標記物),為患者提供用藥指導、分子分型、預后評估等一系列服務。目前,已獲批用于吉非替尼(Gefitinib)、埃克替尼(Icotinib)、奧希替尼(Osimertinib)、克唑替尼(Crizotinib )等NSCLC靶向藥物的伴隨診斷。
“一步法”專利技術只需一個反應步驟即可完成建庫過程,從而減少手工操作環節,有效降低建庫流程中的污染風險。肺癌8基因試劑盒具有快速、便捷等優勢,搭載泛生子基因測序儀GENETRON S5(國械注準20193220820)和全自動加樣系統GENETRON Chef(渝械注準20192220364)使用,兩天即可出具報告,適合醫院獨立開展檢測。
關于和黃醫藥
和黃醫藥(納斯達克/倫敦證交所:HCM;香港交易所:13)是一家處于商業化階段的創新型生物醫藥公司,致力于發現、全球開發和商業化治療癌癥和免疫性疾病的靶向藥物和免疫療法。集團旗下公司共有超過4,600名員工,其中核心的腫瘤/免疫業務擁有約1,500人的團隊。自成立以來,和黃醫藥已將自主發現的12個候選癌癥藥物推進到在全球開展臨床研究,其中首三個創新腫瘤藥物現已獲批上市。欲了解更多詳情,請訪問:www.hutch-med.com 或關注企業領英專頁。
關于泛生子
泛生子(納斯達克代碼:GTH)是全球前沿的癌癥精準醫療公司,專注于癌癥基因組學研究和應用,并致力依托先進的分子生物學及大數據分析能力改變癌癥診療方式。泛生子已打造了豐富的產品及服務管線,覆蓋從癌癥早篩到診斷及治療建議,再到監測及預后管理的癌癥全周期,并與產業鏈上下游合作伙伴積極拓展分子檢測技術的更多創新應用方向和場景。更多公司信息請訪問:https://www.genetronhealth.com。
安全港聲明
本新聞稿包含泛生子對未來的預期、計劃和前瞻性陳述,具有相應風險及不確定性,可能導致實際結果與前瞻性陳述中描述的預期不符。此類陳述是根據1995年美國私有證券訴訟改革法案的“安全港”條款作出的。前瞻性陳述涉及固有風險、不確定性,以及許多可能導致實際結果與任何前瞻性陳述中所描述的內容產生重大差異的因素。比如我們對肺癌8基因試劑盒進一步應用于中國重點醫院的預期,以及其它包含有“預期”“相信”“期待”“計劃”等措辭和類似表達也屬于前瞻性描述。更多有關這些內容及其他風險、不確定性因素的信息,已包含在公司向美國證券交易委員會提交的備案文件中。本新聞稿中提供的所有信息不應被視為本公告發布之日后任何時點的觀點。泛生子預計未來的事件和進展會導致公司的設想和假設發生變化,但無論是否出現了新的信息、未來事件或其它情況,除適用法律要求外,公司不承擔更新任何前瞻性描述的義務。
]]>
中國初級衛生保健基金會常務副秘書長陳易新、山東省腫瘤醫院于金明院士、中國醫學科學院腫瘤醫院王潔教授、清華大學臨床醫學院支修益教授、北京醫院劉東戈教授、中山大學腫瘤醫院張力教授、上海市腫瘤醫院韓寶惠教授、泛生子聯合創始人及首席執行官王思振,以及阿斯利康中國副總裁朱家康等嘉賓通過線上和線下的方式參加啟動會。中國初級衛生保健基金會計劃項目部常務副主任王翰之、泛生子戰略發展高級總監董蕾代表雙方簽署了捐贈協議。
作為項目唯一的企業捐贈方,泛生子將為國內肺癌患者免費提供10000例人類8基因突變聯合檢測試劑盒(半導體測序法)(國械注準20203400072,以下簡稱“肺癌8基因試劑盒”)及相應的基因檢測服務,該檢測也將成為定制患者后續治療方案的重要參考。
中國初級衛生保健基金會常務副秘書長陳易新表示:“肺愛新生基因檢測公益項目針對EGFR陰性的非小細胞肺癌患者提供10000例免費檢測,希望通過初保基金會和檢測機構的力量,使更多人群享受到基因檢測的便利,促進肺癌診療的規范化,未來使更多患者獲益,推動精準診療的發展。同時,也希望未來能有更多像泛生子一樣熱心公益、致力于提升精準醫療可及性的企業,加入到我們的公益項目中來,為基層更廣泛人群帶來切實、有效的醫療診斷檢測與治療服務。”
非小細胞肺癌(Non-small cell lung carcinom, 以下簡稱“NSCLC”)占所有肺癌的80%左右[1],其中最常見的驅動基因變異是 EGFR突變,而罕見驅動基因變異的識別,對肺癌的診療也至關重要。為此,本項目依托泛生子提供的10000例肺癌8基因試劑盒及檢測服務,將為EGFR突變陰性的肺癌患者提供更多靶向治療機會,具有顯著的臨床意義和社會意義。
山東省腫瘤醫院于金明院士表示,“肺愛新生”公益項目旨在通過NGS多基因檢測為EGFR突變陰性的患者提供更多靶向治療機會。肺癌規范診療的第一步在于精準診斷,應將NGS多基因監測這種規范化檢查切實運用到肺癌患者日常檢查中,最終達到延長患者生存時間的目的。
北京醫院劉東戈教授同樣指出,NCCN指南和CSCO指南推薦對非小細胞肺癌的驅動基因進行檢測,這些基因的改變包括突變、融合等多種變異形式。大量研究證實,對于融合基因來說,NGS檢測技術優勢明顯,其中RNA相關的NGS檢測方法對融合基因的檢測更準確。
隨著醫學的進步,肺癌的治療從傳統病理分型指導的放化療模式,逐漸轉變為分子分型指導的靶向治療模式。為了貫徹落實“健康中國2030”計劃精神,輔助臨床醫生對肺癌診療方案的制定,實現診療規范化,最新版《新型抗腫瘤藥物臨床應用指導原則(2020版)》提出,抗腫瘤藥物的使用不僅要依據病理診斷的結果,更要遵循基因檢測后才可使用肺癌靶向藥物治療的原則,即靶向治療,檢測先行。
中國醫學科學院腫瘤醫院王潔教授在致辭中表示,肺癌精準診療離不開檢測技術的發展以及在臨床的廣泛應用,如何應用檢測技術惠及臨床對于精準診療至關重要。經NMPA批準的伴隨診斷產品,與相應藥物聯合使用的臨床有效性及安全性已經充分驗證,檢測結果對臨床有明確的指導意義。
中山大學腫瘤醫院張力教授認為,依據驅動基因進行靶向治療已經成為非小細胞肺癌治療的標準配置。近年來,針對罕見突變的靶向治療發展勢頭非常迅猛。因此,基因檢測是非常重要的一種診斷的手段,只有發現更多的罕見突變患者,找到合適的靶向治療,才能真正做到讓患者獲益。
上海市腫瘤醫院韓寶惠教授同樣認為,精準治療的前提是精確診斷,對于晚期肺癌患者來說,個體化的診斷與個體化的治療起到至關重要的作用。在“肺愛新生”公益項目的推進過程中,通過基因檢測得到精確診斷,從而發現少見、罕見和耐藥的基因,在保障患者取得更好治療效果的同時,也將對今后的治療策略提供有效的醫學證據。
阿斯利康中國副總裁朱家康在活動中表示:“沒有檢測就沒有治療,阿斯利康也會攜手中國初級衛生保健基金會開展更多慈善援助項目,助力肺癌患者的規范化診療。”
搭載了泛生子專利技術“一步法快速構建擴增子文庫的方法”(中國發明專利 ZL201710218529.4,以下簡稱“一步法”)的肺癌8基因試劑盒,應用于泛生子與四川大學華西醫院深度合作的“肺癌早期精準診斷關鍵技術的建立與臨床應用”項目,并獲得國家科技進步二等獎。該試劑盒可一次性檢測與NSCLC患者靶向治療密切相關的8個基因突變和融合,為患者提供用藥指導、分子分型、預后評估等一系列服務。“一步法”技術的使用,將建庫時間從傳統的1-2天縮短到僅1.5小時,收到樣本后最快2天即可出具檢測報告。其中,人工操作僅5分鐘,可避免多次開蓋操作,避免潛在污染的發生,大大降低臨床使用的技術門檻。
清華大學臨床醫學院支修益教授在活動中講到,隨著科技發展以及對肺癌基因研究的深入,從基因層面對腫瘤患者進行了細分用藥,將大大提高靶向治療的有效率。本次“肺愛新生”項目為10000例罕見靶點肺癌患者提供免費基因檢測,利用“一步法”專利技術為廣大的肺癌患者提供了周期更短的分子病理診斷,并聯合阿斯利康提供用藥服務的一體化診療,造福了更多的患者。
泛生子聯合創始人及首席執行官王思振表示:“泛生子秉承‘抵抗癌癥,守護生命’的使命,致力于從產品服務、技術研發和觀念普及三個方面提升癌癥精準醫療的可及性。希望未來能與更多像中國初級衛生保健基金會、阿斯利康這樣的合作伙伴攜手,為中國癌癥患者提供更多可及的服務,讓更多的癌癥患者從基因檢測、用藥服務的一體化診療模式中獲益。同時,在推動服務可及的社會項目中充分實踐,以滿足中國各層級患者多樣化的臨床診療需求,為患者帶來切實的改變,為建設健康中國提供技術支撐。
參考資料:
[1]. Lung Cancer - Non-Small Cell: Statistics:https://www.cancer.net/cancer-types/lung-cancer-non-small-cell/statistics
關于中國初級衛生保健基金會
中國初級衛生保健基金會成立于1996年12月30日,是由中國農工民主黨中央委員會主辦、中華人民共和國國家衛生健康委員會主管、中華人民共和國民政部登記注冊的具有公募資格的4A級基金會。其宗旨是支持中國農村和城鎮貧困社區醫療、衛生、保健事業的發展;促進改善醫療衛生條件;幫助中國農村和城鎮貧困社區人口提高健康水平,增強健康素質和發展能力,實現脫貧致富和持續發展。
基金會始終以“呼吁和動員社會各界共同關心中國醫療衛生保健事業發展,為構建適應和符合社會發展水平、滿足人人能夠享有、社會能夠負擔得起的最基本的衛生保健服務,爭取道義、資金和物質支持,保障與提高人民健康水平”為目標和己任,充分發揮基金會社會公益平臺組織優勢,廣泛動員與匯集社會慈善資源力量投入到初級衛生保健事業。
關于泛生子
泛生子(納斯達克代碼:GTH)是全球前沿的癌癥精準醫療公司,專注于癌癥基因組學研究和應用,并致力依托先進的分子生物學及大數據分析能力改變癌癥診療方式。泛生子已打造了全面的產品及服務管線,覆蓋從癌癥早篩到診斷及治療建議,再到監測及預后管理的癌癥全周期,并與產業鏈上下游合作伙伴積極拓展分子檢測技術的更多創新應用方向和場景。更多公司信息請訪問:https://www.genetronhealth.com。
安全港聲明
本新聞稿包含泛生子對未來的預期、計劃和前瞻性陳述,具有相應風險及不確定性,可能導致實際結果與前瞻性陳述中描述的預期不符。此類陳述是根據1995年美國私有證券訴訟改革法案的“安全港”條款作出的。前瞻性陳述涉及固有風險、不確定性,以及許多可能導致實際結果與任何前瞻性陳述中所描述的內容產生重大差異的因素。其它包含有“預期”、“相信”、“期待”、“計劃”等措辭和類似表達也屬于前瞻性描述。更多有關這些內容及其他風險、不確定性因素的信息,已包含在公司向美國證券交易委員會提交的備案文件中。本新聞稿中提供的所有信息不應被視為本公告發布之日后任何時點的觀點。泛生子預計未來的事件和進展會導致公司的設想和假設發生變化,但無論是否出現了新的信息、未來事件或其它情況,除適用法律要求外,公司不承擔更新任何前瞻性描述的義務。
2021年第三季度及近期運營亮點:
- 財務:
- 2021年第三季度總營收152.5百萬元人民幣(23.7百萬美元),較2020年同期同比增長36.2%。
- 期內LDT業務營收同比增長30.2%,達93.0百萬元人民幣(14.4百萬美元)。
- 期內IVD業務營收同比增長70.5%,達51.3百萬元人民幣(8.0百萬美元)。
- 得益于LDT與IVD業務優化升級,2021年第三季度毛利率較去年同期的62.2%提高至69.0%。
- 早篩產品最新進展:
- 泛生子已拓展其肝癌(HCC)早篩管線的注冊策略。公司于11月開始為基于PCR平臺的試劑盒臨床試驗招募患者,并計劃在數月之后為基于NGS平臺的試劑盒臨床試驗招募患者。泛生子預計這兩項試驗有望將在2023年獲得NMPA批準。
- 泛生子開發了一款基于液體活檢多組學技術的結直腸癌早篩試劑盒,在回顧性隊列(100例病例和100例對照)研究中進行模型訓練,并在另一組同規模的獨立隊列中進行驗證,實現特異度為95%時靈敏度高于91%。詳細的研究結果計劃將于2022年在期刊中發表。
- MRD產品的最新進展:
- 與阿斯利康全球研發中國中心簽訂獨家合作協議,共同開發針對中國實體瘤患者的個性化MRD檢測。阿斯利康全球研發中國中心計劃將共同開發的產品用于其在中國開展的臨床試驗。
- 與復星醫藥就泛生子Seq-MRD®檢測服務簽訂中國地區獨家商業化合作協議。這次合作標志著泛生子在血液腫瘤及MRD檢測領域的首個產品在國內市場落地。
- 期刊雜志收錄發表情況:
- 早篩:泛生子的肝癌(HCC)早篩產品HCCscreenTM的臨床試驗結果與技術研究成果被列入專家共識并且于2021年10月發表在《中華肝臟病雜志》,該雜志在中國肝臟病醫學界具有顯著影響力。
- MRD:基于Mutation Capsule技術開發的個性化MRD檢測的分析結果于《血液與腫瘤學雜志》(影響因子:17.4)發表。在以胃癌患者中的腹腔灌洗液為樣本的檢測中,檢測腫瘤DNA的靈敏度可達到0.001%,表明該檢測可精準預測腹膜擴散。
- 生物信息學:泛生子生物信息團隊開發的增強型變異識別性能的數據于《生物信息學簡報》(影響因子:11.6) 公布。
- 其它:
- 與NeoGenomics(納斯達克:NEO,簡稱 “新極昊”)建立戰略合作伙伴關系,共同驅動全球腫瘤藥物的研發;與英派藥業建立戰略合作伙伴關系,共同推動合成致死產品管線的開發。
- 覆蓋超過800個基因的大panel產品Onco PanScanTM獲歐盟CE資質。
泛生子聯合創始人兼CEO王思振先生表示:“盡管受到新冠肺炎疫情的影響,在2021年第三季度,泛生子的營收較去年仍有36.2%的強勁增長,院內IVD業務收入增長超過70%,毛利率也有穩步提升。在運營方面,我們取得了多項進展,其中包括:啟動泛生子首個HCC早篩產品注冊性臨床試驗、MRD領域簽訂了重大的戰略合作協議,同時我們的研究成果被多個權威性期刊收錄。由于中國針對新冠疫情采取的‘清零’政策,我們在第四季度面臨較為嚴峻的外部運營環境。盡管短期內面臨挑戰,我們持續專注于推動精準腫瘤診斷多個應用領域的臨床差異化管線發展。公司持續專注于實踐我們的策略,我們對企業長期發展的展望保持不變。公司的關鍵項目預計將在未來數月取得進展并獲得數據。此外,由于中國政府致力于為老百姓提供更好的醫療選擇,一系列的利好政策使得宏觀環境持續利于泛生子的發展。”
2021年第三季度未經審計的初步財務業績
2021年第三季度的總營收達到152.5百萬元人民幣(23.7百萬美元),同比增長36.2%,2020年同期為112.0百萬元人民幣。
2021年第三季度診斷和監測業務收入為144.3百萬元人民幣(22.4百萬美元),同比增長42.2%,2020年同期收入為101.5百萬元人民幣,這主要得益于LDT與IVD產品銷售收入的增長。
- 2021年第三季度,LDT服務收入達93.0百萬元人民幣(14.4百萬美元),同比增長30.2%,2020年同期收入71.4百萬元人民幣,主要由于肝癌早篩檢測銷量的增長。2021年第三季度售出約5,900例LDT診斷檢測。
- 2021年第三季度,由于基因測序儀與試劑盒銷售額的增長,IVD產品銷售收入達到51.3百萬元人民幣(8.0百萬美元), 較2020年同期的30.1百萬元人民幣增長70.5%。
已簽署公對公合同的醫院客戶數 |
|||||
(截止各個報告期末) |
|||||
2020年 |
2020年第 |
2021年第 |
2021年 |
2021年第 |
|
IVD產品入院醫院客戶數 |
20 |
22 |
23 |
28 |
29 |
2020年 |
2020年第 |
2021年第 |
2021年 |
2021年第 |
|
簽署公對公合同的醫院客戶數(1) |
38 |
40 |
42 |
50 |
54 |
注:(1)直接簽署公對公合同的醫院客戶數包含了LDT檢測服務和IVD產品入院醫院客戶數。 |
|||||
2021年第三季度,開發服務收入為8.2百萬元人民幣(1.3百萬美元),較2020年同期的10.4百萬元人民幣下降21.4%,主要因為公司繼續以毛利率更高的藥企服務為重點,而測序服務收入有所下降。2021年第三季度,藥企服務收入較2020年同期有所增長。
2021年第三季度的毛利潤為105.2百萬元人民幣(16.3百萬美元),2020年同期為69.6百萬元人民幣,同比增長51.1%。同時得益于公司LDT和IVD業務毛利率提升,帶動公司第三季度整體毛利率提升至69.0%,2020年同期為62.2%。
2021年第三季度的銷售費用為94.6百萬元人民幣(14.7百萬美元),較2020年同期的60.6百萬元人民幣增長56.3%。2021年第三季度銷售費用占收入比為62.0%,高于2020年同期的54.1%,主要是因為公司為拓展核心業務市場與早篩產品銷售團隊而增招了員工。
2021年第三季度的管理費用為63.0百萬元人民幣(9.8百萬美元),較2020年同期的32.4百萬元人民幣增長94.1%。管理費用占收入比從2020年同期的29.0%增至2021年第三季度的41.3%。管理費用的增長主要來自員工人數、專業機構服務費以及IT等運營費用的增加。
2021年第三季度的研發費用為62.4百萬元人民幣(9.7百萬美元),較2020年同期的38.6百萬元人民幣增長61.7%。研發費用占收入比從2020年第三季度的34.4%增至2021年同期的40.9%,這主要源于研發人員增加導致的薪酬開支及相關費用增加,以及公司持續的研發創新投入,包含新產品開發、臨床試驗開展。
截至2021年9月30日的三個月的虧損為130.1百萬元人民幣(20.2百萬美元),高于2020年同期的48.0百萬元人民幣。
非國際財務報告準則下(Non-IFRS)的虧損指扣除股權激勵費用、公允價值變動損失以及優先股其它損失后的當期虧損。截至2021年9月30日的三個月的虧損為109.9百萬元人民幣(17.1百萬美元),去年同期為43.7百萬元人民幣。詳情請參閱本新聞稿中“對于非國際財務報告準則(Non-IFRS)財務指標的衡量”部分。
2021年第三季度,歸屬公司普通股股東基本每股虧損為0.28元人民幣(0.04美元),去年同期歸屬公司普通股股東基本每股虧損為0.11元人民幣。
2021年第三季度,扣除股權激勵費用、優先股公允價值變動損失以及優先股其他損失后,Non-IFRS歸屬公司普通股股東基本每股虧損為0.24元人民幣(0.04美元),2020年同期歸屬公司普通股股東基本每股虧損為0.10元人民幣。
攤薄歸屬公司普通股股東基本每股虧損等于歸屬公司普通股股東基本每股虧損。每股美國存托股代表五份普通股,票面價值為每股0.00002美元。詳情請參閱本新聞稿中“對于非國際財務報告準則(Non-IFRS)財務指標的衡量”部分。
截至2021年9月30日,以公允價值計量且其變動計入當期損益的公司現金和現金等價物、限制性現金、流動性金融資產總計價值1,005.3百萬元人民幣(156.0百萬美元)。
2021年財務指引
我們預計中國將繼續堅持“清零”的防疫政策,并且我們的主要市場受到更為嚴峻的限制措施,因此公司將2021年的全年收入指引調整為約530百萬元人民幣,較公司在2020年的全年收入約增長25%。
電話會議
財務業績討論電話會議和網絡直播將于美國東部時間2021年11月30日上午8:30(或北京時間2021年11月30日晚上21:30)召開。如需參加電話會議,請撥打:
美國: |
+1-332-208-9468 |
中國大陸: |
400-820-5286 |
中國香港: |
+852-3018-6771 |
國際: |
+65-6713-5590 |
會議ID: |
5848053 |
由于參會者量大,建議提前至少15分鐘撥打。
2021年12月7日前可收聽會議重播,請撥打:
美國: |
+1-855-452-5696 |
國際: |
+61-2-8199-0299 |
會議ID: |
5848053 |
在本公司網站投資者欄的“News and Events”界面可同步收看該電話會議的網絡直播。回放有效期為會后30天內。請訪問ir.genetronhealth.com獲取更多信息。
匯率信息
本公告中的財務報表或其他地方的金額均為本幣人民幣對美元的轉換,僅供讀者方便閱讀,并按照2021年9月30日美國聯邦儲備局H.10當日匯率,1美元=6.4434元人民幣換算。公司對本報告中人民幣金額在2021年9月30日已經或可能以該匯率,或任何其他匯率兌換、實現或結算成美元,不作任何陳述。
對于非國際財務報告準則(Non-IFRS)財務指標的衡量
泛生子使用Non-IFRS凈虧損和Non-IFRS的歸屬公司普通股股東基本每股凈虧損,用于評估本公司的經營成果,以及財務和經營決策。本公司認為,Non-IFRS凈虧損和Non-IFRS的歸屬公司普通股股東基本每股凈虧損有助于識別本公司業務的基本趨勢,而這些趨勢可能因本公司計入本年度/期間虧損的某些費用的影響而扭曲。本公司認為,Non-IFRS凈虧損和Non-IFRS的歸屬公司普通股股東基本每股凈虧損提供了有關其經營成果的有用信息,整體提升了對其過去業績和未來前景的全面了解,并使管理層在財務和運營決策中使用的關鍵指標更具可見性。
對于本年度/期間的Non-IFRS財務指標的衡量,泛生子使用的Non-IFRS凈虧損和Non-IFRS的歸屬公司普通股股東基本每股凈虧損不應單獨被考慮,也不應被視為該年度/期間營業利潤、凈虧損或任何其他業績衡量指標的替代品,或作為其經營業績的衡量指標。公司鼓勵投資者審閱該年度/期間的Non-IFRS凈虧損和Non-IFRS的歸屬公司普通股股東基本每股凈虧損,并審閱最直接可比的國際財務報告準則下財務指標的調整過程。此處所列年度/期間的Non-IFRS凈虧損和Non-IFRS的歸屬公司普通股股東基本每股凈虧損可能無法與其他公司提供的類似名稱的財務指標相比較。其他公司可能會以不同的方式計算類似的財務指標,從而限制了它們作為公司可比數據的有用性。泛生子鼓勵投資者和其他人全面審閱本公司的財務信息,而不是僅僅關注于單一的財務指標。
本年度/期間計算的凈利潤指標下Non-IFRS凈虧損和Non-IFRS的歸屬公司普通股股東基本每股凈虧損,不包括股權激勵費用、優先股公允價值變動損失以及優先股的其他損失(如適用)。
請參閱本公告結尾的 “未經審計非國際財務報告準則(NON-IFRS)財務指標的衡量”,獲取本年度/期間Non-IFRS凈虧損和Non-IFRS的歸屬公司普通股股東基本每股凈虧損的完整的調整過程。
關于泛生子
泛生子(納斯達克代碼:GTH)是全球前沿的癌癥精準醫療公司,專注于癌癥基因組學研究和應用,并致力依托先進的分子生物學及大數據分析能力改變癌癥診療方式。泛生子已打造了全面的產品及服務管線,覆蓋從癌癥早篩到診斷及治療建議,再到監測及預后管理的癌癥全周期,并與產業鏈上下游合作伙伴積極拓展分子檢測技術的更多創新應用方向和場景。更多公司信息請訪問:https://ir.genetronhealth.com。
安全港聲明
本新聞稿包含泛生子對未來的預期、計劃和前瞻性陳述。此類陳述是根據1995年美國私有證券訴訟改革法案的“安全港”條款作出的。前瞻性陳述涉及固有風險、不確定性,以及許多可能導致實際結果與任何前瞻性陳述中所描述的內容產生重大差異的因素。其它包含有“預期”、“相信”、“期待”、“計劃”等措辭和類似表達也屬于前瞻性描述。更多有關這些內容及其他風險、不確定性因素的信息,已包含在公司向美國證券交易委員會提交的備案文件中。本新聞稿中提供的所有信息不應被視為本公告發布之日后任何時點的觀點。泛生子預計未來的事件和進展會導致公司的設想和假設發生變化,但無論是否出現了新的信息、未來事件或其它情況,除適用法律要求外,公司不承擔更新任何前瞻性描述的義務。
GENETRON HOLDINGS LIMITED |
|||||||||||
UNAUDITED CONDENSED CONSOLIDATED STATEMENTS OF LOSS |
|||||||||||
For the three months ended |
For the nine months ended |
||||||||||
September |
September 30, 2021 |
September |
September 30, 2021 |
||||||||
RMB’000 |
RMB’000 |
US$’000 |
RMB’000 |
RMB’000 |
US$’000 |
||||||
Revenue |
111,963 |
152,541 |
23,674 |
290,541 |
385,087 |
59,765 |
|||||
Cost of revenue |
(42,331) |
(47,306) |
(7,342) |
(114,448) |
(130,839) |
(20,306) |
|||||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||||
Gross profit |
69,632 |
105,235 |
16,332 |
176,093 |
254,248 |
39,459 |
|||||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||||
Selling expenses |
(60,558) |
(94,625) |
(14,686) |
(175,000) |
(242,812) |
(37,684) |
|||||
Administrative expenses |
(32,440) |
(62,981) |
(9,774) |
(81,969) |
(162,161) |
(25,167) |
|||||
Research and |
(38,556) |
(62,364) |
(9,679) |
(96,030) |
(168,500) |
(26,151) |
|||||
Net impairment losses on |
(1,107) |
(10,437) |
(1,620) |
(2,097) |
(23,741) |
(3,684) |
|||||
Other income/(loss) - net |
3,819 |
334 |
52 |
(513) |
8,945 |
1,388 |
|||||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||||
Operating expenses |
(128,842) |
(230,073) |
(35,707) |
(355,609) |
(588,269) |
(91,298) |
|||||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||||
Operating loss |
(59,210) |
(124,838) |
(19,375) |
(179,516) |
(334,021) |
(51,839) |
|||||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||||
Finance income |
12,772 |
482 |
75 |
11,062 |
1,712 |
265 |
|||||
Finance costs |
(1,560) |
(5,791) |
(898) |
(3,997) |
(5,022) |
(779) |
|||||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||||
Finance income/(costs) - net |
11,212 |
(5,309) |
(823) |
7,065 |
(3,310) |
(514) |
|||||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||||
Fair value loss of financial |
- |
- |
- |
(2,823,370) |
- |
- |
|||||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||||
Loss before |
(47,998) |
(130,147) |
(20,198) |
(2,995,821) |
(337,331) |
(52,353) |
|||||
Income tax expense |
- |
- |
- |
- |
- |
- |
|||||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||||
Loss for the period |
(47,998) |
(130,147) |
(20,198) |
(2,995,821) |
(337,331) |
(52,353) |
|||||
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
||||||
Loss attributable to: |
|||||||||||
Owners of the Company |
(47,998) |
(128,974) |
(20,016) |
(2,995,821) |
(333,548) |
(51,766) |
|||||
Non-controlling interests |
- |
(1,173) |
(182) |
- |
(3,783) |
(587) |
|||||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||||
(47,998) |
(130,147) |
(20,198) |
(2,995,821) |
(337,331) |
(52,353) |
||||||
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
||||||
Loss per share attributable |
RMB |
RMB |
USD |
RMB |
RMB |
USD |
|||||
-Basic and diluted |
(0.11) |
(0.28) |
(0.04) |
(12.02) |
(0.73) |
(0.11) |
|||||
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
||||||
Loss per ADS attributable |
|||||||||||
-Basic and diluted |
(0.53) |
(1.40) |
(0.22) |
(60.10) |
(3.63) |
(0.56) |
|||||
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
||||||
Shares used in loss per |
|||||||||||
-Basic and diluted |
454,231,486 |
461,356,043 |
461,356,043 |
249,230,922 |
459,793,465 |
459,793,465 |
|||||
ADS used in loss per ADS attributable |
|||||||||||
-Basic and diluted |
90,846,297 |
92,271,209 |
92,271,209 |
49,846,184 |
91,958,693 |
91,958,693 |
|||||
GENETRON HOLDINGS LIMITED |
|||||||||
UNAUDITED NON-IFRS FINANCIAL MEASURE |
|||||||||
For the three months ended |
For the nine months ended |
||||||||
September |
September 30, 2021 |
September |
September 30, 2021 |
||||||
RMB’000 |
RMB’000 |
US$’000 |
RMB’000 |
RMB’000 |
US$’000 |
||||
Loss for the |
(47,998) |
(130,147) |
(20,198) |
(2,995,821) |
(337,331) |
(52,353) |
|||
Adjustments: |
|||||||||
Share-based |
4,268 |
20,246 |
3,141 |
19,222 |
42,000 |
6,518 |
|||
Fair value loss of |
- |
- |
- |
2,823,370 |
- |
- |
|||
─────── |
─────── |
─────── |
─────── |
─────── |
─────── |
||||
Non-IFRS Loss |
(43,730) |
(109,901) |
(17,057) |
(153,229) |
(295,331) |
(45,835) |
|||
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
||||
Attributable to: |
|||||||||
Owners of the |
(43,730) |
(108,728) |
(16,875) |
(153,229) |
(291,548) |
(45,248) |
|||
Non-controlling interests |
- |
(1,173) |
(182) |
- |
(3,783) |
(587) |
|||
─────── |
─────── |
─────── |
────── |
─────── |
─────── |
||||
(43,730) |
(109,901) |
(17,057) |
(153,229) |
(295,331) |
(45,835) |
||||
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
||||
Non-IFRS loss |
RMB |
RMB |
USD |
RMB |
RMB |
USD |
|||
-Basic and diluted |
(0.10) |
(0.24) |
(0.04) |
(0.61) |
(0.63) |
(0.10) |
|||
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
||||
Non-IFRS loss |
|||||||||
-Basic and diluted |
(0.48) |
(1.18) |
(0.18) |
(3.07) |
(3.17) |
(0.49) |
|||
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
═══════ |
||||
Shares used in |
|||||||||
-Basic and diluted |
454,231,486 |
461,356,043 |
461,356,043 |
249,230,922 |
459,793,465 |
459,793,465 |
|||
ADS used in non- |
|||||||||
-Basic and diluted |
90,846,297 |
92,271,209 |
92,271,209 |
49,846,184 |
91,958,693 |
91,958,693 |
|||
GENETRON HOLDINGS LIMITED |
|||||||
UNAUDITED REVENUE AND SEGMENT INFORMATION |
|||||||
Diagnosis and |
Diagnosis and |
Development |
Total |
||||
- provision of |
- sale of IVD |
||||||
RMB’000 |
RMB’000 |
RMB’000 |
RMB’000 |
||||
Three months ended September 30, 2020 |
|||||||
Revenue |
71,406 |
30,110 |
10,447 |
111,963 |
|||
Segment profit |
49,212 |
18,439 |
1,981 |
69,632 |
|||
Three months ended September 30, 2021 |
|||||||
Revenue |
92,993 |
51,338 |
8,210 |
152,541 |
|||
Segment profit |
65,022 |
39,159 |
1,054 |
105,235 |
|||
Nine months ended September 30, 2020 |
|||||||
Revenue |
194,754 |
67,468 |
28,319 |
290,541 |
|||
Segment profit |
130,961 |
43,827 |
1,305 |
176,093 |
|||
Nine months ended September 30, 2021 |
|||||||
Revenue |
251,959 |
110,431 |
22,697 |
385,087 |
|||
Segment profit |
175,723 |
75,693 |
2,832 |
254,248 |
|||
GENETRON HOLDINGS LIMITED |
||||
UNAUDITED CONDENSED CONSOLIDATED BALANCE SHEETS |
||||
As at December 31,2020 |
As at September 30,2021 |
|||
RMB’000 |
RMB’000 |
US$’000 |
||
ASSETS |
||||
Non-current assets |
||||
Property, plant and equipment |
76,891 |
85,441 |
13,260 |
|
Right-of-use assets |
59,706 |
50,938 |
7,905 |
|
Intangible assets |
12,265 |
15,104 |
2,344 |
|
Financial assets at fair value through profit |
19,609 |
37,005 |
5,743 |
|
Prepayments |
15,362 |
23,765 |
3,688 |
|
─────── |
─────── |
─────── |
||
Total non-current assets |
183,833 |
212,253 |
32,940 |
|
─────── |
─────── |
─────── |
||
Current assets |
||||
Inventories |
24,971 |
41,657 |
6,465 |
|
Contract assets |
1,112 |
2,217 |
344 |
|
Other current assets |
36,500 |
26,513 |
4,115 |
|
Trade receivables |
164,592 |
279,725 |
43,413 |
|
Other receivables and prepayments |
42,420 |
83,188 |
12,911 |
|
Amounts due from related parties |
214 |
453 |
70 |
|
Financial assets at fair value through profit or loss |
140,294 |
187,398 |
29,084 |
|
Derivative financial instruments |
196 |
673 |
104 |
|
Restricted cash |
- |
2,800 |
435 |
|
Cash and cash equivalents |
1,375,766 |
815,142 |
126,508 |
|
─────── |
─────── |
─────── |
||
Total current assets |
1,786,065 |
1,439,766 |
223,449 |
|
─────── |
─────── |
─────── |
||
Total assets |
1,969,898 |
1,652,019 |
256,389 |
|
═══════ |
═══════ |
═══════ |
||
GENETRON HOLDINGS LIMITED |
||||
UNAUDITED CONDENSED CONSOLIDATED BALANCE SHEETS (CONTINUED) |
||||
As at December 31,2020 |
As at September 30,2021 |
|||
RMB’000 |
RMB’000 |
US$’000 |
||
LIABILITIES |
||||
Non-current liabilities |
||||
Borrowings |
5,493 |
- |
- |
|
Lease liabilities |
43,016 |
32,694 |
5,074 |
|
Other non-current liabilities |
- |
8,354 |
1,297 |
|
──────── |
──────── |
──────── |
||
Total non-current liabilities |
48,509 |
41,048 |
6,371 |
|
──────── |
──────── |
──────── |
||
Current liabilities |
||||
Trade payables |
34,071 |
38,907 |
6,038 |
|
Contract liabilities |
8,417 |
12,640 |
1,962 |
|
Other payables and accruals |
111,164 |
119,399 |
18,530 |
|
Amounts due to related parties |
24 |
350 |
54 |
|
Borrowings |
58,583 |
27,595 |
4,283 |
|
Lease liabilities |
16,585 |
19,640 |
3,048 |
|
Derivative financial instruments |
- |
1,702 |
264 |
|
──────── |
──────── |
──────── |
||
Total current liabilities |
228,844 |
220,233 |
34,179 |
|
──────── |
──────── |
──────── |
||
Total liabilities |
277,353 |
261,281 |
40,550 |
|
──────── |
──────── |
──────── |
||
Net assets |
1,692,545 |
1,390,738 |
215,839 |
|
════════ |
════════ |
════════ |
||
SHAREHOLDERS’ EQUITY |
||||
Equity attributable to owners of the Company |
||||
Share capital |
59 |
60 |
9 |
|
Share premium |
6,657,562 |
6,702,347 |
1,040,188 |
|
Other reserves |
(24,701) |
(44,784) |
(6,950) |
|
Accumulated losses |
(4,940,375) |
(5,273,923) |
(818,500) |
|
──────── |
──────── |
──────── |
||
1,692,545 |
1,383,700 |
214,747 |
||
════════ |
════════ |
════════ |
||
Non-controlling interests |
- |
7,038 |
1,092 |
|
──────── |
──────── |
──────── |
||
Total shareholders’ equity |
1,692,545 |
1,390,738 |
215,839 |
|
════════ |
════════ |
════════ |
||
]]>
根據協議內容,雙方將共同投資合作進行實體腫瘤MRD研發,基于每位患者的原發腫瘤基因變異圖譜,聯合開發與驗證用于療效評估和腫瘤復發監測的個性化定制MRD檢測產品。同時,雙方還將成立聯合委員會以監督產品研發。
阿斯利康計劃將上述與泛生子合作開發的產品,應用于在中國開展、涉及個性化定制實體瘤MRD 檢測的臨床試驗。未來,雙方合作范圍將有望擴大至該產品的IVD注冊與全面的商業化落地。如進展順利,這將是雙方之間一項長期的獨家合作。
阿斯利康全球研發中國中心總裁何靜表示:“我們很高興能與泛生子一起,推進實體腫瘤MRD檢測產品研發及潛在的商業化落地合作,助力患者實現精準治療。希望雙方能夠各施所長,開發出創新、有效的MRD檢測產品,惠及國內更多癌癥患者。”
泛生子聯合創始人及首席執行官王思振表示:“很高興此次與全球領先的生物制藥公司阿斯利康合作。依托泛生子Mutation Capsule原研技術,我們擁有實體腫瘤MRD檢測相關的珍貴資料及數據,此次合作也進一步驗證了這些數據的價值。通過整合阿斯利康全球領先的腫瘤藥物研發經驗與行業洞見,以及泛生子專業的診斷平臺與實驗室檢測能力,期待雙方能夠合作開發出世界領先的MRD產品。此次簽約邁出了雙方長期合作的第一步,未來我們將持續致力于為癌癥患者開發更多的創新診斷產品與解決方案。”
關于泛生子實體腫瘤MRD項目及Mutation Capsule原研技術
泛生子的實體腫瘤MRD項目以泛生子的Mutation Capsule原研技術為技術支持。Mutation Capsule技術實現了液體活檢技術的突破,它具有兩個創新特點:一是可以在少量血液樣本里,同時捕獲并分析基因突變及甲基化變異信號,大幅提升了早篩產品的靈敏度;二是cfDNA(無細胞DNA)樣本的腫瘤相關基因突變及表觀遺傳學變化可以通過Mutation Capsule技術得以保存和擴增,在不影響靈敏度的情況下,一份少量樣本可以用于多達十次的檢測,從而大幅節省時間和成本。此外,Mutation Capsule還能夠支持對cfDNA進行低深度全基因組測序,并可進行甲基化位點篩選,具有臨床診斷價值。
關于泛生子
泛生子(納斯達克代碼:GTH)是全球前沿的癌癥精準醫療公司,專注于癌癥基因組學研究和應用,并致力依托先進的分子生物學及大數據分析能力改變癌癥診療方式。泛生子已打造了全面的產品及服務管線,覆蓋從癌癥早篩到診斷及治療建議,再到監測及預后管理的癌癥全周期,并與產業鏈上下游合作伙伴積極拓展分子檢測技術的更多創新應用方向和場景。更多公司信息請訪問:https://www.genetronhealth.com。
安全港聲明
本新聞稿包含泛生子對未來的預期、計劃和前瞻性陳述,具有相應風險及不確定性,可能導致實際結果與前瞻性陳述中描述的預期不符。此類陳述是根據1995年美國私有證券訴訟改革法案的“安全港”條款作出的。前瞻性陳述涉及固有風險、不確定性,以及許多可能導致實際結果與任何前瞻性陳述中所描述的內容產生重大差異的因素。其它包含有“預期”、“相信”、“期待”、“計劃”等措辭和類似表達也屬于前瞻性描述,包括關于公司與阿斯利康全球研發中國中心合作在中國開發實體腫瘤個性化定制MRD檢測的計劃、戰略和時間表的聲明。更多有關這些內容及其他風險、不確定性因素的信息,已包含在公司向美國證券交易委員會提交的備案文件中。本新聞稿中提供的所有信息不應被視為本公告發布之日后任何時點的觀點。泛生子預計未來的事件和進展會導致公司的設想和假設發生變化,但無論是否出現了新的信息、未來事件或其它情況,除適用法律要求外,公司不承擔更新任何前瞻性描述的義務。
]]>泛生子首席醫療官胡云富博士表示:“泛生子基于‘一步法’專利技術(中國發明專利ZL 201710218529.4)研發的Seq-MRD®和FusionScan Plus產品,突破傳統檢測方法的局限,前者為B淋系血液腫瘤患者及時檢測早期復發、提高臨床療效提供了有效途徑,后者通過對基因突變和基因融合的充分檢測,為臨床病理分型及靶向治療策略的制定提供有效參考。兩項研究結果的數據,進一步增強了我們對產品臨床應用的信心。目前泛生子正通過與江蘇復興醫藥的獨家渠道合作,加速Seq-MRD®在國內血液病重點醫院和診所的推廣應用;未來也會計劃推出FusionScan Plus產品,為患者量身定制更精準的臨床治療方案。”
文摘號 |
文章題目 |
1064612 |
Development and Validation of a Next Generation Sequencing Assay for Measurable Residual Disease Detection in B-lymphoid Malignancies |
1062999 |
An integrated DNA and RNA Next Generation Sequencing Assay for simultaneously Detection of Gene mutations and Fusions |
Seq-MRD® -- B淋系血液腫瘤微小殘留病高通量測序(NGS) 試劑盒產品
由于血液腫瘤患者經臨床治療后,體內還殘留有極少數對治療無反應或耐藥的腫瘤癌細胞,因此相當比例的患者治療后仍會復發。這些殘留的癌細胞數量很少,不會引起身體任何復發癥狀,很難通過傳統臨床方法檢測出來。為能精準檢測血液腫瘤患者治療后的癌細胞殘留,泛生子開發了一款通過高通量測序方法檢測免疫球蛋白基因重排以檢測微小殘留病(MRD)的試劑盒Seq-MRD®,并通過研究(文摘號:1064612)對產品性能進行了驗證。
本次研究共納入56例B淋系腫瘤患者骨髓穿刺液,40例健康人外周血,1例MM細胞系RPMI8226,1例B-ALL細胞系NALM6等不同樣本類型。整體的性能測試內容主要包括準確性、線性、LOD(Limit of detection)、重復性、LOB(Limit of blank)等。
檢測結果發現,Seq-MRD®檢測試劑盒在 B淋系腫瘤微小殘留病檢測時顯示了高度的靈敏度和特異性,可用于對臨床B淋系腫瘤患者不同水平微小殘留病進行精準檢測。
FusionScan plus -- 同時檢測基因突變和未知基因融合的低起始量試劑盒產品
對于潛在獲益基因融合及耐藥突變的充分檢測,可以更加精準地指導臨床診療,同時進行DNA和RNA的高通量測序檢測,是篩選基因突變和基因融合的理想方法。而目前可同時檢測DNA和RNA的試劑盒通常只能檢測到熱點基因突變和已知融合,并且對樣本需求量高。因此臨床上迫切需要可以同時進行廣泛基因突變和融合檢測的低起始量試劑盒產品。
對此,泛生子開發了一款以DNA和RNA為模板分別進行突變和融合基因檢測的二代測序試劑盒FusionScan plus。基于泛生子“一步法”專利技術,FusionScan plus產品覆蓋23個腫瘤相關突變基因以及37個融合基因,可同時用于腫瘤組織樣本中DNA層面的敏感或耐藥基因突變以及RNA層面發生在5’端的未知伴侶基因融合檢測。本次研究(文摘號:1062999)對76例臨床FFPE樣本的檢測結果證明,FusionScan plus產品在基因突變和5’端未知伴侶基因融合檢測時均顯示了高度的準確性,可在有限活檢樣本條件下實現對腫瘤患者用藥位點的精準檢測,及對靶向藥物目標人群的精準篩選,為患者提供臨床獲益。
關于AMP
美國分子病理學協會(AMP)成立于1995年,是一個致力于為分子診斷領域提供規劃指導、引領行業發展的非利性組織,其宗旨是通過教育、創新和倡導,促進分子和基因組實驗室醫學的臨床實踐、科學和卓越發展,推動實現高質量的醫療衛生服務。AMP年會是分子診斷學領域的重要活動,每年有上千名來自世界各地的的分子診斷領域專家代表參會。今年由于疫情原因,AMP年會取消了線下活動,代之以線上論壇形式舉辦。更多信息請訪問:https://www.amp.org/
關于泛生子
泛生子(納斯達克代碼:GTH)是全球前沿的癌癥精準醫療公司,專注于癌癥基因組學研究和應用,并致力依托先進的分子生物學及大數據分析能力改變癌癥診療方式。泛生子已打造了全面的產品及服務管線,覆蓋從癌癥早篩到診斷及治療建議,再到監測及預后管理的癌癥全周期,并與產業鏈上下游合作伙伴積極拓展分子檢測技術的更多創新應用方向和場景。更多公司信息請訪問:https://www.genetronhealth.com
安全港聲明
本新聞稿包含泛生子對未來的預期、計劃和前瞻性陳述,具有相應風險及不確定性,可能導致實際結果與前瞻性陳述中描述的預期不符。此類陳述是根據1995年美國私有證券訴訟改革法案的“安全港”條款作出的。前瞻性陳述涉及固有風險、不確定性,以及許多可能導致實際結果與任何前瞻性陳述中所描述的內容產生重大差異的因素。其它包含有“預期”、“相信”、“期待”、“計劃”等措辭和類似表達也屬于前瞻性描述。更多有關這些內容及其他風險、不確定性因素的信息,已包含在公司向美國證券交易委員會提交的備案文件中。本新聞稿中提供的所有信息不應被視為本公告發布之日后任何時點的觀點。泛生子預計未來的事件和進展會導致公司的設想和假設發生變化,但無論是否出現了新的信息、未來事件或其它情況,除適用法律要求外,公司不承擔更新任何前瞻性描述的義務。
]]>