根據協議條款,加科思近期將收到約2億元款項,其中包括1.5億元首付款,以及約5000萬元研發費用補償和其他付款,此外將收到最高7億元開發及銷售里程碑付款,以及分級兩位數比例的銷售提成,其中JAB-3312凈銷售提成最高至20%,上述金額為含增值稅金額。這標志著加科思正式進入商業化階段,同時SHP2的研發也迎來了新的里程碑。
加科思董事長兼CEO王印祥博士表示:我們很高興與艾力斯達成此次合作。艾力斯在肺癌領域擁有強大的新藥研發,臨床開發及商業化能力,肺癌是戈來雷塞的首個適應癥,也是患者群體最大的適應癥。我們相信憑借雙方優勢的深度契合,此次的強強聯手將釋放出巨大的臨床和商業價值。除戈來雷塞的合作外,艾力斯同時引進SHP2抑制劑JAB-3312,這一產品是全球首款進入注冊性臨床的SHP2抑制劑,有望與戈來雷塞的聯合用藥成為一線療法,這體現了艾力斯在管線布局方面的前瞻性。我們也期待雙方通過合作加速推動兩款產品的研發和上市,滿足更多患者的臨床需求。"
艾力斯董事長兼總經理杜錦豪表示:"我們非常高興與加科思達成戰略合作,此次合作必將有利于雙方公司共贏成長。多年來,艾力斯以‘科技關愛生命'為企業使命,專注于腫瘤治療領域的科學探索和藥物研發,致力于開發及引進由同類最佳藥(Best-in-Class)和首創藥物(First-in-Class)構成的優勢產品管線。我們在成功自主研發并獲批艾弗沙®的同時,打造了一支聚焦肺癌領域,有專業學術推廣能力的,覆蓋面廣的商業化團隊,艾弗沙®上市以來,銷售業績矚目。加科思是一家非常杰出的創新藥企業,成功研發并推進臨床多款極具潛力的優秀產品,包括KRAS G12C抑制劑戈來雷塞和SHP2抑制劑JAB-3312,我們十分看好這兩款產品的臨床優勢及市場前景。此次合作,艾力斯將充分發揮臨床開發和商業化能力的優勢,造福更多中國患者,為雙方公司創造價值。"
戈來雷塞單藥用于KRAS G12C突變二線非小細胞肺癌的新藥上市申請(NDA)已于2024年5月21日獲得優先審評。2022年12月,被國家藥品監督管理局藥品評審中心授予用于KRAS G12C突變的晚期或轉移性非小細胞肺癌患者二線及以上治療的突破性治療藥物認定。2024年4月,加科思在ASCO Plenary Series公布的戈來雷塞二期注冊性臨床試驗數據顯示,單藥二線非小細胞肺癌患者中,確認客觀緩解率(cORR)為47.9%(56/117),其中包括4例患者實現完全緩解(CR),36例患者腫瘤縮小超過50%,疾病控制率為86.3%。中位無進展生存期(mPFS)為8.2個月,中位總生存期(mOS)為13.6個月。
戈來雷塞與SHP2抑制劑JAB-3312聯合用藥用于KRAS G12C突變的一線非小細胞肺癌(NSCLC)對照標準療法(化療和PD-1抗體聯合治療)的注冊性三期臨床試驗已于2024年8月完成首例患者給藥。2024年6月,加科思在美國臨床腫瘤學會(ASCO)年會上發布的I/IIa期數據顯示,800毫克戈來雷塞與2毫克JAB-3312聯用(JAB-3312給藥一周,停藥一周)確認客觀緩解率(cORR)為77.4%(24/31),54.8%(17/31)的患者腫瘤縮小超過50%,達到深度緩解。從安全性數據來看,在194例全劑量組患者中,三級或四級治療相關不良事件(TRAE)的比例為43.8%,無治療相關的死亡,整體安全性可控。
除此之外,戈來雷塞單藥用于KRAS G12C突變的二線及以上胰腺癌,單藥及與西妥昔單抗聯合治療用于KRAS G12C突變的結直腸癌的二期注冊性臨床試驗也正在開展中。胰腺癌方面,2024年4月,戈來雷塞胰腺癌適應癥于2024年4月被美國食品藥品監督管理局(FDA)授予了孤兒藥資格認定;于2023年8月被國家藥品監督管理局(NMPA)藥品評審中心(CDE)授予用于KRAS G12C突變的二線或以上胰腺癌患者治療的突破性治療藥物認定。結直腸癌方面,戈來雷塞與西妥昔單抗聯合用藥治療結直腸癌于2024年5月在中國獲批注冊性三期臨床試驗。
關于戈來雷塞
戈來雷塞(JAB-21822)是加科思自主研發的KRAS G12C抑制劑。加科思目前已在中國、美國及歐洲多國啟動多項針對晚期實體瘤患者的臨床試驗,包括與SHP2抑制劑JAB-3312聯用治療非小細胞肺癌,戈來雷塞與西妥昔單抗在結直腸癌的聯合用藥,以及單藥治療胰腺癌的注冊性臨床研究。胰腺癌適應癥在美國獲得孤兒藥認定,并在中國獲得突破性治療藥物認定。
關于JAB-3312
JAB-3312是一種高選擇性的SHP2抑制劑,具有同類最佳潛力。加科思目前正在中國、美國和歐洲進行多項JAB-3312的臨床試驗,包括和KRAS G12C抑制劑戈來雷塞等項目的聯合用藥試驗。與戈來雷塞聯合用藥的三期臨床試驗于2024年2月在中國獲批。
關于加科思
加科思藥業(1167.HK)致力于為患者提供突破性治療方案。公司在研項目圍繞KRAS、腫瘤免疫、腫瘤代謝、P53、RB、MYC六大腫瘤信號通路布局,核心項目以全球前三為目標。公司的愿景是與合作伙伴攜手共進,成為全球認可的藥物研發領導者。加科思的實驗室坐落于中國北京、上海和美國波士頓,擁有誘導變構藥物發現平臺和iADC藥物研發平臺。
關于艾力斯
上海艾力斯醫藥科技股份有限公司成立于2004年3月,是一家以全球醫藥市場需求為導向,專注于腫瘤治療領域,集新藥研發、生產和商業化為一體的創新型制藥企業。艾力斯醫藥以科技關愛生命為發展理念,以開發首創藥物和同類最佳藥物為首要目標。歷經20年堅持不懈的努力,艾力斯已經成功自主研發并獲批兩款創新藥。2020年12月2日,公司正式在上海證券交易所科創板掛牌上市(股票代碼:688578)。依托公司伏美替尼同類最佳的產品優勢,以及專業化的營銷網絡,公司經營業績實現跨越式增長。2023年度公司實現營業總收入20.18億元,歸母凈利潤6.44億元;2024年上半年,公司實現營收15.76億元人民幣,較去年同比增長110.57%,實現凈利潤6.56億元,較去年同比增長214.82%。
如需了解有關艾力斯的更多信息,請瀏覽:www.allist.com.cn。

北京、上海和波士頓2021年12月6日 /美通社/ -- 加科思藥業集團(1167.HK)主研發的KRAS G12C抑制劑JAB-21822與西妥昔單抗注射液聯合用藥試驗于2021年12月3日獲得國家藥品監督管理局評審中心批準。
此項臨床試驗獲批后,加科思將在中國開啟一項I/II期、開放、多中心、劑量遞增和擴展的臨床研究,旨在探索JAB-21822 聯合西妥昔單抗在KRAS G12C突變的晚期結直腸癌患者中的安全性、耐受性和初步療效。
加科思臨床前研究顯示,JAB-21822與西妥昔單抗聯用可增強JAB-21822抑制劑在結直腸癌腫瘤模型中抗腫瘤活性,使腫瘤發生消退,且延緩停藥后的腫瘤再生長。
JAB-21822目前已在中美兩國獲批5項臨床試驗,包括單藥試驗以及分別與PD-1單抗或西妥昔單抗的聯合用藥試驗,適應癥包括非小細胞肺癌、結直腸癌等KRAS G12C突變的晚期實體瘤。
關于JAB-21822
JAB-21822是加科思自主研發的KRAS G12C小分子抗腫瘤藥,是潛在的同類最佳項目,目前已在中國和美國進行臨床試驗。從內部頭對頭的臨床前研究來看,JAB-21822和同類相比,具有更強的口服生物利用度和系統藥物暴露,擁有更好的藥代動力學特征和耐受性。
關于西妥昔單抗注射液
西妥昔單抗是針對EGF受體的IgG1單克隆抗體,此次聯合用藥臨床試驗所使用的西妥昔單抗注射液已在中國獲批治療RAS基因野生型轉移性結直腸癌、頭頸鱗癌等適應癥。
關于加科思
加科思(1167.HK)致力于為患者提供突破性治療方案。公司的使命是做生物醫藥的創新者,為全球患者提供有效的創新療法,公司的愿景是與合作伙伴攜手共進,成為全球認可的藥物研發領導者。公司的實驗室坐落于中國北京、上海和美國麻州,實驗平臺擁有開發蛋白磷酸酶、KRAS和其他轉錄因子的變構抑制劑技術。

北京和波士頓2021年3月29日 /美通社/ -- 加科思藥業(1167.HK)公布上市以來的首份業績公告,截至止2020年12月31日,全年營收4.86億元,研發投入超2.3億元,同比增長66%。作為一家臨床階段的研發型生物科技公司,加科思在研產品在2020年取得多項進展,核心項目SHP2抑制劑的臨床研究進入二期階段。
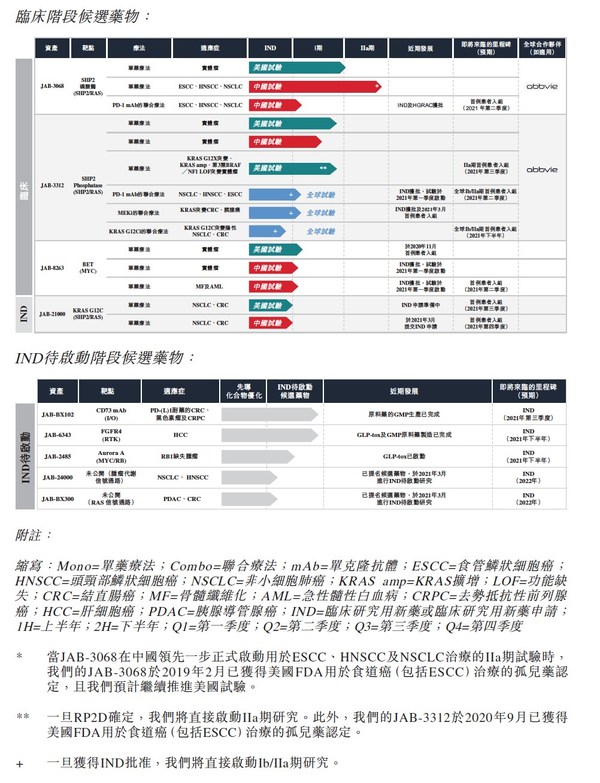
從在研項目來看,加科思圍繞RAS、MYC、RB、I/O等腫瘤信號通路布局,擁有開發蛋白磷酸酶、KRAS和其他轉錄因子的變構抑制劑技術,專注于全球首創新藥的自主研發。JAB-3068和JAB-3312是加科思自主研發的SHP2抑制劑,目前已有項目進入臨床二期試驗,與PD-1抗體、MEK抑制劑的聯合用藥的臨床試驗已經獲得批準。2021年,針對不同適應癥的Ib/IIa期臨床試驗將陸續有病人入組。
加科思與艾伯維在2020年5月展開合作,雙方將共同開發和商業化加科思自主研發的SHP2抑制劑。根據雙方協議,加科思目前已經收到4500萬美元(約2.95億元)的首付款及研發報銷款,日后將收到最多8.1億美元(約53億元)里程碑付款,加科思保留SHP2抑制劑在中國地區的獨家開發、商業化和制造權利,並將根據年度銷售凈額總額收到分級特許權使用費,金額介乎低至中雙位數百分比。
加科思創始人、董事長兼首席執行官王印祥博士表示,“作為一家臨床階段的生物科技公司,加科思已通過對外授權自主研發的臨床階段在研項目獲得合作收入,這體現了市場對加科思自主研發能力的認可。我們希望通過這一模式,與大型藥廠優勢互補,早日將產品推向市場,實現其醫療價值與商業價值。”
在SHP2抑制劑之外,加科思臨床階段的項目還包括KRAS G12C抑制劑JAB-21000與BET抑制劑JAB-8263,目前已提交新藥臨床試驗申請。另有五個處于臨床試驗待啟動(IND-Enabling)階段的在研項目,以及五個臨床前階段的項目。
在公司運營層面,2020年加科思的團隊規模從130人增長至約180人,2021年將繼續擴張團隊規模。北京占地約兩萬平米的GMP工廠正在施工,預計于2023年底前竣工。加科思在波士頓設有實驗室和臨床運營團隊,上海辦公室將于2021年上半年正式使用。
在資本市場層面,加科思2020年12月在香港主板上市,融資近2億美元,2021年3月15日正式被納入恒生綜合指數,并進入港股通交易名單。
王印祥博士強調:“加科思致力于成為一家擁有全球市場份額的創新藥公司,2021年,加科思將繼續投入研發,在自主研發的基礎上,積極尋找合作伙伴,增強我們在新藥研發各個環節的實力,與合作伙伴共同開辟全球市場,充分發揮我們在研項目的醫療價值與商業化價值,在抗爭癌癥的道路上為全球患者帶來幫助。”
有關上述內容的更多信息,請參閱本公司在香港聯交所及公司官網上發布的2020年度業績公告。
聯系人:
媒體:王女士 media@jacobiopharma.com
投資者:俞女士 ir@jacobiopharma.com
關于加科思
加科思致力于為患者提供突破性治療方案。公司的使命是做生物醫藥的創新者,為全球患者提供有效的創新療法,公司的愿景是與合作伙伴攜手共進,成為全球認可的藥物研發領導者。公司的實驗室坐落于中國北京和美國麻州,實驗平臺擁有開發蛋白磷酸酶、KRAS和其他轉錄因子的變構抑制劑技術。
了解更多,請訪問:www.jacobiopharma.com.