自創立以來,來凱醫藥以"治愈"為初心,始終注重企業的健康可持續發展,秉承"長期主義"的精神展開ESG工作。2023年,企業制定了 ESG五年發展戰略LIGHT規劃——以合規/治理(Legitimate)、創新/研發(Innovation)、環境(Green)、健康(Health)、人才(Talent)為五大支柱。此外,來凱各職能部門均推舉了ESG大使,將公司ESG戰略及目標落實到方方面面。
"在ESG工作中,作為CEO我感觸最深的有兩點:勿以善小而不為,勿以己小而松懈",來凱醫藥董事會主席兼首席執行官呂向陽博士解釋:"前者是指,相比大公司而言,我們現階段能做的事情可能有限。但幸運的是,公司每一位員工心懷善念,從點滴做起,發光發熱。后者是指,絕不能因為我們是個初上市企業、規模尚小,就放松對自己的要求。"
呂向陽博士表示,來凱醫藥承諾將恪守法律法規底線,秉持高標準的道德操守,承諾定期發布ESG報告,以透明、負責任的態度,謀求企業長期穩健發展。
"數說"2023來凱ESG
- 合規經營:恪守法律及《港交所上市規則》等規則,制定企業《利益沖突管理》《反舞弊管理》《內幕信息管理》等制度體系材料。合規培訓員工覆蓋率 100%。
- 創新研發:多重機制激勵研發創新,惠及患者。展開6項臨床試驗,內部發現14種候選藥物,7個已推進到PCC;建立患者安全性管理3級結構;通過4個方式(申請專利、商標注冊、簽署保密協議和法律維護)進行企業知識產權保護。
- 回饋社會:通過員工捐款+公司匹配,捐贈云南"云上耕讀"圖書架1500冊圖書及1間甘肅"科學創想教室"。2023年投入志愿公益時長總計 438 小時,公益活動直接受益人344人。
- 平等多元:致力于營造多元的人才機制和平等的職場環境,對不同國家、種族及性別的員工一視同仁。女性員工比例為64%,總監及以上級別女性比例為53%。
- 員工發展:為員工提供多樣化的培訓及職業發展體系,定期舉辦跨部門知識交流活動"來凱大咖說"。員工培訓率100%,人均培訓時長7.95小時。
- 攜手共進:打造有韌性、低風險、負責任、有溫度的供應鏈,供應商中包括公益組織。在本ESG報告中,聽障設計師沈沛衍參與設計封面。
- 節能環保:在日常運營和科研過程中持續探索減少污染物排放的方案,包括用可反復利用的玻璃容器代替一次性容器耗材,比例達20%;全面推廣員工的電子名片及電子工資單。2023年度,公司溫室氣體排放下降19.4%。
歡迎訪問https://www.laekna.com/upload/2024-04/171412287490239800.pdf,閱讀電子版《來凱醫藥2023年環境、社會及管治(ESG)報告》。
— 完 —
關于來凱醫藥
股份代碼:2105.HK
來凱醫藥成立于2016年,是一家以科學為驅動、處于臨床階段的生物醫藥科技公司,致力于為全球癌癥、代謝疾病及肝纖維化患者帶來新型療法。
截至2023年12月31日,來凱醫藥圍繞Afuresertib(LAE002)、LAE001及LAE005高效推進六項臨床試驗,其中三項是國際多中心臨床試驗(MRCT),覆蓋乳腺癌、前列腺癌、卵巢癌及PD-1/PD-L1耐藥實體瘤等,以解決癌癥領域未被滿足的醫療需求。Afuresertib(LAE002) 是目前全球前二處于或完成關鍵臨床開發階段的抗癌AKT抑制劑之一。
在自主研發領域,來凱醫藥內部已發現十四款候選藥物。LAE102是來凱自主研發針對ActRIIA的抗體,已獲得美國FDA針對肥胖適應癥的新藥臨床試驗(IND)批準,及中國CDE的受理。阻斷Activin-ActRII通路可促進肌肉再生和減少脂肪。來凱團隊在這一特定領域積累了豐富的經驗及深厚的專業知識,并正在開發更多的候選藥物(LAE103、LAE123等),以最大限度地發揮靶向ActRII受體的價值。
2023年6月29日, 來凱醫藥在香港聯合交易所有限公司("香港交易所")主板上市,股份代碼:2105.HK。
如需了解更多公司信息,請訪問 http://www.laekna.com
前瞻性聲明
本新聞稿有若干前瞻性陳述,該等前瞻性陳述并非歷史事實,乃基于來凱醫藥的現有看法、假設和期待而對未來事件做出的預測,通常會使用"將"、"可能"、"期望"、"相信"、"計劃"、"預估"、"預測"及其他類似詞語進行表述。盡管本公司相信所做的預測合理,但是基于未來事件固有的不確定性,我們的實際未來業績或表現可能與預測有重大差異。因此,您應注意,依賴任何前瞻性陳述可能導致已知及未知的重大風險和不確定性。本新聞稿載有的所有前瞻性陳述需參照本部分所列的提示聲明。本新聞稿所載的所有信息僅以截至本新聞稿做出當日為準,且僅基于當日的假設,除法律有所規定外,本公司概不承擔義務對該等前瞻性陳述更新。
中國上海和美國新澤西沃倫2024年1月4日 /美通社/ -- 來凱醫藥在肝纖維化領域的自主研發取得新進展。在1月4日-6日美國舉行的2024全球NASH-TAG大會上,來凱醫藥(2105.HK)將以壁報形式公布一個自主研發的靶向激活的肝星狀細胞的雙功能NK-aHSC接合劑藥物發現平臺,以及基于該平臺技術設計出來的LAE105抗體的抗肝纖維化臨床前數據。
肝纖維化是導致肝癌或肝功能衰竭的重要原因,而產生肝纖維化的主要因素是激活的肝星狀細胞(aHSC)的積累。來凱早期研發團隊生物高級總監、本次壁報的作者之一張敏華博士介紹,當前針對脂肪肝纖維化的藥物研發多集中在降解肝脂肪,或通過阻斷肝星狀細胞激活過程中的某個信號通路來緩解纖維化。來凱另辟蹊徑,自主開發并建立一個全球領先且獨有的、利用人體自身免疫系統清除aHSC的藥物發現平臺。依托這個平臺,來凱能夠源源不斷地持續開發抗肝纖維化的抗體。
LAE105就是基于這個獨有平臺設計出的一款潛在抗體。"LAE105在結合aHSC表面蛋白后可以招募和激活免疫細胞(如NK細胞),從而利用人體自身的免疫系統來清除aHSC。除了改善肝纖維化,它還可能應用于其它機理相似的纖維化疾病,是一款潛在的first-in-class新藥。"張敏華博士說。
"很高興來凱的臨床前自主研發又獲新進展。"來凱醫藥首席科學官顧祥巨博士表示:"肝纖維化、代謝和腫瘤是來凱當前聚焦的三大領域,我們擁有扎實的知識底蘊、全新的研發理念和獨創的技術平臺。目前全球肝纖維化領域尚未有獲批的藥物,希望通過我們的努力加速肝纖維化新藥的突破。"
NASH-TAG是全球最權威的非酒精性脂肪肝和肝纖維化領域學術大會之一,匯聚了臨床專家、行業學者及業界領袖,聚焦年度重要數據、最新進展和研發趨勢。
關于來凱醫藥
股份代碼:2105.HK
來凱醫藥成立于2016年,是一家處于臨床階段的生物醫藥科技公司,致力于為全球癌癥及肝纖維化患者帶來新型療法。
截至2023年6月30日,我們已針對Afuresertib (LAE002)、LAE001及LAE005啟動六項臨床試驗,覆蓋卵巢癌、乳腺癌、前列腺癌等,以解決癌癥領域未被滿足的醫療需求。上述六項臨床試驗中,三項是國際多中心臨床試驗(MRCT), 其中包括一項關鍵試驗。
在自主研發領域,來凱醫藥內部已發現十二種候選藥物。LAE102是我們首個自主研發的抗體,潛在用于增肌減脂和抗腫瘤等適應癥,已獲得FDA的新藥臨床試驗(IND)申請批準。
2023年6月29日, 來凱醫藥在香港聯合交易所有限公司("香港交易所")主板上市,股份代碼:2105.HK。
如需了解更多公司信息,請訪問 http://www.laekna.com
前瞻性聲明
本新聞稿有若干前瞻性陳述,該等前瞻性陳述并非歷史事實,乃基于來凱醫藥的現有看法、假設和期待而對未來事件做出的預測,通常會使用"將"、"可能"、"期望"、"相信"、"計劃"、"預估"、"預測"及其他類似詞語進行表述。盡管本公司相信所做的預測合理,但是基于未來事件固有的不確定性,我們的實際未來業績或表現可能與預測有重大差異。因此,您應注意,依賴任何前瞻性陳述可能導致已知及未知的重大風險和不確定性。本新聞稿載有的所有前瞻性陳述需參照本部分所列的提示聲明。本新聞稿所載的所有信息僅以截至本新聞稿做出當日為準,且僅基于當日的假設,除法律有所規定外,本公司概不承擔義務對該等前瞻性陳述更新。
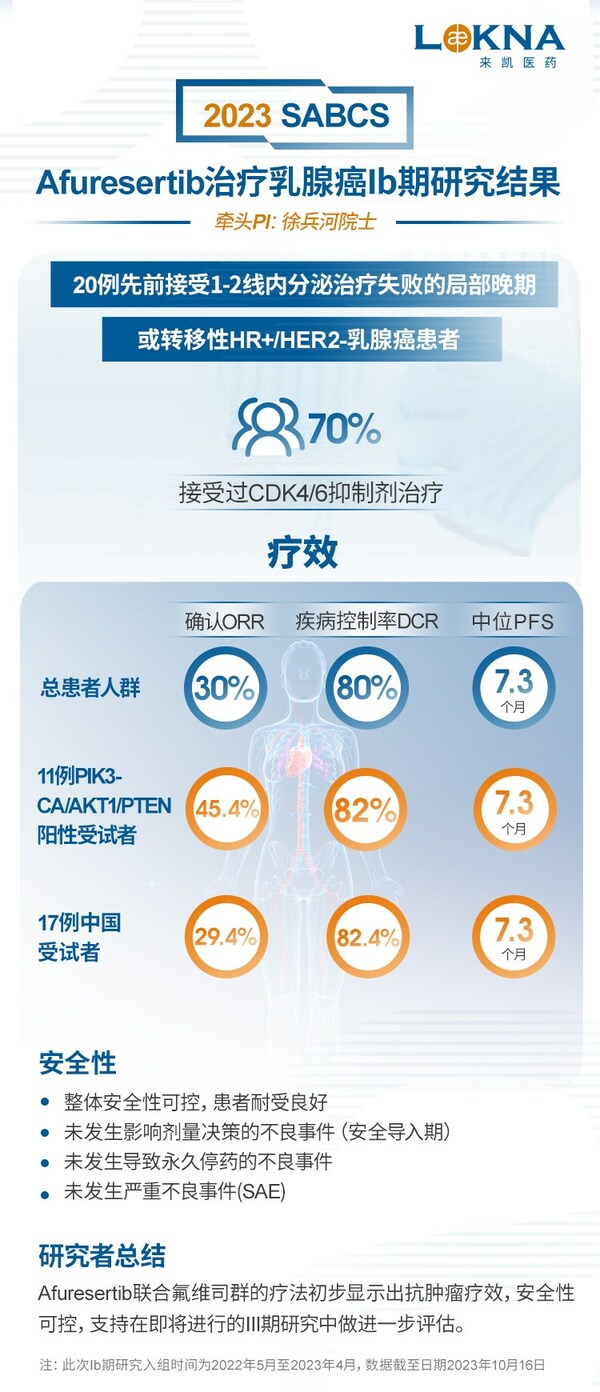
- Ib入組受試者中70%接受過既往CDK4/6抑制劑治療
- 研究結果顯示,確認的客觀緩解率(ORR)為30%,中位無進展生存期 (PFS)為7.3個月,受試者臨床獲益顯著
中國上海和美國新澤西沃倫2023年12月11日 /美通社/ -- 來凱醫藥(股份代碼:2105.HK),一家處于臨床階段的生物醫藥科技公司上周五在2023美國圣安東尼奧乳腺癌研討會(San Antonio Breast Cancer Symposium, SABCS)現場,公布了關于"評價afuresertib聯合氟維司群治療標準治療失敗的局部晚期或轉移性HR+/HER2-乳腺癌患者的療效和安全性的Ib期研究"數據。
療效及安全性積極
此次Ib期研究在2022年5月至2023年4月期間共入組20例受試者(19名女性和1名男性),均為先前接受1-2線內分泌治療失敗的局部晚期或轉移性HR+/HER2-乳腺癌患者。中位隨訪期為11個月。
截至2023年10月16日,療效及安全性研究結果如下:
- 入組患者中70%既往接受過CDK4/6抑制劑治療
- 總患者人群中:確認的客觀緩解率(ORR)為30%(95% CI, 11.9, 54.3),疾病控制率(DCR)為80%,中位無進展生存期 (PFS)為7.3個月(95% CI, 3.7, NE)
- 11例PIK3CA/AKT1/PTEN陽性受試者中:確認的ORR為45.4%(95% CI, 16.7, 76.6),疾病控制率為82%,中位PFS為7.3個月(95% CI, 3.6, 8.2)
- 17例中國受試者中:確認的ORR為29.4%(95% CI, 10.3, 60.0),疾病控制率為82.4%,中位PFS為7.3個月(95% CI, 3.6, 8.2)
- 整體安全性可控,患者耐受良好。未發生影響劑量決策的不良事件(安全導入期)。未發生導致永久停藥的不良事件,也未發生嚴重不良事件(SAE)
研究者在總結中表示,afuresertib聯合氟維司群的療法初步顯示出抗腫瘤療效,安全性可控,支持在即將進行的III期研究中做進一步評估。
乳腺癌成"全球第一大癌" 亟需耐藥后的新療法
世界衛生組織國際癌癥研究機構(IARC)最新發布的數據顯示,2020年全球乳腺癌新發病例數達226萬人,首次超過肺癌躍升為"全球第一大癌",68.5萬患者因此死亡。中國最新的惡性腫瘤流行數據也顯示,乳腺癌已躍居中國女性癌癥發病首位,年新發病例約42萬[i]。
在美國所有乳腺癌患者中,約69%[ii]屬于HR+/HER2,中國患者中這一類分子亞型比例為62%[iii]。盡管大多數此類乳腺癌患者初始可從一/二線內分泌±CDK4/6抑制劑和/或者化療中獲益,但一段時間后,大部分可能會產生耐藥,導致治療失敗。
"盡管乳腺癌的治療方法日益多樣,但不可否認的是,腫瘤耐藥以后的治療依然是臨床難點之一。''徐兵河院士表示:"隨著上個月全球首個AKT抑制劑獲批,局部晚期或轉移性HR+/HER2-乳腺癌患者迎來了新的曙光。在目前處于臨床階段的AKT抑制劑中,afuresertib占據領跑位置,此次Ib期數據令人欣喜。我對下一步afuresertib乳腺癌III期研究充滿期待。"
III期關鍵試驗已經啟動
隨著對AKT研究的日益深入,顯示由于PTEN缺失、AKT/PIK3CA突變等,均會引起AKT信號通路的過度激活,導致腫瘤的發生、發展及耐藥,這在HR+乳腺癌尤為常見。AKT也由此成為了治療腫瘤的熱門靶點。
"對于內分泌治療有效和/或耐藥的靶向治療是乳腺癌領域的一個前沿熱點,來凱此次臨床研究入選的‘壁報突出報道'環節正是聚焦于這一話題。"來凱醫藥首席醫學官岳勇博士表示,"相比氟維司群單藥治療PFS3-4個月[iv],afuresertib聯合氟維司群的中位PFS大幅增加到了7.3個月,同時表現出良好的安全性。"
目前來凱醫藥已經開始啟動afuresertib聯合氟維司群治療HR+/HER2-乳腺癌III期關鍵試驗。"我們期待在更大數量的樣本中看到積極的數據,為患者帶來希望。"岳勇博士說。
-完-
關于afuresertib和AKT抑制劑
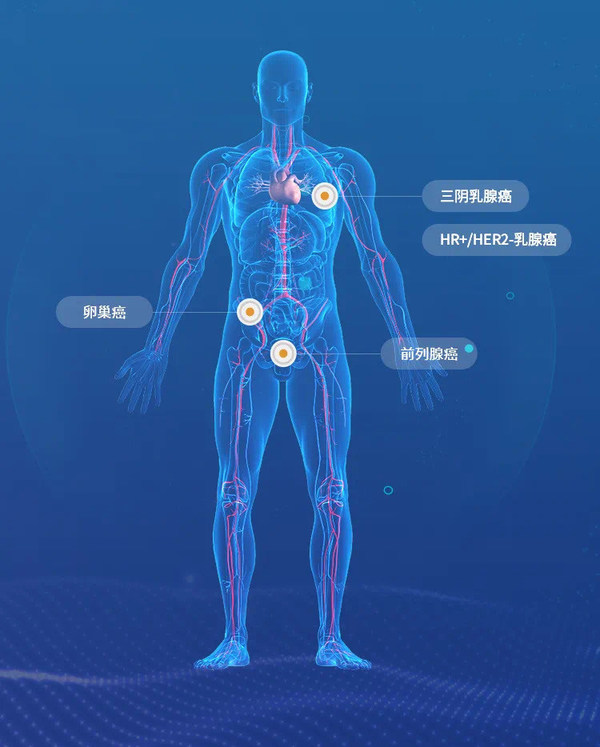
是一種處于臨床階段的AKT抑制劑。來凱醫藥正圍繞鉑類耐藥卵巢癌(PROC)、HR+/HER2-乳腺癌、mCRPC、TNBC、PD-1耐藥宮頸癌及子宮內膜癌等適應癥開展了一系列的臨床研究,其中PROC研究前處于注冊臨床開發階段。
關于來凱醫藥
股份代碼:2105.HK
來凱醫藥成立于2016年,是一家處于臨床階段的生物醫藥科技公司,致力于為全球癌癥及肝纖維化患者帶來新型療法。
截至2023年6月30日,來凱醫藥已針對afuresertib (LAE002)、LAE001及LAE005啟動六項臨床試驗,覆蓋卵巢癌、乳腺癌、前列腺癌等,以解決癌癥領域未被滿足的醫療需求。上述六項臨床試驗中,三項是國際多中心臨床試驗(MRCT),其中包括一項關鍵試驗。
在自主研發領域,來凱醫藥內部已發現十二種候選藥物。LAE102是來凱首個自主研發的抗體,潛在用于增肌減脂和抗腫瘤等適應癥,已獲得FDA的新藥臨床試驗(IND)申請批準。
2023年6月29日, 來凱醫藥在香港聯合交易所有限公司("香港交易所")主板上市,股份代碼:2105.HK。
[i] Global Cancer. IARC. http://gco.iaic.fr/
[ii] Cancer Stat Facts: Female Breast Cancer Subtypes; SEER 22 2016–2020
[iii] Breast cancer subtypes and survival in Chinese women with operable primary breast cancer. Chin J Cancer Res, 2011. 23(2): p. 134-9.
[iv] N Engl J Med 2023;388:2058-70
中國上海和美國新澤西沃倫2022年5月26日 /美通社/ -- 來凱醫藥,一家處于臨床階段的全球醫藥新銳今天宣布,其一項針對乳腺癌的Ib/III期全球多中心臨床研究,已分別在中國天津醫科大學腫瘤醫院和美國亞特蘭大州Piedmont 癌癥中心完成了受試者入組及首例給藥,標志著此項研究的全球同步開發進入了快速推進階段。
該臨床研究是來凱醫藥的AKT抑制劑 -- 處于臨床開發階段的1類候選新藥Afuresertib(LAE002),聯合雌激素受體拮抗劑氟維司群的Ib/III期臨床試驗,針對標準治療失敗的局部晚期或轉移性激素受體陽性/人表皮生長因子2受體陰性(HR+/HER2-)乳腺癌患者。2021年,該研究先后獲得美國食品和藥物管理局(FDA)及中國國家藥品監督管理局藥品評審中心(CDE)的批準。
作為一項全球多中心臨床研究,其中國地區牽頭研究者為中國工程院院士、國家新藥(抗腫瘤)臨床研究中心主任徐兵河院士,首例受試者給藥所在的中心研究者為天津醫科大學腫瘤醫院乳腺腫瘤內科主任佟仲生教授。繼天津之后,中國其他的研究中心正在陸續展開患者入組。在美國,主要研究者為新當選的美國腫瘤臨床試驗聯盟理事、美國佛蒙特大學醫學中心腫瘤內科首席醫師Peter Kaufman教授。首例受試者給藥所在的中心研究者為Piedmont癌癥中心腫瘤內科主治醫師Trevor Feinstein博士。
乳腺癌是全球女性中最常見的癌癥。在中國所有乳腺癌患者中,約62%屬于HR+/HER2-1 ,美國患者中這一類分子亞型比例高達68%2 。中國醫學科學院腫瘤醫院徐兵河院士表示:"盡管大多數此類乳腺癌患者最初可從一/二線內分泌±CDK4/6 抑制劑和/或者化療中獲益,但一段時間后,大部分腫瘤可能會產生耐藥,導致治療失敗。腫瘤耐藥以后的治療選擇一直是乳腺癌各種臨床研究致力解決的難點之一。我對本次Afuresertib聯合雌激素受體拮抗劑氟維司群臨床研究充滿期待 "。
"盡管受到全球新冠疫情的影響,但我們的團隊在各位研究專家的支持下克服重重困難,按時完成中美兩國首例給藥,達成了本項研究的一個重要節點,進一步凸顯了來凱卓越的全球臨床開發能力。"來凱醫藥首席醫學官岳勇博士表示,"接下來我們將全力快速推進全球同步開發,驗證Afuresertib聯合氟維司群在治療HR+/HER2-乳腺癌耐藥方面的安全性和療效,為患者帶去新的希望。" 根據研究流程,如果Afuresertib聯合氟維司群在1b期研究中獲得了可靠的安全性數據,可盡快展開III期全球注冊研究。
Afuresertib是來凱醫藥從諾華公司引進全球獨家權益、已有臨床驗證結果的新一代小分子AKT激酶強效抑制劑,已有研究發現癌癥患者接受化療、靶向治療或腫瘤免疫治療后的耐藥,不少都與AKT表達上調有關3,4。來凱醫藥董事長兼CEO呂向陽博士表示,目前在公司產品線中,Afuresertib與化療、靶向藥、內分泌以及PD-1/PD-L1抑制劑聯用的多項研究都正在開展,"我們期待Afuresertib在解決全球腫瘤耐藥的問題上發揮實力"。
1 Li, Z.S., et al., Breast cancer subtypes and survival in Chinese women with operable primary breast cancer. Chin J Cancer Res, 2011. 23(2): p. 134-9. |
2 SEER Cancer Stat Facts: Female Breast Cancer Subtypes. National Cancer Institute. Bethesda, MD. Available from: https://seer.cancer.gov/statfacts/html/breast-subtypes.htm |
3 Huang WC, Hung MC. Induction of Akt activity by chemotherapy confers acquired resistance. J Formos Med Assoc 2009; 108 (3): 180-194. |
4 O'Donnell JS, Massi D, Teng MWL et al. PI3K-AKT-mTOR inhibition in cancer immunotherapy, redux. Semin Cancer Biol 2018; 48: 91-103. |
如需了解更多公司信息,請訪問 http://www.laekna.com。
作為一家臨床階段的全球生物制藥新銳,來凱致力于為全球的癌癥與肝病患者帶來創新性療法。目前公司產品管線中共有14個創新候選藥物,已有6個項目獲批進入臨床研究,均針對當前腫瘤治療耐藥性這個緊迫、未滿足的醫學需求,其中包括3個國際多中心臨床試驗(含1個關鍵性臨床試驗)。
在迄今完成的四輪融資中,來凱醫藥吸引了多家全球醫療領域領先的投資機構。除了本輪領投的國投招商,2020年10月完成的6,100萬美元C輪融資由深創投領投,B輪和A輪的領投方則為金浦投資和奧博資本。
公司表示,此次D輪融資將主要用于加速推進兩大核心產品 -- AKT抑制劑afuresertib(LAE002),及全球首個處于臨床階段的CYP17A1和CYP11B2雙靶點抑制劑(LAE001)臨床研究進程,涵蓋三種不同的關鍵機制:靶向治療、激素治療和免疫腫瘤治療。其中臨床進展最快的一項名為PROFECTA-II全球隨機、開放、多中心 II 期注冊臨床研究,系AKT抑制劑afuresertib在全球首個針對鉑類耐藥性卵巢癌的注冊臨床試驗。
對于順利完成D輪融資,來凱創始人及CEO呂向陽博士特別感謝新老投資人的認可。“2022年4月恰是來凱醫藥正式投入運營5周年。這5年中,我們有幸持續得到各方鼓勵和支持,我最大的感受,就是來凱生逢一個好的時代,與一群志同道合的人攜手同行。”呂向陽博士表示,目前來凱醫藥正處在一個關鍵的發展階段。“新藥研發之路漫長且艱辛,我們始終初心不變 -- 為了患者的需求,為了治愈的明天。”
國投招商生命科學團隊表示:“當前全球生物制藥賽道千帆競發、百舸爭流,整個行業蓬勃發展。做出投資決策前,我們對來凱醫藥做了全面深入的考察,對公司的研發管線、自主創新能力和人才團隊印象深刻。我們愿意一起攜手,為把來凱醫藥打造成生物制藥行業的實踐者、引領者共同努力,造福全球患者。”
]]>"Jeff Porter博士是一位卓越的科學家和優秀的新藥研發領導者,在藥物發現和靶點研究領域均具豐富的經驗。"來凱醫藥首席執行官呂向陽博士表示,"我們很榮幸能邀請到Jeff Porter博士擔任我們的科學顧問委員會主席,他在科學和戰略領域的遠見卓識必將繼續夯實并加速我們的新藥研發管線。"
"來凱醫藥產品管線令人振奮,無論是其潛在臨床新藥,還是公司自主研發的早期項目,均在國際上擁有相當的競爭力。" Jeff Porter博士表示:"呂向陽博士是一位令人尊敬的科學家,也是我共事多年的前同事。我非常期待與他及來凱團隊合作,攜手發現并開發針對腫瘤和肝纖維化的創新性療法。"
作為前諾華生物醫學研究中心全球領導團隊的資深創始成員,Porter博士建立了一套新藥研發的創新模式,通過研究生物分子通道和功能網絡來探索新靶點和先導藥物的發現,為NIBR在新藥研發領域的成功奠定了基礎。他領導的研究團隊建立起一個動態的多學科平臺,整合了生物學通路和疾病領域的專業認知。他們的努力帶來了廣泛的、具有意義深遠的發現,包括理論研究、全新靶點和通過早期臨床驗證的候選藥物。其中具有代表性的例子,是在生物學的核心途徑中發現多個關鍵靶點及候選藥物,以及能夠靶向RNA剪接的新藥前體。
在加入諾華前,Porter博士曾擔任生物技術公司Ontogeny(現為Curis)研發副總裁。Porter博士擁有約翰霍普金斯大學生物化學博士學位,并在該校的霍華德休斯醫學研究所分子生物學和遺傳學系完成了博士后研究。
中國上海和美國新澤西沃倫2022年1月10日 /美通社/ -- 來凱醫藥,一家專注于腫瘤與肝病領域的突破性新藥研發的醫藥新銳,近日宣布:其治療抗PD-1/PD-L1耐藥特定實體瘤患者的聯合治療方案臨床I/II期試驗申報,已經獲得了中國國家藥品監督管理局藥品審評中心(CDE)的批準。此次臨床研究獲批,是來凱醫藥與信達生物兩家創新醫藥企業2021年7月建立臨床研究合作伙伴關系后的一項重要進展。
此次“afuresertib+信迪利單抗+化療治療抗PD-1/PD-L1耐藥的特定實體瘤患者的 I/II 期劑量遞增和有效性/安全性研究”,由北京大學腫瘤醫院副院長、消化腫瘤內科主任沈琳教授擔任主要研究者。聯合方案采用三個藥物:來凱醫藥的泛AKT抑制劑——處于臨床開發階段的1類候選新藥afuresertib(LAE002),信達生物的信迪利單抗注射液,以及化療藥物白蛋白結合型紫杉醇或多西他賽。
本次研究目標旨在I期部分評估上述三種藥物聯用的安全性、確定II期研究推薦劑量,并在II期研究中評估聯合治療的臨床有效性和安全性。II期的研究人群為對既往抗PD-1/PD-L1治療(單藥治療或與其他抗癌藥物聯合治療)耐藥且患有以下5種選定腫瘤之一的患者:
- 非小細胞肺癌(NSCLC)
- 胃和食管胃結合部腺癌(GC/GEJC)
- 食道癌(EsC)
- 宮頸癌(CC)
- 子宮內膜癌(EC)
沈琳教授表示:AKT(一種絲氨酸/蘇氨酸激酶)是一個治療腫瘤的潛在新靶點。多項臨床前研究顯示,抑制AKT可能恢復耐藥腫瘤的藥物敏感性。“隨著PD-1/PD-L1抑制劑在腫瘤治療領域的廣泛運用,耐藥現象是臨床常見問題和難點。統計顯示,只有部分患者對PD-1/PD-L1療法有積極應答反應。此外,對于大多數經歷初始治療的患者來說,耐藥后如何治療更是一大挑戰。因此我對本次臨床試驗充滿期待,希望AKT抑制劑的加入,能為抗PD-1/PD-L1耐藥患者提供新的治療方案。”
“自去年7月來凱醫藥與信達生物合作啟動后,我們對此次臨床研究的開發策略和設計進行了周密規劃。在合作伙伴和主要研究者的支持下,順利取得了CDE的臨床批件。”來凱醫藥首席醫學官岳勇博士表示:“盡管具有長期的、潛在的接近于治愈的臨床益處,但耐藥性仍然是阻礙PD-1/PD-L1療法進一步應用的重大挑戰。因此,免疫抵抗是一種未竟的巨大醫療需求,是提高癌癥患者生存率和生活質量的主要障礙之一,而癌細胞中的AKT激活是可能導致免疫抵抗的眾多因素之一。來凱醫藥希望此次臨床研究能與信達生物共同探索關于AKT抑制劑afuresertib+信迪利單抗+化療在治療免疫耐藥實體腫瘤上的能力,這項研究的成功有望將惠及更多免疫治療耐藥的癌癥患者。”
來凱醫藥董事長兼CEO呂向陽博士表示:CDE新近發布的《以臨床價值為導向的抗腫瘤藥物臨床研發指導原則》,專門提及“腫瘤耐藥是抗癌治療與新藥研發中所面臨的一大挑戰”。此次來凱醫藥與信達生物的聯合臨床研究,恰好響應了指導原則中關于“應該關注耐藥患者的需求,尋找新一代克服腫瘤耐藥的抗腫瘤新藥,或可以克服耐藥的抗腫瘤藥物組合”的建議。來凱團隊將全力以赴,快速推進本次臨床研究。
]]>來凱醫藥副總裁、公司與業務發展負責人羅森楷博士在會上介紹了來凱醫藥在癌癥和肝病兩大治療領域開發的差異化戰略。他還與來自美國醫療保健、生物技術、制藥和投資界的與會代表共同探討了生物制藥行業的現狀,包括像來凱這樣的biotech如何致力于推動自身的管線產品走向商業化。
“在這樣的時期,我們看到資本市場回歸本源,公司的估值將更多地基于其管線臨床數據的質量和數據。我們很高興來凱醫藥正在全力開發數個處于臨床晚期階段的腫瘤項目,并對目前觀察到的結果倍感鼓舞。”
作為紐約生命科學行業的主要倡導者,NewYorkBIO 匯集了美國整個紐約地區近 300 家致力于推進生命科學研究和商業化的生物科學公司、大學、研究機構和機構。在過去三年中,NewYorkBIO 和紐約證券交易所合作舉辦各類活動,連接起紐約的新興生物技術公司和金融界,共同為開發出醫療保健革命性療法而努力。
]]>兩項臨床研究數據積極
電子壁報597P
CYP17A1和CYP11B2雙靶點抑制劑(LAE001),在轉移性去勢抵抗型前列腺(mCRPC)癌患者中的 I 期研究
主要研究者及報告人:葉定偉教授(復旦大學附屬腫瘤醫院)
這是一項多中心、開放、Ia/Ib期兩階段研究,用于探索在不聯用潑尼松的情況下,LAE001單藥在轉移性去勢抵抗性前列腺癌患者中的安全性、藥代學特點和初步療效。LAE001是全球首個 CYP17A1和CYP11B2雙靶點抑制劑。
初步結果顯示(截至2021年5月25日):
- 在接受50毫克治療的15例患者中,11 名患者(73%)的 PSA 比基線下降 >50%,其中 6 名患者(40%)的 PSA 比基線下降 >90%
- 2 名患者(50 毫克 BID組)的 PSA 反應持續 > 52 周。81%的PSA分析患者仍在接受治療
結論:在II期推薦劑量 每天2次50mg給藥情況下,LAE001 單一療法安全且耐受良好,初步抗腫瘤活性支持治療 mCRPC 患者的潛在臨床益處。 目前II期推薦劑量的進一步Ib期和II期臨床研究[1]正在進行中。
電子壁報599P
LAE001/潑尼松+ afuresertib (一種AKT抑制劑) 聯合,在經標準治療后轉移性去勢抵抗型前列腺癌(mCRPC)患者中的I期研究
主要研究者及報告人:Alberto Bessudo (Encinitas, CA, United States of America)
此項I/II期兩階段研究的I期部分為多中心、開放、劑量遞增研究,適用于先前接受過至少一種二代抗雄激素和/或化療這2種標準治療后疾病進展或不耐受的mCRPC患者,旨在評估安全性并確定II期研究中 LAE001/潑尼松和 afuresertib 聯合治療的2 期推薦 劑量 (RP2D)。
Afuresertib(LAE002)是處于臨床階段的1類候選新藥,屬于新一代小分子泛AKT激酶強效抑制;LAE001是全球首個CYP17A1和CYP11B2雙靶點抑制劑。
初步結果顯示(截至2021年6月29日):
- 在接受治療的14例患者中,2例有較基線降低超過50% 的PSA緩解
- 5例有基線可測量病灶的患者中觀察到1例有緩解和2例疾病穩定
- 10例可評估患者平均已經在3線既往治療中失敗
結論:
II期推薦劑量為LAE001 75mg /潑尼松 5mg 和 afuresertib 125mg 的聯合治療,初步抗腫瘤活性支持治療 dr-mCRPC 的潛在臨床益處,并推進到 II 期臨床研究階段。
期待創新藥物盡早惠及前列腺癌患者
“作為一家醫藥新銳,這是來凱醫藥首次亮相ESMO年會,我們很高興同時有兩項臨床研究得到了這一國際權威學術會議的認可。”來凱醫藥首席醫學官岳勇博士表示。
前列腺癌是全球男性發病率最高的癌癥,也是中國發病率第7位的癌癥。第一個研究項目中,在未與波尼松聯用的情況下,LAE001單藥仍表現出患者可耐受的安全性和較強的抗腫瘤功效。來凱醫藥正快速推進這一臨床研究項目,對需要長期治療的前列腺癌患者而言,有望很大程度避免現有治療標準中對潑尼松的依賴及其引發的副作用和對患者生存質量的影響。
此外,產生抗藥性的晚期前列腺癌是最難治的癌癥之一,患者亟需更有效的創新藥物和療法。來凱醫藥第二項研究中展示的LAE001與afuresertib的聯合治療,有望使PTEN/PIK3CA/AKT 缺失的患者受益。
岳勇博士表示,此次來凱醫藥在ESMO大會上分享的頂線數據,是公司兩個在研的核心創新藥物 -- 全球首個CYP17A1和CYP11B2雙靶點抑制劑和新一代小分子泛AKT激酶強效抑制劑afuresertib,在國際頂級學術會議上的一次重要進展匯報。“隨著上述兩個研究的推進,近三個月我們已經在入組患者中觀察到更鼓舞人心的結果,期待這些候選藥物能夠盡早惠及早期和晚期的前列腺癌患者。”
[1] II期患者招募預計在2021年四季度至2022年一季度開始 |
中國上海和美國新澤西2021年8月25日 /美通社/ -- 來凱醫藥宣布,繼6月19日獲得美國食品和藥物管理局(FDA)臨床批件之后,中國國家藥品監督管理局(CDE)也于8月17日批準了來凱醫藥該項新的臨床試驗:處于臨床開發階段的1類候選新藥afuresertib(LAE002)聯合抗雌激素藥物氟維司群,在標準治療失敗的局部晚期或轉移性在激素受體陽性/人表皮生長因子2受體陰性乳腺癌患者(下簡稱HR+/HER2-)的Ib/III期臨床試驗研究。
至此,這一全球多中心臨床研究比原計劃提前一個月在中美兩國同步啟動。此次快速批準也意味著:afuresertib聯合氟維司群聯合治療在Ib期研究中獲得了可靠的安全性數據后,可盡快展開3期全球注冊研究。
Afuresertib新藥臨床試驗覆蓋4個癌種
Afuresertib(LAE002)是來凱醫藥從諾華公司引進全球獨家權益、已有臨床驗證結果(Proof of Concept)的候選新藥,屬于新一代小分子泛AKT激酶強效抑制劑。
目前Afuresertib已在全球收獲4個癌種的臨床研究:覆蓋了卵巢癌,前列腺癌、三陰乳腺癌,HR+/HER2-乳腺癌。
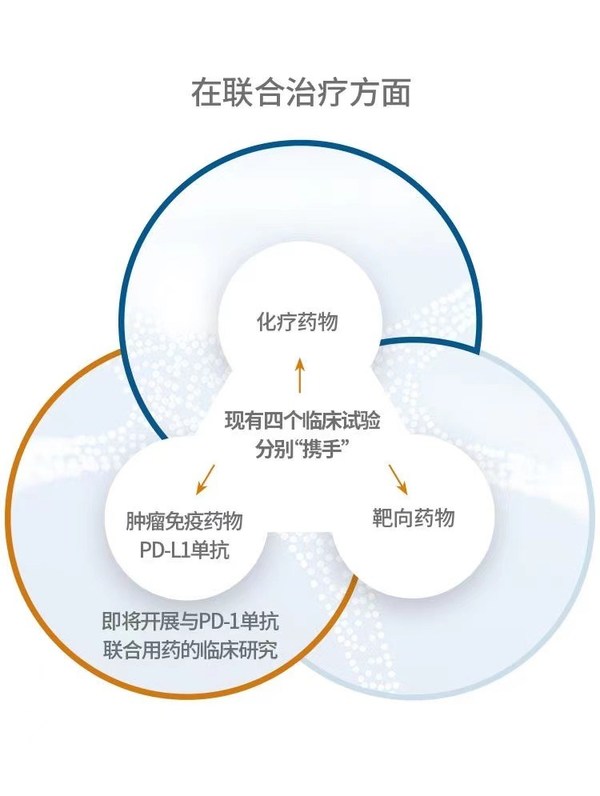
在聯合治療方面,現有四個臨床試驗分別“攜手”化療藥物、靶向藥物和腫瘤免疫藥物PD-L1單抗, 下一步afuresertib還將開展與PD-1單抗聯合用藥的臨床研究。
努力解決HR+/HER2-在乳腺癌耐藥需求
乳腺癌是全球女性中最常見的癌癥。在中國所有乳腺癌患者中,約62%屬于HR+/HER2-[1],美國患者中這一類分子亞型比例高達68%[2]。
盡管大多數此類乳腺癌患者最初可從一/二線治療的抗激素療法及CDK4/6 抑制劑或者化療中獲益,但一段時間后,大部分腫瘤患者可能對上述治療產生耐藥。腫瘤耐藥以后的治療選擇一直是乳腺癌各種臨床研究致力解決的難點之一。
“HR+/HER2-在乳腺癌患者中占比最大,抗激素治療及CDK4/6抑制劑耐藥以后的治療是目前最亟需解決的多種未滿足的醫療需求之一。這也是顯著提高乳腺癌患者治療效果及改善生活質量的最關鍵一環。”來凱醫藥首席醫學官岳勇博士表示:“女性是一個家庭的核心和希望,afuresertib多種聯合治療目前已在多種癌癥耐藥患者的臨床試驗中,初步顯示出抗腫瘤療效及良好的安全性,尤其是女性特有的卵巢癌和乳腺癌。我們期待這些聯合治療能夠給患者帶來新的希望,也讓醫生在面對這些難治的腫瘤耐藥患者時有更多更好的選擇。”
勇爭AKT酶抑制劑全球賽道“金牌”
“此次臨床批件比原計劃提前一個月獲批,充分顯示了中國國家藥品監督管理局的高效和對于乳腺癌耐藥以后新一代治療新藥的期待和重視。同時,也凸顯了來凱醫藥中美團隊的強大執行力,有望使乳腺癌患者更早受益于新藥。”來凱醫藥董事長兼CEO呂向陽博士表示,“在AKT酶抑制劑全球賽道上,來凱醫藥目前位于第一梯隊。我們正在加速推進多項臨床試驗,希望afuresertib有實力摘下全球‘同類首個’(first-in-class)的金牌。”
[1] Li, Z.S., et al., Breast cancer subtypes and survival in chinese women with operable primary breast cancer. Chin J Cancer Res, 2011. 23(2): p. 134-9.
[2] SEER Cancer Stat Facts: Female Breast Cancer Subtypes. National Cancer Institute. Bethesda, MD. Available from: https://seer.cancer.gov/statfacts/html/breast-subtypes.html
]]>這兩項研究分別是:
電子壁報1: CYP17A和CYP11B2雙靶點抑制劑(LAE001),在轉移性去勢抵抗型前列腺(mCRPC)癌患者中的 I 期研究
展示編號:597P
主要研究者及報告人:葉定偉教授(復旦大學前列腺腫瘤研究所所長)
這是一項多中心、開放性治療成年人轉移性去勢抵抗性前列腺癌的I期兩階段研究給藥,用于驗證在不聯用潑尼松的情況下,LAE001單藥的安全性和有效性以及與同類產品相比的優勢。
LAE001是全球首個 CYP17A和CYP11B2雙靶點抑制劑,是一種新型非甾體類、可逆、雙靶點、強效抑制劑。它可同時抑制 CYP17A1 和醛固酮合成酶 (CYP11B2),進而控制雄激素和醛固酮水平,因此無需和潑尼松合用。
來凱醫藥正加速LAE001單藥臨床研究,希望惠及早期前列腺癌患者。由于它無需和潑尼松合用,或可避免在現有阿比特龍治療標準中對潑尼松的依賴及其引發的副作用,有望提高患者的生存質量。
LAE001是全球首個 CYP17A和CYP11B2雙靶點抑制劑,是一種新型非甾體類、可逆、雙靶點、強效抑制劑。來凱醫藥正加速LAE001單藥臨床研究,希望惠及早期前列腺癌患者。由于它無需和潑尼松合用,或可避免在現有阿比特龍治療標準中對潑尼松的依賴及其引發的副作用,有望提高患者的生存質量。
電子壁報2:LAE001/潑尼松+ afuresertib(一種AKT抑制劑)聯合,在經二代抗雄激素治療耐藥、后線轉移性去勢抵抗型前列腺癌患者中的I/II期研究
展示編號:599P
報告人:Alberto Bessudo (Encinitas, CA, United States of America)
I期試驗為多中心、開放、劑量遞增研究,用于對先前接受過二代抗雄激素或化療這2種標準治療后疾病進展或不耐受抗雄激素的轉移性去勢抵抗型前列腺癌(mCRPC)患者,評估安全性并確定在 mCRPC 中 LAE001/潑尼松和 afuresertib 聯合治療的推薦 2 期劑量 (RP2D)。
產生抗藥性的晚期前列腺癌是最難治的癌癥之一,患者亟需更有效的創新藥物和療法。Afuresertib(LAE002)是處于臨床階段的1類候選新藥,屬于新一代小分子泛AKT激酶強效抑制劑。來凱醫藥第二項研究中展示的LAE001和afuresertib的聯合治療被寄予厚望。
以上信息請見ESMO官方網站https://cslide.ctimeetingtech.com/esmo2021/attendee/confcal_4/presentation/list?q=LAE001(注1)
注1:詳細信息將于2021年9月13日00時05分(歐洲中部夏令時)歐洲腫瘤醫學學會年會電子壁報發布
]]>