上海2023年6月1日 /美通社/ -- 隨著國家醫藥改革的逐步深入,醫藥政策法規日趨成熟。藥品上市必須遵循監管機構確立的規則體系,除了必要的注冊申報程序,新藥的立項更要建立在符合國家健康發展規劃的前提下,確立產品商業化路徑。這些都需要企業決策者有高屋建瓴的能力,全面了解國家藥物研發政策與法規體系。
為了助力廣大藥企立足中國,走向世界,2023年6月19-21日,第二十一屆世界制藥原料中國展"暨"第十六屆世界制藥機械、包裝設備與材料中國展"(CPHI & PMEC China 2023)將在上海新國際博覽中心強勢回歸,3,000余家國內外知名展商和55,000余人次海內外觀眾共襄盛舉。展前2天(6月17-18日),制藥在線網站旗下智藥研習社邀請到多位行業資深專家,在上海舉辦《國內藥物研發政策體系及符合中外GMP法規的迎檢策略研習會》及《MAH產品技術轉移管理方法與共線生產風險避讓對策研習會》。為制藥人創造線下學習行業新規、與有藥政機構工作背景的專家面對面交流的寶貴機會。歡迎大家報名參與,在上海度過充實難忘的制藥周。
研習會時間:2023年6月17-18日(周六、周日)
研習會形式:線下閉門會
國家藥物研發政策與法規體系
一、政策體系
1、國家健康發展規劃
2、產業政策
二、法規體系
1、相關法律
- 專利法、標準化法
- 藥品法、實施條例、中藥品種保護條例、麻醉藥品與精神藥品管理條例、反興奮劑條例
2、規范規章
- 藥品注冊管理辦法
- 上市許可持有人制度
- 臨床試驗默示許可
- 關聯審批審批
- 優先審評審批制度
- 藥品注冊申報資料
3、技術指南
- 藥品分類指導原則等
三、發展趨勢
中外GMP相關法規要求及如何準備現場檢查
一、國內藥品相關法規文件體系介紹
二、中國GMP及其附錄基本要求
三、國內近期發布的GMP相關法規指南介紹
- 藥品上市后變更管理辦法
- 藥品記錄與數據管理要求
- 藥品上市許可持有人落實藥品質量安全主體責任監督管理規定
- 藥品共線生產質量風險管理指南
四、FDA CGMP介紹
五、FDA常用指南
(生產質量相關,包括藥品CGMP問答、OOS檢驗結果調查、工藝驗證指南等)
六、EU GMP介紹
七、歐盟GMP無菌附錄基本要求
(如何制定無菌藥品污染控制策略CCS)
八、國外其它相關指導原則介紹
(包括ICH、PDA常用指南、ISPE常用指南、MHRA常用指南等)
九、如何準備中外GMP檢查
(包括審計前準備、策劃和安排、檢查注意事項等)
十、國內外GMP檢查常見缺陷及分析
- 中國GMP檢查
- FDA及歐盟檢查
本場研習會嘉賓講師是兩位教授級高級工程師高老師與牛萍老師。
高老師長期從事食品藥品安全監管技術和政策法規的研究,具有藥政機構工作背景。牛萍老師從事制藥行業質量管理和質量控制近三十年,參與了藥監局組織的"藥品生產驗證指南"、"藥品上市后風險管理計劃制定指南"、"清潔驗證指南"等書的編寫工作。
MAH 主體質量責任建立途徑與方法思考
一、《藥品上市許可人持有人落實藥品質量安全主體責任監督管理規定》文件分析與持有人主體責任識別
二、MAH持有人法規風險發生的來源
三、MAH持有人質量體系構成要素與運營管理模式
四、MAH持有人法規風險與藥品質量風險防范途徑及管理對策
- 質量體系建立與維護
- 委托生產管理
- 增值與符合性質量審計
- 關鍵人員的管理
MAH產品技術轉移管理方法與技術法規風險回避
一、 技術轉移的目標
二、 技術轉移類型與技術轉移工作范圍識別
三、 技術轉移工作流程
四、 技術轉移項目實施瓶頸與工作難點
五、 技術轉移工作案例分析
"共線生產"法規風險識別與風險避讓技術方法
一、 共線生產的意義與現狀
二、 國內外對"共線"認識的差異
- 中國與國外法規及指南的分析
- 中國與國外藥品生產管理的差異
- "共線"的本質與范圍
三、 "共線"質量風險類型與風險的評估
四、 共線生產風險回避的技術方法
- "共線"工廠設計
- "共線"設備選型
- 生產現場管理與生產過程控制
- 清潔程序設計與清潔驗證
本場研習會嘉賓講師是藥品法規與技術專家吳軍老師。吳老師是中國藥品生產與質量管理領域資深專家,在其三十多年的職業生涯中,從一線的維修工程師,到多家上市公司的技術顧問;從藥品生產質量課程培訓教學,到工廠整體規劃設計總設計師;從國家藥品相關法規起草工作,到創辦中國大學生制藥工程設計競賽等等,跨越了不同技術領域、工作角色的工作,游刃有余。
報名方式
研習會一報名鏈接:https://a-iiris.imsharecenter.com/h/p/122fb
研習會二報名鏈接:https://a-iiris.imsharecenter.com/h/p/0fdbe
博華加工包裝優選現已吸引500+優質品牌入駐,匯集15,000+海內外精選優品,涵蓋包裝機械、機器人與自動化、包裝材料與制品、標簽及軟包裝、物流包裝、包裝材料、給藥裝置、保健品包裝、食品加工機械、食品通用機械等全產業鏈細分品類,買家可搜索、瀏覽心儀的品牌或商品,在線一鍵對接,或者發布需求,匹配合作。
微信搜索“博華加工包裝優選”小程序,立即開啟線上商貿之旅。
云展示,云配對
博華加工包裝優選小程序致力于為源頭工廠、經銷商和代理商等打通多渠道銷售鏈路,幫助供應商和采購商建立聯系、挖掘商貿合作機會。
企業/品牌展示:展示企業實力與品牌形象,發布新產品信息,拓展線上貿易渠道
貿易撮合:海量貿易線索蓄勢待發,手機查詢應答輕松方便,讓生意跟著你走
四大亮點 讓對接更便捷
亮點一:海量優質品牌參與,打造加工包裝行業大規模線上云展會
亮點二:涵蓋全產業鏈產品及服務資源滿足眾多用戶需求
亮點三:包裝行業兩大展會全渠道強力推廣獲得行業流量曝光
亮點四:專業買家聚集地與潛在意向客戶一對一精準對接
三大流程 全程跟蹤服務
No.1 買家發布需求
根據采購需求填寫詳細的求購單, 等待賣家響應。
No.2 客服團隊人工配對
審核買家采購需求,根據需求精準匹配賣家,及時提醒賣家接收、回應。
No.3 賣家接收需求
第一時間獲取買家求購信息提醒,可直接聯系買家,商議采購需求。
【博華加工包裝優選】小程序持續為買賣雙方提供便捷的服務與溝通,助力買家與供應商在平臺上輕松尋找心儀產品、在線商貿合作等需求,實現高效貿易配對。
]]>上海2022年12月14日 /美通社/ -- 近年來,中國生物制品注冊申請受理量呈逐年增長趨勢,產品分類與對應的法規監管也逐步細化。為幫助制藥企業深入了解國內生物制品注冊相關法規、申報流程與常規策略、變更管理要點,加快生物制品注冊申報進程,CPHI制藥在線旗下智藥研習社將于2022年12月23-24日在線上舉辦《生物制品注冊法規及申報案例實操研習會》,通過具體的申報案例分析,務實地提升制藥學員在生物制品注冊申報方面的策略思路與撰寫技能,也會詳細講解如何做好生物制品的進口注冊。歡迎大家報名學習。
研習會主題:生物制品注冊法規及申報案例實操
研習會時間:2022年12月23-24日(周五、周六)
研習會形式:線上直播
研習會主要內容如下:
第一天分享:
第一章:生物制品注冊法規和臨床試驗申請
第1節:治療用生物制品法規介紹
第2節:生物制品注冊申報流程(包括受理審查,審評相關流程及其注意事項等)
第3節:臨床試驗申請的常規策略、主要考量點及申請的流程;
第4節:近年來臨床試驗申請分析,了解行業熱點;
第二章:臨床試驗期間變更和上市后變更管理法規及案例分享
第1節:臨床試驗期間變更及案例分析
第2節:上市后變更法規及案例分析
第三章:Pre-CTA/BLA溝通交流會議相關法規及經驗分享
第1節: 溝通交流相關的法規及常規的策略;
第2節:溝通交流會的流程;和資料的準備
第3節: 如何主持一個視頻或面對面溝通交流會;
第4節: 會議記要撰寫及注意事項;
第5節: 溝通交流注意事項、常見問題及小結(企業和監管);
第6節: 溝通交流現狀分析;
第二天分享:
第四章:進口生物制品注冊策略及申報資料準備案例分享
1、進口生物制品注冊策略的考量及案例分享
2、CTA申報資料常見問題及注意事項
3、NDA申報前的準備工作
4、進口藥品證明性文件相關要求
5、說明書撰寫的注意事項及考慮要點
6、質量標準與制造檢定規程的常見問題
7、橋接報告的撰寫考慮
希望以上這些內容能夠幫助到制藥公司高層、研發、注冊申報、QA、臨床等相關部門人員。
這次我們邀請到的嘉賓講師是思路迪醫藥藥政事務部總監徐娜與諾和諾德(中國)制藥有限公司注冊事務副總監汪旭。
徐老師曾就職于國內外大型藥企,擁有十幾年法規事務和醫藥研發相關經驗。主要負責中國、美國和歐盟的IND/BLA藥品注冊申報。根據現行法規指導藥品開發策略,關注法規動向,預測發展趨勢,為決策者和客戶提供前瞻性建議。基于風險評估現有的申報策略,為快速審批提供法規建議。制作高質量,符合藥監當局的申報文件;申報過程中支持來自中國、美國和歐洲等藥監當局的問題及其溝通。已獲得20多個藥品批件,包括生物制品和化藥。
汪老師曾在武田制藥及昆泰醫藥任職,擁有超過10年的生物制品及化藥全生命周期注冊事務經驗,負責的治療領域涵蓋內分泌、心血管、腫瘤、呼吸、免疫、中樞神經等。
報名方式
報名鏈接:https://jinshuju.net/f/OnWloG?x_field_1=MTS
會務費:線上:3500元/賬號(2個及以上賬號享8折優惠)
參會權益:學習資料1份、研討答疑、會務發票。
上海2022年8月11日 /美通社/ -- 中國加入國際人用藥品注冊技術協調會(ICH)后,藥物研發與注冊申報進一步與國際接軌,推動了中美雙報的發展。中美雙報已成為本土企業創新藥申報的新趨勢。要制定相對完善的申報策略,企業需要在申報過程中結合具體的產品特點、種族差異、以及中美法規監督部門對申報資料的要求等情況具體分析。實際操作過程中必然會遇到不少難點。為了幫助藥企解決中美雙報實操中的難點問題,提升應對策略,CPHI制藥在線旗下智藥研習社將于2022年8月26-27日在線上開展《中美雙報難點分析以及應對策略培訓會》,歡迎廣大制藥同仁踴躍報名參加。
培訓主題:中美雙報難點分析以及應對策略培訓會
培訓時間:2022年8月26日-27日(周五、周六)
培訓形式:線上直播
培訓會主要內容如下:
第一天分享:
中美藥品申報要求以及審評關注點;
法律法規體系異同及其背景原因分析;
法規體系的差異對藥品審批的影響及其應對策略;
中美監管對于新藥以及改良型新藥法規的要求以及審評關注點;
仿制藥審批以及橙皮書制定和使用的差異分析;
原輔包關聯審評以及DMF登記制度對行業的影響和應對;
中美溝通交流會議對比以及會議策略分析;
不同特殊審批途徑及其關注點;
CTD資料以及美國QbR解讀。
第二天分享:
中美雙報難點分析及其解決方案;
不同申報策略的分析以及挑戰;
申報受理的挑戰及其差異以及常見的拒絕受理的原因;
CMC要求的關注點,原因以及常見解決方案;
使用已有臨床數據減免臨床試驗的可行性分析;
中美溝通交流會申請的先后順序及其會議結論的影響;
特殊審評途徑的選擇策略;
上市后維護及其評估尺度的差異以及對應策略;
具體實際案例分析;
國際多中心臨床申報以及中國參與的策略;
同一原料藥支持中美不同劑型申報策略;
改良型新藥中美雙報尺度要求。
希望以上這些內容能夠幫助到藥品研發機構、制藥企業研發中心總經理、研發技術總監或高管;藥品注冊經理、法規負責人、質量總監或經理;研發QA;注冊申報人員、CRO公司等。
這次邀請到的講師Chris老師是資深藥政專家,藥企大中華區法規事務負責人。他從事法規事務工作十多年,分別在多個外資企業工作,主要負責進口藥品上市申請,進口藥品地產化等法規注冊工作,并且支持歐美注冊事務,熟悉FDA以及EMA注冊法規。多次參與藥品注冊法規和技術指導原則起草和討論。目前,講者主要負責公司在中國以及亞太地區業務的發展,進口制劑和原料藥在國內的注冊申報,地產產品的注冊維護。
報名方式
報名鏈接:https://jinshuju.net/f/tchI54?x_field_1=MTS
參會權益:紙質培訓資料1份、研討答疑、會務發票。
聯系方式:
TEL:陳女士17317575983(同微信)
上海2022年8月11日 /美通社/ -- 隨著國內《藥品管理法》及配套法規的持續完善,無菌企業所承受的合規壓力越來越大。而且,中國NMPA已經啟動加入PIC/S試點工作,中國藥政體系和國際接軌的步伐持續加快。由歐盟牽頭,WHO和PIC/S參加修訂的EU GMP附錄1,是國際無菌制藥行業的關鍵法規之一。這部法規的修訂和實施,必將對國內外無菌制藥行業產生深遠影響。伴隨中國創新藥的持續快速發展,很多研發創新型藥企的管理團隊面臨即將到來的無菌廠房建設、無菌管控體系建設、無菌CDMO選擇等關鍵問題。為此,制藥在線旗下的智藥研習社于8月23-24日線上舉辦《無菌制藥企業管理體系建設和維護培訓會》,邀請資深GMP專家丁恩峰老師,對無菌企業管理體系構建進行全盤解析,以促進行業對相關關鍵問題的認識和理解。
培訓主題:無菌制藥企業管理體系建設和維護培訓會
培訓時間:2022年8月23日-24日(周二、周三)
培訓形式:線上直播(騰訊會議)
培訓會主要內容如下:
第一天分享:
1、無菌企業的組織架構和人員素質要求(潔凈服選擇、材質測試、更衣確認等);
2、無菌企業的PQS建設特點;
3、無菌企業的廠房布局和設計-法規要求(EU GMP附錄1最新要求解析、FDA無菌指南解析);
4、無菌企業的廠房布局和設計-實施案例(人流通道、物料通道、關鍵區域設計、輔助區域設計、VHP消毒工藝驗證技術要求);
5、無菌企業的倉儲設計(EU GMP附錄1最新要求解析、FDA無菌指南解析、實際實施案例);
6、無菌企業的設備選型-法規要求(EU GMP附錄1最新要求解析、FDA無菌指南解析);
7、無菌企業的關鍵公用系統-無菌真空、無菌工藝工藝用氣、無菌CIP系統(EU GMP附錄1最新要求解析、FDA無菌指南解析、實際實施案例)。
第二天分享:
1、無菌企業的組織架構和人員素質要求(潔凈服選擇、材質測試、更衣確認等);
2、無菌企業的PQS建設特點;
3、無菌企業的廠房布局和設計-法規要求(EU GMP附錄1最新要求解析、FDA無菌指南解析);
4、無菌企業的廠房布局和設計-實施案例(人流通道、物料通道、關鍵區域設計、輔助區域設計、VHP消毒工藝驗證技術要求);
5、無菌企業的倉儲設計(EU GMP附錄1最新要求解析、FDA無菌指南解析、實際實施案例);
6、無菌企業的設備選型-法規要求(EU GMP附錄1最新要求解析、FDA無菌指南解析);
7、無菌企業的關鍵公用系統-無菌真空、無菌工藝工藝用氣、無菌CIP系統(EU GMP附錄1最新要求解析、FDA無菌指南解析、實際實施案例)。
這次邀請到的講師丁恩峰老師是國內GMP和藥品法規資深咨詢師,同時也是ISPE、PDA、ECA會員,國家藥監局高級研修院特聘講師,高級工程師。中國首家集團類型MAH的QP,對于MAH法規和實踐,具有豐富工作經驗。
報名方式
報名鏈接:https://jinshuju.net/f/G5DVdc?x_field_1=MTS
參會權益:紙質培訓資料1份、研討答疑、會務發票。
聯系方式:
TEL:陳女士17317575983(同微信)
郵箱:belle.chen@imsinoexpo.com
本屆金筆獎征文評選活動設立"金筆獎 -- 我喜愛的制藥原創文章"金獎、銀獎、銅獎三大獎項,表彰與鼓勵堅持原創、樂于分享、并廣受業內人士喜愛的制藥撰稿人。獲獎作者將獲得豐厚獎金與行業學習資源。
即日起,金筆獎征文活動報名正式開啟,歡迎廣大制藥人踴躍投稿。
金筆獎征文要求:
1、以個人名義參與,投稿作品主題不限,必須圍繞制藥行業進行深度分析,中文原創寫作,且內容科學真實嚴謹,有學術依據與自己的獨立觀點評論,字數2000字以上,最好配有1-4 幅與內容相關的原創圖表。
2、文章若有引用參考文獻和數據,需在文末列明出處,拒絕純編譯文章。
3、投稿文章必須從未在任何其他平臺發布過,拒絕一稿多投和任何形式的宣傳軟文。
4、如有任何入圍或獲獎文章違反上述原則,一經查實,取消評選資格。
5、投稿文章一經接受及發布, 版權歸CPhI制藥在線所有。
金筆獎獎項設置:
我喜愛的制藥原創文章
金獎1名 - 獎金2000元
銀獎1名 - 獎金1500元
銅獎1名 - 獎金1000元
*20位入圍作者可獲得:豐厚稿酬+智藥研習社價值598元會員年卡1張+電子證書。
*金、銀、銅獎得主除了以上這些還將擁有獎牌一座留念榮譽時刻。
金筆獎評選規則:
1、線上征文,金筆獎組委會評審在投稿作品中選出20篇入圍作品。
2、入圍作品的作者與CPhI制藥在線簽約后,作品均可按照本平臺稿費標準支付稿酬。稿費根據文章發布后7天內微信閱讀量,金額在300元-2000元之間。
3、入圍作品在CPhI制藥在線訂閱號全部展示完畢后,作品發布之日起7天內微信閱讀量排名前十的文章進入投票環節。
4、投票階段,十篇入圍作品根據8天內微信投票排名確定"金筆獎 -- 我喜愛的制藥原創文章"金獎、銀獎、銅獎名次。
金筆獎2022活動進程:
【報名階段】
即日起至7月29日:
面向制藥行業征集金筆獎原創文章。
【作品展示】
8月8日-8月18日:
公布入圍作品名單,入圍文章將在CPhI制藥在線微信公眾號分批展示。
【投票階段】
8月26日-9月2日:
入圍作品發布之日起7天內微信閱讀量排名前十的文章進入為期8天的微信投票環節。
【獲獎名單】
9月5日-9月30日:
根據統計結果,線上全媒體平臺公布2022金筆獎獲獎名單。
【分享交流】
2022年第四季度:
線上或線下舉辦金筆獎作者沙龍,獲獎寫手與行業專家共聚一堂,交流分享行業心得。
]]>活動亮點
八大定制化服務,提供一站式解決方案
多渠道資源整合, 品牌強勢曝光
制藥在線通過整合CPhI & P-MEC China品牌展會資源以及自身的網站平臺、微信公眾號、視頻號、社群、EDM數據庫、搜索引擎等多種渠道,讓企業品牌得到更大程度的曝光,助力更多藥企發掘更多商機。
精準定位,深度觸達目標人群
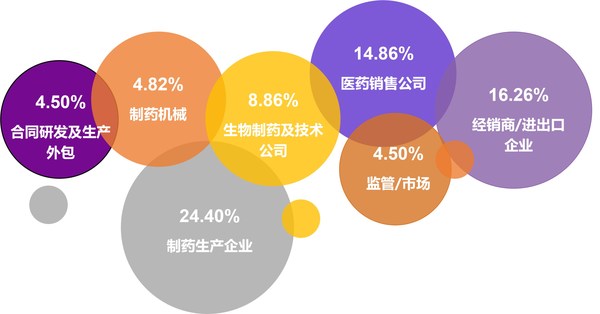
制藥在線深耕制藥行業十余年,積累了龐大的用戶資源,其中75%以上的用戶來自公司決策圈,業務范圍覆蓋制藥整個工業鏈,本次"云上招商季"活動除了能夠滿足品牌曝光之外,也將通過8大個性化活動,協助藥企精準觸達目標人群,高效鏈接客戶資源。
更多精彩內容,盡在藥企云上招商季;
活動期間,參與活動,盡享多重優惠。
培訓會一:ICH創新藥中美雙報與國內注冊實操培訓會
培訓時間:2022年3月17日-18日
培訓地點:上海(具體地址另行通知)
早鳥價:2500元/人 (截止:3月10日) 團購價:3人同行,八折優惠。
課程大綱:
Day 1(3月17日)
講師:Chris老師
國內藥品注冊策略與CTD資料撰寫實操
- 我國法規改革趨勢介紹
- 新藥品注冊分類簡析及異同比較
- 臨床急需藥品注冊策略以及注冊制度討論
- 原輔包共同審評審批系列政策討論
- 上市許可持有人MAH系列制度討論
- 仿制藥一致性評價政策研究
- CTD資料撰寫以及具體實際操作
- 答疑互動
Day 2(3月18日)
講師:張丹博
基于ICH法規的創新藥中美雙報
一、中國及全球監管環境總覽
二、ICH(國際人用藥品注冊技術協調會)介紹
- ICH的背景及法規組成
- 中國加入ICH后藥品審評審批政策的變化
三、 創新藥中美雙報
- 中、美藥品上市申報政策對中外聯合臨床開發的指導意義
- 藥品開發成功后,應如何進行中美雙報
- 如何規劃產品在未來的中美雙報
四、新法規下,如何加快藥品上市路徑、實現國際化?
- 國產藥如何加快上市、走向世界及相關案例解析
- 特殊時期審評審批政策的變化及藥品上市案例解析
五、互動環節
- 由老師提出問題,學員探討
- Q&A
講師簡介:
張丹博士
俄羅斯工程院院士
中國醫藥創新促進會理事
“十三·五”重大新藥創制計劃責任專家
國際ICH E19 IFPMA專家委員會組長
NMPA ICH工作組專家
張博士是中國醫藥創新促進會理事,曾任中國醫藥創新促進會藥物研發專業委員會主任委員,現任創新研發服務專業委員會副主任委員。曾任美中生物醫藥科技協會(CBA)會長,美中藥物專業協會(SAPA)執行董事,百華協會(Bayhelix)董事。現任國家“十三·五”重大新藥創制計劃責任專家,并參與國家藥品監督管理局藥審中心的技術指南制訂和新藥臨床評審及藥審人員培訓工作。目前擔任國際ICH E19 IFPMA專家委員會組長,NMPA ICH工作組專家。
Chris老師
多次參與藥品注冊法規和技術指導原則起草和討論
在跨國企業負責進口藥品上市申請
講者從事法規事務工作十多年,分別在多個外資企業工作,主要負責進口藥品上市申請,進口藥品地產化等法規注冊工作,并且支持歐美注冊事務,熟悉FDA以及EMA注冊法規。目前,講者主要負責公司在中國以及亞太地區業務的發展,進口制劑和原料藥在國內的注冊申報,地產產品的注冊維護。
培訓會二:MAH委托生產與技術轉移培訓會
培訓時間:2022年3月17日—18日
培訓地點:上海
早鳥價:2500元/人 (截止:3月10日) 團購價:3人同行,八折優惠。
課程大綱:
Day1
3月17日 主講:丁老師
一、中國原料藥關聯審評政策最新解析
二、中國原料藥工藝變更管理
三、美國DMF指南要點解析
四、美國原料藥變更指南解析
五、CEP申報資料撰寫要點
六、技術轉移專題(轉移方案撰寫、轉移報告撰寫、技術溝通會議召開、物料和文件準備、如果評估硬件差異、技術轉移接受標準確定、技術轉移責任劃分等)
Day2
3月18日 主講:牛老師
主題一:MAH制度及法規要求
一、藥品管理法及相關法規對MAH的要求
二、美國、歐盟和日本MAH制度介紹
三、需要關注的一些陸續配套出臺的法規文件
四、MAH制度的實施對制藥行業有什么影響
主題二:藥品上市后的變更管理
一、變更控制在整個供應鏈和產品生命周期中的應用
二、持有人變更管理
三、藥品生產場地變更管理
四、委托生產如何進行變更控制
主題三:MAH自行生產藥品的管理
一、根據新的法規要求完善質量體系文件
二、質量風險管理及藥品上市后風險管理計劃的制定
三、如何建立年度報告制度
主題四:藥品委托生產(CDMO)的管理
一、國內外相關法規和指南要求
二、受托方評估、審計和選定
三、持有人和受托人的責任與義務
四、藥品委托生產質量協議內容要求
五、質量體系日常監管
六、產品出廠放行和上市放行
主題五:技術轉移
一、什么是技術轉移
二、技術轉移在整個產品生命周期中的重要性
三、國內外相關法規指南要求
四、技術轉移流程介紹(制定計劃、準備階段、執行和確認、許可和生產以及關閉階段)
五、技術轉移中質量風險管理的應用
六、技術轉移案例分析
七、技術轉移常見問題
講師簡介:
丁恩峰 老師
國內GMP和藥品法規資深咨詢師
曾在跨國企業擔任國際藥品注冊和GMP審計工作,參與我國新版GMP的編寫和修訂工作。作為世界衛生組織(WHO)聘請的顧問,經常參加國際GMP專家組對國內企業的國際GMP審計和指導工作,對我國制藥企業當前存在的質量管理問題有全面的了解。具有20多年藥品研發注冊及生產質量管理的實踐經驗,多次參加過FDA 、WHO、TGA和CEP認證及國內的檢查,具有豐富的分析問題和解決問題的實戰經驗。
牛萍老師
制藥工程碩士、高級工程師(教授級)
質量與合規高級顧問
牛萍老師,制藥工程碩士,執業藥師,高級工程師(教授級),從事制藥行業質量管理和質量控制近三十多。曾在國內著名的制藥企業西安楊森,雅培制藥和揚子江制藥公司擔任QA/QC、質管部部長和質量總監等職。多次赴美國及歐盟國家參加國際先進的質量管理培訓和學術研討會,具有豐富的藥品質量保證和質量管理經驗。
多次接受國內GMP檢查和美國FDA檢查,并獲得優異成績。曾赴荷蘭和法國制藥工廠,協助中國藥監局完成海外GMP檢查。參與了國家藥品監督管理局組織的“藥品生產驗證指南”一書的編寫工作。主持完成了多個制藥行業大型項目,包括藥品質量標準研究提升、BPCS/SAP/ERP 系統安裝及計算機系統驗證、藥品質量一致性評價、技術轉移等。應邀進行過多次GMP相關課程的授課,包括對GMP檢查員的培訓。
報名咨詢:
張女士 17317575983(同微信)
Carina.Zhang@imsinoexpo.com
本屆征文評選,更側重網友對文章的喜愛度,16篇入圍作品通過8天的微信投票,角逐“金筆獎-我喜愛的制藥原創文章”金獎1名(獎金2000元)、銀獎2名(獎金1500元)、銅獎3名(獎金1000元)。
在超萬名制藥人的投票支持下,最終評選出的“金筆獎-我喜愛的制藥原創文章”金、銀、銅獎的榮譽屬于如下六位撰稿人。感謝所有參與金筆獎征文活動的撰稿人以及更多在制藥行業各個內容平臺筆耕不輟、熱忱分享的寫手們。是他們讓制藥行業信息更透明更多元、讓思考的火花更燦爛更炙熱。歡迎越來越多專業人士加入內容創作者的行列。
(以下排名不分先后)
撰稿人:@山東風輕
金筆獎金獎獲得者
起始于2018年的國家集中帶量采購,已經歷了五批六輪,涉及218個品種,平均降價在54%。與以往的藥品招標相比,帶量采購可以給藥品生產企業明確的銷售承諾和預期,通過設定質量標準和采購數量,推動藥品行業轉型升級,通過量價掛鉤、及時回款規范流通秩序、凈化行業生態,從而給出更優惠的價格,讓利患者,確保藥品和醫用耗材降價后群眾買得到、用得起。
作者簡介:山東風輕,國家級人力資源技師,從事醫藥行業工作15年,擅長醫藥政策剖析、解讀,是醫藥經濟報、E藥經理人特約作者。
2、《走入尋常百姓家的“王室病”,關注國內凝血因子類藥物的市場格局》
撰稿人:@小藥丸
金筆獎銅獎獲得者
近年來,我國血友病治療取得了長足的進步,但由于血友病是需要終生治療的疾病,在長期治療過程中,藥物治療的安全、有效及經濟可負擔是廣大血友病患者對于治療的主要訴求。同時,中國血制品消費市場結構與全球血制品市場結構存在巨大差異,在凝血因子類產品方面的差異也較為明顯。
作者簡介:小藥丸,制藥行業從業者,自媒體時代的文字搬運工,專注于制藥圈內的陰晴冷暖。
撰稿人:@李成剛
金筆獎銅獎獲得者
QBD即質量源于設計的理念提出已經多年,但在實際工作中,往往還存在著把質量問題歸咎于分析檢測的情況。隨著轟轟烈烈的一致性評價開展,制劑人員更應該堅持QBD的理念。本文以苯磺酸氨氯地平片(絡活喜)、阿托伐他汀鈣氨氯地平復方片(多達一)、奧美沙坦酯氨氯地平片(思衛卡)為例,對比了苯磺酸氨氯地平單方片和復方片的處方和工藝,發現無論是單方片還是復方片,為提高苯環酸氨氯地平的穩定性,對氨氯地平的處理均采用了相似處理工藝,體現了QBD的理念。
作者簡介:李成剛,南京中醫藥大學研二藥學研究生,讀研前有4年藥品研發經驗,負責過一致性評價中阿托伐他汀鈣氨氯地平片、奧美沙坦酯氨氯地平片、鹽酸氯丙嗪片、諾氟沙星片的制劑研發工作,取得執業藥師資格,授權專利5件,讀研期間獲得了國獎獎學金。
4、《新形勢下,藥企有哪些藥品流通行業高質量發展政策需關注?》
撰稿人:@滴水司南
針對藥品現代物流企業的準入條件及業務開展標準,國內多個省市在國家政策的指導下,出臺了多個地方性相關指導文件。本文梳理了國內藥品現代物流的相關政策。
作者簡介:滴水司南,男,生物醫藥高級工程師,立足于生物醫藥行業質量管理工作,專注于生物醫藥產業。
撰稿人:@小米蟲
金筆獎銅獎獲得者
人參及其有效成分和人參復方制劑可以作為免疫雙向調節劑,通過免疫器官、免疫細胞及細胞因子等多種途徑發揮免疫調節作用,對免疫異常的機體具有修復作用。中醫臨床常用人參作為君藥配伍組成復方制劑調節癌癥患者化療后機體免疫力低下,增強患者免疫功能
作者簡介:小米蟲,藥品質量研究工作者,長期致力于藥品質量研究及藥品分析方法驗證工作,現就職于國內某大型藥物研發公司,從事藥品檢驗分析及分析方法驗證。
撰稿人:@小泥沙
金筆獎銀獎獲得者
間充質干細胞(mesenchymal stem cells,MSCs)是一類起源于中胚層的具有自我更新與多向分化潛能的成體干細胞,其來源主要包括骨髓、臍帶、臍帶血、胎盤、牙髓、脂肪組織、肝臟和肺等。MSCs 具有很強的自我更新能力,其免疫原性較低且排異反應小,在干細胞移植和治療研究領域更有優勢。
作者簡介:小泥沙,食品科技工作者,現就職于國內某大型藥物研發公司,從事營養食品及功能性食品的開發與研究。
7、《制藥企業,合規管理,勢在必行!》
撰稿人:@老陳
自從2011年開始實施《藥品生產質量管理規范(2010年修訂)》以來,制藥行業的法律法規、規章制度、指導原則等越來越多,對制藥企業的要求越來越細,越來越具體。正如“規范”所言,藥品監管法律制度體系“四梁八柱”已基本搭建完成,“兩法兩條例”配套規章和行政規范性文件等文件不斷制定和修訂。這些要求不斷將那些不合規、產品質量不過關的企業淘汰出局,讓合法合規的制藥企業越來越健康,并提供安全、有效的藥品。現有的制藥企業,要做到長期存在,就必須合規管理。
作者簡介:老陳,質量管理專家,從事食品與制藥行業質量管理和質量控制相關工作近二十年,歷任QA主管、質量部長、質量經理和生產廠長等職。在國內著名的跨國明膠企業負責質量和食品安全管理體系管理工作。
撰稿人:@zhulikou431
為了應對新冠疫情以來全球經濟的復雜局面,世界各國藥政機構和行業團隊紛紛探索和發布遠程審計的政策和指南。本文對于上述關鍵政策和指南進行匯總分析,希望有助于國內制藥行業的相關工作開展。
作者簡介:zhulikou431,高級工程師、PDA會員、ISPE會員、ECA會員、PQRI會員、資深無菌GMP專家,在無菌工藝開發和驗證、藥品研發和注冊、CTD文件撰寫和審核、法規審計、國際認證、國際注冊、質量體系建設與維護領域,以及無菌檢驗、環境監控等領域皆具有較深造詣。近幾年開始著力關注制藥宏觀領域趨勢分析和制藥企業并購項目的風險管理工作。
9、《從3個定點生產試點到57個信息監控:短缺藥干預管理的變化史》
撰稿人:@蘇亦
國家臨床必需易短缺藥品重點監測清單的57個產品基本涵括了國內目前短缺的藥品。短缺藥品有加快審評審批的政策,但是目前國內已上市的啟動一致性和仿制藥以新注冊分類申報的并不多。短缺藥如果中標價格合理的話,理應會有企業愿意投入研發短缺藥,久未生產的企業預計也愿意恢復生產。
作者簡介:蘇亦,10年醫藥從業經驗,從事醫藥市場及商務拓展工作,《醫藥經濟報》特約作者。
10、《中國創新藥發展的千重山》
撰稿人:@渺渺
金筆獎銀獎獲得者
21世紀是生物的世紀,這句曾被廣大學子戲稱為永不到來的時代一時間似乎已經就在人們眼前了。然而,中國的創新藥走到了哪一步?生物醫藥的爆發期又將會持續多久?醫藥人真的就此迎來了黃金年代嗎?
作者簡介:渺渺,碩士就讀于倫敦大學學院藥物發現專業,畢業后從事藥包材相容性工作,先后參與了多項產品申報工作,涉及國內主流的化藥、生物藥。后續轉行從事醫藥咨詢工作,利用過去積累的項目經驗、行業研究助力中國醫藥企業發展。
11、《百年滄桑歷程醫藥健康發展》
撰稿人:@張同學
2021年中國**黨成立100周年,回顧過去100年的歷史,中國醫藥經過百年滄桑歷程,風雨兼程。展望未來,中國醫藥事業將蓬勃發展,開創歷史新局面。醫藥事業的發展,也讓我們見證了中國的強大和厚積薄發的力量所在。
作者簡介:張同學,現居新疆烏魯木齊,擁有25年的工作經歷,先后從事衛生教學,一次性醫療器械生產管理;藥品生產/保健食品;化妝品,消毒產品,固體飲料食品的研發,生產/質量/工程建設/GMP認證等工作。
12、《最近一次飛行檢查后,質量人的思考》
撰稿人:@A001
現在的GMP檢查中,檢查方式不局限于常規檢查了,也已轉變成飛檢常態化了,就是要求大家對于日常的質量管理保持持續合規狀態,無論何時來檢查,現場的狀態應該都是一樣的。有時,檢查老師也會使用一些“特殊”的檢查手段,利用一些我們想象不到的方法,出奇制勝。在迎接GMP檢查這場“交鋒”中,這種方式往往能得到真實的答案。
作者簡介:A001,一名走在制藥路上的小奮青,從事制劑生產質量管理,扎根現場十二年,質量體系的踐行者與監督者。
13、《何以止禿?脫發藥物發展現狀分析》
撰稿人:@木芘
近日,開拓藥業宣布其自主研發的雄激素受體拮抗劑福瑞他恩(KX-826)治療女性雄激素性脫發(AGA)患者的中國II期臨床試驗完成首例患者入組及給藥,這一消息再次引起人們對于脫發治療藥物的熱議。
作者簡介:木芘,臨研行業,文字愛好者,愛熱鬧的小書蟲。
14、《RNAi療法:新興技術發展迅速,未來可期》
撰稿人:@醫藥Max
全球范圍內已有四款RNAi療法ONPATTRO® (patisiran)、GIVLAARI® (givosiran)、OXLUMO? (lumasiran)、Leqvio®(inclisiran)獲批上市。隨著近年來RNAi療法獲批上市速度的加快,RNAi療法熱度逐漸興起,越來越多企業開始布局這一領域。
作者簡介:醫藥Max,醫藥行業從業者,主要從事新藥臨床試驗開發工作,熟悉新藥開發動態。
15、《重組人生長激素給藥系統的研究進展》
撰稿人:@沙羅
作為一種多肽分子,rhGH存在穩定性差、易失活或分解、體內半衰期短等問題。目前臨床使用的rhGH凍干粉針制劑或水針制劑均需長期頻繁皮下或肌肉注射給藥,注射部位常出現疼痛紅腫、皮下硬結和脂肪萎縮等副作用。在制劑生產和運輸過程中,rhGH分子也容易受不當干燥方式和路途顛簸等因素的影響而失去藥物活性。因此,開發新型rhGH給藥系統有著極其重要的研究意義和臨床價值。
作者簡介:沙羅,中藥研發工作者,現就職于國內某大型藥物研發公司,致力于中藥新藥的研究開發。
16、《縱觀近四年已獲批的國產原創新藥:獲批數量逐年攀升,PD-1、EGFR、PARP、BTK靶點競爭激烈》
撰稿人:@憶
近年來,我國藥企研發實力不斷增強。據不完全統計,2018年至2021年前三季度NMPA共批準50款國產原創新藥,其中小分子化藥(37款)占了一半以上。值得一提的時,這幾年NMPA每年批準的新藥數量整體保持增加趨勢,其中2021年前三季度獲批的新藥數量就超過了2020年。 作者簡介:憶,醫院藥師,關注國內外新藥研發動態,期望在不斷的輸入和輸出中提升自己,和醫藥自媒體共同成長。
]]>CPhI制藥在線為了幫助國產藥加快藥品上市路徑并實現國際化,特舉辦《ICH創新藥中美雙報與國內注冊實操培訓會》,邀請行業內資深藥品注冊專家張丹博士與Chris老師對中外聯合臨床開發、中美雙報策略與注冊資料實操進行深度解析,并配合實際案例講解,歡迎廣大藥企相關負責人報名學習。
培訓會安排:
培訓主題:ICH創新藥中美雙報與國內注冊實操培訓會
培訓時間:2021年11月25日-26日(周四、周五)
培訓地點:上海(具體地址定向通知報名人員)
培訓大綱:
11月25日主講:Chris老師
國內藥品注冊策略與CTD資料撰寫實操
1、我國藥品法規改革趨勢介紹;
2、新藥品注冊分類簡析及異同比較;
3、臨床急需藥品注冊策略以及注冊制度討論;
4、原輔包共同審評審批系列政策討論;
5、上市許可持有人MAH系列制度討論;
6、仿制藥一致性評價政策研究;
7、CTD資料撰寫以及具體實際操作;
8、答疑互動。
11月26日主講:張丹老師
基于ICH法規的創新藥中美雙報專題培訓
一、中國及全球監管環境總覽
二、ICH(國際人用藥品注冊技術協調會)介紹
1. ICH的背景及法規組成
2. 中國加入ICH后藥品審評審批政策的變化
三、 創新藥中美雙報
1. 中、美藥品上市申報政策對中外聯合臨床開發的指導意義
2. 藥品開發成功后,應如何進行中美雙報
3. 如何規劃產品在未來的中美雙報
四、新法規下,如何加快藥品上市路徑、實現國際化?
1、國產藥如何加快上市、走向世界及相關案例解析
2、特殊時期審評審批政策的變化及藥品上市案例解析
五、互動環節
1、由老師提出問題,學員探討
2、Q&A
學習目的:
1、全面了解中國及全球藥品監管環境;
2、深刻理解中國加入ICH后藥品審評審批政策的變化;
3、通過法規解讀與實戰案例,學習中美雙報從臨床開發到申報上市的策略要點;
4、了解原輔包共同審評審批重點要求;
5、學習CTD資料撰寫以及具體實際操作。
參加對象:
藥品研發機構、制藥企業研發中心總經理、研發技術總監或高管;藥品注冊經理、法規負責人、質量總監或經理;研發QA;注冊申報人員、CRO公司等。
講師簡介:
張丹老師
俄羅斯工程院院士
“十三·五”重大新藥創制計劃責任專家
國際ICH E19 IFPMA專家委員會組長
NMPA ICH工作組專家
知名藥企聯合創始人兼首席戰略官
張博士曾任美中生物醫藥科技協會(CBA)會長,美中藥物專業協會(SAPA)執行董事,百華協會(Bayhelix)董事。現任國家“十三·五”重大新藥創制計劃責任專家,并參與國家藥品監督管理局藥審中心的技術指南制訂和新藥臨床評審及藥審人員培訓工作。目前擔任國際ICH E19 IFPMA專家委員會組長,NMPA ICH工作組專家。
Chris老師
從事法規事務工作十多年,分別在多個外資企業工作,主要負責進口藥品上市申請,進口藥品地產化等法規注冊工作,并且支持歐美注冊事務,熟悉FDA以及EMA注冊法規。多次參與藥品注冊法規和技術指導原則起草和討論。目前,講者主要負責公司在中國以及亞太地區業務的發展,進口制劑和原料藥在國內的注冊申報,地產產品的注冊維護。
報名信息:
1、會議形式:線下實地培訓
2、會務費:3000元
早鳥價:2500元 /人(截止到11月19日)
團購價:3人同行, 8折優惠
*購買智藥商學院VIP會員可免費參會
3、發票:
線下會議:發票將在會議結束后統一安排開票并郵寄。
4、參會權益:
培訓資料、現場研討、午餐、會務發票。
報名咨詢:
]]>CPhI制藥在線始終堅持構建制藥行業知識分享生態圈,為鼓勵筆耕不綴的制藥行業原創撰稿人,CPhI制藥在線聯合“制藥行業原創內容平臺聯盟”舉辦第四屆制藥原創文章金筆獎(簡稱“金筆獎”),旨在通過“我喜愛的原創文章”評選,為行業貢獻出更多的原創精品,讓專家撰稿人有更多綻放光彩的展示舞臺。
本屆金筆獎征文評選活動設立“金筆獎--我喜愛的原創文章”金獎、銀獎、銅獎三大獎項,表彰與鼓勵堅持原創、樂于分享、并廣受業內人士喜愛的制藥撰稿人們。獲獎作者將獲得豐厚獎金與行業資源。同時,此次評選特設“慧眼伯樂獎”,獎勵為制藥原創內容平臺推薦優秀撰稿人的伯樂們。
即日起,金筆獎征文報名正式開啟,歡迎廣大制藥人踴躍投稿。
金筆獎征文要求:
1、以個人名義參與,投稿作品主題不限,必須圍繞制藥行業進行深度分析。中文原創寫作,且內容科學真實嚴謹,有學術依據與自己的獨立觀點評論,字數2000字以上,最好配有1-4 幅與內容相關的原創圖表。
2、文章若有引用參考文獻和數據,需在文末列明出處,拒絕純編譯文章。
3、投稿文章必須從未在任何其他平臺發布過,拒絕一稿多投和任何形式的軟文。
4、如有任何入圍與獲獎文章違反上述規則,一經查實,取消評選資格。
5、投稿文章一經接受及發布,版權歸CPhI制藥在線所有。
本屆金筆獎獎金池+制藥在線平臺稿費,累計稿酬獎勵達到萬元以上。
金筆獎獎項設置:
主獎項
我喜愛的原創文章金獎1名 -- 獎金2000元
我喜愛的原創文章銀獎2名 -- 獎金1500元
我喜愛的原創文章銅獎3名 -- 獎金1000元
特別獎
慧眼伯樂獎 -- 獎金500元
金筆獎評選規則:
1、線上征文,金筆獎組委會在投稿作品中選出16篇入圍作品。
2、入圍作品的作者與CPhI制藥在線簽約后,作品均可按照本平臺稿費標準支付稿酬。稿費根據文章發布之日起7天內微信閱讀量,金額在300元~2000元之間。
3、入圍文章在CPhI制藥在線公眾號分批展示完畢后,統一進入投票環節。根據投票正式啟動之日起8天內微信投票排名確定“金筆獎--我喜愛的原創文章”金、銀、銅獎獲獎人。
4、評選過程嚴禁任何形式的惡意刷票刷量,違反將取消評選資格。
5、慧眼伯樂獎入圍條件:推薦新撰稿人參賽,如果其推薦的撰稿人摘得本次金筆獎金銀銅獎任一名次,推薦人即可獲得慧眼伯樂獎,推薦人不參與金筆獎征文,且也需是醫藥行業人士。
心動不如行動。也歡迎大家推薦身邊愛寫稿、愛分享的制藥人來參與活動,一起為制藥內容生態圈貢獻優質內容。
]]>整合“互聯網+展會”資源,構筑一站式O2O商貿平臺
2010年9月,“制藥在線”在互聯網浪潮的推動下應運而生,與品牌展會 -- 世界制藥原料中國展(CPhI China)線上線下深度融合,共同致力于促進海內外藥企之間的全球貿易往來。特別是在2020年,在全球抗疫的大背景下,“制藥在線”利用展會及其自身的資源和渠道優勢,雙方強強聯手,打造了兩屆Virtual Expo Connect 線上展會(簡稱VEC),通過網絡為參展企業與海內外觀眾架起溝通的橋梁,加強國際醫藥行業之間的合作。
提供精準配對服務,搭建供需對接平臺
自2011年以來,“制藥在線”已成功舉辦十屆買家采購會,通過在展會現場提供便捷高效的對接服務,幫助買家提升采購效率,助力買賣雙方收獲商機。
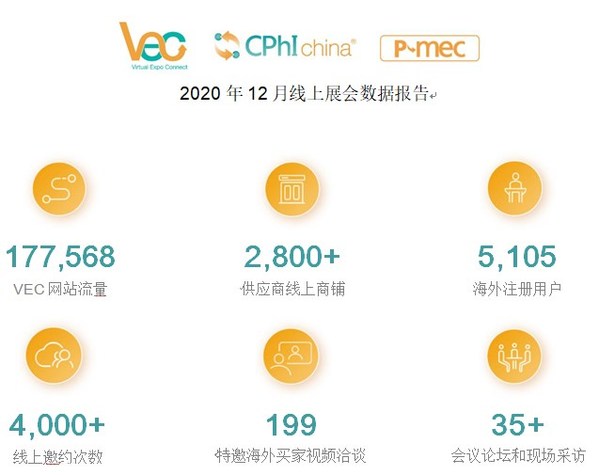
尤其在CPhI China 2020 現場,“制藥在線”攜手展會主辦方共同舉辦了一系列線上線下對接活動,例如:第十屆買家采購會 -- 3天的線下活動共吸引上百位買家到場,洽談場次超310場;特邀買家視頻洽談會 -- 來自35個國家和地區的199位海外買家,通過zoom視頻軟件,在線完成140場云視頻會面,大大提高國際商貿對接的效率和成功率。
打造智藥商學院,構建制藥行業知識分享生態圈
2021年初,“制藥在線”依托網站平臺11年來積累的豐富經驗,對現有會議產品進行資源整合,升級打造為“智藥商學院”,為廣大制藥行業人士創建社交、學習、分享場景,構建制藥行業知識分享生態圈。
至今,“智藥商學院”舉辦近200場線上直播課和線下會議,吸引上萬名業內人士前來學習。
全球站全新升級,海外布局加速,助力中國藥企云上出海
“制藥在線”全球站(PharmaSources.com)經過2020年全新升級上線后,在擴展全球視野、鏈接國際資源等方面進行深度布局,針對外貿企業面臨接單難、貿易壁壘增多等難題,全球站推出e-TRADE season、Pharma Sources Insight、VEC線上展會、Content Hub等產品及服務,協助國內企業搶訂單、保市場,增強外貿企業信心。
未來,制藥在線將著眼全球,深挖行業特征,提供線上線下定制化服務,解決制藥企業在貿易中的痛點。利用大數據等科技手段賦能,實現貿易營銷場景數字化,為企業構建一站式服務平臺,助力行業高質量發展。
同行11年,繼續前行,未來可期。
限時福利:即日起至10月31日申請入駐制藥在線,立享8折優惠。
未來的數年甚至數十年,制藥行業必將迎來一輪又一輪的創新變革。站在風口上的制藥人該如何緊跟行業發展,敏銳洞察行業前沿資訊?如何帶領藥企在創新中尋求突破,及時調整應對新政的戰略架構,在競爭中脫穎而出?
制藥人,你要學會投資你自己,投資自己的學識、實操力、洞察力,才能在這大江奔流的時代中,穩扎穩打,逐浪前行。
那么制藥人該如何進行高效的自我投資呢?制藥在線推薦一個專業的會議與課程提供方 -- 智藥商學院,為廣大制藥人提供制藥行業知識分享生態圈。
為什么選擇智藥商學院
聚焦行業熱門領域
智藥商學院課程涵蓋政策市場、注冊申報、工藝技術、藥物警戒、帶量采購、外貿拓客等多個熱門領域,滿足制藥人士對知識更新的多方位需求。
匯聚行業知名講師
超200位講師來自海內外知名藥企、科技中心、世界500強、國家重點實驗室等政府機構,敏銳洞悉行業熱點趨勢、深度解析前沿政策。
打造終身學習的平臺
全年100+線上直播+線下培訓輪番上陣,把脈行業實用性課題,為制藥人士的知識更新、行業交流提供有效支撐。
構建人脈交流圈
“智藥商學院”推出智藥商學院社群,滿足行業人士多元化社交需求,構建精準人脈。
點擊此處了解更多智藥商學院課程詳情。
即日起,智藥商學院推出會員年卡
598元觀看100+線上課程,平均每天僅需1.6元
個人版普通會員年卡 598元
- 免費觀看智藥商學院所有直播課程(100+)
- 支持直播課程回看
- 享CPhI China展會VIP觀眾權益:
專屬貴賓休息區,享用免費茶歇,展會禮券等
個人版VIP 會員年卡 2,998元
- 免費觀看智藥商學院所有直播課程(100+)
- 支持直播課程回看
- 享CPhI China 展會VIP觀眾權益(1位)
- 線下培訓會參會名額*1(價值¥2,800)
- 行業大咖免費問答1次(通過郵件咨詢老師)
- 智藥商學院定制禮品1份
企業版VIP會員銀卡 5,899元
- 觀看賬號*5
- 免費觀看智藥商學院所有直播課程(100+)
- 支持直播課程回看
- 享CPhI China 展會VIP觀眾權益(5位)
- 線下培訓會參會名額*2(價值5,600元)
- 行業大咖免費問答2次(通過郵件咨詢老師)
- 智藥商學院定制禮品5份
企業版VIP會員金卡 10,785元
- 觀看賬號*10
- 免費觀看智藥商學院所有直播課程(100+)
- 支持直播課程回看
- 享CPhI China 展會VIP觀眾權益(10位)
- 線下培訓會參會名額*3(價值8,400元)
- 行業大咖免費問答5次(通過郵件咨詢老師)
- 智藥商學院定制禮品10份
上海2021年7月19日 /美通社/ -- 2021年是挑戰與機遇并存的一年,“制藥在線”依托“展會+網站”的雙平臺資源優勢,7-8月推出“智藥采購節--原料藥&制藥設備”專場活動,旨在為買賣雙方提供發布求購、在線配對、視頻洽談等一站式采購服務。通過一對一、面對面的洽談方式,有效地拉近買賣雙方的距離,不僅節約采購時間,更能輕松提高采購效率!
7月8日至8月8日期間,“智藥采購節 -- 原料藥專場”正式開啟,采購商可免費報名,提交采購需求,專屬客服將根據采購商的要求匹配合適的供應商,并安排雙方在線洽談,歡迎廣大采購商踴躍報名參加!
采購商額外福利
為什么參與?
精品推薦,廠家直供
8000+中高端品牌貨源,15萬精選優品,供您挑選
云視頻會議,溝通零距離
幫助買賣雙方超越時間與地域限制,獲取真實報價
安全、高效、節約成本
品牌展會認證,提供信用保證,節約采購成本,提高效率
參與流程
Step 1
點擊此處進入智藥采購節,免費申請報名,填寫您的采購需求
Step 2
平臺客服核實并分析需求,為采購商精準配對合適的供應商
Step 3
平臺客服安排買賣雙方視頻會面洽談
云品薈萃,高效對接,趕緊來智藥采購節,開啟您的高效采購之旅吧!
點擊此處進入智藥采購節
點擊此處鏈接,進入制藥精貿節 -- 原料藥專場,了解更多優質供應商與產品。
為什么選擇制藥精貿節
海量產品任意選購
集中展示3000+的原料藥產品,涵蓋維生素類、激素類、四環素類、頭孢菌素素、大環內酯類、消化系統用藥、磺胺類、氯霉素類、解熱鎮痛藥、其他抗感染類10大品類,滿足大家的采購需求。
精選優質供應商
精選資質合格、產品優質的供應商進行展示,無需擔心產品質量問題。
以下為部分展商名單:
華北制藥股份有限公司
常州金晟制藥廠
新發藥業有限公司
山東魯抗醫藥股份有限司
山東京衛制藥有限公司
先鋒國際經貿有限公司
江蘇宇田醫藥有限公司
杭州維高生物科技有限公司
臺州市海盛制藥有限公司
河南東泰制藥有限公司
嘉一藥業有限公司
山東京衛制藥有限公司
武漢武藥制藥有限公司
與供應商直接對接,無中間商賺差價
對于心儀的產品,大家可直接發送詢盤,與供應商及時溝通交流。點擊產品圖片,可了解產品的供應商詳情、企業認證、聯系方式、聯系地址等。
實力工廠,優品精選。點擊此處鏈接,進入制藥精貿節 -- 原料藥專場,了解更多優質供應商,選購需要的原料藥產品吧。
7月19日-8月6日,制藥精貿節 -- 原料藥專場第二波優選品類將繼續來襲。
專場將涵蓋麻醉用藥、氨基酸及其衍生生物、其他抗感染類、青霉素類、氨基糖苷類、林可霉素類、心血管系統用藥、抗寄生蟲病類、中樞神經系統用藥、其他西藥原料10大品類,更有大量的優質原料藥產品可供選購,敬請期待。
制藥在線在2021年全新推出“制藥精貿節”,將在全年持續打造原料藥設備、原料藥、中間體&精細化工、實驗室儀器等主題專場,涵蓋熱門產品展示、商家活動等功能,并依托網站十余年積累的豐富買家資源與全渠道推廣經驗,通過精選行業實力廠家與優質產品進行展示曝光,為企業提供優質的展示平臺。同時幫助買家鎖定供應商和產品,節約采購時間,提升采購效率,為供需雙方提供貿易對接的渠道,助力雙方收獲海量商機。