南京、上海和舊金山 2025年6月23日 /美通社/ -- 馴鹿生物,一家致力于細胞和抗體創新藥物研發、生產和銷售的生物制藥公司,宣布其支持的靶向BCMA CAR-T細胞療法伊基奧侖賽注射液治療多發性硬化癥(MS)的研究者發起的臨床研究(IIT),已在第11屆歐洲神經病學學會(EAN)年會上以線上口頭報告形式展示最新研究數據。研究顯示該療法在治療進展型多發性硬化癥中表現出良好的耐受性和顯著療效。
報告標題:靶向BCMA CAR-T細胞療法治療多發性硬化癥患者
報告類型:線上口頭報告
報告時間:2025年6月22日上午 14:00 - 14:05(歐洲東部夏令時間)
報告地點:芬蘭赫爾辛基
摘要編號:A-25-13667
匯報人:華中科技大學同濟醫學院附屬同濟醫院 秦川教授
本次報告內容基于一項研究者發起的評估輸注伊基奧侖賽注射液治療進展型多發性硬化癥(MS)的療效和安全性的探索性臨床研究(NCT04561557)結果,該研究正在華中科技大學同濟醫學院附屬同濟醫院開展,研究者為同濟醫院神經內科王偉教授團隊。
療效:截至2024年12月31日,研究納入了3例重度進展型MS患者(2例繼發進展型,1例原發進展型),基線EDSS評分(擴展殘疾狀態量表)達6-7分,且既往生物制劑治療失敗。接受單次伊基奧侖賽注射液輸注(1.0×10^6細胞/千克)后,患者表現出快速且持續的臨床改善:
- 功能改善:末次隨訪時所有患者EDSS評分均較基線顯著改善;上肢靈活性(九孔柱測試)和下肢行走能力(25英尺步行測試)明顯提升;
- 生物標志物轉陰:腦脊液寡克隆帶(OCBs)完全消失;K游離輕鏈水平顯著下降;
- 影像學穩定:MRI復查未發現新發或擴大的釓增強T1病灶及T2高信號病灶。
安全性:
- 所有患者均出現短暫性1級細胞因子釋放綜合征(CRS),輸注后未觀察到免疫效應細胞相關神經毒性綜合征(ICANS)或其他神經毒性反應。
- ≥3級血細胞減少均發生于CAR-T細胞輸注后30天內,僅觀察到≥3級中性粒細胞減少和淋巴細胞計數下降,未發生≥3級貧血或血小板減少癥。
結論:伊基奧侖賽注射液在治療多發性硬化癥中表現出良好的耐受性和顯著療效,具體表現為患者軀體功能改善及腦脊液中寡克隆帶(OCBs)消失。
關于多發性硬化癥( MS)
多發性硬化癥是一種影響中樞神經系統(CNS)的神經炎癥性疾病,它會導致脫髓鞘和神經元損傷,是青壯年(18至40歲)非創傷性殘疾最常見的原因之一[1]。根據Frost& Sullivan報告,2023年全球共有約307萬多發性硬化癥患者,其中美國有約40萬。多發性硬化癥的患病率在性別上有顯著差異,女性與男性的整體比例為3:1[2]。 多發性硬化癥的特征是局部淋巴細胞中樞神經系統浸潤導致髓鞘破壞和軸突損傷,這些損傷會導致神經綜合征和身體殘疾[3]。多發性硬化癥的臨床表現取決于中樞神經系統中損傷的位置,常見癥狀包括感覺和視覺障礙、運動和協調障礙,以及痙攣、疲勞、疼痛和認知缺陷[4]。大約85%至90%的多發性硬化癥患者會經歷復發-緩解病程,其特征是癥狀急性加重之后有所緩解,然而,隨著疾病的演變和癥狀恢復的不完全,大約50%的患者最終發展為繼發進展型多發性硬化癥,其特點是神經功能障礙的逐漸、不可逆的累積[5]。
參考文獻
[1]. Thompson AJ, Baranzini SE, Geurts J, Hemmer B, Ciccarelli O. Multiple sclerosis. Lancet 2018; 391: 1622–36.
[2]. GBD 2016 Multiple Sclerosis Collaborators. Global, regional, and national burden of multiple sclerosis 1990-2016: a systematic analysis for the Global Burden of Disease
Study 2016. Lancet Neurol 2019;18: 269–85.
[3]. Compston A, Coles A. 2008. Multiple sclerosis. Lancet 372(9648):1502–17.
[4]. BDendrou CA, Fugger L, Friese MA. 2015. Immunopathology of multiple sclerosis. Nat.Rev. Immunol.15(9):545–58.
[5]. Sospedra M, Martin R. 2016. Immunology of multiple sclerosis. Semin. Neurol. 36:115–27.
]]>
南京、上海和舊金山 2025年5月21日 /美通社/ -- 2025年5月20日,馴鹿生物上海外高橋保稅區的全球研發中心正式啟用,同期主辦的"中國細胞治療全球化的機遇與挑戰"行業論壇圓滿落幕。此次活動邀請到浦東新區副區長徐徠等政府領導,來自俄羅斯、墨西哥、日本、印尼等國家的行業專家與合作伙伴,以及國內生物醫藥領域同仁,逾百位嘉賓齊聚一堂,共話國際細胞治療領域的前沿技術,共謀中國細胞治療的全球化發展路徑。
上海外高橋保稅區素有"離世界最近的地方"之稱,作為全國首批允許外資開展干細胞與基因治療技術研發及產品生產的試點區域,為細胞基因產業提供保稅研發、保稅生產、通關便利、臨床試驗等全方位政策支持。馴鹿生物全球研發中心,建筑面積約30,000平方米,將依托外高橋保稅區獨特的政策優勢,布局最前沿的細胞與基因治療技術。未來,中心將強化與南京馴鹿生物總部的協同效應,并輻射全球市場,加速國際化業務縱深發展。
外高橋集團董事長俞勇先生表示:"今天,即將啟用的全球研發中心,既是馴鹿生物躍升全球競爭力的戰略支點,也是自貿區保稅區域為浦東打造世界級生物醫藥產業集群添磚加瓦的重要實踐。"
中國醫學科學院血液病醫院( 中國醫學科學院血液學研究所) 臨床首席專家邱錄貴教授表示:"福可蘇®已經成功參與了三項國際多中心研究,這證明了中國藥企的實力和責任感。馴鹿生物正在推動福可蘇®二/三線適應癥的注冊臨床研究,這是非常有勇氣的。也證明了他們的信心,我自己也非常有信心,這款產品會越做越好。"
深圳殘友集團創始人鄭衛寧先生表示:“我們與馴鹿的合作旨在通過CGT技術,幫助更多殘疾人和患者突破生理限制、恢復勞動能力。未來,我們期待與馴鹿共同創造更多適合殘疾人的就業崗位,實現產業發展與社會共融的協同共振。”
馴鹿生物創始人、董事長兼首席執行官張金華女士表示:"感謝浦東新區、保稅區管理局及外高橋集團為馴鹿提供了‘空間賦能+資本助力+服務加持'的三維支撐體系。這一創新生態為馴鹿生物全球研發中心提供了強有力的發展支撐,將助力我們加速創新。感謝海內外臨床專家、合作伙伴、投資人及行業同仁的蒞臨現場支持。我們將以外高橋保稅區為戰略支點,全力推動中國細胞治療領域的發展與全球化合作。馴鹿生物將繼續以不屈不撓的創新精神和自主自強的研發實力,持續探索生命科學的邊界。初心如磐,矢志為全球患者帶來治愈的曙光。"
啟動儀式上,與會嘉賓共同點亮了象征著創新與希望的按鈕,見證了馴鹿生物開啟全球化發展新篇章。
活動現場,馴鹿生物與來自日本、墨西哥、俄羅斯、印尼等國家的合作伙伴以及深圳殘友集團達成重要戰略合作。合作將重點推進兩大方向:一方面加速CAR-T產品在海外市場的注冊申報與商業化布局,另一方面引進國際先進的干細胞治療技術和產品,拓展治療領域,惠及全球更廣大患者。
在"中國細胞治療全球化的機遇與挑戰"圓桌論壇環節,國內外知名專家和學者就1)全球協作——患者可及性拓展(從國際注冊流程和患者支付能力的角度切入);2)全球創新——下一代CGT療法技術(從CGT產品研發和生產的挑戰,和下一代CGT治療癌癥、遺傳疾病和慢性疾病進展的角度切入)兩大話題展開深入探討。來自歐洲、亞洲和美洲的專家學者分享了不同地區的實踐經驗,多元視角的深入交流為中國細胞治療行業發展提供了寶貴參考。
關于馴鹿生物
馴鹿生物成立于2017年,是一家行業領先的專注于研發、生產和銷售創新細胞療法的生物制藥公司。公司以開發血液腫瘤細胞類藥物為創新基石,并向自身免疫性疾病領域和抗體類藥物拓展,擁有完整的從早期藥物發現、臨床研發、注冊申報到商業化的全流程能力。公司現有10余款處于不同研發階段的創新藥物品種,其中由馴鹿生物自主研發的全球首個全人源CAR-T產品,靶向BCMA的伊基奧侖賽注射液(福可蘇®)已于2023年6月獲中國國家藥品監督管理局(NMPA)批準上市,用于治療既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)的復發或難治性多發性骨髓瘤(R/RMM)成人患者。其前線適應癥用于治療2-3線多發性骨髓瘤(MM)已進入III期臨床。此外,伊基奧侖賽注射液在中國和美國已獲得多個自身免疾性疾病的新藥臨床試驗申請(IND)許可。
同時,針對淋巴瘤的雙靶點(CD19/CD22)產品CT120即將進入II期臨床。另一款靶向GPRC5D用于治療復發難治多發性骨髓瘤的產品IASO118已在中國獲得IND許可。除細胞療法產品外,公司的全人源靶向CD19抗體產品IASO-782,已在中國和美國獲得治療多個自身免疫性疾病的IND許可,同時仍在探索更多的自身免疫性疾病適應癥。公司先后和海外細胞治療公司Sana Therapeutics、Cabaletta Bio及Umoja Biopharma達成全球商業拓展授權或研發合作,積極探索新一代細胞療法產品的開發。馴鹿生物依托其強大的管理團隊、創新的產品管線、自有的GMP生產和先進的臨床開發能力,全力以赴為中國及全球患者帶來變革性、可及的創新療法和治愈的希望。了解更多信息,請訪問公司官網:www.iasobio.com或領英賬號:www.linkedin.com/company/iasobiotherapeutics。
 ]]>
]]>
中國南京、上海和美國舊金山 2025年5月9日 /美通社/ -- 馴鹿生物,一家致力于細胞和抗體創新藥物研發、生產和銷售的生物制藥公司,宣布沙特阿拉伯王國食品藥品監督管理局(Saudi Food and Drug Authority, SFDA)授予其自主研發的靶向BCMA的CAR-T細胞治療產品伊基奧侖賽注射液(FUCASO)孤兒藥資格認定(Orphan Drug Designation, ODD),用于治療既往經過至少三線治療后出現疾病進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)的復發或難治性多發性骨髓瘤(R/R MM)成人患者。
孤兒藥資格認定是沙特阿拉伯SFDA為鼓勵罕見病治療藥物研發設立的特殊政策。獲得認定的藥物將享有注冊審評加速、注冊策略指導等多重政策支持。伊基奧侖賽注射液獲得ODD后可直接遞交新藥上市申請(NDA),有望縮短申報周期,盡早惠及中東地區患者。
馴鹿生物創始人、董事長兼首席執行官張金華女士表示:"伊基奧侖賽注射液獲得沙特阿拉伯孤兒藥資格認定,再次體現了國際監管機構對其創新性和臨床價值的認可。沙特阿拉伯不僅是我們布局中東市場的重要起點,也是公司穩步推進國際化戰略的重要一步。我們將與當地監管機構、醫療機構及合作伙伴通力協作,加快推進伊基奧侖賽注射液在沙特的注冊審批進程,讓這一具有顯著療效和安全性的細胞治療藥品早日惠及當地患者。"
關于多發性骨髓瘤( MM)
多發性骨髓瘤(MM)在全球是第二常見的血液系統惡性腫瘤。根據Globocan數據,2022年全球多發性骨髓瘤發病率為1.8/10萬,5年患病率為6.8/10萬。盡管當前抗骨髓瘤治療取得了進展,但MM仍大多無法治愈,且易多次復發,并傾向于對多種藥物類別產生耐藥性,給治療帶來了重大挑戰。因此,對于復發或難治性MM的治療,除了當前抗骨髓瘤療法外,仍迫切需要新的治療選擇,以實現深度且持久的療效。
關于伊基奧侖賽注射液( FUCASO )
FUCASO(伊基奧侖賽注射液)是一種針對B細胞成熟抗原(BCMA)的CAR-T細胞療法,以慢病毒為基因載體轉染自體T細胞,CAR包含全人源scFv、CD8a 鉸鏈和跨膜區、4-1BB共刺激分子和CD3ζ激活結構域。基于嚴格的分子結構篩選,通過全面的體內外功能評價,福可蘇®具有快速和強勁的療效,并有突出的體內持久存續性,可使患者獲得深度而持久的緩解,持續守護多發性骨髓瘤患者。
]]>
中國南京、上海和美國加州圣荷西2025年3月28日 /美通社/ -- 馴鹿生物,一家專注于細胞和抗體創新藥物研發、生產和商業化的生物制藥公司今日宣布,其CAR-T細胞產品伊基奧侖賽注射液(福可蘇®, equecabtagene autoleucel)的新藥上市許可申請(NDA)已獲得中國澳門藥物監督管理局批準,用于治療既往經過至少三線治療后出現疾病惡化(至少使用過一種蛋白酶體抑制劑及免疫調節劑)的復發或難治性多發性骨髓瘤(R/RMM)成人患者。
此次是伊基奧侖賽注射液的首個境外NDA獲批。2023年6月30日,伊基奧侖賽注射液獲中國國家藥品監督管理局(NMPA)批準上市,用于治療既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)的復發/難治性多發性骨髓瘤(R/RMM)成人患者。2025年1月29日及2月14日,該產品針對以上適應癥的NDA相繼獲得了新加坡衛生科學局和中國香港衛生署正式受理。
此次澳門地區NDA的批準基于FUMANBA-1臨床研究數據(CTR20192510,NCT05066646)。FUMANBA-1臨床研究是一項在中國多中心開展的評估伊基奧侖賽注射液治療復發/難治性多發性骨髓瘤患者的I/II期注冊臨床研究,該研究結果顯示伊基奧侖賽注射液具有優異的療效和安全性。
馴鹿生物創始人、董事長兼首席執行官張金華女士表示:"我們非常高興伊基奧侖賽注射液的新藥上市申請(NDA)獲得澳門藥物監督管理局批準,這是該產品首個境外NDA獲批,具有重要的里程碑意義。我們將通過‘南京生產、供應境外'的創新模式,確保澳門地區的多發性骨髓瘤患者能夠及時獲得此CAR-T藥物。
去年底,我們已成功通過指定患者藥物使用計劃(NPP)為香港地區患者實現跨境供藥。今年1月和2月,伊基奧侖賽注射液的NDA已相繼獲得新加坡衛生科學局和中國香港衛生署的正式受理。目前我們正全力配合當地監管部門推進注冊審批工作,力爭早日為這些地區的患者帶來臨床獲益。同時,馴鹿生物將持續推進國產CAR-T藥物的國際化布局,為全球多發性骨髓瘤患者提供更多治療選擇。"
關于多發性骨髓瘤(MM)
根據Globocan數據,2022年全球多發性骨髓瘤發病率為1.8/10萬,5年患病率為6.8/10萬。盡管當前抗骨髓瘤治療取得了進展,但MM仍大多無法治愈,且易多次復發,并傾向于對多種藥物類別產生耐藥性,給治療帶來了重大挑戰。因此,對于復發或難治性MM的治療,除了當前抗骨髓瘤療法外,仍迫切需要新的治療選擇,以實現深度且持久的療效。
關于伊基奧侖賽注射液(福可蘇®)
伊基奧侖賽注射液(福可蘇®)是一種針對B細胞成熟抗原(BCMA)的CAR-T細胞療法,以慢病毒為基因載體轉染自體T細胞,CAR包含全人源scFv、CD8a 鉸鏈和跨膜區、4-1BB共刺激分子和CD3ζ激活結構域。基于嚴格的分子結構篩選,通過全面的體內外功能評價,福可蘇®具有快速和強勁的療效,并有突出的體內持久存續性,可使患者獲得深度而持久的緩解,持續守護多發性骨髓瘤患者。
]]>
南京、上海和美國圣荷西2025年2月14日 /美通社/ -- 2025年2月14日,馴鹿生物宣布,中國香港衛生署已正式受理其CAR-T細胞產品伊基奧侖賽注射液(FUCASO)的新藥上市許可申請(NDA),用于治療既往經過至少3線治療后進展的復發/難治性多發性骨髓瘤(R/RMM)成人患者。
這是香港衛生署首次正式受理國產CAR-T細胞產品的新藥上市申請。由于伊基奧侖賽注射液已經實現為香港地區患者跨境供藥,一旦成功獲批,香港患者將可直接使用馴鹿生物南京生產基地制備的該產品。
自2024年下半年起,為滿足香港及周邊地區R/RMM患者對創新療法的迫切需求,馴鹿生物迅速啟動了香港指定患者藥物使用計劃(NPP)申請。然而,讓香港患者足不出"港"使用南京生產的伊基奧侖賽注射液,挑戰巨大。CAR-T藥物不僅需滿足特殊物品進出境申報要求,作為"活的藥物",其原材料和成品對物流運輸的溫控、時長等條件要求也極為苛刻,且無法通過機場X光檢查。
為攻克這一難題,南京海關及江北新區多政府部門為馴鹿生物提供了全力支持。金陵海關和南京祿口機場海關在南京海關衛生檢疫處的指導下,聯合多單位多次深入企業生產線實地調研,創新實施了進出境特殊物品的多部門聯合監管機制。南京海關各機構以服務企業為宗旨,優化了風險評估、進出口物品查驗和放行流程,顯著提升了進出口效率。與此同時,江蘇省藥監局積極為企業提供專業指導,并高效完成了伊基奧侖賽注射液藥品出口銷售證明的辦理工作,共同為國產CAR-T療法走向國際市場提供了堅實保障。
2024年12月,首位來自香港的R/RMM患者在香港瑪麗醫院成功接受了南京生產基地制備的伊基奧侖賽注射液的回輸治療。這一突破標志著馴鹿生物成為全國首家完成香港NPP真實患者治療全流程的細胞治療企業,也意味著伊基奧侖賽注射液成功實現跨境供藥,為中國細胞與基因治療(CGT)企業的國際化探索開辟了新路徑。
馴鹿生物創始人、董事長兼首席執行官張金華女士表示:"
基于伊基奧侖賽注射液顯著的臨床價值,我們相信具有國際競爭力的CAR-T藥品應當走出國門,惠及全球更多患者。香港作為內地生物醫藥企業拓展國際市場的重要窗口,是馴鹿布局全球市場的關鍵一步。去年12月,首位香港NPP患者成功接受伊基奧侖賽注射液的回輸治療,證明了馴鹿生物"南京生產、供應境外"創新模式的有效性,也標志著這一藥品已成功實現跨境供藥。我們希望這一突破能為CGT行業同仁帶來鼓舞。
這一成就的取得,離不開江蘇省和南京市各級政府部門的鼎力支持與指導。我們由衷感謝江蘇省藥監局的專業指導,南京海關、金陵海關及南京祿口機場海關的高效協作,以及江北新區各部門、臨空經濟示范區和南京祿口國際機場等相關單位的全方位支持。
今天,我們很高興伊基奧侖賽注射液的NDA已正式獲得香港衛生署受理。依托香港"1+"創新審批機制,我們快速完成了申請遞交,充分展現了馴鹿注冊團隊對不同地區藥品注冊政策的深刻理解和高效執行力。在此,我要特別感謝團隊的專業奉獻與不懈努力。接下來,我們將全力配合相關部門的審批流程,力爭早日實現這款創新CAR-T產品在中國香港地區的獲批,為更多患者帶來希望。"
]]>
中國南京、上海和加州圣荷西2025年1月29日 /美通社/ -- 2025年1月29日,馴鹿生物宣布,新加坡衛生科學局(HSA)已正式受理其CAR-T細胞產品伊基奧侖賽注射液(FUCASO)的新藥上市許可申請(NDA),用于治療既往經過至少3線治療后進展的復發/難治性多發性骨髓瘤(R/RMM)成人患者。
伊基奧侖賽注射液(中國內地商品名:福可蘇®)于2023年6月30日獲中國國家藥品監督管理局(NMPA)批準上市,用于治療既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)的復發/難治性多發性骨髓瘤(R/RMM)成人患者。作為全球第一款商業化全人源 CAR-T產品,自福可蘇®獲批上市以來,憑借其顯著的療效及安全性,不僅獲得了國內臨床專家及患者的認可,更吸引了全球十余個國家和地區的患者來華接受該療法的治療。
馴鹿生物創始人、董事長兼首席執行官張金華女士表示:"穩步推進國際化是馴鹿生物的核心戰略。新加坡是我們首個遞交境外新藥上市申請的國家,此次伊基奧侖賽注射液NDA獲HSA正式受理是馴鹿生物"出海"歷程的重要里程碑。伊基奧侖賽注射液無論在臨床試驗還是真實世界中均展現出了突破性的療效和安全性,我們將積極配合HSA的審批工作,盡快推進此款藥物在新加坡上市。上市申請一經獲批,我們將采用創新的"在中國生產,供應到境外"的模式,真正實現國產自體 CAR-T藥物走出國門。
新興市場存在著巨大的未被滿足的醫療需求,馴鹿生物擁有經驗豐富的國際藥品注冊團隊,并具備高效推進海外商業化的實力。未來,我們計劃同時啟動多個國家的藥品注冊工作,全力加速國際化進程,期望這一創新療法能夠造福全球更多國家和地區的患者。"
關于多發性骨髓瘤(MM)
多發性骨髓瘤(MM)在全球及新加坡均是第二常見的血液系統惡性腫瘤。根據Globocan數據,2022年全球多發性骨髓瘤發病率為1.8/10萬,5年患病率為6.8/10萬。新加坡2022年多發性骨髓瘤發病率為2.2/10萬,5年患病率為15.0/10萬。盡管當前抗骨髓瘤治療取得了進展,但MM仍大多無法治愈,且易多次復發,并傾向于對多種藥物類別產生耐藥性,給治療帶來了重大挑戰。因此,對于復發或難治性MM的治療,除了當前抗骨髓瘤療法外,仍迫切需要新的治療選擇,以實現深度且持久的療效。
關于伊基奧侖賽注射液(FUCASO)
FUCASO(伊基奧侖賽注射液)是一種針對B細胞成熟抗原(BCMA)的CAR-T細胞療法,以慢病毒為基因載體轉染自體T細胞,CAR包含全人源scFv、CD8a 鉸鏈和跨膜區、4-1BB共刺激分子和CD3ζ激活結構域。基于嚴格的分子結構篩選,通過全面的體內外功能評價,福可蘇®具有快速和強勁的療效,并有突出的體內持久存續性,可使患者獲得深度而持久的緩解,持續守護多發性骨髓瘤患者。
]]>
中國南京、上海和美國加州圣荷西2024年12月10日 /美通社/ -- 馴鹿生物,一家專注于細胞創新藥物研發、生產和銷售的生物制藥公司,在2024年第66屆美國血液學會(ASH)年會上以壁報形式展示了其全人源靶向BCMA 的CAR-T產品伊基奧侖賽注射液的CAR-T細胞存續對復發/難治性多發性骨髓瘤臨床預后的影響。研究成果證實了效靶比對骨髓瘤控制具有顯著影響,并進一步揭示了骨髓瘤的CAR-T治療需要選擇CAR-T細胞存續長且存續不受可溶性B細胞成熟抗原(sBCMA)基線水平影響的CAR-T藥物。
報告標題: Impact of CAR T-Cell Persistence on Clinical Outcomes in Relapsed/Refractory Multiple Myeloma: Insights from the Phase 2 FUMANMA-1 Study(在FUMANBA-1 2期研究中,CAR-T細胞存續對復發/難治性多發性骨髓瘤臨床預后的影響)
報告編號: 4761
展示時間: 2024年12月9日,周一,6:00 PM -8:00 PM(太平洋標準時間)/ 2024年12月10日,周二,10:00 AM-12:00 PM(北京時間)
研究結論
- 效靶比是接受伊基奧侖賽注射液治療的患者臨床預后的一個關鍵決定因素,強調了CAR-T細胞存續持久性的重要性。
- 效靶比或可成為未來治療規劃的生物標志物,強調了為實現最佳疾病控制而需要延長CAR-T細胞存續的必要性。
- 同時,患者基線sBCMA水平并不會對伊基奧侖賽的存續和療效產生影響。
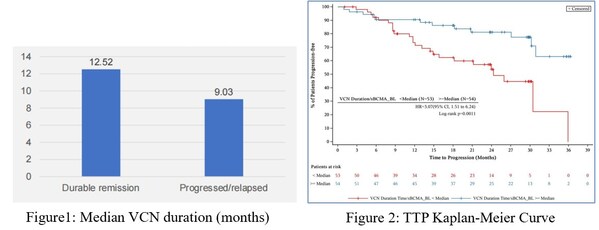
本次對FUMANBA-1 2期研究的回顧性分析主要探索CAR-T細胞存續與無進展生存期(PFS)及至疾病進展(TTP)的關系,并從效靶比,即載體拷貝數(VCN)持續時間與基線可溶性B細胞成熟抗原(sBCMA)的比值,角度分析基線sBCMA水平對其影響。中位隨訪至24.67個月,14個治療中心的107名受試者接受了伊基奧侖賽注射液的治療。
在數據截止時,持續緩解組較進展或復發組的中位VCN持續時間有更長的趨勢(12.52m vs 9.03m),如圖1。107例受試者的中位效靶比為1.05(day *mL/ng)。如圖2所示,效靶比較低的受試者疾病進展的風險顯著更高,其至疾病進展時間(TTP)的風險比(HR)為3.07(95% CI:1.51–6.24,p=0.0011),無進展生存時間(PFS)的風險比為2.3(95% CI:1.27–4.14,p=0.0045),兩者均表明效靶比與疾病進展風險顯著相關。
在基線特征中,包括ECOG評分、R-ISS和ISS疾病分期、骨髓瘤BCMA表達、腫瘤負荷、基線sBCMA水平、既往自體干細胞移植(ASCT)、三線治療暴露、橋接治療、既往CAR-T治療以及淋巴清除預處理等因素,僅既往自體干細胞移植(n=30)和抗藥抗體(ADA,作為輸注后因素)與伊基奧侖賽的存續顯著相關,風險比(HR)分別為0.35和5.79,如表1所示。
在107例受試者中,僅有14例表現出中性粒細胞恢復障礙,其特征為中性粒細胞計數持續14天或更長時間低于500/μl。與無此表現的受試者相比,VCN持續時間沒有顯著差異,表明伊基奧侖賽的長期存續并不增加血液學毒性。
本次臨床研究的主要研究者,中國醫學科學院血液病醫院邱錄貴教授和華中科技大學同濟醫學院附屬同濟醫院李春蕊教授表示:
"本次回顧性分析從效靶比(VCN存續/sBCMA)角度探索CAR-T治療后的長期療效影響的決定因素,證實效靶比對骨髓瘤長期控制(PFS和TTP)的顯著影響,提示骨髓瘤的CAR-T治療需選擇"效"長,并且"效"不受"靶"影響的CAR-T產品,即選存續長,存續不受sBCMA水平影響的CAR-T療法。
本研究結構也進一步揭示了CAR-T細胞長期存續對于改善復發/難治性多發性骨髓瘤受試者預后的重要作用。在2023年的ASH報告中,我們已明確證實了CAR-T細胞存續時間與微小殘留病灶(MRD)陰性持續狀態之間存在正相關關系。伊基奧侖賽的CAR-T細胞中位存續時間長達419天,這可能是其實現97.8%的高MRD陰性率及12個月時81.7%的MRD陰性持續率的關鍵因素。
此外,值得注意的是,在本次研究的107例受試者中,僅有14例出現超過14天的粒細胞缺乏癥,這表明伊基奧侖賽的長期存續并不會增加血液學毒性,進一步驗證了該療法的安全性。"
馴鹿生物首席醫學官陳杰博士表示:"此次馴鹿生物在ASH年會期間所展示的研究結果數據,著重強調了效靶比對多發性骨髓瘤疾病控制的重要影響。數據顯示,效靶比高于中位值的患者其無進展生存期和疾病進展時間的預后更好。這一結果進一步證實了CAR-T細胞在患者體內長存續對于實現長期療效的顯著正面作用。伊基奧侖賽注射液在研發初期便精心篩選出不受sBCMA水平影響的候選分子,為受試者提供更為顯著且持久的疾病緩解。同時,此次研究的結果還顯示,在接受伊基奧侖賽注射液治療后,僅有少數患者出現超過14天的粒細胞缺乏癥。表明伊基奧侖賽的長期存續并不會增加患者的血液學毒性,進一步驗證了伊基奧侖賽的安全性。
我們對伊基奧侖賽注射液的顯著療效和安全性充滿信心,目前馴鹿生物已啟動并在快速推進該療法用于二/三線多發性骨髓瘤的隨機對照3期臨床研究,我們期待盡早將這一先進療法帶給國內外的更廣大的多發性骨髓瘤患者。"

——1b/2期FUMANBA-1研究數據證明,伊基奧侖賽注射液在復發/難治性多發性骨髓瘤患者中實現深度且持久的緩解;
——數據顯示,治療總體緩解率(ORR)為96.0%,其中既往未接受過CAR-T治療受試者的ORR為98.9%;
——103例受試者中,僅一例發生3級及以上細胞因子釋放綜合征(CRS),無3級以上免疫效應細胞相關神經毒性綜合征(ICANS)發生
中國南京、上海和加州圣荷西2024年11月8日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司宣布,其全人源靶向BCMA的CAR-T療法——伊基奧侖賽注射液(商品名:福可蘇®)針對復發/難治性多發性骨髓瘤(R/RMM)的1b/2期臨床研究FUMANBA-1結果,已發表于國際權威期刊JAMA Oncology。該研究評估了伊基奧侖賽注射液在既往接受過3線及以上治療的R/RMM患者中的有效性和安全性,結果顯示伊基奧侖賽注射液在R/RMM患者中表現出高總體緩解率和持久緩解,同時安全性良好。
此次JAMA 0ncology發表了截至2022年9月9日共103例受試者接受伊基奧侖賽注射液回輸的臨床研究數據,受試者中位隨訪時間為13.8(范圍 0.4-27.2)個月。療效方面,在療效可評估的101例受試者中,總體緩解率(ORR)為 96.0%(97/101)。嚴格意義的完全緩解/完全緩解率(sCR/CR)為74.3%(75/101)。在既往未接受過CAR-T治療的89例受試者中,ORR為98.9%(88/89),CR/sCR率為78.7%(70/89)。在這101例受試者中,中位達緩解時間為16天(范圍11-179),中位持續緩解時間(DOR)和中位無進展生存期(PFS)均未達到,12個月的PFS率為78.8%(95% CI: 68.6–86.0)。95.0%(96/101)的受試者達到微小殘留病灶(MRD)陰性,中位達MRD陰性時間為15天(范圍14-186),所有sCR/CR受試者均達到MRD陰性,MRD陰性的中位持續時間尚未達到。安全性方面,103例受試者中,93.2%(96/103)受試者發生細胞因子釋放綜合征(CRS),其中絕大多數為1~2級CRS,僅1例受試者發生3級及以上CRS。僅1.9%(2/103)受試者出現免疫效應細胞相關神經毒性綜合征(ICANS),其中1級和2級各1例。
值得注意的是,此項研究于2023年美國血液學會(ASH)年會期間公布了截至 2022年12月31日的數據更新。中位隨訪時間增至18.07個月,103例可評估受試者中總體緩解率(ORR)為96.1%,嚴格意義的完全緩解/完全緩解(sCR/CR)率為77.7%,達到CR及以上受試者MRD陰性率100%;91例既往未接受過CAR-T治療的受試者中,ORR達98.9%,sCR/CR率達到 82.4%,微小殘留病灶(MRD)陰性率97.8%,81.7%的受試者在回輸后12個月依然保持MRD陰性,12個月無進展生存(PFS)率為85.5%。此外,伊基奧侖賽注射液可以在體內長期續存,50%的受試者在回輸后12個月時,載體拷貝數(VCN)在檢測下限以上,24個月時仍有40%的受試者可以檢測到VCN持續存在。
中國醫學科學院血液病醫院邱錄貴教授表示:"FUMANBA-1的研究結果展現出了伊基奧侖賽注射液在治療復發/難治性多發性骨髓瘤患者中令人鼓舞的療效和安全性。其突破性全人源scFv設計克服了非全人源性CAR-T細胞的高免疫原性問題,同時對表達BCMA的腫瘤細胞具有適度的親和力,優異的解離動力學特征有利于伊基奧侖賽細胞在體內快速擴增和長期續存。"
浙江大學醫學院附屬第一醫院黃河教授表示:"伊基奧侖賽注射液(福可蘇®)已于2023年6月在中國獲批,上市一年多以來,為中國和來自海外的復發/難治性多發性骨髓瘤患者帶來了顯著的生存獲益,同時我們也積累了寶貴的真實世界應用經驗,期待這一創新療法能夠惠及更多的患者。"
華中科技大學同濟醫學院附屬同濟醫院李春蕊教授表示:"伊基奧侖賽是全球首個獲批的全人源CAR-T藥品,通過輕鏈和重鏈充分結合BCMA的表位,快解離降低自身耗竭,且免疫原性更低,為多發性骨髓瘤患者帶來快速、深度、持久的緩解。"
馴鹿生物首席醫學官陳杰博士表示:"很高興伊基奧侖賽注射液用于治療R/RMM的1b/2期臨床研究數據在JAMA Oncology發表,此項針對既往接受過3線及以上治療的R/RMM患者的研究結果令人振奮。感謝FUMANBA-1研究團隊嚴謹的科學態度和高標準的執行。目前,馴鹿生物也正在積極開展和推進伊基奧侖賽注射液前線適應癥用于治療既往接受過1-2線治療的多發性骨髓瘤(MM)患者的III期臨床研究FUMANBA-3,我們非常期待這些基于中國患者的臨床研究能夠早日取得積極結果,盡早讓伊基奧侖賽注射液服務于更多患者,為他們帶來新的治療選擇。"
]]>
中國南京、上海和美國加州圣荷西2024年9月30日 /美通社/ -- 巴西時間9月23日,國際骨髓瘤學會(IMS)年會前夕,馴鹿生物首席科學官張永克博士與中國血液腫瘤領域權威專家中國醫學科學院血液病醫院邱錄貴教授、浙江大學醫學院附屬第一醫院金潔教授等一行,造訪了巴西坎皮納斯州立大學(Unicamp)血液中心,與巴西專家和研究人員深入交流經驗、并積極探索在為腫瘤患者開發創新療法方面的潛在合作機會。
在Unicamp血液中心的會談中,巴西方面主要介紹了其在擴大腫瘤創新療法可及性方面的進展。例如,CEPID CancerThera機構(此次訪問組織者)詳細介紹了其正在開發的治療診斷模型Theranostic,Ribeirão Preto高級治療中心Nutera介紹了其CAR-T細胞研究情況。中方對巴西在該領域尤其是血液腫瘤領域的發展表現出了極大的興趣。
隨后中方代表重點介紹了CAR-T細胞療法的治療優勢——CAR-T療法利用腫瘤癌癥患者自身機體的免疫細胞來治療血液腫瘤,為那些蛋白酶抑制劑、免疫調節劑和抗CD38單克隆抗體一線至三線治療失敗的患者帶來了新的治療選擇。
會談后,中方代表團參觀了該血液中心用于開發CAR-T細胞療法的淋巴細胞收集裝置,以及Unicamp Hospital de Clínicas的核醫學服務,并參觀了為骨髓移植后恢復期的患者配備的先進設施。此次訪問為合作打開了新的大門,中國代表團強調了未來在生物技術、醫院或研究機構領域合作的重要性。

從左到右:前排為 Claudia Wu(Shamano集團)、Camen S. P. Lima(CancerThera)、金潔(浙江大學醫學院附屬第一醫院)和郝牧(中國醫學科學院血液病醫院);中間一排為:邱錄貴(中國醫學科學院血液病醫院)、王偉(Shamano集團)、Francisco Pessine(化學研究所/Unicamp);第三排為,Carmino A. de Souza (CancerThera)、Celso D. Ramos(CancerThera)、張永克(馴鹿生物)、Li Li Min(醫學科學學院/Unicamp)、Maria Carolina S. Mendes(CancerThera)、Bruno D. Benites(Hemocentro/Unicamp)和Elvira Correa(CancerThera) (圖片源自CEPID CancerThera官網)
"因為此次中國代表團的一半成員均為血液腫瘤專家,所以代表團的最大興趣是了解我們在CAR-T領域的進展",巴西血液腫瘤學家、Unicamp醫學科學學院教授兼RIDC CancerThera研究員 Carmino Antonio de Souza 博士評論道。
"我們非常重視與巴西的關系,我們在多個領域有著悠久的合作歷史。現在,我們正在努力將馴鹿生物自主研發的產品帶到這里,我們的目標就是將這種新的CAR-T療法帶給更多的患者,"馴鹿生物首席科學官張永克博士表示。
馴鹿生物致力于為中國及全球患者帶來可治愈的且可及的CAR-T療法,同時正積極主動地與全球來自科研、技術、臨床和商業化等領域的合作伙伴共同探索創新的合作模式,以加快CAR-T等創新療法更廣泛的臨床應用。

中國南京、上海和美國加州圣荷西2024年9月29日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,今日宣布在2024年國際骨髓瘤學會(IMS)年會上以壁報形式展示了其全人源靶向BCMA的CAR-T療法——伊基奧侖賽注射液(福可蘇®)在治療復發難治性多發性骨髓瘤(R/R MM)的FUMANBA-1研究中不同淋巴細胞清除方案下的比較研究。研究結果表明足量的淋巴細胞清除預處理能夠顯著提升患者的緩解深度,延長緩解時間和無進展生存期,同時不增加治療相關毒性。
摘要編號:P-094
摘要標題:The Optimal Lymphodepletion Prior to Eque-cel in Patients with Refractory Relapsed Multiple Myeloma in FUMANBA-1 Study
展示時間:2024年9月28日(UTC-3)
此次壁報內容基于FUMANBA-1研究(研究登記號:NCT05066646)。此項研究中共納入91例既往無CAR-T治療史的患者接受伊基奧侖賽注射液的治療,中位隨訪時間為18.07個月。研究顯示共有33名受試者的淋巴細胞清除劑量發生了調整,58名受試者接受了標準的清淋劑量。兩組受試者在基線特征上相似,包括年齡、體力評分、腫瘤分期、高風險細胞遺傳異常和治療線數等。
結果顯示,在療效方面,標準劑量組的總體反應率(ORR)和嚴格意義上的完全緩解率(sCR)分別為100%和82.8%,而劑量調整組分別為97%和78.8%。標準劑量組顯示出了更顯著的緩解深度和更佳的長期預后,標準劑量組持續緩解時間(DOR)超過一年的比例為92.2%,而劑量調整組為70.6%。此外,劑量調整組達到微小殘留病灶(MRD)陰性的中位時間較長,為22天,相比之下標準劑量組為15天,同時標準劑量組12個月MRD陰性持續率為90.4%,而劑量調整組為63.7%(HR=3.33,P=0.0166)。標準劑量組12個月無進展生存(PFS)率為92.2%且中位PFS尚未達到,而劑量調整組12個月PFS為73.5%,中位PFS為30.28個月(HR=3.64,P=0.0032)。按照90%劑量調整分組的人群PFS也展示了同樣的趨勢。
在安全性方面,兩組在CRS(細胞因子釋放綜合征)和ICANS(免疫效應細胞相關神經毒性綜合征)的嚴重程度和發生率上沒有顯著差異。CRS在標準劑量組和劑量調整組的發生率分別為94.8%和93.9%,均未出現3級以上的嚴重CRS。除調整組中有1例2級ICANS病例外,兩組均沒有出現嚴重的ICANS(≥3級)。
結論:該研究進一步證實了淋巴細胞清除方案對于CAR-T治療至關重要,而足劑量的清淋劑量能有效改善疾病結果和預后。在患者能夠耐受的情況下,給予足劑量的淋巴細胞清除可以帶來更大的益處,且不增加毒性。
本次臨床研究的主要研究者,中國醫學科學院血液病醫院的邱錄貴教授和華中科技大學同濟醫學院附屬同濟醫院李春蕊教授表示:"淋巴細胞清除方案對于CAR-T細胞治療至關重要。本次研究數據表明,規范足量的清淋預處理能在不增加不良反應的前提下,帶來更高的緩解質量和更理想的微小殘留病清除。此次研究成果對于優化預處理方案以及進一步提高CAR-T細胞治療的療效和安全性提供了科學依據,為R/R MM患者帶來更長的生存期與更高的生活質量。"
馴鹿生物首席科學官張永克博士表示:"我們非常高興能夠在IMS年會上展示FUMANBA-1研究的新成果:規范足量的淋巴細胞清除在提高治療效果和預后方面的重要作用。我們期待此次研究發現能夠推進CAR-T細胞治療領域的清淋預處理標準的制定和優化,引領行業行為的規范化進程,確保每位接受CAR-T治療的患者都能享受到更加科學、高效的治療方案。"
關于FUMANBA-1研究
該研究是一項Ib/II期,單臂,多中心研究,旨在評估全人源靶向BCMA CAR-T細胞療法伊基奧侖賽注射液對既往接受過3線及以上治療復發難治性多發性骨髓瘤患者有效性和安全性的研究。
]]>
中國南京、上海和美國加州圣荷西2024年9月27日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,今日宣布在2024年國際骨髓瘤學會(IMS)年會上以壁報形式展示了其全人源靶向BCMA的CAR-T療法——伊基奧侖賽注射液(福可蘇®)在FUMANBA-1研究中用于治療復發難治性多發性骨髓瘤(R/RMM)合并腎功能損傷患者的預后研究數據。研究結果表明伊基奧侖賽注射液對于伴有腎功能損傷的R/R MM患者展現出同等的療效,且安全性表現良好,同時能改善患者的腎功能狀況。
摘要編號:P-100
摘要標題:Outcomes of R/R MM Patients with Renal Function Impairment Treated with Eque-cel in the Pivotal Phase 2 FUMANBA-1 Study
展示時間:2024年9月26日(UTC-3)
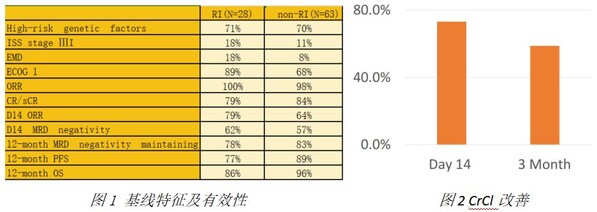
此次壁報內容基于FUMANBA-1研究(研究登記號:NCT05066646)。此項研究中共納入91例既往無CAR-T治療史的患者接受伊基奧侖賽注射液的治療,中位隨訪時間為18.07個月。根據CAR-T治療時肌酐清除率(CrCl)是否≤70ml/min,將患者分為腎損組和非腎損組。其中28例患者屬于腎損組伴有腎功能損傷,CrCl在40至70 ml/min之間,63例屬于非腎損組,CrCl>70 ml/min。
結果顯示,在療效方面,腎損組的大多數基線特征與非腎損組相當。腎損組也能實現與非腎損組一樣快速和深入的緩解。腎損組的長期療效與非腎損組相當。(如圖1)在安全性方面,兩組之間未觀察到顯著的CRS和嚴重CRS發生率差異。非腎損組中有1例2級ICANS,腎損組中沒有ICANS發生。腎損組中短期嚴重細胞減少癥的發生率稍高,但到第60天時同樣恢復。研究中有73.2%和58.8%患者在伊基奧侖賽回輸后14天和3個月肌酐清除率較基線進一步提升。(如圖2)
結論:在FUMANBA-1研究中,接受伊基奧侖賽注射液治療的復發難治性多發性骨髓瘤合并腎功能受損患者也能實現快速、深入且持久的緩解,且不影響安全性。且部分患者由于伊基奧侖賽輸注后清除了骨髓瘤細胞,腎功能得到了改善。為真實世界中中重度腎損傷患者的CAR-T治療提供了參考。
本次臨床研究的主要研究者,中國醫學科學院血液病醫院的邱錄貴教授和華中科技大學同濟醫學院附屬同濟醫院李春蕊教授表示:"以往,臨床醫生在治療復發難治性多發性骨髓瘤合并腎功能受損的患者時,會擔心患者出現不耐受的情況。而此次研究結果證實,即便在伴有一定腎功能受損的患者中,伊基奧侖賽注射液同樣能夠實現快速、深入且持久的緩解,其療效表現與非腎功能受損患者組相當,這一發現無疑為臨床治療提供了寶貴的參考。尤為值得一提的是,隨著骨髓瘤細胞的有效清除,患者的腎功能還得到了顯著改善,這一額外獲益進一步凸顯了伊基奧侖賽注射液在治療復雜病例中的獨特價值。"
馴鹿生物首席科學官張永克博士表示:"非常高興能將伊基奧侖賽注射液(福可蘇®)用于治療復發難治性多發性骨髓瘤(R/R MM)合并腎功能損害患者的預后研究數據展示在IMS大會上。FUMANBA-1研究中的數據表明,對于有一定腎功能損傷的R/RMM患者,伊基奧侖賽注射液展現了令人振奮的療效和安全性。并且基于伊基奧侖賽快速且深度的骨髓瘤細胞清除作用,同時能夠改善患者的腎功能。相信這一發現將為中重度腎功能受損的R/RMM患者真實世界治療提供參考,進一步推進CAR-T療法在骨髓瘤治療領域更廣法的應用。"
關于FUMANBA-1研究
該研究是一項Ib/II期,單臂,多中心研究,旨在評估全人源靶向BCMA CAR-T細胞療法伊基奧侖賽注射液對既往接受過3線及以上治療復發難治性多發性骨髓瘤患者有效性和安全性的研究。

中國南京、上海和美國加州圣荷西2024年8月12日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,宣布公司自主研發的全人源靶向BCMA嵌合抗原受體自體T細胞注射液(伊基奧侖賽注射液)的新藥臨床試驗申請(IND)已獲得美國食品藥品監督管理局(FDA)的默示許可,擬用于治療非腎臟系統性紅斑狼瘡 (Systemic Lupus Erythematosus, SLE) 和系統性紅斑狼瘡性腎炎(Lupus Nephritis, LN),這是該產品在自身免疫性疾病領域于中美兩國獲得的第五個臨床批件。
"很高興美國FDA批準了SLE和LN這兩種新適應癥的IND,這進一步顯示了Eque-cel作為治療自身免疫疾病產品的潛力," 馴鹿生物首席科學官張永克博士表示,"中國的臨床試驗數據已經顯示出Eque-cel 在治療復發/難治性自身抗體介導的神經系統疾病中的顯著療效和安全性。我們相信,它將對系統性紅斑狼瘡(SLE)和狼瘡性腎炎(LN)及其他以自身抗體為主要致病因素的自身免疫性疾病具有類似的治療前景。我們將繼續全力推進這一創新療法的研發,以使中國及和全球更多自身免疫性疾病患者受益。"
截至目前,伊基奧侖賽注射液在自身免疫疾病適應癥中已獲得美國FDA 3項IND許可,分別針對重癥肌無力(MG)、多發性硬化癥(MS)以及此次SLE和LN的治療。在中國,該產品在自身免疫性疾病適應癥中也已獲得國家藥品監督管理局(NMPA)2項IND默示許可,分別針對視神經脊髓炎譜系疾病(NMOSD)和MG的治療。同時,伊基奧侖賽注射液(福可蘇®)已經于2023年6月獲得國家藥品監督管理局批準用于治療既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)的復發難治多發性骨髓瘤成人患者 。
關于系統性紅斑狼瘡(SLE)
系統性紅斑狼瘡(SLE)是一種系統性自身免疫疾病,是最早發現的自身免疫與B淋巴細胞亞群異常相關的人類疾病之一。患者主要癥狀表現為全身多系統多臟器受累,體內存在大量自身抗體,并且自然病程多為病情的加重與緩解交替。如不及時治療,會造成受累臟器的不可逆損害,最終導致患者死亡。據Frost & Sullivan數據顯示,2023年全球約有804.9萬名SLE患者,其中美國SLE患者人數約為28.9萬。
關于系統性紅斑狼瘡性腎炎(LN)
狼瘡性腎炎(LN)是SLE最常見的嚴重并發癥,研究表明有60%的SLE患者在其疾病進程中會發展成LN[1],是導致SLE患者高死亡率的主要原因。目前的標準治療方案雖然能夠緩解癥狀,但無法根治疾病,且高達14%至33%的LN患者對治療無反應[2,3]。
關于伊基奧侖賽注射液
伊基奧侖賽注射液是一種個性化定制的、針對B細胞成熟抗原(BCMA)的基因改造自體 T 細胞免疫療法(CAR-T)產品,能夠識別和清除表達 BCMA 的細胞。基于對SLE病理機制的深入理解,特別是針對疾病中起到關鍵作用的B細胞和致病性抗體,伊基奧侖賽利用第二代CAR技術,能夠精準識別并清除表達BCMA的B細胞和漿細胞,從而達到清除致病性細胞和自身抗體,抑制自身免疫炎癥,降低疾病活動度的目的。
參考文獻
[1]. Saxena R, Mahajan T, Mohan C. Lupus nephritis: current update. Arthritis Res Ther. 2011;13(5):240. |
[2]. Anders HJ, Hiepe F. Treatment options for refractory lupus nephritis. Clin J Am Soc Nephrol. 2019;14:653–655. [PubMed: 30979714] |
[3]. Moroni G, Ponticelli C. The multifaceted aspects of refractory lupus nephritis. Expert Rev Clin Immunol. 2015;11:281–8. [PubMed: 25487410] |

中國南京、上海和美國加州圣荷西2024年7月25日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,宣布公司自主研發的全人源抗CD19單克隆抗體IASO-782注射液新藥臨床試驗申請(IND)獲國家藥品監督管理局(NMPA)默示許可,擬用于治療系統性紅斑狼瘡(SLE)。
此前,IASO-782注射液已分別在中美兩國獲得IND批準,針對的適應癥包括自身免疫性血小板減少癥(ITP)和溫抗體型自身免疫性溶血性貧血(wAIHA)。此次對SLE的適應癥獲批,進一步擴展了IASO-782注射液的治療領域,再次展現了馴鹿生物在生物制藥領域的創新實力和對患者需求的深刻理解。
馴鹿生物首席醫學官陳杰博士表示:"自身免疫性疾病領域是馴鹿生物戰略發展的重點,IASO-782注射液自去年起至今,已經在中美成功獲批三項IND。另外馴鹿生物的CAR-T細胞產品伊基奧侖賽注射液治療視神經脊髓炎譜系疾病以及難治性全身型重癥肌無力的臨床試驗申請也在此前獲得國家藥品監督管理局默示許可。此外,我們的合作伙伴Cabaletta Bio利用我們授權的CD19序列開發了CAR-T細胞療法用于治療自身免疫疾病, 并在包括系統性紅斑狼瘡在內的4種自免疾病中獲得美國食品藥品監督管理局的IND批準。馴鹿生物將與行業同道繼續攜手,進一步推動自身免疫性疾病治療的創新和進步,通過創新療法為患者帶來顯著的臨床益處。"
關于系統性紅斑狼瘡(SLE)
系統性紅斑狼瘡( SLE)是一種系統性自身免疫病,是最早發現自身免疫與 B 淋巴細胞亞群異常相關的人類疾病之一。以全身多系統多臟器受累,自然病程多為病情的加重與緩解交替,并且體內存在大量自身抗體為主要臨床特點。如不及時治療,會造成受累臟器的不可逆損害,最終導致患者死亡。根據Frost & Sullivan報告,2023年全球約有804.9萬SLE患者,其中,中國SLE患者數約為104.8萬人。男女患病比為1:10~12[1]。
關于IASO-782注射液
IASO-782是一種靶向CD19的全人源單克隆抗體,進行了 Fc突變以增強抗體依賴的細胞介導的細胞毒作用,功能同時保持其他 Fc功能不變(抗體依賴性細胞介導的細胞吞噬作用等)。B細胞表面抗原CD19在B細胞發育過程中表達,從前B細胞通過成漿細胞和一些漿細胞表達。許多自身免疫性疾病,如ITP和 wAIHA,主要由致病性B細胞和漿細胞產生的自身反應性抗體介導。IASO-782可以有效地清除人體內CD19陽性表達的B細胞、漿母細胞和一些漿細胞,從而減少或消除這些細胞產生的自身反應性抗體。IASO-782具有治療一系列與自身反應性抗體相關的自身免疫性疾病的潛力。同時,IASO-782為全人源抗體,潛在免疫原性較低,反復給藥后不容易產生抗藥抗體,對于治療需要長期反復給藥的自身免疫疾病具有潛在優勢。
參考文獻
1. Zhang Xiao, et al. ‘2020 Chinese guidelines for the diagnosis and treatment of systemic lupus erythematosus'. Rheumatology and Immunology Research 1, no. 1 (1 December 2020): 5–23. https://doi.org/10.2478/rir-2020-0009.
]]>
中國南京、上海和美國加州圣荷西2024年7月24日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,宣布其自主研發的全人源靶向BCMA嵌合抗原受體自體T細胞注射液(伊基奧侖賽注射液)的新藥臨床試驗申請(IND)已獲得美國食品藥品監督管理局(FDA)的默示許可,擬用于治療多發性硬化癥(Multiple Sclerosis, MS)。這是伊基奧侖賽注射液在2024年繼難治性全身型重癥肌無力(gMG)之后,成功獲得FDA批準的第二個自身免疫疾病適應癥IND。
馴鹿生物首席科學官張永克博士表示:"伊基奧侖賽注射液在中國進行的一項針對自身免疫性疾病的研究者發起臨床研究(IIT)中, 在多達6種自身免疫性疾病中被驗證有效。此次伊基奧侖賽注射液用于治療多發性硬化癥的臨床試驗申請獲得FDA的默示許可,是馴鹿生物在自身免疫性疾病治療領域持續深耕、不斷實現技術突破的有力證明。我們將始終堅持以臨床價值為導向的研發理念,解決臨床未滿足的需求,高度重視全球化戰略的實施,通過與國際臨床研究機構的緊密合作與深入交流,加快推進更多創新藥物的研發與上市進程,為全球患者帶來更多的獲益。"
關于多發性硬化癥
多發性硬化癥是一種影響中樞神經系統(CNS)的神經炎癥性疾病,它會導致脫髓鞘和神經元損傷,是年輕成年人(18至40歲)非創傷性殘疾最常見的原因之一[1]。根據Frost& Sulivan報告,2023年全球共有約307萬多發性硬化癥患者,其中美國有約40萬。多發性硬化癥的患病率在性別上有顯著差異,女性與男性的整體比例為3:1[2]。
多發性硬化癥的特征是局部淋巴細胞中樞神經系統浸潤導致髓鞘破壞和軸突損傷,這些損傷會導致神經綜合征和身體殘疾[3]。多發性硬化癥的臨床表現取決于中樞神經系統中損傷的位置,常見癥狀包括感覺和視覺障礙、運動和協調障礙,以及痙攣、疲勞、疼痛和認知缺陷[4]。大約85%至90%的多發性硬化癥患者會經歷復發-緩解病程,其特征是癥狀急性加重之后有所緩解,然而,隨著疾病的演變和癥狀恢復的不完全,大約50%的患者最終發展為繼發進展型多發性硬化癥的疾病形式,其特點是神經功能障礙的逐漸、不可逆的累積[5]。
參考文獻 |
[1] Thompson AJ, Baranzini SE, Geurts J, Hemmer B, Ciccarelli O. Multiple sclerosis. Lancet 2018; 391: 1622–36. |
[2] GBD 2016 Multiple Sclerosis Collaborators. Global, regional, and national burden of multiple sclerosis 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol 2019;18: 269–85. |
[3] Compston A, Coles A. 2008. Multiple sclerosis. Lancet 372(9648):1502–17. |
[4] BDendrou CA, Fugger L, Friese MA. 2015. Immunopathology of multiple sclerosis. Nat.Rev. Immunol.15(9):545–58. |
[5] Sospedra M, Martin R. 2016. Immunology of multiple sclerosis. Semin. Neurol. 36:115–27. |

中國南京、上海和美國加州圣荷西2024年7月5日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,與信達生物制藥集團(香港聯交所股票代碼:01801),一家致力于研發、生產和銷售腫瘤、自身免疫、代謝、眼科等重大疾病領域創新藥物的生物制藥公司,共同宣布雙方已簽署一系列合作協議,內容涉及馴鹿生物自信達生物購買合作產品福可蘇®的收益權和知識產權許可、以及信達生物對馴鹿生物的入股等相關方面。
根據協議條款,馴鹿生物將按照約定價格購買信達生物在原BCMA CAR-T合作協議項下擁有的相關權益;同時,信達生物將按照相同價格入股馴鹿生物,入股后將持有馴鹿生物18%的股份比例。在新的戰略合作框架下,雙方將在細胞免疫治療領域達成資源的高度整合。馴鹿生物將獲得福可蘇®(伊基奧侖賽注射液)的全球市場商業化權益及知識產權許可等權益,并獨立負責和決策產品的開發、生產及銷售;同時,信達生物成為馴鹿生物的戰略股東。
馴鹿生物與信達生物合作開發的福可蘇®(伊基奧侖賽注射液)于2023年6月30日獲得國家藥品監督管理局(NMPA)的批準正式上市,是全球第一款商業化全人源CAR-T產品,也是中國第一款自主研發并且全流程自主生產的CAR-T細胞療法、國內首個獲批的靶向BCMA CAR-T產品以及國內首款獲批的治療多發性骨髓瘤的細胞治療產品。2024年3月28日,其新藥臨床試驗申請(IND)再獲批準,擬擴大適應癥用于治療既往經過1-2線治療且來那度胺耐藥的復發/難治性多發性骨髓瘤患者。2024年,其治療難治性全身型重癥肌無力(gMG)等自身免疫性疾病領域的新藥臨床試驗申請(IND)也在中美兩國獲批。
馴鹿生物創始人、董事長兼首席執行官張金華女士表示:"我們衷心感謝信達生物對我們研發實力及商業化能力的高度認可和信任。過去六年中,我們與信達生物建立了堅實的合作伙伴關系,共同見證了彼此在生物醫藥領域的創新和成長。信達生物作為國內創新藥物研發的領軍企業,其在生物醫藥領域取得的卓越成就,始終是我們追求卓越、不斷學習的典范。我們堅信,通過此次戰略聯盟,將會為雙方帶來顯著的協同效應,并充分發揮各自優勢,共同致力于推動創新治療方案的發展。我們將堅守為患者帶來更多的創新治療方案的初心,在今后與信達生物的戰略合作伙伴關系中實現共贏。"
信達生物創始人、董事長兼首席執行官俞德超博士表示:"我們對馴鹿生物在細胞治療這一特殊藥品領域展現出的專業能力、創新精神和高執行力表示高度贊賞。我們相信,新的合作模式將更有利于發揮雙方現有資源的協同作用。CAR-T細胞療法作為一種前沿的生物醫藥產品,更加整合的資源、專業和團隊將更有利于充分發揮其生產制備、適應癥開發和商業化運營的潛力,而同時我們將作為股東繼續戰略支持馴鹿生物。信達生物致力于推動生物醫藥行業的發展,我們期待與馴鹿生物共同提升全球患者用藥的可及性,為更多的患者帶去希望。"
]]>
中國南京、上海和美國加州圣荷西2024年7月1日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,在2024年歐洲神經病學協會(EAN)年會上口頭報告了全人源靶向BCMA嵌合抗原受體自體T細胞注射液伊基奧侖賽注射液治療中樞神經系統免疫性疾病的臨床數據和單細胞多組學分析成果。
報告標題:中樞神經系統自身免疫性疾病的BCMA CAR-T細胞治療和單細胞分析
報告類型:口頭報告
報告時間:2024年7月1日上午 8:30 - 9:45(歐洲東部夏令時間)
報告地點:芬蘭赫爾辛基
摘要編號:A-24-12777
匯報人:華中科技大學同濟醫學院附屬同濟醫院 秦川教授
本次匯報內容基于一項研究者發起的評估輸注伊基奧侖賽注射液治療復發/難治性抗體介導的神經系統特發性炎癥性疾病的安全性和有效性的探索性臨床研究(NCT04561557)結果,該研究正在華中科技大學同濟醫學院附屬同濟醫院開展,研究者為同濟醫院神經內科王偉教授團隊。
該研究入組了12例水通道蛋白4(AQP4)抗體陽性的復發/難治性視神經脊髓炎譜系疾病(NMOSD)受試者,入組的受試者為至少使用一種免疫抑制劑治療一年以上、但癥狀控制欠佳的患者。研究結果顯示,伊基奧侖賽注射液在NMOSD中展現出良好耐受性和安全性、持久的致病性抗體清除作用以及潛在的臨床療效。具有趨化特性的CAR-T細胞可以穿透血腦屏障進入中樞,直接殺傷中樞神經系統的異常漿細胞,減少鞘內自身抗體的分泌以及免疫細胞的異常激活,從而糾正NMOSD患者中樞神經系統免疫紊亂狀態,有利于患者的中樞免疫重建。
華中科技大學同濟醫學院附屬同濟醫院和馴鹿生物作為全球最先使用BCMA CAR-T治療免疫病的研究團隊之一,其突破性的研究成果驗證了創新細胞治療用于復發難治的免疫病的臨床價值,使其應用前景在國際范圍內越來越受認可和重視。目前,BCMA CAR-T療法已被國際視神經脊髓炎研究小組(NEMOS)評價為極具潛力的治療策略之一,并納入最新的治療修訂建議(J Neurol 2024)。約翰霍普金斯大學免疫學系Maximilian F. Konig教授在Nat Rev Rheumatol雜志撰寫年度細胞治療進展(Year in review,Immunotherapies in 2023: The rise of precision cellular therapies)中指出,CAR-T療法的應用,為免疫病的創新細胞治療帶來了劃時代意義的進展。
本項臨床研究的主要研究者,華中科技大學同濟醫學院附屬同濟醫院王偉教授表示:"該研究是全球首個CAR-T療法在AQP4介導的復發/難治性NMOSD疾病領域的臨床試驗,不僅證明了伊基奧侖賽注射液在NMOSD中令人鼓舞的有效性和可控的安全性,還闡明了CAR-T治療中樞神經系統免疫性疾病的細胞動力學特征和免疫學特征,為抗體介導的自身免疫性疾病提供了一種新的治療思路,也為后續CAR-T細胞治療免疫病的產品迭代改良提供重要的科學依據。除NMOSD外,伊基奧侖賽注射液在治療其他抗體介導的自身免疫性疾病包括重癥肌無力和免疫介導性壞死性肌病中均展現出非常好的臨床療效,甚至逆轉了疾病的征象,并在國際權威學術期刊發表了多篇相關研究論文。自免疾病患者群體龐大,反復發作,難以治愈,患者需要長期甚至終身用藥,存在巨大的未被滿足的臨床需求,我們將與馴鹿生物團隊持續探索伊基奧侖賽注射液在更多難治性自身免疫性疾病中的應用,改變自免疾病的治療格局。"
]]>
中國南京、上海和美國加州圣荷西2024年6月28日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,宣布公司自主研發的全人源靶向GPRC5D嵌合抗原受體T細胞(CAR-T細胞)注射液(研發代碼:RD118)的新藥臨床試驗申請(IND)獲國家藥品監督管理局(NMPA)默示許可,擬用于治療復發/難治性多發性骨髓瘤(RRMM)。
關于RD118
RD118是一種個體化定制、自體回輸的靶向GPRC5D的基因修飾T細胞免疫治療產品,能識別和清除表達GPRC5D的惡性腫瘤細胞。GPRC5D靶點在多發性骨髓瘤細胞上高表達,在正常組織中僅限于表達在漿細胞和毛囊細胞中,是新興的多發性骨髓瘤治療的安全和有效靶點。
RD118的靶點識別結構域開發自馴鹿特有的全人源單域抗體平臺,具有高親和力,高特異性及低免疫原性的優點;胞內采用4-1BB(CD137)和 CD3ζ信號結構域融合。RD118在抗體篩選和結構優化方面進行了深度開發,候選分子表現出優異的體外殺傷活性和體內抑瘤能力,同時具有良好的體內擴增和存續能力,具備較強的開發潛力。
在一項由研究者發起的探索性臨床研究中(IIT研究,Clinicaltrials.gov登記號:NCT05759793、NCT05219721),對RD118注射液治療復發/難治性多發性骨髓瘤或漿細胞白血病患者的安全性和有效性進行了初步探索。主要研究者為上海交通大學醫學院附屬瑞金醫院糜堅青教授和華中科技大學同濟醫學院附屬同濟醫院李春蕊教授。
試驗入組既往接受過至少3線治療(必須包括至少一種蛋白酶體抑制劑和一種免疫調節劑)的多發性骨髓瘤患者或漿細胞白血病患者。既往接受過BCMA CAR-T治療的受試者也可入組。試驗對1.0~3.0 ×106 CAR-T cells/kg劑量的RD118進行了探索,截至2023年11月20日,已基本完成劑量爬坡階段的入組回輸,已回輸的受試者安全性良好,療效良好,既往接受過BCMA CAR-T治療的受試者也可獲益。
上海交通大學醫學院附屬瑞金醫院糜堅青教授表示:"研究表明,幾乎所有多發性骨髓瘤患者的惡性漿細胞均能表達GPRC5D。 通過針對GPRC5D的靶向治療,可以有效地控制多發性骨髓瘤的進展并延長患者的生存期,因此GPRC5D正逐漸成為另一個具有競爭力的靶點。此外,GPRC5D也已被證明能獨立于BCMA在骨髓瘤細胞表面表達,而且其表達也不受BCMA缺失的影響。那些經抗BCMA的CAR-T細胞治療后再次復發的患者,使用靶向GPRC5D的CAR-T細胞治療后,仍大部分會有效。這進一步說明抗GPRC5D的CAR-T細胞治療是潛在的候選治療方法。"
華中科技大學同濟醫學院附屬同濟醫院李春蕊教授表示:"CAR-T細胞療法的發展極大地改變了多發性骨髓瘤的治療格局。目前用于治療多發性骨髓瘤的靶點主要為BCMA, 由于其在大多數惡性漿細胞上的表達具有異質性,可導致不同的患者出現不同深度的療效反應。此次IIT研究結果顯示,RD118在治療靶向BCMA治療后靶點逃逸的患者以及BCMA低表達或表達不穩定的患者中展示出積極療效和可控的安全性,或將為RRMM患者提供新的治療路徑,臨床價值顯著。在未來的臨床研究中,我們將持續探索針對GPRC5D的適宜治療順序及策略。"
馴鹿生物創始人兼首席執行官張金華女士表示:"GPRC5D作為一種在多發性骨髓瘤細胞上表達的靶點,與BCMA一樣,是治療多發性骨髓瘤的重要靶點之一。多發性骨髓瘤是一種復雜的疾病,需要多種治療策略來應對不同的患者情況,RD118 作為馴鹿生物開發的GPRC5D靶點治療多發性骨髓瘤細胞的產品,在探索性臨床研究中,也展現出了巨大的潛力和治療前景,將會為醫生和患者提供了一個新的治療選擇。我們對RD118的未來充滿期待,并將繼續進行深入的研究,以確保其在臨床應用中的安全性和有效性。同時,我們也將繼續與全球的醫療專家和研究機構合作,共同推動這一領域的發展,為患者帶來更多的福音。"
]]>
中國南京、上海和加州圣荷西2024年6月15日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,在2024年歐洲血液學協會(EHA)年會上以口頭報告形式展示了全球首個獲批的全人源CAR-T產品伊基奧侖賽注射液用于治療不適合移植的高危新診斷多發性骨髓瘤(NDMM)患者的臨床數據。
報告標題: 伊基奧侖賽注射液,一種新型全人源靶向BCMA CAR-T細胞療法用于治療高危新診斷多發性骨髓瘤患者
報告類型:口頭報告
報告時間:2024年6月15日下午 16:30 - 17:45(歐洲中部夏令時間)
報告地點:西班牙馬德里
摘要編號:S206
匯報人:南京鼓樓醫院 陳兵教授
FUMANBA-2研究是一項由研究者發起的多中心、開放標簽、Ⅰ期、單臂研究,主要研究者為江蘇省人民醫院陳麗娟教授和南京鼓樓醫院陳兵教授。本次臨床研究旨在探索伊基奧侖賽注射液治療高危NDMM的有效性、安全性及藥代動力學/藥效動力學特征。受試者在輸注伊基奧侖賽注射液前需完成4個周期的誘導治療,第3個誘導治療周期結束后,經研究者評估不適合自體造血干細胞移植(ASCT)的患者將接受外周血單個核細胞采集,并后續接受伊基奧侖賽注射液治療,輸注劑量為1×106 CAR-T/kg。
本研究的主要終點為微小殘留病(MRD)陰性受試者比例和無進展生存期(PFS);次要終點包括客觀緩解率(ORR)、緩解持續時間(DOR)、安全性和藥代動力學/藥效動力學(PK/PD)。
截止至2024年1月25日,共納入16例具有高危特征的NDMM受試者,其中62.5%為雙打擊型,12.5%為三打擊型;25%的受試者伴有髓外病灶;37.5%的受試者為R-ISS III期,6.3%為R-ISS III期合并雙打擊,6.3%為R-ISS III期合并三打擊。
有效性:伊基奧侖賽注射液回輸后中位隨訪時間7.46(范圍:2.8-18.1)個月,中位PFS尚未達到,12個月PFS率為84.4% (95% CI: 49.31-96.00),100%受試者均達到MRD陰性,其中71.4% (95% CI: 25.8-92.0)受試者持續維持MRD陰性超過12個月;客觀緩解率(ORR)為100%,其中93.8%達到嚴格意義的完全緩解(sCR)。
安全性:伊基奧侖賽注射液輸注后,1-2級的細胞因子釋放綜合征(CRS)發生率為68.8%,沒有觀察到3級及以上CRS,無免疫效應細胞相關神經毒性綜合征(ICANS)和其他神經毒性發生。CRS發生的中位時間為回輸后第7(范圍:2-9)天,CRS的中位持續時間為3(范圍:1-8)天。最常見的3級及以上藥物相關不良事件為血細胞計數減少,3級及以上感染性疾病不良事件發生率為25.0%。
藥代動力學和藥效動力學:外周血的CAR拷貝數中位達峰時間為回輸后第10(范圍:7-21)天,中位峰值水平為79681.299拷貝數/微克DNA。81.25%受試者在回輸后1月內游離B細胞成熟抗原(sBCMA)達到清除;回輸后細胞因子檢測IL-6、CRP的中位達峰時間分別為第7天和第10天,血清鐵蛋白水平無顯著變化。
江蘇省人民醫院陳麗娟教授表示:"伊基奧侖賽作為一種新型全人源BCMA CAR-T療法,在高危且不適合移植的初診多發性骨髓瘤患者中展現了令人鼓舞的療效和安全性,這是國際上首次報道CAR-T療法在這一特定人群中的一線治療應用。對于初診不適合移植的NDMM,一線治療應用CAR-T療法與傳統化療和其他靶向藥治療相比,有望進一步提高緩解率,延長生存改善患者預后,這讓我們看到了伊基奧侖賽注射液在前線MM治療領域的應用潛力。將CAR-T療法提前到一線,將為患者提供更多樣化且具有前景的治療選擇。隨著研究的深入和治療策略的不斷完善,期待未來CAR-T療法惠及更多患者。"
南京鼓樓醫院陳兵教授表示:"高危初診多發性骨髓瘤患者在標準一線治療中預后較差,對于不符合ASCT條件的高危NDMM患者,伊基奧侖賽注射液展示出了優越的有效性和安全性,可實現深度、持續緩解,所有患者均實現MRD陰性,開啟了逆轉高危骨髓瘤患者不良預后的新思路。并且,相比于復發難治多發性骨髓瘤(RRMM)患者,伊基奧侖賽治療高危NDMM患者CRS發生率和嚴重程度更低,顯示出更有利的安全性。后續將在更長時間的隨訪中,進一步論證伊基奧侖賽注射液對高危初診多發性骨髓瘤患者的臨床獲益性。"
]]>
中國南京、上海和加州圣荷西2024年5月11日 /美通社/ -- 2024年5月10日,國際權威學術期刊Science子刊 《Science Immunology》(《科學-免疫》)正式發表了馴鹿生物全人源靶向BCMA嵌合抗原受體自體T細胞注射液(伊基奧侖賽注射液,研發代號CT103A)治療視神經脊髓炎譜系疾病(NMOSD)患者的單細胞多組學分析的研究論文——Single-cell analysis of anti-BCMA CAR T cell therapy in patients with central nervous system autoimmunity。此論文在世界范圍內首次描繪了CAR-T在自身免疫疾病患者體內的動態變化軌跡,分析了CAR-T細胞中樞浸潤的分子特征,揭示了CAR-T治療中樞神經系統免疫性疾病的中樞神經免疫重塑機制,并從細胞和分子水平闡明了自身免疫性疾病患者和腫瘤患者CAR-T細胞的分子差異。
馴鹿生物于2022年曾在Nature子刊Signal Transduction and Targeted Therapy(IF=38.1) 發表過伊基奧侖賽注射液治療視神經脊髓炎譜系疾病(NMOSD)研究者發起的I期臨床研究的中期結果,初步證明了伊基奧侖賽注射液在NMOSD中良好的耐受性和安全性、持久的致病性抗體清除作用以及潛在的臨床療效。然而CAR-T治療中樞神經系統免疫性疾病的細胞動力學特征和免疫學特征尚不明確。
該研究為一項研究者發起的開放評價輸注伊基奧侖賽注射液治療復發難治性抗體介導的神經系統特發性炎癥性疾病的安全性和有效性的探索性臨床研究(NCT04561557),研究者為華中科技大學同濟醫學院附屬同濟醫院王偉教授團隊。
本次對接受伊基奧侖賽注射液的5例復發難治性AQP4陽性的NMOSD患者和同期5例多發性骨髓瘤患者的血液和腦脊液樣本進行單細胞多組學分析,以研究CAR-T細胞在自身免疫性疾病患者的體內特性。研究發現,在NMOSD患者的外周血和腦脊液中B細胞免疫球蛋白重鏈可變區(IgVH)序列只存在13%的重疊區域,說明腦脊液中的B細胞多源于中樞神經固有的B細胞,而非來自外周血。而具有趨化特性的CAR-T細胞可以穿透血腦屏障進入中樞,直接殺傷中樞神經系統的異常漿細胞,減少鞘內自身抗體的分泌以及免疫細胞的異常激活,從而糾正NMOSD患者中樞神經系統免疫紊亂狀態,有利于患者的中樞免疫重建。研究表明,免疫病患者體內CAR-T細胞是以CD8+的細胞毒性CAR-T細胞表型占主要地位,且與對照組相比,CAR-T細胞殺傷功能降低。以上特性,解釋了免疫病患者CAR-T治療后CRS嚴重程度相對較輕及CAR-T細胞存續時間相對較短的現象,有利于患者盡早的免疫重建,進一步證實了伊基奧侖賽注射液在自身免疫病中良好的安全性。
此項研究主要研究者,華中科技大學同濟醫學院附屬同濟醫院王偉教授表示:"隨著CAR-T治療自身免疫性疾病的創新臨床研究在全世界不同國家和地區不斷涌現,現在全球專家對于這類創新細胞治療用于復發難治的免疫病患者的應用前景越來越重視和認可。我們此次研究是世界上首次通過對于NMOSD患者的多種體液進行單細胞多組學深度分析,從細胞分子層面描繪了CAR-T細胞進入免疫病患者體內的動態演變過程。特別是我們發現具有趨化特性的CAR-T細胞更容易穿透血腦屏障進入中樞,直接殺傷中樞神經系統的異常免疫細胞,這個發現對于治療中樞神經的免疫異常非常關鍵。同時, 通過與腫瘤病人體內的CAR-T細胞比較,我們發現了自免病人體內CAR-T細胞與腫瘤病人體內CAR-T細胞存在許多不同的特性,有望為后續CAR-T細胞治療免疫病的產品迭代改良提供重要的科學依據。"
馴鹿生物創始人兼首席執行官張金華女士表示:"很高興伊基奧侖賽注射液用于治療自免疾病的又一研究成果在《Science Immunology》發表,這是馴鹿生物與武漢同濟醫院王偉教授團隊今年以來合作的第三篇在國際權威期刊發表的自免領域學術文章。此次的研究成果再次創造了"世界首次",進一步驗證了CAR-T療法用于治療自免疾病的有效性、安全性和持久性,這也再一次堅定了馴鹿生物將持續聚焦自免領域CAR-T產品開發的決心。目前,馴鹿生物在中國和美國已獲得包括視神經脊髓炎和重癥肌無力等自免疾病的臨床批準,并計劃加速推進這些項目的進展。在BD合作方面,我們在2022年與美國細胞治療公司Cabaletta Bio達成全球獨家許可協議,我們授予Cabaletta經臨床驗證的全人源CD19序列在CAR-T自免領域全球獨家開發、生產及商業化權利,目前該產品在系統性紅斑狼瘡/狼瘡腎炎、特發性炎性肌病、系統性硬化病以及重癥肌無力等多項自免適應癥IND獲批,正在穩步推進臨床。我們會積極拓展更多在自免領域的全球BD合作,加速產品開發,使全球的自免病人能夠更快地用上更安全有效的藥物。"
]]>
中國南京、上海和美國加州圣荷西2024年4月5日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,宣布公司自主研發的全人源靶向BCMA嵌合抗原受體自體T細胞注射液(伊基奧侖賽注射液,研發代號CT103A)新藥臨床試驗申請(IND)獲美國食品藥品監督管理局(FDA)默示許可,擬用于治療難治性全身型重癥肌無力(Generalized Myasthenia Gravis,gMG),該產品此項適應癥中國IND于今年1月份已獲NMPA批準。
基于一項研究者發起的開放評價輸注伊基奧侖賽注射液治療復發/難治性抗體介導的神經系統特發性炎癥性疾病的安全性和有效性的探索性臨床研究(NCT04561557),該研究中入組了2例難治性MG受試者,其中1例受試者為33歲女性,AChR-IgG和Titin-IgG陽性,入組前21個月接受了胸腺切除術治療,經膽堿酯酶抑制劑、糖皮質激素、免疫抑制劑及靶向CD20單抗治療仍未達到臨床緩解;另1例受試者為60歲女性,MuSK-IgG4陽性,20年病史,既往接受過激素、免疫抑制劑、靶向CD20單抗等多種治療無效。2例受試者分別接受了1.0×106CAR-T/Kg的伊基奧侖賽注射液單次回輸治療。研究結果今年2月在國際權威學術期刊《EMBO Molecular Medicine》正式發表。
安全性:2例受試者中,僅1例受試者發生了1級的細胞因子釋放綜合征(Cytokine Release Syndrome,CRS),未發生免疫效應細胞相關神經毒性綜合征(Immune effector Cell-Associated Neurotoxicity Syndrome,ICANS),≥3級的血細胞減少均在回輸后4周內恢復。相較于在多發性骨髓瘤適應癥研究中的安全性譜,未發現新的安全性風險,且安全性更優。
有效性:2例受試者的臨床癥狀持續改善超過18個月。伊基奧侖賽注射液回輸后3個月開始,患者肢力和肺活量明顯改善,重癥肌無力-日常生活活動評分(MG-ADL)、重癥肌無力定量評分(QMG)、重癥肌無力-生活質量評分(MG-QOL)和改良Rankin評分(mRS)持續改善。
PK/PD:伊基奧侖賽注射液回輸后在受試者體內擴增良好,2例受試者的抗AChR和抗Titin抗體、抗MuSK抗體在回輸后均迅速降低并長期維持在極低水平。2例受試者的B細胞和漿細胞在回輸后2個月內降低至無法檢測,而后逐漸恢復。兩例受試者的B細胞在回輸后18個月均已恢復至正常水平,其中約80%為幼稚B細胞,而漿細胞仍維持較低水平。該結果顯示CAR-T細胞治療的長期療效,可能與幼稚表型為主的B細胞重建而漿細胞持續清除有關。
本項臨床研究的主要研究者,華中科技大學同濟醫學院附屬同濟醫院王偉教授表示,"自身免疫疾病現有治療手段有限,難以治愈,反復發作,會給患者及家屬帶來身體上和心理上的極大負擔。我們和馴鹿生物合作,率先將BCMA CAR-T這一先進的細胞療法應用到包括MG在內的多種嚴重的自身免疫疾病中,并取得了非常好的臨床療效,在國際權威學術期刊發表了多篇研究論文。此次伊基奧侖賽注射液自免適應癥重癥肌無力美國IND的獲批,代表了FDA對于我們研究方向具有的潛在臨床價值的又一次肯定。 我們將進一步探索BCMA CAR-T在更多難治性自身免疫性疾病的應用。"
馴鹿生物創始人兼首席執行官張金華女士表示,"很高興伊基奧侖賽注射液重癥肌無力適應癥在美國獲批臨床。這是馴鹿在美國取得的第一個CAR-T應用在自免領域的臨床批件。這不僅代表我們在細胞治療自免領域研發實力和產品潛在價值得到國際認可,更是馴鹿生物開啟拓展國際自免市場新征程的重要里程碑。感謝幫助我們開展臨床試驗的臨床醫生團隊的付出,也感謝參與臨床試驗的病人和家屬對我們馴鹿的信任。看到反復受到疾病折磨,生活無法自理的嚴重自免疾病患者經過伊基奧侖賽治療后恢復正常的生活是我們開發的最大動力。我們將積極推進伊基奧侖賽在美國的臨床進程,為全球的重癥肌無力病人提供更高效、持久的治療方案。同時,我們也將致力于拓展突破性的細胞療法到更廣泛的自免疾病領域,力爭改善全球自免疾病的治療格局,讓更多的嚴重自免病人恢復健康的生活。"
關于重癥肌無力
重癥肌無力(Myasthenia Gravis,MG)是一種由自身抗體介導的神經肌肉接頭傳遞障礙疾病,MG的主要臨床表現為局部或全身肌肉的肌力下降,可累及眼肌、呼吸肌、四肢肌等重要肌群,對患者的生活質量產生巨大的負面影響,而且肌無力危象導致的吞咽或呼吸困難會危及生命。MG的主要致病抗體包括 AChR、MuSK 及 LRP4抗體,極少部分患者血清無上述可檢測到的抗體 1。MG可發生于任何年齡段,女性略多于男性2。根據相關研究,美國MG的發病率為3.1/10萬人,患病率為37.0/10萬人3,預估2023年美國MG發病人數約1萬人,患病人數約12.4萬人。
關于馴鹿生物
馴鹿生物是一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司。公司以開發血液腫瘤細胞類藥物和抗體藥物為創新基石,向自身免疫疾病拓展,擁有完整的從早期發現、臨床開發、注冊申報到商業化生產的全流程能力。
公司現有10余個處于不同研發階段的創新藥物品種,其中伊基奧侖賽注射液(全人源BCMA CAR-T產品)已獲國家藥監局(NMPA)批準上市用于治療復發/難治多發性骨髓瘤,同時該適應癥也已獲得美國FDA批準開展臨床。
馴鹿生物憑借其強大的管理團隊、創新的產品線、自有的GMP生產和超強的臨床開發能力,旨在提供變革性、可治愈的創新型療法,為中國乃至全球患者帶來治愈的希望。
了解更多信息,請訪問公司官網:www.iasobio.com 或領英賬號:www.linkedin.com/company/iasobiotherapeutics。
參考文獻
1. 中國重癥肌無力診斷和治療指南(2020)版 |
2. Incidence, mortality, and economic burden of myasthenia gravis in China: A nationwide population-based study - The Lancet Regional Health – Western Pacific. |
3. Rodrigues, E. et al. Incidence and prevalence of myasthenia gravis in the United States: A claims-based analysis. Muscle Nerve 69, 166–171 (2024). |
]]>