中國南京、上海和美國加州圣荷西2024年12月10日 /美通社/ -- 馴鹿生物,一家專注于細胞創新藥物研發、生產和銷售的生物制藥公司,在2024年第66屆美國血液學會(ASH)年會上以壁報形式展示了其全人源靶向BCMA 的CAR-T產品伊基奧侖賽注射液的CAR-T細胞存續對復發/難治性多發性骨髓瘤臨床預后的影響。研究成果證實了效靶比對骨髓瘤控制具有顯著影響,并進一步揭示了骨髓瘤的CAR-T治療需要選擇CAR-T細胞存續長且存續不受可溶性B細胞成熟抗原(sBCMA)基線水平影響的CAR-T藥物。
報告標題: Impact of CAR T-Cell Persistence on Clinical Outcomes in Relapsed/Refractory Multiple Myeloma: Insights from the Phase 2 FUMANMA-1 Study(在FUMANBA-1 2期研究中,CAR-T細胞存續對復發/難治性多發性骨髓瘤臨床預后的影響)
報告編號: 4761
展示時間: 2024年12月9日,周一,6:00 PM -8:00 PM(太平洋標準時間)/ 2024年12月10日,周二,10:00 AM-12:00 PM(北京時間)
研究結論
- 效靶比是接受伊基奧侖賽注射液治療的患者臨床預后的一個關鍵決定因素,強調了CAR-T細胞存續持久性的重要性。
- 效靶比或可成為未來治療規劃的生物標志物,強調了為實現最佳疾病控制而需要延長CAR-T細胞存續的必要性。
- 同時,患者基線sBCMA水平并不會對伊基奧侖賽的存續和療效產生影響。
本次對FUMANBA-1 2期研究的回顧性分析主要探索CAR-T細胞存續與無進展生存期(PFS)及至疾病進展(TTP)的關系,并從效靶比,即載體拷貝數(VCN)持續時間與基線可溶性B細胞成熟抗原(sBCMA)的比值,角度分析基線sBCMA水平對其影響。中位隨訪至24.67個月,14個治療中心的107名受試者接受了伊基奧侖賽注射液的治療。
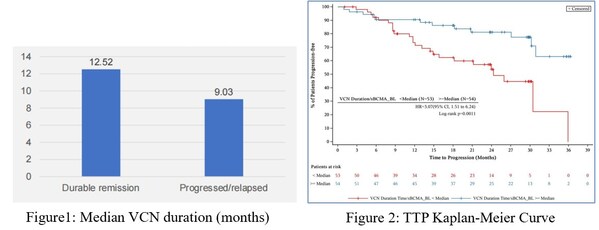
在數據截止時,持續緩解組較進展或復發組的中位VCN持續時間有更長的趨勢(12.52m vs 9.03m),如圖1。107例受試者的中位效靶比為1.05(day *mL/ng)。如圖2所示,效靶比較低的受試者疾病進展的風險顯著更高,其至疾病進展時間(TTP)的風險比(HR)為3.07(95% CI:1.51–6.24,p=0.0011),無進展生存時間(PFS)的風險比為2.3(95% CI:1.27–4.14,p=0.0045),兩者均表明效靶比與疾病進展風險顯著相關。
在基線特征中,包括ECOG評分、R-ISS和ISS疾病分期、骨髓瘤BCMA表達、腫瘤負荷、基線sBCMA水平、既往自體干細胞移植(ASCT)、三線治療暴露、橋接治療、既往CAR-T治療以及淋巴清除預處理等因素,僅既往自體干細胞移植(n=30)和抗藥抗體(ADA,作為輸注后因素)與伊基奧侖賽的存續顯著相關,風險比(HR)分別為0.35和5.79,如表1所示。
在107例受試者中,僅有14例表現出中性粒細胞恢復障礙,其特征為中性粒細胞計數持續14天或更長時間低于500/μl。與無此表現的受試者相比,VCN持續時間沒有顯著差異,表明伊基奧侖賽的長期存續并不增加血液學毒性。
本次臨床研究的主要研究者,中國醫學科學院血液病醫院邱錄貴教授和華中科技大學同濟醫學院附屬同濟醫院李春蕊教授表示:
"本次回顧性分析從效靶比(VCN存續/sBCMA)角度探索CAR-T治療后的長期療效影響的決定因素,證實效靶比對骨髓瘤長期控制(PFS和TTP)的顯著影響,提示骨髓瘤的CAR-T治療需選擇"效"長,并且"效"不受"靶"影響的CAR-T產品,即選存續長,存續不受sBCMA水平影響的CAR-T療法。
本研究結構也進一步揭示了CAR-T細胞長期存續對于改善復發/難治性多發性骨髓瘤受試者預后的重要作用。在2023年的ASH報告中,我們已明確證實了CAR-T細胞存續時間與微小殘留病灶(MRD)陰性持續狀態之間存在正相關關系。伊基奧侖賽的CAR-T細胞中位存續時間長達419天,這可能是其實現97.8%的高MRD陰性率及12個月時81.7%的MRD陰性持續率的關鍵因素。
此外,值得注意的是,在本次研究的107例受試者中,僅有14例出現超過14天的粒細胞缺乏癥,這表明伊基奧侖賽的長期存續并不會增加血液學毒性,進一步驗證了該療法的安全性。"
馴鹿生物首席醫學官陳杰博士表示:"此次馴鹿生物在ASH年會期間所展示的研究結果數據,著重強調了效靶比對多發性骨髓瘤疾病控制的重要影響。數據顯示,效靶比高于中位值的患者其無進展生存期和疾病進展時間的預后更好。這一結果進一步證實了CAR-T細胞在患者體內長存續對于實現長期療效的顯著正面作用。伊基奧侖賽注射液在研發初期便精心篩選出不受sBCMA水平影響的候選分子,為受試者提供更為顯著且持久的疾病緩解。同時,此次研究的結果還顯示,在接受伊基奧侖賽注射液治療后,僅有少數患者出現超過14天的粒細胞缺乏癥。表明伊基奧侖賽的長期存續并不會增加患者的血液學毒性,進一步驗證了伊基奧侖賽的安全性。
我們對伊基奧侖賽注射液的顯著療效和安全性充滿信心,目前馴鹿生物已啟動并在快速推進該療法用于二/三線多發性骨髓瘤的隨機對照3期臨床研究,我們期待盡早將這一先進療法帶給國內外的更廣大的多發性骨髓瘤患者。"

中國南京、上海和美國加州圣荷西2024年9月30日 /美通社/ -- 巴西時間9月23日,國際骨髓瘤學會(IMS)年會前夕,馴鹿生物首席科學官張永克博士與中國血液腫瘤領域權威專家中國醫學科學院血液病醫院邱錄貴教授、浙江大學醫學院附屬第一醫院金潔教授等一行,造訪了巴西坎皮納斯州立大學(Unicamp)血液中心,與巴西專家和研究人員深入交流經驗、并積極探索在為腫瘤患者開發創新療法方面的潛在合作機會。
在Unicamp血液中心的會談中,巴西方面主要介紹了其在擴大腫瘤創新療法可及性方面的進展。例如,CEPID CancerThera機構(此次訪問組織者)詳細介紹了其正在開發的治療診斷模型Theranostic,Ribeirão Preto高級治療中心Nutera介紹了其CAR-T細胞研究情況。中方對巴西在該領域尤其是血液腫瘤領域的發展表現出了極大的興趣。
隨后中方代表重點介紹了CAR-T細胞療法的治療優勢——CAR-T療法利用腫瘤癌癥患者自身機體的免疫細胞來治療血液腫瘤,為那些蛋白酶抑制劑、免疫調節劑和抗CD38單克隆抗體一線至三線治療失敗的患者帶來了新的治療選擇。
會談后,中方代表團參觀了該血液中心用于開發CAR-T細胞療法的淋巴細胞收集裝置,以及Unicamp Hospital de Clínicas的核醫學服務,并參觀了為骨髓移植后恢復期的患者配備的先進設施。此次訪問為合作打開了新的大門,中國代表團強調了未來在生物技術、醫院或研究機構領域合作的重要性。

從左到右:前排為 Claudia Wu(Shamano集團)、Camen S. P. Lima(CancerThera)、金潔(浙江大學醫學院附屬第一醫院)和郝牧(中國醫學科學院血液病醫院);中間一排為:邱錄貴(中國醫學科學院血液病醫院)、王偉(Shamano集團)、Francisco Pessine(化學研究所/Unicamp);第三排為,Carmino A. de Souza (CancerThera)、Celso D. Ramos(CancerThera)、張永克(馴鹿生物)、Li Li Min(醫學科學學院/Unicamp)、Maria Carolina S. Mendes(CancerThera)、Bruno D. Benites(Hemocentro/Unicamp)和Elvira Correa(CancerThera) (圖片源自CEPID CancerThera官網)
"因為此次中國代表團的一半成員均為血液腫瘤專家,所以代表團的最大興趣是了解我們在CAR-T領域的進展",巴西血液腫瘤學家、Unicamp醫學科學學院教授兼RIDC CancerThera研究員 Carmino Antonio de Souza 博士評論道。
"我們非常重視與巴西的關系,我們在多個領域有著悠久的合作歷史。現在,我們正在努力將馴鹿生物自主研發的產品帶到這里,我們的目標就是將這種新的CAR-T療法帶給更多的患者,"馴鹿生物首席科學官張永克博士表示。
馴鹿生物致力于為中國及全球患者帶來可治愈的且可及的CAR-T療法,同時正積極主動地與全球來自科研、技術、臨床和商業化等領域的合作伙伴共同探索創新的合作模式,以加快CAR-T等創新療法更廣泛的臨床應用。

中國南京、上海和美國加州圣荷西2024年9月27日 /美通社/ -- 馴鹿生物,一家致力于細胞創新藥物研發、生產和銷售的生物制藥公司,今日宣布在2024年國際骨髓瘤學會(IMS)年會上以壁報形式展示了其全人源靶向BCMA的CAR-T療法——伊基奧侖賽注射液(福可蘇®)在FUMANBA-1研究中用于治療復發難治性多發性骨髓瘤(R/RMM)合并腎功能損傷患者的預后研究數據。研究結果表明伊基奧侖賽注射液對于伴有腎功能損傷的R/R MM患者展現出同等的療效,且安全性表現良好,同時能改善患者的腎功能狀況。
摘要編號:P-100
摘要標題:Outcomes of R/R MM Patients with Renal Function Impairment Treated with Eque-cel in the Pivotal Phase 2 FUMANBA-1 Study
展示時間:2024年9月26日(UTC-3)
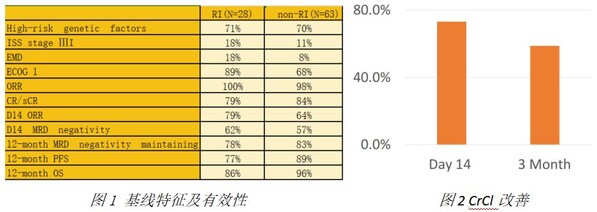
此次壁報內容基于FUMANBA-1研究(研究登記號:NCT05066646)。此項研究中共納入91例既往無CAR-T治療史的患者接受伊基奧侖賽注射液的治療,中位隨訪時間為18.07個月。根據CAR-T治療時肌酐清除率(CrCl)是否≤70ml/min,將患者分為腎損組和非腎損組。其中28例患者屬于腎損組伴有腎功能損傷,CrCl在40至70 ml/min之間,63例屬于非腎損組,CrCl>70 ml/min。
結果顯示,在療效方面,腎損組的大多數基線特征與非腎損組相當。腎損組也能實現與非腎損組一樣快速和深入的緩解。腎損組的長期療效與非腎損組相當。(如圖1)在安全性方面,兩組之間未觀察到顯著的CRS和嚴重CRS發生率差異。非腎損組中有1例2級ICANS,腎損組中沒有ICANS發生。腎損組中短期嚴重細胞減少癥的發生率稍高,但到第60天時同樣恢復。研究中有73.2%和58.8%患者在伊基奧侖賽回輸后14天和3個月肌酐清除率較基線進一步提升。(如圖2)
結論:在FUMANBA-1研究中,接受伊基奧侖賽注射液治療的復發難治性多發性骨髓瘤合并腎功能受損患者也能實現快速、深入且持久的緩解,且不影響安全性。且部分患者由于伊基奧侖賽輸注后清除了骨髓瘤細胞,腎功能得到了改善。為真實世界中中重度腎損傷患者的CAR-T治療提供了參考。
本次臨床研究的主要研究者,中國醫學科學院血液病醫院的邱錄貴教授和華中科技大學同濟醫學院附屬同濟醫院李春蕊教授表示:"以往,臨床醫生在治療復發難治性多發性骨髓瘤合并腎功能受損的患者時,會擔心患者出現不耐受的情況。而此次研究結果證實,即便在伴有一定腎功能受損的患者中,伊基奧侖賽注射液同樣能夠實現快速、深入且持久的緩解,其療效表現與非腎功能受損患者組相當,這一發現無疑為臨床治療提供了寶貴的參考。尤為值得一提的是,隨著骨髓瘤細胞的有效清除,患者的腎功能還得到了顯著改善,這一額外獲益進一步凸顯了伊基奧侖賽注射液在治療復雜病例中的獨特價值。"
馴鹿生物首席科學官張永克博士表示:"非常高興能將伊基奧侖賽注射液(福可蘇®)用于治療復發難治性多發性骨髓瘤(R/R MM)合并腎功能損害患者的預后研究數據展示在IMS大會上。FUMANBA-1研究中的數據表明,對于有一定腎功能損傷的R/RMM患者,伊基奧侖賽注射液展現了令人振奮的療效和安全性。并且基于伊基奧侖賽快速且深度的骨髓瘤細胞清除作用,同時能夠改善患者的腎功能。相信這一發現將為中重度腎功能受損的R/RMM患者真實世界治療提供參考,進一步推進CAR-T療法在骨髓瘤治療領域更廣法的應用。"
關于FUMANBA-1研究
該研究是一項Ib/II期,單臂,多中心研究,旨在評估全人源靶向BCMA CAR-T細胞療法伊基奧侖賽注射液對既往接受過3線及以上治療復發難治性多發性骨髓瘤患者有效性和安全性的研究。

南京、上海和加州圣荷西2023年11月10日 /美通社/ -- 2023年11月5日,第六屆中國國際進口博覽會在上海舉行。馴鹿生物在進博會上展示了其多項前沿的細胞治療技術和創新產品,同時,還與多家一流醫藥機構達成了關于其全球首個全人源CAR-T產品福可蘇®的多元化戰略合作,共同致力于推動細胞治療領域的發展。通過共享資源和技術,馴鹿生物與合作伙伴們將合力打造創新服務方案,讓細胞治療藥物惠及更多患者。
探索創新患者服務方案,多方聚力
馴鹿生物致力于為全球患者提供服務,本次簽約聯合國藥控股、上藥控股及華潤醫藥等多方共同推進福可蘇®的商業化進程,拓展市場渠道,提高藥品的可及性。通過與中國醫藥行業的領軍企業的合作深化,將為福可蘇®的商業化進程提供強大的支持和保障,惠及更多患者。同時,馴鹿生物持續關注著患者對創新藥物的可及性和可支付性,與鎂信健康、宸汐健康進一步加深了在患者關愛和服務層面的合作。作為行業領先的創新型醫療服務及保障平臺,他們將與馴鹿生物共同探索多元化支付手段與合作模式,進一步構建面對血液腫瘤患者的多層次支付體系,提供更加靈活和可持續的醫療保障。
馴鹿生物高級副總裁兼首席商務官張華先生表示:"馴鹿生物從一家初創公司逐漸成長為生物醫藥領域的創新引領者,離不開每一位合作伙伴的鼎力支持。馴鹿生物正在打造中國服務于全球的醫療中心,以展現中國的創新技術及醫療實力,我們希望依托與眾多優秀醫藥公司的戰略合作方式,助力國內乃至全球的骨髓瘤患者能夠從靶向BCMA CAR-T療法中獲益。同時,定制化的醫療和服務,也將成為醫藥行業未來發展的新方向。"
馴鹿生物將充分把握每一個機遇,務實推進各項戰略合作。未來,馴鹿生物將繼續致力于細胞創新藥物和技術的研發,與合作伙伴們攜手,讓更有效、更安全的治療方案惠及全球患者。
]]>系統性紅斑狼瘡(SLE)是一種可能引起多器官嚴重損傷的慢性自身免疫性疾病,最常見于15至40歲的年輕女性。SLE會使自身免疫系統攻擊全身的健康組織,其特征是B細胞功能異常和自身抗體產生,導致一系列臨床表現,包括末端器官損傷和死亡風險增加。美國或有16-32萬患者受到影響,而我國患病人數可高達100萬人。活動性狼瘡腎炎(LN)是SLE最常見的終末器官表現,約40%的SLE-者受其影響。在這些患者中,終末期腎病的風險約為17%,死亡風險約為12%,均在診斷后10年內發生。
馴鹿生物于2022年10月授予 Cabaletta經臨床驗證的全人源CD19序列的全球獨家開發、生產及商業化權利,應用于Cabaletta在自身免疫性疾病領域開發修飾T細胞的產品中。
通過該項合作,馴鹿生物將有資格獲得最多兩款產品, 累計約為1.62億美元的首付款以及潛在開發和商業化里程碑付款和銷售分成。同時,馴鹿生物擁有在大中華區使用該許可序列開發Cabaletta產品并將其商品化的優先權。
關于Cabaletta Bio
Cabaletta Bio(納斯達克股票代碼:CABA)是一家致力于發現與開發工程化T細胞療法的臨床階段生物技術公司。此類療法有可能為自身免疫性疾病患者提供深度和持久,或者有可能是治愈性的治療。CABA?平臺—包括針對自身免疫性的嵌合抗原受體T細胞CARTA (Chimeric Antigen Receptor T cells for Autoimmunity)策略(其中以CABA-201,一種包含4-1BB的CD19-CAR T細胞為領先產品),和Cabaletta Bio的專有嵌合自身抗體受體T細胞CAART(Chimeric AutoAntibody Receptor T cells)策略(包含多種候選產品,包括針對黏膜尋常型天皰疹的DSG3-CAART,針對MuSK重癥肌無力的MuSK-CAART)—為眾多自身免疫性疾病提供了多種潛在治愈性的療法。Cabaletta Bio的總部位于美國賓夕法尼亞州的費城。如需了解更多信息,請訪問 www.cabalettabio.com,或LinkedIn和Twitter上公司賬號。
關于馴鹿生物
馴鹿生物是一家處于臨床階段、致力于細胞創新藥物開發的生物制藥公司。公司以開發血液腫瘤細胞類藥物和抗體藥物為創新的基石,向實體瘤和自身免疫疾病拓展,擁有完整的從早期發現、注冊申報、臨床開發到商業化生產的全流程平臺能力及包括了全人源抗體發現平臺、高通量CAR-T藥物優選平臺、通用CAR技術平臺、生產技術平臺、臨床轉化研究平臺在內的多個技術平臺。
公司現有10個在研品種處于不同研發階段,其中進展最為迅速的候選產品伊基侖賽注射液上市申請(NDA)獲國家藥監局(NMPA)正式受理并納入優先審評資格,并已獲得美國FDA批準注冊臨床,用于治療復發/難治多發性骨髓瘤,該產品被NMPA納入“突破性治療藥物”品種,并先后獲FDA授予“孤兒藥(ODD)”認定及再生醫學先進療法(RMAT)和快速通道(FT)資格。除多發性骨髓瘤外,伊基侖賽注射液新增擴展適應癥-抗體介導的視神經脊髓炎譜系疾病(Neuromyelitis Optica Spectrum Disorder,NMOSD)的臨床試驗申請(IND)已獲NMPA批準;公司自主研發的創新候選產品CT120(全人源CD19/CD22雙靶點CAR-T細胞注射液)已進入臨床研究階段,適應癥分別為CD19/CD22陽性的復發/難治B細胞非霍奇金淋巴瘤(B-NHL)和復發/難治急性B淋巴細胞白血病(B-ALL),并已獲得FDA授予“孤兒藥 (ODD)”認定。
公司先后和海外細胞治療公司Sana Therapeutics,Cabaletta Bio及Umoja Biopharma達成了基于馴鹿生物臨床驗證全人源的CAR結構或序列的BD授權或研發合作,積極探索下一代細胞治療產品的開發。馴鹿生物憑借其強大的管理團隊、創新的產品線、自有的GMP生產和超強的臨床開發能力,旨在提供變革性、可治愈和可負擔的創新型療法,以滿足中國乃至世界各地患者未滿足的醫療需求。
了解更多信息,請訪問公司官網:www.iasobio.com或領英賬號:www.linkedin.com/company/iasobiotherapeutics。
南京、上海和美國圣荷西2022年11月21日 /美通社/ -- 馴鹿生物("IASO Bio"),一家從事發現、開發和制造創新藥物的臨床階段生物制藥公司,Umoja Biopharma, Inc. 一家以開創即用型綜合療法,可重新編程免疫細胞以治療實體瘤和血液系統惡性腫瘤的免疫腫瘤學公司,今天共同宣布雙方已達成一項研究協議,以評估 Umoja 的 iCIL 平臺結合IASO 的業界最優 CAR,開發即用型療法,為急性髓性白血病(AML)及潛在其他血液系統惡性腫瘤患者,提供可負擔、便捷的治療方案。
馴鹿生物首席執行官汪文博士表示:"我們很高興能與Umoja達成合作。我們的全人源 CAR 結構的優勢在針對多個靶點,廣泛血液系統惡性腫瘤的臨床試驗中已經得到驗證。我們很高興將我們的 CAR 結構與 Umoja 的新型 ShRED 技術相結合,以更低的成本開發即用型下一代新型細胞療法。"
馴鹿生物利用其專有的全人源抗體發現平臺(IMARS)、高通量 CAR 篩選平臺、快速臨床試驗的執行力,以及自有的質粒、病毒載體和 CAR-T 細胞生產成功率均超過90%的GMP生產設施來篩選潛在業界最優的 CAR。同時,公司也致力于將其創新療法帶給全球更廣泛的人群。
"我們相信,結合我們的 iCIL 平臺和馴鹿生物的 CAR 開發的即用型療法將為更廣泛的患者獲得血液惡性腫瘤的最優療法鋪平道路,"Umoja聯合創始人兼首席執行官,醫學博士 Andy Scharenberg說,"隨著醫學和科學的進步,癌癥患者的治療方法也在進步,但我們還有很長的路要走。 Umoja 和馴鹿生物之間的合作旨在推動下一階段的癌癥治療。"
Umoja 基于 iPSC 的同種異體細胞治療平臺使用其合成受體啟用分化(ShRED)制造工藝來指導 iCILs 的分化和擴增,iCILs 是一種新型的先天性淋巴細胞,具有強大的抗腫瘤活性。 ShRED 生成的 iCIL 在無飼養層細胞培養100 天后仍保留功能,并且由于 ShRED 不需要飼養層細胞來誘導效應細胞擴增,因此這些細胞無需多種復雜原材料即可保持其增殖能力。
關于Umoja的iCIL?平臺:誘導的細胞毒性先天淋巴細胞
Umoja的iCIL?平臺是一種全新的細胞生產工藝,可誘導多能干細胞大規模分化為抗癌細胞。這些細胞,稱為誘導細胞毒性先天淋巴細胞或iCIL,輸注到患者體內后可增強其內源性抗腫瘤免疫功能,并與VivoVec產生的體內CAR-T細胞一起產生協同作用。與VivoVec生成的CAR-T細胞類似,iCIL可以利用我們的RACR/CAR?和TumorTag?平臺進行基因編輯,來支持細胞存活并靶向腫瘤及其基質細胞,從而可能減少不良事件并延長患者的緩解期。關于Umoja的平臺的更多信息,請訪問https://www.umoja-biopharma.com/our-science/。
]]>NMOSD是一種罕見的、終生的、進展性的中樞神經系統自身免疫性疾病,以視神經和脊髓的炎性脫髓鞘及軸突損傷為特征,可致盲、癱瘓、大小便失禁。NMOSD首次發病見于各年齡階段,以青壯年居多,中位數年齡為39歲,亞裔人群較高加索人群高發。中國發病率約為0.41/10萬,患病率約為3.31/10萬。NMOSD為高復發、高致殘性疾病,多數受試者遺留有嚴重的后遺癥。
該研究為一項研究者發起的開放評價輸注伊基侖賽細胞治療復發/難治性抗體介導的神經系統特發性炎癥性疾病的安全性和有效性的探索性臨床研究(NCT04561557),研究者為華中科技大學同濟醫學院附屬同濟醫院王偉教授團隊。
該研究入組了漿細胞產生的AQP4抗體陽性的難治性NMOSD受試者,入組的受試者為至少使用一種免疫抑制劑治療一年以上、但癥狀控制欠佳的患者。截至2022年3月20日,12例受試者接受了CT103A注射液回輸,其中0.5×106 CAR-T細胞/kg劑量組3例受試者、爬坡階段與擴展階段1.0×106 CAR-T細胞/kg劑量組分別3例和6例受試者接受了伊基侖賽注射液注射液CAR-T細胞回輸。
安全性:在本研究劑量探索階段中,6例劑量爬坡階段受試者完成了28天的DLT訪視,均未觀察到方案預先規定的DLT(Dose-Limiting Toxicity,劑量限制性毒性)事件。所有12例受試者發生了1至2級的CRS(Cytokine Release Syndrome,細胞因子釋放綜合征)。所有12例受試者未發生任何ICANS(Immune effector Cell-Associated Neurologic Syndrome,免疫效應細胞相關神經系統綜合征)。相較于已在多發性骨髓瘤適應癥研究中建立的安全性譜,未發現新的安全性風險。
有效性:中位隨訪5.5個月后,11例(92%)受試者未觀察到NMOSD的復發。相較于回輸前,伊基侖賽普遍降低了NMOSD受試者的EDSS(Expanded Disability Status Scale,擴展的殘疾狀態評分量表)評分,其中6例(50%)受試者視力改善、8例(67%)受試者行走能力改善、9例(75%)受試者直腸膀胱功能改善。在其它生活質量量表與疼痛量表方面也觀察到了相應的改善。
PK/PD:伊基侖賽細胞回輸后在受試者體內均擴增良好,同時伴隨血清AQP4抗體水平的明顯下降并持續維持在極低水平。
上述研究數據表明,伊基侖賽在復發/難治性NMOSD的治療中初步表現出安全可控和潛在療效。
除本次發表的研究結果外,馴鹿生物和研究者團隊仍在持續探索伊基侖賽在治療NMOSD中的細胞與分子生物學機制,以及伊基侖賽在治療其他抗體介導的自身免疫性疾病包括重癥肌無力、慢性炎性脫髓鞘性多發性神經病以及免疫介導性壞死性肌病中的安全性和有效性,敬請期待后續研究結果。
CD19靶向嵌合抗原受體(CAR)T細胞療法在臨床上已經被證明能深度并持久的清除B細胞,從而在B細胞惡性腫瘤的治療中表現出顯著療效,這一變革性療法為B細胞介導自身免疫性疾病患者的治療前景提供了有力支持。治療自身免疫病的現有療法有兩方面的局限性:療效有限,從而導致耐藥性和疾病不受控,或者與治療相關的高發病率和死亡率。
"通過與馴鹿生物的合作,Cabaletta可以在我們新開發的以CD19為靶點的CAR-T候選產品CABA-201中使用CD19序列。含有這一CD19序列的產品已經開展了臨床評估,安全信數據和有效性數據支持針對患有自身免疫性疾病的患者進行臨床開發,"Cabaletta的首席執行官和聯合創始人Steven Nichtberger博士表示,"我們很高興能夠在CABA-201的開發上取得進一步的進展,它將推動我們開發旨在為自身免疫性疾病患者提供深度、持久并有可能具有治愈潛力的療法。"
馴鹿生物首席執行官汪文博士表示:"我們很高興能與Cabaletta達成合作。我們的全人源抗體庫開發的這一CD19序列的安全性和有效性潛力已經在我們自主開發的全人源CD19/CD22雙靶向嵌合抗原受體T細胞療法CT120的IIT臨床試驗中得到了驗證,迄今為止取得了良好的臨床數據。CT120已在中國獲得了非霍奇金淋巴瘤(NHL)和急性淋巴母細胞白血病(ALL)的兩項IND批準,并獲得了FDA對ALL的孤兒藥認證(ODD)。公司保留了CT120在全球的開發權益,并正在推進該療法在中國的開發。我們很高興能與Cabaletta合作,幫助實現CD19序列價值的最大化,讓更多自身免疫性疾病患者群體從中受益。"
]]>
南京、上海和加州圣荷西2022年5月20日 /美通社/ -- 歲月的沉淀鑄就了馴鹿的成長,也為馴鹿生物品牌注入了新的內涵與精神。站在2022年的起跑線上,初心不變再出發,馴鹿生物將以全新的LOGO視覺,創見細胞免疫治療新未來。
2022年3月18日,馴鹿生物發布全新品牌LOGO,與此同時公司簡稱由"馴鹿醫療"正式變更為"馴鹿生物"。
品牌關鍵詞:馴鹿生物,跨越,專業,生命力
馴鹿生物秉持進化的原則對舊LOGO進行升級,新LOGO更強調品牌的靈活多樣性,契合當下審美和傳遞馴鹿精神。
馴鹿,吉祥之物,是生命力旺盛的象征。
馴鹿生物LOGO"換裝",是公司品牌具有重大意義的一次煥新。馴鹿生物將一如既往的致力于創造生命的無限可能,不負使命,為患者帶來治愈的希望。

南京、上海和美國舊金山2022年3月2日 /美通社/ -- 馴鹿醫療,一家處于臨床階段、致力于細胞治療和抗體藥物開發和產業化的創新生物制藥公司,今日宣布,公司位于南京的商業化生產基地順利通過江蘇省藥品監督管理局(JSMPA)的全面審核,被授予《藥品生產許可證》。
馴鹿醫療南京商業化生產基地于2020年11月投入使用,位于南京市江北新區生物醫藥谷產業區,總面積近10,000平方米,擁有完整的質粒、慢病毒載體和CAR-T細胞生產能力,以及保證相應產品的質量控制能力。作為核心設施區域的細胞生產車間采用工作站的形式,按照中國GMP標準,并參考歐盟GMP及FDA cGMP進行設計,設計產能可實現年生產CAR-T細胞3000人份。獲得《藥品生產許可證》標志著馴鹿醫療在細胞免疫治療產業化和惠及腫瘤患者的道路上更進一步。
馴鹿醫療首席技術官兼執行副總裁David He博士表示:
“此次獲批《藥品生產許可證》,是新藥上市前的里程碑事件,對于馴鹿醫療首款自主研發生產的CAR-T細胞治療藥物上市具有重要意義,意味著馴鹿醫療已具備涵蓋質粒、慢病毒載體和細胞治療產品全產業鏈的自主產業化生產能力。我們將以此為新的起點,盡快把公司自主研發的細胞產品推向市場,早日為患者提供安全、有效和質量可靠的細胞免疫治療藥品,努力實現公司為患者帶來治愈希望的愿景。”
]]>付博士是一位兼具科研與金融專業的卓越領導者,在資本市場、財務管理及科學研究領域擁有超過20年的豐富經驗與成果。在加入馴鹿前,付博士曾擔任海通國際董事總經理及花旗環球金融(Citigroup Global Markets) 董事,領導及推進了很多中國企業在香港、美國成功上市,包括多個醫療健康領域的企業。此前,他分別在達維律師事務所(Davis Polk & Wardwell) 香港辦事處和世達律師事務所(Skadden, Arps, Slate, Meagher & Flom) 美國帕羅奧圖辦事處工作,專注于資本市場業務,包括公司上市及債券發行。在其更早的職業生涯中,他曾在美國生物技術公司Rigel Pharmaceuticals擔任研發科學家,專注于免疫學和腫瘤學領域的研究和藥物開發。
付博士榮獲加州大學伯克利分校 (University of California, Berkeley) 法學博士(J.D.)學位,華盛頓大學 (Washington University in St. Louis) 分子遺傳學博士(Ph.D.)學位,中國科學院上海細胞生物學研究所免疫學碩士學位以及復旦大學遺傳及遺傳工程學士學位。
付翀博士表示:“馴鹿醫療致力于開發以治愈為結果的創新細胞治療和抗體藥物,挽救全球更多患者的生命。這讓我深感意義重大,也倍感興奮。馴鹿的快速發展在行業有目共睹,尤其在今年多個產品取得了BTD、IND等出色成績,吸引了眾多國際學術界的目光。我很高興在馴鹿快速發展過程中的關鍵節點加入這一充滿活力和斗志的團隊,也希望我在香港和美國金融市場的經驗以及對生物制藥領域的理解,能幫助公司進一步創造價值。”
馴鹿醫療首席執行官汪文博士表示:“Alan是一位兼具生物醫藥科研與資本市場管理的卓越領導者,對醫療保健系統與資本市場有著深刻的理解。很高興Alan在馴鹿即將邁入商業化并放眼全球的重要階段成為領導團隊一員,他的加入標志著馴鹿醫療領導團隊的進一步優化和完善,我們相信和期待他的專業知識、領導力和廣泛的行業人脈將加速公司下一階段重要目標的實現!”
]]>本輪融資將用于加速馴鹿醫療多款創新細胞療法的臨床前研究、臨床開發、上市申請和商業化。此外,公司還將利用募集到的資金開拓更廣闊的異體通用與實體瘤治療細胞產品管線,拓展核心產品的全球合作,進一步豐富現有產品管線。
馴鹿醫療CEO兼CMO汪文博士表示:“非常感謝新老股東的信任。馴鹿醫療的臨床開發能力、創新研發能力、CMC開發能力及公司發展潛力獲得國內外優質投資人的認可,這讓我們深感榮幸和責任。新藥的創新使命重大,馴鹿經過四年快速且扎實的發展,已形成細胞治療平臺和生物大分子藥物平臺協同開發的雙輪驅動發展態勢。目前我們的全人源靶向BCMA的CAR-T候選產品(CT103A)的關鍵臨床試驗正在緊鑼密鼓地推進,商業化廠房已完成建設且驗證工作已接近尾聲;全球第一款全人源靶向CD19/CD22雙靶點CAR-T候選產品兩項IND申請已獲批,注冊臨床已在有序推進;全球第一款全人源、雙表位靶向CD5的CAR-T候選產品已經完成臨床前研究,現處于pre-IND階段。”
“以上三款創新產品的臨床開發標志著馴鹿醫療的細胞免疫治療產品在漿細胞、B細胞和T細胞惡性腫瘤的全覆蓋。不僅如此,公司核心產品CT103A的臨床開發還在向前線治療、聯合用藥、適應癥拓展、海外布局四個維度推進,今年下半年我們還將遞交兩項細胞治療的IND申請。目前,公司抗體平臺的一批全人源單抗產品正在IND enabling階段,2022年將會有產品申報IND,進入臨床開發階段。本輪融資將幫助我們進一步推進產品管線的開發與創新,強化我們在腫瘤及自身免疫疾病領域的戰略定位和擴大產品優勢。馴鹿團隊將繼續以創新開拓的精神和強勁的執行力,實現公司‘讓創新療法成為治愈患者的支柱療法’的使命。”
鼎暉百孚管理合伙人應偉先生表示:“細胞與基因療法的蓬勃發展正以前所未有的速度將更多突破性療法帶給患者。在競爭日益激烈的環境下,馴鹿醫療憑借對腫瘤免疫藥物開發的獨特理解、優秀的團隊創新能力與執行力,已建立了豐富的、以全人源為特點的產品管線,多個重磅CAR-T產品數據喜人。生物醫藥是鼎暉最重視的領域之一,很高興與馴鹿這樣優秀的業內創新企業攜手同行,未來我們還將進一步拓展與該領域優秀企業的合作,加速創新療法的落地,助力生物醫藥行業發展。”
]]>