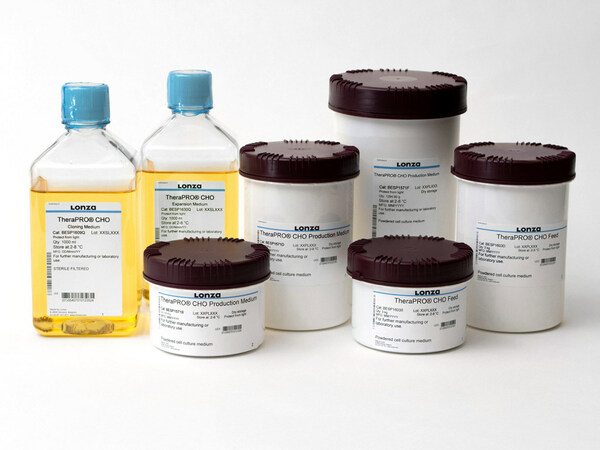
- Lonza 的新型細胞培養基系統旨在優化治療性單克隆抗體的生產
- 此分為兩部分的生產系統可以從 GS-CHO 細胞系(一種被廣泛用于蛋白質生產的哺乳動物宿主細胞)中生產高質量的蛋白質
- 此培養基系統化學成分明確、不含動物成分,可用于從細胞系開發到生物工藝制造的放大生產
瑞士巴塞爾和中國上海2023年7月20日 /美通社/ -- Lonza (龍沙)推出了新產品 TheraPROTM CHO 培養基系統,這是一種新的細胞培養系統,與 GS-CHO 細胞系一起使用時,可簡化工藝并優化生產力和蛋白質質量。本次新品發布旨在幫助生產治療性蛋白的制藥和生物技術公司進一步提高產品質量,同時縮短上市時間。
抗體療法的多功能性和效率持續改變著醫療保健行業。為了滿足此類療法不斷增長的需求,生物制藥制造商必須優化蛋白生產并縮短上市時間。然而,蛋白生產具有挑戰性,在放大和生產過程中出現的意外問題可能會增加成本并延遲向患者提供改變生活的療法。
為了應對這些挑戰,Lonza 開發了 TheraPROTM CHO 培養基系統。化學成分明確、不含動物成分、由兩部分組成的生產系統易于使用并簡化了培養基制備。它具有可擴展性,并由具有豐富經驗的技術專家提供支持。 TheraPROTM CHO 培養基系統提供高效的性能,在 15 天的培養周期內獲得高濃度的活細胞和超過 5g/L 的蛋白滴度。這意味著增加了一倍多的使用現有方案產生的蛋白滴度。
Lonza 生物科學全球高級產品經理 Deirdre Raduns 評論道:"制造高質量的生物制劑是一項復雜的挑戰,而大規模和快速地生產則更加困難。 TheraPROTM CHO 培養基系統借助數十年的 GS-CHO 細胞培養專業知識來應對這些挑戰——通過簡化的兩部分生產系統提供顯著的性能。通過這次新品發布,我們將繼續履行我們的使命,幫助客戶更快地將改變生活的療法推向市場。"
Lonza 生物科學副總監兼蛋白表達培養基研發主管 Harsh Amin 博士評論道:"我們開發了一種培養基系統,該系統易于使用,同時提供高滴度和產品質量。由于該培養基系統被設計為多功能的,因此它可以與多種 GS 敲除 CHO 細胞宿主一起使用,并且支持具有不同代謝特征的多種克隆。"
新系統的所有組分均在 ISO 13485 認證的工廠中按照良好生產規范 (GMP) 進行制造,確保全面的產品可追溯性和優秀的批間一致性。 TheraPROTM CHO 培養基系統的客戶可獲得藥物主文件 (DMF) 和協助注冊申請的專家技術支持,以幫助提高成功注冊的機會。
如需申請試用,請關注Lonza Bioscience微信公眾號,在公眾號中回復“試用申請”,數量有限,工作人員會盡快聯系您。
關于 TheraPROTM CHO培養基系統的更多信息, 請訪問 www.lonza.com/therapro
瑞士巴塞爾和荷蘭阿姆斯特丹2023年6月9日 /美通社/ -- 全球制藥、生物技術和營養市場的制造伙伴Lonza今日宣布已收購Synaffix,一家專注于開發及商業化ADC臨床階段平臺技術的生物技術公司。自收購之日起,Synaffix的收入和利潤將納入Lonza業務的范圍內。
ADC在癌癥方面展現出廣泛且有針對性的治療潛力,不過仍面臨著一系列復雜的開發和生產挑戰。Synaffix技術平臺(包括藥物載荷和位點特異性鏈接技術)在科學專家團隊的支持下,將增強和擴展Lonza的綜合ADC服務,包括早期階段的服務。Synaffix的ADC技術平臺包括專有的酶重塑定點偶聯技術GlycoConnect?、高極性間隔子技術HydraSpace?和高效載荷平臺toxSYN?技術。該技術平臺屢獲殊榮,能夠顯著增強ADC的療效和耐受性。
Lonza的開發和生產能力與Synaffix的ADC技術平臺相結合,將為客戶和被授權方提供全面的服務,即為創新的和差異化的ADC提供快速發現、開發、放大和商業化服務。這些增強的能力將幫助加速臨床試驗和商業化的過程。
Lonza專利授權許可業務副總裁Ulrich Osswald評論道:“Synaffix的ADC技術是金標準,幫助負責臨床階段的開發者在醫療需求強烈但仍未實現的領域內設計出具有治愈潛力的療法。收購Synaffix凸顯了生物偶聯物在Lonza的服務組合中具有戰略地位,擴展了我們在這個增長迅速的市場上提供的服務,并增強了我們面向臨床客戶的價值主張。通過與Synaffix的結合,我們具有了業界領先的知識和能力,能夠同時支持臨床和商業化需求。”
Synaffix首席執行官Peter van de Sande補充道:“我們的使命是將Synaffix的ADC技術帶給患者,我們很高興成為Lonza的一部分,通過強大而直接的協同合作,確保我們的被授權方在進入晚期臨床和商業化開發階段擁有一個穩固的技術和生產平臺。我們現在還可以借助Lonza所提供的服務潛力,加快細胞毒性ADC以外的生物偶聯藥物技術創新。期待與Lonza的同事密切合作,繼續為有需求的患者提供有前景的潛在藥物。”
作為Lonza的子公司,Synaffix將繼續以Synaffix的公司名字來運營,并進一步擴大在荷蘭奧斯的業務,以滿足進一步創新和增長的需求。
此次收購反映了Lonza通過技術和創新實現差異化的戰略。從其領先的生物偶聯物服務、到細胞和基因療法的商業化生產,以及對生產活性生物藥的支持,Lonza的生產技術幫助客戶為患者交付創新療法。
此次收購中,Bird & Bird擔任Lonza的法律顧問。William Blair擔任Synaffix的金融顧問,Goodwin和NautaDutilh擔任Synaffix的法律顧問。
]]>美國加利福尼亞州洛杉磯和中國上海2023年5月17日 /美通社/ -- 龍沙推出新產品TheraPEAKTM T-VIVOTM 細胞培養基,這是一種旨在優化 CAR-T 細胞制造的新型化學成分明確的培養基。該培養基不含動物成分,可提高一致性和過程控制,并簡化監管審批,從而加快上市時間。
在傳統的CAR-T細胞制造過程中,高度依賴于動物或人類血清的使用,但血清的差異性很大,而且可能含有不確定的外源因子。因此,血清需要嚴格的安全檢測、性能篩選以及對質量合適批次的儲存,這一過程會導致制造過程更加昂貴和耗時。
企業使用此新型培養基可以在不需要添加人血清或血清成分的情況下達到所需的性能——這是許多早期無血清培養基遇到的問題。此次新品發布是龍沙為用戶加快細胞療法商業化的最新一步。
龍沙的新型GMP級培養基是化學成分明確的培養基,不含動物源成分,僅使用重組蛋白。通過提供更高的批間一致性和供應安全性,此新型培養基可加速臨床前開發、監管審批和療法生產。龍沙的新型培養基還具有極小的污染風險,并減少了可追溯性和文檔負擔。關鍵的是,
在美國細胞基因治療學會(ASGCT)會議上,龍沙將與測試了此新型培養基用于實驗室的CAR-T細胞制造的弗勞恩霍夫細胞治療和免疫學研究所(IZI)一起發表演講。該演講將于2023年5月18日15:45 在洛杉磯會議中心的展廳演示劇院舉行。
龍沙生物科學高級全球產品經理Erin Brooks說: "通過此次新品發布,我們有望實現對原材料和制造流程的前所未有的把控,并為用戶解鎖了更高的終端產品一致性。通過減少在獲得更快、更具成本效益的上市途徑的障礙,制造商現在可以更好地專注于讓患者的生活變得更好。
龍沙生物科學細胞培養基研發總監Alexis Bossie補充說:"龍沙以其細胞培養專業性而聞名,是早期將其細胞培養解決方案用于制造商業化細胞療法的公司之一。我們已經將這些專業知識匯集到TheraPEAKTM T-VIVOTM培養基中,可以滿足市場對可放大、高性能培養基的迫切需求,從而避免動物成分和人類血清的挑戰。
TheraPEAKTM T-VIVOTM 培養基將供應給全球細胞治療制造商。用戶還可以向龍沙的全球技術專家尋求建議和應用支持,以快速解決問題并極大地提高成功率。憑借分析證書和藥物主文件等支持文件,該T細胞培養基簡化了流程并支持合規性,促進了從臨床前開發到生產的規模放大。
想要了解有關TheraPEAKTM T-VIVOTM 培養基的更多信息,請瀏覽我們的網站,參觀#209展位或參加ASGCT的講座,與龍沙的專家交談。
]]>瑞士巴塞爾和中國北京2022年4月19日 /美通社/ -- 北京綠竹生物技術股份有限公司(綠竹生物)與龍沙(制藥、生物技術和營養行業的全球開發和生產合作伙伴)已簽署研究和商業許可協議,授權綠竹生物使用龍沙GS Xceed®基因表達系統和GS piggyBac®轉座子技術。綠竹生物是一家生物制藥公司,致力于研發用于預防、控制和治療人類疾病的疫苗和治療性雙特異性抗體。
綠竹生物LZ901重組帶狀皰疹疫苗獲得臨床試驗批件,適合50歲以上易感成人接種。LZ901疫苗由在CHO細胞中表達的重組水痘帶狀皰疹病毒糖蛋白E制成,不含防腐劑和抗生素。此外,綠竹生物的K193抗體注射液目前也進入臨床試驗階段,它是一種同時靶向人CD19和CD3的雙特異性抗體,主要用于治療復發性或難治性B細胞非霍奇金淋巴瘤以及復發性或難治性B細胞白血病。LZ901疫苗和K193抗體均采用龍沙GS Xceed®基因表達系統和GS piggyBac®轉座子技術表達。
與龍沙簽署授權協議之后,綠竹生物即可利用GS Xceed®基因表達系統,研發可擴展、穩定且可靠的表達工藝。綠竹生物充分認識到,運用龍沙GS Xceed®基因表達系統可以穩定表達其研發的疫苗和治療性雙特異性抗體。目前,GS Xceed®基因表達系統工具箱還包括GS piggyBac®轉座子技術,該技術優先靶向基因組的高轉錄活性區域。
https://pharma.lonza.com/offerings/specialized-capabilities/expressions-technologies/GS-piggyBac
龍沙授權許可和制劑服務部門負責人Peter Droc表示:“綠竹生物的創新候選藥物進入臨床試驗階段,標志著在新一代抗體分子和疫苗研發領域邁進了一大步。龍沙致力于開發有助于適應行業趨勢的表達系統。我們采用靈活多變的模式,適合各種產品類型,便于用戶在內部使用經授權的技術平臺。”
綠竹生物創始人、首席執行官兼首席科學家孔健先生指出:“龍沙GS Xceed®基因表達系統是一種易于使用的哺乳動物細胞蛋白表達系統。我們已經通過該系統成功表達和生產了多種重組雙特異性抗體和病毒蛋白。GS Xceed®系統表達的病毒抗原有優異的免疫活性,糖基化類型很好地涵蓋了現有的病毒蛋白類型。此外,免疫學研究結果表明,利用龍沙GS Xceed®表達系統研發的重組帶狀皰疹疫苗可以刺激動物的免疫系統,從而產生良好的細胞免疫和體液免疫。”
掃描二維碼,下載GS Xceed® 詳細資料:https://lonzalpb.wjx.cn/vj/mBVsOgw.aspx
]]>瑞士巴塞爾和澳大利亞悉尼2022年1月28日 /美通社/ -- HaemaLogiX已與全球制藥、生物技術與營養市場的優秀合作伙伴龍沙簽署協議,為HaemaLogiX生產多發性骨髓瘤候選藥物KappaMab的下一個臨床批次(cGMP)。HaemaLogiX是一家生物技術公司,主要從事針對多發性骨髓瘤的新型單克隆抗體療法方面的臨床階段開發工作。
KappaMab是一種嵌合型IgG1單克隆抗體,可與僅在骨髓瘤癌細胞表面發現(正常細胞表面不表達)的靶點,即kappa骨髓瘤抗原(KMA)結合。KappaMab可與骨髓瘤細胞特異性結合,使患者免疫系統識別出異常細胞,觸發天然免疫應答,對骨髓瘤細胞進行攻擊并殺滅。最終,患者體內僅癌細胞減少,而正常的健康細胞可免受免疫系統的攻擊。
迄今為止,已有三項臨床試驗對KappaMab進行了研究,這些研究結果均表明KappaMab具有良好的安全性特征,且不具有單次、多次給藥[1],[2],[3]后劑量限制性毒性。在近期開展的一項IIb期臨床試驗中,與來那度胺聯合地塞米松治療相比(對照組),KappaMab協同來那度胺(免疫調節性酰亞胺類藥物(IMiD))聯合地塞米松治療,可提高復發性、難治性多發性骨髓瘤2患者的疾病緩解率,同時改善緩解質量。
HaemaLogiX董事長兼首席執行官Bryce Carmine表示:“多發性骨髓瘤是全球第二大常見的惡性血液腫瘤。根據2019年數據,僅在美國預計每年就有新發病例3.2萬例,死亡人數超1.25萬人,歐洲的發病率大致相當。由于多發性骨髓瘤無法根治,我們應提供更多治療方案讓患者選擇。我們期待將KappaMab聯合標準治療重新投入臨床試驗,與龍沙簽訂的這項協議是重要一步,旨在為我們即將進行的試驗提供藥品。”
根據協議條款,龍沙將在其配備先進的中國廣州cGMP哺乳動物細胞新生產基地為KappaMab臨床試驗提供原液生產,該基地裝載有2個1000L和2個2000L的一次性生物反應器。HaemalogiX將充分利用龍沙的法規專業知識、全球生產網絡以及在生產單克隆抗體方面的豐富經驗。
龍沙臨床開發和戰略營銷執行總監Jeetendra Vaghjiani表示:“我們期待與HaemalogiX建立合作關系,加速推動其多發性骨髓瘤候選藥物的商業化進程,充分利用我們在中國廣州工廠擁有的獨特、靈活的單克隆抗體生產能力和先進的專業技術。”
該藥品的目標完成日期為2022年第4季度。目前計劃于2022年底在澳大利亞啟動臨床試驗,屆時該藥品將投入臨床使用。
[1] Spencer A, Walker P, Asvadi P, et al. A preliminary study of the anti-κ myeloma antigen monoclonal antibody KappaMab (MDX-1097) in pretreated patients with κ-restricted multiple myeloma. Blood Cancer J. 2019; 9(8):58. |
[2] Kalff A, Shortt J, Yuen F, et al. A Sequential Cohort Study Comparing Kappamab Alone to Kappamab, Lenalidomide and Low Dose Dexamethasone in Kappa-Restricted Relapsed Refractory Multiple Myeloma (AMaRC 01-16). Blood. 2019; 134(Supplement_1): 3144-3144. |
[3] Spencer A, Augustson B, Mollee P, Copeman M, Asvadi P, Dunn R. Phase 2a, open-label, multi-dose study of the anti-kappa monoclonal antibody, MDX-1097, in relapsed kappa-chain restricted multiple myeloma with stable measurable disease. The European Hematology Association (EHA). Stockholm, Sweden; 2013. |
瑞士巴賽爾和中國杭州2021年12月14日 /美通社/ -- 浙江道爾生物科技有限公司(“道爾生物”)與制藥、生物技術和營養行業的全球開發和生產合作伙伴Lonza(龍沙)簽署研發許可協議,以許可道爾生物利用龍沙的XS Technologies® 平臺結合其獨有的MultipleBody®和SMART-VHHBody平臺技術研發新一代多特異性抗體藥物。道爾生物是一家臨床階段的生物醫藥創新公司,專注于開發癌癥、內分泌、代謝性疾病、眼科等多個領域的多域、多特異性新型蛋白藥物。
通過該許可協議,道爾生物可利用龍沙的XS® Pichia表達系統開發可放大、穩定且可靠的表達工藝。 道爾生物也可通過該Pichia系統來表達并生產基于單域抗體(VHH)的多特異性抗體藥物,以滿足腫瘤免疫治療領域的未被滿足的臨床需求。道爾生物前期已利用龍沙XS® Pichia表達系統在生產多結構域蛋白藥物應用方面初獲成效。因此,道爾生物希望與龍沙繼續合作并開發出更多創新型治療性生物藥物。
龍沙全球授權許可和制劑服務部門負責人Peter Droc說道:“新一代療法需要利用新的表達系統。龍沙一直也在開發各種不同的表達系統來幫助適應行業發展趨勢、打破生產瓶頸、與下游工藝保持一致并推動取得臨床突破。道爾生物擁有創新的VHH抗體研發管道,我們相信這項協議也將進一步加速道爾生物候選抗體藥物從臨床前研究到商業化生產階段的推進。”
浙江道爾生物科技有限公司的創始人兼CEO黃巖山博士對合作評論道:“與單靶點藥物相比,多特異性生物藥物的效價往往更強、半衰期更長、治療窗口更佳,臨床的開發潛力也更大。但是,設計和開發新的多特異性生物藥物是實現新的免疫療法所面臨的最大挑戰之一。龍沙專利的表達技術可為我們的候選抗體提供高效的表達和便捷的工藝,從而幫助我們加快基于道爾生物獨有的MultipleBody®和SMART-VHHBody平臺開發出的創新藥物的生產。我們相信,在龍沙的XS® Pichia表達系統的支持下,我們可以用更快、更低的成本開發出高質量的基于VHH抗體的多特異性生物藥物。”
有關 XS Technologies® 的更多詳細信息,請訪問 : https://pharma.lonza.com/xstechnologies
]]>龍沙哺乳動物細胞生物制藥全球負責人,兼高級副總裁Jennifer Cannon表示:
“我們期待與Pinteon建立穩固的合作關系,以助其將創新的Tau抗體治療推向商業化。這項合作彰顯了我們的靈活性與承諾,以高質量的生產滿足全球客戶的臨床需求,同時也充分運用了我們在中國廣州cGMP工廠的專業生產能力。”
Pinteon首席執行官Martin Jefson表示:
“我們自2017年以來便與龍沙合作。我們對龍沙快速靈活地回應我們的需求表示贊賞。本協議的簽訂令人振奮,因為它正是在我們希望快速推進PNT001的時候,確保了充足的臨床供應。PNT001是一種創新的Tau抗體,專門靶向一種已知能導致神經退行性疾病的表位抗原。”
瑞士巴塞爾2021年6月24日 /美通社/ -- 今日,龍沙與Pinteon Therapeutics宣布雙方的擴大生產協議。Pinteon是一家生物技術公司,致力于通過靶向Tau蛋白神經毒性的形成來保護神經健康。雙方的進一步合作將使Pinteon的主要候選藥物PNT001實現未來的臨床生產,該藥物在I期臨床研究中取得了令人滿意的結果。
2018年以來,雙方成功地建立了長期生產合作,由龍沙英國Slough工廠為Pinteon的I期臨床研究供應提供原液(DS)生產,而本次合作則是在這一基礎上的深化和延伸。自2021年第四季度開始,龍沙廣州全新先進的cGMP生物制藥工廠將為PNT001生產cGMP級原液,以滿足Pinteon在美國開展的臨床試驗,以及未來可能拓展至歐洲的研究。
PNT001是一種可以靶向高度神經毒性構象Tau蛋白(稱為cis-pT231 Tau)抗原的單克隆抗體。這種Tau構象具有急性神經毒性,同時還會促成Tau病變在神經退行性Tau蛋白病中的發生和傳播,例如創傷性腦損傷、慢性創傷性腦部病變、阿爾茨海默病和進行性核上性麻痹。目前,PNT001正在急性創傷性腦損傷患者中進行I期臨床試驗。Pinteon預計在2021年底前啟動PNT001在阿爾茨海默病患者中的Ib期/II期研究。
Pinteon將借助龍沙的全球生產網絡、法規支持能力、廣泛的單抗生產專長以及支持加速生產的豐富經驗,同時為未來的潛在商業化生產奠定基礎。
]]>