- 健康元集團將主導BRII-693在大中華區的臨床開發和商業化
- 騰盛博藥保留大中華區以外地區的商業化權利,以應對全球抗菌藥耐藥性威脅,并繼續專注于其他優先管線資產
中國北京和美國北卡羅來納州達勒姆 2025年7月4日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今日宣布已與健康元藥業集團("健康元集團")簽署知識產權許可及技術轉移協議。健康元集團將從騰盛博藥獲得在大中華區對 BRII-693 進行研究、開發和商業化的獨家許可。
根據協議,健康元集團將全面負責BRII-693在大中華區的開發、監管審批和商業化。作為交易對價,騰盛博藥已收到首付款,并將收到額外的開發和商業化里程碑付款,以及根據產品凈銷售額分級比例獲得的銷售分成。
BRII-693是一種在研新型合成脂肽,用于治療多重耐藥和廣泛耐藥(MDR/XDR)革蘭氏陰性菌感染的重癥患者,尤其是耐碳青霉烯類鮑曼不動桿菌(CRAB)、銅綠假單胞菌(CRPA)以及腸桿菌(CRE)引起的感染。BRII-693是通過對多粘菌素支架進行迭代結構改造研發而成,旨在增強抗菌效力,同時降低老式多粘菌素制劑常見的毒性作用,如腎毒性和神經毒性。在1期研究中,BRII-693在非中國籍和中國籍健康參與者中均表現出良好的安全性、耐受性和藥代動力學特征。騰盛博藥已從國家藥品監督管理局藥品審評中心取得臨床試驗許可,獲準在中國開展BRII-693的1期PK橋接研究,以支持未來在醫院獲得性細菌性肺炎/呼吸機相關細菌性肺炎患者中開展3期注冊試驗。
騰盛博藥董事長兼首席執行官洪志博士表示:"大中華地區的抗菌藥耐藥威脅日益嚴重,凸顯了新型醫院抗生素的迫切性。健康元集團在醫院抗生素的生產和商業化方面有著久經考驗的能力,我們找到了加速BRII-693開發和商業化的理想合作伙伴。這次合作使我們能夠為面臨生命危險感染的中國患者提供重癥監護藥物。"
健康元集團CEO林楠棋先生表示:"騰盛博藥在創新藥物研發領域深耕已久、實力深厚。BRII-693 項目依托其成熟的研發體系推進,展現了高度的專業性與創新性,該項目在疾病治療潛力、藥效學特性和藥代動力學表現等方面均顯示出積極結果,有望成為Best-in-Class藥物,切實解決臨床上亟待滿足的治療需求。我們十分看好 BRII-693 的臨床開發前景,此次合作進一步強化了健康元集團在抗感染管線的戰略布局。期待這款藥物能早日上市,為患者提供更多優質治療選擇。"
關于BRII-693
BRII-693 是一種正在開發的新型合成脂肽,用于治療多重耐藥和廣泛耐藥(MDR/XDR)革蘭氏陰性菌感染的重癥患者,特別是耐碳青霉烯類鮑曼不動桿菌和銅綠假單胞菌。騰盛博藥擁有在全球獨家開發和商業化BRII-693的權益。
關于健康元集團
健康元藥業集團創立于1992年,歷經多年穩健經營和快速發展,現已成為一家創新科研型的綜合醫藥集團。旗下擁有健康元、麗珠醫藥兩家大型上市公司,20余家主要控股子公司。一直以來,健康元集團始終堅持以科技創新為戰略基點,以打造創新藥和高壁壘復雜制劑技術平臺雙輪驅動為戰略目標,圍繞呼吸、抗感染、消化道、輔助生殖、精神、腫瘤等具有顯著臨床需求的領域進行了豐富的管線布局,形成了豐富多元的產品矩陣及在研藥物管線。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,重點包括針對乙型肝炎病毒(HBV)感染的領先項目。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問 www.briibio.com。
 ]]>
]]>
- ENSURE 研究隊列 4 的治療結束( EOT )數據表明,對既往 BRII-179 治療有應答的患者在接受治愈性治療后相較 BRII-179 未經治患者實現了更快、更高的表面抗原清除率,強調了利用 BRII-179 識別和免疫激活患者,以提高功能性治愈結果的新型富集策略
- ENSURE 研究隊列 1-3 的 24 周隨訪結果表明,與 PEG-IFNα 單藥相比, elebsiran + PEG-IFNα 聯合治療具有持續的非治療性獲益
北京和北卡羅來納州達勒姆 2025年5月8日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今日宣布,在荷蘭阿姆斯特丹舉行的2025年歐洲肝病研究協會(EASL)會議上以最新突破壁報的形式公布其正在進行的ENSURE 2期研究數據。
ENSURE(NCT05970289)是一項多中心、開放性2期研究。隊列1-3旨在評估elebsiran(一種研究性小干擾核糖核酸(siRNA))在與聚乙二醇干擾素α(PEG-IFNα)聯合治療慢性乙型肝炎病毒(HBV)感染者(基線乙肝表面抗原(HBsAg)水平為100-3,000 IU/mL)中的作用。
隊列4入組了在先前的亞太地區研究BRII-179-835-001(NCT04749368)中接受過9劑BRII-179(一種基于重組蛋白的治療性疫苗)聯合elebsiran給藥的參與者,接受elebsiran與PEG-IFNα聯合治療。這些參與者根據他們之前接受 BRII-179 治療后產生的抗HBs應答進行分組:抗HBs滴度峰值 ≥ 10 IU/L的參與者被定義為抗HBs應答者,抗HBs滴度峰值 < 10 IU/L 的參與者被定義為無應答者。本研究隊列 4 的設計基于BRII-179可以區分免疫應答者和無應答者的一種見解,從而為預測未來的治療應答提供了可能。
隊列4的中期數據顯示,抗HBs應答者的HBsAg血清清除率顯著高于無應答者。EOT(第48周)時,61%(11/18)的抗HBs應答者達到HBsAg血清清除,而無應答者為10%(1/10)。在11名實現HBsAg清除的抗HBs應答者中,91%(10/11)在EOT時的抗HBs滴度≥100 IU/L。
值得注意的是, 隊列4中的BRII-179經治參與者比隊列2和隊列3中BRII-179未經治參與者更快實現HBsAg清除,第24周時在BRII-179經治參與者中已有83%(10/12)的參與者實現HBsAg清除,而BRII-179未經治參與者為55% (6/11)。這些發現表明,快速的HBsAg血清清除率和較高的抗HBs滴度可轉化為持久的HBsAg清除,以及評估縮短PEG-IFNα療程的可能性。
ENSURE研究隊列1-3的其他數據表明,與PEG-IFNα單藥治療相比,100或200 毫克elebsiran與PEG-IFNα聯合治療在EOT24周后均可實現更高的HBsAg清除率,支持siRNA的額外獲益。
騰盛博藥首席醫學官David Margolis博士表示:"ENSURE研究隊列4的數據令人鼓舞。我們在目標人群中發現,經過BRII-179預治療產生免疫應答的患者在實現較高的HBsAg血清清除率方面表現出顯著優勢。借助BRII-179,我們可以識別內在免疫受損程度較低的患者,并進一步增強其免疫應答。這種方法可使 HBsAg 清除更持久,并有可能縮短 PEG-IFNα的治療時間。我們正在全速推進臨床工作,以期為慢性乙型肝炎患者提供有意義的可選方案。"
摘要編號:LB25123/ LBP-018
標題:對既往BRII-179治療產生應答的慢性乙型肝炎病毒感染參與者在接受elebsiran 和 PEG-IFNα 治療后可獲得更快更高的乙型肝炎表面抗原清除率:來自ENSURE研究的治療結束時數據
主講人:黃麗虹教授,MBChB(CUHK),MD(CUHK),FRCP(Lond, Edin),FHKCP,FHKAM(Medicine),香港中文大學醫學數據分析中心(MDAC)及香港中文大學內科及藥物治療學系腸胃及肝病科專科教授,中國香港特別行政區
- 共分析了28例基線HBsAg > 100和≤ 3000 IU/mL的參與者。在既往研究中,BRII-179誘導的18例參與者的抗HBs滴度峰值≥ 10 IU/L(定義為抗HBs應答者)和10例參與者< 10 IU/L(定義為無應答者)。
- 在開始elebsiran + PEG-IFNα治療時,抗HBs應答者(539.4 [106.7-2165.0] IU/mL)的HBsAg中位數(范圍)在數值上高于無應答者(219.3 [106.7-671.5] IU/mL)。EOT(第48周)時,61%(11/18)的抗HBs應答者達到HBsAg血清清除,而無應答者為10%(1/10)。
- 在HBsAg轉陰的抗HBs應答者中,91%(10/11)在EOT時的抗HBs滴度≥100 IU/L。
- BRII-179經治參與者比BRII-179未經治參與者更快實現HBsAg清除,第24周時已有83%(10/12)的參與者實現HBsAg清除(BRII-179未經治參與者為55% (6/11))。
- Elebsiran + PEG-IFNα聯合治療在BRII-179經治的參與者中總體安全且可耐受。
摘要編號:LB25115/ LBP-016
標題:Elebsiran 和 PEG-IFNα聯合治療與PEG-IFNα治療慢性乙型肝炎病毒感染參與者的有效性和安全性:正在進行的2期、隨機、開放性ENSURE研究的隨訪結果
主講人:David Margolis,M.D.,MPH,騰盛博藥首席醫學官
- 第72周(EOT后24周)時,與PEG-IFNα單藥治療相比,在接受elebsiran 200 mg或100 mg與PEG-IFNα聯合治療的參與者中觀察到更高的HBsAg轉陰率(21.1% [4/19]或33.3% [6/18] vs 5.6% [1/18]),所有11例實現HBsAg清除的參與者基線HBsAg < 1500IU/mL。
- 聯合治療隊列和PEG-IFNα單藥治療隊列之間治療中出現的不良事件(TEAE)的發生率相當。大多數TEAE與PEG-IFNα的已知副作用一致。
作為騰盛博藥開發HBV功能性治愈的獨特方法的一部分,公司及其合作伙伴正在積極推進我們差異化產品組合的多項聯合研究,包括BRII-179(正在騰盛博藥領導的多項elebsiran聯合療法中進行評估);elebsiran(正在騰盛博藥領導的PEG-IFNα聯合療法中進行評估);以及tobevibart(一種靶向HBV的研究性廣泛中和單克隆抗體,正在Vir Biotechnology領導的在多項2期和3期tobevibart和elebsiran聯合療法中進行評估)。數月后,我們將在2025年的科學會議上分享關鍵數據。
關于乙型肝炎
乙型肝炎病毒(HBV)感染是世界上最重大的感染性疾病威脅之一,全球感染人數超過2.54億。[1]慢性HBV感染是肝臟疾病的主要原因,每年約有82萬人死于慢性HBV感染的并發癥。[1]中國慢性HBV感染人數達8,700萬,非常值得關注。[2]
關于 BRII-179
BRII-179是一種基于重組蛋白質的新型HBV 免疫治療候選藥物,可表達HBV的Pre-S1、Pre-S2和S表面抗原,旨在誘導增強和廣泛的B細胞和T細胞免疫應答。騰盛博藥于2018年12月從VBI Vaccines, Inc.("VBI")引進了BRII-179,還自2023年7月起,將BRII-179的獨家許可擴展至全球市場。2023年11月,中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)授予BRII-179突破性治療認定。
關于 Elebsiran (曾用名 BRII-835 , VIR-2218 )
Elebsiran是一種經皮下注射給藥的靶向乙型肝炎病毒(HBV)的小干擾核糖核酸(siRNA)研究性藥物,旨在降解HBV RNA轉錄本及限制乙型肝炎表面抗原的產生,其具有針對HBV及丁型肝炎病毒(HDV)的直接抗病毒活性。其是首個進入臨床的采用增強穩定化學增強技術的siRNA,以增強穩定性并最大程度地減少脫靶活性,從而有可能提高治療指數。騰盛博藥于2020年從Vir Biotechnology, Inc. 獲得了在大中華地區開發和商業化elebsiran的獨家權益。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,重點包括針對乙型肝炎病毒(HBV)感染的領先項目。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問 www.briibio.com。
| [1] World Health Organization. (April 2024). Global hepatitis report 2024: action for access in low- and middle-income countries. World Health Organization. Retrieved from https://www.who.int/publications/i/item/9789240091672 |
| [2] World Health Organization. Hepatitis. World Health Organization. Retrieved from https://www.who.int/china/health-topics/hepatitis#:~:text=There%20are%2087%20million%20people,living%20with%20chronic%20hepatitis%20C. |
 ]]>
]]>
- ENSURE研究隊列4的初步數據支持一項新穎的富集策略,利用BRII-179識別免疫應答患者,使其有望在治療結束時(EOT)實現更高的HBsAg清除率
- ENSURE研究隊列1-3的48周EOT數據清楚表明,elebsiran聯合PEG-IFNα治療可實現額外獲益,達到更高的HBsAg清除率
中國北京和美國北卡羅來納州達勒姆2025年3月30日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今日宣布,在中國北京舉行的第34屆亞太肝病學會年會(APASL 2025)上,公司以最新突破口頭報告的形式公布了其正在進行的ENSURE 2期研究的最新數據。
ENSURE(NCT05970289)是一項多中心、開放性2期研究。隊列1-3旨在評估elebsiran(一種研究性小干擾核糖核酸(siRNA))在與聚乙二醇干擾素α(PEG-IFNα)聯合治療慢性乙型肝炎病毒(HBV)感染者(基線乙肝表面抗原(HBsAg)水平為100-3,000 IU/mL)中的作用。在先前的亞太地區研究BRII-179-835-001(NCT04749368)中接受過9劑BRII-179(一種基于重組蛋白的治療性疫苗)聯合elebsiran(BRII-835)給藥的參與者被納入該研究的隊列4,并接受elebsiran和PEG-IFNα聯合治療。本研究隊列4的設計基于既往研究的見解,即很大一部分慢性HBV患者在接受治療性疫苗的多次治療后未能產生足夠的免疫應答,因此不太可能獲得免疫支持以實現持久的功能性治愈。
隊列4的最新數據顯示,過往產生BRII-179誘導的乙肝表面抗體(抗-HBs)應答的參與者,其HBsAg血清清除率顯著高于未產生應答的參與者。第24周時,超過半數的BRII-179應答者(55.6% [10/18])實現了HBsAg血清清除,而無應答者只有10.0%(1/10)實現了HBsAg血清清除。本次公布的數據表明,BRII-179有潛力成為一種預測工具,用于篩選出更可能對治愈方法產生應答的患者。
此次公布的ENSURE研究中隊列1-3額外數據顯示,與接受PEG-IFNα單藥治療的參與者相比,接受elebsiran聯合PEG-IFNα治療的參與者在治療結束 (EOT) 時有更高的HBsAg清除率和血清轉換率。
黃麗虹教授(香港中文大學醫學數據分析中心(MDAC)及香港中文大學內科及藥物治療學系腸胃及肝病科專科教授)表示:"ENSURE研究隊列4的積極數據為HBV功能性治愈打開了新的大門。既往研究表明,BRII-179可能為識別能夠產生必要的HBsAg抗體應答的慢性乙型肝炎 (CHB)患者提供新路徑。我相信,這次的新數據為BRII-179在篩選治療獲益人群方面的價值提供了有力的證據,進一步確立了BRII-179在未來聯合療法格局中的地位。"
騰盛博藥首席醫學官David Margolis博士表示:"ENSURE研究隊列4的數據繼續支持我們在目標人群中開發慢性HBV功能性治愈的富集策略,這令我們備受鼓舞。研究結果進一步凸顯了BRII-179在識別更可能對功能性治愈療法產生應答的患者方面的潛力,通過患者富集策略能提高目標人群的功能性治愈率,同時有助于降低治愈概率較低人群的治療成本負擔。我們致力于通過正在開展的臨床研究以及與戰略合作伙伴的合作,將BRII-179與多種療法結合使用,以期為全球2.54億慢性HBV感染患者實現更高的功能性治愈率。"
摘要編號:OP0335
報告標題:對既往BRII-179治療產生應答的慢性乙型肝炎病毒感染者在接受elebsiran 和 PEG-IFNα 治療后可獲得更快更高的HBsAg清除:來自ENSURE研究的初步數據
主講人:黃麗虹教授,MBChB(CUHK),MD(CUHK),FRCP(Lond, Edin),FHKCP,FHKAM(Medicine),香港中文大學醫學數據分析中心(MDAC)及香港中文大學內科及藥物治療學系腸胃及肝病科專科教授,中國香港特別行政區
- 在隊列4中入組的31例參與者中,有28例基線HBsAg ≥ 100 IU/mL的參與者被納入分析。其中,18例通過先前BRII-179治療誘導的抗-HBs峰值≥10 IU/L的受試者被定義為BRII-179應答者,10例抗-HBs峰值<10 IU/L的受試者被定義為無應答者。
- 在elebsiran + PEG-IFNα治療第24周時,隊列4參與者中有39.3%(11/28)實現了HBsAg血清清除。
- 第24周時,BRII-179應答者的HBsAg血清清除率為55.6%(10/18),明顯高于無應答者的10%(1/10)。
- 與此前報告的接受elebsiran + PEG-IFNα治療但未經BRII-179治療的參與者相比,既往接受BRII-179治療的應答者似乎可以實現更快的HBsAg血清清除。
- 病毒學抑制的慢性HBV感染參與者中,elebsiran聯合PEG-IFNα治療總體安全且耐受性良好。
- Elebsiran + PEG-IFNα治療會持續48周。
摘要編號:LB0009
報告標題:與單用 PEG-IFNα 相比,接受 elebsiran 和PEG-IFNα治療的慢性 HBV 感染者在治療結束 (EOT) 時 HBsAg 清除率和血清轉換率更高: 正在進行的ENSURE研究第48周結果
主講人:賈繼東教授,M.D.,Ph.D.,首都醫科大學附屬北京友誼醫院肝病研究中心主任,中國北京
- EOT時,在基線HBsAg水平為100-3,000 IU/mL的參與者中,elebsiran 200 mg + PEG-IFNα隊列和elebsiran 100 mg + PEG-IFNα隊列的HBsAg血清清除率分別為26.3%(5/19)和33.3%(6/18),明顯高于PEG-IFNα單藥治療隊列(5.6%)。
- 與PEG-IFNα隊列(-1.02 [0.30] log10 IU/mL)相比,elebsiran + PEG-IFNα隊列在EOT時的HBsAg下降幅度更大(平均值[SE]:elebsiran 200 mg或100 mg分別為-2.47 [0.28]或-3.01 [0.28] log10 IU/mL)。
- Elebsiran聯合PEG-IFNα治療(劑量分別為200 mg和100 mg),在HBsAg下降幅度和血清清除率方面均表現出相似的效果。在病毒學抑制的慢性HBV感染參與者中,elebsiran聯合PEG-IFNα療法總體安全且耐受性良好。
- 治療后隨訪仍在進行中,并將持續隨訪至治療終止后第24周。
作為騰盛博藥開發HBV功能性治愈的獨特療法的一部分,公司及其合作伙伴正在積極推進我們差異化產品組合的多項聯合研究,包括 BRII-179(一種重組蛋白HBV免疫治療候選藥物,由騰盛博藥開展 elebsiran 和 BRII-179 聯合療法的研究) 、elebsiran(由騰盛博藥開展 elebsiran 和 PEG-IFNα 聯合研究)以及tobevibart(一種靶向HBV的研究性廣泛中和單克隆抗體,Vir Biotechnology正就tobevibart和elebsiran聯合療法開展多項 2 期和 3 期研究 )。在2025年接下來的幾個月,我們將在各大科學會議上持續分享關鍵數據。
關于乙型肝炎
乙型肝炎病毒(HBV)感染是世界上最重大的感染性疾病威脅之一,全球感染人數超過2.54億。[1]慢性HBV感染是肝臟疾病的主要原因,每年約有82萬人死于慢性HBV感染的并發癥。[1]中國慢性HBV感染人數達8,700萬,非常值得關注。[2]
關于BRII-179
BRII-179是一種基于重組蛋白質的新型HBV免疫治療候選藥物,可表達HBV的Pre-S1、Pre-S2和S表面抗原,旨在誘導增強和廣泛的B細胞和T細胞免疫應答。2023年11月,中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)授予BRII-179突破性治療認定。
關于Elebsiran(BRII-835,VIR-2218)
Elebsiran是一種經皮下注射給藥的靶向HBV的siRNA研究性藥物,旨在降解乙型肝炎病毒RNA轉錄本及限制乙型肝炎表面抗原的產生,其具有針對HBV及HDV的直接抗病毒活性。其是首個進入臨床的采用增強穩定化學增強技術的siRNA,以增強穩定性并最大程度地減少脫靶活性,從而有可能提高治療指數。騰盛博藥于2020年從Vir Biotechnology, Inc.獲得了在大中華地區開發和商業化elebsiran的獨家權益。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,重點包括針對乙型肝炎病毒(HBV)感染的領先項目。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com 。
[1] World Health Organization. (April 2024). Global hepatitis report 2024: action for access in low- and middle-income countries. World Health Organization. Retrieved from https://www.who.int/publications/i/item/9789240091672 |
[2] World Health Organization. Hepatitis. World Health Organization. Retrieved from https://www.who.int/china/health-topics/hepatitis#:~:text=There%20are%2087%20million%20people,living%20with%20chronic%20hepatitis%20C. |
]]>

戰略性收購BRII-179知識產權,未來將全資擁有這項可與多種機制的乙肝療法聯合以實現治愈的臨床2b期資產
多項晚期研究數據進一步支持騰盛博藥的乙肝功能性治愈策略,即通過優化聯合療法覆蓋更廣泛患者群體
公司將在亞太肝臟研究學會(APASL)會議上(3月26-30日)展示4篇摘要,包括正在進行的ENSURE研究2期數據的兩項口頭報告
高達3.357億美元的強勁現金儲備,資金足夠覆蓋運營至2028年
公司正在為非HBV項目積極尋找合作機會
公司將于3月31日上午8:30(香港時間)/3月30日晚間8:30(美東時間)召開電話會議(中文場)
中國北京和美國北卡羅來納州達勒姆2025年3月21日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者醫療需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今日發布最新公司進展并報告截至2024年12月31日的年度財務業績。
2024年,騰盛博藥持續推進其核心乙型肝炎病毒(HBV)功能性治愈項目,并從正在進行的2期臨床試驗中獲得了關鍵數據,支持其通過免疫調節與降低表面抗原雙管齊下的方式提高患者功能性治愈率的目標。這些數據表明,BRII-179(一種基于重組蛋白的HBV免疫療法)有望識別可能對治愈性療法產生應答的患者,從而為推進治愈性療法起到關鍵性作用。兩項2b期研究ENRICH和ENHANCE已完成全部入組,將進一步驗證這些重要發現。其中ENSURE研究治療結束時(EOT)數據顯示,靶向HBV的小干擾核糖核酸(siRNA)藥物elebsiran對取得更高HBV功能性治愈率起到直接作用。目前elebsiran正在進行多項臨床試驗,評估其與騰盛博藥的其他資產的聯用,包括Vir Biotechnology, Inc. ("Vir Biotechnology",納斯達克股票代碼:VIR)正在對 tobevibart(一種針對HBV的廣譜中和單克隆抗體)開展的試驗。這些研究即將在2025年公布的數據,將為公司的后期開發及注冊策略帶來指引。騰盛博藥仍有3.357億美元的充足現金儲備,足以支持公司完成乙肝功能性治愈后期開發計劃。
騰盛博藥董事長兼首席執行官洪志博士表示:"我們2024年取得的多項重要里程碑從臨床和戰略層面強化了騰盛博藥覆蓋多種作用機制的HBV產品組合。多項聯合療法研究數據顯示,我們差異化的HBV資產有望通過多重機制的療法為更廣泛的乙肝患者群體帶來更高的功能性治愈率。通過對BRII-179的戰略性收購,和將在今明兩年陸續公布數據的三項在研2b期研究,我們正在為慢性乙肝患者開發多元的治愈性治療方案。"
臨床開發進展
騰盛博藥正積極推動其創新產品管線,重點聚焦核心HBV項目的后期臨床開發。
HBV項目
公司正在推進多項差異化HBV候選藥物的聯合研究,包括靶向HBV的siRNA藥物elebsiran、基于重組蛋白的HBV免疫療法BRII-179。公司的合作伙伴 Vir Biotechnology公司也正在推進 elebsiran 和 tobevibart(一種針對 HBV 表面抗原的廣譜中和單克隆抗體)的多項聯合研究。
通過以上三種不同治療機制的藥物組合治療HBV,騰盛博藥旨在確定針對不同患者亞群的最佳治愈方案,及最高效的審評路徑。隨著騰盛博藥在 HBV 功能性治愈方面取得進展,公司正在進行的ENRICH(評估BRII-179在激活HBV特異性免疫及篩選高免疫應答患者中的作用)和ENSURE(elebsiran聯合聚乙二醇干擾素α(PEG-IFNα)對照PEG-IFNα單藥)研究預計將在 2025-2026 年間獲得關鍵數據,進一步為后期研究提供信息。
- ENHANCE研究:2025年1月完成入組。該2b期隨機雙盲研究評估BRII-179、elebsiran聯合PEG-IFNα對比PEG-IFNα單藥在非肝硬化慢性HBV感染患者(接受核苷酸逆轉錄酶抑制劑(NRTI)背景治療)中的療效與安全性。
- ENSURE研究:在2024年11月舉行的美國肝病研究學會(AASLD)年會上,騰盛博藥以最新突破性口頭報告形式公布了ENSURE研究48周治療結束時數據。數據顯示,elebsiran聯合PEG-IFNα治療組患者的乙肝表面抗原(HBsAg)清除率顯著高于干擾素單藥組。ENSURE研究標志著業內首次通過與干擾素單藥頭對頭的比較,明確了siRNA(elebsiran)在與干擾素聯用時對功能性治愈的貢獻,凸顯其提升HBV功能性治愈率的潛力。騰盛博藥將于2025年上半年公布更多關鍵數據。
- ENRICH研究:ENSURE 研究還對曾接受過 BRII-179 治療的患者進行了研究。基于ENSURE研究隊列4的早期數據(將于2025年APASL公布),ENRICH研究于2024年11月完成入組,旨在評估BRII-179作為治愈方案中激活HBV特應性免疫的一部分,并將其作為一種工具,用于識別免疫應答患者,以提高功能性治愈的可能性。
- 騰盛博藥的開發合作伙伴Vir Biotechnology在2024年11月AASLD年會上公布了其2期MARCH研究和SOLSTICE研究數據.
- Vir Biotechnology近期啟動了3期注冊性臨床試驗ECLIPSE項目以在評估tobevibart與elebsiran聯合療法治療慢性丁型肝炎(CHD)。
- 2024年6月,美國食品藥品監督管理局(FDA)授予Vir Biotechnology用于治療CHD的tobevibart和elebsiran 快速通道認證;2024年11月獲歐洲藥品管理局(EMA)孤兒藥認證;12月獲FDA突破性治療品種認定及EMA的PRIME認證(PRIME Designation)。
- 2024年5月,tobevibart與elebsiran獲中國國家藥品監督管理局藥品審評中心(CDE)突破性治療品種認定。
其他臨床項目
騰盛博藥正積極為HIV、多重耐藥/廣泛耐藥感染及中樞神經系統疾病領域的候選藥物尋求外部合作。
- 2024年10月,騰盛博藥獲得了 NMPA CDE 的 IND 批準,在中國開展BRII-693(新型多黏菌素,用于治療嚴重革蘭氏陰性菌感染)的1期藥代動力學橋接試驗。此前1期數據已于2024年12月發表于《Antimicrobial Agents and Chemotherapy》期刊,支持未來針對醫院獲得性細菌性肺炎/呼吸機相關細菌性肺炎的全球3期注冊性臨床試驗。騰盛博藥擁有BRII-693的全球獨家開發及商業化權益。
2024年度企業亮點及近期動態
- 股份回購:2024年12月,公司宣布批準6,000萬港元股票回購計劃(占已發行股份10%),彰顯了公司對其前景的信心。截至2025年3月21日,公司已在香港聯交所回購約443.3萬股,耗資約530萬港元。
- 資產收購:2024年12月,公司與VBI Vaccines, Inc. 及其關聯子公司簽署了一項資產購買協議,以1,800萬美元總價收購BRII-179完整知識產權及相關資產。該協議取消了未來向VBI支付的與BRII-179和PreHevbri TM相關的費用,并解除了之前于2024年2月14日宣布的協議。此次收購為騰盛博藥帶來了更多的商業獲益,同時確保了 BRII-179 的不間斷臨床供應。公司將繼續開發這一資產,目前正在進行的研究支持 BRII-179 具有提高 HBV 患者對治療反應的潛力。
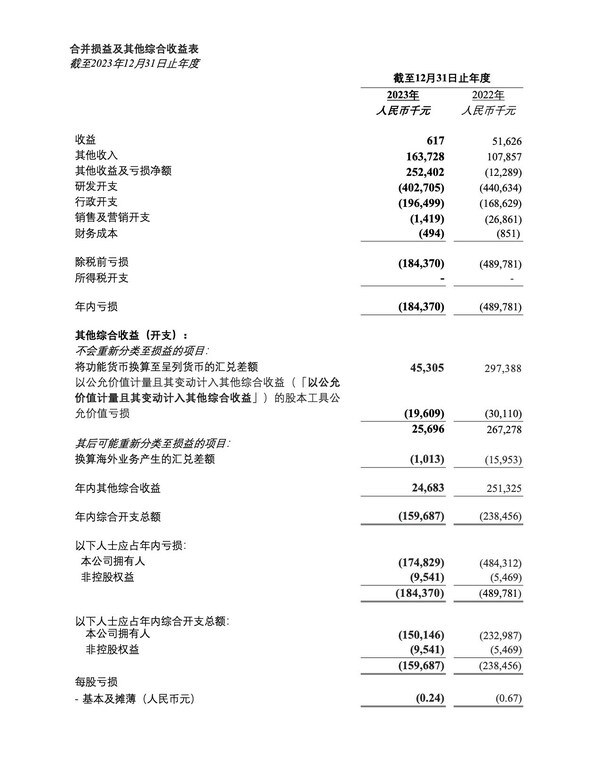
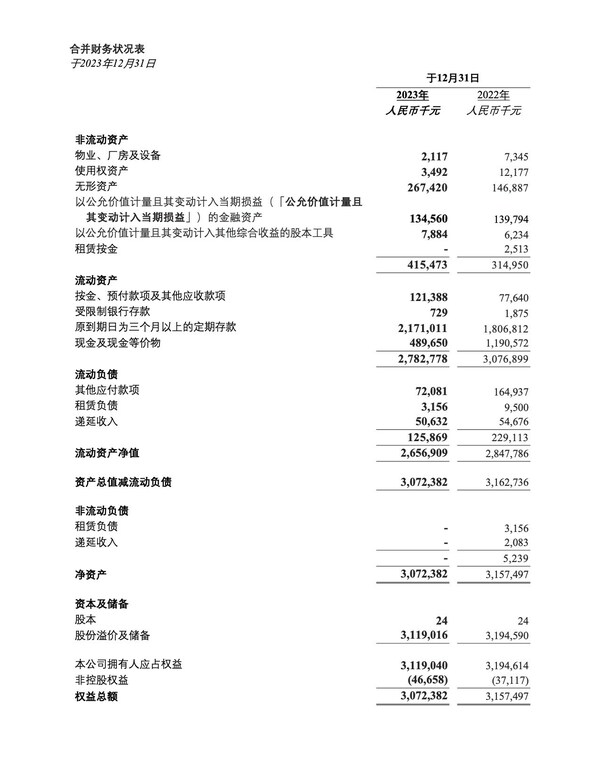
2024年度財務業績
- 截至2024年12月31日,我們的銀行存款、現金及現金等價物為人民幣24.134億元,與截至2023年12月31日的人民幣26.614億元相比,減少了人民幣2.48億元或9.3%。該減少主要是由于日常營運及研發活動支出。
- 截至2024年12月31日止年度,其他收入為人民幣1.414億元,與截至2023年12月31日止年度的人民幣1.637億元相比,減少人民幣2,230萬元或13.6%。這主要是由于美元及港元定期存款利率下降導致銀行利息收入減少人民幣2,080萬元以及就中國政府補助確認的收入減少。
- 截至2024年12月31日止年度,研發開支為人民幣2.498億元,與截至2023年12月31日止年度的人民幣4.027億元相比,減少了人民幣1.529億元或38.0%。該減少主要歸因于報告期間管線排序及組織優化,導致第三方承包成本減少了人民幣7,930萬元及雇員成本減少人民幣6,770萬元。
- 截至2024年12月31日止年度,行政開支為人民幣1.532億元,與截至2023年12月31日止年度的人民幣1.965億元相比,減少了人民幣4,330億元或22.0%。該減少主要歸因于報告期間管線排序及組織優化,導致雇員成本減少人民幣3,970萬元。
- 截至2024年12月31日止年度,期內虧損為人民幣5.124億元,與截至2023年12月31日止年度的人民幣1.844億元相比,增加了人民幣3.28億元或177.9%。虧損增加主要歸因于投資相關虧損人民幣1.261億元及減值費用人民幣9,030萬元,部分被研發開支及行政開支減少所抵銷。上一年度得益于一次性出售資產產生的重大收益人民幣1.318億元及一項股權投資的股價上升人民幣1.292億元,而本年度則受同一項股權投資公允價值下跌所影響。
電話會議信息
公司將于將于2025年3月31日香港時間上午8:30(美國東部時間3月30日晚間8:30)召開電話會議(中文場)。管理層將分享年度更新及在3月26日至30日期間APASL會議上展示的數據。所有參會者須完成會議注冊。注冊鏈接請點擊這里。
所有參會者須在電話會議之前通過上述鏈接完成在線注冊。注冊后,每位參會者將收到一封電子郵件,其中包含此次電話會議的重要信息,包括電話會議日期、時間及訪問鏈接。該鏈接須予以保密,不得與其他參會者共享。此外,此電話會議的回放將在會議后提供,并可通過訪問本公司網站www.briibio.com的投資者關系版塊獲取。
本新聞稿涉及第三方信息的引用。此類信息不應被視為參考信息納入本新聞稿中。騰盛博藥對此類第三方信息的不負任何責任。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,重點包括針對乙型肝炎病毒(HBV)感染的領先項目。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
前瞻性聲明
本新聞稿中傳達的信息包含某些具有或可能具有前瞻性的陳述。這些陳述通常包含諸如"將"、"期望"、"相信"、"計劃"和"預期"等詞語以及類似含義的詞語。就其性質而言,前瞻性陳述涉及風險和不確定性,因為它們與事件相關并取決于未來將發生的情況。可能存在目前被認為不重要或公司未意識到的其他重大風險。這些前瞻性陳述并非對未來業績的保證。在這些不確定性的背景下,讀者不應依賴這些前瞻性陳述。前瞻性陳述可能更新或根據未來的事件或發展進行相應修改,對此公司不承擔任何責任。
]]>
進一步鞏固了騰盛博藥對BRII-179知識產權和未來生產及供應的完全控制
包含BRII-179的組合療法研究(ENSURE、ENRICH和ENHANCE)正在快速推進,夯實公司實現乙型肝炎(HBV)功能性治愈的戰略
中國北京和美國北卡羅來納州達勒姆2024年12月31日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者醫療需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今日宣布,公司已與VBI Vaccines, Inc.和其部分子公司("VBI")及其債權人K2 VBI Equity Trust, LLC 和K2 HealthVentures LLC重新簽署協議,收購與BRII-179相關的知識產權(IP)及其他資產。
根據協議,公司將完全收購BRII-179的專利、技術訣竅和相關材料,消除了需向VBI支付的所有未來里程碑款項和特許權使用費。騰盛博藥將支付的總對價為1,800萬美元。隨著本次交易的完成,騰盛博藥和VBI還將終止此前于2024年2月14日宣布的相關協議,該協議因VBI停止運營而未能完成。除已經以本票形式支付的250萬美元外,被終止協議項下的所有付款義務均會被取消。
"此次交易將確保BRII-179的臨床供應獲得保障,并擁有完整的IP所有權,"騰盛博藥董事長兼首席執行官洪志博士表示,"隨著BRII-179進入后期臨床開發階段,此次交易也將更多BRII-179的潛在回報留在騰盛博藥,為股東帶來更多價值。"
目前,騰盛博藥已啟動多項包含BRII-179的組合療法研究,以實現對慢性乙型肝炎(HBV)感染患者更高的功能性治愈率。現有研究繼續證明BRII-179有潛力篩選對治愈性療法高應答的HBV患者。基于過往累積的和最新數據,評估BRII-179序貫聯合elebsiran和PEG-IFNα治療的一項大型、前瞻、驗證性2b期研究(ENRICH研究)已完成患者招募。
關于乙型肝炎
乙型肝炎病毒(HBV)感染是世界上最重大的感染性疾病威脅之一,全球感染人數超過2.54億。[1]慢性HBV感染是肝臟疾病的主要原因,每年約有82萬人死于慢性HBV感染的并發癥。[1]中國慢性HBV感染人數達8,700萬,非常值得關注。[2]
關于BRII-179
BRII-179(VBI-2601)是一種基于重組蛋白質的新型HBV 免疫治療候選藥物,可表達Pre-S1、Pre-S2和S HBV表面抗原,旨在誘導增強和廣泛的B細胞和T細胞免疫應答。騰盛博藥于2018年12月從VBI Vaccines, Inc.("VBI")引進了BRII-179,還自2023年7月起,將BRII-179的獨家許可擴展至全球市場。2023年11月,中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)授予BRII-179突破性治療認定。
關于 ENSURE、ENRICH 和 ENHANCE研究
ENSURE、ENRICH和ENHANCE都是2b期的驗證性研究,旨在評估BRII-179和elebsiran的不同聯合療法在顯著提高功能性治愈率方面的作用。這幾項研究設計結合了迄今為止多項早前和正在進行的2a期聯合療法研究累積的臨床數據。他們在統計學上能夠為更廣泛的 HBV 患者群體提供各種治療方案的治愈結果,并將決定公司的注冊策略。預計這幾項研究的結果將在 2025 年和 2026 年的各個科學會議上公布。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,重點包括針對乙型肝炎病毒(HBV)感染的領先項目。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
[1] World Health Organization. (April 2024). Global hepatitis report 2024: action for access in low- and middle-income countries. World Health Organization. Retrieved from https://www.who.int/publications/i/item/9789240091672
[2] World Health Organization. Hepatitis. World Health Organization. Retrieved from https://www.who.int/china/health-topics/hepatitis#:~:text=There%20are%2087%20million%20people,living%20with%20chronic%20hepatitis%20C.
]]>

正在進行的2期ENSURE研究提供的48周治療結束數據清楚地表明,elebsiran聯合PEG-IFNα可實現更多獲益,從而獲得更高功能性治愈率
由公司及其合作伙伴開展的多項聯合研究數據將繼續支持公司的策略,即通過正確的聯合治療方案在更廣泛的患者群體中實現HBV功能性治愈
中國北京和美國北卡羅來納州達勒姆2024年11月19日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者醫療需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,在11月15日至19日于美國加利福尼亞州圣地亞哥舉行的美國肝病研究學會(AASLD)年會上,以最新突破(late-breaking)口頭報告的形式公布了其正在進行的2期ENSURE研究的最新數據。
ENSURE是一項陽性對照、隨機、2期研究,旨在評估試驗性小干擾核糖核酸(siRNA)elebsiran(BRII-835,VIR-2218)聯合聚乙二醇干擾素α(PEG-IFNα)對乙型肝炎表面抗原(HBsAg)基線為100-3,000 IU/mL的慢性HBV感染者的作用。該研究排除了HBsAg基線水平較低(<100 IU/mL)的HBV患者,以研究在更廣泛患者群體中的潛在療效。ENSURE 48周治療結束(EOT)數據顯示,在治療結束時,接受200 mg或100 mg elebsiran聯合PEG-IFNα治療的參與者中分別有26.3%(5/19)或33.3%(6/18)實現HBsAg血清清除,而接受PEG-IFNα單藥治療的參與者中只有5.6%(1/18)實現HBsAg血清清除。
首都醫科大學附屬北京友誼醫院肝病中心主任賈繼東教授表示:"ENSURE研究的EOT數據非常明確。既往研究顯示,siRNA聯合PEG-IFNα是最有希望獲得更高HBsAg血清清除的療法之一。ENSURE研究首次為siRNA在已有的PEG-IFNα療法基礎上對實現功能性治愈的作用提供了證據。我們相信,elebsiran有望對提高HBV功能性治愈率產生重要影響。"
騰盛博藥首席醫學官David Margolis博士表示:"這項試驗數據令我們備受鼓舞,它將繼續支持我們在目標人群中開發慢性HBV功能性治愈療法的目標。該結果凸顯了elebsiran作為目前正在開展的多項臨床研究中進行評估的聯合治療方案核心的潛力。我們期待著通過正在進行的2期研究,將elebsiran與其他療法相結合,以為全球2.54億慢性HBV感染者提供更高的功能性治愈率。"
摘要編號:5008
最新突破口頭報告標題:Elebsiran(BRII-835)聯合聚乙二醇干擾素α(PEG-IFNα)對比 PEG-IFNα 在病毒學抑制的慢性乙型肝炎病毒(HBV)感染者中的療效和安全性的初步結果
講者:賈繼東教授,首都醫科大學附屬北京友誼醫院肝病中心主任
- 在治療結束時,elebsiran 200 mg + PEG-IFNα隊列和elebsiran 100 mg + PEG-IFNα隊列的HBsAg血清清除率分別為26.3%(5/19)和33.3%(6/18),明顯高于PEG-IFNα單藥治療隊列(5.6%)。
- 在HBsAg基線為100-1,500 IU/mL的亞組中,接受elebsiran 200 mg或100 mg聯合PEG-IFNα治療后分別有31.3%(5/16)或40.0%(6/15)的參與者實現了HBsAg血清清除。
- Elebsiran + PEG-IFNα隊列在治療結束時的HBsAg下降幅度(平均值[SE]:elebsiran 200 mg或100 mg分別為-2.47 [0.28]或-3.01 [0.28] log10 IU/mL)大于 PEG-IFNα隊列(-1.02 [0.30] log10 IU/mL)。
- 在HBsAg基線水平為100-3,000 IU/mL的參與者中, elebsiran 200 mg和100 mg劑量聯合PEG-IFNα可實現相似的HBsAg血清清除率和HBsAg降幅。
- 在病毒學抑制的慢性HBV感染參與者中,elebsiran聯合PEG-IFNα治療總體安全且耐受性良好。
- 治療后隨訪仍在進行中,將在治療結束后繼續隨訪24周。
作為騰盛博藥開發HBV功能性治愈獨特方法的一部分,公司及其合作伙伴正在積極推進我們差異化產品組合的多項聯合研究,包括elebsiran、針對HBV的在研廣譜中和性單克隆抗體tobevibart,以及重組蛋白HBV免疫治療藥物BRII-179。我們將在2025年的科學會議上分享關鍵數據。
關于乙型肝炎
乙型肝炎病毒(HBV)感染是世界上最重大的感染性疾病威脅之一,全球感染人數超過2.54億。[1]慢性HBV感染是肝臟疾病的主要原因,每年約有82萬人死于慢性HBV感染的并發癥。[1]中國慢性HBV感染人數達8,700萬,非常值得關注。[2]
關于Elebsiran(BRII-835,VIR-2218)
Elebsiran是一種經皮下注射給藥的靶向乙型肝炎病毒(HBV)的小干擾核糖核酸(siRNA)研究性藥物,旨在降解HBV RNA轉錄本及限制乙型肝炎表面抗原的產生,其具有針對HBV及丁型肝炎病毒(HDV)的直接抗病毒活性。其是首個進入臨床的采用增強穩定化學增強技術的siRNA,以增強穩定性并最大程度地減少脫靶活性,從而有可能提高治療指數。騰盛博藥于2020年從Vir Biotechnology, Inc. 獲得了在大中華地區開發和商業化elebsiran的獨家權益。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,重點包括針對乙型肝炎病毒(HBV)感染的領先項目。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
[1] World Health Organization. (April 2024). Global hepatitis report 2024: action for access in low- and middle-income countries. World Health Organization. Retrieved from https://www.who.int/publications/i/item/9789240091672
[2] World Health Organization. Hepatitis. World Health Organization. Retrieved from https://www.who.int/china/health-topics/hepatitis#:~:text=There%20are%2087%20million%20people,living%20with%20chronic%20hepatitis%20C.
]]>
- 新的轉化數據表明, BRII-179誘導的免疫應答與部分慢性乙型肝炎病毒 (HBV) 感染受試者的乙型肝炎表面抗原 (HBsAg)大幅下降密切相關
- BRII-179作為疊加療法可誘導功能性抗體應答,有助于改善接受聚乙二醇干擾素α (PEG-IFNα) 治療的慢性HBV感染受試者的HBsAg持續清除
中國北京和美國北卡羅萊納州達勒姆市2024年6月7日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"、"我們"或"公司",股票代碼:2137.HK),一家致力于針對患者未被滿足的需求以及重大公共衛生性疾病開發創新療法的跨國企業,今天在2024年歐洲肝臟研究協會(EASL?)大會上發布了兩項2期研究的新數據,這些數據評估了BRII-179與BRII-835(elebsiran)聯合療法或BRII-179作為疊加療法聯合PEG-IFNα 治療慢性HBV感染的有效性。
一項2期臨床試驗的口頭報告數據顯示,在部分慢性HBV感染受試者中,BRII-179與BRII-835(elebsiran)聯合可誘導顯著的HBV特異性B細胞和T細胞應答,這些應答與抗病毒作用相關。這項探索性轉化研究評估了治療誘導的免疫應答與抗病毒效果之間的相關性,結果表明:
- 靶向牛磺膽酸鈉協同轉運多肽(NTCP)鄰近區域的Pre-S1特異性T細胞應答與部分接受BRII-835(elebsiran)和BRII-179治療的受試者中HBsAg的高水平下降有關。
- 在HBsAg下降水平較高的受試者中,離體檢測到Pre-S1特異性Th1型細胞因子(IL-2),而Th2型應答與HBsAg降低無關。
- 在有HBsAg大幅降低及乙型肝炎病毒表面抗體(HBsAb)升高的受試者中, BRII-179誘導的抗體有強效抗HBV的中和活性。
杜克-新加坡國立大學醫學院新興傳染病項目教授、醫學博士Antonio Bertoletti表示:"這項研究首次直接證明了HBV治療性疫苗誘導的免疫應答在部分慢性HBV感染受試者中與HBsAg降低和病毒控制相關。抗病毒活性看上去與BRII-179誘導的抗乙型肝炎病毒表面抗體增強以及Pre-S1特異性T細胞應答有關,證明了BRII-179可以打破免疫耐受,對病毒感染的持續控制產生影響。"
另一項2期臨床試驗的最新突破壁報展示的數據顯示,與PEG-IFNα組相比,從治療結束(EOT)到核苷(酸)類逆轉錄酶抑制劑(NRTI)停藥后至少24周,在PEG-IFNα的基礎上使用治療性疫苗BRII-179可改善總體HBsAg清除率。在114名病毒抑制慢性HBV感染受試者中進行的隨機、雙盲、安慰劑對照臨床試驗的隨訪數據顯示:
- 在符合NRTI停藥標準并進入NRTI停藥監測期(NDMP)的受試者中,BRII-179+PEG-IFNα組中保持HBsAg清除的受試者百分比高于安慰劑+PEG-IFNα組(全分析集[FAS]中19.3% vs 12.3%)。從EOT(FAS中26.3% vs 19.3%)到NRTI停藥后至少24周或EOT后36周(即數據截止日期),BRII-179+PEG-IFNα組的總體HBsAg清除率改善趨勢持續維持。NRTI停藥的受試者均不需要接受NRTI再治療。
- NRTI停藥后至少24周時,與安慰劑+PEG-IFNα組相比,BRII-179+PEG-IFNα組保持HBsAg清除的受試者中HBsAb ≥ 100 IU/L的受試者比例更高(FAS中36.4% vs 14.3%)。
- 在EOT時HBsAb滴度≥ 100 IU/L的受試者中,沒有受試者在數據截止日期前出現HBsAg從< 0.05 IU/mL(LLOQ)變為≥ 0.05 IU/mL(即HBsAg反彈)的情況,這表明對HBV的穩健抗體應答是停止治療后HBsAg持續清除的必要條件。
- BRII-179和PEG-IFNα聯合療法總體上安全且可耐受。在EOT后的隨訪期和NDMP中沒有發現新的風險。
這些研究的有利風險-獲益特征和科學洞見將進一步支持BRII-179聯合其他療法(例如siRNA和PEG-IFNα)作為慢性HBV感染治療的關鍵組成部分以實現功能性治愈目標的臨床評估。
關于BRII-179
BRII-179是一種基于重組蛋白質的新型HBV 免疫治療候選藥物,可表達Pre-S1、Pre-S2和S HBV表面抗原,旨在誘導增強的和廣泛的B細胞和T細胞免疫應答。騰盛博藥于2018年12月從VBI Vaccines, Inc.("VBI")引進BRII-179,并自2023年7月起將獨家許可擴展至全球權益。
關于 BRII-835(Elebsiran)
BRII-835(elebsiran)是一種經皮下注射給藥的靶向HBV的siRNA研究性藥物,具有對HBV和HDV直接抗病毒活性和誘導有效免疫應答的潛力。它是首個進入臨床的采用增強型穩定化學+(ESC+)技術的siRNA,可增強穩定性并最大程度地降低脫靶效應,從而可提升治療效力。騰盛博藥于2020年從Vir Biotechnology, Inc.("Vir")獲得了在大中華地區開發和商業化BRII-835 (elebsiran) 的專有權。
關于乙型肝炎
乙型肝炎病毒(HBV)感染是世界上最重大的感染性疾病威脅之一,全球感染人數超過2.54億。1慢性HBV感染是肝臟疾病的主要原因,每年約有82萬人死于慢性HBV感染的并發癥。1中國慢性HBV感染人數達8,700萬,非常值得關注。2
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,重點包括針對乙型肝炎病毒(HBV)感染的領先項目。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
[1] World Health Organization. (April 2024). Global hepatitis report 2024: action for access in low- and middle-income countries. World Health Organization. Retrieved from https://www.who.int/publications/i/item/9789240091672 |
[2] World Health Organization. Hepatitis. World Health Organization. Retrieved from https://www.who.int/china/health-topics/hepatitis#:~:text=There%20are%2087%20million%20people,living%20with%20chronic%20hepatitis%20C. |
]]>

中國北京和美國北卡羅來納州達勒姆2024年5月14日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者未被滿足的需求以及重大公共衛生性疾病開發創新療法的跨國企業,今天宣布中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)將在研的乙型肝炎病毒(HBV)特異性廣譜中和單克隆抗體 BRII-877(tobevibart)和在研的HBV靶向小干擾核糖核酸(siRNA)BRII-835(elebsiran)納入突破性治療品種。這是繼 2023 年 11 月基于重組蛋白的 HBV 免疫療法 BRII-179 獲得突破性治療品種認定之后,公司在尋求 HBV 功能性治愈方面取得的又一個里程碑。
BRII-877(tobevibart)獲得突破性治療品種認定是基于由Vir Biotechnology, Inc.("Vir",納斯達克股票代碼:VIR)和騰盛博藥開展的1期和2期研究。截至2023年9月,有超過350例HBV感染者接受了BRII-877(tobevibart)的治療。數據顯示,BRII-877(tobevibart)具有良好的耐受性,并能顯著降低HBsAg水平,這表明BRII-877(tobevibart)有潛力成為慢性HBV感染者和慢性丁型肝炎病毒(HDV)感染者治療方案的重要組成部分。BRII-835(elebsiran)獲得突破性治療品種認定是基于由騰盛博藥及其合作伙伴Vir開展的1期和2期研究。截至2023年9月,已有超過570例HBV感染者參加了臨床研究,這些研究結果表明 BRII-835(elebsiran)具有良好的耐受性,并在慢性HBV和慢性HDV受試者中顯示出直接的抗病毒活性。
騰盛博藥中國研發負責人朱青博士表示:"BRII-877和BRII-835獲得突破性治療品種認定,以及BRII-179早前獲得突破性治療品種認定,進一步支持了我們長期以來為慢性HBV感染患者開發功能性治愈聯合療法的科學依據。在過去的五年中,騰盛博藥和我們的合作伙伴Vir進行了大量的臨床試驗,我們從中獲得了非常全面的臨床安全性和有效性數據,并對我們的后期開發計劃,以及在更廣泛的患者群體中實現更高的HBV功能性治愈率有了透徹的認識。"
擁有三種突破性治療手段,使公司在應對更廣泛的 HBV 感染(包括合并 HDV 感染)方面處于獨特的地位。作為騰盛博藥開發HBV功能性治愈療法的一部分,公司及其合作伙伴Vir正在推進于2024年啟動多項聯合研究的計劃,以進一步優化治療方案,為公司的注冊戰略提供依據,從而為HBV感染患者提供最佳治療方案。
關于乙型肝炎
乙型肝炎病毒(HBV)感染是世界上最重大的感染性疾病威脅之一,全球感染人數超過2.54億。1慢性HBV感染是肝臟疾病的主要原因,每年約有82萬人死于慢性HBV感染的并發癥。1中國慢性HBV感染人數達8,700萬,非常值得關注。2
關于丁型肝炎
丁型肝炎是由丁型肝炎病毒(HDV)引起的肝臟炎癥,HDV 依靠乙型肝炎病毒(HBV)進行復制。這種感染只有在 HBV 存在的情況下才會發生。HDV-HBV合并感染被認為是慢性病毒性肝炎最嚴重的形式,會導致快速發展至肝細胞癌和與肝臟相關的死亡。全球有近 5% 的慢性 HBV 感染者受到 HDV 的影響。HDV 可通過同時感染乙型肝炎和丁型肝炎(協同感染)或在感染乙型肝炎后感染丁型肝炎(重疊感染)而發生。3
關于BRII-877 (Tobevibart)
BRII-877(tobevibart)是一種皮下注射的研究性中和單克隆抗體,旨在阻斷HBV和HDV進入肝細胞,并降低血液中病毒顆粒和亞病毒顆粒的水平。BRII-877(tobevibart)結合了Xencor的Xtend ?和其他Fc技術,通過這些改造延長了半衰期,并有希望在感染患者中作為針對HBV和HDV的T細胞疫苗發揮作用。騰盛博藥于2022年從Vir Biotechnology, Inc.("Vir")獲得了BRII-877(tobevibart)在大中華區的獨家開發和商業化權益。
關于 BRII-835(Elebsiran)
BRII-835(elebsiran)是一種經皮下注射給藥的靶向HBV的siRNA研究性藥物,具有對HBV和HDV直接抗病毒活性和誘導有效免疫應答的潛力。它是首個進入臨床的采用增強型穩定化學+(ESC+)技術的siRNA,可增強穩定性并最大程度地降低脫靶效應,從而可提升治療效力。騰盛博藥于2020年從Vir Biotechnology, Inc.("Vir")獲得了在大中華地區開發和商業化BRII-835 (elebsiran) 的專有權。
關于BRII-179
BRII-179是一種基于重組蛋白質的新型HBV 免疫治療候選藥物,可表達Pre-S1、Pre-S2和S HBV表面抗原,旨在誘導增強的和廣泛的B細胞和T細胞免疫應答。騰盛博藥于2018年12月從VBI Vaccines, Inc.("VBI")引進BRII-179,并自2023年7月起將獨家許可擴展至全球權益。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,重點包括針對乙型肝炎病毒(HBV)感染的領先項目。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
[1] World Health Organization. (April 2024). Global hepatitis report 2024: action for access in low- and middle-income countries. World Health Organization. Retrieved from https://www.who.int/publications/i/item/9789240091672
2 World Health Organization. Hepatitis. World Health Organization. Retrieved from https://www.who.int/china/health-topics/hepatitis#:~:text=There%20are%2087%20million%20people,living%20with%20chronic%20hepatitis%20C.
[3] World Health Organization. (July 2023). Hepatitis D. World Health Organization. Retrieved from https://www.who.int/news-room/fact-sheets/detail/hepatitis-d
]]>
將乙肝治愈項目推進至多項后期臨床聯合研究,2024年和 2025年取得的中期結果將為公司的注冊戰略提供依據
通過收購BRII-179的全球知識產權并拓展生產布局,以整合研發、生產和商業優勢
優化公司資源,3.76億美元的充足現金將支持公司運營至 2027年
公司將于3 月 25日上午8:30(香港時間)/ 3月24日晚間8:30(美東時間)召開電話會議(中文場)
中國北京和美國北卡羅萊納州達勒姆市2024年3月22日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者未被滿足的需求以及重大公共衛生性疾病開發創新療法的跨國企業,今日發布了最新公司進展和截至2023年12月31日的全年業績報告。
2023年,公司在其重點的乙型肝炎病毒(HBV)項目中取得了重要里程碑,推動了HBV功能性治愈新型聯合療法的開發,同時拓展了產品組合。隨著正在進行的多個HBV候選藥物臨床試驗產生形成性數據,以及獲得了BRII-179的全球知識產權和生產技術,公司將在2024年啟動多項聯合療法的研究。
騰盛博藥董事長兼首席執行官洪志博士表示:"2023年對騰盛博藥來說是關鍵的一年,我們從多項2期聯合研究中獲得了重要洞見。通過過去5年的積極臨床研究,我們深入了解了最大限度減少和維持乙肝表面抗原(HBsAg)清除所需的條件。基于BRII-179,我們制定了評估和增強乙肝患者內在免疫力的策略,針對最有可能產生應答的患者進行治療,同時避免其他患者接受不必要的治療。這些重要突破為我們的后期臨床聯合研究提供了依據。"
2023財年及近期公司進展
- 2024年2月,騰盛博藥與VBI Vaccines, Inc.("VBI",納斯達克股票代碼:VBIV)達成協議,收購 BRII-179的全球知識產權和生產技術,以擴大其未來的全球生產和供應能力。同時還取消了未來向VBI支付的與BRII-179和PreHevbriTM相關的費用。
- BRII-179于2023年11月獲得中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)頒發的突破性療法認定(BTD),加快為HBV患者提供創新療法。
- 騰盛博藥于2023年7月獲得PreHevbriTM在大中華區和亞太地區(日本除外)的獨家開發和商業化權益,并已就PreHevbriTM在中國的注冊計劃向CDE提交了兩項臨床前申請(pre-IND)。香港的上市注冊申請也已提交。
- 騰盛博藥已優化其資源,重點投入其領先的HBV產品組合的臨床和商業開發中。公司正積極尋求合作機會,以進一步開發其中樞神經系統(CNS)、人類免疫缺陷病毒(HIV)和多重耐藥和廣泛耐藥(MDR/XDR)領域擁有全球權益的管線。
- 騰盛博藥任命Brian A. Johns博士為首席科學官,負責騰盛博藥的早期發現項目,并制定公司未來的管線戰略。我們的新組織戰略由在感染性疾病領域擁有豐富經驗的領導者所引領,以確保公司管線目標的達成。
2023財年臨床管線亮點和未來里程碑
乙型肝炎病毒(HBV)項目
2023年獲得的關鍵數據證明,我們擁有所有權的治療性疫苗BRII-179可在慢性乙型肝炎患者引發強效的特異性免疫應答,其與臨床療效的改善密切相關。騰盛博藥與其戰略合作伙伴將于2024年開展一系列確證性聯合研究,旨在建立以BRII-179為核心的未來乙肝治療方案。為了進一步履行我們在BRII-179上的承諾,騰盛博藥與VBI就全球知識產權和生產權益達成交易。我們正與合作伙伴密切合作,以啟動后期臨床研究,來明確BRII-179和BRII-835(elebsiran)對提高HBV功能性治愈率的貢獻。此外,BRII-179有可能識別出能產生良好抗體應答并獲得更高功能性治愈機會的慢乙肝患者。
關鍵數據及開發計劃
- BRII-179 相關研究和計劃
- 在 2023 年 11 月舉行的美國肝病研究協會年會(AASLD)上,騰盛博藥展示了兩份關于BRII-179的突破性壁報,揭示了HBsAg清除率與乙肝表面抗體反應之間的重要聯系。這些數據為進一步提高功能性治愈率和識別最有可能對治愈性療法產生應答的患者指明了方向。
- BRII-179可誘導功能性免疫應答,提高接受聯合聚乙二醇干擾素α(PEG-IFNα)治療的慢乙肝患者的HBsAg清除率和清除持續時間,進而可能提高慢乙肝患者功能性治愈率。
- 騰盛博藥對BRII-179和BRII-179聯合BRII-835(elebsiran)開展的1b/2a期研究的轉化研究數據表明,BRII-179可能有助于識別出能夠產生必要HBV特異性免疫應答的慢乙肝患者,從而在這些被篩選出的患者中實現更高的功能性治愈率,同時避免了其他患者接受不必要的治療。
- 騰盛博藥計劃在2024年下半年啟動多項聯合研究,以驗證BRII-179與其他療法聯合使用時提高HBV功能性治愈率的能力。
- 騰盛博藥將在2024年3月27日至31日于日本京都舉行的第33屆亞太肝臟研究學會(APASL)會議上,以突破性口頭報告的形式公布其正在進行的BRII-179聯合PEG-IFNα治療慢乙肝患者的 2 期研究中,符合核苷酸逆轉錄酶抑制劑(NRTI)停藥標準的患者數據。
- 在 2023 年 11 月舉行的美國肝病研究協會年會(AASLD)上,騰盛博藥展示了兩份關于BRII-179的突破性壁報,揭示了HBsAg清除率與乙肝表面抗體反應之間的重要聯系。這些數據為進一步提高功能性治愈率和識別最有可能對治愈性療法產生應答的患者指明了方向。
- BRII-835(Elebsiran)& BRII-877(Tobevibart)相關研究和計劃
- 已完成在包括中國大陸在內的亞太地區開展的BRII-835(elebsiran)聯合PEG-IFNα的2期研究患者入組工作。該研究旨在進一步了解BRII-835(elebsiran)相較單用PEG-IFNα對提高HBV治愈率方面的效果,并探索BRII-179在篩選出合適的患者以獲得更佳療效方面的潛力。該研究的初步頂線結果預計將于2024年第四季度公布。
- 騰盛博藥的合作伙伴Vir Biotechnology, Inc.("Vir",納斯達克股票代碼:VIR)在2023年11月的AASLD會議上展示了MARCH研究B部分的新數據。數據顯示,在將BRII-877(tobevibart)加入聯合或不聯合PEG-IFNα的BRII-835(elebsiran)方案中治療24周后,應答率提高了約三倍: BRII-877(tobevibart)+ BRII-835(elebsiran)+ PEG-IFNα的應答率為15.0%,BRII-877(tobevibart)+ BRII-835(elebsiran)的應答率為14.3%。治療48周的隊列數據將于2024年第四季度公布。
- Vir在2023年11月AASLD會議的突破性報告中,以及在2024年1月第42屆摩根大通醫療健康年會上,分享了SOLSTICE研究中一小部分慢性丁型肝炎(CHD)參與者的初步數據。經過12周的BRII-877(tobevibart)和BRII-835(elebsiran)聯合治療后,6名參與者中有5人無法檢測到丁型肝炎病毒核糖核酸(HDV RNA),6名參與者中有6人的HDV RNA低于定量下限。其他數據將于2024年第二季度公布,完整的24周治療數據預計將于2024年第四季度公布。
- BRII-877(tobevibart)的一項1期研究正在中國開展。中國大陸受試者的人體藥代動力學(PK)數據將與亞太地區和歐洲的受試者進行比較。
其他臨床和臨床前開發更新
基于公司所專注的HBV項目戰略,騰盛博藥正尋求以下項目后續開發的合作機會。
多重耐藥和廣泛耐藥(MDR/XDR)革蘭氏陰性菌感染項目
- BRII-693
- 騰盛博藥于2023年6月獲得了開發和商業化BRII-693的全球獨家權益,BRII-693是一種新型多粘菌素,用于治療嚴重的革蘭氏陰性感染。公司正尋求戰略資金合作伙伴,以加快BRII-693的開發,這種新型抗生素旨在幫助應對全球日益嚴峻的抗菌藥耐藥威脅。
- 2023年4月,騰盛博藥向NMPA提交了BRII-693的pre-IND申請,計劃在中國啟動1期臨床PK橋接研究。公司正計劃開展更多PK臨床研究,以支持3期臨床試驗的啟動。這些研究對支持全球開發工作至關重要。針對醫院獲得性細菌性肺炎(HABP)/呼吸機相關細菌性肺炎(VABP)的大型全球3期注冊性臨床試驗預計將于2025年開展。
人類免疫缺陷病毒(HIV)項目
- BRII-753是公司內部研發的新化學實體,目前正處于臨床前開發階段。BRII-753是一種長效皮下注射劑,可每月一次、每季度一次或每年兩次給藥,可用于治療HIV的聯合療法和暴露前預防的單藥療法。
- BRII-732已完成1期研究,有潛力開發為HIV患者每周口服一次的長效聯合治療方案的一部分。
非結核分枝桿菌(NTM)肺病項目
- BRII-658(Epetraborole):2024年2月,騰盛博藥的合作伙伴AN2 Therapeutics, Inc.(納斯達克股票代碼:ANTX)宣布自愿暫停其epetraborole(BRII-658)治療難治性復合分枝桿菌(MAC)肺病的2/3 期臨床試驗患者招募,以待進一步的數據審查。
產后抑郁癥(PPD)和重度抑郁癥(MDD)項目
- BRII-296:2023年9 月,評估BRII-296的2期研究完成首例患者給藥。BRII-296是一種長效注射劑,正在開發用于治療PPD。公司預計將于2024年第二季度公布2期試驗數據。
- BRII-297是一種長效注射劑,正在開發用于治療焦慮癥和抑郁癥,該藥的1期臨床試驗已完成患者給藥。該研究旨在評估BRII-297在健康志愿者中的安全性、耐受性和藥代動力學,預計將于2024年下半年獲得數據。
2023年全年財務業績
- 截至2023年12月31日,銀行存款以及現金及現金等價物為人民幣26.614億元,與截至2022 年12月31日的人民幣29.993億元相比,減少人民幣3.379億元或11.3%。該減少主要是由于日常營運及研發活動支出。
- 截至2023年12月31日止年度,其他收入為人民幣1.637億元,與截至2022 年12月31日止年度的人民幣1.079億元相比,增加人民幣5,580萬元或51.7%。這主要是由于美元及港元定期存款利率上升導致銀行利息收入增加人民幣7,080萬元。該增加部分被確認的中國政府補助收入減少所抵銷。
- 截至2023年12月31日止年度,研發開支為人民幣4.027億元,與截至 2022年12月31日止年度的人民幣4.406億元相比,減少人民幣3,790萬元或8.6%。該減少主要是由于COVID-19項目終止。
- 截至2023年12月31日止年度,行政開支為人民幣1.965億元,與截至 2022年12月31日止年度的人民幣1.686億元相比,增加人民幣2,790萬元或16.5%。該增加主要歸因于雇員成本增加。
- 截至2023年12月31日止年度,綜合開支總額為人民幣1.597億元,與截至2022年12月31日止年度的人民幣2.385億元相比,減少人民幣7,880萬元或33.0%。該減少主要歸因于其他收益及虧損增加,部分被由功能貨幣換算至呈列貨幣的匯兌差額所產生的收益減少所抵銷。
電話會議信息
公司將于2024年3月25日,香港時間上午8:30(美國東部時間3月24日晚間8:30)舉行電話會議(中文場)。在參加電話會議之前,參會者須完成會議注冊。注冊鏈接請點擊這里。
所有參會者須在電話會議之前通過上述鏈接完成在線注冊。此外,此電話會議的回放將在會議后提供,并可通過訪問公司網站www.briibio.com的投資者關系版塊獲取。
***
本新聞稿涉及第三方信息的引用。此類信息不應被視為參考信息納入本新聞稿中。騰盛博藥對此類第三方信息的不負任何責任。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)以及重度抑郁癥(MDD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
前瞻性聲明
本新聞稿中傳達的信息包含某些具有或可能具有前瞻性的陳述。這些陳述通常包含諸如"將"、"期望"、"相信"、"計劃"和"預期"等詞語以及類似含義的詞語。就其性質而言,前瞻性陳述涉及風險和不確定性,因為它們與事件相關并取決于未來將發生的情況。可能存在目前被認為不重要或公司未意識到的其他重大風險。這些前瞻性陳述并非對未來業績的保證。在這些不確定性的背景下,讀者不應依賴這些前瞻性陳述。前瞻性陳述可能更新或根據未來的事件或發展進行相應修改,對此公司不承擔任何責任。
媒體問詢:
media@briibio.com
投資者問詢:
ir@briibio.com

在滿足特定條件后,公司將收購與BRII-179相關的所有知識產權,取消未來向VBI支付的里程碑費用和特許權使用費
在滿足特定條件后,公司將轉移BRII-179和PreHevbrio/PreHevbri的生產技術至其他生產基地,以擴大全球商業供應范圍
在滿足特定條件后,公司將收購VBI-1901在亞太地區(除日本外)的市場權益,為該地區帶來新機遇
中國北京和美國北卡羅來納州達勒姆2024年2月14日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者未被滿足的需求以及重大公共衛生性疾病開發創新療法的跨國企業,今日宣布與VBI Vaccines, Inc.("VBI",NASDAQ:VBIV)達成協議,以確保擴大并掌控BRII-179的未來臨床和商業供應。BRII-179是騰盛博藥乙肝(HBV)功能性治愈產品組合中處于后期臨床階段的產品。
根據協議,騰盛博藥最初將向VBI開具250萬美元的本票,這將取消PreHevbri相關的特許權使用費和里程碑費用。在滿足特定條件后,票據將增加至1,000萬美元,以獲得VBI在BRII-179的所有知識產權,BRII-179相關付款也都將被取消。此外,在滿足特定條件后,騰盛博藥會和VBI一起合作將BRII-179的生產技術轉移至騰盛博藥指定的生產基地。在完成與該技術轉移有關的必要舉措后,視一定的潛在調整情況,騰盛博藥將向VBI開具最多800萬美元的額外本票。在滿足特定條件后,騰盛博藥還將在2024年6月30日或之后,以1,000萬美元現金接管VBI位于雷霍沃特的BRII-179和PreHevbrio/PreHevbri生產基地,屆時騰盛博藥將和VBI計劃簽訂供應協議,根據該協議,騰盛博藥將成為VBI的PreHevbrio/PreHevbri商業供應商。
此外,視VBI一定的條件達成情況,騰盛博藥將獲得VBI的候選膠質母細胞瘤(GBM)免疫療法VBI-1901在亞太(APAC)地區(日本除外)的獨家開發和商業化許可權,并向VBI開具500萬美元的本票。VBI-1901已獲得美國食品藥品監督管理局(FDA)的快速通道認定和孤兒藥認定,目前正在進行一項2b期研究。
騰盛博藥董事長兼首席執行官洪志博士表示:"非常感謝雷霍沃特生產基地的VBI同事們,盡管面臨重大挑戰,仍然不斷提供BRII-179的持續供應。隨著騰盛博藥的HBV項目進入后期開發階段,全球生產策略變得至關重要。我們期待與雷霍沃特生產基地的生物制品生產專家合作,并及時整合我們的研發和生產能力。"
關于BRII-179
BRII-179(VBI-2601)是一種基于重組蛋白質的新型HBV 免疫治療候選藥物,可表達Pre-S1、Pre-S2和S HBV表面抗原,旨在誘導增強和廣泛的B細胞和T細胞免疫應答。作為治療慢性HBV感染的潛在功能性治愈方案的一部分,騰盛博藥正在開展BRII-179與BRII-835(VIR-2218)聯合用藥,及BRII-179與PEG-IFNα聯合用藥的兩項2期研究。
騰盛博藥于2018年12月從VBI Vaccines, Inc.("VBI")引進了BRII-179,獲得了在包括中國大陸,香港,澳門和臺灣地區的商業化權益。公司還自2023年7月起,將BRII-179的獨家許可擴展至全球市場。2023年11月,中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)授予BRII-179突破性治療認定。
關于PreHevbri®
PreHevbri®是唯一一款具有三種抗原的乙型肝炎疫苗,由乙型肝炎病毒的三種乙型肝炎表面抗原S、pre-S1和pre-S2組成。該疫苗已在美國、歐盟/歐洲經濟區、英國、加拿大和以色列獲批上市。疫苗的商品名為:PreHevbrio® (美國/加拿大)、PreHevbri®(歐盟/歐洲經濟區/英國)和Sci-B-Vac®(以色列)。
關于VBI-1901
VBI-1901是一種新型癌癥疫苗免疫治療候選藥物,采用包膜病毒樣顆粒(eVLP)技術開發,靶向兩種高度免疫原性的巨細胞病毒(CMV)抗原gB和pp65。VBI-1901被FDA授予"快速通道認定"和"孤兒藥認定", 用于治療膠質母細胞瘤。這些認定旨在為藥品開發企業提供更多益處,包括與FDA更頻繁的會面機會,以及在符合相關標準的情況下獲得加速審批和優先審查權等。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家商業化階段的生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)以及重度抑郁癥(MDD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
]]>
中國北京和美國北卡羅來納州達勒姆2024年1月3日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者未被滿足的需求以及重大公共衛生性疾病開發創新療法的跨國企業,宣布Brian Alvin Johns博士自2024年1月3日起擔任首席科學官。Johns博士將全面負責騰盛博藥的新藥開發項目,并制定公司的未來管線策略和優先事項。
Johns博士在制藥行業擁有豐富的經驗,曾成功組建和領導多個團隊完成多個創新藥物的發現和早期開發項目。他對端到端研發目標的深刻理解在創造和提供差異化藥物方面發揮了關鍵作用,改變了許多患者的生活。
騰盛博藥董事長兼首席執行官洪志博士表示:"我很高興能再次與Brian合作,由其擔任我們的首席科學官。他是業內新藥開發領域首屈一指的專家,他在大型制藥公司和初創生物技術公司工作的獨特經驗將為騰盛博藥帶來助益。"
在加入騰盛博藥之前,Johns博士曾在HemoShear Therapeutics, Inc.擔任首席科學官,負責帶領團隊開發各疾病領域的新靶點和平臺。在此之前,他曾在ViiV Healthcare和葛蘭素史克擔任新藥開發副總裁,為ViiV/葛蘭素史克的HIV系列藥物做出了巨大貢獻,發現了多替拉韋和卡替拉韋這兩種突破性藥物。
Johns博士擁有化學博士學位,并因其在該領域的巨大貢獻獲得了眾多榮譽和獎項。他在藥物化學和藥物發現方面的豐富專業知識還體現在其獲得的眾多專利和發表的多個出版物中。
Brian A. Johns博士表示:"我很高興能加入騰盛博藥,為感染性疾病的變革性療法開發貢獻力量。騰盛博藥專注于治愈性藥物和新型治療方案,并擁有一支備受認可的優秀團隊,我迫不及待地想成為該團隊的一員,與他們一起以突破性的創新和洞察,踐行解決重大公共衛生問題的使命。"
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家商業化階段的生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)以及重度抑郁癥(MDD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
]]>
直接證據顯示,BRII-179誘導的功能性抗體應答有助于提高和維持HBsAg清除率
在利用BRII-179富集具有內在體液免疫應答的患者以提高HBsAg清除率或HBV功能性治愈率方面獲得新的洞察
新數據支持進入后期臨床開發階段,這些數據有望為慢性乙型肝炎的治愈性療法提供依據
北京美國和北卡羅來納州達勒姆2023年11月14日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者未被滿足的需求以及重大公共衛生性疾病開發創新療法的跨國企業,今日在馬薩諸塞州波士頓舉行的美國肝病研究協會年會(AASLD)上分享了三張壁報,其中兩張壁報為最新突破壁報,提供了慢性乙型肝炎(CHB)臨床項目中的兩項處于2期研發階段的產品BRII-179(VBI-2601)和BRII-835(VIR-2218)的最新數據。
騰盛博藥首席醫學官David Margolis博士表示:"我們很高興能在肝病年會上分享這些數據。這些數據證實我們HBV管線組合的多功能性,并展示了我們在尋找HBV功能性治愈方法過程中的重要洞見。HBsAg清除與抗體應答之間的重要聯系,為進一步提高功能性治愈率和識別最有可能對治愈性療法產生應答的患者指明了方向。我們的目標是在盡可能廣泛的人群中為合適的患者開發適當的治療方案,同時讓患者避免選擇昂貴或耐受性較差且不會給他們帶來獲益的治療選擇。"
在最新突破壁報報告中,騰盛博藥公布了BRII-179聯合聚乙二醇干擾素α(PEG-IFNα)治療CHB患者的隨機、安慰劑對照和雙盲的2期研究治療組別層面揭盲的進一步數據。報告結果包括:
- 在現有PEG-IFNα治療基礎上聯合BRII-179總體上安全且耐受性良好,其不良事件與既往報道的PEG-IFNα治療和BRII-179的不良事件相似。
- 在第36周(治療結束后 [EOT] 12周),與安慰劑 + PEG-IFNα組相比,BRII-179 + PEG-IFNα組的HBsAg清除率更高(全分析集 [FAS]:24.6% vs. 14.0%,符合方案集 [PPS]:31.8% vs. 14.9%)。在第24周(EOT)已觀察到該HBsAg清除率方面的差異,這種差異一直維持到第36周。臨床研究還發現,在第24周(EOT),聯合給藥組的HBsAg血清學轉換率顯著高于安慰劑 + PEG-IFNα組(FAS:15.8% vs. 1.8%,p=0.0163;PPS:19.6% vs. 2.0%,p=0.0058)。
- 聯合BRII-179可誘導針對HBsAg的穩健的、功能性的抗體應答。BRII-179 + PEG-IFNα聯合給藥組的受試者在第24周和第36周的乙型肝炎表面抗體(HBsAb)應答率顯著高于安慰劑 + PEG-IFNα組(第24周FAS:38.6% vs. 14.0%,p=0.0052;PPS:39.1% vs. 13.7%,p=0.0054;第36周FAS:33.3% vs. 12.3%,p=0.0131;PPS:34.1% vs. 10.6%,p=0.0105)。在第24周和第36周,HBsAb滴度與HBsAg清除顯著相關,HBsAg反彈的5例患者中有4例檢測不到抗體應答。
- 這項概念驗證性研究的數據表明,聯合BRII-179可誘導功能性免疫應答,提高接受PEG-IFNα治療的CHB患者的HBsAg清除率和清除持續時間,進而提高CHB功能性治愈率。
在第二張最新突破壁報報告中,騰盛博藥展示了BRII-179-001和BRII-179-835-001研究的轉化研究數據,表明僅在部分CHB受試者中觀察到BRII-179可誘導獨特的HBsAg抗體應答,這說明一些患者對HBV的內在免疫應答可能受到了更嚴重的損害。此外,研究人員還發現:
- BRII-179聯合BRII-835(VIR-2218)每月一次給藥,連續給藥9個月的耐受性總體良好,沒有發生2級以上的治療相關不良事件。
- 在接受核苷(酸)逆轉錄酶抑制劑(NrtI)治療的CHB受試者中,BRII-179單藥治療或聯合BRII-835治療均可誘導產生顯著的HBV特異性T細胞應答,而僅在部分CHB受試者中,在與BRII-835聯合接種9劑后(一種HBV靶向siRNA,可降低免疫抑制性病毒抗原如HBsAg),引起顯著的抗HBsAg抗體應答。
- 免疫分析表明,BRII-179可以提供一個獨特的機會,可以富集能夠產生必要的抗HBsAg抗體應答的CHB患者,在一些患者中實現更高的功能性治愈率,同時避免其他患者接受不必要的治療。
在另一個壁報報告中,騰盛博藥重點介紹了1b/2期和2期臨床試驗中BRII-835(VIR-2218)在慢性HBV感染患者中的多次給藥藥代動力學(PK),以及區域或種族背景可能對藥物PK產生的影響。重點內容包括:
- BRII-835在慢性HBV感染患者中的PK特性與在健康志愿者中的PK特性基本相似。劑量為50 mg和100 mg時,觀察到全身暴露量呈劑量依賴性增加。四周后第2次給藥后,血漿中無明顯蓄積。
- 亞太地區和中國大陸入組患者的PK特征相似,表明來自中國大陸的中國患者的種族背景未產生顯著影響,這可以支持中國大陸參與未來全球試驗,以進一步評估BRII-835。
作為騰盛博藥開發HBV功能性治愈獨特方法的一部分,公司與其合作伙伴正在進行多項臨床2期研究,包括BRII-835和BRII-179聯合用藥、BRII-179和PEG-IFN?聯合用藥、BRII-835、BRII-877(VIR-3434)聯合或不聯合PEG-IFN?。此外,Vir Biotechnology, Inc.("Vir")還在研究VIR-2218和/或VIR-3434用于治療HBV/HDV合并感染。
關于乙型肝炎
乙型肝炎病毒感染是世界上最重大的感染性疾病威脅之一,全球感染人數超過2.9億。1慢性HBV感染是肝臟疾病的主要原因,每年約有82萬人死于慢性HBV感染的并發癥。1中國慢性HBV感染人數達8,700萬,非常值得關注。2
關于BRII-179
BRII-179(VBI-2601)是一種基于重組蛋白質的新型HBV 免疫治療候選藥物,可表達Pre-S1、Pre-S2和S HBV表面抗原,旨在誘導增強和廣泛的B細胞和T細胞免疫應答。作為治療慢性HBV感染的潛在功能性治愈方案的一部分,騰盛博藥正在開展BRII-179與BRII-835(VIR-2218)聯合用藥,及BRII-179與PEG-IFNα聯合用藥的兩項2期研究。
騰盛博藥于2018年12月從VBI Vaccines, Inc.("VBI")引進了BRII-179,獲得了在包括中國大陸,香港,澳門和臺灣地區的商業化權益。公司還自2023年7月起,將BRII-179的獨家許可擴展至全球市場。
關于BRII-835
BRII-835(VIR-2218)是一種經皮下注射給藥的靶向HBV的siRNA研究性藥物,具有對HBV直接抗病毒活性和誘導有效免疫應答的潛力。它是首個進入臨床的采用增強型穩定化學+(ESC+)技術的siRNA,可增強穩定性并最大程度地降低脫靶效應,從而可提升治療效力。騰盛博藥于2020年從Vir Biotechnology, Inc.("Vir")獲得了在大中華地區開發和商業化BRII-835的專有權。
關于 BRII-877
BRII-877(VIR-3434)是一種皮下注射的研究性HBV中和單克隆抗體,旨在阻斷所有10種基因型的HBV進入肝細胞,并降低血液中病毒顆粒和亞病毒顆粒的水平。BRII-877(VIR-3434)結合了Xencor的Xtend ?和其他Fc技術,通過這些改造有希望在感染患者中作為針對HBV的T細胞疫苗,并具有延長的半衰期。騰盛博藥于2022年從Vir Biotechnology, Inc.("Vir")獲得了BRII-877在大中華區的獨家開發和商業化權益。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家商業化階段的生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于感染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)以及重度抑郁癥(MDD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
1 World Health Organization. (June 2022). Hepatitis B. World Health Organization. Retrieved from https://www.who.int/news-room/fact-sheets/detail/hepatitis-b
2 World Health Organization. Hepatitis. World Health Organization. Retrieved from https://www.who.int/china/health-topics/hepatitis#:~:text=There%20are%2087%20million%20people,living%20with%20chronic%20hepatitis%20C.
]]>

BRII-179(VBI-2601)與標準療法PEG-IFN?的聯合治療,可提高PEG-IFN?治療結束和12周隨訪時的乙肝表面抗原(HBsAg)清除率
BRII-179治療與HBsAg清除率的增加相關,并與HBsAg血清學轉換率的顯著增加密切相關
安全性結果與此前報告的PEG-IFN?和BRII-179治療的安全性結果相似
中國北京和美國北卡羅萊納州達勒姆市2023年9月6日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥","我們"或"公司",股票代碼:2137.HK),一家致力于針對患者未被滿足的需求以及重大公共衛生性疾病開發創新療法的跨國企業,今日公布了一項隨機、雙盲、安慰劑對照的2期研究治療組別層面揭盲的第 36 周頂線數據結果。該數據來自BRII-179,一種首創的Pre-S1/Pre-S2/S治療性疫苗與聚乙二醇干擾素?(PEG-IFN?)聯合治療慢性乙型肝炎(CHB)患者的期中分析。在此前的研究中,曾報告過BRII-179能誘導CHB患者產生針對Pre-S1、Pre-S2 和S表位的廣泛抗體和T細胞反應。
該研究的治療組別層面揭盲數據顯示,在第24周(治療結束或EOT)的意向治療分析中,有26.3%(15例)接受BRII-179/PEG-IFNα治療的患者實現了HBsAg清除,而在接受安慰劑/PEG-IFNα治療的患者中,有19.3%(11例)實現了HBsAg清除。在第 36 周(治療結束后12 周隨訪),有24.6%(14例)接受BRII-179/PEG-IFNα 治療的患者實現了HBsAg清除,而在接受安慰劑/PEG-IFNα治療的患者中, 有14.0%(8例)實現HBsAg清除。在治療結束(第24周)時的符合方案分析中,有32.6%(15例)接受BRII-179/PEG-IFNα治療的患者實現了HBsAg清除,而接受安慰劑/PEG-IFNα治療的患者中,有21.6%(11例)實現HBsAg清除;在治療結束后12周隨訪(第36周)時,分別有31.8%(14例)和14.9%(7例)實現HBsAg清除。此外,接受BRII-179/PEG-IFNα治療并實現HBsAg清除的15例患者中,有9例在治療結束(第24周)時實現了HBsAg血清學轉換,而在接受安慰劑/PEG-IFNα治療并實現HBsAg清除的11例患者中,僅有1例實現了HBsAg血清學轉換。24周治療組別層面揭盲安全性數據顯示,BRII-179/PEG-IFNα治療總體上安全性及耐受性良好,不良事件與PEG-IFNα治療的不良反應或此前報告的BRII-179治療的不良事件相似。目前隨訪正在進行中。
騰盛博藥首席醫學官David Margolis博士表示:"BRII-179能誘導功能性免疫反應,對PEG-IFNα等其他治療方式起到補充作用,這項概念驗證性研究的數據與我們之前的機制驗證性研究結果一致,我們對此感到非常興奮。我們期待通過正在進行以及未來的研究,繼續評估這一一流的免疫治療候選藥物,努力為全球 2.9 億 慢性HBV 感染者提供最高的HBV功能性治愈率。"
Vir Biotechnology評估 BRII-835(VIR-2218)聯合或不聯合PEG-IFNα的研究,以及騰盛博藥正在進行的BRII-179與BRII-835聯用的2期研究等多項研究的積極結果,均顯示持久的HBsAg清除與抗體反應之間存在顯著的相關性,凸顯了BRII-179有潛力作為HBV功能性治愈方案中重要的免疫調節藥物。
與此同時,騰盛博藥新啟動的一項HBV 2期研究,將BRII-835 + PEG-IFNα聯用與單用PEG-IFNα的對照組進行了比較,旨在明確聯合用藥在實現功能性治愈上的額外效果。公司計劃在該2期研究中納入亞太地區曾接受過BRII-179治療的患者。公司相信,BRII-179 具有獨特的能力,可以識別具有良好內在體液免疫應答的患者。
2023年7月,騰盛博藥將VBI Vaccines(納斯達克股票代碼:VBIV)的BRII-179(VBI-2601)許可權益擴展至全球。公司計劃在不久的將來開展更多聯合研究,以探討BRII-179(VBI-2601)提高抗體應答的能力,并為患者提供更多的潛在治愈性療法。
更多詳細數據將在未來的科學會議上進行分享。
關于BRII-179 (VBI-2601) + PEG-IFNα聯合療法研究
此2期研究是一項多中心、隨機、雙盲、安慰劑對照的平行組研究,旨在評估在PEG-IFNα和NrtI基礎上聯合BRII-179治療慢性HBV感染的安全性和有效性。這項研究招募了中國大陸的成年慢性HBV感染者,這些患者已按照治療指南接受了24至28劑PEG-IFNα,以及至少接受了12個月的NrtI治療,并符合預設定的部分應答標準。受試者按1:1比例隨機接受BRII-179或安慰劑治療,在18周內接受每3周一次,共計7次給藥,同時繼續接受PEG-IFNα治療24周。符合Nrtl停藥標準的受試者將停止Nrtl治療,并繼續接受額外48周的隨訪。
關于乙型肝炎
乙型肝炎病毒感染是世界上最重大的感染性疾病威脅之一,全球感染人數超過2.9億。[1]慢性HBV感染是肝臟疾病的主要原因,每年約有82萬人死于慢性HBV感染的并發癥。[1]中國慢性HBV感染人數達8,700萬,非常值得關注。[2]
關于BRII-179(VBI-2601)
BRII-179(VBI-2601)是一種基于重組蛋白質的新型HBV 免疫治療候選藥物,可表達Pre-S1 、 Pre-S2 和 S HBV 表面抗原,旨在誘導增強和廣泛的B 細胞和 T 細胞免疫應答。作為治療慢性HBV感染的潛在功能性治愈方案的一部分,騰盛博藥正在開展BRII-179與BRII-835(VIR-2218)聯合用藥,及BRII-179與PEG-IFNα聯合用藥的兩項2期研究。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家商業化階段的生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于傳染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)以及重度抑郁癥(MDD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
[1] World Health Organization. (June 2022). Hepatitis B. World Health Organization. Retrieved from https://www.who.int/news-room/fact-sheets/detail/hepatitis-b
[2] World Health Organization. Hepatitis. World Health Organization. Retrieved from https://www.who.int/china/health-topics/hepatitis#:~:text=There%20are%2087%20million%20people,living%20with%20chronic%20hepatitis%20C.

用于乙肝功能性治愈的BRII-835 + PEG-IFN-α聯合療法對照PEG-IFN-α的2期研究已完成首例患者首次給藥
將于2023年底前啟動多項研究中的首個研究,以探索BRII-179在具有顯著內在抗HBsAg反應患者中的治愈性療法潛力
PreHevbri®在亞太國家和地區的注冊申請及上市準備工作正在進行中
PreHevbri®帶來的近期收入機會以及充足的現金將支持公司至少運營至2026年
公司將于8月23日上午8:00(香港時間)/ 8月22日晚間8:00(美東時間)召開業績發布電話會議。慢乙肝藥物研發研討會(HBV R&D Day)將于8月24日下午1:00-2:30(香港時間)舉辦
中國北京和美國北卡羅萊納州達勒姆市2023年8月22日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥","我們"或"公司",股票代碼:2137.HK),一家致力于針對患者未被滿足的需求以及重大公共衛生性疾病開發創新療法的跨國企業,今日發布了公司最新進展和截至2023年6月30日止六個月的中期業績報告。
傳染性疾病治療領域
近期,騰盛博藥與VBI Vaccines Inc.(納斯達克股票代碼:VBIV)達成了兩項戰略協議,獲得了BRII-179的全球獨家許可,將具有臨床差異化的乙肝預防性疫苗PreHevbri®引入亞太國家和地區。
PreHevbri®的引入不僅充實了騰盛博藥已有的乙肝功能性治愈產品組合,也進一步推進了公司在大中華區及其他亞太國家和地區減少HBV傳播的解決方案。目前,公司正積極為 PreHevbri®在亞太市場上市做準備工作,其中優先考慮那些可能不需要額外試驗的國家和地區。目前,針對香港的市場注冊申請已經提交,預計監管機構將在近期做出決定。
今年6月,騰盛博藥的戰略合作伙伴Vir Biotechnology, Inc.(納斯達克股票代碼:VIR)在2023年歐洲肝臟研究協會(EASL)大會上分享了VIR-2218(BRII-835)和VIR-3434(BRII-877)的2期MARCH試驗A部分數據。數據顯示,慢性HBV患者的乙肝表面抗原(HBsAg)水平顯著下降,90%的患者HBsAg水平低于10 IU/mL,這表明VIR-3434(BRII-877)在慢性HBV治療中具有廣闊的潛力。隨著這些數據的公布,騰盛博藥于2023年8月獲得了中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)對BRII-877(VIR-3434)1 期研究的新藥臨床試驗(IND)批準。
此外,在EASL大會上公布的令人信服的數據強調了BRII-835(VIR-2218)/PEG-IFN-α組合作為治療慢性HBV感染的同類最佳功能性治愈療法的潛力。值得注意的是,數據表明,治療結束時較高的抗HBs抗體應答與治療后24周持續的HBsAg清除有關,這表明患者的體液免疫在持續控制HBV感染方面的重要作用。
基于這一重要洞見,在獲得包括中國國家藥品監督管理局(NMPA)在內的多個亞太地區監管機構的批準后,騰盛博藥啟動了一項隨機、陽性對照的BRII-835 + PEG-IFN-α聯合療法的2期研究。該研究的主要目標是比較BRII-835/PEG-IFN-α聯合療法與單用PEG-IFN-α在功能性治愈率上的表現。公司還計劃將之前曾接受BRII-179治療并有抗HBsAg反應記錄的患者納入研究。公司相信,BRII-179具有獨特的能力,可以區分具有顯著自身體液免疫應答的患者和不具備這種能力的患者。此外,公司還在計劃開展更多研究,以探究BRII-179在激發更強抗體反應方面的作用,以及在廣泛的HBV患者群體中為BRII-835/PEG-IFN-α及其他聯合療法等治愈性療法拓展其適用患者的情況。
在另一項與Qpex的交易中,騰盛博藥獲得了BRII-693(此前也稱為QPX9003)的全球獨家權益,這是一種潛在的同類最佳合成脂肽靜脈注射抗生素,用于治療難治性多重耐藥(MDR)/廣泛耐藥(XDR)革蘭氏陰性菌感染(尤其是耐碳青霉烯類鮑曼不動桿菌和銅綠假單胞菌),從而鞏固了公司應對抗生素耐藥性挑戰的承諾,并進一步強化了財務支持。
中樞神經系統疾病治療領域
在與美國食品和藥物管理局(FDA)達成協議后,公司將于2023年第三季度啟動BRII-296用于治療產后抑郁癥(PPD)的2期臨床試驗,以研究這種首創的長效、單次治療方案。BRII-296代表著患者治療模式的轉變,有望快速、持續地緩解新媽媽的抑郁癥狀。據估計,僅在美國就有約50萬名母親患有PPD,全球有近2,000萬名女性受到PPD的困擾。
此外,公司還在繼續推進第二種長效注射劑BRII-297的首次人體1期臨床研究,擴大了各種焦慮和抑郁癥或適應癥的潛在突破性治療選擇。
2023年中期財務業績
- 2023年上半年的其他收入為人民幣8,590萬元,與2022年上半年的人民幣 3,820萬元相比,增加了人民幣4,770萬元,增幅為124.9%。收入增加的主要原因是增加了原始期限超過三個月的定期存款,銀行利息收入增加了人民幣3,610 萬元,以及確認的中國政府補助收入增加了人民幣1,160萬元。
- 2023年上半年的研發支出為人民幣2.022億元,與2022年上半年的人民幣2.585億元相比,減少了人民幣5,630萬元,降幅為21.8%。減少的主要原因是由于公司決定終止COVID-19項目后,第三方承包費用的減少。
- 2023年上半年的行政支出為人民幣1.028億元,與2022年上半年的人民幣9,550萬元相比,增加了人民幣730萬元,增幅為7.6%。增加的主要原因是員工人數和電腦軟件費用的增加。
- 2023年上半年的綜合支出總額為人民幣1.04億元,與2022年上半年的人民幣2.177億元相比,減少了人民幣1.137億元,降幅為52.2%。減少的主要原因是其他收入增加,研發支出減少。
電話會議信息
公司將于香港時間2023年8月23日上午8:00(美國東部時間2023年8月22日晚間8:00)舉行電話會議。參會者須在電話會議之前完成注冊。注冊鏈接請點擊這里。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家商業化階段的生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會歧視的重大公共衛生挑戰開發創新療法。公司專注于傳染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)以及重度抑郁癥(MDD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
前瞻性聲明
本新聞稿中傳達的信息包含某些具有或可能具有前瞻性的陳述。這些陳述通常包含諸如"將"、"期望"、"相信"、"計劃"和"預期"等詞語以及類似含義的詞語。就其性質而言,前瞻性陳述涉及風險和不確定性,因為它們與事件相關并取決于未來將發生的情況。可能存在目前被認為不重要或公司未意識到的其他重大風險。這些前瞻性陳述并非對未來業績的保證。在這些不確定性的背景下,讀者不應依賴這些前瞻性陳述。前瞻性陳述可能更新或根據未來的事件或發展進行相應修改,對此公司不承擔任何責任。

從VBI Vaccines擴展BRII-179許可至全球權益,助力公司實現在廣泛患者群體中同類最佳乙肝功能性治愈的領導地位
公司從VBI獲得具有臨床差異化的3抗原預防性疫苗PreHevbri®在大中華區及亞太市場的獨家權益
公司將于7月6日上午8:30(香港時間)/ 7月5日晚間8:30(美國東部時間)召開電話會議
中國北京和美國北卡羅來納州達勒姆2023年7月6日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今天宣布與VBI Vaccines, Inc.("VBI",NASDAQ:VBIV)簽訂許可協議,以拓展雙方在乙型肝炎(HBV)領域的戰略合作。
與VBI達成的新許可協議,標志著公司抗擊HBV感染的實質性擴展。在首個協議中,騰盛博藥的BRII-179(VBI-2601)獨家許可擴大至全球市場,進一步確立了其在追求HBV功能性治愈的領導地位。越來越多的證據支持,強效的HBV特異性免疫應答對實現持久的功能性治愈至關重要,這突顯了BRII-179作為聯合治療策略一部分的重要潛力。
此外,騰盛博藥還將獲得在大中華區及包括澳大利亞、印度尼西亞、馬來西亞、新西蘭、菲律賓、新加坡、韓國、泰國和越南等亞太國家的開發和商業化PreHevbri®的獨家權益。作為具有臨床差異化的3抗原成人HBV預防性疫苗,PreHevbri®近期在美國、歐盟/歐洲經濟區、英國、加拿大和以色列獲批上市。根據協議條款,VBI將獲得1500萬美元的首付款,其中包括用于制造和供應的500萬美元,以及騰盛博藥的300萬美元股權投資,具體取決于近期里程碑的實現情況。VBI還有資格獲得基于實現注冊和商業化里程碑的額外付款,以及特許權使用費。完成以上交易需滿足若干交割條件,包括VBI順利完成融資。
騰盛博藥董事長兼首席執行官洪志博士表示:"我們很高興能夠加強與VBI的合作,以擴大我們的HBV產品管線,并履行我們在抗擊乙型肝炎的公共衛生承諾。通過在我們的產品組合中探索聯合治療策略,我們致力于在最廣泛的HBV患者群體中提供最持久的治愈性方案。將VBI的預防性疫苗PreHevbri®納入騰盛博藥的HBV產品組合,使我們能通過從預防到治愈的不同手段,全面有效地應對HBV帶來的挑戰。同時,我們還將充分利用中國和亞太地區高HBV患病率和人口密度的巨大市場,來推進我們的商業化工作,并獲得巨大的收入潛力。"
目前,騰盛博藥正在中國開展BRII-179(VBI-2601)的2期研究,旨在評估其作為慢性HBV患者功能性治愈療法關鍵組成部分的潛力。多個研究的積極結果,包括Vir Biotechnology的MARCH研究,以及騰盛博藥正在進行的BRII-179(VBI-2601)與BRII-835(VIR-2218)聯合用藥的2期試驗,均表明持久的HBsAg血清清除率和抗體血清轉化之間存在強相關性,突顯了BRII-179(VBI-2601)作為功能性治愈方案中有價值潛力的免疫調節成分。騰盛博藥計劃在即將進行的研究中進一步評估將BRII-179作為聯合治療策略的一部分,以顯著提高PEG-IFN-α單藥治療的治愈率,并擴大潛在可被治愈的慢性乙型肝炎患者人群。
PreHevbri®,在美國和加拿大名為PreHevbrio®,在歐盟/歐洲經濟區和英國名為PreHevbri®,以色列名為Sci-B-Vac®,是唯一一款獲批的具有三種抗原的HBV疫苗。在關鍵性3期臨床研究PROTECT和CONSTANT中,與單抗原HBV疫苗Engerix-B相比,PreHevbri®在所有18歲以上的受試者中均顯示出較高且持久的血清保護率,且抗體滴度高達5至10倍。此外,兩項研究的綜合安全性分析均表明,PreHevbri®耐受性良好,未觀察到非預期的反應原性。
電話會議信息
直播電話會議將于7月6日星期四,香港時間上午8:30(美國東部時間7月5日星期三,晚間8:30)舉行。參會者須在電話會議開始前進行會議注冊。注冊鏈接請點擊這里。
關于BRII-179(VBI-2601)
BRII-179(VBI-2601)是一種新型重組蛋白HBV免疫治療候選藥物,可表達Pre-S1、Pre-S2和S HBV表面抗原,以誘導增強B細胞和T細胞免疫。作為治療慢性HBV感染的潛在功能性治愈方案的一部分,騰盛博藥正在開展BRII-179(VBI-2601)與BRII-835(VIR-2218)聯合用藥,及BRII-179(VBI-2601)與PEG-IFN-α聯合用藥的兩項2期研究。
關于PreHevbri®
PreHevbri®是唯一一款具有三種抗原的乙型肝炎疫苗,由乙型肝炎病毒的三種乙型肝炎表面抗原S、pre-S1和pre-S2組成。該疫苗已在美國、歐盟/歐洲經濟區、英國、加拿大和以色列獲批上市。疫苗的商品名為:PreHevbrio® (美國/加拿大)、PreHevbri®(歐盟/歐洲經濟區/英國)和Sci-B-Vac®(以色列)。
關于乙型肝炎
乙型肝炎病毒(HBV)感染是世界上最重大的傳染病威脅之一,全球感染人數超過2.9億。[1]慢性HBV感染是肝臟疾病的主要原因,每年約有82萬人死于慢性HBV感染的并發癥。[1]我國HBV感染人數達8,700萬,非常值得關注。[2]
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會病恥感的世界最常見的疾病開發創新療法。公司專注于傳染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)以及重度抑郁癥(MDD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
----------------------------
[1] World Health Organization. (June 2022). Hepatitis B. World Health Organization. Retrieved from https://www.who.int/news-room/fact-sheets/detail/hepatitis-b
[2] World Health Organization. Hepatitis. World Health Organization. Retrieved from https://www.who.int/china/health-topics/hepatitis#:~:text=There%20are%2087%20million%20people,living%20with%20chronic%20hepatitis%20C.

公司擴大BRII-179許可至全球權益,并在大中華區及亞太市場引進預防性疫苗PreHevbri®
BRII-835+PEG-IFN-α研究的最新數據表明,治療結束時的抗乙肝表面抗體(HBs)應答與乙肝表面抗原(HBsAg)持續下降相關
公司擁有BRII-693的全球獨家權益,正在開發用于治療難治性耐碳青霉烯類革蘭氏陰性菌感染
David Margolis博士被任命為首席醫學官,負責領導公司推進商業化的后期臨床開發工作
北京和北卡羅來納州達勒姆2023年7月6日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今日公布了其包括傳染性疾病(ID)和中樞神經系統疾病(CNS)候選藥物多元化產品管線的最新進展,并宣布了一項領導層變化,以進一步推進公司的戰略工作重點。
騰盛博藥董事長兼首席執行官洪志博士表示,"我們非常自豪地宣布我們在推進改善患者健康,和解決關鍵公共衛生問題方面所取得的最新成就。隨著我們擴大與合作伙伴的合作和收購,包括將BRII-179的許可擴大至全球市場,在大中華區和亞太市場引進 PreHevbri®疫苗,以及獲得BRII-693的全球權益,我們在傳染性疾病產品組合方面取得了顯著的進展。除此之外,我非常高興地宣布,David Margolis博士將擔任騰盛博藥新一任的首席醫學官。憑借其在傳染性疾病領域的專業知識和藥物開發方面的豐富經驗,Margolis博士將在領導我們后期臨床項目的成功實施,以及推進商業化等方面發揮關鍵作用。這些戰略舉措將與我們的增長計劃無縫銜接,展示了我們在更廣泛的全球戰略層面取得的重要進展。"
核心臨床開發進展
乙型肝炎病毒(HBV)
在騰盛博藥中國團隊及其合作伙伴Vir Biotechnology, Inc.("Vir",納斯達克股票代碼:VIR),和VBI Vaccines, Inc.("VBI",納斯達克股票代碼:VBIV)的領導下,公司正在通過開展多項聯合用藥研究來解決HBV的各種疾病影響,以實現同類最佳的功能性治愈,并在大中華區和亞太地區推進預防性疫苗的商業化。中國和許多亞太國家有著全球最高的HBV感染率,約有超過1.5億人受此疾病影響(中國約8600萬,東南亞約6900萬1),但目前尚無有效的功能性治愈方案,并且迫切需要一款更優的預防性疫苗。
- 2023年7月,騰盛博藥宣布與VBI合作,擴展其HBV產品組合。根據協議條款,騰盛博藥將持有的BRII-179(VBI-2601)獨家許可擴大至全球市場。此外,騰盛博藥還獲得在大中華區及包括澳大利亞、印度尼西亞、馬來西亞、新西蘭、菲律賓、新加坡、韓國、泰國和越南等亞太國家開發和商業化PreHevbri®的獨家權益。作為具有臨床差異化的三抗原成人HBV預防性疫苗,PreHevbri®近期在美國、歐盟/歐洲經濟區、英國、加拿大和以色列獲批上市。
- 2023年6月,Vir和VBI在2023年歐洲肝臟研究協會(EASL)大會上公布了多項臨床研究結果:
- Vir公布了一項2期研究的隨訪數據。數據表明,在最長48周的聚乙二醇干擾素?(PEG-IFN-?)療程基礎上,給藥VIR-2218(BRII-835)24或48周時, 16%(5/31)的受試者在治療結束后24周乙肝表面抗原(HBsAg)持續清除。治療結束時乙肝表面抗體(anti-HBs)滴度大于500 mIU/mL與治療結束后24周HBsAg的持續清除相關。
- 來自Vir的2期MARCH試驗A部分數據,評估了VIR-2218(BRII-835)和VIR-3434(BRII-877)在慢乙肝受試者中聯合用藥的短期療程。數據表明,HBsAg水平下降了2.7-3.1 log10 IU/mL,90%的受試者在治療結束時HBsAg水平小于10 IU/mL。
- VBI公布了關鍵性3期PROTECT研究受試者亞組,在免疫接種預防性三抗原HBV疫苗PreHevbrio® (在歐盟/歐洲經濟區和英國名為PreHevbri®,以色列名為Sci-B-Vac®)后長達3.5年的隨訪數據。數據顯示,接種PreHevbrio®疫苗的受試者平均抗HBs滴度比接種Engerix-B疫苗的受試者高5.1倍(1287 vs. 254 mIU/mL),表明接種PreHevbrio®疫苗后誘導的T細胞應答,可維持持久和更強的體液免疫應答,并且有比Engerix-B疫苗更強的持久性。
- 2023年5月,騰盛博藥向國家藥品監督管理局(NMPA)提交了關于開發BRII-877(VIR-3434)的新藥臨床試驗(IND)申請,預計將于2023年底啟動1期臨床研究。
- 在2023年下半年,公司預計公布兩項關鍵2期試驗的數據:
- 評估BRII-835(VIR-2218)和BRII-179(VBI-2601)聯合用藥2期研究的進一步數據。
- 評估BRII-179(VBI-2601)和PEG-IFN-α聯合用藥2期研究的頂線結果。
- 騰盛博藥計劃最早于2023年下半年開展其他聯合療法的研究。
產后抑郁癥(PPD)和重度抑郁癥(MDD)/其他中樞神經系統(CNS)疾病
騰盛博藥正在自主研發BRII-296。作為首創的一次性注射治療候選藥物,該療法有可能改善美國患者的PPD及MDD治療前景。
- 2023年6月,騰盛博藥宣布在BRII-297的1期臨床試驗中完成首例受試者給藥。BRII-297是一款正在開發用于治療各種焦慮和抑郁的長效注射劑(LAI)。目前正在進行的研究旨在評估BRII-297在健康志愿者中的安全性、耐受性和藥代動力學。
- 騰盛博藥正與美國FDA密切討論,就PPD治療方案達成一致,從而為預計于2023年下半年啟動的2期驗證性(POC)研究做準備。
- 騰盛博藥正在積極擴大BRII-296的臨床適應癥,并計劃于2024年在美國啟動其他研究。
其他臨床前和臨床開發進展
人類免疫缺陷病毒(HIV)感染
- 2022年12月,騰盛博藥成功解除了美國FDA的臨床試驗暫停令,使公司能夠開展計劃的1期研究,以開展較低口服劑量每周一次給藥BRII-732的研究,該給藥方案計劃于2023年第二季度啟動。
- 公司正在探索合作機會,以繼續開發BRII-732,作為潛在每周一次口服長效聯合療法的一部分,用于HIV患者的治療。
- 公司正在尋求BRII-753的合作機會,作為潛在每月一次給藥、每季度給藥一次給藥,或每年兩次給藥長效皮下注射聯合療法的一部分,用于HIV患者的治療。
多重耐藥(MDR)/廣泛耐藥(XDR)革蘭氏陰性菌感染
- 2023年6月,騰盛博藥宣布與Qpex Biopharma ("Qpex")達成最終協議,獲得BRII-693(QPX-9003)的全球獨家權益,從而擴大了其在大中華區的現有權益。公司就Shionogi收購Qpex事宜,將其在大中華區的BRII-636(QPX-7728或OMNIvance),和BRII-672(QPX-7831或ORAvance)的獨家權益返還給Qpex。
- 2023年4月,騰盛博藥向中國NMPA提交了關于在中國開發BRII-693的IND前(Pre-IND)申請。BRII-693具有高度差異化的安全性和有效性特征,可用于治療對碳青霉烯類耐藥的最難治療的鮑曼不動桿菌和銅綠假單胞菌感染。
非結核分枝桿菌(NTM)肺病
- 騰盛博藥的合作伙伴AN2 Therapeutics, Inc.("AN2",納斯達克股票代碼:ANTX)正在開展2/3期試驗,以評估每日一次口服epetraborole(BRII-658)治療難治性MAC肺病。AN2在5月的報告中表明,在epetraborole治療難治性MAC肺病的關鍵2/3期試驗中,已啟動近80個臨床研究中心。
企業信息更新
- David Margolis博士在擔任騰盛博藥傳染病治療領域負責人近3年后,被任命為首席醫學官(CMO)。作為CMO,Margolis博士將在公司整個產品管線推進至商業發展的后期臨床開發工作中發揮關鍵作用。另外,Margolis博士還將繼續履行其之前作為傳染病治療領域負責人的職責。與此同時,嚴立博士將離開公司尋求其他發展。騰盛博藥對嚴立博士在過去五年中為公司作出貢獻表示誠摯感謝。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會病恥感的世界最常見的疾病開發創新療法。公司專注于傳染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)以及重度抑郁癥(MDD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
1 Lancet Gastroenterol Hepatol. 2018; 3(6): 383-403

公司獲得新型脂肽BRII-693的全球獨家權益,用于治療難治性多重耐藥/廣泛耐藥革蘭氏陰性菌感染
公司將返還Qpex Biopharma在大中華區的基于β-內酰胺酶抑制劑QPX7728的產品權益
公司將收到約2,400萬美元的首付款
中國北京和美國北卡羅來納州達勒姆2023年6月26日 /美通社/ -- 騰盛博藥生物科技有限公司(以下簡稱"騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今天宣布與Qpex Biopharma("Qpex")以及與收購Qpex的第三方Shionogi達成最終協議。
根據協議條款,騰盛博藥將獲得BRII-693(也稱為QPX9003)的全球獨家開發和商業化權益,以擴大其現有的大中華區權益。未來騰盛博藥無需再向Qpex支付與BRII-693相關的成本分攤費用、里程碑費用和特許權使用費。公司將返還基于QPX7728的產品BRII-636和BRII-672在大中華區的獨家權益,并不再向Qpex支付與這些產品相關的成本分攤費用、里程碑費用和特許權使用費。
與此同時,Qpex將完成與Shionogi的合并。作為Qpex的股東以及QPX7728大中華區權益的轉讓方,騰盛博藥在收購完成后將獲得約2,400萬美元的收入,以及未來基于在美國的里程碑事件的潛在付款。
BRII-693是一種處于研發階段的新型合成脂肽,用于治療多重耐藥/廣泛耐藥(MDR/XDR)革蘭氏陰性菌感染的危重癥患者,特別是耐碳青霉烯類鮑曼不動桿菌和耐碳青霉烯類銅綠假單胞菌感染。2019年10月,騰盛博藥與Qpex簽訂了許可協議,獲得了BRII-693和基于QPX7728的產品在大中華區的開發和商業化權益。
騰盛博藥董事長兼首席執行官洪志博士表示:"BRII-693由于具有明確的抗菌機制和更優良的安全性,有望成為治療革蘭氏陰性菌感染危重癥患者的最安全和最有效的多粘菌素。同時鑒于BRII-693的微生物學和臨床特征,我們非常高興有機會優先專注該藥物的全球開發。"
2023年4月,騰盛博藥向中國藥品監督管理局(NMPA)提交了在中國開發BRII-693(QPX9003)的新藥臨床試驗(IND)前申請。
關于BRII-693
BRII-693是在澳大利亞莫納什大學生物醫學發現研究所李健教授的指導下發現的一種新型抗菌脂肽。這一發現得到了美國國家過敏和傳染病研究所(NIAID;RO1 AI098771和AI132154)的部分資助。BRII-693的發現和臨床前研究于2022年發表于《Nature Communications》雜志。研究結果表明,與之前的多粘菌素抗菌劑相比,BRII-693的效果更好,且毒性較小。與目前可用的多粘菌素抗生素相比,BRII-693可改善腎臟安全性,對治療革蘭氏陰性菌感染,包括MDR/XDR菌株的治療取得了重大進展。
2021年,QPX9003(BRII-693)獲得美國藥品監督管理局(FDA)授予的"合格傳染病產品資格"(QIDP)認定。QIDP認定為BRII-693在美國的研發提供了政策激勵,包括獲得優先審評和FDA快速通道認定資格,同時也可能延長在美國的監管和市場排他期。
2022年10月,在華盛頓特區舉辦的美國感染性疾病周(IDWeek)上公布的在美國進行的首次人體臨床研究的1期中期結果表明,BRII-693在所有試驗劑量下均安全且耐受性良好。2022年12月,與美國FDA召開了1期結束會議,并與其討論了這些結果以及未來3期項目的方案。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會病恥感的世界最常見的疾病開發創新療法。公司專注于傳染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。

- BRII-835+PEG-IFN-?研究的最新突破(late-breaking)數據表明,治療結束時的抗乙肝表面抗體(HBs)滴度與治療結束后24周的乙肝表面抗原(HBsAg)持續下降相關
- 新數據顯示,接種VBI的三抗原預防性乙型肝炎疫苗PreHevbrio®后,抗HBs滴度表現出更佳的穩健性和持久性
- 數據支持繼續開發BRII-835、BRII-877和BRII-179,以實現在廣泛HBV患者人群中的最佳功能性治愈效果
中國北京和美國北卡羅來納州達勒姆2023年6月25日 /美通社/ -- 騰盛博藥生物科技有限公司("騰盛博藥","我們"或"公司",股票代碼:2137.HK),一家致力于針對患者需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今天宣布,其戰略合作伙伴Vir Biotechnology, Inc.("Vir",NASDAQ:VIR)和VBI Vaccines, Inc.("VBI",NASDAQ:VBIV)在2023年歐洲肝臟研究協會(EASL)大會上公布了多項治療和預防慢性乙型肝炎病毒(HBV)感染的臨床研究結果,進一步支持騰盛博藥的產品作為潛在同類最佳的慢乙肝功能性治愈療法的臨床評估。
騰盛博藥傳染病治療領域負責人David Margolis博士表示,"與我們的合作伙伴一起,我們期待借助這些從試驗中獲得的令人興奮的洞察來不斷完善我們的科學策略。我們精心設計和構建的這個HBV產品組合,使我們能夠探索多種新型聯合治療方案,以提高廣泛HBV患者人群實現高功能性治愈率的可能性。同時,我們將繼續致力于代表患者推動科學創新。"
在最新突破口頭報告(late-breaker oral presentation)中,Vir公布了一項2期試驗的24周隨訪數據。該數據表明,在最長48周的聚乙二醇干擾素?(PEG-IFN-?)療程基礎上,給藥VIR-2218(BRII-835)24或48周時,26%(8/31)的病毒學抑制的慢乙肝受試者在治療結束時實現了HBsAg清除。
- 16%(5/31)的受試者在治療結束后24周HBsAg持續清除;5例受試者中有2例基線HBsAg水平大于1000 IU/mL。隨訪期間未觀察到新的安全性問題。
- 在治療結束時抗HBs滴度大于500 mIU/mL的4例受試者,在治療結束后24周均實現了持續的HBsAg清除,表明抗HBs滴度有可能作為治療期間持續應答的預測指標。
在另一份口頭報告中,Vir宣布了2期MARCH試驗A部分治療后48周的數據。VIR-2218(BRII-835)和VIR-3434(BRII-877)作為慢性HBV感染的聯合治療,在聯合給藥5周或12周后,受試者的HBsAg水平降低2.7-3.1 log10 IU/mL,90%的受試者在該短期治療結束時HBsAg水平小于10 IU/mL。
- 大多數受試者達到以下所有指標要求,符合停止核苷酸逆轉錄酶抑制劑(NRTI)治療的標準:HBsAg水平小于100 IU/mL,且較基線HBsAg水平下降大于或等于1 log10 IU/mL,HBV DNA低于定量下限(LLOQ),HBeAg陰性且ALT水平小于或等于2倍正常值上限。67%(4/6)的受試者在最后一次已完成的隨訪中仍無需接受NRTI治療。
- VIR-2218(BRII-835)和VIR-3434(BRII-877)聯合治療總體耐受性良好,主要與輕度不良事件相關。所有治療相關的不良事件均為1級,沒有終止研究的情況發生。
另外,在一份海報展示中,Vir強調了一項在慢性HBV感染患者中進行的VIR-3434(BRII-877)1期臨床試驗單次給藥的藥代動力學特征,該數據支持繼續對VIR-3434(BRII-877)進行評估。
- 無論基線HBsAg水平如何,在300 mg劑量下均觀察到最高和最持久的游離VIR-3434(BRII-877)暴露量。評估的其他劑量包括6 mg、18 mg和75 mg。
- VIR-3434(BRII-877)在基線HBsAg較高的受試者中的終末半衰期較短,清除速度更快。
此外,VBI還公布了關鍵性3期研究PROTECT受試者亞組,在免疫接種預防性三抗原疫苗PreHevbrio®后長達3.5年內的隨訪數據,以確定免疫應答的程度和持續時間。PreHevbrio是由與BRII-179(VBI-2601)病毒樣顆粒中重組HBV表面抗原PreS1、PreS2和S相同的抗原組成。
- 在所有測量時間點,與接種Engerix-B®的受試者相比,接種PreHevbrio的受試者的平均HBsAg抗體滴度顯著提高(P<0.0001)。
- 數據表明PreHevbrio誘導了針對Pre-S1和Pre-S2蛋白的T細胞應答,并與較高的抗HBs滴度相關。
- 在3.5年的隨訪期間,接種PreHevbrio的受試者的平均抗HBs滴度是接種Engerix-B的受試者的5.1倍(1287.2 vs. 253.7 mIU/mL),這表明與Engerix-B相比,PreHevbrio的T細胞應答可能有助于實現更加持久和強烈的體液免疫應答。
作為騰盛博藥開發HBV功能性治愈獨特方法的一部分,騰盛博藥與其合作伙伴正在進行多項研究,包括BRII-835(VIR-2218)和BRII-179(VBI-2601)聯合用藥、BRII-179和PEG-IFN-?聯合用藥、BRII-835(VIR-2218)、BRII-877(VIR-3434)聯合或不聯合PEG-IFN-?,以及BRII-835(VIR-2218)和/或BRII-877(VIR-3434)與其他藥物的聯合用藥。迄今為止,分別有約390、240和180例受試者接受了BRII-835(VIR-2218)、BRII-877(VIR-3434)和BRII-179(VBI-2601)的治療。
關于BRII-835(VIR-2218)
BRII-835(VIR-2218)是一種靶向所有HBV病毒RNA的 GalNAc偶聯的小干擾核糖核酸(siRNA),其可阻斷HBV的病毒轉錄、減少病毒蛋白并緩解免疫抑制。
關于BRII-877(VIR-3434)
BRII-877(VIR-3434)是一種皮下注射的研究性HBV單克隆中和抗體,旨在阻斷所有10種基因型的HBV進入肝細胞,并降低血液中病毒顆粒和亞病毒顆粒的水平。BRII-877(VIR-3434)結合了Xencor的Xtend?和其他Fc技術,通過這些改造有希望在感染患者中作為針對HBV的T細胞疫苗,并具有延長的半衰期。
關于BRII-179(VBI-2601)
BRII-179(VBI-2601)是一種基于重組蛋白質的新型HBV 免疫治療候選藥物,可表達Pre-S1 、 Pre-S2 和 S HBV 表面抗原,旨在誘導增強B 細胞和 T 細胞的免疫應答。
關于乙型肝炎
乙型肝炎病毒(HBV)感染是世界上最重大的傳染病威脅之一,全球感染人數超過2.9億。1慢性HBV感染是肝臟疾病的主要原因,每年約有82萬人死于慢性HBV感染的并發癥。1中國HBV感染人數達8,700萬,非常值得關注。2
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會病恥感的世界最常見的疾病開發創新療法。公司專注于傳染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。
1 World Health Organization. (June 2022). Hepatitis B. World Health Organization. Retrieved from https://www.who.int/news-room/fact-sheets/detail/hepatitis-b、
2 World Health Organization. Hepatitis. World Health Organization. Retrieved from https://www.who.int/china/health-topics/hepatitis#:~:text=There%20are%2087%20million%20people,living%20with%20chronic%20hepatitis%20C.

BRII-297是一款焦慮和抑郁類疾病的首創治療選擇,有可能使患者達到更優的治療依從性和便利性
中國北京和美國北卡羅萊納州達勒姆市2023年6月1日 /美通社/ -- 騰盛博藥生物科技有限公司Brii Biosciences Limited(以下簡稱"騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今日宣布評估BRII-297的1期臨床試驗完成首例受試者接受給藥,BRII-297是一款正在開發用于治療各種焦慮和抑郁類疾病的首創長效注射劑(LAI)。此項1期研究正在評估BRII-297在澳大利亞健康志愿者中的安全性、耐受性和藥代動力學。
"我們期望通過1期臨床試驗數據繼續推進BRII-297的開發,進一步評估我們的長效技術是否能夠為患者在精神健康旅程中提供差異化的治療選擇,"騰盛博藥新藥研究負責人徐連紅博士說,"我們認為,焦慮和抑郁等精神疾病的治療需要順從患者意見和偏好,以便患者能夠及時、方便地獲得所需的護理。通過我們的內部發現機制,我們嚴謹設計BRII-297以及管線中的其他長效治療藥物,旨在改善結果并消除社會歧視。"
BRII-297是一款內部發現的新化學實體(NCE)。它是一種新型γ-氨基丁酸A(GABAA)受體陽性變構調節劑(PAM),具有LAI劑型,旨在快速、深度且持續地減輕癥狀,有可能為焦慮和抑郁類疾病患者提供治療依從性和便利性。
關于焦慮和抑郁類疾病
2019年,近10億人患有精神健康障礙。自COVID-19大流行出現以來,焦慮和抑郁類疾病驚人地增加了25%。盡管精神健康問題普遍存在,且科學創新為開發更有效的治療藥物敞開了大門,但社會恥辱和歧視仍然是獲得和接受精神疾病護理的重大障礙。
關于BRII-297
BRII-297是一款正在開發用于治療各種焦慮和抑郁的首創長效注射劑(LAI)治療候選藥物。通過內部發現,BRII-297作為γ-氨基丁酸A(GABAA)受體陽性變構調節劑(PAM)發揮作用,是一種已經被證實的作用機制,已知其有可能恢復各種抑郁和焦慮類中樞神經系統疾病的GABAA受體功能的"正常"水平。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會病恥感的世界最常見的疾病開發創新療法。公司專注于傳染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。

騰盛博藥在最近的MSCI ESG評級中獲得"A"評級
中國北京和北卡羅萊納州達勒姆市2023年4月28日 /美通社/ -- 騰盛博藥生物科技有限公司 Brii Biosciences("騰盛博藥"或"公司",股票代碼:2137.HK),一家致力于針對患者需求未被滿足的疾病開發治療方案,以改善患者健康狀況和治療選擇的生物技術公司,今日發布了2022年環境、社會及管治("ESG")報告,概述了公司在關鍵ESG領域為實現長期增長和成功所取得的長足進展和表現。該報告可在公司網站的 "公司介紹" 欄目下查閱。
"2022年,在我們員工、股東以及一流合作伙伴的不懈努力下,我們秉承著對患者的承諾,實現了多個關鍵臨床和企業里程碑。" 騰盛博藥董事長兼首席執行官洪志博士表示:"與此同時,我們繼續在騰盛博藥內部營造一個多元、公平和包容(DEI)的工作環境,這一點在2022年公司進行的第三方獨立調研中獲得的較高員工滿意度得到了很好的印證。現在,我們意識到世界正面臨著前所未有的課題,比如針對疫情大流行、氣候變化、社會公平等諸多挑戰。為此,我們的管理層在董事會的指導下將持續管理和關注騰盛博藥的ESG實踐和目標。隨著我們進一步擴大在全球的影響力和投入創新,我們將時刻謹記作為企業的責任,并致力為所有利益相關方創造可持續價值。"
騰盛博藥的ESG報告遵守了國際可持續發展框架和最佳實踐。公司2022年ESG報告的主要亮點包括:
- 提高人類健康水平:在2022年,騰盛博藥專注于其在中國的核心開發項目,旨在開發乙型肝炎病毒(HBV)的功能性治愈藥物。公司通過內部研發和戰略合作,建立了強大的候選藥物管線,并開展了多種新型組合療法的臨床試驗,以提高所有HBV患者群體高功能治愈率的可能性。此外,在美國,騰盛博藥專注于中樞神經系統(CNS)項目,特別是產后抑郁癥(PPD)和重度抑郁癥(MDD)。公司不遺余力地促進ESG實踐,并在開展針對嚴重未滿足醫療需求和巨大公共衛生負擔疾病創新療法的同時,亦強調公司在擴大患者偏好選擇和藥物可及性方面的承諾。
- 患者權益倡導舉措:在2022年,騰盛博藥成立了以患者為中心的委員會,以指導公司在相關疾病社區中贊助和支持患者倡導組織的工作策略,以及提供患者教育和提高對PDD和MDD等疾病的認知。此外,騰盛博藥贊助了一系列以患者為中心的活動,這對于促進與患者以及特定疾病的非盈利組織建立良好關系,以了解患者的需求和偏好非常有益。這也進一步履行了公司對患者權益倡導的承諾。
- 為我們的員工賦能:騰盛博藥非常重視員工的成長和發展。公司努力營造遵循DEI原則的積極工作環境,為員工提供充分的個人發展和自我實現的機會。公司高度重視員工的反饋和建議,通過開放式溝通,更好地了解他們的訴求和關注點,從而為員工提供歸屬感、尊重感和認同感。騰盛博藥的2022年員工滿意度調查結果顯示,員工的滿意度達到79%,高于行業基準水平。騰盛博藥將持續營造一個充滿活力、有吸引力的公司文化。
- 秉持誠信和道德開展業務:騰盛博藥致力于以高度的誠信和道德標準開展其業務。公司堅持以該核心價值觀為指導,促使其以誠實、開放的方式經營,成為一家具有社會責任感的全球企業。
- 促進環境可持續性:作為一家致力于踐行長期責任感愿景的企業,騰盛博藥努力定期改善其資源管理和氣候相關舉措。我們密切關注各種排放物的回收管理,并制定了多項環境保護目標,作為持續改善我們綠色辦公的重要驅動力。
關于騰盛博藥
騰盛博藥(股票代碼:2137.HK)是一家生物技術公司,致力于針對存在巨大未被滿足的患者需求、治療手段有限,以及給患者帶來嚴重社會病恥感的世界最常見的疾病開發創新療法。公司專注于傳染性疾病和中樞神經系統疾病,正在推進一條涵蓋多種獨特候選藥物的產品管線,并通過領先的項目開發針對乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和針對產后抑郁癥(PPD)的首創治療方案。在富有遠見卓識和經驗豐富的領導團隊帶領下,公司在位于羅利-達勒姆、舊金山灣區、北京和上海的主要生物技術中心開展業務。欲了解更多信息,請訪問www.briibio.com。