上海2025年4月10日 /美通社/ -- 信念醫藥集團(以下簡稱信念醫藥)與武田中國今日共同宣布,信玖凝®(BBM-H901注射液, 通用名稱:波哌達可基注射液)已正式獲得國家藥品監督管理局(NMPA)批準,用于中重度血友病B(先天性凝血因子IX缺乏癥)成年患者的治療。作為中國首個獲批的血友病B基因治療藥物[1],信玖凝®由信念醫藥研發生產,武田中國負責該產品在中國內地、中國香港和中國澳門的商業化進程。雙方將整合各自資源優勢,加速為患者提供突破性的基因療法,共同開拓血友病B治療領域新格局。
信念醫藥聯合創始人、董事長兼首席科學家肖嘯博士表示:"信念醫藥始終致力于前沿基因治療領域的研發和創新,以患者需求為核心,突破技術壁壘,致力于填補未被滿足的臨床需求。此次獲批是信念醫藥發展歷程中的重要里程碑,作為中國自主研發的首款血友病B基因治療藥物[1],信玖凝®將為血友病B患者提供一種全新的治療方案,有望幫助患者擺脫需要終生頻繁靜脈注射用藥的困擾,回歸自由人生。通過與武田中國的商業化合作,雙方將共同加速推動這一創新療法快速落地,讓科研成果真正惠及患者。未來,信念醫藥將努力推進該項研究成果的海外商業化進程,期望能夠惠及更多血友病B患者。"
武田制藥全球高級副總裁、武田中國總裁單國洪表示:"武田很榮幸能夠與信念醫藥共同推動本土研發的首款血友病B基因治療藥物[1]實現高效商業轉化,讓患者切實受益于創新成果。信玖凝®的獲批,將進一步豐富武田中國在罕見病領域的戰略布局和產品矩陣。未來,我們將持續深化與本土創新企業的戰略合作,加速推動更多突破性療法的研發與商業化成果, 讓中國創新惠及更多患者,為提升中國罕見疾病事業高質量發展做出貢獻。"
血友病 B 是一種遺傳性出血性疾病,由凝血因子 Ⅸ(FⅨ)缺乏引起[2]。長期以來,患者主要依賴終生頻繁接受靜脈注射凝血酶原復合物(PCC)或凝血因子Ⅸ 進行替代治療[3],[4]。患者持續頻繁出血易導致關節結構和功能損傷嚴重,致殘率居高不下[5]。這不僅給患者帶來極大的身體痛苦和生活不便,也伴隨感染、血栓等風險[3],[4],高昂的治療費用也讓患者家庭長期背負沉重的經濟負擔。
信玖凝®采用工程化改造的嗜肝性重組腺相關病毒(rAAV)載體,可將含優化的人凝血因子Ⅸ基因遞送到患者肝臟細胞內,進而利用宿主細胞基因轉錄系統持續表達人凝血因子Ⅸ,并分泌到血液中,發揮FⅨ的促凝血活性。
信玖凝®注冊臨床研究的牽頭研究者,中國醫學科學院血液病醫院(中國醫學科學院血液學研究所)張磊教授表示:"血友病的傳統療法需要頻繁進行靜脈注射,且因子水平會隨著外源性凝血因子的半衰期而波動,部分患者還會面臨產生抑制物的風險,導致治療效果下降,這些痛點長期困擾著患者和臨床醫生。基因治療藥物的獲批為血友病患者帶來了革命性的希望。患者通過接受單次給藥,在降低出血風險和關節損傷風險的基礎上,有望告別終身頻繁靜脈注射的困境,使血友病的治療目標進一步提升。我們相信,隨著藥物研發的不斷突破和臨床經驗的積累,血友病的治療將邁向一個全新的時代,為患者帶來更高質量的生活。"
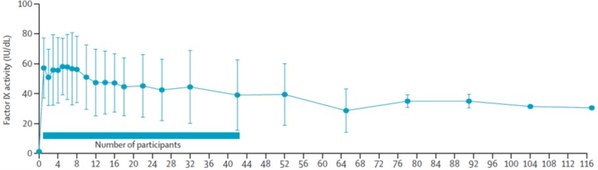
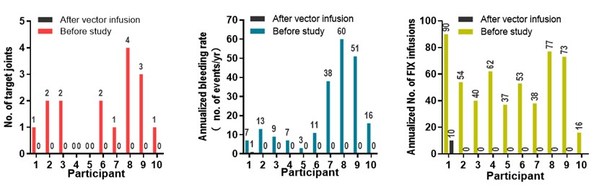
信玖凝®于2019年開始研究者發起的研究(IIT)。2022年,IIT研究成果先后發表于國際權威期刊《柳葉刀-血液病學》和《新英格蘭醫學雜志》[5],[6],研究納入的10例中重度血友病B成年患者,在接受基因治療后中位隨訪58周,FIX活性達到平均36.9 IU/dL(基于actin FSL aPTT試劑的一期法)。隨訪過程無嚴重不良事件(SAE),無3-4級不良事件 [5]。3年以上長期隨訪結果在2024國際血栓與止血學會(ISTH)大會上以口頭報告形式展示,與2022年文章發表時相比,患者FIX活性在各隨訪節點保持穩定,且未觀察到藥物相關嚴重不良事件、血栓事件及抑制物產生[8]。
2021年8月,信玖凝®獲批在國內開展注冊臨床研究,2022年8月被國家藥品監督管理局藥品審評中心納入"突破性治療品種"名單[7],同月獲得美國食品藥品監督管理局(FDA)的孤兒藥認定(ODD);2024年獲得FDA兒科罕見病資格認定(RPDD)以及歐洲藥品管理局(EMA)先進治療藥物分類認證(ATMP)。
2024年12月,信念醫藥在第66屆美國血液學會(ASH)年會正式發布Ⅲ期臨床研究結果。結果顯示,接受基因治療后隨訪52周時,受試者年化出血率(ABR)均值為0.6,平均FⅨ活性達到55.08 IU/dL(基于SynthaSIL aPTT試劑的一期法),外源性FⅨ藥物的平均輸注次數從治療前的58.2次/年降至治療后的2.9次/年。26名受試者中的21位(80.8%)在治療后未出現出血事件,且所有受試者均無嚴重不良事件發生[8]。該研究中所有患者仍在持續隨訪過程中。
[1] 截止至2025年4月。https://www.nmpa.gov.cn/yaopin/index.html |
[2] 中華醫學會血液學分會血栓與止血學組,中國血友病協作組.血友病治療中國指南(2020年版).中華血液學雜志.2020;41(4):265-271 |
[3] Mortensen GL,et al. Haemophilia. 2018;862–872 |
[4] Srivastava A, et al. Haemophilia. 2020;001–158.P95 |
[5] Xue F, et al. Lancet Haematol. 2022 Jul;9(7):e504-e513 |
[6] Xue F, et al. N Engl J Med. 2022 Oct 27;387(17):1622-1624 |
[7] 國家藥品監督管理局藥品審評中心https://www.cde.org.cn/main/xxgk/listpage/da6efd086c099b7fc949121166f0130c |
[8] Feng X,et al. 2024 ASH. Poster 3582 |
關于信念醫藥
信念醫藥集團(Belief BioMed Inc.),是一家集基因治療產品研發、生產和臨床應用為一體的高科技企業。公司致力于通過安全高效的病毒載體技術為嚴重遺傳疾病和慢性疾病提供更加有效的創新性基因療法。公司研發了數百種載體關鍵技術,包括HEK293細胞懸浮無血清培養工藝和全層析規模化純化工藝,并建立了基因治療藥物商業化生產平臺。公司在靶向不同組織的AAV新型衣殼、高效的轉基因表達盒設計、先進的臨床級載體制造工藝等領域進行了全面布局。同時還建立了豐富的研發管線,治療領域覆蓋血友病、杜氏肌營養不良癥、帕金森病、骨關節炎等未被滿足臨床需求的疾病,多個產品管線已經進入臨床研究階段或IND申報階段,其針對血友病B的基因療法的新藥已獲中國國家藥品監督管理局批準上市。
更多信息,敬請訪問:www.beliefbiomed.com。
關于武田
武田制藥以"為人類創造健康生活,為世界締造美好未來"為使命。我們專注于消化和炎癥性疾病、罕見病、血液制品、腫瘤、神經科學及疫苗等關鍵治療領域,著力研發并為患者帶來突破性的創新療法。我們的目標是攜手合作伙伴,打造動態化和多樣化的產品管線,不斷改善患者體驗,并拓展對前沿性治療方案的探索。
武田制藥總部位于日本,作為一家以價值觀為基礎、以研發為驅動的全球化生物制藥公司,我們始終致力于兌現對患者、員工和地球的承諾。我們遍布全球80多個國家和地區的員工肩負著相同的使命,始終踐行兩個多世紀以來形成的價值觀。
更多信息,敬請訪問:https://www.takeda.com。
聲明
1.本資料僅為介紹企業業務及經營活動等情況,并不以宣傳任何公司產品和/或服務為目的,更不應被理解為就任何藥物、醫療器械及治療方案的選擇提供任何意見或建議。
2. 如欲了解任何公司產品、疾病和/或診療等相關信息,請務必咨詢醫療衛生專業人士。
]]>上海 2024年9月25日 /美通社/ -- 專注前沿基因治療領域的信念醫藥集團(Belief BioMed Inc.)(以下簡稱"信念醫藥")今日宣布:與拜耳集團的全資獨立運營的基因療法子公司Asklepios BioPharmaceutical, Inc.(以下簡稱"AskBio")達成戰略合作,共同探索創新基因療法潛力。
根據合同條款,雙方將結合各自在基因治療技術方面的專業積淀和優勢力量,深入研究和探索通過肝臟靶向治療途徑實現創新基因治療方案的疾病領域。
信念醫藥聯合創始人、董事長兼首席科學家肖嘯博士表示:"信念醫藥聚焦深耕基因治療領域,自成立以來在研發、臨床、生產等方面均取得矚目成果,公司自主研發的重組腺相關病毒(rAAV)載體遞送系統獲得行業廣泛認可。信念醫藥與AskBio達成此次戰略合作,主要基于真誠互信,志同道合,以及雙方的獨特優勢和互補資源,以此聚力將更多創新治療方案早日帶給全球患者。"
AskBio是一家全球總部位于美國北卡羅來納州的公司,專注開發護航生命健康、提升生活質量的基因治療藥物。其產品管線非常豐富,覆蓋神經肌肉、中樞神經系統、心血管和代謝等多個疾病領域。該公司已經自主研發數百種用于基因治療藥物的衣殼和啟動子,其中幾種已進入臨床前和臨床試驗階段。
AskBio首席執行官Gustavo Pesquin先生表示:"與信念醫藥的戰略合作是我們在AskBio如何工作的一個很好詮釋。肖嘯博士于信念醫藥以及此前擔任AskBio聯合創始人期間,在基因治療領域做出了卓越貢獻,亦使得此次合作尤為特別。信念醫藥是一家創新型企業,我們擁有共同的志向和目標,通過領域內資源整合和優勢互補,可以為我們的管線資產找到最佳的前行路徑, 更高效地開發出針對重大未被滿足需求的全新療法。"
信念醫藥聯合創始人兼首席執行官鄭靜博士表示:"信念醫藥近些年的高質量穩步發展,有賴于信念人的專業專注和不懈努力,更離不開行業各界的精誠合作和有力支持。公司始終積極構建開放、協作、共贏的伙伴關系,一如這次兩家企業的合作,便是一種創新且遞進的合作模式,期待合力之下填補更多未被滿足的臨床需求,同時,信念醫藥向'立足中國、服務全球'的目標,再次邁出堅實一步。"
信念醫藥是一家集基因治療產品研發、生產和臨床應用為一體的高科技企業,治療領域廣泛覆蓋血友病、杜氏肌營養不良癥、帕金森病、骨關節炎等多種疾病領域。本次合作將進一步強化公司在基因治療領域的核心競爭力,為中國乃至世界患者帶來更多創新性基因療法,打下更為牢固的基礎。
]]>BBM-H803注射液是信念醫藥首款適用于治療A型血友病的基因治療藥物,也是公司第二款獲得國家藥品監督管理局(NMPA)臨床試驗批準的藥物,該款產品于2022年12月獲得美國食品藥品監督管理局(FDA)的孤兒藥認定(ODD)。截至目前,國內尚無已上市的適用于治療A型血友病成年患者的腺相關病毒(AAV)基因治療藥物。
本研究是一項多中心、單臂、開放、單次給藥的注冊臨床研究,旨在評估單次靜脈輸注BBM-H803注射液在≥18歲的重度A型血友病患者中的安全性、耐受性和有效性。該款藥物使用了具備自主知識產權的工程化衣殼,相對而言,其免疫原性較低,肝臟遞送效率較高。臨床擬用劑量亦低于國外已上市同類AAV基因治療產品,預期安全性更佳。此前開展的探索性研究已于2023年8月完成所有患者入組,相關數據為后續注冊臨床研究提供了堅實的基礎支撐。
信念醫藥聯合創始人、董事長及首席科學家肖嘯博士表示:"歲序更迭、華章日新,對于信念醫藥以及A型血友病患者而言,今天定然是個令人欣喜的日子,BBM-H803 注射液的注冊臨床成功完成首例受試者給藥!此次里程碑的達成,意味著信念醫藥在基因治療血液疾病領域取得了又一項重大突破,亦再次印證了公司強大且穩健的研發實力。我們將繼續秉持初心,內外合力,全面有序推進臨床研究各項工作,致力將這款創新藥物盡早帶給廣大中國患者。"
]]>上海2023年10月17日 /美通社/ -- 信念醫藥集團(以下簡稱信念醫藥)與武田中國今日宣布達成獨家合作協議,信念醫藥授權武田中國在中國內地、中國香港和中國澳門負責其在研產品BBM-H901注射液的商業化經營。雙方將結合各自領域的優勢和資源,加速推動該產品的商業化進程,助力B型血友病患者獲得創新治療新選擇,共同促進基因療法的產業發展。
信念醫藥聯合創始人、董事長兼首席科學家肖嘯博士表示:"信念醫藥專注深耕前沿基因治療領域,產品管線廣泛涵蓋罕見病與常見病,致力填補大量未被滿足的臨床需求。BBM-H901注射液是信念醫藥自主研發和生產的重磅產品之一,亦是國內首個進入注冊臨床試驗的B型血友病的腺相關病毒(AAV)基因治療藥物。非常高興在2023上海國際生物醫藥產業周期間,信念醫藥與武田中國達成此次戰略合作,相信依托信念醫藥扎實的臨床開發實力以及武田中國強大的商業化能力,必將助力雙方進一步夯實管線策略及市場布局,強強聯手,互信合作,聚力將更多創新治療方案帶給廣大中國患者。"
B型血友病是一種遺傳性凝血功能障礙疾病,由于患者血液中缺乏凝血因子Ⅸ(FIX)所致,其特點為反復的、自發性的關節、肌肉和軟組織出血,如長時間反復出血,還可能導致患者關節畸形、肌肉萎縮甚至死亡。我國已注冊登記的B型血友病患者約3800人[1]。目前,中國B型血友病患者仍面臨著治療選擇有限、診療不規范等挑戰,患者多使用凝血酶原復合物(PCC)用于替代治療,存在感染風險和給藥不便等問題。同時,由于治療不充分或不規范,中重度患者常見關節出血和畸形,患者的醫療需求仍未得到滿足。
BBM-H901注射液由信念醫藥自主研發和生產,以靜脈給藥的方式將人凝血因子IX基因導入B型血友病患者體內持續表達,提高并長期維持患者的凝血因子水平,用于預防B型血友病成年患者出血。該產品是國內首個獲批進入注冊臨床試驗的B型血友病的AAV基因治療藥物,目前已經順利完成Ⅲ期注冊臨床試驗的受試者給藥[2]。2022年,BBM-H901注射液相關臨床研究結果先后發表于國際權威期刊《柳葉刀-血液病學》和《新英格蘭醫學雜志》,同年被國家藥監局藥品審評中心納入"突破性治療品種"名單。
《柳葉刀-血液病學》發表的臨床研究(NCT04135300)是一項研究者發起、單中心、單臂的臨床試驗,旨在評估單次靜脈輸注BBM-H901的安全性和有效性。根據其研究結果,18歲以上、FIX殘留水平≤2IU/ dl的B型血友病患者在接受BBM-H901注射液治療后,58周隨訪顯示:患者中位年化出血率從12次減少至0次(p=0.0092),中位靶關節數從1.5個減少至0個(p=0.0031),中位凝血因子IX藥物年輸注次數從53.5次減少至0次(p<0.0001)。隨訪過程無嚴重不良事件,無3-4級不良事件,與BBM-H901相關的1 - 2級不良事件包括發熱(1例[10%])和轉氨酶升高(1例[10%])[3]。
"與信念醫藥的合作是一個重要的里程碑,將進一步豐富我們現有的產品組合和療法。我們期待聯合信念醫藥的研發技術、以及武田中國在商業化領域豐富的經驗和專業知識,能加速讓更多患者從突破性的基因療法中獲益。"武田制藥全球高級副總裁、武田中國總裁單國洪表示,"以信念醫藥為代表的本土基因治療技術正在日益崛起,我們深信未來中國的醫藥創新也將加速融入全球,成為全球生物醫藥技術的創新策源地。"
信念醫藥是一家集基因治療產品研發、生產和臨床應用為一體的高科技企業,治療領域廣泛覆蓋血友病、帕金森病、關節炎、神經肌肉病等多種重大、未被滿足臨床需求的疾病。本次合作建立在雙方的互信與協作的基礎上,將大大加速信念醫藥在血友病治療領域基因療法在中國的商業化,為更多患者點亮生命之光,為中國基因治療行業的蓬勃發展增添力量。
注釋說明:
[1] Demographics, clinical profile and treatment landscape of patients with hemophilia B in China [J]. Haemophilia, 2022 Mar, 28(2): e56-e60
[2] https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[3] Safety and activity of an engineered, liver-tropic adeno-associated virus vector expressing a hyperactive Padua factor IX administered with prophylactic glucocorticoids in patients with haemophilia B: a single-centre, single-arm, phase 1, pilot trial [J]. The Lancet, 2022 May, 9(7): E504-E513
聲明:
1.本資料僅為介紹企業業務及經營活動等情況,并不以宣傳任何公司產品和/或服務為目的,更不應被理解為就任何藥物、醫療器械及治療方案的選擇提供任何意見或建議。
2. 如欲了解任何公司產品、疾病和/或診療等相關信息,請務必咨詢醫療衛生專業人士。
3. 本文所述BBM-H901注射液還未在中國獲批上市。
前瞻性聲明:
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內所有陳述乃本文章刊發日期作出,可能因未來發展而出現變動。
BBM-H901注射液適用于預防血友病B成年患者出血,是國內第一個獲批進入注冊臨床試驗的血友病B的腺相關病毒(AAV)基因治療藥物。
本次研究是一項多中心、單臂、開放、單次給藥注冊臨床研究,旨在評估單次靜脈輸注BBM-H901注射液在≥18歲且內源性凝血因子Ⅸ(FⅨ)活性≤2 IU/dL(即≤2%)的血友病B患者中的安全性和有效性。截至目前,其劑量探索和劑量遞增階段研究已在中國完成,并在有效性和安全性方面取得了令人鼓舞的數據:100%的受試者停用FⅨ 產品治療,年化出血率(ABR)顯示為0,體內凝血因子水平顯著提高并長期穩定表達;安全性良好,沒有報告任何嚴重不良事件。
信念醫藥聯合創始人、董事長及首席科學家肖嘯博士表示:"我們很高興看到作為信念醫藥自主研發且自主生產的首款重磅產品,BBM-H901注射液三期注冊性臨床試驗的受試者給藥順利完成,并有望成為國內首個獲批上市的預防血友病B成年患者出血的AAV基因治療藥物,其‘一次給藥、長期有效'的創新治療方案將為患者帶來更佳的生存獲益。在此,我誠摯感謝所有參與到研究中的研究者、受試者及其家屬,以及項目組所有成員。另外,這是公司在臨床研究方面取得的又一個具有里程碑意義的進展,為我們更多基因治療藥物的臨床應用奠定了堅實基礎,亦為整個基因治療行業的蓬勃發展增添了全新力量。信念醫藥一直致力于解決未被滿足的臨床需求,公司將繼續深耕基因治療領域,力爭將更多同類首創和同類最優的藥物帶給患者。"
前瞻性聲明
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,于作出前瞻性陳述當日之后,無論是否出現新資料、未來事件或其他情況,我們并無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,并理解我們的實際未來業績或表現可能與預期有重大差異。本文內所有陳述乃本文章刊發日期作出,可能因未來發展而出現變動。
]]>https://www.thelancet.com/journals/lanhae/article/PIIS2352-3026(22)00113-2/fulltext
該臨床研究由中國醫學科學院血液病醫院(中國醫學科學院血液學研究所)、創新制藥公司信念醫藥和華東理工大學合作。研究結果證實了BBM-H901治療策略的安全性、長期有效性,并且能夠顯著緩解相關并發癥。
BBM-H901由信念醫藥開發和生產,是一款用于血友病B的分子生物學工程改造的腺相關病毒(AAV)基因治療在研藥物。信念醫藥擁有AAV衣殼和表達盒的自主知識產權。創新性的人肝臟靶向AAV衣殼,能夠高效感染肝細胞,大大縮短藥物在血液中的駐留時間,降低衣殼產生的免疫反應。而創新性的表達盒,利用了迷你肝特異啟動子驅動FIX-padua的高效表達。此外,信念醫藥在工藝和質檢方面取得了多項自主開發和創新,形成了一套先進、可靠、高效的CMC工藝流程,單次生產體積可達500L。
“該研究是信念醫藥在中國進行的第一次臨床研究,我們非常感謝合作伙伴在整個過程中的大力支持。”信念醫藥首席執行官鄭靜博士表示,“我們也非常自豪能夠推出BBM-H901注射液,這是中國首個自主研發的靜脈注射的血友病B基因治療在研藥物和全身遞送的罕見病基因治療在研藥物。我們將繼續推進所有其他管線的發現和研究,并加快藥物的臨床試驗和商業化。我們希望罕見或常見病患者能盡快獲得基因治療。”
BBM-H901注射液的臨床研究共納入10例重型/中重型血友病B(FIX:C<2%)患者,靜脈輸注5×1012vg/kg BBM-H901注射液。完成中位58(IQR:51.5-99.5)周隨訪,FIX:C凝血因子達到平均36.9±20.5IU/dl。與國際同類研究相比,BBM-H901注射液起效迅速,載體衍生FIX: C在基因治療后24h內即可表達,1周時達到57.1±20.2 IU/dl(均值±SD),并在中位5(1,6)周時達到FIX:最高值64.1±22.5IU/dl(均值±SD)。
"BBM-H901研究是中國乃至亞洲首個利用肝靶向AAV載體治療血友病B的臨床研究,該治療策略的安全性、長期有效、以及顯著緩解相關并發癥都得到了證實,必將為今后系統給藥基因治療藥物臨床應用提供可靠的基礎和理論支持,對于推動我國基因治療藥物研發和臨床轉化具有重要的指導意義。"中國醫學科學院血液病醫院(中國醫學科學院血液學研究所)副所院長張磊教授表示。
經治療后,BBM-H901給患者帶來了顯著臨床獲益。患者中位年化出血率從12次減少至0次;中位靶關節數從1.5個減少至0個;中位FIX藥物輸注次數從53.5次減少至0次。此外,BBM-H901也展現出良好的安全性,整個隨訪過程中無3-4級不良事件(AE)發生。
綜上所述,BBM-H901注射液已經在中國人群中證實了其安全性和有效性,實現了血友病B的長期治療,緩解了相關并發癥的發生,顯著增加了患者獲益。BBM-H901的臨床研究成果,將為今后系統給藥基因治療藥物臨床應用提供可靠的基礎和理論支持,對于推動中國基因治療藥物研發和臨床轉化具有重要的指導意義。
關于血友病
血友病作為一種遺傳性出血疾病,主要由凝血因子VIII或IX基因突變引起。自發出血可能是由于患者凝血因子VIII活性顯著降低(FVIII:C,血友病A)或因子IX活性顯著降低(FIX:C,血友病B)導致,關節和肌肉反復出血可導致終身殘疾。如今,預防和按需使用凝血因子替代療法仍然是血友病的標準臨床治療。患者需要終生反復注射血漿源性或重組凝血因子以維持凝血功能。因此,開發能夠治愈血友病的藥物是世界科學家不懈追求的目標,其中基因治療成為治療血友病的尖端新技術。
關于信念醫藥
信念醫藥成立于2016年,是一家立足全球的創新生物醫藥公司,專注于開發以腺相關病毒(Adeno-associated virus, AAV)為載體的創新型基因療法,已成為全球領先的覆蓋早期研究到商業生產的基因治療一體化開發平臺。信念醫藥旨在為基因缺陷遺傳疾病、老年退行性疾病以及其它重大惡性疾病提供更加有效、安全的療法。信念醫藥的研發和生產實力獲得頂尖投資機構及企業的認可,公司已在中國上海、香港、北京和蘇州以及美國北卡羅納州設立了辦公室或研發、生產中心。
此次注冊臨床研究(CTR20212816)是一項多中心、單臂、開放、單次給藥臨床研究,研究目的為評價單次靜脈輸注BBM-H901注射液在≥18歲,且內源性凝血因子IX(FIX)活性≤2 IU/dL(即≤2%)的血友病B患者中的安全性、耐受性、藥代動力學特征、有效性及長期有效性和安全性。
信念醫藥聯合創始人、董事長兼首席科學家肖嘯博士表示:“作為公司自主研發且自主生產的首款重磅產品,很高興信念醫藥BBM-H901注射液在中國完成首例受試者給藥,在臨床研究上邁出了里程碑式的一步。BBM-H901注射液既往臨床研究數據顯示了良好的安全性和有效性,AAV基因治療藥物輸注后患者年化出血率(Annualized Bleeding Rate, ABR)顯著降低,體內凝血因子水平顯著提高并長期穩定表達,安全性良好,沒有報告任何嚴重不良事件。”
肖嘯博士進一步表示:“誠摯感謝我們的臨床合作者,我們的患者以及整個項目團隊,是他們讓這一切成為了現實。作為中國領先的基因治療公司,信念醫藥將繼續在臨床前研究和臨床研究中大步前進,為有需要的患者帶來更多的創新藥物。此外,此次臨床試驗的順利開展也為公司基因治療藥物的臨床應用奠定了夯實基礎,為信念醫藥未來多種重大、未被滿足臨床需求疾病的基因治療藥物臨床開發鋪平道路。我們的使命是讓創新的基因治療藥物早日造福廣大患者,推動基因治療行業蓬勃發展。”
關于血友病
血友病是一種會減慢血液凝固過程的出血疾病。患者在受傷、手術或拔牙后會經歷長時間的出血或滲出。在血友病的嚴重病例中發現,患者如有輕微創傷甚至沒有損傷(自發出血)后會發生持續性出血的情況。嚴重的并發癥可由關節、肌肉、大腦或其他內臟出血引起。這種疾病嚴重危害了患者的生活質量,給患者及其家庭和社會帶來了巨大的影響和沉重的負擔。
關于BBM-H901注射液
BBM-H901注射液是信念醫藥擁有自主知識產權的AAV基因治療藥物,通過靜脈給藥將人凝血因子IX(Factor IX,FIX)基因導入血友病B患者體內,從而提高并長期維持患者體內凝血因子水平,以期達到“一次給藥、長期有效”的治療及預防出血效果。BBM-H901注射液藥物的設計采用了擁有完全自主知識產權的肝靶向性血清型和高效基因表達盒,運用公司自主開發的無血清懸浮培養和層析工藝進行符合GMP要求的藥物生產。
BBM-H901注射液是國內最早開展臨床研究的AAV基因治療藥物之一,自2019年就開始了研究者發起的臨床研究(Investigator Initiated Trial, IIT, NCT04135300)。2021年4月,信念醫藥全資子公司上海信致醫藥科技有限公司正式向國家藥品監督管理局(NMPA)提交了BBM-H901注射液的臨床試驗申請(Investigational New Drug, IND)。2021年5月14日,藥品審評中心(Center for Drug Evaluation, CDE)正式受理,并于2021年8月6日正式批準BBM-H901注射液進入臨床試驗階段(CTR20212816)。
關于信念醫藥
信念醫藥集團公司于2016年9月成立,是業內領先的,將基因治療、生產平臺和臨床轉化全面整合的創新藥公司。公司聯合創始人為基因治療行業的領軍人物肖嘯博士。作為全球基因治療行業資深專家及領導者,肖嘯博士擁有超過35年的AAV基因治療行業研發轉化經驗和深遠的國際影響力。
信念醫藥致力于通過腺相關病毒(adeno-associated virus,AAV)載體技術為單基因遺傳病、神經退行性疾病以及一些惡性疾病提供更加有效的創新性解決方案。公司擁有自主專利的多種AAV載體,以及數十種組織嗜性極其特異的新型AAV衣殼,其所擁有的重組AAV包裝技術已被廣泛應用于AAV基因治療領域。公司具有極其豐富的研發管線,覆蓋血友病、神經退行性疾病、溶酶體貯積癥、遺傳性神經肌肉疾病、遺傳性肌肉疾病及眼科疾病等多種重大、未被滿足臨床需求的疾病。作為行業領先者,信念醫藥的研發實力獲得頂尖投資機構的認可,公司也擁有深耕于研究領域的科學家及商業化經驗豐富的管理者。此次血友病基因治療注冊臨床試驗順利完成首例受試者給藥,是公司的又一重大里程碑,公司將秉承“以科技為信,以患者為念”的初心,助力全民健康,惠及中國及全球患者。
更多信息請訪問:
前瞻性陳述
本文檔包含的某些信息包含前瞻性陳述。這些前瞻性陳述包括但不限于與收入和收益相關的陳述。您可通過“相信”、“打算”、“預期”、“預期”、“項目”、“估計”、“預測”、“有信心”、“有信心”等詞語和類似表達來識別前瞻性陳述。這些前瞻性陳述不是歷史事實,而是公司董事和管理層對我們經營所在的業務、行業和市場的當前信念、假設、預期、估計和預測。這些前瞻性陳述并非對未來業績的保證,并受風險、不確定性和其他因素的影響,其中一些因素超出我們的控制范圍且難以預測。因此,實際結果可能與這些前瞻性陳述中明示、暗示或預測的結果存在重大差異。所有材料,包括公開可用的網站信息、公司政策和其他文件,除非另有說明,均為公司的財產。這些材料受著作權法和其他知識產權法的保護。此類材料或公司網站提供的信息可在僅供個人和非商業用途的情況下展示、重新編輯和打印。未經公司事先書面同意,任何人不得以任何方式全部或部分復制或轉發材料。
]]>信念醫藥首席執行官鄭靜表示,“如果將小分子藥物、抗體藥物稱為生物醫藥的前兩次革命,基因治療被視為將引領生物醫藥的第三次產業革命。經過多年的技術積累,基因治療產業市場規模增長迅速,輝瑞、諾華、強生等大型制藥企業紛紛布局。”鄭靜進一步表示,“依托強大的研發團隊和生物技術領域核心關鍵技術,信念醫藥是全球基因治療新藥領域,少有的與歐美跨國公司技術比肩的新創企業。”
BBM-H901注射液是信念醫藥擁有自主知識產權的AAV基因治療藥物,通過靜脈給藥將人凝血因子IX(Factor IX,FIX)基因導入血友病B患者體內,從而提高并長期維持患者體內凝血因子水平,以期達到“一次給藥、長期有效”的治療及預防出血效果。BBM-H901注射液藥物的設計采用了擁有完全自主知識產權的肝靶向性血清型和高效基因表達盒,運用公司自主開發的無血清懸浮培養和層析工藝進行符合GMP要求的藥物生產。BBM-H901注射液具有表達效果好、產量高、安全性強的特點。
BBM-H901注射液的基因治療是國內最早開展臨床試驗的AAV基因療法之一,自2019年就開始了研究者發起的臨床研究(Investigator Initiated Trial, IIT, NCT04135300)。臨床研究數據顯示BBM-H901注射液具有良好的安全性和有效性,AAV基因治療藥物輸注后患者體內凝血因子水平提高顯著,并長期穩定,且在臨床期間未發現明顯的不良反應,患者的年化出血率(Annualized Bleeding Rate, ABR)顯著降低。2021年4月,信念醫藥正式向國家藥品監督管理局(NMPA)提交了BBM-H901注射液的臨床試驗申請(Investigational New Drug, IND)。2021年5月14日,藥品審評中心(Center for Drug Evaluation, CDE)正式受理,并于2021年8月6日正式批準BBM-H901注射液進入臨床試驗階段。
信念醫藥創辦于2016年9月,是一家集基因治療藥物研發、生產和臨床應用為一體的高科技企業,公司創始人為著名基因治療行業領軍人物肖嘯教授。作為全球基因治療行業資深專家,肖嘯教授擁有超過35年的AAV基因治療行業研發轉化經驗和深遠的國際影響力,主持了20余項目國內外基因治療研究項目,帶領團隊成功研發了數十種 AAV 基因治療藥物及相關的關鍵技術,其研究成果被美國《Discover》雜志評選為年度全球科學領域100項重大發現之一。肖嘯教授也是全球基因治療行業知名的連續創業者。2016年8月,其共同創辦的Bamboo Therapeutics公司被輝瑞以6.45億美元收購,藥物目前已進入臨床III期;2020年10月,其共同創辦的Asklepios BioPharmaceutical 公司被拜耳以40億美元收購,多個藥物已進入臨床階段。
信念醫藥擁有數項全球領先的專利與技術,在靶向不同組織的AAV新型capsid、高效的轉基因表達盒設計、先進的臨床級載體制造工藝、創新的臨床開發范式等領域進行了全面布局,已成功開發全球領先的HEK293 500L懸浮培養工藝和全層析的規模化下游純化工藝,已有多個項目進入IND申報和臨床驗證階段。公司研發管線包含血友病A、血友病B、帕金森癥、老年黃斑變性、粘多糖貯積癥、脊髓性肌萎縮癥等多種適應癥。
作為行業領先者,信念醫藥的研發實力獲得頂尖投資機構的認可。截至目前,信念醫藥已經獲得啟明創投、禮來亞洲基金、夏爾巴、經緯中國、北極光創投、雙湖資本、千驥資本、晨嶺資本(CDG)等知名基金超1.5億美元投資,公司已在美國北卡羅萊納州,中國香港、上海、北京和蘇州設立了辦公室或研發、生產中心。
信念醫藥血友病基因療法獲臨床試驗許可,既是公司的里程碑事件,也將開啟國內AAV基因療法新篇章。依托領先技術,信念醫藥將持續通過AAV(腺相關病毒)載體技術為單基因遺傳病、老年性疾病以及一些惡性疾病提供更加有效的創新性解決方案,以科技為信、以患者為念,助力全民健康。