口頭報告
研究背景:
尿路上皮癌(UC)是世界范圍內常見的惡性腫瘤。2024 年發布的全球癌癥統計報告中顯示,膀胱癌是全球第九大常見診斷的癌癥,每年有新發病例約 61.4 萬,死亡病例約 22.0 萬。男性疾病負擔和發病率顯著高于女性,膀胱癌是男性第六大常見癌癥,是男性癌癥死亡第九大原因[1]。
9MW2821 (Bulumtatug Fuvedotin, BFv) 是新一代靶向 Nectin-4 的抗體偶聯藥物,早期研究顯示 9MW2821 在既往接受過含鉑化療和免疫檢查點抑制劑的局部晚期或轉移性尿路上皮癌人群中展現了具有潛力的療效[2]。單藥末線的 III 期關鍵臨床正在進行中(NCT06196736,CTR20234024)。
特瑞普利單抗(Toripalimab)是一種新型人源化重組抗 PD-1 單抗,已先后在中美等多國獲批上市。
本次 ASCO 會議首次詳細匯報了 9MW2821 聯合特瑞普利單抗在局部晚期或轉移性尿路上皮癌患者中療效和安全性。
研究方法:
本研究是一項開放、多中心的 Ib/II 期臨床試驗,篩選合格的受試者將接受 9MW2821 聯合特瑞普利單抗治療。特瑞普利單抗采用固定給藥劑量 240mg,在劑量遞增階段 9MW2821 從 1.0mg/kg 遞增至1.25mg/kg,在隊列擴展階段將分別在 1.0mg/kg 和 1.25mg/kg 劑量組進行擴展。每 21 天 1 個周期,9MW2821 每周期 D1 和 D8 各給藥一次,特瑞普利單抗每周期 D1 給藥一次,直至發生疾病進展或不可耐受的毒性。
研究結果:
截至 2025 年 4 月 30 日,本研究共入組 52 例局部晚期或轉移性尿路上皮癌(la/mUC)受試者。40 例可腫評的晚期 UC 一線受試者中,中位年齡 67 歲,70% 為男性,72.5% ECOG 評分為 1 分,腫瘤原發部位為上尿路的占比 55%,肝轉移占比 15%。生物標志物表達方面,82.5% 為 Nectin-4 表達陽性,20% 為 PD-L1 表達陽性。
研究結果顯示,客觀緩解率( ORR)為 87.5%(95% CI: 73.2,95.8),經確認的 ORR 為 80%,CR 率為 12.5%。疾病控制率(DCR)為92.5%(95% CI: 79.6,98.4)。最佳靶病灶大小變化與基線相比,97.5% 的受試者腫瘤病灶縮小,57.5% 的受試者腫瘤縮小超過 50%。
ORR 亞組分析顯示,在選定的亞組中,ORR 獲益與總體人群保持一致。無論年齡、腫瘤原發部位、是否基線存在肝轉移、以及腫瘤生物標志物 Nectin-4 和 PD-L1 的表達狀態,所有亞組均可從 9MW2821 聯合特瑞普利單抗的治療中獲益。年齡超過 65 歲、腫瘤原發部位為下尿路、肝轉移、Nectin-4 表達陰性以及 PD-L1 表達陽性的受試者 ORR 分別為100%(24/24)、94.44%(17/18)、83.33%(5/6)、100%(7/7)、100%(8/8)。
截至 2025 年 4 月 30 日,45% (18/40) 受試者發生疾病進展或死亡,中位無進展生存期(mPFS)為 12.5 個月(95% CI:6.47-NA),中位緩解持續時間(mDoR)尚未達到。中位隨訪時間為 10.8 個月,mPFS 和 mDoR 尚未成熟。
安全性方面,治療相關不良事件(TRAE)發生率為 98.1%,絕大多數 TRAE 為 1-2 級;3級及以上TRAE 發生率為 42.3%,≥3 級的 TRAE 主要表現為中性粒細胞計數降低(11.5%)、ALT 升高(5.8%)、白細胞計數降低(5.8%)等;治療相關嚴重不良事件的發生率為 28.8%,未發生導致死亡的 TRAE。聯合治療過程中,受試者整體耐受性良好,未觀察到新的安全性信號。
結論:
9MW2821 聯合特瑞普利單抗治療局部晚期或轉移性尿路上皮癌展現出了令人鼓舞的療效及良好的安全性特征。值得注意的是,本研究中高齡、肝轉移以及生物標志物 Nectin-4 表達為陰性的受試者也均取得了相當可觀的療效緩解,預示著相較于傳統含鉑化療,9MW2821 聯合特瑞普利單抗將為那些不能耐受含鉑化療或潛在化療預后差的晚期尿路上皮癌患者提供新的治療選擇,有望成為真正意義上的、可覆蓋全部晚期尿路上皮癌人群的新療法。9MW2821 聯合特瑞普利單抗對比含鉑化療治療一線晚期尿路上皮癌的 III 期關鍵注冊臨床研究正在進行中(NCT06592326,CTR20242828)。
關于 9MW2821
9MW2821 是由邁威生物自主研發的靶向 Nectin-4 ADC 創新藥,通過具有自主知識產權的偶聯技術連接子及優化的 ADC 偶聯工藝,實現抗體的定點修飾。該品種是國內同靶點藥物中首個開展臨床試驗的品種,亦是全球同靶點藥物中首個在宮頸癌、食管癌以及乳腺癌適應癥披露臨床有效性數據的品種。目前已開展三項 III 期關鍵性注冊臨床。尿路上皮癌單藥、聯合特瑞普利單抗治療均被 CDE 納入突破性治療品種名單。并已被 FDA 授予 3 項快速通道認定(FTD)和 1 項孤兒藥資格認定(ODD)。
[1] Bray F, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024;
[2] Zhang et al. ASCO 2024.
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承"讓創新從夢想變成現實"的愿景,踐行"探索生命,惠及健康"的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及腫瘤、自身免疫、骨疾病、眼科、血液、感染等治療領域,憑借國際領先的特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 16 個品種處于不同階段,包括 12 個創新品種和 4 個生物類似藥,其中 4 個品種上市,1 個品種已提交上市許可申請前溝通(pre-NDA)會議申請,2 個品種處于 III 期關鍵注冊臨床階段。并獨立承擔 1 項國家"重大新藥創制"重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用"預期"、"相信"、"預測"、"期望"、"打算"及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
 ]]>
]]>壁報展示
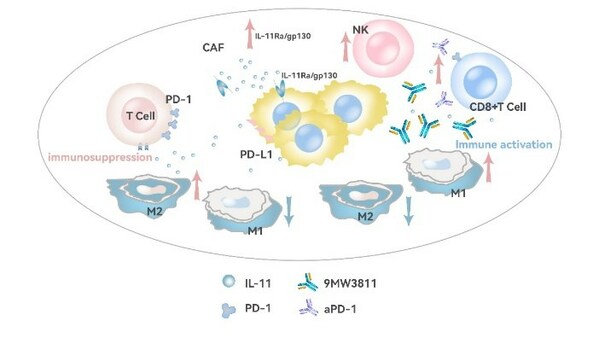
1. 9MW3811, 一種高親和力 IL-11 阻斷抗體,在臨床前研究中顯著增強 T 細胞的腫瘤浸潤,并與抗 PD-1 治療具有很強的協同作用
摘要編號:2365
此次報告的 9MW3811 是邁威生物自主研發的高親和力抗 IL-11 人源化中和抗體,已獲得中國、美國和澳大利亞臨床準入,目前正在澳大利亞和中國開展 I 期臨床。
IL-11 是重要的炎癥因子,在纖維化和腫瘤的發生和進展中均發揮重要作用。研究表明,IL-11 高表達與肺癌、肝癌和結直腸癌等多種腫瘤的預后相關。IL-11 不僅通過 STAT3 通路促進腫瘤細胞的生長,同時對腫瘤微環境中免疫細胞也具有重要影響。9MW3811 通過結合 IL-11,有效阻斷 IL-11/IL-11Ra/gp130 三體復合物形成,從而抑制下游信號通路的活化。9MW3811 在多個臨床前藥效模型中表現出良好的抗腫瘤治療效果,尤其是與抗 PD-1 抗體聯用時,明顯促進 CD8+T 淋巴細胞浸潤,改善抗 PD-1 抗體引起的 T 細胞耗竭狀態,上調殺傷性細胞因子的分泌,從而表現出更好的聯合抗腫瘤藥效。
2. 2MW4991,一種 ADCC 增強型的整合素 αvβ8 新型阻斷抗體,在臨床前研究中展示出強大的抗腫瘤活性和安全性
摘要編號:6349
此次報告的 2MW4991 是一種靶向整合素 αvβ8 的高特異性高親和力的 ADCC 增強型抗體。整合素 αvβ8 是 TGF-β 重要的激活蛋白,在免疫細胞中特異性地調控 TGF-β 的活性。研究發現整合素 αvβ8 在多種腫瘤中高表達,阻斷 αvβ8 能夠完全抑制 TGF-β 的釋放。2MW4991 可以完全阻斷 αvβ8 介導的 TGF-β 釋放,在 CT26、EMT6 等多種藥效模型中展現出強大的抗腫瘤活性,同時能夠顯著促進腫瘤的免疫細胞浸潤,大大增加免疫排斥型腫瘤對 PD1 抑制劑的敏感性。2MW4991 與 PD1 聯用具有顯著的協同作用。非靈長類模型研究表明 2MW4991 具有良好的安全性以及代謝曲線。
3. 2MW4691,一種新型的 CCR8/CTLA-4 雙特異抗體,通過特異性清除腫瘤浸潤 Treg 細胞和阻斷 CD8+ T 細胞表面的 CTLA-4 信號通路發揮強大的抗腫瘤活性
摘要編號:6350
此次報告的 2MW4691 是一款 ADCC 增強型的靶向 CCR8/CTLA-4 的雙特異抗體。靶向 CTLA-4 具有強大的抗腫瘤作用,但由于強烈的副作用限制了臨床應用。CCR8 是腫瘤浸潤的 Treg 特異性標志物,在其他免疫細胞以及外周 Treg 上幾乎不表達。對多種腫瘤浸潤的 Treg 進行單細胞測序分析,發現 CCR8 表達在腫瘤浸潤 Treg 的一小部分亞群上,CTLA-4 在 Treg 有廣泛表達,并且在 CD8+ T 也有廣泛表達。2MW4691 保留 CCR8 高親和力以及弱化的 CTLA-4 結合和阻斷活性,特異清除腫瘤浸潤的 Treg 細胞。在外周,由于 CTLA-4 的表達豐度較低,2MW4691 僅阻斷外周 CD8+ T 細胞上 CTLA-4 信號介導的免疫抑制作用。在臨床前 CCR8 單轉基因動物模型、CTLA-4 單轉基因動物模型以及雙轉基因動物模型上均展示出強大的抗腫瘤活性,并在靈長類動物中展示出較好的代謝活性和安全性。
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承"讓創新從夢想變成現實"的愿景,踐行"探索生命,惠及健康"的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及腫瘤、自身免疫、代謝、眼科、感染等治療領域,憑借國際領先的特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 14 個品種處于不同階段,包括 10 個創新品種和 4 個生物類似藥,其中 3 個品種上市,1 個品種藥品上市許可申請已獲受理,3 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家"重大新藥創制"重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用"預期"、"相信"、"預測"、"期望"、"打算"及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
壁報內容概述
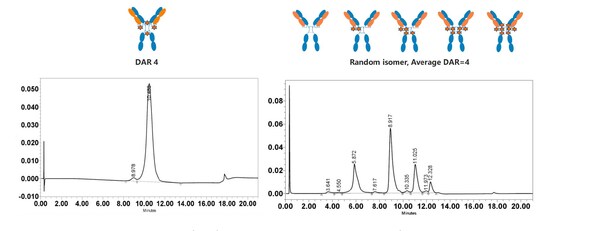
新型偶聯技術、釋放技術以及新型毒素的廣泛應用促使 ADC 領域蓬勃發展,然而進一步提升藥物傳遞效率以及克服腫瘤耐藥是下一代 ADC 藥物亟待解決的問題,邁威生物自主開發了 IDDC? 技術以及新型載荷 Mtoxin?。研究結果顯示:
- DARfinity?產生DAR 4為主成分的定點偶聯藥物(DAR 4≧95%)
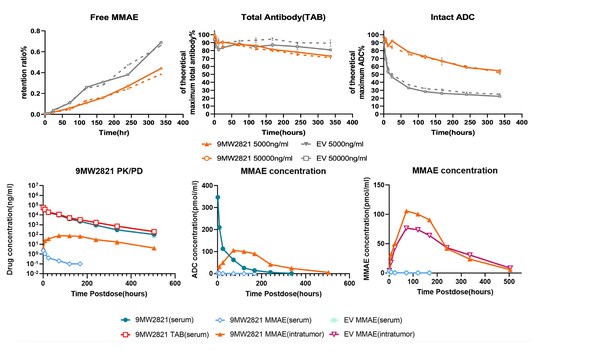
- IDconnect?提升ADC藥物血漿穩定性,提高載荷傳遞效率(相對對照組提升40%)
- LysOnly?技術提升ADC藥物的腫瘤特異性釋放能力,降低脫靶效應
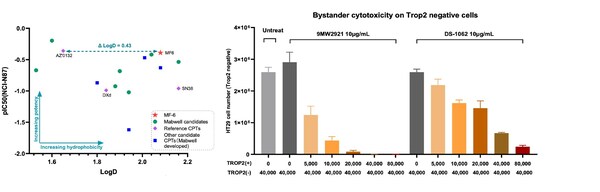
- Mtoxin?具有良好的腫瘤穿透性、旁觀者殺傷效果以及抗多藥耐藥特性
- IDDC?與Mtoxin?構建的ADC藥物具有良好的藥效及安全性特性,特別在DXd耐藥的多藥耐藥模型中,具有良好的藥效
總結
IDDC? 是一項經過臨床驗證的定點偶聯技術,構建的 ADC 具有良好的均一性、有效性以及安全性優勢。此外,新型載荷 Mtoxin? (MF6) 具有良好的藥效,旁觀者殺傷效果,以及抗多藥耐藥等優勢。
基于 IDDC? 平臺開發的 ADC 創新藥
目前 IDDC? 平臺已在多個在研品種中得到驗證。
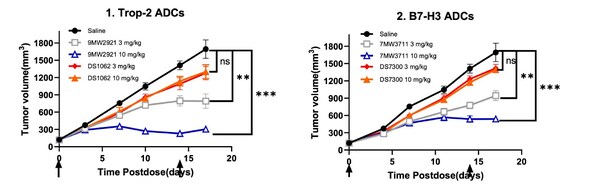
靶向 Nectin-4 ADC 創新藥 9MW2821
該品種針對尿路上皮癌適應癥是國內企業首家進入 III 期臨床研究且全球進度第二;亦是全球同靶點藥物中首款在宮頸癌和食管癌適應癥披露臨床有效性和安全性數據的治療藥物。已獲 FDA 快速通道認定用于治療晚期、復發或轉移性食管鱗癌。
靶向 B7-H3 ADC 創新藥 7MW3711
該品種已開展針對晚期實體瘤適應癥的臨床試驗,并獲 FDA 批準針對晚期惡性實體瘤患者開展臨床試驗。
靶向 Trop-2 ADC 創新藥 9MW2921
該品種已開展針對晚期實體瘤適應癥的臨床試驗。
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承“讓創新從夢想變成現實”的愿景,踐行“探索生命,惠及健康”的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及腫瘤、自身免疫、代謝、眼科、感染等治療領域,憑借國際領先的特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 14 個品種處于不同階段,包括 10 個創新品種和 4 個生物類似藥,其中 2 個品種上市,2 個品種藥品上市許可申請已獲受理,3 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家“重大新藥創制”重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用“預期”、“相信”、“預測”、“期望”、“打算”及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
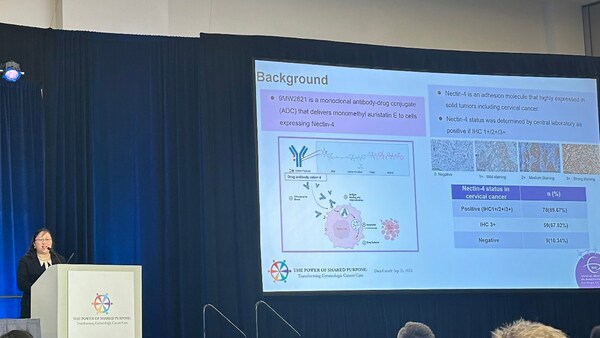
此次公布的數據展現了其在宮頸癌領域的有效性及良好安全性,有望為復發或轉移性宮頸癌的治療帶來新的突破,滿足大量未被滿足的臨床需求。
9MW2821 是全球同靶點藥物中首個在宮頸癌適應癥報道臨床數據的品種。
靶向 Nectin-4 ADC 治療復發或轉移性宮頸癌研究數據報告
該項多中心、開放、I/II 期臨床研究由復旦大學附屬腫瘤醫院張劍教授牽頭,本次由復旦大學附屬腫瘤醫院楊慧娟教授代表研究團隊在大會做深入報告。研究結果獲得現場專家高度認可。期待獲得更進一步的臨床研究數據,為復發或轉移性宮頸癌患者提供更多治療選擇。
臨床結果
針對復發或轉移性宮頸癌的系統性治療藥物選擇和治療效果較為有限。9MW2821 的 I/II 期宮頸癌隊列納入含鉑雙藥化療聯合或不聯合貝伐珠單抗失敗、系統性治療方案不超過 2 線的復發或轉移性 Nectin-4 陽性宮頸癌患者。受試者在每 28 天為 1 個周期的第 1 天、第 8 天和第 15 天接受靜脈輸注 1.25mg/kg 的 9MW2821,直到確認疾病進展、死亡、無法忍受的不良反應或退出研究。
截至 2023 年 9 月 25 日,該研究宮頸癌拓展隊列中,Nectin-4 表達的檢出率為 89.67%,Nectin-4 腫瘤細胞染色強度 3+(以下簡稱 "Nectin-4 3+")檢出率為 67.82%。該研究共入組 40 名患者,57.5% 受試者既往接受過含鉑雙藥化療聯合貝伐單抗治療, 60% 受試者既往接受過含鉑雙藥化療及免疫檢查點抑制劑治療。
有效性方面,37 例可評估療效的患者的 ORR 和 DCR 分別為 40.54% 和 89.19%,其中 1 例完全緩解 (2.70%),14 例部分緩解 (37.84%),中位無疾病進展生存期 (PFS)、總生存期 (OS) 和緩解持續時間 (DOR) 尚未達到。Nectin-4 3+ 的患者中,26 例可評估療效的患者 ORR 和 DCR 分別為 50.00% 和 92.31%。經過含鉑雙藥化療及免疫檢驗點抑制劑治療的患者中,21 例可評估療效的患者 ORR 和 DCR 為 38.10% 和 85.71%。
安全性方面,92.50% 的受試者發生了與治療相關的不良事件,3/4 級治療相關不良事件中最常見的是中性粒細胞減少癥 (40.00%)、皮疹 (17.50%) 和γ-谷氨酰轉移酶增加癥 (12.50%)。沒有與治療相關的死亡報告。
上述研究結果表明,9MW2821 在宮頸癌患者中具有可控的安全性和積極的治療效果。
關于 9MW2821
9MW2821 為邁威生物首款靶向 Nectin-4 的定點偶聯 ADC 新藥,為公司利用 ADC 藥物開發平臺聯合自動化高通量雜交瘤抗體分子發現平臺兩項平臺技術開發的創新品種,是國內企業同靶點藥物中首個開展臨床試驗的品種。9MW2821 已在國內開展多項臨床研究,評估其在多種晚期實體瘤患者中的安全性、耐受性、藥代動力學特征及治療效果。
9MW2821 單藥治療經鉑類化療和 PD-(L)1 抑制劑治療的局部晚期或轉移性尿路上皮癌的 III 期臨床研究已正式啟動,與 PD-1 抑制劑聯合用藥的 I/II 期臨床研究也在推進中,均已完成首例受試者入組。針對食管癌適應癥的 II 期臨床研究將繼續入組和評估,并盡快啟動 III 期臨床的溝通交流。9MW2821 于 2024 年 2 月獲美國食品藥品監督管理局授予"快速通道認定" (FTD) 用于治療晚期、復發或轉移性食管鱗癌。目前是全球首款針對食管癌和宮頸癌適應癥披露臨床有效性和安全性數據的靶向 Nectin-4 的治療藥物。
關于宮頸癌
宮頸癌是全球女性第四大常見腫瘤之一,也是全球女性癌癥死亡的第四大原因(摘自 Worldwide trends in cervical cancer incidence and mortality, with predictions for the next 15 years, Cancer 2021.)。據國際癌癥研究機構 (IARC) 發布《全球癌癥 2020 年報告》顯示,2020 年全球新發宮頸癌 60 萬例,因宮頸癌死亡人數高達 34 萬例。根據 2024 年 2 月份國家癌癥中心在 JNCC 上發表的 2022 年中國惡性腫瘤疾病負擔情況顯示,我國宮頸癌新發 15.07 萬例,死亡 5.57 萬例,新發病例數和死亡人數分別排名第 8 和第 9;相比同口徑 2022 年 2 月發布的 2016 年的 11.9 萬新發病例數和 3.7 萬死亡病例數,均有明顯增長。
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承"讓創新從夢想變成現實"的愿景,踐行"探索生命,惠及健康"的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及腫瘤、自身免疫、代謝、眼科、感染等治療領域,憑借國際領先的特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 14 個品種處于不同階段,包括 10 個創新品種和 4 個生物類似藥,其中 2 個品種上市,2 個品種藥品上市許可申請已獲受理,3 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家"重大新藥創制"重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用"預期"、"相信"、"預測"、"期望"、"打算"及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
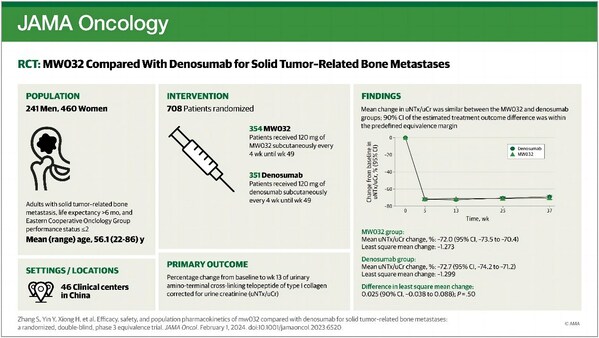
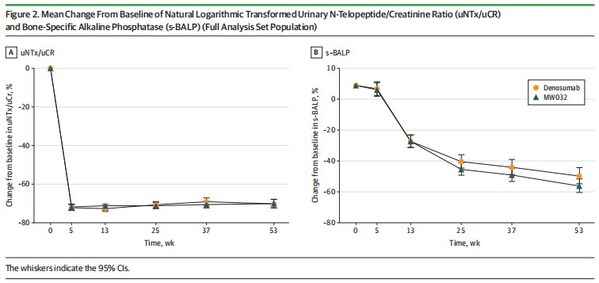
該研究納入了 708 例實體瘤骨轉移患者,隨機平均 (1:1) 分配至 MW032 組及原研藥組,每 4 周給藥一次直至 49 周。研究的主要終點為 13 周骨轉化指標尿I型膠原交聯 N 末端肽-肌酐比值 (uNTx/uCr) 較基線變化率,次要終點包括:5、13、25、37 及 53 周 uNTx/uCr 及血清骨堿性磷酸酶 (s-BALP) 較基線變化率;骨相關事件 (SREs) 發生率。
研究結果顯示,MW032 組及對照組的 13 周uNTx/uCr 較基線變化率分別為 ?72.0% 及 ?72.7%,校正分層因素后,兩治療組之間最小二乘均數之差為 0.02,90% 置信區間(-0.04 至 0.09)包含在等效界值之內。主要終點的敏感性分析、亞組分析及次要終點結果均證明兩治療組在有效性方面的相似性。
705 例受試者至少接受了 1 次給藥被納入安全性分析。MW032 組及對照組不良事件發生率、不良反應發生率及導致研究終止的不良事件發生率均相似。兩個治療組發生率最高的不良反應分別為低鈣血癥、低磷血癥及高尿酸血癥,發生率均相似。研究對于免疫原性及群體藥代動力學均進行了相似性研究。
該研究成果全面系統的證明了 MW032 在實體瘤骨轉移患者中使用的有效性、安全性及與原研藥的相似性。MW032 成功上市將增加患者的藥物可及性,降低患者的經濟負擔,造福更多腫瘤患者。
論文地址:https://jamanetwork.com/journals/jamaoncology/fullarticle/2814859
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承"讓創新從夢想變成現實"的愿景,踐行"探索生命,惠及健康"的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及腫瘤、自身免疫、代謝、眼科、感染等治療領域,憑借國際領先的特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 14 個品種處于不同階段,包括 10 個創新品種和 4 個生物類似藥,其中 2 個品種上市,2 個品種藥品上市許可申請已獲受理,3 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家"重大新藥創制"重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用"預期"、"相信"、"預測"、"期望"、"打算"及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
關于摩根大通醫療健康年會
摩根大通醫療健康年會 (J.P. Morgan Healthcare Conference) 是國際上規模最大、信息最豐富的醫療健康領域大會,聚集來自各大跨國公司和生物科技中小企業高管以及醫療投資人參加,引領著全球醫療健康產業發展和投資趨勢。
關于 Biotech Showcase
Biotech Showcase 吸引全球范圍內的投資者、生物制藥企業高管及行業內各領域專家,致力于為生物技術和生命科學公司提供合作機會。
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承"讓創新從夢想變成現實"的愿景,踐行"探索生命,惠及健康"的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及腫瘤、自身免疫、代謝、眼科、感染等治療領域,憑借國際領先的特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 14 個品種處于不同階段,包括 10 個創新品種和 4 個生物類似藥,其中 2 個品種上市,2 個品種藥品上市許可申請已獲受理,3 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家"重大新藥創制"重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用"預期"、"相信"、"預測"、"期望"、"打算"及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
9MW2821 口頭報告
研究背景:
Nectin-4 是一種在包括尿路上皮癌在內多種實體瘤中高度表達的粘附分子,可作為有效治療靶點。9MW2821 是一種單克隆抗體-藥物偶聯物 (ADC),能將 MMAE 釋放到表達 Nectin-4 的細胞中。本研究評估了該藥物在實體瘤患者中的安全性、耐受性和初步療效。
研究方法:
9MW2821 在每 28 天為 1 個周期的第 1 天、第 8 天和第 15 天通過靜脈輸注給藥。研究包括劑量遞增、劑量擴展和隊列擴展期。隊列中包括尿路上皮癌和其他 Nectin-4 陽性實體瘤受試者。主要目標為評估該藥物的安全性和初步療效。
研究結果:
截至 2023 年 4 月 27 日,該研究共入組 97 名患者,其中包括尿路上皮癌患者 39 例,宮頸癌患者 29 例。患者的年齡范圍為 32-78 歲(年齡中位數為 57 歲),劑量范圍為 0.33 至 1.5mg/kg。這些受試者既往接受過鉑類化療和免疫檢查點抑制劑治療。
研究中未發生與治療相關的死亡事件。在 1.5mg/kg 組僅觀察到 1 例劑量限制性毒性,為 4 級中性粒細胞減少持續大于 5 天。最大耐受劑量尚未達到。
研究中,任何級別的治療相關不良事件的發生率為 64.9%。最常見的治療相關不良事件是白細胞計數降低 (36.1%),中性粒細胞減少 (35.1%),惡心 (22.7%),天冬氨酸氨基轉移酶升高 (22.7%),皮疹 (19.6%),脫發 (19.6%),疲勞 (18.6%),食欲減退 (18.6%),貧血 (17.5%),嘔吐 (16.5%),外周感覺神經病 (16.5%)。3/4 級治療相關不良事件的發生率為 35.1%,最常見的是白細胞計數降低 (18.6%) 和中性粒細胞減少 (18.6%)。
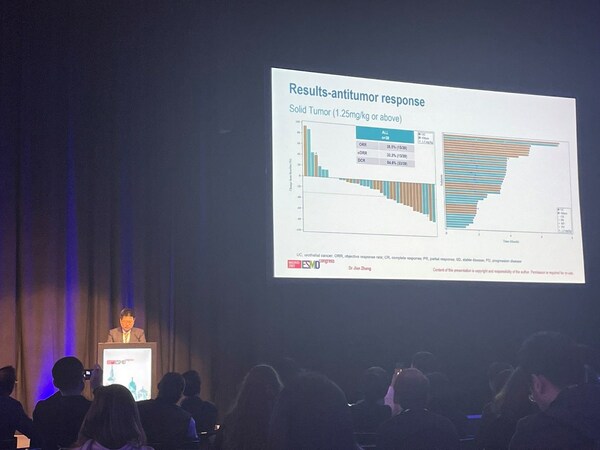
在接受 1.25mg/kg 或以上劑量 9MW2821 治療的 39 例實體瘤可腫評受試者中,客觀緩解率 (ORR) 和 疾病控制率 (DCR) 分別為38.5% 和 84.6%。在 1.25mg/kg 劑量組的 18 例尿路上皮癌可腫評受試者中,ORR 和 DCR 分別為 55.6% 和 94.4%。此外,9MW2821 在乳腺癌和宮頸癌患者中也觀察到了客觀緩解。
結論:
- 9MW2821 擁有良好可控的安全性。血液學毒性作為最常見的不良反應,被認為可控、可耐受且可逆轉。
- 除尿路上皮癌外,9MW2821 在其他癌種中也觀察到具有前景的抗腫瘤活性。
- 多適應癥拓展研究還在繼續開展以確定其療效。
8MW0511 壁報展示
注射用重組(酵母分泌型)人血清白蛋白-人粒細胞集落刺激因子融合蛋白 8MW0511 在 ESMO 大會上以壁報形式發布 III 期研究結果。研究顯示8MW0511 有確切的臨床療效,非劣于陽性對照藥物,能夠改善 4 級中性粒細胞降低的發生率和持續時間,其中第 2-3 周期 4 級中性粒細胞降低發生率明顯低于陽性對照組。總體安全性與陽性對照組相似,人體用藥安全可控,耐受性較好。
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承"讓創新從夢想變成現實"的愿景,踐行"探索生命,惠及健康"的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及腫瘤、自身免疫、代謝、眼科、感染等治療領域,憑借國際領先的特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 14 個品種處于不同階段,包括 10 個創新品種和 4 個生物類似藥,其中 2 個品種上市,1 個品種藥品上市許可申請已獲受理,1 個品種處于提交上市申請準備階段,2 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家"重大新藥創制"重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用"預期"、"相信"、"預測"、"期望"、"打算"及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
泰州醫藥高新區黨工委副書記、管委會主任,高港區委副書記、區長丁志強,泰州醫藥產業園黨工委副書記、管委會主任吳翔等政府代表,中國醫學科學院北京協和醫院夏維波教授等專家學者,國藥物流總經理趙立東,招商銀行泰州分行行長徐一,以及邁威生物聯合創始人、CEO 劉大濤博士,邁威生物副總裁李瀚,邁威生物全資子公司泰康生物常務副總經理丁滿生博士共同啟動儀式,慶祝邁利舒®全國上市。
泰州醫藥高新區黨工委副書記、管委會主任,高港區委副書記、區長丁志強表示:"邁威生物始終堅守初心、保持定力,與中國醫藥城攜手同行、并肩奮進,為中國醫藥城生物醫藥產業高質量發展提供了強勁動力。希望邁威生物以此次產品上市為契機,繼續專注細分產品領域深耕細作,打造具有全球競爭力的核心重磅產品,為加快中國醫藥城產業化進程,推動生物醫藥產業高質量發展貢獻力量。中國醫藥城將始終秉持‘專業、專注、專心'的服務理念,努力為企業發展營造最優營商環境。"
中國醫學科學院北京協和醫院夏維波教授表示:"邁利舒®遵循相關研究指南及監管要求,依據比對及逐步遞進的研發原則,通過藥學、非臨床及臨床比對結果綜合評價,證明了邁利舒®與原研藥在質量、安全性和有效性方面的整體相似性。作為高質量的地舒單抗生物類似藥,邁利舒®能夠增加患者治療的便利性及依從性。希望邁利舒®的上市能造福更多中國骨質疏松癥患者。"
國藥物流總經理趙立東表示:"非常感謝邁威生物對國藥物流的信任,選擇將邁利舒®交給國藥物流來進行全國物流存儲和配送。國藥物流完善的存儲和運輸網絡,以及專業的服務團隊將助力邁威生物在中國的銷售擴張、終端下沉,協助邁威生物一起為廣大患者提供安全可靠的藥品。"
邁威生物聯合創始人、CEO 劉大濤博士表示:"骨質疏松癥具有高發病率、高致殘率和低治療率等特點,在中國乃至全球都有著廣闊的臨床需求。邁利舒®在獲批后,我們的泰州產業化基地全力投入,力求高質量的藥品盡早服務于患者,提高他們的生活品質。同時,我們正在積極拓展邁利舒®的適應癥,并與多個國家達成戰略合作,希望惠及全球更多骨質疏松癥患者。"
在本次骨質疏松癥診療高峰論壇上,多名專家還就聚焦骨質疏松癥的研究進展、臨床用藥、治療策略、診療規范等話題,結合理論與實踐,展開了精彩的學術講座及互動討論。
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承"讓創新從夢想變成現實"的愿景,踐行"探索生命,惠及健康"的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及腫瘤、自身免疫、代謝、眼科、感染等治療領域,憑借國際領先的特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 14 個品種處于不同階段,包括 10 個創新品種和 4 個生物類似藥,其中 2 個品種上市,1 個品種上市申請獲得受理,3 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家"重大新藥創制"重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用"預期"、"相信"、"預測"、"期望"、"打算"及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
邁利舒®是全球第二款獲批上市的地舒單抗生物類似藥,用于骨折高風險的絕經后婦女的骨質疏松癥。在絕經后婦女中,本品可顯著降低椎體、非椎體和髖部骨折的風險。
邁威生物營銷中心開展了針對治療領域、患者構成、市場潛力等多方面調研工作,制定并多次完善產品推廣策略及資源配置計劃,并于 2022 年第四季度全面啟動了產品上市前的籌備工作。年內預計可實現醫院準入超過 200 家,實現銷售不低于 30 萬支。目前公司正積極推進包括定價、準入等營銷相關工作。
邁威生物的聯合創始人、CEO劉大濤博士表示:“很高興繼君邁康®上市后一年,邁威生物第二款全球商業化產品邁利舒®獲批上市。年齡相關疾病是我們重點布局的領域。中國老齡女性人群半數以上患有骨質疏松癥,而骨質疏松的并發癥脆性骨折,是影響患者生活質量及生命安全的主要原因。邁威生物已組建了精準高效的營銷團隊,集醫學、市場、銷售一體商業化管理,提升國內患者可及性。此外,邁利舒®已在多個國家達成了戰略合作,希望與海外合作伙伴共同努力,惠及全球更多的骨質疏松癥患者。”
關于邁利舒®
邁利舒®是全球第二款獲批上市的 Prolia®(普羅力®)生物類似藥,活性成份為抗 RANKL(receptor activator of NF-κB ligand,核因子-κB 受體活化因子配體)免疫球蛋白 G2 全人源單克隆抗體。
地舒單抗是國際上一線廣譜類抗骨折風險藥物,能夠阻斷 RANKL 激活破骨細胞及其前體表面的受體 RANK,阻斷 RANKL/RANK 相互作用可抑制破骨細胞形成、功能和存活,從而減少骨吸收,增加骨皮質和骨小梁的骨量和強度。地舒單抗可以顯著降低患者多個部位的骨折風險,包括椎體、非椎體和髖部骨折的風險。適用于治療高骨折風險絕經后婦女骨質疏松癥、治療高骨折風險男性骨質疏松癥,以增加骨量、治療高骨折風險男性和女性糖皮質激素誘導的骨質疏松癥、治療接受雄激素剝奪療法的高骨折風險非轉移性前列腺癌男性,以增加骨量以及治療接受芳香化酶抑制劑療法的高骨折風險乳腺癌女性,以增加骨量。預充式注射器以及每 6 個月通過皮下注射給藥一次的長效給藥方案,能夠增加患者自行治療的便利性及依從性,長程治療中地舒單抗已被確認為較優的治療選擇,有臨床應用 10 年的安全性數據。
邁利舒®遵循相關研究指南,通過藥學、非臨床、人體藥代動力學、臨床有效性一系列逐步遞進的研究,科學、嚴謹、完整地確證了邁利舒®與原研參照藥的整體相似性,二者的質量、安全性和有效性高度相似,無臨床意義上的差異。邁利舒®完成的臨床試驗結果已在《Expert Opinion on Biological Therapy》發表。
根據安進公司年報,Prolia® 2022 年的銷售額為 36.28 億美元,同比增長 12%;此外其合作伙伴第一三共報道日本授權品牌 Pralia® 2021 年日本銷售額為 379 億日元。根據弗若斯特沙利文報告,用于骨質疏松癥的地舒單抗在中國的市場規模預期于 2030 年將達人民幣 78 億元。
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承“讓創新從夢想變成現實”的愿景,踐行“探索生命,惠及健康”的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及自身免疫、腫瘤、代謝、眼科、感染等治療領域,憑借國際領先的五項特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 17 個品種處于不同階段,包括 13 個創新品種和 4 個生物類似藥,其中 2 個品種上市,1 個品種上市申請獲得受理,3 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家“重大新藥創制”重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用“預期”、“相信”、“預測”、“期望”、“打算”及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
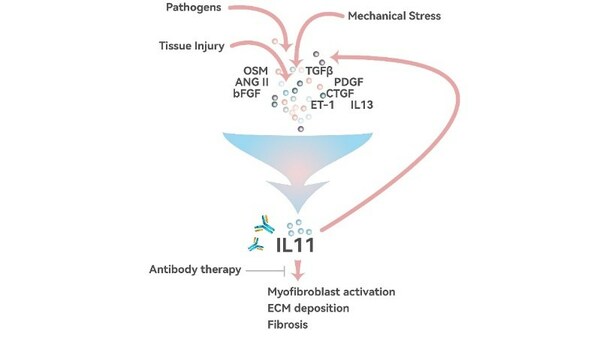
9MW3811 是創新靶點人源化單克隆抗體,可高效阻斷 IL-11 下游信號通路的激活,從而達到對纖維化和腫瘤的治療效果。
9MW3811 是第一款進入臨床階段的靶向 IL-11 的單克隆抗體,也是 IL-11 靶點第一款進入臨床階段的非重組蛋白藥物。
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承"讓創新從夢想變成現實"的愿景,踐行"探索生命,惠及健康"的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及自身免疫、腫瘤、代謝、眼科、感染等治療領域,憑借國際領先的五項特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 16 個品種處于不同階段,包括 12 個創新品種和 4 個生物類似藥,其中 1 個品種上市,2 個品種上市申請獲得受理,3 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家"重大新藥創制"重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用"預期"、"相信"、"預測"、"期望"、"打算"及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
邁威的聯合創始人、董事、CEO 劉大濤博士表示:“很高興邁威生物能與 Binnopharm Group 達成在俄羅斯和歐亞經濟聯盟國家地區的戰略合作,這是我們該地區的第一個戰略合作伙伴,該區域也是生物類似藥和創新藥的重要市場。我們的三款生物類似藥將在該區域商業化和本土化,這代表了我們高品質的產品和高可靠性的臨床數據得到了認可。”
Binnopharm Group 董事、CEO Rustem Muratov 先生表示:“與邁威生物的伙伴關系是我們在俄羅斯和歐亞經濟聯盟地區進一步發展生物技術業務戰略的一個組成部分。本項目的目標不僅是在俄羅斯和歐亞經濟聯盟引進邁威生物的產品,還要與邁威生物等創新公司建立合作。此次合作對于 Binnopharm Group 以及我們在俄羅斯和歐亞經濟聯盟國家的患者來說也是一個重要的里程碑,他們將獲得優質且可負擔起的藥物,提升生活品質。”
關于君邁康®
君邁康®(阿達木單抗注射液)于 2022 年 3 月獲批上市,目前在國內已獲批 8 項適應癥,包括類風濕關節炎、強直性脊柱炎、銀屑病、克羅恩病、葡萄膜炎、多關節型幼年特發性關節炎、兒童斑塊狀銀屑病和兒童克羅恩病。
關于 9MW0321
9MW0321(地舒單抗注射液)是 Xgeva® 的生物類似藥。原研藥已獲批用于以下適應癥:
- 預防多發性骨髓瘤患者和實體瘤骨轉移患者的骨骼相關事件;
- 成人和骨骼成熟青少年骨巨細胞瘤不可切除或手術切除可能導致嚴重發病率的治療;
- 雙膦酸鹽治療難治性惡性腫瘤高鈣血癥 (HCM) 的治療。
關于 9MW0311
9MW0311(地舒單抗注射液)是 Prolia® 的生物類似藥。原研藥已獲批用于以下適應癥:
- 治療更年期、骨折風險增加、無法服用或對其他骨質疏松藥物治療無效的女性骨質疏松;
- 治療骨折風險增加或無法服用或對其他骨質疏松藥物治療無效的男性;
- 治療由皮質類固醇藥物引起的骨質疏松,男性和女性將使用皮質類固醇藥物至少 6 個月且骨折風險增加,或無法使用或對其他骨質疏松藥物治療無效;
- 使用某些導致骨質流失的藥物治療正在接受前列腺癌治療的男性骨質流失;
- 治療正在接受某些增加骨折風險的藥物治療的乳腺癌女性骨質流失。
關于Binnopharm Group
Binnopharm Group 通過整合 Sistema PJSFC 的制藥資產 (LSE: SSA, MOEX: AFKS) 成立。Binnopharm Group 是俄羅斯排名前五的制藥公司(根據AlphaRM),營業額超過 250 億盧布,是俄羅斯最大的非專利藥品生產商,也是面向獨立國家聯合體(CIS)市場的第一大產品生產商。2020 年,Binnopharm Group 成為世界上第一家生產新冠疫苗的公司。它在俄羅斯不同地區擁有 5 個先進的生產工廠來生產化藥和生物藥。Binnopharm Group 生產 200 多種不同劑型產品(包括片劑、膠囊、軟膏、凝膠、栓劑、輸液等)。公司在俄羅斯生產商中擁有數一數二的產品組合規模,共持有 450 多種藥品的注冊證書。更多信息請訪問:https://en.binnopharmgroup.ru.
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承“讓創新從夢想變成現實”的愿景,踐行“探索生命,惠及健康”的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及自身免疫、腫瘤、代謝、眼科、感染等治療領域,憑借國際領先的五項特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 14 個品種處于不同階段,包括 10 個創新品種和 4 個生物類似藥,其中 1 個品種上市,2 個品種上市申請獲得受理,3 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家“重大新藥創制”重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用“預期”、“相信”、“預測”、“期望”、“打算”及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
創新是引領發展的第一動力。隨著我國“創新驅動發展戰略”和“健康中國戰略”的深入推進,創新力量正成為護航中國人民身心健康的核心動能。“中國醫藥新銳創新力量”榜單由專家評選小組對中國醫藥領域的新銳創新企業進行基于客觀數據的研究與分析后評選得出。
榜單評選依據
數據來源:新藥研發監測數據庫及企業自主申報數據的考察。
評價依據:分為產品和企業兩個層面,在產品層面考察創新維度、投入維度、技術維度和競爭維度;在企業層面考察特性維度、動力維度、戰略維度和發展維度,評審小組針對各維度對各企業進行評分。
評估打分:由產品評選組和企業評選組兩個獨立的專家團隊,分別對藥品和企業的幾個維度值設立打分標準;由綜合評判組專家對各個維度在綜合評判中所占的比重給予系數調整權重,并與標準分值相乘,加權計算后獲得企業的綜合得分。企業的最終排名由綜合得分決定。
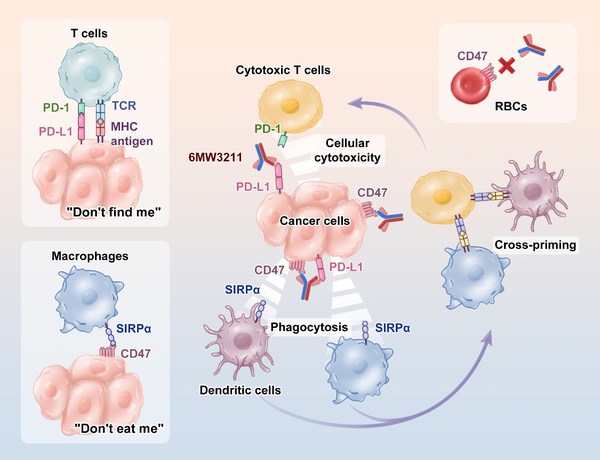
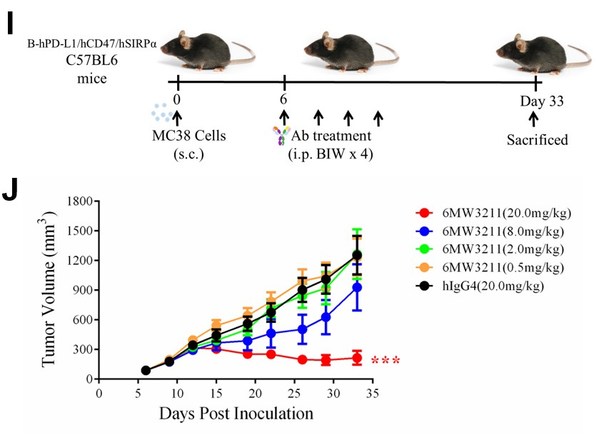
]]>6MW3211是共輕鏈結構,采用差異化的親和力設計,以確保優先結合到表達PD-L1的腫瘤細胞,并在此基礎上發揮CD47抗體臂的阻斷作用,同時活化T細胞及Macrophage的抗腫瘤作用。
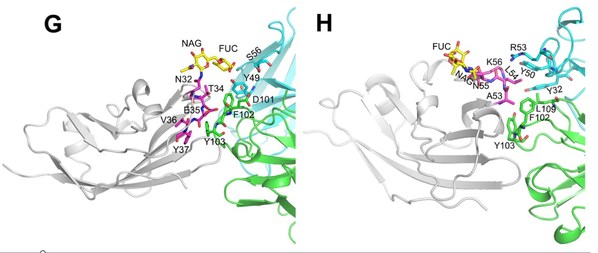
臨床前研究顯示,6MW3211完全不結合人及恒河猴的紅細胞。進一步的晶體結構數據顯示,CD47上的兩個N-糖基化位點參與了跟6MW3211的結合,提示了6MW3211對腫瘤細胞表面CD47特異性結合的結構基礎。
6MW3211 在 Raji/NCG 及 hCD47/hSIRPα/hPD-L1 三轉基因小鼠模型上展示了很好的治療效果,顯著抑制腫瘤生長,延長小鼠生存期。體內外的功能研究結果表明,腫瘤細胞上 PD-L1 的表達能很大程度上提高 6MW3211 中 CD47 抗體臂的抗腫瘤效果。
恒河猴的毒理試驗中,6MW3211 顯示了很好的安全性,在 200mg/kg 劑量下,未觀察到任何紅細胞毒性。6MW3211 作用機制明確,具有很好的安全性,在動物模型上展示了顯著的抗腫瘤效果,當前已推進到 II 期臨床階段。
本文圖片均來源于 Theranostics 2023; 13(1):148-160.
關于邁威生物
邁威生物 (688062.SH) 是一家全產業鏈布局的創新型生物制藥公司,始終秉承"讓創新從夢想變成現實"的愿景,踐行"探索生命,惠及健康"的使命,通過源頭創新,為患者提供療效更好、可及性更強的生物創新藥,滿足全球未被滿足的臨床需求。2017 年成立以來,邁威生物構建了以抗體藥物靶點發現與分子發現為起點,覆蓋成藥性研究、臨床前研究、臨床研究和生產轉化等藥品研發全周期的創新體系,實現集研發、生產、營銷于一體的全產業鏈布局。我們專注于腫瘤和年齡相關疾病,涉及自身免疫、腫瘤、代謝、眼科、感染等治療領域,憑借國際領先的五項特色技術平臺和研發創新能力,建立了豐富且具有競爭力的管線。現有 14 個品種處于不同階段,包括 10 個創新品種和 4 個生物類似藥,其中 1 個品種上市,2 個品種上市申請獲得受理,3 個品種處于關鍵注冊臨床試驗階段。并獨立承擔 1 項國家"重大新藥創制"重大科技專項、2 項國家重點研發計劃和多個省市級科技創新項目。邁威生物以創新為本,注重產業轉化,符合中國 NMPA、美國 FDA、歐盟 EMA GMP標準的抗體和重組蛋白藥物產業化基地已在江蘇泰州投入使用,并已通過歐盟 QP 審計,位于上海金山和江蘇泰州的大規模商業化生產基地正在建設中。欲了解更多信息,請訪問:www.mabwell.com。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用"預期"、"相信"、"預測"、"期望"、"打算"及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司并無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制范圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
本公司、本公司董事及雇員代理概不承擔 (a) 更正或更新本網站所載前瞻性表述的任何義務;及 (b) 若因任何前瞻性表述不能實現或變成不正確而引致的任何責任。
在接受《第一財經》針對"聚焦轉化醫學與多中心臨床研究,全球布局再邁新步伐"專題的采訪過程中,劉大濤博士指出,轉化醫學能夠通過集中解決臨床上的問題,有針對性地進行研究,大大加速藥品研發進程并提高研發的成功率,是加速生物藥研發的有效工具。而我國多中心臨床研究已和國際接軌,數據得到了國際互認,有助于中國藥品快速走向國際市場。
近年來,不斷涌現的新靶點、新藥物給很多腫瘤的治療帶來了顛覆性的變革,這些都是轉化醫學應用的成果,包括邁威生物自研的國內首個、全球第二個靶向 Nectin-4 的 ADC 藥物,目前正在中美開展多項臨床試驗。
]]>