上海2025年8月15日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家專注于開發創新CAR-T細胞療法的生物制藥公司,已發布2025中期業績。
業績亮點速覽
- 截至2025年6月30日,現金及銀行結余約為人民幣12.61億元,于2025年末的現金及現金等價物及存款預期將不少于人民幣11.00億元;不考慮后續現金流入的前提下,預期將有充足現金支持運營到2028年。
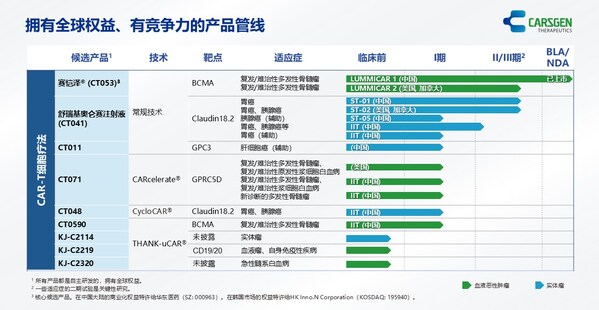
- 2025年上半年,賽愷澤®完成認證及備案的醫療機構覆蓋全國20多個省市,科濟藥業共計從商業化合作伙伴華東醫藥獲得111份有效訂單。
- 舒瑞基奧侖賽注射液新藥上市申請(NDA)獲中國國家藥品監督管理局(NMPA)的藥品審評中心(CDE)受理。
- 舒瑞基奧侖賽注射液在中國的確證性II期臨床試驗研究結果發表于《柳葉刀》及2025 ASCO年會。
- 多款通用型CAR-T產品開發中,涵蓋血液惡性腫瘤、實體瘤、自身免疫性疾病等領域。
- 引入珠海軟銀欣創投資以加速通用型CAR-T細胞產品在中國內地研發進程。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"2025年上半年,我們在技術創新、產品研發、商業化等方面均取得可喜的成績,賽愷澤®銷量快速增長,舒瑞基奧侖賽成為全球首款提交NDA的針對實體瘤的CAR-T,同時我們也在持續開發多款通用型CAR-T,以期帶來更大的臨床獲益和提高可及性。"
財務摘要
截至2025年6月30日止六個月,科濟藥業的收益約為人民幣5,100萬元,主要來自賽愷澤®,是以出廠價格而非終端市場價進行計算的。我們的收益于完成產品的出廠交付后確認。由于CAR-T生產存在必需的時間周期,從華東醫藥獲得的訂單數量與出廠交付的數量存在差異。截至2025年6月30日止六個月,科濟藥業的毛利約為人民幣2,900萬元。于商業化階段,我們彰顯了強大的成本競爭優勢,主要由于我們自主生產的質粒及載體產出穩定,每批產量很高。
截至2025年6月30日,現金及銀行結余約為人民幣12.61億元,較截至2024年12月31日約人民幣14.79億元減少約人民幣2.18億元。該減少主要是由于支付研發開支、行政開支及資本開支投入所致。于2025年末的現金及現金等價物及存款預期將不少于人民幣11.00億元。不考慮后續的現金流入的前提下,我們預期將有充足現金支持運營到2028年。
賽愷澤®銷量快速增長
賽愷澤®(澤沃基奧侖賽注射液,研發代號:CT053)是一種全人源B細胞成熟抗原(BCMA)自體CAR-T細胞產品,已獲中國NMPA批準用于治療復發或難治性多發性骨髓瘤(R/R MM)成人患者,既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)。
科濟藥業與華東醫藥(000963.SZ)已就在中國大陸地區商業化賽愷澤®簽訂合作協議。在商業化落地方面,華東醫藥已組建獨立專業、全方位的商業化團隊全面推廣賽愷澤®,利用中國多層次保險體系,提高患者可及性。于2025年上半年,賽愷澤®完成認證及備案的醫療機構覆蓋全國20多個省市,科濟藥業共計從華東醫藥獲得111份有效訂單。我們預計,隨著營銷活動的持續進行及保險覆蓋范圍的擴大,賽愷澤®的銷售收益將進一步加快增長。
舒瑞基奧侖賽注射液中國NDA獲受理
舒瑞基奧侖賽注射液(研發代號:CT041)是一種靶向Claudin18.2(CLDN18.2)的自體人源化CAR-T細胞產品。2025年6月,中國NMPA的CDE已受理舒瑞基奧侖賽注射液的NDA,用于治療Claudin18.2表達陽性、至少二線治療失敗的晚期胃/食管胃結合部腺癌(G/GEJA)。舒瑞基奧侖賽注射液是全球首款且唯一一款進入NDA階段的用于治療實體瘤的CAR-T細胞產品。舒瑞基奧侖賽注射液于2025年5月獲CDE納入優先審評,并于2025年3月獲授予突破性治療藥物品種認定(BTD)。
舒瑞基奧侖賽注射液在中國的確證性II期的臨床試驗(NCT04581473)的研究結果已在《柳葉刀》(The Lancet)發表,并于2025年美國臨床腫瘤學會(ASCO)年會上進行口頭報告。研究結果顯示,舒瑞基奧侖賽對比標準治療可顯著改善無進展生存期(PFS),并展現出有臨床意義的總生存期(OS)獲益,同時具有可控的安全性特征。
多款通用型CAR-T細胞產品開發中
科濟藥業利用其專有THANK-uCAR®平臺推進差異化的通用型CAR-T細胞產品。公司最近開發了THANK-u Plus?平臺,作為THANK-uCAR®的升級版,以克服NKG2A表達水平對通用型CAR-T細胞產品療效可能的影響。
CT0596是一款利用THANK-u Plus?平臺治療R/R MM或R/R漿細胞白血病(PCL)的靶向BCMA通用型CAR-T細胞產品,正在中國開展研究者發起的臨床試驗。初步臨床數據已于2025年5月在公司官網發布。根據初步安全性及療效數據,CT0596用于R/R MM患者總體耐受性良好,在所有預設劑量組都觀察到了CAR-T細胞的擴增,并出現了令人鼓舞的療效信號。
多個通用型CAR-T產品亦正在開發中:
- KJ-C2219 - 靶向CD19/CD20,用于治療血液惡性腫瘤及自身免疫性疾病。2024年底啟動一項針對復發/難治性B細胞非霍奇金淋巴瘤(R/R B-NHL)的研究者發起的臨床試驗,2025年上半年啟動一項針對系統性紅斑狼瘡(SLE)和系統性硬化癥(SSc)的研究者發起的臨床試驗。
- KJ-C2320 - 靶向CD38,用于治療急性髓系白血病(AML),2024年底啟動一項研究者發起的臨床試驗。
- KJ-C2114 - 用于治療實體瘤。
- KJ-C2526 - 靶向NKG2DL,用于治療AML、其他惡性腫瘤,以及抗衰老。
2025年2月25日,科濟藥業與珠海橫琴軟銀欣創股權投資管理企業(有限合伙)旗下管理的基金達成協議。根據該協議,投資者同意以現金對價人民幣80,000,000元認購優愷澤生物醫藥(上海)有限公司("優愷澤")的新增注冊資本,占優愷澤增資后注冊資本的8%。本次增資完成后,科濟藥業于優愷澤的股份將由100%稀釋至92%。
優愷澤是一家在中國內地專注于利用通用型CAR-T細胞療法治療血液瘤的新藥研發公司。根據該等協議,優愷澤獲得科濟藥業治療多發性骨髓瘤、漿細胞白血病的通用型BCMA CAR-T細胞產品以及治療B細胞腫瘤的通用型CD19/CD20雙靶CAR-T細胞產品(不包括治療自身免疫性疾病的適應證)在中國內地的研發、生產與商業化的獨家權利。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家生物制藥公司,專注于開發創新CAR-T細胞療法,以滿足未滿足的臨床需求,包括但不限于血液惡性腫瘤、實體瘤及自身免疫性疾病。公司形成了從靶點發現、臨床前研究、產品臨床開發到商業規模生產的CAR-T細胞研究與開發的端到端能力。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法的挑戰,比如提高安全性,提高實體瘤治療的療效和降低治療成本等。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥及其他疾病的患者提供創新和差異化的細胞療法,使癌癥及其他疾病可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/

上海 2025年7月14日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家專注于開發創新CAR-T細胞療法的生物制藥公司,宣布其歐洲專利EP3445407在歐洲專利局(European Patent Office, EPO)的異議程序中取得了積極成果。該專利涉及科濟藥業自主研發的靶向GPC3 CAR-T細胞治療技術。
2025年7月3日,來自美國的一家生物技術公司——作為兩位原始異議人中唯一提起上訴的一方——已正式撤回其對EPO異議部門決定的上訴。根據EPO相關規定,該上訴的撤回使得異議部門關于維持專利有效的決定對所有異議人具有終局效力,實際上終結了異議人提出的異議程序。
該專利于2022年獲EPO授權,并于2023年收到兩方異議。經過口頭審理后,EPO異議部門決定以修改后的形式維持專利有效。被支持的關鍵權利要求涵蓋在使用環磷酰胺和氟達拉濱進行清淋預處理后,采用GPC3 CAR-T細胞治療肝癌、肺癌、卵巢癌、乳腺癌、胃癌及甲狀腺癌。在該決定作出后,僅有一方異議人在法定期限內提起上訴,而該上訴現已正式撤回。
根據EPO相關程序,異議人及任何其他第三方將無法再通過EPO途徑對該專利提出挑戰。此次進展進一步鞏固了科濟藥業在靶向GPC3 CAR-T細胞療法領域的專利布局,彰顯了公司在實體瘤治療領域的技術創新能力與全球競爭優勢。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家生物制藥公司,專注于開發創新CAR-T細胞療法,以滿足未滿足的臨床需求,包括但不限于血液惡性腫瘤、實體瘤及自身免疫性疾病。公司形成了從靶點發現、臨床前研究、產品臨床開發到商業規模生產的CAR-T細胞研究與開發的端到端能力。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法的挑戰,比如提高安全性,提高實體瘤治療的療效和降低治療成本等。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥及其他疾病的患者提供創新和差異化的細胞療法,使癌癥及其他疾病可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
 ]]>
]]>
上海 2025年6月26日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家專注于開發創新CAR-T細胞療法的生物制藥公司宣布,中國國家藥品監督管理局(NMPA)已受理舒瑞基奧侖賽注射液(產品編號:CT041,一種靶向Claudin18.2的自體CAR-T細胞產品)的新藥上市申請(NDA),用于治療Claudin18.2表達陽性、至少二線治療失敗的晚期胃/食管胃結合部腺癌(G/GEJA)患者。此次提交的NDA主要是基于一項在中國開展的開放標簽、多中心、隨機對照的確證性II期臨床試驗(CT041-ST-01, NCT04581473)結果。相關數據已在《The Lancet》和2025年美國臨床腫瘤學會(ASCO)年會上正式公布。
此外,本公司正積極拓展探索舒瑞基奧侖賽注射液在癌癥早線及圍術期治療中的應用,包括一項正在進行的用于胰腺癌輔助治療的Ib期注冊臨床試驗,及一項正在進行的用于G/GEJA患者術后輔助治療后鞏固治療的研究者發起的臨床試驗。
CT041-ST-01 試驗的牽頭研究者,北京大學腫瘤醫院沈琳教授表示:"胃癌是全球范圍內疾病負擔重且治療挑戰大的一類惡性腫瘤,尤其對于晚期胃癌患者,現有治療手段及其療效十分有限,生存預后極差。在目前的胃癌治療格局下,越來越多的患者已在前線經歷免疫治療、抗血管生成治療失敗,三線及以上可選擇或可獲益的藥物更加受限。因此,二線治療失敗后的晚期胃癌患者存在巨大的未滿足的臨床需求。舒瑞基奧侖賽確證性隨機對照臨床試驗已明確顯示,與現有標準治療相比,舒瑞基奧侖賽在延長無進展生存期(PFS)方面和總生存期(OS)方面均具有顯著優勢和臨床價值,試驗成果已獲得國際廣泛關注與認可,也為舒瑞基奧侖賽的NDA申報提供了堅實的證據基礎。期待舒瑞基奧侖賽早日獲批上市,為廣大胃癌患者提供新的治療選擇。"
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"我們非常高興地宣布,公司自主研發的靶向Claudin18.2 CAR-T產品舒瑞基奧侖賽注射液的NDA已獲國家藥品監督管理局受理。這是全球首款進入到NDA階段的用于治療實體瘤的CAR-T細胞產品,是CAR-T領域的一個重要的里程碑。我衷心感謝參與該產品臨床試驗的研究者、管理者、受試者;也期待該產品能早日獲批,為胃癌患者提供新的治療選擇。"
關于舒瑞基奧侖賽注射液
舒瑞基奧侖賽注射液是一款潛在全球同類首創的、靶向Claudin18.2蛋白的自體CAR-T細胞治療候選產品,用于治療Claudin18.2陽性實體瘤,主要治療胃/食管胃結合部腺癌及胰腺癌。已開展的試驗包括在中國開展的研究者發起的臨床試驗(CT041-CG4006, NCT03874897),在中國開展的針對晚期胃/食管胃結合部腺癌的確證性II期臨床試驗(CT041-ST-01, NCT04581473),在中國開展的針對胰腺癌輔助治療的Ib期注冊臨床試驗(CT041-ST-05, NCT05911217),在中國開展的用于胃/食管胃結合部腺癌患者術后輔助治療后鞏固治療的研究者發起的臨床試驗(CT041-CG4010,NCT06857786)以及在北美開展的針對晚期胃癌或胰腺癌的1b/2期臨床試驗(CT041-ST-02, NCT04404595)。
2025年5月,舒瑞基奧侖賽注射液被中國NMPA的藥品審評中心(CDE)納入優先審評,用于治療Claudin18.2表達陽性、至少二線治療失敗的晚期胃/食管胃結合部腺癌的患者。2025年3月,舒瑞基奧侖賽注射液獲得了中國NMPA的CDE授予的突破性治療藥物品種認定,擬定適應癥為既往接受過至少二線治療失敗的Claudin18.2表達陽性的晚期胃/食管胃結合部腺癌。2022年1月,舒瑞基奧侖賽注射液被美國FDA授予"再生醫學先進療法"(RMAT)認定用于治療Claudin18.2陽性的晚期胃/食管胃結合部腺癌。2020年9月,舒瑞基奧侖賽注射液被美國FDA授予"孤兒藥"認定用于治療胃/食管胃結合部腺癌。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家生物制藥公司,專注于開發創新CAR-T細胞療法,以滿足未滿足的臨床需求,包括但不限于血液惡性腫瘤、實體瘤及自身免疫性疾病。公司形成了從靶點發現、臨床前研究、產品臨床開發到商業規模生產的CAR-T細胞研究與開發的端到端能力。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法的挑戰,比如提高安全性,提高實體瘤治療的療效和降低治療成本等。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥及其他疾病的患者提供創新和差異化的細胞療法,使癌癥及其他疾病可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
 ]]>
]]>
上海 2025年6月2日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家專注于開發創新CAR-T細胞療法的生物制藥公司宣布,舒瑞基奧侖賽注射液(產品編號:CT041,一款靶向Claudin18.2蛋白的自體CAR-T細胞治療候選產品)在中國開展的針對Claudin18.2陽性、至少二線治療失敗的晚期胃/食管胃結合部腺癌患者的確證性II期臨床試驗(CT041-ST-01, NCT04581473)的研究結果已全文發表在《柳葉刀》(《The Lancet》),并于2025年美國臨床腫瘤學會(ASCO)年會進行了口頭報告。更多詳情請參見公司官網https://www.carsgen.com。
發表在《柳葉刀》上的文章題為"靶向Claudin18.2 CAR-T細胞(舒瑞基奧侖賽注射液)對比研究者選擇治療用于既往治療失敗的晚期胃/食管胃結合部癌患者(CT041-ST-01):隨機、開放標簽、II期臨床試驗"("Claudin-18 isoform 2-specific CAR T-cell therapy (satri-cel) versus treatment of physician's choice for previously treated advanced gastric or gastro-oesophageal junction cancer (CT041-ST-01): a randomised, open-label, phase 2 trial")。全文參見https://doi.org/10.1016/S0140-6736(25)00860-8。
在2025 ASCO年會上的口頭報告(摘要編號:4003)題為"靶向Claudin18.2 CAR-T細胞(舒瑞基奧侖賽注射液)對比研究者選擇治療用于既往治療失敗的晚期胃/食管胃結合部癌患者:隨機、開放標簽、II期臨床試驗(CT041-ST-01)的主要結果"("Claudin18.2-specific CAR T cells (Satri-cel) versus treatment of physician's choice (TPC) for previously treated advanced gastric or gastroesophageal junction cancer (G/GEJC): Primary results from a randomized, open-label, phase II trial (CT041-ST-01)")。
本項研究的牽頭研究者,北京大學腫瘤醫院沈琳教授表示:"CT041-ST-01試驗是全球首個針對實體瘤的CAR-T細胞療法隨機對照臨床試驗。對于現有治療選擇極其有限、預后極差的晚期末線胃/食管胃結合部癌患者,舒瑞基奧侖賽無論在無進展生存期、總生存期還是腫瘤緩解率方面均展現出突破性的療效提升與巨大獲益,為廣大無藥可醫的晚期胃/食管胃結合部癌患者帶來新的希望。我們也將進一步探索舒瑞基奧侖賽在術后輔助治療及一線序貫治療中的潛力,以期通過更早干預重塑疾病進程,為患者爭取更長的生存獲益窗口,甚至潛在治愈的可能。"
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"很高興看到CT041-ST-01的研究成果在國際醫學頂刊《柳葉刀》和2025 ASCO年會上同步發表。這個隨機對照研究的陽性結果是實體瘤CAR-T領域的一項重大里程碑式成果。這一成就離不開整個研究團隊多年來的辛勤付出,也衷心感謝患者及其家屬的信任與支持。今年,舒瑞基奧侖賽已獲得國家藥品監督管理局藥品審評中心授予的突破性治療藥物品種認定,并被納入優先審評,用于治療Claudin18.2表達陽性、至少二線治療失敗的晚期胃/食管胃結合部腺癌的患者。我們預計本月將向國家藥品監督管理局正式遞交舒瑞基奧侖賽的新藥上市申請,期待舒瑞基奧侖賽早日上市,并成為全球首款商業化的實體瘤CAR-T產品,惠及廣大患者。"
關于舒瑞基奧侖賽注射液
舒瑞基奧侖賽注射液是一款潛在全球同類首創的、靶向Claudin18.2蛋白的自體CAR-T細胞治療候選產品,用于治療Claudin18.2陽性實體瘤,主要治療胃/食管胃結合部腺癌及胰腺癌。已開展的試驗包括在中國開展的研究者發起的臨床試驗(CT041-CG4006, NCT03874897),在中國開展的針對晚期胃/食管胃結合部腺癌的確證性II期臨床試驗(CT041-ST-01, NCT04581473),在中國開展的針對胰腺癌輔助治療的Ib期臨床試驗(CT041-ST-05, NCT05911217),在中國開展的用于胃/食管胃結合部腺癌患者術后輔助治療后鞏固治療的研究者發起的臨床試驗(CT041-CG4010,NCT06857786)以及在北美開展的針對晚期胃癌或胰腺癌的1b/2期臨床試驗(CT041-ST-02, NCT04404595)。
2025年5月,舒瑞基奧侖賽注射液被中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)納入優先審評,用于治療Claudin18.2表達陽性、至少二線治療失敗的晚期胃/食管胃結合部腺癌的患者。2025年3月,舒瑞基奧侖賽注射液獲得了中國NMPA的CDE授予的突破性治療藥物品種認定,擬定適應癥為既往接受過至少二線治療失敗的Claudin18.2表達陽性的晚期胃/食管胃結合部腺癌。2022年1月,舒瑞基奧侖賽注射液被美國FDA授予"再生醫學先進療法"(RMAT)認定用于治療Claudin18.2陽性的晚期胃/食管胃結合部腺癌。2020年9月,舒瑞基奧侖賽注射液被美國FDA授予"孤兒藥"認定用于治療胃/食管胃結合部腺癌。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家生物制藥公司,專注于開發創新CAR-T細胞療法,以滿足未滿足的臨床需求,包括但不限于血液惡性腫瘤、實體瘤及自身免疫性疾病。公司形成了從靶點發現、臨床前研究、產品臨床開發到商業規模生產的CAR-T細胞研究與開發的端到端能力。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法的挑戰,比如提高安全性,提高實體瘤治療的療效和降低治療成本等。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥及其他疾病的患者提供創新和差異化的細胞療法,使癌癥及其他疾病可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
 ]]>
]]>
上海 2025年5月28日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家專注于開發創新CAR-T細胞療法的生物制藥公司宣布,舒瑞基奧侖賽注射液(產品編號:CT041,一款靶向Claudin18.2蛋白的自體CAR-T細胞治療候選產品)已被國家藥品監督管理局藥品審評中心納入優先審評,用于治療Claudin18.2表達陽性、至少二線治療失敗的晚期胃/食管胃結合部腺癌的患者。
關于舒瑞基奧侖賽注射液
舒瑞基奧侖賽注射液是一款潛在全球同類首創的、靶向Claudin18.2蛋白的自體CAR-T細胞治療候選產品,用于治療Claudin18.2陽性實體瘤,主要治療胃/食管胃結合部腺癌及胰腺癌。已開展的試驗包括在中國開展的研究者發起的臨床試驗(CT041-CG4006, NCT03874897),在中國開展的針對晚期胃/食管胃結合部腺癌的確證性II期臨床試驗(CT041-ST-01, NCT04581473),在中國開展的針對胰腺癌輔助治療的Ib期臨床試驗(CT041-ST-05, NCT05911217),在中國開展的用于胃/食管胃結合部腺癌患者術后輔助治療后鞏固治療的研究者發起的臨床試驗(CT041-CG4010,NCT06857786)以及在北美開展的針對晚期胃癌或胰腺癌的1b/2期臨床試驗(CT041-ST-02, NCT04404595)。2025年3月,舒瑞基奧侖賽注射液獲得了中國國家藥品監督管理局藥品審評中心授予的突破性治療藥物品種認定,擬定適應癥為既往接受過至少二線治療失敗的Claudin18.2表達陽性的晚期胃/食管胃結合部腺癌。2022年1月,舒瑞基奧侖賽注射液被美國FDA授予"再生醫學先進療法"(RMAT)認定用于治療Claudin18.2陽性的晚期胃/食管胃結合部腺癌。2020年9月,舒瑞基奧侖賽注射液被美國FDA授予"孤兒藥"認定用于治療胃/食管胃結合部腺癌。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家生物制藥公司,專注于開發創新CAR-T細胞療法,以滿足未滿足的臨床需求,包括但不限于血液惡性腫瘤、實體瘤及自身免疫性疾病。公司形成了從靶點發現、臨床前研究、產品臨床開發到商業規模生產的CAR-T細胞研究與開發的端到端能力。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法的挑戰,比如提高安全性,提高實體瘤治療的療效和降低治療成本等。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥及其他疾病的患者提供創新和差異化的細胞療法,使癌癥及其他疾病可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
 ]]>
]]>
上海2025年5月23日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家專注于開發創新CAR-T細胞療法的生物制藥公司宣布,舒瑞基奧侖賽注射液(產品編號:CT041,一款靶向Claudin18.2蛋白的自體CAR-T細胞治療候選產品)在中國開展的針對晚期胃癌/食管胃結合部癌的確證性II期臨床試驗(CT041-ST-01, NCT04581473)的研究結果摘要已于ASCO網站公布。
研究名稱
靶向Claudin18.2 CAR-T細胞(舒瑞基奧侖賽注射液)對比研究者選擇治療用于既往治療失敗的晚期胃/食管胃結合部癌患者:隨機、開放標簽、II期試驗(CT041-ST-01)的主要結果 Claudin18.2-specific CAR T cells (Satri-cel) versus treatment of physician's choice (TPC) for previously treated advanced gastric or gastroesophageal junction cancer (G/GEJC): Primary results from a randomized, open-label, phase II trial (CT041-ST-01)
摘要編號
4003
會議類型與名稱
口頭摘要會議——胃腸癌專題:胃食管癌、胰腺癌與肝膽癌 Oral Abstract Session – Gastrointestinal Cancer— Gastroesophageal, Pancreatic, and Hepatobiliary
口頭報告日期及時間
美國中部(夏令時)5月31日 下午3:00-6:00,即北京時間 2025年6月1日 凌晨4:00-7:00
這是一項在中國開展的開放標簽、多中心、隨機對照臨床試驗,旨在對比舒瑞基奧侖賽注射液與現有標準治療在Claudin18.2表達陽性、至少二線治療失敗晚期胃/食管胃結合部癌(G/GEJC)患者中的有效性和安全性。主要終點為獨立評審委員會(IRC)評價的無進展生存期(PFS),關鍵次要終點為總生存期(OS)。數據截止日期為2024年10月18日。
入組患者以2:1的比例隨機分配至舒瑞基奧侖賽組(satri-cel/CT041組)或研究者選擇治療組(TPC組)。舒瑞基奧侖賽組受試者將接受CT041輸注(250×106 /次,最多3次輸注)。TPC組受試者將根據研究者評估,接受一種標準治療(SOC)藥物(包括阿帕替尼、紫杉醇、多西他賽、伊立替康或納武利尤單抗)。TPC組受試者如出現疾病進展或藥物不耐受,根據研究者判斷可接受后續的CT041治療。
從2022年3月29日至2024年8月16日,共有156例受試者被隨機分配至CT041組(n=104)或TPC組(n=52)。其中,TPC組中有20例受試者接受了后續的CT041治療。所有受試者既往均接受過至少二線治療,CT041組和TPC組分別有26.9% vs 19.2%受試者接受過至少三線治療;Lauren彌漫型/混合型比例71.2% vs 65.4%;腹膜轉移比例69.2% vs 59.6%。
在ITT即所有隨機人群中:基于IRC評價,CT041較標準治療可顯著延長PFS(mPFS 3.25個月 vs 1.77個月;HR 0.366,95% CI:0.241,0.557;p<0.0001),達到本試驗的主要終點,患者疾病進展/死亡風險顯著下降達63%。同時OS顯示出明顯的獲益趨勢(mOS 7.92個月 vs 5.49個月;HR 0.693,95%CI:0.457,1.051;單側p=0.0416),即便在CT041組15.4%(16例)未能接受細胞輸注、TPC組近40%(20例)后續接受CT041輸注的情況下,CT041組患者死亡風險下降仍超過30%。
更為重要的是,在mITT即實際用藥人群中:兩組接受試驗藥物的受試者共136例,其中CT041組88例和TPC組48例。CT041組和TPC組基于IRC評價的mPFS為4.37個月 vs 1.84個月,HR 0.304(95%CI:0.195,0.474),患者疾病進展/死亡風險下降70%;mOS為8.61個月 vs 5.49個月,HR 0.601(95%CI:0385,0.939),死亡風險下降40%。以上結果顯示,在實際接受了細胞輸注的患者中,CT041的治療獲益更加明顯。
值得注意的是,TPC組20例接受CT041輸注受試者的mOS達到9.20個月。兩組所有接受CT041輸注的108例受試者(其中CT041組88例,TPC組20例)mOS達9.17個月,而TPC組28例未使用CT041治療者mOS僅3.98個月(HR 0.288;95%CI:0169,0.492)。由此進一步提示,CT041輸注可以為患者帶來明顯的生存獲益。
安全性方面,舒瑞基奧侖賽注射液治療的整體耐受性良好,僅4例發生3級細胞因子釋放綜合癥(CRS),無4-5級CRS,無任何免疫效應細胞相關神經毒性綜合征(ICANS)發生。
這是全球范圍內實體瘤CAR-T領域首個開展的確證性隨機對照試驗。研究結果顯示,在CLDN18.2表達陽性、至少二線治療失敗的G/GEJC患者中,舒瑞基奧侖賽對比標準治療可顯著改善PFS,并展現出有臨床意義的OS獲益,同時具有可控的安全性特征。上述結果支持舒瑞基奧侖賽成為晚期G/GEJC患者新的標準治療方案。
關于舒瑞基奧侖賽注射液
舒瑞基奧侖賽注射液是一款潛在全球同類首創的、靶向Claudin18.2蛋白的自體CAR-T細胞治療候選產品,用于治療Claudin18.2陽性實體瘤,主要治療胃癌/食管胃結合部腺癌及胰腺癌。已開展的試驗包括在中國開展的研究者發起的臨床試驗(CT041-CG4006, NCT03874897),在中國開展的針對晚期胃癌/食管胃結合部腺癌的確證性II期臨床試驗(CT041-ST-01, NCT04581473),在中國開展的針對胰腺癌輔助治療的I期臨床試驗(CT041-ST-05, NCT05911217),在中國開展的用于胃癌/食管胃結合部腺癌患者術后輔助治療后鞏固治療的研究者發起的臨床試驗(CT041-CG4010,NCT06857786)以及在北美開展的針對晚期胃癌或胰腺癌的1b/2期臨床試驗(CT041-ST-02, NCT04404595)。2025年3月,舒瑞基奧侖賽注射液獲得了中國國家藥品監督管理局藥品審評中心授予的突破性治療藥物品種認定,擬定適應癥為既往接受過至少二線治療失敗的Claudin18.2表達陽性的晚期胃癌/食管胃結合部腺癌。2022年1月,舒瑞基奧侖賽注射液被美國FDA授予"再生醫學先進療法"(RMAT)認定用于治療Claudin18.2陽性的晚期胃癌/食管胃結合部腺癌。2020年9月,舒瑞基奧侖賽注射液被美國FDA授予"孤兒藥"認定用于治療胃癌/食管胃結合部腺癌。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家生物制藥公司,專注于開發創新CAR-T細胞療法,以滿足未滿足的臨床需求,包括但不限于血液惡性腫瘤、實體瘤及自身免疫性疾病。公司形成了從靶點發現、臨床前研究、產品臨床開發到商業規模生產的CAR-T細胞研究與開發的端到端能力。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法的挑戰,比如提高安全性,提高實體瘤治療的療效和降低治療成本等。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥及其他疾病的患者提供創新和差異化的細胞療法,使癌癥及其他疾病可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/

上海 2025年5月12日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家專注于開發創新CAR-T細胞療法的生物制藥公司,公布了CT0596的初步臨床數據。CT0596為科濟藥業基于THANK-u Plus?平臺開發的一款靶向BCMA的通用型CAR-T細胞注射液,目前正在復發/難治性多發性骨髓瘤(R/R MM)或復發/難治性漿細胞白血病(R/R PCL)中開展一項早期探索性臨床研究,用于評估CT0596的安全耐受性及初步的有效性。
截止2025年5月6日,此項臨床研究已經完成8例至少經過三線治療后的R/R MM患者的細胞輸注,所用清淋方案為FC方案(氟達拉濱22.5-30 mg/m2,環磷酰胺為350-500 mg/m2),在最長4個月的隨訪中我們觀察到:
- 無劑量限制性毒性(DLT)、≥3級的細胞因子釋放綜合征(CRS)、免疫細胞治療相關神經毒性綜合征(ICANS)、或移植物抗宿主病(GVHD)等不良事件發生,患者總體耐受性良好;無患者因不良事件退出研究。
- 5例患者已完成首次第4周的療效評估,其中3例(60%)總體療效評估達到嚴格的完全緩解/完全緩解(sCR/CR),4例(80%)獲得骨髓微小殘留病(MRD)陰性;2例獲得第14天的早期療效觀測數據,可測量病灶的下降幅度即分別達到92%和65%以上;另外1例患者尚未達到方案規定療效監測時點。
- 所有sCR/CR患者均在持續緩解中,包括已完成第4個月訪視的首例患者。
基于已獲得的初步安全性及有效性數據,CT0596用于R/R MM患者總體耐受性良好,在所有預設劑量組都觀察到了CAR-T細胞的擴增,并出現了令人鼓舞的療效信號,在R/R MM、其他漿細胞腫瘤以及自身反應性漿細胞驅動的自身免疫性疾病中值得進一步探索。公司會在后續學術大會上分享更詳實的臨床試驗數據。公司預估下半年提交該品種的IND申請。
關于 THANK-u Plus?
科濟藥業基于其自主研發的THANK-uCAR®通用型CAR-T技術,開發了升級版的THANK-u Plus?平臺,以克服NKG2A表達水平對療效可能的影響。在不同NKG2A表達水平NK細胞的存在下,THANK-u Plus?均可持續擴增,并且擴增水平較THANK-uCAR®顯著提升。動物實驗顯示,THANK-u Plus?在NK細胞存在下的抗腫瘤療效顯著優于THANK-uCAR®。在此平臺下的通用型BCMA或CD19/CD20雙靶CAR-T在NK細胞存在時都顯示出極強的抗腫瘤療效,表明該平臺可廣泛用于多種通用型CAR-T細胞的研制。公司正在開發使用THANK-u Plus?平臺的通用型CAR-T細胞產品,以期提高CAR-T細胞的擴增、持久性及療效。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家生物制藥公司,專注于開發創新CAR-T細胞療法,以滿足未滿足的臨床需求,包括但不限于血液惡性腫瘤、實體瘤及自身免疫性疾病。公司形成了從靶點發現、臨床前研究、產品臨床開發到商業規模生產的CAR-T細胞研究與開發的端到端能力。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法的挑戰,比如提高安全性,提高實體瘤治療的療效和降低治療成本等。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥及其他疾病的患者提供創新和差異化的細胞療法,使癌癥及其他疾病可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
 ]]>
]]>
上海2025年3月19日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家專注于開發創新CAR-T細胞療法的生物制藥公司,已發布2024年度業績。
業績亮點速覽
- 賽愷澤®獲國家藥品監督管理局批準上市。
- 截至2024年12月31日,完成賽愷澤®認證及備案的醫療機構覆蓋全國23個省市、數量超過200家;科濟藥業從商業化合作伙伴華東醫藥獲得154份有效訂單。
- 舒瑞基奧侖賽注射液確證性II期試驗完成入組并達成主要終點,納入突破性治療藥物品種名單;計劃于2025年上半年在中國提交新藥上市申請。
- 舒瑞基奧侖賽注射液研究者發起的臨床試驗成果發表于《Nature Medicine》雜志及2024 ASCO年會。
- 利用THANK-uCAR®技術平臺開發的通用型CAR-T產品CT0590,IIT數據發表于2024 ASH年會。
- 開發了通用型CAR-T技術平臺THANK-u Plus?,作為THANK-uCAR®技術平臺的升級版;多款通用型CAR-T產品開發中,涵蓋血液惡性腫瘤、實體瘤、自身免疫性疾病等領域。
- 引入珠海軟銀欣創投資以加速通用型CAR-T細胞產品在中國內地研發進程。
- 截至2024年12月31日,公司現金及銀行結余約為人民幣14.79億元,于2025年末的現金及現金等價物及存款預期將不少于人民幣10.80億元;預期將有充足現金支持運營到2028年。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"科濟藥業于2024年實現首個藥品商業化,并在重要管線和技術創新方面取得關鍵進展。展望未來,我們將繼續開發創新的CAR-T細胞產品,以滿足重大的未滿足的醫療需求。"
賽愷澤®獲國家藥品監督管理局批準上市
賽愷澤®(澤沃基奧侖賽注射液,研發代號CT053)是一種全人源B細胞成熟抗原(BCMA)自體CAR-T細胞產品,于2024年2月23日獲國家藥品監督管理局(NMPA)批準上市,用于治療復發或難治性多發性骨髓瘤(R/R MM)成人患者,既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)。科濟藥業與華東醫藥已就在中國大陸地區商業化賽愷澤®簽訂合作協議。截至2024年12月31日,賽愷澤®完成認證及備案的醫療機構覆蓋全國23個省市、數量超過200家,公司共計從華東醫藥獲得154份有效訂單。
賽愷澤®中國II期注冊臨床試驗的更新結果已在第29屆歐洲血液學協會(EHA)年會上進行口頭報告,亞組分析結果亦已在第66屆ASH年會上進行壁報展示。公司預計,隨著營銷活動的持續進行及保險覆蓋范圍的擴大,賽愷澤®的銷售收入增長將進一步加速。
舒瑞基奧侖賽注射液確證性II期試驗達成主要終點,計劃提交NDA
舒瑞基奧侖賽注射液(研發代號CT041)是一種潛在全球同類首創的、靶向Claudin18.2蛋白的自體CAR-T細胞候選產品,用于治療Claudin18.2陽性實體瘤,主要治療胃癌/食管胃結合部腺癌(GC/GEJ)及胰腺癌(PC)。在中國用于治療晚期GC/GEJ的確證性II期試驗(CT041-ST-01,NCT04581473)已完成患者入組工作并已達成試驗主要終點,即由獨立評審委員會(IRC)評估的無進展生存期(PFS)具有統計學意義上的顯著改善。與研究者選擇治療組(包括紫杉醇、多西他賽、伊立替康、阿帕替尼或納武利尤單抗)相比,舒瑞基奧侖賽注射液組中的受試者的PFS具有統計學意義上的顯著改善。基于確證性II期的臨床數據,舒瑞基奧侖賽注射液被國家藥品監督管理局藥品審評中心納入突破性治療藥物品種名單。
公司計劃于2025年上半年在中國向NMPA提交舒瑞基奧侖賽注射液的新藥上市申請(NDA),該產品有望成為全球第一款針對實體瘤的CAR-T上市產品。
研究者發起的臨床試驗(CT041-CG4006,NCT03874897)的最新成果已于2024年6月發表于《Nature Medicine》雜志,并于同月在美國臨床腫瘤學會(ASCO)年會上進行口頭報告。亦有更多研究成果發表于《Journal of Clinical Oncology》《Journal for ImmunoTherapy of Cancer》等學術期刊。
一項針對PC輔助治療的I期臨床試驗(CT041-ST-05,NCT05911217)及一項針對GC/GEJ輔助治療的研究者發起的臨床試驗(CT041-CG4010,NCT06857786)正在中國開展。
大力推進多款通用型CAR-T細胞產品開發
除自體產品外,科濟藥業還利用專有THANK-uCAR®平臺推進差異化的通用型/同種異體CAR-T細胞產品。公司亦開發了THANK-u Plus?平臺,作為其專有THANK-uCAR®通用型CAR-T技術的升級版,以克服NKG2A表達水平對療效可能的影響。
公司利用THANK-uCAR®技術平臺開發了靶向BCMA的通用型CAR-T細胞候選產品CT0590,用于治療R/R MM及R/R PCL,研究者發起的臨床試驗(IIT)的數據已于2024年12月在第66屆ASH年會上進行壁報展示。數據顯示,CT0590在sCR患者中實現了20個月以上的緩解持續時間(DoR),CAR拷貝數峰值大于280,000 copies/ug gDNA,與自體BCMA CAR-T相當,初步體現出療效的持久性。
此外,還有多款通用型CAR-T產品正在開發中,涵蓋血液惡性腫瘤、實體瘤、自身免疫性疾病等領域:
- CT059X - 靶向BCMA,用于治療R/R MM及R/R PCL,IIT首例患者在第28天訪視療效評估為sCR;
- KJ-C2219 - 靶向CD19/CD20,用于治療B細胞腫瘤,以及系統性紅斑狼瘡和系統性硬皮病,IIT已啟動;
- KJ-C2320 - 靶向CD38,用于治療AML,IIT已啟動;
- KJ-C2114 - 用于治療實體瘤;
- KJ-C2526 - 靶向NKG2DL,用于治療AML、其他惡性腫瘤,以及抗衰老。
2025年2月25日,科濟藥業宣布與珠海橫琴軟銀欣創股權投資管理企業(有限合伙)("珠海軟銀欣創")旗下管理的基金計劃達成協議,共同投資優愷澤生物醫藥(上海)有限公司("優愷澤"),以加速通用型CAR-T細胞產品在中國內地研發進程。根據協議條款,優愷澤獲得科濟藥業治療多發性骨髓瘤、漿細胞白血病的通用型BCMA CAR-T細胞產品以及治療B細胞腫瘤的通用型CD19/CD20 CAR-T細胞產品在中國內地的研發、生產與商業化的獨家權利。珠海軟銀欣創旗下的基金計劃以人民幣80,000,000元認購優愷澤新增注冊資本,從而持有優愷澤交易完成后注冊資本的8%,科濟藥業于優愷澤的權益將由100%攤薄至92%。
財務摘要
截至2024年12月31日止年度,公司收益約為人民幣3,940萬元,主要來自賽愷澤®,以出廠價格而非終端市場價進行計算。我們的收益于完成產品的出廠交付后確認。此外,截至2024年12月31日止年度,公司就賽愷澤®從華東醫藥獲得里程碑付款人民幣7,500萬元。由于CAR-T生產存在必需的時間周期,從華東醫藥獲得的訂單數量與出廠交付的數量存在差異。截至2024年12月31日止年度,公司毛利約為人民幣1,480萬元,銷售成本約為人民幣2,470萬元。于商業化階段,我們彰顯了強大的成本競爭優勢,主要由于我們自主生產的質粒及載體產出穩定,每批產量很高。
截至2024年12月31日,公司現金及銀行結余約為人民幣14.79億元。于2025年末的現金及現金等價物及存款預期將不少于人民幣10.80億元。不考慮后續的現金流入的前提下,預期將有充足現金支持運營到2028年。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家生物制藥公司,專注于開發創新CAR-T細胞療法,以滿足未滿足的臨床需求,包括但不限于血液惡性腫瘤、實體瘤及自身免疫性疾病。公司建立了從靶點發現、臨床前研究、產品臨床開發到商業規模生產的CAR-T細胞研究與開發的端到端能力。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法的挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本等。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥及其他疾病的患者提供創新和差異化的細胞療法,使癌癥及其他疾病可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2025年3月3日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,公司自主研發的舒瑞基奧侖賽注射液(研發代碼:CT041)已被國家藥品監督管理局藥品審評中心納入突破性治療藥物品種名單,擬定適應癥為既往接受過至少二線治療失敗的Claudin18.2表達陽性的晚期胃/食管胃結合部腺癌。
公司預計將于2025年上半年向國家藥品監督管理局遞交舒瑞基奧侖賽注射液的新藥上市申請。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"我們正在全力推進CT041的上市申請準備工作。我們很高興CT041能獲得突破性治療藥物品種,這將有望加速該產品的上市并早日惠及患者。"
關于舒瑞基奧侖賽注射液
舒瑞基奧侖賽注射液是一種潛在全球同類首創的、靶向Claudin18.2蛋白的自體CAR-T細胞候選產品,用于治療Claudin18.2陽性實體瘤,主要治療胃癌/食管胃結合部腺癌及胰腺癌。相關試驗包括在中國開展的研究者發起的臨床試驗(CT041-CG4006,NCT03874897),在中國開展的針對晚期胃/食管胃結合部腺癌的確證性II期臨床試驗(CT041-ST-01,NCT04581473),在中國開展的針對胰腺癌輔助治療的I期臨床試驗(CT041-ST-05,NCT05911217),以及在北美開展的針對晚期胃癌或胰腺癌的1b/2期臨床試驗(CT041-ST-02,NCT04404595)。2022年1月,舒瑞基奧侖賽注射液被美國食品藥品監督管理局(FDA)授予"再生醫學先進療法"(RMAT)認定用于治療Claudin18.2陽性的晚期胃癌/食管胃結合部腺癌。2020年9月,舒瑞基奧侖賽注射液被美國FDA授予"孤兒藥"認定用于治療胃癌/食管胃結合部腺癌。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
]]>
上海2025年2月28日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,公司自主研發的一款靶向CD19/CD20的通用型CAR-T細胞治療候選產品KJ-C2219,已在研究者發起的臨床試驗(IIT)中完成首例以臨床方案中起始劑量輸注的系統性紅斑狼瘡受試者給藥。
KJ-C2219基于THANK-u Plus?平臺開發,目前正在中國開展一項針對B細胞腫瘤的IIT,以及一項針對系統性紅斑狼瘡和系統性硬化癥的IIT。
關于THANK-u Plus?
科濟藥業基于其自主研發的THANK-uCAR® 通用型CAR-T技術,開發了升級版的THANK-u Plus?平臺,以克服NKG2A表達水平對療效可能的影響。在不同NKG2A表達水平NK細胞的存在下,THANK-u Plus?均可持續擴增,并且擴增水平較THANK-uCAR®顯著提升。動物實驗顯示,THANK-u Plus?在NK細胞存在下的抗腫瘤療效顯著優于THANK-uCAR®。在此平臺下的通用型BCMA或CD19/CD20雙靶CAR-T在NK存在時都顯示出極強的抗腫瘤療效,表明該平臺可廣泛用于多種通用型CAR-T細胞的研制。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
]]>
上海2025年2月25日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,宣布與珠海橫琴軟銀欣創股權投資管理企業(有限合伙)("珠海軟銀欣創")旗下管理的基金計劃達成協議,共同投資優愷澤生物醫藥(上海)有限公司("優愷澤"),一家在中國內地專注于利用通用型CAR-T細胞療法治療血液瘤的新藥研發公司。
根據協議條款,優愷澤獲得科濟藥業治療多發性骨髓瘤、漿細胞白血病的通用型BCMA CAR-T細胞產品以及治療B細胞腫瘤的通用型CD19/CD20 CAR-T細胞產品在中國內地的研發、生產與商業化的獨家權利。珠海軟銀欣創旗下的基金計劃(該基金正在履行登記備案的相關程序之中)以人民幣80,000,000元認購優愷澤新增注冊資本,從而持有優愷澤交易完成后注冊資本的8%,科濟藥業于優愷澤的權益將由100%攤薄至92%。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
]]>
上海2025年2月10日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,基于THANK-u Plus?平臺開發的通用型BCMA CAR-T,其首例入組患者在第28天訪視療效評估為嚴格意義上的完全緩解(sCR)和微小殘留病(MRD)陰性。
該患者為復發/難治性多發性骨髓瘤IgA-λ型(R-ISS分期II期),既往曾經接受過3線聯合藥物治療和自體造血干細胞移植,末次治療后疾病進展入組臨床試驗。患者接受臨床方案中的最低劑量組的CAR-T細胞輸注后發生1級CRS,予以退熱、托珠單抗治療后恢復,未見ICANS和其他CAR-T治療免疫相關不良反應,整體安全性良好。
該CAR-T產品計劃用于治療復發/難治性多發性骨髓瘤(R/R MM)或復發/難治性漿細胞白血病(R/R PCL)。公司預估于今年下半年分享更多數據信息。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"THANK-u Plus?平臺是科濟自主研發的通用型CAR-T技術平臺,旨在解決CAR-T的可及性問題。我們很興奮地觀察到首個患者的CAR-T擴增和初步積極的療效,讓我們對通用型CAR-T的未來充滿了信心。我們也非常感謝研究者的大力支持和患者的積極參與,以更早地滿足未被滿足的醫療需求。"
關于THANK-u Plus?
科濟藥業基于其自主研發的THANK-uCAR® 通用型CAR-T技術,開發了升級版的THANK-u Plus?平臺,以克服NKG2A表達水平對療效可能的影響。在不同NKG2A表達水平NK細胞的存在下,THANK-u Plus?均可持續擴增,并且擴增水平較THANK-uCAR®顯著提升。動物實驗顯示,THANK-u Plus?在NK細胞存在下的抗腫瘤療效顯著優于THANK-uCAR®。在此平臺下的同種異體BCMA或CD19/CD20雙靶CAR-T在NK存在時都顯示出極強的抗腫瘤療效,表明該平臺可廣泛用于多種通用型CAR-T細胞的研制。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
]]>
上海2025年1月20日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,公司自主研發的一款靶向CD38的通用型CAR-T細胞治療候選產品KJ-C2320已完成研究者發起的臨床試驗(IIT)的首例受試者給藥。
KJ-C2320基于THANK-uCAR®平臺開發,正在中國開展一項針對復發/難治性急性髓系白血病(R/R AML)的研究者發起的臨床試驗。
關于THANK-uCAR®
THANK (Target to Hinder the Attack of NK cells)-uCAR®為科濟藥業的專有技術,通過修飾供體來源的T細胞,產生具有更好擴增和持久性的通用型CAR-T細胞。為了盡可能減少通用型T細胞的移植物抗宿主病(GvHD)和宿主抗移植物反應(HvGR),我們破壞了編碼TCR和β2微球蛋白(B2M)的基因組位點,以消除TCR和人類白細胞I類抗原(HLA-I)的細胞表面表達,這種方法已經被先前的研究所驗證。然而,由于自然殺傷(NK)細胞會攻擊沒有HLA-I表達的T細胞,進而限制了通用型CAR-T細胞的擴增和持久性。為了保護通用型CAR-T細胞免受患者NK細胞的攻擊,我們將一種識別NKG2A的CAR裝載到TCR-/B2M-T細胞中,以阻止NKG2A陽性NK細胞對CAR-T細胞的排異,從而使THANK-uCAR-T細胞抵抗NK細胞的攻擊。臨床研究顯示,基于THANK-uCAR®平臺開發的BCMA CAR-T在完全緩解的患者體內可擴增到與自體CAR-T相當的水平,初步展現了可控的安全性和良好的療效。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站 https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
]]>
上海2025年1月13日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,公司自主研發的一款靶向CD19/CD20的通用型CAR-T細胞治療候選產品KJ-C2219已完成研究者發起的臨床試驗(IIT)的首例受試者給藥。
KJ-C2219基于THANK-u Plus平臺開發,計劃用于治療血液惡性腫瘤和自身免疫性疾病,目前正在中國開展一項針對復發/難治性B細胞非霍奇金淋巴瘤(R/R B-NHL)的研究者發起的臨床試驗。
關于THANK-u Plus
科濟藥業基于其自主研發的THANK-uCAR® 通用型CAR-T技術,開發了升級版的THANK-u Plus平臺,以克服NKG2A表達水平對療效可能的影響。在不同NKG2A表達水平NK細胞的存在下,THANK-u Plus均可持續擴增,并且擴增水平較THANK-uCAR®顯著提升。動物實驗顯示,THANK-u Plus在NK細胞存在下的抗腫瘤療效顯著優于THANK-uCAR®。在此平臺下的同種異體BCMA或CD19/CD20雙靶CAR-T在NK存在時都顯示出極強的抗腫瘤療效,表明該平臺可廣泛用于多種通用型CAR-T細胞的研制。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站 https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
]]>
上海2024年12月31日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,公司自主研發的一款靶向CD19/CD20的通用型CAR-T細胞治療候選產品KJ-C2219已在中國啟動一項針對復發/難治性B細胞非霍奇金淋巴瘤(R/R B-NHL)的研究者發起的臨床試驗(IIT)。
KJ-C2219基于THANK-u Plus平臺開發,計劃用于治療血液惡性腫瘤和自身免疫性疾病。
關于THANK-u Plus
科濟藥業基于其自主研發的THANK-uCAR® 通用型CAR-T技術,開發了升級版的THANK-u Plus平臺,以克服NKG2A表達水平對療效可能的影響。在不同NKG2A表達水平NK細胞的存在下,THANK-u Plus均可持續擴增,并且擴增水平較THANK-uCAR®顯著提升。動物實驗顯示,THANK-u Plus在NK細胞存在下的抗腫瘤療效顯著優于THANK-uCAR®。在此平臺下的同種異體BCMA或CD19/CD20雙靶CAR-T在NK存在時都顯示出極強的抗腫瘤療效,表明該平臺可廣泛用于多種通用型CAR-T細胞的研制。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
]]>
上海2024年12月30日 /美通社/ -- 2024年12月30日,科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,關鍵II期臨床試驗CT041-ST-01(NCT04581473)已取得陽性結果。該試驗是一項在中國進行的隨機對照、多中心的臨床試驗,旨在評估舒瑞基奧侖賽注射液(研發代碼:CT041,一種靶向Claudin18.2自體CAR-T細胞候選產品)治療Claudin18.2表達陽性、既往接受過至少2線治療失敗的晚期胃/食管胃結合部腺癌的有效性和安全性,受試者以2:1的比例隨機分配至舒瑞基奧侖賽注射液組或研究者選擇治療組(包括紫杉醇、多西他賽、伊立替康、阿帕替尼或納武利尤單抗)。該試驗的主要終點為由獨立評審委員會(IRC)評價的無進展生存期(PFS)。該試驗主要終點已達成,即:與研究者選擇治療組相比,舒瑞基奧侖賽注射液組中的受試者的無進展生存期具有統計學意義上的顯著改善。既往試驗數據表明,該產品安全性可控。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"非常高興看到舒瑞基奧侖賽在中國關鍵II期臨床試驗中取得了陽性結果,研究表明舒瑞基奧侖賽為既往接受過至少2線治療失敗的胃癌患者帶來了顯著的獲益,這對于實體瘤CAR-T領域具有開拓性的重大意義。我們預計將于2025年上半年向NMPA遞交新藥上市申請,期待舒瑞基奧侖賽能成為全球首款針對實體瘤的CAR-T產品,早日惠及廣大患者。我們也會持續探索舒瑞基奧侖賽針對胃癌或胰腺癌的術后輔助治療,以期為患者帶來更大的獲益。"
關于舒瑞基奧侖賽注射液
舒瑞基奧侖賽注射液是一種潛在全球同類首創的、靶向Claudin18.2蛋白的自體CAR-T細胞候選產品,用于治療Claudin18.2陽性實體瘤,主要治療胃癌/食管胃結合部腺癌及胰腺癌。正在進行的試驗包括在中國開展的研究者發起的臨床試驗(CT041-CG4006, NCT03874897),在中國開展的針對晚期胃/食管胃結合部腺癌的確證性II期臨床試驗(CT041-ST-01, NCT04581473),在中國開展的針對胰腺癌輔助治療的I期臨床試驗(CT041-ST-05, NCT05911217),以及在北美開展的針對晚期胃癌或胰腺癌的1b/2期臨床試驗(CT041-ST-02, NCT04404595)。2022年1月,舒瑞基奧侖賽注射液被美國FDA授予"再生醫學先進療法"(RMAT)認定用于治療Claudin18.2陽性的晚期胃癌/食管胃結合部腺癌。2020年,舒瑞基奧侖賽注射液被美國FDA授予"孤兒藥"認定用于治療胃癌/食管胃結合部腺癌。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
]]>
上海2024年11月6日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,賽愷澤®(澤沃基奧侖賽注射液)、CT071和CT0590的數據將于第66屆美國血液學會("ASH")年會上以壁報形式展示,大會將于2024年12月7日至10日舉辦。上述產品的摘要已在ASH官網公布。
科濟藥業首席醫學官Raffaele Baffa博士表示:"科濟在血液瘤領域布局了多款強有力的管線產品,包括自體CAR-T產品澤沃基奧侖賽注射液、快速生產的CT071,以及通用型CAR-T產品CT0590。這些產品彰顯了科濟在血液瘤領域的持續創新。借助自主研發的CARcelerate®和THANK-uCAR®等技術平臺,科濟致力于開發差異化的CAR-T細胞療法,以應對臨床面臨的重大挑戰。我們期待在大會上與大家分享新的數據,相信我們的CAR-T細胞療法將有潛力惠及全球患者。"
Subgroup Analyses of Phase 2 Study: Evaluating the Efficacy of Fully Human BCMA-Targeting CAR T Cells (Zevorcabtagene Autoleucel) in Patients with Relapsed/Refractory Multiple Myeloma (II期研究的亞組分析:評估全人源BCMA CAR-T細胞(澤沃基奧侖賽注射液)在復發/難治性多發性骨髓瘤患者中的療效)
編號:4762
展示時間:2024年12月9日,周一,6:00 PM - 8:00 PM(太平洋標準時間)/ 2024年12月10日,周二,10:00 AM – 12:00 PM(北京時間)
在102例接受過≥3線治療(包括一種免疫調節藥物和一種蛋白酶體抑制劑)的復發/難治性多發性骨髓瘤(RRMM)患者中,客觀緩解率(ORR)為92.2%,嚴格意義上的完全緩解(sCR)或完全緩解(CR)率為71.6%。ORR或CR/sCR率不受任何分析中的基線特征的影響。中位隨訪20.3個月(范圍:0.4至27個月),中位緩解持續時間(DOR)、無進展生存期(PFS)和總生存期(OS)數據尚未成熟,因此采用18個月和估算的30個月的無事件率作為亞組分析的療效指標。年齡或國際分期系統(ISS)分期對DOR、PFS和OS均無影響。
LUMMICAR STUDY 1 關鍵性 II 期研究的亞組分析表明,基線特征對賽愷澤®的臨床有效性影響不大,進一步說明即使是預后不良的 RRMM 患者也能夠從賽愷澤®中獲益。
GPRC5D-Targeted CAR T-Cell Therapy CT071 for the Treatment of Refractory/Relapsed Multiple Myeloma (靶向GPRC5D的CAR-T細胞療法CT071在難治/復發性多發性骨髓瘤治療中的應用)
編號:3451
展示時間:2024年12月8日,周日,6:00 PM - 8:00 PM(太平洋標準時間)/ 2024年12月9日,周一,10:00 AM – 12:00 PM(北京時間)
CT071是一種全人源的靶向GPRC5D的自體CAR-T細胞產品,采用快速生產的CARcelerate®平臺生產,使生產時間縮短至約30小時,極大地減少了從單采到回輸的時間。入組的患者均為復發/難治性多發性骨髓瘤(RRMM)患者,既往至少三線治療失敗或2類抗多發性骨髓瘤治療藥物耐藥(即至少1種蛋白酶體抑制劑和至少1種免疫調節劑治療后出現進展或未獲得緩解)。入組時處于疾病進展狀態。所有患者的ECOG評分為0-2。在17例接受CT071治療的患者中,11例(64.7%)出現了細胞因子釋放綜合癥(CRS),均為1級(8例)或2級(3例)。未觀察到免疫效應細胞相關神經毒性綜合癥(ICANS)。未發生劑量限制性毒性(DLT)。
總體緩解率(ORR)為94.1%(16/17),嚴格意義上的完全緩解(sCR)率為52.9%(9/17)。值得注意的是,有7例患者在第4周時獲得了CR或sCR。既往接受過 BCMA 或 BCMA/CD19 CAR T 治療的4例患者均獲得了緩解(2例sCR,2例PR)。
A First-in-Human Study of CT0590, a Triple Knock-out, Allogeneic CAR T-Cell Therapy Targeting BCMA and NKG2A, in Subjects with Relapsed/Refractory Multiple Myeloma (CT0590:一種靶向BCMA和NKG2A的三重基因敲除異體CAR-T細胞療法在復發/難治性多發性骨髓瘤患者中的首次人體研究)
編號:4843
展示時間:2024年12月9日,周一,6:00 PM - 8:00 PM(太平洋標準時間)/ 2024年12月10日,周二,10:00 AM – 12:00 PM(北京時間)
CT0590是一種異體雙靶點的CAR-T細胞療法,采用THANK-uCAR®技術,靶向BCMA和NKG2A(一種在NK細胞和T細胞上表達的膜蛋白),TRAC/B2M/NKG2A三重基因敲除,以減少移植物抗宿主病(GvHD)、宿主免疫排斥和自相殘殺。
本研究為CT0590在復發/難治性多發性骨髓瘤(RRMM)患者中進行的首次人體(FIH)、開放標簽、單中心 I 期研究,旨在評估CT0590的安全性、耐受性、藥代動力學及初步療效(NCT05066022)。截至2024年4月22日,已有5例受試者入組,包括4例RRMM患者和1例同情用藥的原發性漿細胞白血病(pPCL)患者。
未觀察到≥3級細胞因子釋放綜合癥(CRS)。未觀察到免疫效應細胞相關神經毒性綜合癥(ICANS)或移植物抗宿主病(GvHD)。未發生劑量限制性毒性,也沒有因不良事件導致退出研究或死亡。
中位隨訪時間為16.6個月(范圍:5.1至24.2個月)時,有3例患者獲得緩解,包括2例sCR和1例PR。2例sCR患者中,其中1例 RRMM 患者的緩解持續時間(DOR)已達23個月(sCR仍在持續中),另1例pPCL患者的DOR為20個月。在這2例sCR患者中,CAR拷貝數峰值大于280,000 copies/µg genomic DNA。
本研究的初步結果表明,CT0590通用型CAR-T細胞療法的安全性可控,同時實現了深度和持久的臨床緩解。
關于賽愷澤®
賽愷澤®(澤沃基奧侖賽注射液,產品編號:CT053)是一種用于治療復發或難治性多發性骨髓瘤的全人源自體BCMA CAR-T細胞產品。國家藥品監督管理局于2024年2月23日批準賽愷澤®新藥上市申請,用于治療復發或難治性多發性骨髓瘤成人患者,既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)。科濟藥業正在北美推進1b/2期臨床試驗(LUMMICAR STUDY 2),以評估澤沃基奧侖賽注射液用于治療復發或難治性多發性骨髓瘤的安全性及療效。
澤沃基奧侖賽注射液于2019年獲得美國FDA的再生醫學先進療法(RMAT)及孤兒藥稱號,以及先后于2019年及2020年獲得歐洲藥品管理局(EMA)的優先藥物(PRIME)及孤兒藥產品稱號。
關于CT071
CT071是一款科濟藥業基于CARcelerate®專有平臺開發的靶向GPRC5D的CAR-T細胞治療候選產品,用于治療復發/難治多發性骨髓瘤或復發/難治漿細胞白血病。一項研究者發起的臨床試驗(NCT05838131)正在中國開展,旨在評估CT071治療復發/難治多發性骨髓瘤或漿細胞白血病的安全性和有效性。另一項研究者發起的試驗 (NCT06407947) 正在中國開展,用于治療新診斷的多發性骨髓瘤 (NDMM)。
關于CT0590
CT0590是一種利用科濟藥業的THANK-uCAR®技術靶向BCMA的同種異體CAR-T細胞候選產品。一項研究者發起的臨床試驗正在中國開展,旨在初步評估CT0590治療復發或難治多發性骨髓瘤的安全性和療效。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站 https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
]]>
上海2024年11月1日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,美國食品藥品監督管理局("FDA")已解除在美國的澤沃基奧侖賽注射液(zevor-cel,CT053,一種靶向BCMA的自體CAR-T細胞產品)、舒瑞基奧侖賽注射液(satri-cel,CT041,一種靶向Claudin18.2的自體CAR-T細胞產品)以及CT071(一種靶向GPRC5D的自體CAR-T細胞產品)的臨床試驗暫停。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中"主要風險和不確定性"標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
]]>
上海2024年8月29日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,發布了2024中期業績。
業績亮點速覽
- 賽愷澤®獲國家藥品監督管理局批準上市
- 舒瑞基奧侖賽注射液(CT041)中國確證性II期試驗完成患者入組
- 多項實體瘤CAR-T輔助治療研究積極開展
- 舒瑞基奧侖賽注射液、賽愷澤®、CT071臨床數據于學術大會發表
- 快速推進差異化同種異體CAR-T產品管線開發
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"在過去的半年中,我們在推動技術創新、產品研發和業務運營方面取得了重大的進展。賽愷澤®在中國成功獲批上市,并被納入近20個省市的惠民保及商業保險,為復發/難治多發性骨髓瘤患者帶來了新的希望。舒瑞基奧侖賽注射液的中國確證性II期試驗已完成患者入組,未來有望成為全球首款實體瘤CAR-T上市產品。我們也在積極探索舒瑞基奧侖賽在早線及術后輔助治療的潛力,以期為患者帶來更大的臨床獲益。此外,我們也在快速推進基于CARcelerate®平臺快速生產的CT071,并持續開發基于THANK-uCAR®平臺的多個同種異體CAR-T產品,以提高患者可及性。"
一、賽愷澤®中國上市及商業化進展
賽愷澤®(澤沃基奧侖賽注射液,CT053)是一種全人源B細胞成熟抗原(BCMA)自體CAR-T細胞產品,于2024年2月23日獲國家藥品監督管理局批準上市,用于治療復發或難治性多發性骨髓瘤(R/R MM)成人患者,既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)。科濟藥業正在與華東醫藥就賽愷澤®在中國大陸地區商業化開展合作。截至2024年7月31日,賽愷澤®被納入近20個省或市的惠民保及商業保險,完成認證及備案的醫療機構覆蓋全國19個省市、數量超過100家,我們共計從華東醫藥獲得52份訂單。
截至2024年6月30日止六個月,本集團的收益約為人民幣600多萬元,主要來自賽愷澤®,其中賽愷澤®的主要收入是以出廠價格進行計算的,而不是以終端市場價進行計算的。我們的收益于完成產品的出廠交付后確認。此外,截至2024年6月30日止六個月,本公司就賽愷澤®從華東醫藥獲得里程碑付款人民幣7500萬元。由于CAR-T生產存在必需的時間周期,這導致從華東醫藥獲得的訂單數量與出廠交付的數量存在差異。
二、差異化CAR-T管線進展
舒瑞基奧侖賽注射液(CT041)是一種靶向Claudin18.2的自體人源化CAR-T細胞產品。在中國用于治療胃癌/胃食管結合部腺癌(GC/GEJ)的確證性II期試驗(NCT04581473)已完成患者入組工作。與美德納公司的合作正在進行中,目前正在開展美德納的在研Claudin18.2 mRNA產品與舒瑞基奧侖賽注射液聯合使用的臨床前研究。
科濟藥業正積極擴展CAR-T在實體瘤術后治療中的應用,包括一項正在進行的用于胰腺癌的I期臨床試驗(CT041-ST-05,NCT05911217);一項正在啟動的用于胃癌/胃食管結合部腺癌的研究者發起的臨床試驗;及一項用于肝細胞癌的I期臨床試驗(CT011-HCC-03,NCT06560827)。
公司在血液瘤領域的研發管線重點包括CT071,CT071是一種靶向GPRC5D的自體全人源CAR-T細胞產品。CT071利用科濟藥業的CARcelerate®平臺開發,用于治療MM及原發性漿細胞白血病(pPCL)。CARcelerate®是科濟藥業開發的專有平臺,可將生產時間縮短至30小時左右,因此相較于傳統生產過程可制造出更年輕且可能更強效的CAR-T細胞。一項研究者發起的針對R/R MM及R/R PCL的臨床試驗(NCT05838131)及一項研究者發起的治療新診斷的多發性骨髓瘤(NDMM)的臨床試驗(NCT06407947)正在中國進行。CT071已于2023年11月獲得FDA的IND批準用于治療R/R MM及R/R pPCL。
除自體產品外,科濟藥業還在基于THANK-uCAR®平臺推進差異化的同種異體CAR-T細胞產品。產品包括:用于治療R/R MM及PCL的CT0590;用于治療急性髓系白血病的KJ-C2320;靶向CD19和CD20的、用于治療B細胞相關血液惡性腫瘤及自身免疫性疾病的KJ-C2219;及用于治療實體瘤的KJ-C2114。
三、臨床數據披露
賽愷澤®在中國進行的關鍵性II期注冊臨床試驗的更新結果已在2024 EHA年會上進行口頭報告。舒瑞基奧侖賽注射液研究者發起的臨床試驗(CT041-CG4006, NCT03874897)的最新數據已于6月發表于《Nature Medicine》雜志,并于2024年美國臨床腫瘤學會("ASCO")年會上進行口頭報告。舒瑞基奧侖賽用于治療難治性轉移性胰腺癌(PC)患者的安全性及療效的匯總分析(CT041-CG4006及CT041-ST-01 Ib)已發表于《Journal of Clinical Oncology》雜志。舒瑞基奧侖賽注射液美國1b期研究(CT041-ST-02,NCT04404595)結果已于2024年ASCO GI大會進行壁報展示。CT071研究者發起的用于治療R/R MM臨床試驗(NCT05838131)的結果已在2024 EHA年會上以壁報形式展示。公司預計于2024下半年披露CT071和CT0590數據更新。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2024年8月19日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,舒瑞基奧侖賽注射液(研發代號:CT041,一種靶向Claudin18.2自體CAR-T細胞候選產品)在中國進行的針對晚期胃癌/食管胃結合部腺癌的確證性II期臨床試驗,已按照臨床方案完成全部受試者的入組和隨機。
該試驗是一項在中國進行的開放標簽、多中心、隨機對照臨床試驗,旨在評估舒瑞基奧侖賽注射液治療Claudin18.2表達陽性、既往接受過至少2種治療失敗的晚期胃癌/食管胃結合部腺癌的有效性和安全性,對照組為研究者選擇治療(包括紫杉醇、多西他賽、伊立替康、阿帕替尼或納武利尤單抗)。
胃癌是中國最常見的惡性腫瘤之一,2022年中國胃癌新發病例約35.9萬,死亡病例約26.0萬[1]。晚期胃癌患者常常面臨治療選擇有限和預后較差的困境,亟需更創新和有效的治療手段。舒瑞基奧侖賽注射液是一種潛在全球同類首創的、靶向Claudin18.2的自體CAR-T細胞候選產品,主要治療胃癌/食管胃結合部腺癌及胰腺癌,已發表的臨床數據展示了其令人鼓舞的安全性和療效。
舒瑞基奧侖賽注射液研究者發起的I期臨床試驗CT041-CG4006(NCT03874897)最終結果已在《Nature Medicine》全文發表和2024 ASCO年會口頭報告。整體安全性可控,未觀察到劑量限制性毒性(DLTs),未觀察到3級或以上的細胞因子釋放綜合征(CRS),未觀察到免疫效應細胞相關神經毒性綜合征(ICANS)。在51例基線存在靶病灶的胃癌/食管胃結合部腺癌(GC/GEJ)患者中,舒瑞基奧侖賽注射液單藥治療的ORR和DCR分別達到54.9%(28/51)和96.1%(49/51),mDOR為6.4個月。[2][3]CT041-ST-01(NCT04581473)注冊性臨床試驗的Ib期數據已發表于2022 ASCO年會,進一步顯示出舒瑞基奧侖賽注射液可管理的安全性和有前景的療效。14例至少二線治療后的GC/GEJ患者接受了舒瑞基奧侖賽注射液單藥治療,未發生DLTs或治療相關死亡,未發生ICANS或胃腸道黏膜損傷。ORR和DCR分別為57.1%和78.6%。[4]
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"非常高興舒瑞基奧侖賽注射液中國確證性II期臨床試驗順利完成受試者的入組。這一重要的里程碑標志著我們在實體瘤CAR-T療法研發道路上又邁出了堅實的一步。感謝所有參與此次臨床試驗的研究者、患者及其家屬的支持和信任。我們期待早日在中國遞交新藥上市申請并獲得上市批準,造福更多胃癌患者。作為CAR-T療法領域的領軍企業之一,我們始終致力于解決現有CAR-T細胞療法面臨的重大挑戰,期待為癌癥患者帶來更多創新CAR-T產品。"
關于舒瑞基奧侖賽注射液
舒瑞基奧侖賽注射液是一種潛在全球同類首創的、靶向Claudin18.2蛋白的自體CAR-T細胞候選產品,用于治療Claudin18.2陽性實體瘤,主要治療胃癌/食管胃結合部腺癌及胰腺癌。正在進行的試驗包括在中國開展的研究者發起的臨床試驗(CT041-CG4006, NCT03874897),針對晚期胃癌/食管胃結合部腺癌的確證性II期臨床試驗(CT041-ST-01, NCT04581473),在中國開展的針對胰腺癌輔助治療的I期臨床試驗(CT041-ST-05, NCT05911217),以及在北美開展的針對晚期胃癌或胰腺癌的1b/2期臨床試驗(CT041-ST-02, NCT04404595)。2022年1月,舒瑞基奧侖賽注射液被美國FDA授予"再生醫學先進療法"(RMAT)認定用于治療Claudin18.2陽性的晚期胃癌/食管胃結合部腺癌。2021年11月,舒瑞基奧侖賽注射液被歐洲藥品管理局(EMA)授予優先藥物(PRIME)資格治療晚期胃癌。2020年和2021年,舒瑞基奧侖賽注射液分別被美國FDA授予"孤兒藥"認定用于治療胃癌/食管胃結合部腺癌和EMA授予"孤兒藥產品"認定用于治療晚期胃癌。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站 https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
參考文獻
[1] Han B, et al. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent. 2024 Feb 2;4(1):47-53. doi: 10.1016/j.jncc.2024.01.006 |
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
]]>