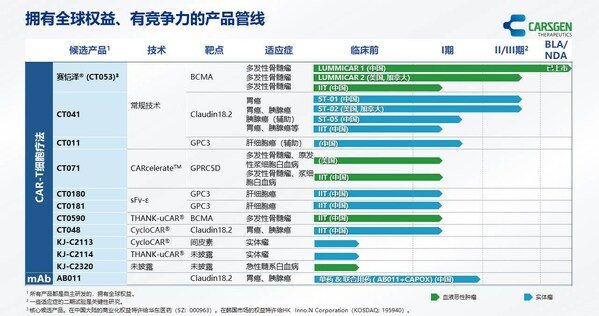
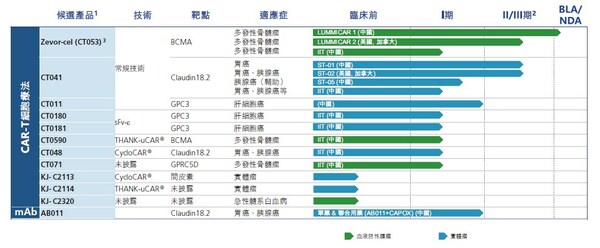
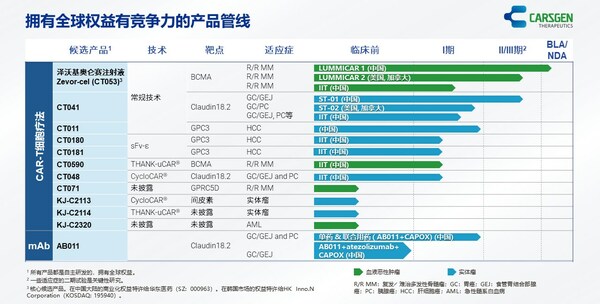
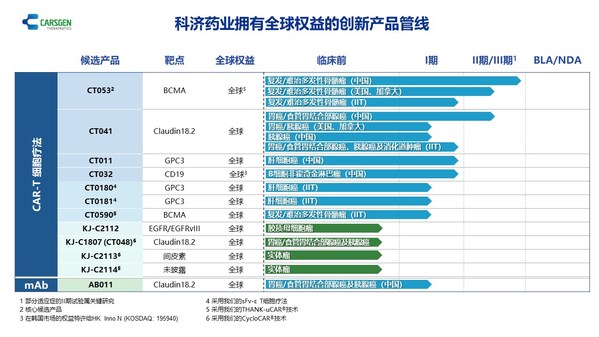
上海2025年8月15日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家專注于開發創新CAR-T細胞療法的生物制藥公司,已發布2025中期業績。
業績亮點速覽
- 截至2025年6月30日,現金及銀行結余約為人民幣12.61億元,于2025年末的現金及現金等價物及存款預期將不少于人民幣11.00億元;不考慮后續現金流入的前提下,預期將有充足現金支持運營到2028年。
- 2025年上半年,賽愷澤®完成認證及備案的醫療機構覆蓋全國20多個省市,科濟藥業共計從商業化合作伙伴華東醫藥獲得111份有效訂單。
- 舒瑞基奧侖賽注射液新藥上市申請(NDA)獲中國國家藥品監督管理局(NMPA)的藥品審評中心(CDE)受理。
- 舒瑞基奧侖賽注射液在中國的確證性II期臨床試驗研究結果發表于《柳葉刀》及2025 ASCO年會。
- 多款通用型CAR-T產品開發中,涵蓋血液惡性腫瘤、實體瘤、自身免疫性疾病等領域。
- 引入珠海軟銀欣創投資以加速通用型CAR-T細胞產品在中國內地研發進程。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"2025年上半年,我們在技術創新、產品研發、商業化等方面均取得可喜的成績,賽愷澤®銷量快速增長,舒瑞基奧侖賽成為全球首款提交NDA的針對實體瘤的CAR-T,同時我們也在持續開發多款通用型CAR-T,以期帶來更大的臨床獲益和提高可及性。"
財務摘要
截至2025年6月30日止六個月,科濟藥業的收益約為人民幣5,100萬元,主要來自賽愷澤®,是以出廠價格而非終端市場價進行計算的。我們的收益于完成產品的出廠交付后確認。由于CAR-T生產存在必需的時間周期,從華東醫藥獲得的訂單數量與出廠交付的數量存在差異。截至2025年6月30日止六個月,科濟藥業的毛利約為人民幣2,900萬元。于商業化階段,我們彰顯了強大的成本競爭優勢,主要由于我們自主生產的質粒及載體產出穩定,每批產量很高。
截至2025年6月30日,現金及銀行結余約為人民幣12.61億元,較截至2024年12月31日約人民幣14.79億元減少約人民幣2.18億元。該減少主要是由于支付研發開支、行政開支及資本開支投入所致。于2025年末的現金及現金等價物及存款預期將不少于人民幣11.00億元。不考慮后續的現金流入的前提下,我們預期將有充足現金支持運營到2028年。
賽愷澤®銷量快速增長
賽愷澤®(澤沃基奧侖賽注射液,研發代號:CT053)是一種全人源B細胞成熟抗原(BCMA)自體CAR-T細胞產品,已獲中國NMPA批準用于治療復發或難治性多發性骨髓瘤(R/R MM)成人患者,既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)。
科濟藥業與華東醫藥(000963.SZ)已就在中國大陸地區商業化賽愷澤®簽訂合作協議。在商業化落地方面,華東醫藥已組建獨立專業、全方位的商業化團隊全面推廣賽愷澤®,利用中國多層次保險體系,提高患者可及性。于2025年上半年,賽愷澤®完成認證及備案的醫療機構覆蓋全國20多個省市,科濟藥業共計從華東醫藥獲得111份有效訂單。我們預計,隨著營銷活動的持續進行及保險覆蓋范圍的擴大,賽愷澤®的銷售收益將進一步加快增長。
舒瑞基奧侖賽注射液中國NDA獲受理
舒瑞基奧侖賽注射液(研發代號:CT041)是一種靶向Claudin18.2(CLDN18.2)的自體人源化CAR-T細胞產品。2025年6月,中國NMPA的CDE已受理舒瑞基奧侖賽注射液的NDA,用于治療Claudin18.2表達陽性、至少二線治療失敗的晚期胃/食管胃結合部腺癌(G/GEJA)。舒瑞基奧侖賽注射液是全球首款且唯一一款進入NDA階段的用于治療實體瘤的CAR-T細胞產品。舒瑞基奧侖賽注射液于2025年5月獲CDE納入優先審評,并于2025年3月獲授予突破性治療藥物品種認定(BTD)。
舒瑞基奧侖賽注射液在中國的確證性II期的臨床試驗(NCT04581473)的研究結果已在《柳葉刀》(The Lancet)發表,并于2025年美國臨床腫瘤學會(ASCO)年會上進行口頭報告。研究結果顯示,舒瑞基奧侖賽對比標準治療可顯著改善無進展生存期(PFS),并展現出有臨床意義的總生存期(OS)獲益,同時具有可控的安全性特征。
多款通用型CAR-T細胞產品開發中
科濟藥業利用其專有THANK-uCAR®平臺推進差異化的通用型CAR-T細胞產品。公司最近開發了THANK-u Plus?平臺,作為THANK-uCAR®的升級版,以克服NKG2A表達水平對通用型CAR-T細胞產品療效可能的影響。
CT0596是一款利用THANK-u Plus?平臺治療R/R MM或R/R漿細胞白血病(PCL)的靶向BCMA通用型CAR-T細胞產品,正在中國開展研究者發起的臨床試驗。初步臨床數據已于2025年5月在公司官網發布。根據初步安全性及療效數據,CT0596用于R/R MM患者總體耐受性良好,在所有預設劑量組都觀察到了CAR-T細胞的擴增,并出現了令人鼓舞的療效信號。
多個通用型CAR-T產品亦正在開發中:
- KJ-C2219 - 靶向CD19/CD20,用于治療血液惡性腫瘤及自身免疫性疾病。2024年底啟動一項針對復發/難治性B細胞非霍奇金淋巴瘤(R/R B-NHL)的研究者發起的臨床試驗,2025年上半年啟動一項針對系統性紅斑狼瘡(SLE)和系統性硬化癥(SSc)的研究者發起的臨床試驗。
- KJ-C2320 - 靶向CD38,用于治療急性髓系白血病(AML),2024年底啟動一項研究者發起的臨床試驗。
- KJ-C2114 - 用于治療實體瘤。
- KJ-C2526 - 靶向NKG2DL,用于治療AML、其他惡性腫瘤,以及抗衰老。
2025年2月25日,科濟藥業與珠海橫琴軟銀欣創股權投資管理企業(有限合伙)旗下管理的基金達成協議。根據該協議,投資者同意以現金對價人民幣80,000,000元認購優愷澤生物醫藥(上海)有限公司("優愷澤")的新增注冊資本,占優愷澤增資后注冊資本的8%。本次增資完成后,科濟藥業于優愷澤的股份將由100%稀釋至92%。
優愷澤是一家在中國內地專注于利用通用型CAR-T細胞療法治療血液瘤的新藥研發公司。根據該等協議,優愷澤獲得科濟藥業治療多發性骨髓瘤、漿細胞白血病的通用型BCMA CAR-T細胞產品以及治療B細胞腫瘤的通用型CD19/CD20雙靶CAR-T細胞產品(不包括治療自身免疫性疾病的適應證)在中國內地的研發、生產與商業化的獨家權利。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家生物制藥公司,專注于開發創新CAR-T細胞療法,以滿足未滿足的臨床需求,包括但不限于血液惡性腫瘤、實體瘤及自身免疫性疾病。公司形成了從靶點發現、臨床前研究、產品臨床開發到商業規模生產的CAR-T細胞研究與開發的端到端能力。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法的挑戰,比如提高安全性,提高實體瘤治療的療效和降低治療成本等。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥及其他疾病的患者提供創新和差異化的細胞療法,使癌癥及其他疾病可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2025年3月19日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家專注于開發創新CAR-T細胞療法的生物制藥公司,已發布2024年度業績。
業績亮點速覽
- 賽愷澤®獲國家藥品監督管理局批準上市。
- 截至2024年12月31日,完成賽愷澤®認證及備案的醫療機構覆蓋全國23個省市、數量超過200家;科濟藥業從商業化合作伙伴華東醫藥獲得154份有效訂單。
- 舒瑞基奧侖賽注射液確證性II期試驗完成入組并達成主要終點,納入突破性治療藥物品種名單;計劃于2025年上半年在中國提交新藥上市申請。
- 舒瑞基奧侖賽注射液研究者發起的臨床試驗成果發表于《Nature Medicine》雜志及2024 ASCO年會。
- 利用THANK-uCAR®技術平臺開發的通用型CAR-T產品CT0590,IIT數據發表于2024 ASH年會。
- 開發了通用型CAR-T技術平臺THANK-u Plus?,作為THANK-uCAR®技術平臺的升級版;多款通用型CAR-T產品開發中,涵蓋血液惡性腫瘤、實體瘤、自身免疫性疾病等領域。
- 引入珠海軟銀欣創投資以加速通用型CAR-T細胞產品在中國內地研發進程。
- 截至2024年12月31日,公司現金及銀行結余約為人民幣14.79億元,于2025年末的現金及現金等價物及存款預期將不少于人民幣10.80億元;預期將有充足現金支持運營到2028年。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"科濟藥業于2024年實現首個藥品商業化,并在重要管線和技術創新方面取得關鍵進展。展望未來,我們將繼續開發創新的CAR-T細胞產品,以滿足重大的未滿足的醫療需求。"
賽愷澤®獲國家藥品監督管理局批準上市
賽愷澤®(澤沃基奧侖賽注射液,研發代號CT053)是一種全人源B細胞成熟抗原(BCMA)自體CAR-T細胞產品,于2024年2月23日獲國家藥品監督管理局(NMPA)批準上市,用于治療復發或難治性多發性骨髓瘤(R/R MM)成人患者,既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)。科濟藥業與華東醫藥已就在中國大陸地區商業化賽愷澤®簽訂合作協議。截至2024年12月31日,賽愷澤®完成認證及備案的醫療機構覆蓋全國23個省市、數量超過200家,公司共計從華東醫藥獲得154份有效訂單。
賽愷澤®中國II期注冊臨床試驗的更新結果已在第29屆歐洲血液學協會(EHA)年會上進行口頭報告,亞組分析結果亦已在第66屆ASH年會上進行壁報展示。公司預計,隨著營銷活動的持續進行及保險覆蓋范圍的擴大,賽愷澤®的銷售收入增長將進一步加速。
舒瑞基奧侖賽注射液確證性II期試驗達成主要終點,計劃提交NDA
舒瑞基奧侖賽注射液(研發代號CT041)是一種潛在全球同類首創的、靶向Claudin18.2蛋白的自體CAR-T細胞候選產品,用于治療Claudin18.2陽性實體瘤,主要治療胃癌/食管胃結合部腺癌(GC/GEJ)及胰腺癌(PC)。在中國用于治療晚期GC/GEJ的確證性II期試驗(CT041-ST-01,NCT04581473)已完成患者入組工作并已達成試驗主要終點,即由獨立評審委員會(IRC)評估的無進展生存期(PFS)具有統計學意義上的顯著改善。與研究者選擇治療組(包括紫杉醇、多西他賽、伊立替康、阿帕替尼或納武利尤單抗)相比,舒瑞基奧侖賽注射液組中的受試者的PFS具有統計學意義上的顯著改善。基于確證性II期的臨床數據,舒瑞基奧侖賽注射液被國家藥品監督管理局藥品審評中心納入突破性治療藥物品種名單。
公司計劃于2025年上半年在中國向NMPA提交舒瑞基奧侖賽注射液的新藥上市申請(NDA),該產品有望成為全球第一款針對實體瘤的CAR-T上市產品。
研究者發起的臨床試驗(CT041-CG4006,NCT03874897)的最新成果已于2024年6月發表于《Nature Medicine》雜志,并于同月在美國臨床腫瘤學會(ASCO)年會上進行口頭報告。亦有更多研究成果發表于《Journal of Clinical Oncology》《Journal for ImmunoTherapy of Cancer》等學術期刊。
一項針對PC輔助治療的I期臨床試驗(CT041-ST-05,NCT05911217)及一項針對GC/GEJ輔助治療的研究者發起的臨床試驗(CT041-CG4010,NCT06857786)正在中國開展。
大力推進多款通用型CAR-T細胞產品開發
除自體產品外,科濟藥業還利用專有THANK-uCAR®平臺推進差異化的通用型/同種異體CAR-T細胞產品。公司亦開發了THANK-u Plus?平臺,作為其專有THANK-uCAR®通用型CAR-T技術的升級版,以克服NKG2A表達水平對療效可能的影響。
公司利用THANK-uCAR®技術平臺開發了靶向BCMA的通用型CAR-T細胞候選產品CT0590,用于治療R/R MM及R/R PCL,研究者發起的臨床試驗(IIT)的數據已于2024年12月在第66屆ASH年會上進行壁報展示。數據顯示,CT0590在sCR患者中實現了20個月以上的緩解持續時間(DoR),CAR拷貝數峰值大于280,000 copies/ug gDNA,與自體BCMA CAR-T相當,初步體現出療效的持久性。
此外,還有多款通用型CAR-T產品正在開發中,涵蓋血液惡性腫瘤、實體瘤、自身免疫性疾病等領域:
- CT059X - 靶向BCMA,用于治療R/R MM及R/R PCL,IIT首例患者在第28天訪視療效評估為sCR;
- KJ-C2219 - 靶向CD19/CD20,用于治療B細胞腫瘤,以及系統性紅斑狼瘡和系統性硬皮病,IIT已啟動;
- KJ-C2320 - 靶向CD38,用于治療AML,IIT已啟動;
- KJ-C2114 - 用于治療實體瘤;
- KJ-C2526 - 靶向NKG2DL,用于治療AML、其他惡性腫瘤,以及抗衰老。
2025年2月25日,科濟藥業宣布與珠海橫琴軟銀欣創股權投資管理企業(有限合伙)("珠海軟銀欣創")旗下管理的基金計劃達成協議,共同投資優愷澤生物醫藥(上海)有限公司("優愷澤"),以加速通用型CAR-T細胞產品在中國內地研發進程。根據協議條款,優愷澤獲得科濟藥業治療多發性骨髓瘤、漿細胞白血病的通用型BCMA CAR-T細胞產品以及治療B細胞腫瘤的通用型CD19/CD20 CAR-T細胞產品在中國內地的研發、生產與商業化的獨家權利。珠海軟銀欣創旗下的基金計劃以人民幣80,000,000元認購優愷澤新增注冊資本,從而持有優愷澤交易完成后注冊資本的8%,科濟藥業于優愷澤的權益將由100%攤薄至92%。
財務摘要
截至2024年12月31日止年度,公司收益約為人民幣3,940萬元,主要來自賽愷澤®,以出廠價格而非終端市場價進行計算。我們的收益于完成產品的出廠交付后確認。此外,截至2024年12月31日止年度,公司就賽愷澤®從華東醫藥獲得里程碑付款人民幣7,500萬元。由于CAR-T生產存在必需的時間周期,從華東醫藥獲得的訂單數量與出廠交付的數量存在差異。截至2024年12月31日止年度,公司毛利約為人民幣1,480萬元,銷售成本約為人民幣2,470萬元。于商業化階段,我們彰顯了強大的成本競爭優勢,主要由于我們自主生產的質粒及載體產出穩定,每批產量很高。
截至2024年12月31日,公司現金及銀行結余約為人民幣14.79億元。于2025年末的現金及現金等價物及存款預期將不少于人民幣10.80億元。不考慮后續的現金流入的前提下,預期將有充足現金支持運營到2028年。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家生物制藥公司,專注于開發創新CAR-T細胞療法,以滿足未滿足的臨床需求,包括但不限于血液惡性腫瘤、實體瘤及自身免疫性疾病。公司建立了從靶點發現、臨床前研究、產品臨床開發到商業規模生產的CAR-T細胞研究與開發的端到端能力。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法的挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本等。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥及其他疾病的患者提供創新和差異化的細胞療法,使癌癥及其他疾病可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2024年8月29日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,發布了2024中期業績。
業績亮點速覽
- 賽愷澤®獲國家藥品監督管理局批準上市
- 舒瑞基奧侖賽注射液(CT041)中國確證性II期試驗完成患者入組
- 多項實體瘤CAR-T輔助治療研究積極開展
- 舒瑞基奧侖賽注射液、賽愷澤®、CT071臨床數據于學術大會發表
- 快速推進差異化同種異體CAR-T產品管線開發
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"在過去的半年中,我們在推動技術創新、產品研發和業務運營方面取得了重大的進展。賽愷澤®在中國成功獲批上市,并被納入近20個省市的惠民保及商業保險,為復發/難治多發性骨髓瘤患者帶來了新的希望。舒瑞基奧侖賽注射液的中國確證性II期試驗已完成患者入組,未來有望成為全球首款實體瘤CAR-T上市產品。我們也在積極探索舒瑞基奧侖賽在早線及術后輔助治療的潛力,以期為患者帶來更大的臨床獲益。此外,我們也在快速推進基于CARcelerate®平臺快速生產的CT071,并持續開發基于THANK-uCAR®平臺的多個同種異體CAR-T產品,以提高患者可及性。"
一、賽愷澤®中國上市及商業化進展
賽愷澤®(澤沃基奧侖賽注射液,CT053)是一種全人源B細胞成熟抗原(BCMA)自體CAR-T細胞產品,于2024年2月23日獲國家藥品監督管理局批準上市,用于治療復發或難治性多發性骨髓瘤(R/R MM)成人患者,既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)。科濟藥業正在與華東醫藥就賽愷澤®在中國大陸地區商業化開展合作。截至2024年7月31日,賽愷澤®被納入近20個省或市的惠民保及商業保險,完成認證及備案的醫療機構覆蓋全國19個省市、數量超過100家,我們共計從華東醫藥獲得52份訂單。
截至2024年6月30日止六個月,本集團的收益約為人民幣600多萬元,主要來自賽愷澤®,其中賽愷澤®的主要收入是以出廠價格進行計算的,而不是以終端市場價進行計算的。我們的收益于完成產品的出廠交付后確認。此外,截至2024年6月30日止六個月,本公司就賽愷澤®從華東醫藥獲得里程碑付款人民幣7500萬元。由于CAR-T生產存在必需的時間周期,這導致從華東醫藥獲得的訂單數量與出廠交付的數量存在差異。
二、差異化CAR-T管線進展
舒瑞基奧侖賽注射液(CT041)是一種靶向Claudin18.2的自體人源化CAR-T細胞產品。在中國用于治療胃癌/胃食管結合部腺癌(GC/GEJ)的確證性II期試驗(NCT04581473)已完成患者入組工作。與美德納公司的合作正在進行中,目前正在開展美德納的在研Claudin18.2 mRNA產品與舒瑞基奧侖賽注射液聯合使用的臨床前研究。
科濟藥業正積極擴展CAR-T在實體瘤術后治療中的應用,包括一項正在進行的用于胰腺癌的I期臨床試驗(CT041-ST-05,NCT05911217);一項正在啟動的用于胃癌/胃食管結合部腺癌的研究者發起的臨床試驗;及一項用于肝細胞癌的I期臨床試驗(CT011-HCC-03,NCT06560827)。
公司在血液瘤領域的研發管線重點包括CT071,CT071是一種靶向GPRC5D的自體全人源CAR-T細胞產品。CT071利用科濟藥業的CARcelerate®平臺開發,用于治療MM及原發性漿細胞白血病(pPCL)。CARcelerate®是科濟藥業開發的專有平臺,可將生產時間縮短至30小時左右,因此相較于傳統生產過程可制造出更年輕且可能更強效的CAR-T細胞。一項研究者發起的針對R/R MM及R/R PCL的臨床試驗(NCT05838131)及一項研究者發起的治療新診斷的多發性骨髓瘤(NDMM)的臨床試驗(NCT06407947)正在中國進行。CT071已于2023年11月獲得FDA的IND批準用于治療R/R MM及R/R pPCL。
除自體產品外,科濟藥業還在基于THANK-uCAR®平臺推進差異化的同種異體CAR-T細胞產品。產品包括:用于治療R/R MM及PCL的CT0590;用于治療急性髓系白血病的KJ-C2320;靶向CD19和CD20的、用于治療B細胞相關血液惡性腫瘤及自身免疫性疾病的KJ-C2219;及用于治療實體瘤的KJ-C2114。
三、臨床數據披露
賽愷澤®在中國進行的關鍵性II期注冊臨床試驗的更新結果已在2024 EHA年會上進行口頭報告。舒瑞基奧侖賽注射液研究者發起的臨床試驗(CT041-CG4006, NCT03874897)的最新數據已于6月發表于《Nature Medicine》雜志,并于2024年美國臨床腫瘤學會("ASCO")年會上進行口頭報告。舒瑞基奧侖賽用于治療難治性轉移性胰腺癌(PC)患者的安全性及療效的匯總分析(CT041-CG4006及CT041-ST-01 Ib)已發表于《Journal of Clinical Oncology》雜志。舒瑞基奧侖賽注射液美國1b期研究(CT041-ST-02,NCT04404595)結果已于2024年ASCO GI大會進行壁報展示。CT071研究者發起的用于治療R/R MM臨床試驗(NCT05838131)的結果已在2024 EHA年會上以壁報形式展示。公司預計于2024下半年披露CT071和CT0590數據更新。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決現有CAR-T細胞療法面臨的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為全球生物制藥領域的領導者,為全球癌癥患者提供創新和差異化的細胞療法,使癌癥可治愈。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2024年6月4日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,CT041(satricabtagene autoleucel,Satri-cel,一種靶向Claudin18.2自體CAR-T細胞候選產品)由研究者發起的臨床試驗CT041-CG4006 (NCT03874897)最終結果于2024年6月3日在線發表于《Nature Medicine》雜志,并于2024年6月3日下午(美國東部夏令時間)在美國臨床腫瘤學會("ASCO")年會上進行口頭報告。更多詳情請參見公司官網https://www.carsgen.com。
發表在《Nature Medicine》雜志上的文章題為"靶向Claudin18.2嵌合抗原受體T細胞治療胃腸道腫瘤:1期臨床試驗的最終結果" ("Claudin18.2-specific CAR T Cells in gastrointestinal cancers: phase 1 trial final results")。[1]
發表在2024 ASCO年會上的摘要標題為"靶向Claudin18.2嵌合抗原受體T細胞用于治療胃腸道腫瘤患者:CT041-CG4006 1期臨床試驗最終結果" ("Claudin18.2-Targeted Chimeric Antigen Receptor T Cell Therapy for Patients with Gastrointestinal Cancers: Final Results of CT041-CG4006 Phase 1 Trial")。[2]
這是一項單臂、開放標簽的I期臨床試驗,旨在評估Satri-cel在Claudin18.2陽性的晚期消化系統腫瘤患者中的安全性和有效性。2019年3月26日至2022年1月21日期間進行患者入組,共有98例患者接受了Satri-cel輸注。截至數據截止日期(2024年1月26日),中位隨訪時間為32.4個月(95% CI,27.3–36.5個月),最長隨訪時間為41.0個月。
結果顯示,Satri-cel治療的整體耐受性良好,未觀察到劑量限制性毒性(DLTs),也未發現長期隨訪相關并發癥。Satri-cel的安全性特征與之前報告的結果基本一致[3],隨訪期間未發現新的安全性事件。95例(96.9%)患者出現1級或2級細胞因子釋放綜合癥(CRS),未觀察到3級或以上的CRS。未觀察到免疫效應細胞相關神經毒性綜合征(ICANS)、噬血細胞性淋巴組織細胞增多癥(HLH)或治療相關死亡。
98例患者中有90例(91.8%)基線有靶病灶,其中70例患者顯示腫瘤不同程度的腫瘤退縮。在51例Satri-cel單藥治療、存在靶病灶的胃癌/食管胃結合部腺癌患者中,ORR和DCR分別為54.9%(28/51)和96.1%(49/51),mDOR為6.4個月。在所有接受Satri-cel單藥治療的胃癌/食管胃結合部腺癌患者(n=59)中,中位無進展生存期(mPFS)為5.8個月,中位總生存期(mOS)為9.0個月,12個月的生存率為37.3%。臨床獲益人群(即CR/PR+SD≥6個月)(n=36)的生存獲益更加顯著,中位無進展生存期(mPFS)為8.4個月(vs 2.6個月,P <0.0001),中位總生存期(mOS)為12.5個月(vs 4.0個月,P = 0.0036)。此外,Claudin18.2高表達且無肝轉移或骨轉移的胃癌/食管胃結合部腺癌患者(n=35)也顯示出更加顯著的治療獲益,mPFS和mOS分別為8.4個月(vs 3.7個月,P = 0.00002)和13.1個月(vs 6.3個月,P = 0.0028)。
![KM Plot of PFS/OS in GC/GEJ Pts with Monotherapy [Clinical Benefit Group (CR+PR+SD≥6m) Vs Non-CB Group] KM Plot of PFS/OS in GC/GEJ Pts with Monotherapy [Clinical Benefit Group (CR+PR+SD≥6m) Vs Non-CB Group]](https://mma.prnasia.com/media2/2429214/image_5019987_4556748.jpg?p=medium600)
KM Plot of PFS/OS in GC/GEJ Pts with Monotherapy [Clinical Benefit Group (CR+PR+SD≥6m) Vs Non-CB Group]
本項研究的牽頭研究者,北京大學腫瘤醫院的沈琳教授表示:"Satri-cel在Claudin18.2陽性的晚期消化系統腫瘤患者,特別是胃癌/食管胃結合部腺癌患者中顯示出極具前景的療效和可控的安全性特征。這一研究標志著CAR-T細胞療法在實體瘤治療領域的重大進展,意味著CAR-T有可能改變現有的治療范式,也為探索更多創新性研究提供了重要的參考。未來,我們期待更多的臨床試驗和研究能夠進一步驗證和完善CAR-T這一創新療法,使其能夠早日惠及廣大患者。"
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"很高興看到CT041-CG4006研究的最終成果在權威學術期刊《Nature Medicine》和2024年ASCO大會上同步發表。這項研究對于實體瘤CAR-T領域來說是一個重要的里程碑,同時也顯示了Satri-cel令人鼓舞的安全性和療效。感謝研究團隊多年來的辛勤付出,感謝患者及其家屬的信任與支持。為患者提供更好的治療手段是我們的共同愿望,我們將持續推動Satri-cel在全球的臨床開發進程,使這一創新的CAR-T療法惠及更多胃癌、胰腺癌等消化系統腫瘤患者。"
關于CT041(Satri-cel)
CT041(Satri-cel)是一種潛在全球同類首創的、靶向Claudin18.2蛋白的自體CAR-T細胞候選產品,用于治療Claudin18.2陽性實體瘤,主要治療胃癌/食管胃結合部腺癌及胰腺癌。正在進行的試驗包括研究者發起的臨床試驗(CT041-CG4006, NCT03874897),在中國開展的針對晚期胃癌/食管胃結合部腺癌的確證性II期臨床試驗(CT041-ST-01, NCT04581473),在中國開展的針對胰腺癌輔助治療的I期臨床試驗(CT041-ST-05, NCT05911217),以及在北美開展的針對晚期胃癌或胰腺癌的1b/2期臨床試驗(CT041-ST-02, NCT04404595)。2022年1月,CT041被美國FDA授予"再生醫學先進療法"(RMAT)認定用于治療Claudin18.2陽性的晚期胃癌/食管胃結合部腺癌。2021年11月,CT041被歐洲藥品管理局(EMA)授予優先藥品(PRIME)資格治療晚期胃癌。2020年和2021年,CT041分別被美國FDA授予"孤兒藥"認定用于治療胃癌/食管胃結合部腺癌和EMA授予"孤兒藥產品"認定用于治療晚期胃癌。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com上發布的其他公告和報告中“主要風險和不確定性”標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
參考文獻
[1] Qi, C., Liu, C., Gong, J. et al. Claudin18.2-specific CAR T cells in gastrointestinal cancers: phase 1 trial final results. Nat Med (2024). https://doi.org/10.1038/s41591-024-03037-z |
[2] Qi C, et al. ASCO 2024. Abstract 2501 |
[3] Qi, C., Gong, J., Li, J. et al. Claudin18.2-specific CAR T cells in gastrointestinal cancers: phase 1 trial interim results. Nat Med 28, 1189–1198 (2022). https://doi.org/10.1038/s41591-022-01800-8 |
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
公共關系:PR@carsgen.com
投資者關系:IR@carsgen.com

上海2024年3月27日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,發布了2023年度業績。
業績亮點速覽
- 賽愷澤®(澤沃基奧侖賽注射液,CT053)新藥上市申請獲國家藥品監督管理局批準
- CT041獲得國家藥品監督管理局的IND批準用于Claudin18.2表達陽性的胰腺癌術后輔助治療
- CT011獲得國家藥品監督管理局的IND批準用于治療手術切除后出現復發風險的GPC3陽性的IIIa期肝細胞癌
- 兩名接受局部治療與GPC3 CAR-T細胞療法聯合治療的肝細胞癌患者獲得了超過7年的無病生存期
- CT071獲得FDA的IND批準用于治療復發/難治多發性骨髓瘤或復發/難治原發性漿細胞白血病
- 開發專有的CARcelerate?技術平臺,可將生產時間縮短至30小時左右;該平臺已用于CT071
- 科濟藥業和華東醫藥關于在中國大陸地區商業化賽愷澤®簽訂合作協議
- 科濟藥業與美德納公司啟動一項合作協議,以研究CT041與mRNA癌癥疫苗的組合效果
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"2023年,科濟藥業仍懷著‘科創濟世'的愿景,致力于強化團隊協作及提高經營效率。我們在創新產品注冊及臨床研究以及新技術平臺推進方面取得重要進展。同時,我們在不同候選產品臨床研究、注冊及業務發展等方面達成多個重要里程碑。我們樂觀地認為,我們將以韌性和決心面對及克服前方的挑戰,推進我們的創新細胞療法。"
賽愷澤®(澤沃基奧侖賽注射液,CT053)是一種用于治療復發或難治性多發性骨髓瘤的全人源B細胞成熟抗原(BCMA)自體CAR-T細胞候選產品。科濟藥業于2024 年3 月1日收到國家藥品監督管理局的通知,附條件批準賽愷澤®新藥上市申請(批準日期2024年2月23日),用于治療復發或難治性多發性骨髓瘤成人患者,既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)。在中國進行的I期試驗(NCT03975907)的三年隨訪的更新數據于2023年12月在2023年美國血液學會("ASH")年會上以壁報形式展示。
CT041是一種靶向Claudin18.2(CLDN18.2)(一種在部分癌癥中高表達的膜蛋白)的自體人源化CAR-T細胞候選產品。截至公告日期,根據我們的資料,CT041是世界上第一款進入II期臨床試驗的治療實體瘤的CAR-T細胞候選藥物。CT041已于2023年4月獲得國家藥品監督管理局的IND批準用于Claudin18.2表達陽性的胰腺癌術后輔助治療(CT041-ST-05, NCT05911217)。2023年5月,美國和加拿大1b/2期臨床試驗(NCT04404595)的2期部分啟動,用于治療既往接受過至少二線治療失敗Claudin18.2表達陽性的晚期胃癌/食管胃結合部腺癌的患者。CT041在美國的1b期研究(NCT04404595)的更新數據在2024年美國臨床腫瘤學會胃腸道腫瘤研討會("ASCO GI")上以壁報形式展示。
CT011是一種靶向Glypican-3(GPC3)的自體CAR-T細胞候選產品。CT011已于2024年1月獲得國家藥品監督管理局的IND批準用于治療手術切除后出現復發風險的GPC3陽性的IIIa期肝細胞癌患者。
2023年7月,一篇題為"CAR-GPC3 T細胞聯合局部治療用于晚期肝細胞癌:一種概念驗證治療策略"("Combined local therapy and CAR-GPC3 T-cell therapy in advanced hepatocellular carcinoma: a proof-of-concept treatment strategy")的文章發表在《Cancer Communication (London, England)》上,表明接受局部治療后序貫輸注CAR-GPC3 T細胞的患者獲得了超過7年的無病生存期。
CT071是一種靶向G蛋白偶聯受體C組5成員D(GPRC5D)的自體全人源CAR-T細胞治療候選藥物,利用科濟藥業專有的CARcelerate?平臺開發,用于治療復發或難治性多發性骨髓瘤(R/R MM)及復發/難治原發性漿細胞白血病(R/R pPCL)。CT071已于2023年11月30日獲得FDA的IND批準用于治療R/R MM及R/R pPCL。一項研究者發起的臨床試驗正在中國開展,旨在評估CT071治療R/R MM及復發/難治漿細胞白血病(R/R PCL)(NCT05838131)的安全性和療效。
2023年1月,科濟藥業和華東醫藥股份有限公司(股票代碼:SZ.000963)全資子公司華東醫藥(杭州)有限公司關于在中國大陸地區商業化賽愷澤®簽訂合作協議。
2023年8月,科濟藥業與美德納公司(納斯達克股票代碼:MRNA,"美德納")已啟動一項合作協議,以研究CT041與美德納的試驗性Claudin18.2 mRNA癌癥疫苗的組合效果。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
公共關系:PR@carsgen.com
投資者關系:IR@carsgen.com

上海2023年11月20日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,宣布成立臨床顧問委員會,這一聲譽卓著的專家團隊將為科濟藥業創新候選產品的全球臨床開發提供寶貴的指導和建議。
科濟藥業首席醫學官Raffaele Baffa博士表示:"在我們踏上這個激動人心的旅程,推動差異化CAR-T細胞療法時,我非常高興歡迎我們尊敬的臨床顧問委員會專家成員。專家們卓越的專業知識和致力于推動癌癥治療的決心,高度契合科濟藥業的愿景和臨床開發項目。我們堅信,他們的知識和經驗將助力科濟藥業臨床開發工作的戰略規劃和實施,最終幫助我們為全世界的癌癥患者帶來有意義的改變。愿我們攜手并肩,科創濟世。"
以下是科濟藥業臨床顧問委員會新任成員簡介,按姓氏字母順序排列:
David S. Hong博士是德克薩斯大學MD安德森癌癥中心癌癥治療研究系的Douglas E Johnson講席教授和副系主任,同時也是安德森癌癥中心臨床轉化研究中心的臨床醫學主任。Hong博士是組建全球最大、最具創新性的I期臨床試驗單位之一的領軍者,該單位在2022年納入了超過1200名患者參加臨床試驗,目前正在進行的臨床試驗超過280項。Hong博士作為主要研究者參與了約110項研究,并在《新英格蘭醫學雜志》《柳葉刀腫瘤學》等同行評審期刊上發表了400多篇論文。Hong博士積極參與了許多腫瘤藥物的早期開發,這些藥物包括卡博替尼、司妥昔單抗、達拉非尼、曲美替尼、瑞戈非尼、侖伐替尼、拉羅替尼、替索單抗、特泊替尼和索托拉西布。
Carl Ola Landgren博士是邁阿密大學Sylvester綜合癌癥中心(美國國家癌癥研究所指定的癌癥中心之一)的醫學教授、骨髓瘤科主任、Sylvester骨髓瘤研究所所長、Paul J. DiMare 免疫治療講席教授、實驗治療項目負責人,以及轉化和臨床腫瘤項目聯合負責人。在加入邁阿密大學之前,Landgren博士曾擔任紐約市紀念斯隆凱特琳癌癥中心的骨髓瘤科主任,在此之前,他曾在馬里蘭州貝塞斯達擔任國家癌癥研究所多發性骨髓瘤科主任。 Landgren博士是委員會認證的血液腫瘤學家,已發表500多篇論文和章節書籍,聚焦于多發性骨髓瘤、MGUS(意義未定的單克隆丙種球蛋白病)和冒煙型骨髓瘤。Landgren博士的研究重點是前驅疾病進展為明顯惡性腫瘤的機制、疾病反應/耐藥性的機制、微小殘留病變(MRD)陰性的作用、與持續 MRD 陰性相關的生物學機制、新型治療靶點的識別、早期藥物開發,以及新型生物標記物的識別。
Sattva S. Neelapu博士是德克薩斯大學 MD 安德森癌癥中心淋巴瘤和骨髓瘤系的終身教授和副系主任。他的研究重點是B細胞惡性腫瘤新型免疫療法的臨床和轉化開發。Neelapu博士在阿基侖賽(針對侵襲性B細胞淋巴瘤的靶向CD19 CAR-T細胞療法)的關鍵臨床試驗中所做的工作助力該療法獲得 FDA 批準,成為首個治療淋巴瘤的CAR-T細胞療法。Neelapu博士的實驗室專注于開發針對新靶點的CAR-T細胞療法、了解CAR-T 細胞療法的耐藥機制,以及開發同種異體細胞療法。他獨立撰寫或合作發表了超過275篇論文。
Noopur Raje博士是哈佛醫學院的醫學教授、哈佛醫學院馬薩諸塞州總醫院癌癥中心多發性骨髓瘤中心主任,以及Rita Kelley腫瘤學講席教授。Raje博士的研究主要集中在開發治療多發性骨髓瘤和相關漿細胞疾病的新型治療策略。她的實驗室致力于識別有助于骨髓環境中骨髓瘤細胞存活和增殖的細胞信號傳導途徑。Raje博士在細胞療法方面的專長促使首個用于治療骨髓瘤的CAR-T細胞產品idecabtagene vicleucel獲得FDA批準。Raje博士曾獲得多個獎項,并在多發性骨髓瘤方面論著頗豐。
Paul G. Richardson 博士是哈佛醫學院RJ Corman醫學教授,也是丹娜-法伯癌癥研究所Jerome Lipper多發性骨髓瘤中心的臨床項目負責人和臨床研究主任。Richardson博士在多發性骨髓瘤領域擔任領導職務已有20多年,他主導開發了多款用于多發性骨髓瘤的第一代新藥,包括來那度胺(Revlimid)和硼替佐米(Velcade)的組合療法。他的重要貢獻之一是將來那度胺和硼替佐米與地塞米松聯合應用于骨髓瘤的初線治療。此后,他在將這種聯合治療與達雷妥尤單抗等其他藥物結合的進一步發展中發揮了關鍵作用,從而提高了新診斷多發性骨髓瘤的治療效果。他還在 伊沙佐米、艾羅妥珠單抗、達雷妥尤單抗、艾薩妥昔單抗、 泊馬度胺等藥物,以及最近的melflufen和belantamab mafodotin研發中擔任了領導角色。Richardson 博士目前的研究重點是開發強效的CelMod口服生物制劑,包括 美齊格米特 。Richardson博士著作繁多,在同行評審期刊上獨立撰寫或合作發表了460多篇原創型論文和 340 篇綜述、章節和述評。他獲得了多個獎項,包括 2017年Robert A. Kyle終身成就獎、2012年Warren Alpert獎以及2016年Ernest Beutler獎。
Josep Tabernero博士是西班牙Vall d'Hebron大學醫學腫瘤學部門負責人、Vall d'Hebron 腫瘤研究所 (VHIO) 所長、維克大學-加泰羅尼亞中央大學(UVic-UCC)醫學教授。Tabernero博士是多項 I 期藥理學研究、腫瘤靶向治療和免疫治療轉化項目的首席研究員。Tabernero博士的研究旨在增強針對特定癌蛋白的分子療法,并為遺傳病變或途徑失調的患者加速開發更有效的個性化抗癌藥物。Tabernero博士著有大量論文,在ESMO等知名組織擔任領導職務,為腫瘤治療做出了重要貢獻。
該臨床顧問委員會的成立,是科濟藥業持續開拓CAR-T細胞療法的重要一步。這些卓有成就的專家將發揮重要作用,為科濟藥業開發有效的療法提供寶貴的建議,從而惠及全球患者。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。公司建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。公司通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。科濟藥業的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
公共關系:PR@carsgen.com
投資者關系:IR@carsgen.com

上海2023年8月22日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,發布了2023中期業績。
業績亮點速覽
- 科濟藥業與華東醫藥就澤沃基奧侖賽注射液在中國大陸地區商業化簽訂合作協議。
- CT041獲得國家藥監局的IND批準用于Claudin18.2表達陽性的胰腺癌術后輔助治療。
- CT041美國啟動2期臨床試驗,用于治療至少二線治療失敗的Claudin18.2表達陽性的晚期胃癌/食管胃結合部腺癌患者。
- 科濟藥業與美德納公司啟動了一項合作協議,以研究CT041與美德納的試驗性Claudin18.2 mRNA癌癥疫苗的組合效果。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:
"在過去的半年里,我們在推動技術創新、產品研發和業務運營等領域取得了顯著的進展。我們的團隊不僅在美國,也在中國取得了令人驕傲的成果,不斷地拓展著我們的科學探索和商業邊界。展望未來,我們將繼續堅持創新,加強國際合作,以更快的速度將前沿科學成果轉化為切實可行的治療方案,爭取讓創新的CAR-T療法早日惠及全球腫瘤患者。"
澤沃基奧侖賽注射液(Zevor-cel,研發代號:CT053)是一種用于治療復發/難治多發性骨髓瘤的全人抗BCMA自體CAR-T細胞候選產品。2022年10月,中國國家藥品監督管理局已受理澤沃基奧侖賽注射液的新藥上市申請(NDA),并將該申請納入優先審評。預期澤沃基奧侖賽注射液將于2023年底或2024年初獲國家藥品監督管理局批準用于治療復發/難治多發性骨髓瘤。在美國及加拿大進行的2期臨床試驗的入組正在進行中。2023年1月,科濟藥業和華東醫藥股份有限公司(股票代碼:SZ.000963)(「華東醫藥」)全資子公司華東醫藥(杭州)有限公司關于在中國大陸地區商業化科濟藥業的主導候選藥物澤沃基奧侖賽注射液簽訂合作協議。協議達成后,科濟藥業和華東醫藥的團隊一直在緊密配合,以落實此項合作,推動澤沃基奧侖賽注射液在中國獲批及商業化。
CT041是一種靶向Claudin18.2的自體人源化CAR-T細胞候選產品。根據我們的資料,CT041是世界上第一款進入確證性II期臨床試驗的治療實體瘤的CAR-T細胞候選藥物。CT041已于2023年4月獲得國家藥監局的IND批準用于Claudin18.2表達陽性的胰腺癌術后輔助治療(CT041-ST-05, NCT05911217)。CT041已于2023年5月啟動在美國的2期臨床試驗,用于治療至少二線治療失敗的Claudin18.2表達陽性的晚期胃癌/食管胃結合部腺癌患者。正在進行的CT041試驗包括在美國及加拿大進行的針對晚期胃癌及胰腺癌的1b/2期臨床試驗(CT041-ST-02, NCT04404595),在中國進行的針對晚期胃癌/食管胃結合部腺癌及胰腺癌的Ib期臨床試驗(CT041-ST-01, NCT04581473)和針對晚期胃癌/食管胃結合部腺癌的確證性II期臨床試驗(CT041-ST-01, NCT04581473),以及一項研究者發起的臨床試驗(NCT03874897)。2023年8月21日,科濟藥業宣布與美德納公司(Nasdaq: MRNA)已啟動了一項合作協議,以研究CT041與美德納的試驗性Claudin18.2 mRNA癌癥疫苗的組合效果。
除了上述的現有臨床項目,科濟將積極探索創新CAR-T細胞產品用于早期治療方法。公司亦已努力開發創新技術和候選產品,以更好地應對現有細胞療法產品面臨的挑戰。截至2023年6月30日,我們擁有300多項專利,其中有101項為全球(包括中國、美國、歐洲及日本)授權專利。相較2022年底,新增了9項授權專利及24項專利申請。我們的研究活動將繼續在我們的專業領域內產生數量可觀的知識產權。
我們已經針對CAR-T制造的三個關鍵階段建立了獨立自主的內部垂直一體化的生產能力,包括質粒生產、慢病毒載體生產及CAR-T細胞生產。我們持續在中國及美國擴張全球產能,以支持臨床試驗及隨后我們管線產品的商業化。通過位于上海徐匯的臨床生產廠房及位于上海金山的商業化GMP生產廠房,我們自主生產CAR-T細胞產品以支持中國的臨床試驗,并自主生產慢病毒載體以支持全球臨床試驗。我們位于北卡羅來納州達勒姆的三角研究園(RTP)CGMP生產工廠已經開始自體CAR-T細胞產品的GMP生產。RTP生產工廠將為科濟提供每年為700名患者生產自體CAR-T細胞產品的額外產能,將用于支持在美國、加拿大及歐洲的臨床研究和早期商業化。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了從靶點發現、創新型CAR-T細胞研制、臨床試驗到商業規模生產的CAR-T細胞研究與開發平臺。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
前瞻性聲明
本新聞稿中所有不屬于歷史事實或與當前事實或當前條件無關的陳述都是前瞻性陳述。此類前瞻性聲明表達了本集團截至本新聞稿發布之日對未來事件的當前觀點、預測、信念和預期。此類前瞻性聲明是基于本集團無法控制的一些假設和因素。因此,它們受到重大風險和不確定性的影響,實際事件或結果可能與這些前瞻性聲明有重大差異,本新聞稿中討論的前瞻性事件可能不會發生。這些風險和不確定性包括但不限于我們最近的年度報告和中期報告以及在我們公司網站https://www.carsgen.com 上發布的其他公告和報告中「主要風險和不確定性」標題下的詳細內容。對于本新聞稿中的任何預測、目標、估計或預測的實現或合理性,我們不作任何陳述或保證,也不應依賴這些預測。
聯系科濟藥業
更多信息,請訪問公司網站:https://www.carsgen.com/
媒體聯系:PR@carsgen.com

上海2023年3月22日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,發布了2022年度業績。
業績亮點速覽
- 澤沃基奧侖賽注射液(CT053)的新藥上市申請于2022年10月獲國家藥品監督管理局受理,并納入優先審評
- CT041在中國進入確證性II期臨床試驗
- AB011完成I期單藥及與化療聯合治療的患者入組工作
- 多項數據披露于學術期刊和會議,包括《Nature Medicine》、《Haematologica》、《Frontiers in Immunology》、ASCO 2022、7th CAR-TCR summit、ASH 2022、ASCO GI 2023等
- 與華東醫藥就澤沃基奧侖賽注射液在中國大陸地區商業化簽訂合作協議
- 與羅氏就AB011達成一項臨床合作協議
- 位于美國的RTP生產工廠已開始自體CAR-T細胞產品的GMP生產,并成功放行首批GMP批次
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:
"2022年,我們在推進管線產品臨床研究及注冊、新技術開發、擴大全球生產能力及業務發展等方面達成了重要里程碑。展望未來,我們正走在更為振奮人心的征途上。我們相信,憑借差異化候選產品管線、敬業的團隊精神及高經營效率,科濟藥業有能力鞏固其在全球CAR-T細胞療法領域的領先地位。"
澤沃基奧侖賽注射液(即zevor-cel,或CT053)是一種升級的、用于治療復發/難治多發性骨髓瘤的全人抗BCMA自體CAR-T細胞候選產品。中國國家藥品監督管理局已受理澤沃基奧侖賽注射液的新藥上市申請,并于2022年10月將該申請納入優先審評。科濟已在第七屆CAR-TCR年度峰會上口頭介紹了美國2期研究(NCT03915184)的最新進展,并于2022年12月在第64屆美國血液學會(ASH)年會上展示了有關中國關鍵性II期研究(NCT03975907)的最新進展的海報。中國研究者發起的試驗的最新進展已于2022年8月發表在《Haematologica》期刊上。科濟計劃于2024年向美國FDA提交生物藥物上市許可申請(BLA)。
對于CT041(靶向CLDN18.2蛋白的同類首創自體CAR-T細胞候選產品),一項針對晚期胃癌/食管胃結合部腺癌的中國確證性II期臨床試驗正在進行中。預計美國2期臨床試驗將于2023年上半年啟動。美國1b期研究(NCT04404595)及中國Ib/II期研究的最新進展已于2022年6月在2022年美國臨床腫瘤學會(ASCO)年會上以海報方式展示。中國研究者發起的試驗的最新進展已于2022年5月發表在《Nature Medicine》期刊上。科濟計劃于2024年上半年向中國國家藥監局提交NDA,并計劃于2025年向美國FDA提交BLA。
AB011是一種靶向CLDN18.2的人源化單克隆抗體候選產品。科濟已完成I期單藥及與化療聯合治療的患者入組工作。有關I期研究(AB011-ST-01,NCT04400383)的最新進展已于2023年1月在2023年ASCO年會胃腸腫瘤研討會(GI)上以海報方式展示。
除了上述的現有臨床項目,科濟將積極探索創新CAR-T細胞產品用于早期治療方法。公司亦已努力開發創新技術和候選產品,以更好地應對現有細胞療法產品面臨的挑戰。
2022年是科濟藥業在中國境外擴大產能的重要一年。公司位于美國達勒姆三角研究園的先進GMP生產工廠(RTP生產工廠),已開始了自體CAR-T細胞產品的GMP生產,并于2022年9月成功放行了首批用于臨床試驗的GMP批次。RTP生產工廠將繼續支持科濟藥業在海外進行中的臨床研究和早期商業化。
在業務發展方面,科濟與華東醫藥股份有限公司(股票代碼:SZ.000963)就在中國大陸地區商業化澤沃基奧侖賽注射液簽訂合作協議。科濟藥業將繼續負責澤沃基奧侖賽注射液在中國大陸地區的開發、注冊和生產。2023年1月,科濟宣布與羅氏達成一項臨床合作協議,就科濟藥業的試驗藥物AB011與羅氏PD-L1免疫檢查點抑制劑阿替利珠單抗(atezolizumab)及標準治療化療,開展聯合用藥治療胃癌/食管胃結合部腺癌患者的臨床試驗。科濟期望與行業合作伙伴及學術機構建立更多合作,以開發及推進創新細胞療法及技術,惠及全球癌癥患者。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。

上海2023年1月16日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,宣布與華東醫藥股份有限公司(股票代碼:SZ.000963)(以下簡稱"華東醫藥")全資子公司華東醫藥(杭州)有限公司就科濟藥業BCMA CAR-T細胞產品澤沃基奧侖賽注射液(zevorcabtagene autoleucel,研發代號:CT053),達成在中國大陸地區的商業化合作。
CT053,澤沃基奧侖賽注射液("zevor-cel")作為科濟藥業領先的管線產品,是一款用于治療復發/難治多發性骨髓瘤的自體CAR-T細胞產品。2022年10月,中國國家藥品監督管理局(NMPA)受理CT053的新藥上市申請(NDA)。基于華東醫藥強大的市場推廣能力及營銷網絡,科濟藥業授予華東醫藥澤沃基奧侖賽注射液在中國大陸地區的獨家商業化權益。
對于此次合作,科濟藥業董事會主席、首席執行官、首席科學官李宗海博士表示:"華東醫藥擁有在中國大陸地區豐富的商業化經驗和成為腫瘤治療領域領軍者的戰略目標,這為雙方建立強大、共贏的戰略合作伙伴關系奠定了堅實的基礎,對于多發性骨髓瘤的治療,雖然近些年有些突破,但依然存在較大的未滿足醫療需求。澤沃基奧侖賽注射液是一款具有差異化的 BCMA CAR- T細胞療法,在臨床試驗中展現了優秀的安全性和有效性,目前已被中國國家藥品監督管理局(NMPA)受理新藥上市申請,并納入優先審評。我們相信此次合作將加速澤沃基奧侖賽注射液在中國的成功商業化。"
華東醫藥董事長呂梁表示:"科濟藥業是腫瘤領域細胞療法的領軍者,具備細胞療法端到端的早期研究、臨床開發和生產能力。我們很高興與科濟藥業合作,負責CT053在中國大陸地區的商業化。CT053是一款臨床療效卓越的創新療法。借助華東醫藥在血液領域強大的商業化能力,華東醫藥將致力于讓CT053惠及更多中國多發性骨髓瘤患者,延長患者的生存期并提高生活質量。"
根據協議條款,科濟藥業將獲得2億人民幣的首付款,并有權獲得最高不超過10.25億人民幣的注冊及銷售里程碑付款。科濟藥業將繼續負責 CT053 在中國大陸地區的開發、注冊和生產。
關于澤沃基奧侖賽注射液
澤沃基奧侖賽注射液(CT053)是一種用于治療復發/難治多發性骨髓瘤的全人抗自體BCMA CAR-T細胞候選產品。澤沃基奧侖賽注射液基于中國I/II期臨床試驗(LUMMICAR STUDY 1)的新藥上市申請已被國家藥品監督管理局受理。科濟藥業正在北美開展1b/2期臨床試驗(LUMMICAR STUDY 2),以評估澤沃基奧侖賽注射液用于治療復發/難治多發性骨髓瘤的安全性及療效。公司也計劃進行其他臨床試驗以開發澤沃基奧侖賽注射液作為多發性骨髓瘤的早線治療方法。
澤沃基奧侖賽注射液于2019年獲得美國FDA的再生醫學先進療法(RMAT)及孤兒藥稱號,以及先后于2019年及2020年獲得歐洲藥品管理局(EMA)的優先藥物(PRIME)及孤兒藥產品稱號。澤沃基奧侖賽注射液也于2020年獲得國家藥監局的突破性治療藥物品種。
公司認為,澤沃基奧侖賽注射液有可能重塑多發性骨髓瘤的治療范式,并成為多發性骨髓瘤患者的基礎性治療方法。
關于華東醫藥
華東醫藥股份有限公司(SZ.000963)是一家領先的中國大型綜合性醫藥上市公司,總部位于中國杭州。華東醫藥成立于1993年,具有完整的產品研發、生產和銷售能力。華東醫藥的產品組合和管線主要專注于腫瘤學、免疫學、腎臟病學及糖尿病領域。公司現有員工12,000余人,在中國具有非常廣泛的商業覆蓋和市場營銷能力。"以科研為基礎,以患者為中心"是華東醫藥秉承的企業理念。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
聯系我們:
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2022年11月1日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司宣布,Sylvie Peltier博士(以下簡稱"Peltier博士")已被委任為本公司全球注冊事務高級副總裁,于2022年10月31日起生效。她將主要負責制定全球注冊戰略,領導和推動注冊事務的相關活動,并支持全球在研產品的臨床研究申請和新藥上市申請。
Peltier博士曾任職多家跨國制藥公司和生物制藥公司,在臨床和CMC注冊事務方面具有豐富的實戰經驗和全球管理經驗。在加入科濟藥業之前,Peltier博士自2020年起擔任MorphoSys US Inc(納斯達克股票代碼:MOR)的副總裁,美國注冊事務負責人,并從2018年起擔任Servier Pharmaceuticals LLC的注冊事務負責人。在加入Servier Pharmaceuticals LLC之前,Peltier博士自2007年起在Cephalon(一家國際生物制藥公司,后來被TEVA Pharmaceuticals Industries Ltd(紐約證券交易所股票代碼:TEVA)收購)擔任了多個職位,包括歐洲注冊事務高級總監(中樞神經/疼痛和CMC)、美國注冊事務高級總監,以及臨床開發評估和盡職調查高級總監。在此之前,Peltier博士自1995年起在Pfizer的注冊事務部門工作。
Peltier博士在法國巴黎第十一大學取得藥學博士學位及衛生法高級專業學位(DESS)。
科濟藥業首席醫學官Raffaele Baffa博士表示:"很高興Peltier博士加入科濟藥業,Peltier博士的到來使我們的高級管理團隊得到了進一步加強。在我們推進全球管線產品的過程中,Peltier博士在臨床和CMC監管方面的豐富經驗和知識將成為公司的重要資產。Peltier博士將與我們的團隊一起,不遺余力地開發創新型細胞治療產品,以造福全球癌癥患者。"
科濟藥業全球注冊事務高級副總裁Sylvie Peltier博士表示:"科濟藥業是全球CAR-T細胞療法的領軍企業,擁有頗具競爭力的產品管線和技術平臺。當前科濟正在開發多種差異化的CAR-T 細胞治療產品,包括具有競爭力的抗BCMA CAR-T產品澤沃基奧侖賽注射液,以及全球同類首創的、抗 CLDN18.2 CAR-T產品CT041,我很高興能在這個激動人心的時刻加入科濟藥業。期待與科濟的同事們共同努力,盡快將我們的創新產品推向市場,實現我們‘科創濟世'的愿景。"
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
聯系我們
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2022年9月2日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,宣布公司位于美國北卡羅來納州的三角研究園(RTP)區域符合現行藥品生產質量管理規范(CGMP)的生產工廠("RTP GMP生產工廠")已經開始了自體CAR-T細胞產品的GMP生產,并成功放行了首批用于臨床試驗的GMP批次。
RTP GMP生產工廠,總建筑面積約為3300平方米,將為科濟藥業提供每年為700名患者生產自體CAR-T細胞產品的額外產能,用于支援在北美和歐洲的臨床研究和早期商業化。CARsgen Therapeutics Corporation總裁Richard Daly先生表示:"我很高興地宣布,RTP生產工廠已于2022年第三季度完成首例CAR-T產品的臨床批次生產,供美國患者使用。科濟藥業正在快速擴展在美國的自主生產和質量測試能力。公司將加速推進臨床研究,為全球患者提供更多有前景的CAR-T細胞產品。"
"美國RTP GMP生產工廠用于患者首例CAR-T產品的完成,對于科濟而言是一個重大里程碑。"科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士說道,"通過利用科濟藥業垂直一體化生產優勢,我們的世界級CMC團隊高效完成了從中國生產工廠的全球技術轉移,以有效推進臨床生產。在RTP GMP生產工廠開始臨床生產將大大降低目前全球供應鏈短缺的風險并且增強科濟藥業的價值鏈。"
除在中國正在進行的數項臨床研究外,科濟藥業還有兩項獲得了美國FDA和加拿大衛生部批準的 IND試驗正在進行中,包括CT053用于治療復發/難治多發性骨髓瘤的關鍵2期臨床試驗和CT041用于治療晚期胃癌和胰腺癌的1b期臨床試驗。目前,科濟藥業是唯一一家在血液瘤(CT053)和實體瘤(CT041)領域均獲得"再生醫學先進療法"(RMAT)和"優先藥物"(PRIME)認定的CAR-T公司。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們 建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
聯系我們
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2022年8月24日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,已公布2022中期業績。
業績亮點速覽
- CT053完成中國關鍵II期臨床試驗入組,計劃于2022年第三季度在國內提交NDA
- CT041啟動中國確證性Ⅱ期臨床試驗
- CT041被FDA授予"再生醫學先進療法"(RMAT)
- CT041中國研究者發起試驗的數據在《Nature Medicine》發表
- 持續開發創新CAR-T技術,布局下一代管線候選產品
- 美國CGMP生產工廠啟動運營,于下半年支持北美臨床試驗
- 委任科濟藥業首席醫學官及旗下美國公司總裁,加強領導團隊力量
科濟藥業董事長、首席執行官、首席科學官李宗海博士表示:
回顧2022年上半年,雖然疫情帶來了一些挑戰,但科濟藥業在管線產品的臨床開發、技術創新及在中國和美國的業務運營方面,均取得了重大的進展。目前,CT041已成為全球首個且唯一進入確證性II期臨床試驗的實體瘤CAR-T產品,CT053即將于第三季度在國內提交NDA申請。公司位于美國的CGMP生產工廠也啟動運營。我們持續推進CAR-T技術創新以攻克行業重大挑戰,同時我們也建立了獨立自主、垂直一體化的生產能力。我們將始終秉承"科創濟世"的愿景,早日為全球癌癥患者帶來創新和差異化的細胞療法,也為廣大投資者和社會公眾創造更多價值。
一、產品管線穩步推進,實體瘤CAR-T保持領先
CT053
CT053是一種升級的、用于治療復發/難治多發性骨髓瘤(R/R MM)的全人抗BCMA自體CAR-T細胞候選產品。其融合了具有較低免疫原性和較高穩定性的全人抗BCMA特異性單鏈抗體的CAR結構,在沒有腫瘤相關靶點的情況下,可降低CAR-T細胞的自動激活,克服了T細胞耗竭的問題。
CT053就治療R/R MM于2019年獲得美國FDA的再生醫學先進療法(RMAT)及孤兒藥認定,以及就治療R/R MM于2019年獲得歐洲藥品管理局(EMA)的優先藥物(PRIME)資格及于2020年獲得孤兒藥產品認定,并就治療R/R MM于2020年獲得國家藥監局的突破性療法認定。
科濟已經完成中國關鍵性II期試驗(LUMMICAR STUDY 1)的患者入組,并計劃于2022年第三季度向國家藥監局提交新藥上市申請(NDA)。科濟正在北美進行關鍵性2期試驗(LUMMICAR STUDY 2),并計劃于2023年向美國FDA提交生物藥物上市許可申請(BLA)。公司亦計劃進行額外臨床試驗,以開發CT053作為多發性骨髓瘤的早期治療方法。
CT053中國研究者發起的試驗(IIT)研究結果于2022年在《Haematologica》雜志發表。
CT041
CT041是一種全球潛在同類首創的,靶向Claudin18.2(CLDN18.2)蛋白的自體CAR-T細胞候選產品。CT041用于治療CLDN18.2陽性實體瘤,主要治療胃癌/食管胃結合部癌(GC/GEJ)及胰腺癌(PC)。科濟在全球范圍內率先成功識別、驗證并報告CLDN18.2可作為實體瘤的相關抗原,是治療CLDN18.2普遍及高表達的實體瘤CAR-T細胞療法的可行靶點。
CT041就治療GC/GEJ于2020年取得美國FDA的孤兒藥認定以及就治療晚期胃癌于2021年取得EMA的孤兒藥產品認定。CT041就治療晚期胃癌于2021年獲EMA授予PRIME資格,及就治療CLDN18.2陽性晚期GC/GEJ于2022年獲得RMAT認定。
截至公告日,CT041是全球首個且唯一進入到確證性II期臨床試驗的用于治療實體瘤的CAR-T細胞候選產品。
科濟正在進行的試驗包括在北美的一項針對晚期GC/GEJ和PC的1b/2期臨床試驗(CT041-ST-02,NCT04404595),在中國的一項針對晚期GC/GEJ和PC的Ib期臨床試驗和一項針對晚期GC/GEJ的確證性II期臨床試驗(CT041-ST-01,NCT04581473)以及IIT。科濟計劃于2024年上半年向中國國家藥監局提交NDA。CT041在美國現已完成劑量爬坡并已啟動劑量擴展。科濟亦計劃于2022年下半年在北美啟動一項2期臨床試驗,并于2024年向美國FDA提交BLA。
CT041在美國的1b期研究(NCT04404595)的結果及在中國的Ib/II期研究(NCT04581473)的結果于2022年6月舉行的2022年美國臨床腫瘤學會(ASCO)年會上以壁報形式進行展示。中國研究者發起的試驗的結果于2022年5月在《Nature Medicine》發表,是首個發表于頂級學術期刊的迄今為止最大樣本量的CAR-T細胞治療實體瘤臨床研究。
AB011
AB011是一種靶向CLDN18.2的人源化單克隆抗體候選產品,用于治療CLDN18.2陽性實體瘤。科濟就靶向CLDN18.2的單克隆抗體取得該靶點全球第二項試驗用新藥(IND)許可。
科濟正在中國進行AB011用于治療CLDN18.2陽性實體瘤的I期臨床試驗,現已完成I期單藥入組并啟動聯合化療階段試驗。
二、持續推動CAR-T技術創新,攻克行業重大挑戰
科濟已建立了涵蓋整個CAR-T開發周期的綜合研發平臺,包括靶點發現、抗體開發、載體設計、制造、質量保證以及質量控制。科濟持續投身于推進CAR-T技術創新,以攻克行業重大挑戰。公司的四大戰略支柱包括:
(1) 療效:為提升治療實體瘤的療效,科濟持續開發下一代CAR-T技術,如CycloCAR®。CycloCAR®的特色是在CAR-T細胞中共同表達細胞因子IL-7和趨化因子CCL21,有望產生更高的臨床療效并減少清淋化療預處理。
(2) 安全性:為提高過繼性細胞療法的適用性,科濟開發了基于sFv-ε的T細胞療法,其由GPC3靶向的scFv和CD3ε亞單位組成的全T細胞受體(TCR)復合物提供動力,可與其他TCR亞單位形成功能性TCR復合物,重定向T細胞以非MHC依賴性方式殺傷腫瘤細胞。
(3) 患者可及性:科濟正在開發使用THANK-uCAR®技術的同種異體CAR-T細胞候選產品。公司認為該技術有望促進CAR-T細胞的增殖、持久性及療效。公司相信,成功應用THANK-uCAR®技術將大幅降低CAR-T細胞療法的成本,提高患者可及性。
(4) 靶點可用性:科濟開發了LADAR®技術(由人工受體驅動的局部作用),其中人工受體由LADAR®配體觸發,誘導目標基因的轉錄。通過LADAR®人工受體,只有當LADAR®與LADAR®配體結合時,才會觸發抗腫瘤CAR轉錄,從而可以精準控制免疫細胞何時及于何種情況下作用于癌細胞。
目前上述技術均為自主研發,擁有全球權益,可單獨或結合使用以升級科濟的現有候選產品及產生未來的管線候選產品。
截至2022年6月30日,科濟擁有超過300項專利,其中有70項為全球(包括中國、美國、歐洲及日本)授權專利。相較2021年底,增加了7項授權專利及21項專利申請。
三、垂直一體化產能,支持全球臨床試驗
科濟已建立了自主、垂直一體化的生產能力,包括質粒生產、慢病毒載體生產和CAR-T細胞生產。
公司持續擴大在中國和美國的全球產能,以支持臨床試驗和隨后的管線產品的商業化。利用公司在上海徐匯區的臨床生產工廠以及位于上海金山區的商業GMP生產工廠,公司能夠獨立自主地生產CAR-T細胞以支持在中國的臨床試驗,以及獨立自主地生產慢病毒載體以支持全球的臨床試驗。
今年,公司通過啟動位于美國北卡羅來納州達勒姆三角研究園(RTP)的CGMP生產工廠,于擴大公司在中國以外的產能方面取得重大進展。工廠順利通過了官方檢查,并已獲得達勒姆市縣檢驗局頒發的合規證書,并經與FDA進行RMAT協商后啟動RTP生產工廠的調試、資質及驗證工作。同時,科濟一直在執行向RTP生產工廠的技術轉讓,推進CT041及CT053產品的臨床生產。
四、資深高級管理人員加入,加強領導團隊力量
截至2022年6月30日,科濟共有601名雇員。公司亦加強了領導團隊的力量:聘請Raffaele Baffa博士擔任科濟藥業首席醫學官及Richard Daly先生擔任CARsgen Therapeutics Corporation(科濟藥業旗下美國公司)總裁。高級管理人員履歷詳情載于公司網站(www.CARsgen.com)。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
聯系我們
更多信息,請訪問公司網站:https://www.carsgen.com/

上海, 2022年8月18日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,今日宣布,公司自主研發的靶向GPC3的CAR-T細胞候選產品CT011治療晚期肝細胞癌的長期生存案例報告已在《Frontiers in Immunology》雜志發表,題為"Long Term Complete Response of Advanced Hepatocellular Carcinoma to Glypican-3 Specific Chimeric Antigen Receptor T-Cells plus Sorafenib, A case report"。(https://www.frontiersin.org/articles/10.3389/fimmu.2022.963031/full )
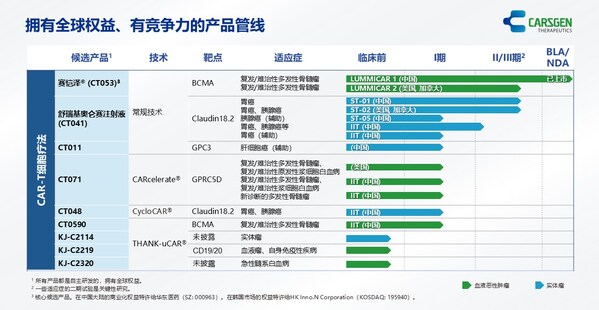
肝癌是全球第六大常見癌癥,而肝細胞癌(HCC)是原發性肝癌最常見的組織學亞型。現有療法對不可切除的肝細胞癌的療效仍較有限。CAR-T細胞療法已經獲批用于多種血液腫瘤,但其用于實體瘤仍面對極大挑戰。我們是最早報告GPC3是CAR-T合理治療靶點的團隊,并率先開展了用于肝細胞癌的臨床試驗[1,2] 。為了進一步增強其療效,我們于2014年報道了采用GPC3 CAR-T與索拉非尼聯合治療肝細胞癌的臨床前研究[3]。為了嘗試該策略是否能在臨床中實現,我們在溫州醫科大學附屬第一醫院開展了研究者發起的臨床試驗。該研究報告了一名晚期肝細胞癌患者在接受GPC3 CAR-T細胞與索拉非尼聯合治療后獲得了完全緩解(CR)和長期生存。
案例顯示,一名患有乙型肝炎病毒(HBV)相關肝細胞癌的60歲亞裔男性,2018年5月接受手術,2018年8月術后肝癌復發并出現肺轉移,隨后接受經動脈化療栓塞治療(TACE)處理肝部病灶和介入消融處理肺部轉移,但于2018年11月6日出現疾病進展,進而入組本臨床試驗。入組后,患者接受了單采,用于GPC3 CAR-T細胞的制備。單采后7天,患者開始服用索拉非尼,每天兩次,每次400毫克。患者接受了4個周期的GPC3 CAR-T細胞(CT011)治療,每個周期分為兩次輸注。在接受CT011治療的每個周期之前,進行清淋化療預處理。共輸注4×109 個GPC3 CAR-T細胞。
CT011聯合索拉非尼治療耐受性良好。患者從第3個月開始達到部分緩解(PR),并在第一個 CT011 輸注周期后的第12個月達到完全緩解。腫瘤超過36個月沒有進展,在第一次輸注后保持完全緩解狀態超過24個月。
這是CAR-T細胞與酪氨酸激酶抑制劑聯合治療后報告的首個完全緩解病例。臨床結果表明,GPC3 CAR-T細胞與索拉非尼的聯合治療,可能成為治療GPC3表達陽性的晚期肝細胞癌患者的一種有前景的療法。
科濟藥業董事長、首席執行官兼首席科學官李宗海博士表示:"如何用CAR-T治愈實體瘤患者是大家極為期待的。這個患者雖然經過了TACE和介入消融等局部治療,但沒有經過抗血管生成抑制劑等系統性治療。我們基于臨床前的研究基礎,采用索拉非尼和CT011聯合治療,取得了完全緩解的效果,并且已經有兩年多沒有復發,表明GPC3 CAR-T有可能用于肝細胞癌早線治療并可能治愈患者,該研究也為CAR-T用于其他實體瘤早線治療提供了新的依據。"
關于CT011
CT011是一種潛在全球同類首創的CAR-T細胞候選產品(人源化GPC3 CAR-T),具有治療肝細胞癌(HCC)的概念驗證臨床數據。科濟藥業的創始人、董事會主席、首席執行官、首席科學官李宗海博士領導了全球首次成功識別、驗證和報告GPC3作為開發CAR-T細胞療法用于治療肝細胞癌相關的工作。公司已在中國完成I期試驗患者入組。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
參考文獻
1. Gao H, et. al. Clin Cancer Res. 2014 Dec 15;20(24):6418-28
2. Shi D, et. al. Clin Cancer Res. 2020 Aug 1;26(15):3979-3989
3. Wu X, et. al. Mol Ther. 2019 Aug 7;27(8):1483-1494
聯系我們
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2022年8月2日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,公告宣布委任蔣華博士為執行董事。
蔣博士在腫瘤生物治療領域約有18年的工作經驗。她目前擔任科濟藥業早期研發副總裁,負責制定公司早期研究策略和研發管線的建設。蔣博士于2021年4月加入本公司,擔任免疫細胞研發部高級總監,負責免疫細胞研發部和藥理部的研究工作,成績斐然,不僅加強了技術平臺建設且擴充了多個候選產品管線。加入本公司之前,蔣博士于2007年7月至2021年4月在上海市腫瘤研究所工作,主要負責抗體及CAR-T細胞的研發以及相關機制的研究工作。蔣博士曾為上海市腫瘤研究所的研究員及上海交通大學醫學院博士生導師。
蔣博士迄今已發表超過20篇SCI論文,期刊包括Journal of the National Cancer Institute、Clinical Cancer Research、Molecular Therapy等。她以第一作者發表全球首篇CLDN18.2 CAR-T以及EGFR/EGFRvIII CAR-T論文,作為共同通訊作者發表全球首篇小分子藥物和CAR-T聯合治療實體瘤的論文。
蔣博士于2001年獲得濟寧醫學院臨床醫學學士學位。于2004年獲得山東大學病原生物學醫學碩士學位。于2007年獲得復旦大學病原生物學醫學博士學位。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"代表董事會熱烈歡迎蔣華博士成為公司執行董事。蔣博士擁有豐富的專業知識和卓越的領導能力,尤其是她在CAR-T研發方面有多年的科研經歷和突出成績。蔣博士加入公司董事會,不僅使得董事會更加多元化,也將持續助力我們為全球患者開發更多差異化的CAR-T候選產品。"
科濟藥業執行董事、早期研發副總裁蔣華博士表示:"我很高興也很榮幸成為科濟藥業董事會的一員。感謝公司董事會對我的認可,今后我將不遺余力,與科濟的同事們一起,為癌癥患者持續開發創新CAR-T細胞療法,實現我們‘科創濟世'的愿景。"
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
聯系我們
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2022年6月6日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,公告宣布,在2022年美國臨床腫瘤學會(ASCO)年會上,公司展示了兩篇關于CT041(一種靶向Claudin18.2(CLDN18.2)蛋白質的自體CAR-T細胞候選產品)的研究結果的海報,其包含了(1)在美國進行的針對晚期胃癌和胰腺癌患者的多中心1b期試驗的結果,和(2)在中國進行的針對晚期胃癌/食管胃結合部腺癌患者的Ib/II期CT041試驗的安全性和初步療效結果。
海報摘要情況如下:
摘要#2538:靶向CLDN18.2 CAR-T細胞療法(CT041)治療晚期胃癌和胰腺癌患者的多中心1b期試驗
一項單臂、開放標簽的1b期試驗(NCT04404595)在美國6個中心進行。CLDN18.2陽性患者,包括之前接受過至少兩種前線系統治療的胃癌/食管胃結合部腺癌(GC/GEJ)患者以及至少接受過一種前線治療的胰腺癌患者,都有資格參加該研究。在CT041輸注前,采用氟達拉濱、環磷酰胺和白蛋白結合型紫杉醇 (100mg或者100mg/m2;FNC)預處理。不良事件(AE)按照CTCAE v5.0進行分級。細胞因子釋放綜合征(CRS)和免疫細胞治療相關神經系統毒性綜合征(ICANS)按照ASTCT標準進行分級。腫瘤療效按RECIST 1.1標準評估。
截至2022年5月6日,已有14例患者入組(5例患有胃癌/食管胃結合部腺癌,9例患有胰腺癌),既往中位治療線數為3線(范圍1-5),且共接受了18個周期的CT041治療。14例患者按三個劑量水平(DL)給藥,包括DL1為2.5-3.0×108細胞(n=6),DL2為3.75-4.0×108細胞(n=6)和DL3為6.0×108細胞(n=2)。
安全性
未觀察到劑量限制性毒性或治療相關死亡。未觀察到≥3級的CRS或ICANS。未發生胃腸道出血或急性胃粘膜損傷。在出現CRS的13例患者中,11例為1級CRS,2例為2級CRS。有1例患者未發生CRS。
有效性
在胃癌/食管胃結合部腺癌患者的分組中,客觀緩解率(ORR)為60%,其中1例患者實現了完全緩解(CR)。此外,在80%(4/5)的疾病穩定(4例胰腺癌患者)患者中觀察到了腫瘤的縮小。中位緩解持續時間(mDOR)和中位無進展生存期(mPFS)尚未達到。接受DL3的兩例患者在數據截止日期前尚未進行腫瘤療效評估。在DL1和DL2中觀察到劑量依賴性反應。在DL1中觀察到的ORR為16.7%,疾病控制率(DCR)為50%。在DL2中觀察到的ORR為33.3%以及DCR為83.3%。腫瘤療效詳情如下所示。
基于腫瘤類型的腫瘤療效 |
|||
GC/GEJ (n=5), n (%) |
PC (n=7), n (%) |
||
完全緩解 |
1 (20) |
0 (0) |
|
部分緩解 |
2 (40) |
0 (0) |
|
疾病穩定 |
1 (20) |
4 (57.1) |
|
疾病進展 |
1 (20) |
3 (42.9) |
|
注: GC/GEJ:胃癌/食管胃結合部腺癌; PC:胰腺癌。 |
|||
結論
在經歷過多線治療的胃癌中,CT041 CLDN18.2 CAR-T細胞與歷史治療方案相比,可能有顯著的抗腫瘤活性改善。
摘要#4017:CLDN18.2 CAR-T細胞療法(CT041)在晚期胃癌/食管胃結合部腺癌患者中安全性、耐受性和初步療效的Ib/II期研究結果
這是一項多中心、開放標簽的Ib/II期試驗(NCT04581473),旨在評估中國胃癌/食管胃結合部腺癌患者的安全性和有效性。在Ib期,使用3+3設計研究了CT041 2.5×108和3.75×108細胞的劑量水平。
Ib期研究關鍵入選標準:符合參與本研究資格的人群為至少二線治療失敗或不耐受的CLDN18.2表達陽性(由免疫組織化學[IHC]染色驗證[在≥40%的腫瘤細胞中2+/3+])的晚期胃癌/食管胃結合部腺癌患者。HER2陽性患者應接受過標準抗HER2治療。
截至2021年12月22日,14例符合條件的胃癌/食管胃結合部腺癌患者納入Ib期研究。其中57.1% 的患者轉移器官數目≥3個,92.9%存在腹膜轉移。大多數患者(85.7%)之前接受過二線治療或包含氟尿嘧啶、奧沙利鉑和紫杉醇的三聯療法治療。35.7%的患者曾接受過PD-1/PD-L1抑制劑治療。基線特征如下表所示。
人口統計學與基線特征 |
合計(N = 14) |
中位年齡 (范圍),年 |
44.5 (23–71) |
男性,n (%) |
6 (42.9%) |
東部腫瘤協作組體力狀態=1, n (%) |
12 (85.7%) |
Lauren 分型,n (%) |
|
腸型 |
3 (21.4%) |
彌漫型 |
9 (64.3%) |
混合型 |
2 (14.3% |
印戒細胞癌,n (%) |
9 (64.3%) |
Claudin18.2 染色,n (%) |
|
2+ |
2 (14.3%) |
3+ |
12 (85.7%) |
HER2 表達,n (%) |
|
陽性 |
1 (7.1%) |
陰性 |
12 (85.7%) |
未知 |
1 (7.1%) |
轉移器官的數量,n (%) |
|
<3 |
6 (42.9%) |
≥3 |
8 (57.1%) |
腹膜轉移,n (%) |
13 (92.9%) |
肝轉移,n (%) |
3 (21.4%) |
前線治療數量,n (%) |
|
2* |
12 (85.7%) |
≥3 |
2 (14.3%) |
既往系統性治療,n (%) |
|
氟尿嘧啶 |
14 (100%) |
鉑劑 |
14 (100%) |
紫杉醇/白蛋白結合型紫杉醇 |
13 (92.9%) |
PD–1/PD-L1抑制劑 |
5 (35.7%) |
酪氨酸激酶抑制劑 |
2 (14.3%) |
* 5例患者接受了氟尿嘧啶、奧沙利鉑和紫杉醇的三聯療法作為一線治療。 |
|
所有14例患者均接受了由研究者確定的1個周期的橋接化療,其中13例患者(92.9%)接受了伊立替康,只有1例患者接受了5-氟尿嘧啶聯合腹腔注射白蛋白結合型紫杉醇。在輸注CT041之前,所有患者均接受淋巴細胞耗竭處理(氟達拉濱25mg/m2 d1-2、環磷酰胺250mg/m2 d1-3和白蛋白結合型紫杉醇100mg d2)。所有患者至少輸注一次CT041(11例2.5×108,3例3.75×108),7例患者輸注兩次。對于接受兩次輸注的7例患者,第一次和第二次輸注之間的中位間隔為132天(范圍49–252天)。
安全性
未發生劑量限制性毒性或治療相關死亡。13例患者發生2級CRS,僅有1例患者發生4級CRS,與患者自身的疾病負擔相關,且在使用糖皮質激素治療后完全恢復。未發生ICANS或胃腸道黏膜損傷。
有效性
13例患者可評估,1例患者在進行腫瘤評估之前退出研究。14例患者中有8例(57.1%)在CT041首次輸注后的首次腫瘤評估即達到部分緩解,基于研究者評估ORR和DCR分別為57.1%和78.6%。
中位隨訪時間為 8.8個月, mPFS和中位總生存期(mOS)分別為 5.6個月和 10.8個月。至數據截止日期,有7例患者仍然存活。
結論
初步研究結果表明,CT041在接受過治療的晚期胃癌/食管胃結合部腺癌患者中具有可控的安全性/耐受性和有前景的抗腫瘤療效。本試驗正在進行中,目前對CT041進行進一步的確證性II期試驗。
科濟藥業首席醫學官Raffaele Baffa博士表示:"在全球范圍內,實體瘤發病人數約占所有腫瘤的90%,包括胃癌等常見疾病。目前胃癌的治療選擇仍然有限,亟需更多創新療法。本次ASCO 2022年會上更新的CT041臨床數據,在接受過既往治療的胃癌/食管胃結合部腺癌患者和胰腺癌患者中,都非常令人鼓舞,顯示出明顯的療效和出色的耐受性,包括令人印象深刻的60%的ORR和1例CR。我們期待持續開發CT041,相信它可以幫助到更多患者。"
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"這是CT041中美兩地的注冊臨床試驗數據的首次亮相。繼5月份CT041的研究者發起的試驗數據在《Nature Medicine》上發表后,本次ASCO年會上公布的注冊臨床試驗數據進一步顯示了CT041前景光明的治療效果及良好的安全性。CT041是目前全球唯一進入到確證性II期臨床試驗的用于治療實體瘤的CAR-T細胞候選產品,我們將持續推動該產品在全球的臨床開發,早日惠及廣大患者。"
關于CT041
CT041是一種潛在全球同類首創的、靶向CLDN18.2蛋白質的自體CAR-T細胞候選產品,用于治療CLDN18.2陽性實體瘤,主要治療胃癌/食管胃結合部腺癌及胰腺癌。CT041在正在進行的臨床試驗中表現出前景光明的治療效果及良好的安全性。科濟藥業認為,CT041有可能在未來成為胃癌/食管胃結合部腺癌和胰腺癌的骨干療法并惠及全球大量患者群體。
截至發稿日,CT041為全球唯一已獲得美國食品藥品監督管理局(FDA)、中國國家藥監局(NMPA)和加拿大衛生部的IND/CTA批準并正在進行臨床試驗研究的靶向CLDN18.2的CAR-T細胞候選產品。
科濟藥業正在進行的試驗包括在中國開展的研究者發起的試驗、一項針對晚期胃癌/食管胃結合部腺癌和胰腺癌的Ib期和針對晚期胃癌/食管胃結合部腺癌的確證性II期臨床試驗(CT041-ST-01, NCT04581473),以及在北美啟動了一項針對晚期胃癌或胰腺癌的1b/2期臨床試驗(CT041-ST-02, NCT04404595)。科濟藥業亦擬于2022年在北美啟動關鍵2期臨床試驗。
2022年5月,CT041研究者發起試驗的I期期中分析結果在《Nature Medicine》上發表,是首個發表于頂級學術期刊的迄今為止最大樣本量的CAR-T細胞治療實體瘤臨床研究。
CT041重要監管里程碑事件一覽:
2020年,CT041獲美國FDA授予"孤兒藥"資格,用于治療胃癌/食管胃結合部腺癌;
2021年,CT041獲歐洲藥品管理局(EMA)授予"孤兒藥產品"資格,用于治療晚期胃癌;獲EMA授予"優先藥物"(PRIME)資格,用于治療晚期胃癌,CT041亦是全球首個入選PRIME計劃的實體瘤CAR-T產品;
2022年,CT041獲美國FDA授予"再生醫學先進療法"(RMAT)資格,用于治療CLDN18.2陽性的晚期胃癌/食管胃結合部腺癌。據公開可查的資料顯示,CT041是全球首個獲RMAT資格的實體瘤CAR-T產品。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2022年5月10日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,今天公告宣布,公司CAR-T細胞候選產品CT041研究者發起試驗的I期期中分析結果在《Nature Medicine》上發表(https://www.nature.com/articles/s41591-022-01800-8),該雜志為《Nature》旗下國際頂級醫學學術期刊(近2年影響因子:53.44)。作為首個發表于頂級學術期刊的迄今為止最大樣本量的CAR-T細胞治療實體瘤臨床研究,文章公布了該研究更為詳細的中期數據,更為全面地解讀了CT041治療患者的療效和安全性特征、CAR-T細胞的擴增、CAR-T的免疫原性及CT041 T細胞亞群與臨床療效的相關性。
該結果來自于一項題為"Claudin18.2靶向CAR-T細胞在消化系統腫瘤中的Ⅰ期期中分析試驗結果"的在中國開展的、多中心、開放標簽的Ⅰ期臨床試驗,研究CT041治療CLDN18.2表達陽性的晚期消化系統腫瘤患者的安全性、有效性和細胞代謝動力學。結果顯示,在37例晚期消化系統腫瘤患者中,CT041整體耐受性良好且安全性風險可控,在輸注后的28天內未發生劑量限制性毒性(DLT),未發生≥3級細胞因子釋放綜合征(CRS),未發生神經毒性綜合征(ICANS),無治療相關死亡事件。在消化系統腫瘤患者中的客觀緩解率(ORR)和疾病控制率(DCR)分別為48.6%和73.0%,在胃癌患者中的ORR和DCR分別達到57.1%和75.0%。
截至公告日,CT041為全球首個且唯一進入到確證性Ⅱ期臨床試驗的實體瘤CAR-T細胞候選產品。
北京大學腫瘤醫院副院長、消化腫瘤內科主任、Ⅰ期臨床病區主任、北京市腫瘤防治研究所副所長沈琳教授表示:"CAR-T細胞治療已經成功應用于多種血液腫瘤,但在實體瘤治療中鮮有突破。CT041是國際上第一個針對Claudin18.2靶點的CAR-T候選產品。在本臨床研究中,我們在常規治療失敗的消化系統腫瘤患者特別是胃癌患者中觀察到了非常有前景的療效和可控的安全性。這項研究不僅是迄今為止最大樣本的實體瘤CAR-T臨床研究,也應該是CAR-T治療實體瘤療效最好的報道。通過發表在《Nature Medicine》上,與國內外同行分享我們的研究成果,不僅推動CAR-T在實體瘤更大的發展,也證明中國會有越來越多的原創藥物走向國際舞臺。
這項研究離不開科濟產品研發工作人員和我們所有臨床研究者的共同努力,也離不開廣大患者和家屬的支持和信任。對于這款全球首個進入確證性臨床試驗的實體瘤CAR-T候選產品,我們將全力以赴,有序推進其臨床開發,以早日造福廣大癌癥患者。"
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:"祝賀沈琳教授領導的研究團隊,感謝所有研究者的傾力付出和所有患者的積極參與。CT041的IIT研究結果在權威學術期刊《Nature Medicine》上發表,體現出該項研究的質量和價值。眾所周知,創新藥物開發如履薄冰。CAR-T治療實體瘤挑戰非常大,我們和合作者從2015年開展肝癌和腦膠質瘤的臨床試驗至今,一直在不斷努力探索。很高興在沈琳教授的領導下,CT041取得了令人振奮的研究成果。我們將繼續和研究者一起,共同推動CT041在全球的臨床開發進程。"
]]>
上海和波士頓2022年4月8日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,公告任命Raffaele Baffa博士為公司首席醫學官(CMO)。Baffa博士將負責領導公司創新管線候選產品的全球臨床開發戰略和運營。Baffa博士將向科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士匯報。
Baffa博士在制藥行業和研究機構擁有非常豐富的經驗,在加入科濟藥業前,曾在跨國公司和生物技術公司擔任多項領導職務。他曾在Ziopharm Oncology(納斯達克股票代碼:ZIOP,現已更名為“Alaunos”,納斯達克股票代碼:TCRT)擔任首席醫學官和研發執行副總裁,曾在 Medisix Therapeutics (一家專注于開發新型免疫細胞療法的公司)擔任研發負責人和首席醫學官,以及在夏爾制藥(Shire Pharmaceuticals)擔任全球臨床開發部副總裁和腫瘤學治療區負責人,在施維雅制藥(Servier Pharmaceuticals)收購夏爾腫瘤學部門后,Baffa博士擔任施維雅制藥首席醫學官。Baffa博士還曾在輝瑞和賽諾菲等全球知名藥企擔任過其他領導職務。
Baffa博士擁有意大利帕多瓦大學醫學院的醫學博士學位,并擁有意大利帕爾馬大學生物學和分子病理學博士學位。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:
“代表董事會熱烈歡迎Baffa博士加入科濟藥業,Baffa博士作為一名資深的醫學專業人士和行業專家,在腫瘤和細胞免疫治療領域的臨床開發和轉化科學方面擁有豐富的經驗。Baffa博士曾在跨國公司以及生物技術公司擔任多個醫學領導職位,并積累了豐富經驗。當前正值CT053和CT041的臨床試驗在北美大力推進,并在其他地區積極開拓之際,Baffa博士的加入將進一步推動我們創新管線候選產品的全球臨床開發。”
科濟藥業首席醫學官Raffaele Baffa博士表示:
“我很高興能加入科濟藥業。科濟藥業作為全球細胞治療領域的領先公司之一,擁有豐富且差異化的產品管線和技術平臺,如同種異體技術平臺THANK-uCAR®和精準靶向技術LADAR®等。科濟正在北美開展的臨床試驗以及建造的美國生產工廠,彰顯了科濟藥業對于全球市場的重視和持續投資。期待與科濟藥業的所有同事及外部合作伙伴勠力同心,推動公司管線產品的全球臨床開發,為全球癌癥患者帶來更多創新產品。”
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
聯系我們
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2022年3月23日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,今日公告,公司自主研發的CAR-T細胞候選產品CT041于北京大學腫瘤醫院完成了中國確證性II期臨床試驗的首例患者入組,主要治療既往接受過至少二線治療失敗的Claudin18.2(CLDN18.2)表達陽性的晚期胃癌/食管胃結合部腺癌(GC/GEJ)。
截至發稿日,CT041為全球首個且唯一進入到確證性II期臨床試驗的用于治療實體瘤的CAR-T細胞候選產品;也是全球唯一已獲得美國FDA和中國國家藥監局及加拿大衛生部的IND/CTA批準、并正在進行臨床試驗研究的靶向CLDN18.2的CAR-T細胞候選產品。公司認為,CT041有可能在未來成為胃癌/食管胃結合部腺癌和胰腺癌的骨干療法并惠及全球大量患者。
CT041重要監管里程碑事件一覽:
2020年,
CT041獲美國FDA授予“孤兒藥”資格,用于治療胃癌/食管胃結合部腺癌;
2021年,
CT041獲歐洲藥品管理局(EMA)授予“孤兒藥產品”資格,用于治療晚期胃癌;
CT041獲EMA授予“優先藥物”(PRIME)資格,用于治療晚期胃癌。CT041亦是全球首個入選PRIME計劃的實體瘤CAR-T產品;
2022年,
CT041獲美國FDA授予“再生醫學先進療法”(RMAT)資格,用于治療CLDN18.2陽性的晚期胃癌/食管胃結合部腺癌。據公開可查的資料顯示,CT041是全球首個獲RMAT資格的實體瘤CAR-T產品。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:
“2021年9月ESMO大會公布的研究者發起臨床試驗數據顯示了CT041前景光明的治療效果及良好的安全性。在接下來的臨床試驗中,我們將進一步探索CT041治療晚期胃癌/食管胃結合部腺癌、以及胰腺癌的有效性和安全性。我們期待CT041這款潛在全球同類首創CAR-T產品取得積極的研究進展,早日滿足未被滿足的醫療需求,使廣大患者獲益。”
關于CT041
CT041是一種潛在全球同類首創的、靶向CLDN18.2的自體CAR-T細胞候選產品,用于治療CLDN18.2陽性實體瘤,主要治療胃癌/食管胃結合部腺癌及胰腺癌。
科濟藥業在中國開展了研究者發起的試驗、一項針對晚期胃癌/食管胃結合部腺癌和胰腺癌的Ib期臨床試驗、一項針對晚期胃癌/食管胃結合部腺癌的確證性II期臨床試驗,以及在北美啟動了一項針對晚期胃癌或胰腺癌的1b期臨床試驗,亦擬于2022年在北美啟動關鍵2期臨床試驗。
關于CLDN18.2
CLDN18.2是一種高度選擇性的細胞譜系標記物,在70%至80%胃癌患者及約60%胰腺癌患者的癌組織中普遍表達。CLDN18.2在正常組織中的表達嚴格限于胃黏膜分化的上皮細胞,并不存在于胃干細胞區。CLDN18.2可在正常組織的惡性轉化中保留,從而使其在極大比例的原發性轉移性胃癌細胞中表達。除胃癌組織外,CLDN18.2在其他類型實體瘤(如胰腺癌及食道癌)中表達。
科濟藥業在全球范圍內率先成功識別、驗證并報告CLDN18.2可作為其普遍及高表達的實體瘤的相關抗原,有潛力用于開發治療實體瘤的CAR-T療法。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
聯系我們
更多信息,請訪問公司網站:https://www.carsgen.com/

上海2022年3月3日 /美通社/ -- 2022年3月3日,科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,今日公告,公司自主研發的CAR-T細胞候選產品CT041獲中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)同意進入確證性Ⅱ期臨床試驗,主要治療既往接受過至少二線治療失敗的Claudin18.2(CLDN18.2)表達陽性的晚期胃癌/食管胃結合部腺癌(GC/GEJ),該試驗旨在評估CT041治療晚期胃癌/食管胃結合部腺癌的有效性和安全性。
截至發稿日,CT041為全球首個且唯一進入到確證性Ⅱ期臨床試驗的用于治療實體瘤的CAR-T細胞候選產品。
根據Globocan 2020數據統計,胃癌是全球第五大常見癌癥,2020年全球胃癌新發病例達108.9萬,死亡病例為76.8萬例。其中,中國新發病例數達47.8萬,占全球新發病例約43%,死亡病例37.3萬例,占全球死亡病例數近50%。在中國,胃癌疾病負擔重,晚期胃癌5年生存率很低,胃癌治療亟需新的療法來打破現有的治療瓶頸。
CT041作為一種潛在全球同類首創(First-in-class)的、針對CLDN18.2靶點的自體CAR-T細胞候選產品,在正在進行的臨床試驗中表現出前景光明的治療效果及良好的安全性。2021年9月ESMO大會公布的研究者發起試驗最新數據表明,在既往接受至少2線治療失敗、接受II期推薦劑量(RP2D) 2.5×108 CT041細胞治療的18例胃癌/食管胃結合部腺癌患者中,客觀緩解率達61.1%。歷史數據表明,至少2線治療失敗的胃癌患者,化療藥物或抗血管生成多激酶抑制劑的客觀緩解率約為4%~8%,抗PD-1單抗的客觀緩解率約為11%。
CT041既往重要監管里程碑事件一覽:
- 2020年,CT041獲美國FDA授予“孤兒藥”資格,用于治療胃癌/食管胃結合部腺癌;
- 2021年,CT041獲歐洲藥品管理局(EMA)授予“孤兒藥產品”資格,用于治療晚期胃癌;
- 2021年,CT041獲EMA授予“優先藥物”(PRIME)資格,用于治療晚期胃癌。CT041亦是全球首個入選PRIME計劃的實體瘤CAR-T產品;
- 2022年,CT041獲美國FDA授予“再生醫學先進療法”(RMAT)資格,用于治療Claudin18.2 (CLDN18.2)陽性的晚期胃癌/食管胃結合部腺癌(GC/GEJ)。據公開可查的資料顯示,CT041是全球首個獲RMAT資格的實體瘤CAR-T產品。
北京大學腫瘤醫院副院長、消化腫瘤內科主任、Ⅰ期臨床病區主任、北京市腫瘤防治研究所副所長沈琳教授表示:
“胃癌是中國大癌,每年新患病例數在50萬左右,但針對至少二線治療失敗后的胃癌患者的治療手段非常有限,現有藥物包括抗PD1單抗的中位無進展生存(mPFS)均在兩個月左右[1],迫切需要創新藥物。已披露的我們中心牽頭開展的CT041的早期數據觀察到了超過5個月的mPFS,顯示了良好的治療前景,所以我們非常期待通過接下來的研究來進一步確定其臨床獲益,推動該產品的發展,爭取早日為廣大患者提供一個最佳的治療機會。”
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:
“CT041率先在中國進入確證性Ⅱ期臨床試驗是廣大中國患者的福音,也是中國近年來一系列促進醫藥創新政策支持下的成果。本次獲批對科濟藥業來說只是一個新的起點,我們將通過持續的創新研發為腫瘤患者提供更好的治療手段,期待 CT041在未來成為胃癌/食管胃結合部腺癌和胰腺癌等惡性腫瘤的骨干療法,早日惠及全球患者。”
科濟藥業長期堅持源頭創新,公司已建立11款產品管線,均為自主研發且擁有全球權益,已獲8個CAR-T產品的臨床試驗許可(IND),在中國所有CAR-T公司中排名第一。截至2021年12月31日,公司已在全球申請專利300余件,其中授權專利65件。
為了讓CAR-T產品盡快惠及更多患者,科濟藥業在全國同類公司中率先建立了綜合性的細胞治療平臺,形成了覆蓋質粒生產、慢病毒載體生產、CAR-T細胞產品制備全過程,端對端的生產制造能力。科濟藥業在上海市金山區建成的商業化生產廠房,取得了中國第一張CAR-T細胞療法的藥品生產許可證,預計每年可支持多達2000名患者的CAR-T治療;同時,科濟藥業位于美國北卡羅來納州三角研究園的總建筑面積3300平方米的生產工廠也已建設完工,助力公司全球化生產能力再上新臺階。
關于CT041
CT041是一種潛在全球同類首創的、靶向CLDN18.2的自體CAR-T細胞候選產品,用于治療CLDN18.2陽性實體瘤,主要治療胃癌/食管胃結合部腺癌及胰腺癌。
截至發稿日,CT041為全球唯一已獲得美國FDA和中國國家藥監局及加拿大衛生部的IND/CTA批準、并正在進行臨床試驗研究的靶向CLDN18.2的CAR-T細胞候選產品。
除了在中國的研究者發起的試驗外,科濟藥業還在中國啟動了一項針對晚期胃癌/食管胃結合部腺癌和胰腺癌的Ib期臨床試驗,以及在北美啟動了一項針對晚期胃癌或胰腺癌的1b期臨床試驗,亦擬于2022年在北美啟動關鍵2期臨床試驗。
關于CLDN18.2
CLDN18.2是一種高度選擇性的細胞譜系標記物,在70%至80%胃癌患者及約60%胰腺癌患者的癌組織中普遍表達。CLDN18.2在正常組織中的表達嚴格限于胃黏膜分化的上皮細胞,并不存在于胃干細胞區。CLDN18.2可在正常組織的惡性轉化中保留,從而使其在極大比例的原發性轉移性胃癌細胞中表達。除胃癌組織外,CLDN18.2在其他類型實體瘤(如胰腺癌及食道癌)中表達。
科濟藥業在全球范圍內率先成功識別、驗證并報告CLDN18.2可作為其普遍及高表達的實體瘤的相關抗原,有潛力用于開發治療實體瘤的CAR-T療法。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
參考資料
| [1]Yoon-Koo, Kang, Narikazu, et al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial.[J]. Lancet, 2017. |

美國北卡羅來納州達勒姆、羅利和教堂山2022年2月21日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,今日公告,公司旗下美國公司CARsgen Therapeutics Corporation在美國北卡羅來納州三角研究園(RTP)區域建設的cGMP生產工廠(以下簡稱“RTP生產工廠”)已通過當地政府官方檢查。科濟藥業已獲得達勒姆市縣檢驗局頒發的合規證書,并啟動臨床生產運營。RTP生產工廠是科濟藥業全球首個啟動運營的中國以外的工廠,標志著公司全球化布局邁上新臺階。
當地時間2月18日上午,公司在RTP生產工廠現場舉行了啟動儀式,美國北卡羅來納州和達勒姆市當地政府及經濟發展部門官員、RTP生產工廠建設相關服務方、以及科濟藥業美國公司的重要合作伙伴等共同出席了本次儀式。
RTP生產工廠采用了一體化的項目交付方法,大大縮短了施工周期,提高了成本效益。工廠總建筑面積約為3300平米,裝備精良、技術先進,每年可以為700名患者提供服務,將顯著提升科濟藥業的自體CAR-T細胞產品生產能力,并將支持公司在北美和歐洲的臨床研究和早期商業化,科濟藥業已開始為RTP生產工廠的運營組建一支世界級的CMC團隊。該項目已獲得美國北卡羅來納州達勒姆縣和達勒姆市的人才發展投資基金(JDIG)支持以及其他投資激勵。
為了加快RTP生產工廠的臨床生產,科濟藥業位于中國上海金山區的GMP生產工廠(以下簡稱“金山生產工廠”),將繼續為公司旗下兩款核心候選產品CT053和CT041在美國開展FDA批準的IND臨床研究,提供用于制造CAR-T細胞產品的慢病毒載體物質。科濟藥業已經建立了可持續和可擴展的慢病毒載體GMP生產能力,以及包括質粒、慢病毒載體和CAR-T細胞產品的端到端、一體化生產能力。金山生產工廠所具備的大規模生產病毒載體物質能力將大大降低CAR-T細胞產品的制造成本,提高患者可及性。
CARsgen Therapeutics Corporation總裁Richard Daly先生表示:
“我們很高興慶祝科濟藥業在美國的第一家cGMP生產工廠盛大開業,這是我們全球化布局的重要里程碑。RTP生產工廠,以及科濟藥業在中國上海的兩個現有的GMP生產工廠,將提高公司的全球化生產能力,增強供應鏈的可持續性,推進公司的臨床研究,并助力早期商業化。期待RTP生產工廠早日為北美和歐洲的患者帶去科濟藥業創新和差異化的CAR-T細胞療法,并進一步造福全球患者。”
關于北卡羅來納州三角研究園
三角研究園(RTP)成立于1959年,是美國最早、規模最大的研發產業園,是美國媒體和研究機構評選的經濟發展最快都市圈排行榜的常客,其科研投入、高科技人才比例等指標位居全美前列。三角研究園經濟區主要涉及制藥、生物技術、醫療保健、分析儀器、計算機處理技術、信息技術等多個產業集群。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。


![KM Plot of PFS/OS - GC/GEJ Mono [Selected (No LM/BM & CLDN18.2 High expression) Vs Others] KM Plot of PFS/OS - GC/GEJ Mono [Selected (No LM/BM & CLDN18.2 High expression) Vs Others]](https://mma.prnasia.com/media2/2429215/image_5019987_4556921.jpg?p=medium600)