引領"自然日交付"的五大核心技術支撐
1.全產業鏈自主可控:實現合成原料、設備與工藝的完全自主
2.引物合成突變率降低,杜絕返工
3.基因組裝效率躍升,多片段合成能力提升
4.檢測技術升級,Sanger測序+NGS雙重保障體系
5.智能生產體系,MES系統管理,層層精控,步步為贏
擎科生物基因合成負責人表示"自然日交付不僅僅是周期數字的變化,更是我們對研發生產效率的重新定義。通過基因合成自主全產業鏈,我們正在幫助全球科學家把更多時間留給創新本身"。
"基因工廠"打造高效交付體系
擎科生物基因工廠,運用智能化、工廠化思維,集合成原料、合成設備、合成工藝于一體,搭建智能化合成產線,在數字化管理系統的賦能下,可為客戶提供包含核心產品基因合成在內的,寡核苷酸合成/修飾、基因檢測、化學試劑、生物試劑、儀器設備、抗體蛋白、基因調控等多種服務和產品,形成強大的交付能力和產品協同優勢。
總結與展望
在當前全球供應鏈環境日益復雜的背景下,擎科生物的"自然日交付"能力不僅代表了服務模式的升級,更彰顯了中國生物科技行業的自主創新力量。隨著"基因工廠"模式的持續深化,擎科將進一步優化產業鏈整合,確保交付速度與質量的雙重保障,推動更多前沿技術落地,并為全球科學家提供更加高效、穩定的支持。
]]>當前行業面臨的主要挑戰集中在三個維度:
- 技術創新 —— 高載量合成儀等關鍵設備的自主研發能力亟待突破;
- 成本優化 —— 核心原料的穩定供應與成本控制直接影響研發效率;
- 交付保障 —— 從設備到試劑的全流程供應時效關系到項目進度。
在這樣的行業背景下,擎科生物通過全產業鏈布局,為生物技術企業提供了更可靠的技術支持和解決方案。其構建的自主創新體系,正在幫助行業突破發展瓶頸,推動產業向更高效、更穩定的方向發展。
擎科解法:基因工廠的"全產業鏈黃金三角"
- 源頭掌控:四維一體全鏈條覆蓋
擎科生物通過化學原料+智能設備+合成試劑+合成技術的全產業鏈布局,實現全流程自主研發與生產。
化學原料自主化:子公司河北迪納興科實現CPG、分子篩、單體等關鍵原料100%國產化,建立了完整的原料供應體系。
設備自主研發:自主研發多種類型的高通量、高質量和高載量合成儀,合成通量從2 nmol至50 mmol不等,滿足各類應用,實現關鍵設備的自主可控。
酶試劑閉環供應:子公司達領生物自主研發生產的克隆、qPCR等全系列試劑,全面適配國產設備,并在擎科及客戶場景中累計驗證數千萬次,保障性能穩定、交付可控。
合成技術壁壘:擎科自動化分析軟件評估基因序列的功能與結構復雜性,識別毒性基因、poly結構、重復序列等風險;多方案設計系統提供高效構建策略,顯著提高成功率;密碼子優化降低序列合成難度,提升蛋白表達;自主研發酵母組裝與智能組裝系統,支持長達200 kb大片段合成。整體交付成功率已達到行業領先水平。
- 智能筑基:Helixtech系統串聯全流程
全鏈路數字化管控:從訂單錄入到質檢交付,Helixtech系統實現生產、質控、物流數據實時聯動,交付周期快至3天;
高效精準:自動化序列分析評估軟件結合智能算法,確保序列優化快速、精準,分析速度0.1秒/個,準確度高,顯著提升優化效率;
產能彈性擴展:天津、南京基因合成基地聯動,日產能達百萬級堿基,確保供應鏈穩定供應。
- 生態賦能:從本土到全球的韌性網絡
次日達網絡:全國20+城布局Oligo合成實驗室,北京/蘇州修飾引物GMP車間(梓熙生物)實現常規引物產品次日達甚至當日達;
全球化服務:服務全球30多萬科研與工業客戶,包括清華、北大、哈佛、斯坦福等提供專業服務,確保及時響應。
技術協作:與創新形企業開放合作,降低行業試錯成本,共同構建可持續發展的技術生態體系。
- 價值重構:從企業護城河到全球生物經濟新范式
擎科生物的"基因工廠"正在重塑產業規則:全產業鏈自主將CPG、合成儀等關鍵領域實現技術自主,建立完整的產業生態體系。
重定義安全標準:ISO 9001、13485、14001、45001認證+萬級GMP車間,建立完整全面的質量管理體系,讓"中國造"基因產品比肩國際品質;
倡導開放創新:通過技術共享與跨國協作,促進合成生物學、生物制造等領域的融合發展,推動產業鏈深度協同。"真正的生物安全,源于每一段寡核苷酸的自主合成。" —— 這或許是對擎科模式的最佳注解。
擎科的布局的遠見 —— 將原料、設備、技術、數據全鏈條握于手中,當"基因工廠"從中國輻射至全球,它不僅是產業的避風港,更是中國為世界生物經濟貢獻的"新基建"。
]]>一、酶工程的困境:傳統改造方法的"攔路虎"
酶,作為生物催化劑的"明星",在工業生產中扮演著重要角色。然而,自然酶在復雜多變的工業生產環境中,往往難以完全契合嚴苛的生產要求。為了讓酶更好地服務于生產,科研人員不得不對其進行改造。
1. 傳統方法的局限:隨機誘變的"大海撈針"
傳統的酶工程改造手段——隨機誘變,曾一度發揮作用。然而,這種方法猶如"大海撈針",篩選工作耗時耗力,且成功率極低。科研人員需要在海量的突變體中尋找那一顆"珍珠",不僅工作量巨大,還伴隨著高昂的成本。
2. 理性和半理性改造:進步中的"新痛點"
隨著科技進步,理性改造和半理性改造方法應運而生。這些方法雖然比隨機誘變更為高效,但仍存在諸多挑戰。科研人員在進行分子對接、動力學模擬等關鍵分析時,需要具備極高的專業素養,且需在海量參數中艱難抉擇。這一過程極為復雜,批量分析幾乎成為奢望,許多科研人員因此望而卻步,酶改造效率大打折扣。
二、擎科AI蛋白智能開發平臺:酶工程的"超級助手"
面對傳統酶工程改造的種種困境,擎科AI蛋白智能開發平臺應運而生。精準解鎖了酶工程改造的難題,助力企業和科研人員突破瓶頸,開啟酶工程的嶄新未來!
1.多維度蛋白評估:筑牢優化根基
平臺從蛋白質最基礎的一級序列出發,運用protein LLMs模型精準預測其復雜的三級結構。同時,整合分子對接、折疊自由能、動力學模擬等一系列先進的計算化學方法,為酶的催化活性提供全方位、深層次且詳盡的數據支撐。這些數據如同穩固的基石,為酶的優化設計工作奠定堅實基礎,讓后續改造工作有的放矢,方向明確。
2. AI智能設計算法:提升研發效能
平臺搭載先進的神經網絡深度學習模型,如同一位不知疲倦且智慧超群的篩選大師。它能夠對酶序列生成的多組候選突變體進行高效篩選,通過持續優化蛋白質序列,不僅顯著提升了酶的活性和穩定性,還讓研發周期大幅縮短。此外,篩選模型具備自我進化能力,能夠根據不斷反饋的數據優化分析模型,使得精準度持續提升,為酶工程研發注入源源不斷的動力。
3. 密碼子優化:暢通生產轉化之路
緊密貼合基因工程的特性,平臺將優化后的酶序列轉化為穩定表達的基因模板。攻克了長期以來從體外基因合成到體內正常表達過程中的難題。助力科研人員順利跨越"最后一公里",快速達成實驗目標,加速了酶的工業化進程。
4. 多元模型適配:滿足多樣需求
考慮到用戶在不同場景下的多樣化需求,我們精心設計了多元模型體系。采用protein LLMs模型預測獲取蛋白結構。簡易模型如同快速偵察兵,使用序列分析和能量計算等技術,適用于快速初步篩選;標準模型增加分子對接功能,適合中等復雜度的酶優化;專業模型涵蓋動力學模擬,適用于高精度、高復雜度的酶開發。這種精細化的模型設計,讓酶開發工作更加靈活高效,充分滿足不同用戶的個性化需求。
三、創新亮點:擎科AI平臺如何引領行業變革?
1. 突破傳統局限,開辟高效新路徑
擎科AI蛋白智能開發平臺通過多維度數據分析與AI算法預測,徹底打破了傳統酶工程改造方法的桎梏。不再受限于繁瑣低效的傳統模式,而是開辟出一條高效、精準的全新發展路徑,為酶工程的發展注入了全新活力與無限可能。
2. 加速開發流程,提升創新效率
強大的高通量篩選功能,猶如為科研人員配備了超級助手,使他們從大量重復且耗時的實驗中解脫出來。研發周期的大幅縮短,在更短的時間內能夠實現更多的創新突破,極大地加速了整個行業的發展步伐。
3. 降低研發成本,實現降本增效
精準的優化設計使得不必要的試錯環節大幅減少。企業無需再為大量無效實驗投入高昂成本,真正實現了降本增效。這不僅有助于企業提升經濟效益,更讓整個行業在資源利用上更加高效合理,實現可持續發展。
4. 攻克科研難題,賦能科研人員
針對科研人員在分子對接或動力學模擬分析蛋白時面臨的操作繁瑣、參數選擇困難等棘手問題,平臺給出了完美解決方案。讓科研人員擺脫復雜操作的困擾,專注于核心科研工作,為科研創新提供了有力保障,激發了科研人員的創新活力。
四、未來展望:擎科AI平臺助力生物制造邁向新高峰
在聚焦新質生產力的時代浪潮下,擎科AI蛋白智能開發平臺正憑借功能與創新亮點,重塑酶工程發展格局,共同推動生物制造產業邁向新的高峰。
酶工程的未來已來,擎科AI蛋白智能開發平臺正以科技之力,為生物制造注入無限可能。讓我們攜手擎科,共同開啟生物制造的新篇章!
聯系方式:擎科生物市場部,Market@tsingke.com.cn
"雛鷹企業"是天津市推出的一項重要榮譽評選,旨在表彰那些在技術創新和商業模式上具有獨特優勢和發展潛力的企業。作為"雛鷹-瞪羚-領軍"企業梯度培育體系的一部分,天津市通過科技型企業身份評價和多項指標的綜合企業評價,為具有創新能力的企業提供全方位的支持與扶持。
天津擎科作為擎科基因合成全產業鏈中的重要一環,積極響應天津市支持創新型企業發展的政策,在激烈的市場競爭中脫穎而出,成為天津市"雛鷹企業"的新晉成員。公司始終致力于推動科技創新,深耕技術研發,不斷提升自主研發的核心競爭力,成為推動天津市科技和經濟發展重要力量。
"雛鷹企業"榮譽資質的授予,是天津市推動創新型經濟和科技型企業發展的一個重要舉措。通過該項評選,市政府旨在通過多維度評價與培育機制,促進各類創新要素向企業集聚,從而不斷增強企業的創新主體地位,為本市經濟的高質量發展注入新的活力。
未來,擎科生物將肩負推動"生物科技?讓世界更美好"的使命,秉承"品質、創新、奮斗、共贏"的價值觀,努力在科技創新的道路上不斷前行,為天津市的科技創新和產業升級貢獻更大力量。
]]>王亞寧博士的行業經驗與貢獻
王亞寧博士在醫藥領域擁有豐富的經驗和卓越的成就。他于1996年獲得北京大學藥學學士學位,1999年取得國家興奮劑檢測中心生物化學碩士學位,并于2003年在佛羅里達大學獲得藥學博士及統計學碩士雙學位。在美國食品藥品監督管理局(FDA)工作期間,王博士先后擔任多個關鍵職位,最終擔任臨床藥理審評室定量藥理學審評部部長,主導了多項新藥的審批,確保其安全性和有效性,為全球藥品監管領域的進步做出了重要貢獻。
全球小核酸藥物的快速發展與合規挑戰
隨著全球小核酸藥物市場的快速擴展,對高品質、合規化原料的需求日益增加。小核酸藥物,尤其是用于治療遺傳性疾病、罕見病以及癌癥的創新藥物,已成為全球制藥行業的研究熱點。隨著市場對這些藥物的需求不斷增加,企業不僅面臨著技術挑戰,更要確保產品符合日益嚴格的監管要求。
擎科生物作為合成領域的領軍企業,已在小核酸藥物領域積累了強大而深厚的技術基礎與產業鏈資源。通過與王亞寧博士的合作,擎科生物將引入最新的全球監管標準和合規指導,提升企業的合規化管理能力,確保產品在復雜的市場環境中滿足最高的質量和安全要求。
擎科生物的技術優勢和全產業鏈服務
擎科生物在小核酸藥物的設計、合成、遞送及生產方面擁有完整的技術平臺,并通過全資子公司——梓熙生物,進一步擴大了在該領域的布局。梓熙生物積累了豐富的項目經驗,提供從序列設計、合成、篩選到驗證的全方位服務。公司已經建立了大規模的寡核苷酸原料藥生產線,可以提供從μg級到kg級的寡核苷酸合成服務,滿足科研級別到GMP級別的交付需求,支持客戶完成臨床前研究,具備中試和放大經驗,為臨床及商業化需求提供定制化的服務與技術支持。
推動小核酸藥物領域的技術迭代與創新
小核酸藥物的開發涉及多個環節,包括適應癥的選擇、靶點篩選、序列設計、化學修飾、藥物遞送和工藝放大等。在罕見病治療領域,小核酸藥物的開發和應用潛力巨大,尤其對那些由單基因突變引起的疾病,具有高度的適配性和治療潛力。
隨著2024年諾貝爾生理學或醫學獎的揭曉,Victor Ambros博士和Gary Ruvkun博士因發現microRNA及其在轉錄后基因調控中的作用獲得該獎項,也進一步推動了RNA相關技術在全球制藥領域的關注與發展。
擎科生物致力于不斷推動小核酸藥物的核心技術的迭代創新,重點攻克小核酸合成、修飾、遞送和放大等關鍵技術難題,在技術平臺上驗證藥物的安全性和遞送效率。通過不斷提升技術創新與產業化能力,擎科生物將與國內外專家學者攜手合作,推動小核酸藥物在更廣泛的適應癥中實現突破。
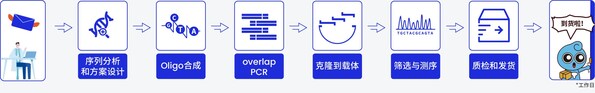
今天,本篇將繼續帶您走進擎科基因工廠,詳細探討擎科生物在Oligo合成等方面的技術優勢,以及如何通過精密控制和智能化平臺,實現基因合成高效交付的背后秘密。通過技術升級與質量管理,擎科生物不僅為客戶提供了可靠的產品質量保障,還為廣泛應用領域的發展提供強有力的支持。
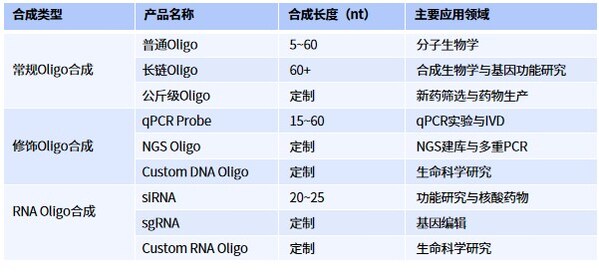
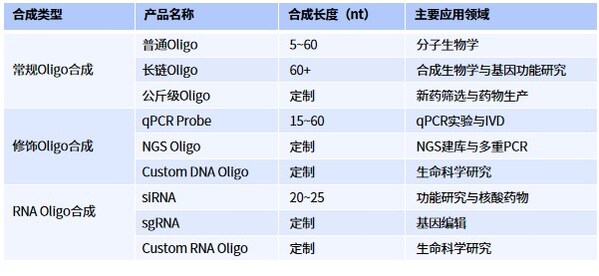
高效率和高準確度的Oligo合成
寡核苷酸(Oligo)合成是基因合成的基礎模塊。在基因合成過程中,短鏈寡核苷酸片段首先被合成,然后通過拼接和延長構建出完整的基因序列。Oligo合成不僅對基因合成至關重要,還涵蓋了DNA和RNA的合成,以及修飾寡核苷酸的合成。這些合成在分子生物學、基因治療、診斷和藥物開發等領域發揮著關鍵作用。
- 合成效率和合成長度
Oligo合成通常采用化學合成固相亞磷酸三酯法,通過每個【脫保護,偶聯,加帽,氧化】的循環逐個加入核苷酸單元,每一步反應效率都不能達到100%,且該過程會隨著引物長度的增加而變得復雜。每輪寡核苷酸的合成效率都會影響最終的總合成效率。隨著合成長度越長,總合成效率會降低,即使每個合成周期的效率高,但當鏈長增加到一定程度時,產物中的目標序列占比會顯著降低。假設每步反應效率是98%,合成100 nt長度時,產物中的目標序列占比降至13.26%(98%的100次方),且較難純化出目標的Oligo。而且較長的鏈會增加內部錯誤配率對和二級結構形成的可能性,這也將導致合成效率下降和錯誤率上升。
引物合成的耦合效率高低與多種因素相關,包括人員專業性、機器先進性、原料穩定性、規章制度的精細性以及環境控制的嚴格性。2024年年初擎科生物從"人機料法環"5個方面進行了全面升級,并嚴格執行周期質量跟蹤。擎科生物Oligo合成每步耦合效率高達99.5%,這為總效率提供了保障,合成長度可達200 nt。
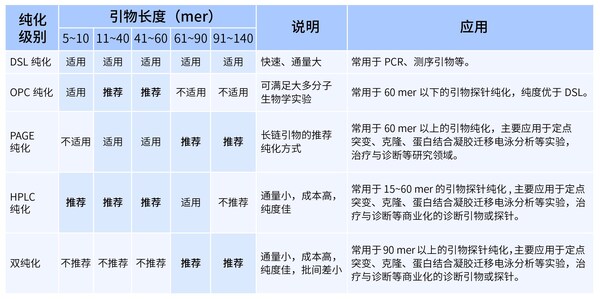
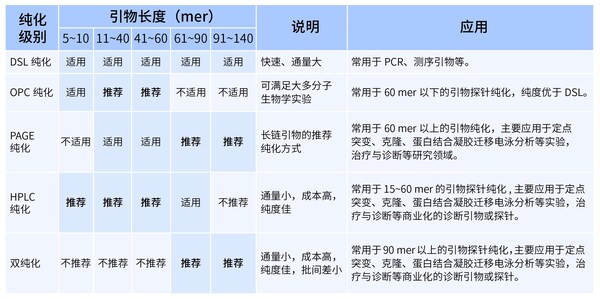
- 合成純度
純度指目標序列占全部序列的百分比,Oligo的純度對于確保實驗的準確性和可靠性至關重要。從實驗的準確度來說,Oligo的純度越高,實驗結果通常越可靠。但在實際應用中,綜合考慮成本、時間和實驗需求,合理選擇純度是關鍵。常見的純化方式有DSL 純化、OPC 純化、PAGE 純化、HPLC 純化等。擎科生物子公司梓熙生物是業內為數不多支持CE檢測的企業,精度可達1 nt的分辨率。
- 合成修飾
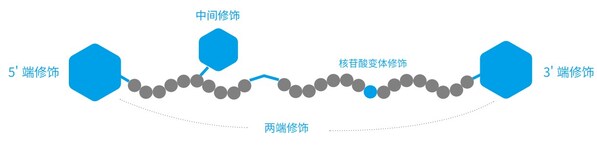
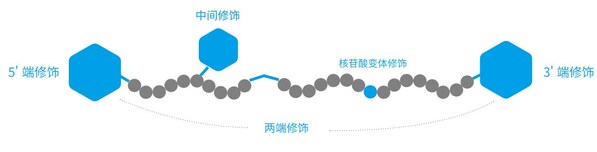
為了提高Oligo在不同應用場景下的穩定性、細胞攝取效率以及特定實驗的靈敏度和特異性,可以進行核苷酸變體、熒光基團、淬滅基團、化學連接基團、生物素等不同修飾。
擎科生物子公司梓熙生物,在北京和蘇州布局了高質量修飾引物/探針的生產工廠,可提供百余種修飾基團,客戶可根據需要進行選擇,修飾位置包括5'端修飾、3'端修飾、雙標修飾、中間修飾與核苷酸堿基修飾,按照功能可劃分為以下幾類:
擎科生物具備卓越的Oligo合成能力,不僅顯著提升了基因合成的成功率和成本控制,還為mRNA疫苗研發、抗體藥物制備、基因編輯、分子診斷及基礎科研等領域提供了高品質的Oligo產品,為各領域客戶的研究和開發提供了有力支持。同時不斷優化流程與配送時效,全國20個合成基地附近均可提供次日早晨送達服務,部分基地快至當日達。
從PCR到基因組裝:揭示合成關鍵步驟與精準驗證
由于寡核苷酸從頭合成長度的限制,通常采用DNA組裝技術、使用短寡核苷酸作為原料來構建更長的合成片段。常用的組裝方法包括全片段酶促連接法和酶促填充法。全片段酶促連接法利用DNA連接酶將具有5'磷酸化且重疊互補的寡核苷酸片段連接形成雙鏈DNA。酶促填充法基于聚合酶循環組裝(Polymerase Cycling Assembly,PCA)技術,使用DNA聚合酶將重疊的寡核苷酸延伸成雙鏈片段,通過overlap PCR獲取較長片段,然后將各片段一起組裝至載體上,最終構建出完整載體。
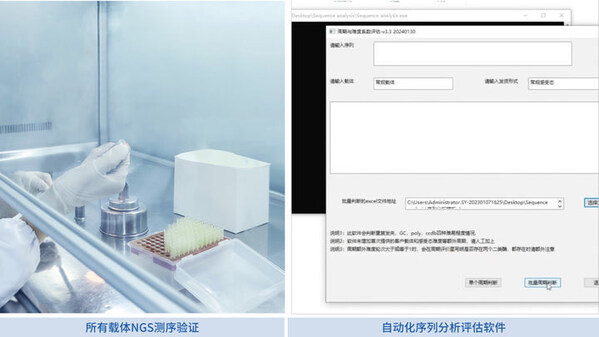
擎科生物的基因合成智能化生產平臺專注于1.5 kb以內短片段的自動化生產,能夠有效減少人工操作失誤并顯著提高生產效率。客戶可根據不同應用需求選擇合適的載體骨架。公司已經建立了一個精準規范的載體庫,提供160多個免費載體供選擇,并可按需制備合格的線性化載體。同時,擎科生物還為客戶自備的載體提供NGS測序驗證,確保載體序列的準確性,并提供一年的免費存儲服務,方便后續使用。
為保證高效且高質量的基因合成過程,擎科生物自主研發了高品質的重組酶、聚合酶和感受態細胞,這些都是保證載體構建及PCR片段連接反應順利進行的關鍵試劑。全流程的試劑控制確保每個環節的質量。
在自動化生產過程中,載體與PCR片段的連接反應由自動移液工作站完成,復蘇液通過自動涂布儀進行樣品涂布,隨后利用全自動菌落挑選儀篩選陽性克隆。整個過程支持二維碼和條形碼管理,大幅提高了生產效率,減少了人工失誤。
擎科生物還采用了自主開發的"磁珠法測序平臺"進行Sanger測序,確保目的序列的100%準確性。此外,創新性的Fast NGS技術用于NGS測序,進一步保障了全質粒序列的精準度。通過智能化生產線的全程控制,從自動化序列分析到篩選、測序和質檢,每一環節都經過嚴格把控,確保基因合成的高效率和高質量。最終,擎科生物的基因合成交付率超過99.5%,最快可在3天內完成交付。
在對擎科基因工廠的探秘之旅中,我們深入探討了擎科基因工廠的核心組成部分,從自研的高質量合成原料到創新的合成儀設備,再到高效精準的合成技術與流程控制,每一環節都為推動基因合成技術的快速發展奠定了堅實基礎。通過這些創新,擎科生物不僅打破了技術壁壘,建立起全自主的產業鏈,還在提高核酸合成效率、合成規模的同時,保證了產品的高質量和高交付速度。
隨著基因合成技術的不斷進步,我們可以預見未來生物醫藥、基因治療、精準醫療等多個領域都會發生前所未有的變革。擎科生物在這場技術革命中,將為相關產業注入了強勁的動力。未來,擎科生物將繼續發揮創新優勢,推動基因合成技術的發展,為全球生物產業帶來更多突破。
擎科生物突破技術壁壘形成基因合成全自主產業鏈的基因工廠,并向下游多個應用領域拓展,以此推動生物技術和生物經濟發展。
擎科基因工廠是以合成要素中的合成原料、合成設備及合成工藝進行自動化自我聚集,搭建出合成要素自主的生產平臺,可實現穩定、高效、自動化的核酸合成。
擎科基因工廠生產的核酸類型從十幾bp到十幾kb甚至幾百kb更長,廣泛應用于各個領域,從科學研究到工業生產。例如,Oligo合成在分子生物學研究、分子診斷、基因編輯和核酸藥物等多個領域中具有廣泛應用,不僅為科學研究和技術創新提供了關鍵工具,還為拓展疾病治療方法開辟了新途徑。基因合成的應用涵蓋核酸、氨基酸和蛋白質等多個領域,在基礎科研中發揮著關鍵作用,同時也廣泛應用于核酸疫苗、基因細胞療法等領域。而基因組合成和最簡基因組合成的應用,則包括生物育種、菌種改造以及代謝改造等領域的應用,將對未來食品和材料領域產生積極影響。
為揭開擎科基因工廠的神秘面紗,本"擎科基因工廠大探秘"系列文章,將帶領大家深入了解。
一、合成原料與合成儀
基因合成的起點是寡核苷酸合成,寡核苷酸合成為基因合成提供了至關重要的原材料。在這個過程中,合成原料是寡核苷酸合成的基礎,正如俗話所說:"巧婦難為無米之炊",合成原料的質量直接決定了最終產品的準確性和可靠性。同時,合成儀作為核心裝備,其通量、載量、長度和效率也顯著影響合成的成本和質量。因此,本篇文章首先聚焦于"基因工廠"的核心基礎——合成原料和合成儀。
01 合成原料
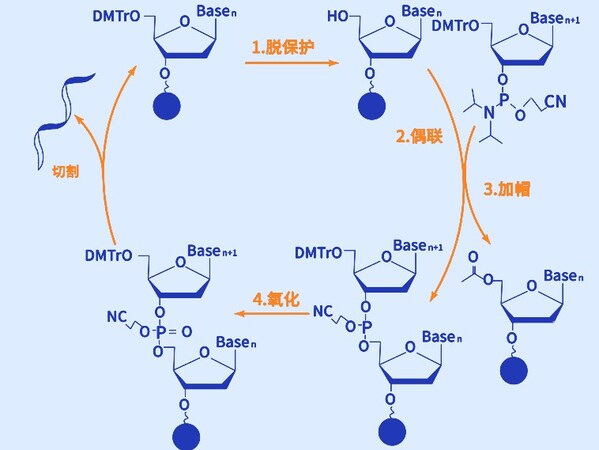
- 化學合成固相亞磷酸三酯法
盡管酶促合成法近年來有了顯著的發展,亞磷酰胺三酯化學合成法仍然是寡核苷酸合成的主流技術。寡核苷酸的化學合成始于20世紀40年代末,1987年美國Marvin H.Caruthers 教授研發出DNA單鏈合成的固相亞磷酰胺法(Phosphoramidite Synthesis,SPS),并通過固相技術和自動化合成儀,使得寡核苷酸合成效率大幅增加。
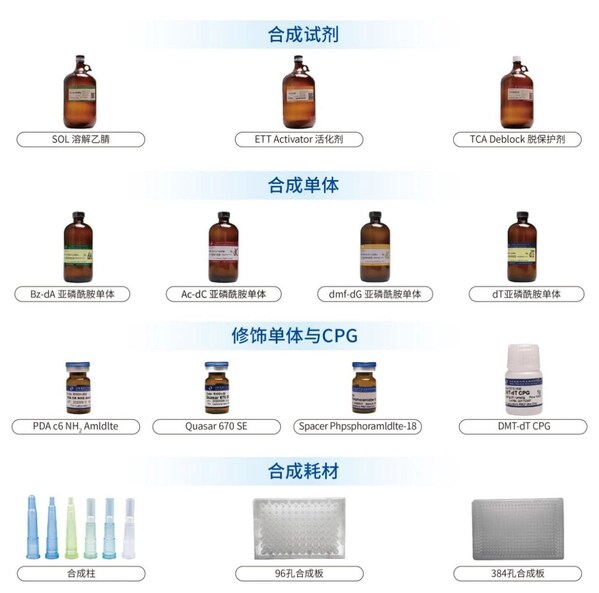
合成原料包括核苷亞磷酰胺單體(如腺苷、胞苷、鳥苷、胸苷)、脫保護和偶聯試劑、固相載體、保護基團、洗脫和純化試劑、溶劑及緩沖液,以及反應催化劑,這些原料和試劑共同保證了合成過程的效率和最終產品的質量。
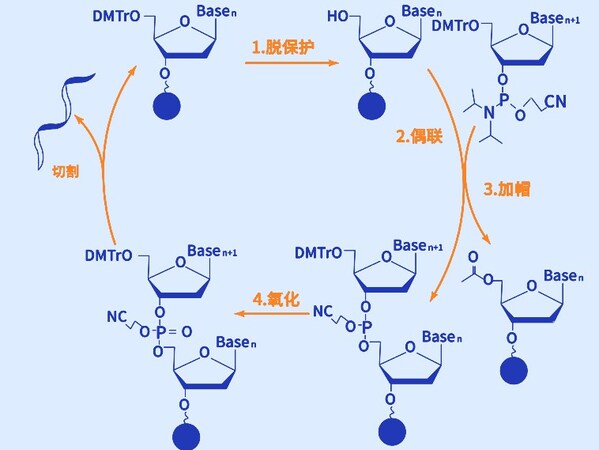
磷酰胺三酯合成法由脫保護、偶聯、加帽和氧化四步化學反應組成循環,在每個循環中,(1)脫保護,通過酸處理去除新引入的核苷酸5'-羥基上的DMT保護基團,使其暴露出來,為下一個核苷酸的連接做好準備;(2)偶聯,使用活化的磷酰胺三酯核苷酸與已固定在固相載體上的核苷酸鏈進行化學偶聯,形成磷酸二酯鍵,將新的核苷酸添加到鏈的3'端;(3)加帽,未偶聯的5'-羥基會被加帽以防止它們在后續循環中反應,確保只有偶聯成功的鏈繼續延長;(4)氧化,最后通過氧化劑將不穩定的三價磷原子氧化為更穩定的五價磷,從而使鏈上的磷酸二酯鍵得到鞏固。以此循環,直到完成指定寡核苷酸序列的合成。
- 合成后處理
合成完成后,寡核苷酸鏈仍固定在固相載體上,需使用裂解液打斷固相載體與寡核苷酸之間的連接,將合成好的寡核苷酸從固相載體上氨解切割下來,并去除寡核苷酸上的各種保護基團,包括堿基上的保護基和糖基2'位的TBDMS基團,最后通過高效液相色譜(HPLC)或其他純化方法,分離并純化目標寡核苷酸序列,以去除未反應的殘留物和副產物。
擎科生物子公司迪納興科,專注于DNA和RNA修飾單體的研發和生產,合成原材料年產量達200噸。自主研發了包括修飾單體&CPG、DNA合成試劑、條狀分子篩、合成柱在內的一系列合成產品,已成為國內DNA合成試劑的主要供應商之一,為擎科生物實現"基因工廠"生產要素的自我聚集,提供了合成原料的支撐。擎科生物依托高品質的合成原料進行寡核苷酸合成,進而提供高品質基因合成服務,最終推動抗體藥物研發、生物育種等應用領域的發展。同時,這些合成原料也能滿足核酸藥物開發更高質量要求的需求。
-
- 自主研發合成試劑
含水量低:完全能夠能達到ppm級別;
純度高:完全能夠替代同類進口產品,確保合成的高效率;
包裝靈活:根據客戶需求提供100 mL~200 L的不同包裝。 - 自主研發合成單體/修飾單體/CPG
含水量低、純度高;
產品種類豐富、應用廣泛;
可定制化合成。 - 自主研發合成耗材
oligo純度高,突變率低;
降低整體合成成本;
合成柱容量大,可裝載更多試劑。
- 自主研發合成試劑
02 合成儀
合成儀作為基因工廠的"心臟",是DNA和RNA合成的底層核心裝備,其通量、載量、長度和效率等關鍵參數決定了合成的成本和質量。它不僅需要高度自動化和精密控制,還需具備處理復雜序列的能力,以確保每一個堿基的準確插入。現代合成儀顯著提高了合成效率和準確性,減少了人工操作的誤差,能夠同時合成多個不同的DNA序列,滿足大規模生產需求。高性能的合成儀能減少錯誤率,提高合成速度和產量。
基于擎科生物多年的合成領域研究經驗以及原始數據累積分析,擁有高質量、高載量、高通量3個技術平臺,在2014年成功研制出單鏈核酸合成儀-192B,并在隨后的幾年開發出可應用于不同領域具備差異化功能的產品系列:單鏈核酸合成儀-12P、單鏈核酸合成儀-24P、單鏈核酸合成儀-192P/B、單鏈核酸合成儀-768B,并在2023年4月發布擎核TsiKer?高載量合成儀。
擎科生物憑借自主研發的合成原材料和先進的合成設備,突破了基因合成領域的技術壁壘,建立了全自主產業鏈的"基因工廠"。未來,擎科生物也將繼續創新和拓展,推動科技進步和產業升級。
[1] Sharp, P. M., & Li, W. H. (1987). "The Codon Adaptation Index—a measure of directional synonymous codon usage bias, and its potential applications." Nucleic Acids Research, 15(3), 1281-1295.
[2] Gustafsson, C., Govindarajan, S., & Minshull, J. (2004). "Codon bias and heterologous protein expression." Trends in Biotechnology, 22(7), 346-353.
本期,我們精心挑選了10篇發布于Cell、Science和Molecular Cancer等知名期刊的學術文章,涵蓋基因功能研究、疾病診斷與治療等領域,這些研究展示了擎科生物產品在生命科學領域中的廣泛應用與深遠影響。
部分高分文章解讀
使用擎科產品: 引物合成
1
文章題目:Transport mechanism and pharmacology of the human GlyT1
DOI: 10.1016/j.cell.2024.02.026
期刊:Cell
影響因子:64.5
內容概要:
研究表明,甘氨酸轉運體1(GlyT1)在抑制性和興奮性神經傳遞的調控中發揮關鍵作用,通過從突觸間隙中移除甘氨酸來實現這一功能。由于其與谷氨酸/甘氨酸共激活的NMDA受體(NMDARs)密切相關,GlyT1已成為治療與NMDAR功能不足相關的精神分裂癥的核心靶點。本研究探索了GlyT1與底物甘氨酸及藥物ALX-5407、SSR504734和PF-03463275結合的冷凍電鏡結構,展示了轉運循環的三個基本狀態:向外開放狀態、閉合狀態和向內開放狀態,詳細描繪與甘氨酸再攝取相關的構象變化。此外,該研究還識別了三個特定口袋用于容納藥物,提供了其抑制機制和選擇性的結構基礎。這些結構綜合起來為理解GlyT1的轉運機制以及底物和抗精神分裂癥藥物的識別提供了重要見解,從而為設計治療精神分裂癥的小分子藥物奠定了基礎。
2
文章題目:Catalytically inactive long prokaryotic Argonaute systems employ distinct effectors to confer immunity via abortive infection
DOI:10.1038/s41467-023-42793-3
期刊:Nature Communications
影響因子: 16.6
內容概要:
研究表明,Argonaute蛋白(Agos)通過結合短核酸作為向導,被引導識別目標互補核酸。多樣的原核生物Argonaute蛋白(pAgos)在微生物防御中可能發揮潛在功能。然而,一組全長但催化不活躍的pAgos,即長B型pAgos,其功能和機制尚不清楚。研究發現大多數長B型pAgos功能上與不同的相關蛋白質相連接,包括核酸酶、含Sir2結構域的蛋白質和跨膜蛋白質。長B型pAgo-核酸酶系統(BPAN)通過向導RNA引導的目標DNA識別而被激活,并在體外執行旁側DNA降解。在體內,該系統在感知入侵質粒后介導基因組DNA降解,導致被感染細胞的死亡,從而從細胞群體中消除入侵者。總之,BPAN系統通過流產性感染提供免疫保護。其他配備不同相關蛋白質的長B型pAgos也采用類似的防御策略。
產品直通車:
擎科生物在全國布局了20多個常規Oligo產品的生產基地,實現次日交付,可快速地為客戶提供全品類寡核苷酸一站式合成服務!
使用擎科產品: siRNA
3
文章題目:CircPPAP2B controls metastasis of clear cell renal cell carcinoma via HNRNPC-dependent alternative splicing and targeting the miR-182-5p/CYP1B1 axis
DOI: 10.1186/s12943-023-01912-w
期刊:Molecular Cancer
影響因子: 37.3
內容概要:
該研究探索了環狀RNA circPPAP2B在透明細胞腎細胞癌(ccRCC)中的作用及其調控機制。腎細胞癌(RCC)是全球常見的惡性腫瘤之一,轉移是RCC相關死亡的主要原因。環狀RNA(circRNA)在癌癥轉移中具有重要調控作用,但其在RCC中的功能和機制尚不明確。
研究發現circPPAP2B在高侵襲性ccRCC細胞和轉移性ccRCC組織中高表達,并與預后不良相關。功能實驗表明,circPPAP2B促進ccRCC細胞的增殖和轉移。機制研究顯示,circPPAP2B通過m6A依賴方式與HNRNPC相互作用,促進其核轉位,并調節HNRNPC與剪接因子PTBP1和HNPNPK的相互作用,影響前mRNA選擇性剪接。此外,circPPAP2B作為miRNA海綿,結合miR-182-5p,增加CYP1B1的表達。揭示了circPPAP2B通過HNRNPC依賴的選擇性剪接和miR-182-5p/CYP1B1軸促進ccRCC增殖和轉移,強調了circPPAP2B作為ccRCC治療靶點的潛力。
4
文章題目:CD97 negatively regulates the innate immune response against RNA viruses by promoting RNF125-mediated RIG-I degradation
DOI: 10.1038/s41423-023-01103-z
期刊:Cell Mol Immunol
影響因子: 24.1
內容概要:
本研究發現,G蛋白偶聯受體ADGRE5(CD97)能夠結合多種在代謝中發揮重要調控作用的代謝物。然而,其在抗病毒先天免疫反應中的功能尚未明確。研究報告了CD97抑制病毒誘導的I型干擾素(IFN-I)釋放,并在細胞和小鼠中增強RNA病毒復制的情況。CD97被確定為先天免疫受體RIG-I的新負調控因子,RIG-I的降解導致了IFN-I信號通路的抑制。此外,CD97的過表達促進了RIG-I的泛素化,從而導致其降解,但并不影響其mRNA的表達。在機制上,CD97通過上調RNF125的表達,誘導RNA病毒感染后RNF125介導的K48連接泛素化在Lys181位點的RIG-I降解。最重要的是,與野生型小鼠相比,缺乏CD97的小鼠對RNA病毒感染更具抵抗力。研究發現,血根堿介導的CD97抑制能夠有效阻止VSV和SARS-CoV-2的復制。這些發現闡明了CD97在抗病毒先天免疫反應中負調控RIG-I的未知機制,并為新治療策略的開發和靶向抗病毒藥物的設計提供了分子基礎。
產品直通車:
擎科生物可以提供高品質 siRNA產品合成服務,純度高,毒性低,所有產品經質譜檢測,保證序列準確性,為實驗提供有力保障。
使用擎科產品:sgRNA
5
文章題目:Engineered Extracellular Vesicle-Delivered CRISPR/Cas9 for Radiotherapy Sensitization of Glioblastoma
DOI: 10.1021/acsnano.2c12857
期刊:ACS Nano
影響因子: 17.1
內容概要:
該研究通過在小鼠體內的原位腫瘤中進行全基因組CRISPR敲除篩選,識別出與放療相關的合成致死基因。通過功能篩選和轉錄組分析,發現谷胱甘肽合成酶(GSS)可能是通過鐵死亡調控放射抗性的潛在因子。高水平的GSS與膠質瘤患者的不良預后和復發密切相關。機制研究表明,GSS與抑制膠質瘤細胞放射治療誘導的鐵死亡有關。GSS的缺失導致谷胱甘肽(GSH)合成中斷,進而引起GPX4失活和鐵積累,從而增強了放射治療引發的鐵死亡。此外,為了克服CRISPR編輯廣泛治療應用的障礙,研究報告了一種新型基因編輯遞送系統,其中將Cas9蛋白/sgRNA復合物裝載入修飾有Angiopep-2(Ang)和轉錄激活因子(TAT)肽的雙修飾細胞外囊泡(EV)中,該系統不僅靶向血腦屏障(BBB)和GBM,還能夠穿透BBB并滲透腫瘤。研究所開發的囊泡在GBM組織中顯示出良好的靶向效果,使GSS基因編輯效率達到67.2%,且幾乎沒有非靶向基因編輯。這些結果表明,將無偏基因篩選與CRISPR-Cas9基因療法結合,可以有效識別潛在的合成致死基因,從而擴展治療靶點。
產品直通車:
擎科生物可提供穩定性強、編輯效率高的化學合成sgRNA,純化方式可選,同時在sgRNA的3'和5'端各加3個硫代和甲氧基修飾,有效提高sgRNA穩定性,從而降低脫靶效應,解決基因編輯不穩定、效果差等難題。
使用擎科產品: 基因合成
6
文章題目:Enhancing rice panicle branching and grain yield through tissue-specific brassinosteroid inhibition
DOI: 10.1126/science.adk8838
期刊:Science
影響因子:56.9
內容概要:
該研究表明,作物產量潛力受限于諸如籽粒大小與數量之間的固有權衡。雖然油菜素內酯(BRs)能促進籽粒增大,但其在調節籽粒數量方面的作用尚不明確。通過解析簇穗水稻種質,研究發現激活BR代謝基因BRASSINOSTEROID-DEFICIENT DWARF3(BRD3)顯著增加籽粒數量。建立了一個分子通路,其中BR信號抑制因子GSK3/SHAGGY-LIKE KINASE2磷酸化并穩定了OsMADS1轉錄因子,該轉錄因子靶向TERMINAL FLOWER1樣基因RICE CENTRORADIALIS2。在次級分枝分生組織中特異性激活BRD3能增強穗狀分枝,減少對籽粒大小的負面影響,并提高籽粒產量。研究展示了組織特異性激素操縱在打破各種性狀之間的權衡并釋放水稻產量潛力方面的強大作用。
7
文章題目:Targeting carnitine palmitoyl transferase 1A (CPT1A) induces ferroptosis and synergizes with immunotherapy in lung cancer
DOI: 10.1038/s41392-024-01772-w
期刊:Signal Transduction and Targeted Therapy
影響因子:39.3
內容概要:
盡管免疫檢查點療法取得了一定成功,肺癌中無反應或復發現象依然普遍存在。研究發現,癌癥干細胞(CSCs)是免疫療法相關耐藥的重要因素。鐵死亡是一種由鐵依賴性脂質過氧化驅動的細胞死亡形式,通過細胞代謝重塑高度調控,已顯示出與免疫療法結合的協同效果。CSCs的代謝適應推動了腫瘤耐藥性,但其在腫瘤免疫逃逸中抵抗鐵死亡的機制尚不清楚。研究通過代謝組學、轉錄組學、肺上皮特異性Cpt1a敲除小鼠模型和臨床分析,證明了脂肪酸氧化的關鍵限速酶CPT1A與來源于腫瘤相關巨噬細胞的L-肉堿共同驅動肺癌中鐵死亡耐受和CD8+ T細胞失活。在機制上,CPT1A抑制c-Myc的泛素化和降解,而c-Myc則轉錄激活CPT1A表達。CPT1A/c-Myc正反饋環通過激活NRF2/GPX4系統和下調ACSL4減少磷脂多不飽和脂肪酸的數量,進一步增強細胞抗氧化能力,從而抑制CSCs中的鐵死亡。重要的是,靶向CPT1A能增強免疫檢查點阻斷誘導的抗腫瘤免疫力和腫瘤負載小鼠的腫瘤鐵死亡。這些結果展示了一種通過靶向CSCs鐵死亡中的代謝脆弱性來改善肺癌免疫療法療效的機制導向治療策略的潛力。
8
文章題目:Abiotic Synthetic Antibody Inhibitor with Broad-Spectrum Neutralization and Antiviral Efficacy against Escaping SARS-CoV?2 Variants
DOI: 10.1021/acsnano.3c02050
期刊:ACS Nano
影響因子:17.1
內容概要:
該研究針對新冠病毒(SARS-CoV-2)疫苗和抗體逃逸變種的快速出現和傳播所帶來的挑戰,提出了一種潛在的治療策略。研究人員開發了一種人工合成的抗體抑制劑,名為Aphe-NP14,作為抗新冠病毒的治療劑。Aphe-NP14從一個合成水凝膠聚合物納米顆粒庫中篩選而出,該庫通過結合與新冠病毒刺突蛋白受體結合域(RBD)關鍵殘基相互作用的單體功能性基團構建而成。Aphe-NP14在生物相關條件下表現出高容量、快速吸附動力學、強親和力和廣泛特異性,能有效中和包括Beta、Delta和Omicron在內的多種新冠病毒變種。通過阻斷刺突蛋白RBD與人類血管緊張素轉化酶2(ACE2)的相互作用,Aphe-NP14能夠抑制這些逃逸變種病毒的感染。研究還發現,Aphe-NP14通過鼻腔給藥具有較低的體內外毒性,表明其在新冠病毒變種的預防和治療方面具有潛在應用價值。
產品直通車:
擎科生物根植于經驗豐富的基因合成技術,搭建基因智能分子拆分及組裝技術平臺,有效提高拆分正確率和一次組裝成功率;結合多年的生產經驗以及專業的生命科學、生物信息學、計算機科學等學科背景開發深度密碼子優化技術,同時,依托螺旋槳系統(TSINGKE HELIXTECH),這一集成了客戶服務、生產管理和精益管理的全周期管理系統,將AI算法應用于原料、設備和工藝的串聯,搭建了智能化生產線,并通過精準的基因檢測質檢技術,共同實現了低成本、高效率、高品質的基因合成服務,滿足生命科學研究、生物制藥、生物育種、生物制造、基因存儲等領域的需求。
使用擎科產品:shRNA質粒
9
文章題目:Targeting gut microbial nitrogen recycling and cellular uptake of ammonium to improve bortezomib resistance in multiple myeloma
DOI: 10.1016/j.cmet.2023.11.019
期刊:Cell Metabolism
影響因子: 29
內容概要:
本研究發現腸道微生物群在多發性骨髓瘤(MM)治療中起著關鍵作用,而多發性骨髓瘤由于耐藥性仍被認為是不可治愈的。發現腸道中的氮循環細菌在MM患者中有所富集。然而,這些細菌在MM復發中的作用仍不清楚。本研究強調了復發性MM患者中特定富集的弗氏檸檬酸桿菌(Citrobacter freundii,C. freundii)。通過糞菌移植實驗,證明了C. freundii通過增加循環氨水平在MM中誘導耐藥性起著關鍵作用。氨通過跨膜通道蛋白SLC12A2進入MM細胞,穩定NEK2蛋白,從而促進染色體不穩定性和耐藥性。還發現環利尿劑呋塞米鈉能夠下調SLC12A2,抑制MM細胞對氨的攝取,提高無進展生存期和治療效果評分。這些發現為干預MM進展和耐藥性提供了新的治療靶點和策略。
10
文章題目:Targeting FAPα-positive lymph node metastatic tumor cells suppresses colorectal cancer metastasis
DOI:10.1016/j.apsb.2023.11.002
期刊:APSB
影響因子:14.5
內容概要:
研究發現,淋巴轉移是結直腸癌的主要轉移途徑,這增加了癌癥復發和遠處轉移的風險。淋巴結轉移性結直腸癌(LNM-CRC)細胞的特性尚不完全了解,且缺乏有效的治療方法。研究發現,缺氧條件下LNM-CRC細胞中纖維母細胞活化蛋白α(FAPα)的表達增加。通過功能增益或缺失實驗表明,FAPα通過激活STAT3通路,增強了腫瘤細胞的遷移、侵襲、上皮-間質轉化、干性和淋巴管生成。此外,腫瘤細胞中的FAPα通過招募調節性T細胞誘導細胞外基質重塑,并建立免疫抑制環境,從而促進結直腸癌的淋巴結轉移(CRCLNM)。FAPα激活的前藥Z-GP-DAVLBH通過靶向FAPα陽性的LNM-CRC細胞抑制了CRCLNM。研究強調了FAPα在CRCLNM中的作用,并提供了一個潛在的治療靶點和有前景的治療策略。
產品直通車:
擎科生物憑借豐富的載體構建經驗,為客戶提供高品質的shRNA載體構建服務,年合成量大、效率有保障。我們采用無復制能力的慢病毒載體來表達shRNA,可根據需求選擇直接轉染shRNA質粒或將其包裝成慢病毒顆粒后感染靶細胞。載體中的抗性標記(如PURO/NEO)簡化了穩轉株篩選過程,同時熒光標記(如GFP/RFP)不僅方便觀察轉染/感染效率,還能輔助流式細胞術篩選,提升實驗效率與精準度。
通過這些前沿研究的展示,我們不僅見證了擎科生物產品在生命科學研究中的廣泛應用,也體現了公司在推動科學進步方面的堅定承諾。擎科生物將繼續依托創新的基因合成技術和卓越的服務,致力于為全球科研人員提供更加高效、精準的解決方案。我們期待與更多的科研伙伴攜手合作,共同推動科學探索的邊界,為全球生命科學的發展貢獻力量。
]]>一、科研實力與資質認證——專業與可靠的雙重保障
擎科生物贏得客戶信任的背后,是強大的科研實力和嚴苛的資質認證。作為基因合成領域的領先者,公司在科研領域積累了豐富的經驗:參與4項國家級重大科技專項,獨立承擔3項省部級科研項目,這些科研成果和項目經驗,為擎科生物提供了堅實的技術基礎,也為客戶的信任提供了強有力的保障。
截止2024年,擎科生物及分子公司擁有數百項自主知識產權,其中十余項產品榮獲"三新產品"認證。這一系列的成就不僅展示了擎科生物在技術創新方面的領先地位,也讓客戶對其產品的可靠性和先進性充滿信心。同時,擎科生物及分子公司先后獲得ISO 13485、9001、14001等國際質量認證及高新技術企業認證,為公司的服務提供了更加全面的質控保障。
二、生產模式——標準化與智能化并行,打造"世界偉大基因工廠"
擎科生物始終以打造"世界偉大的基因工廠"為愿景,在生產模式上精益求精。作為一家擁有自主全產業鏈的基因合成平臺型企業,擎科生物將標準化、自動化、信息化與智能化生產相結合,力求每一環節都能達到世界一流的品質。
公司建設了符合國際標準的10萬級潔凈間和局部萬級生產環境,并通過嚴格執行GB/T 19001-2016/ISO 9001:2015品質標準,保證了生產過程中的每一項細節都符合最嚴格的要求。公司自主研發的高效基因合成儀器和AI算法平臺(TSINGKE HELIXTECH)、GeneOptimizer軟件,創新了基因合成技術,成功解決了高成本、長周期等行業難題,特別在復雜片段、困難訂單的基因合成中展現了卓越的技術優勢。通過這些技術創新和智能化的生產平臺,打造更高效、更穩定、更可靠的基因合成生產體系。
三、質檢與服務——精準檢測與高效響應,確保客戶的每一份需求
擎科生物的質量控制不僅體現在生產環節,也貫穿于產品的整個生命周期。在基因合成質檢過程中,公司嚴格執行雙重驗證質量控制,通過Sanger測序與FastNGS技術的結合,確保每一批基因合成產品都達到最高的質量標準。雙重的QC措施能夠最大程度地保障質粒質量,讓客戶更安心進行下游實驗,助力客戶研究提速。
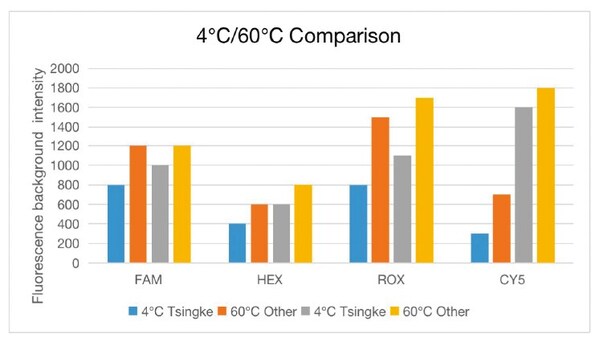
在引物方面,擎科生物為了交付質量更加可靠的引物產品,配備了大量國際領先的自動化質檢設備,其中毛細管電泳儀檢測(CE)設備,可實現單堿基的分辨率,尤其適合高通量的 Oligo 純度檢測,除此之外擎科生物還提供 MS、HPLC、OD定量、NTC 等多種定制化質檢方法,精確的質檢手段將保證引物質量,避免非特異性擴增、擴增失敗等風險,為客戶的研究與生產保駕護航。
同時,擎科生物已在全國范圍內建設了20多家分子公司,構建了覆蓋國內外市場的服務網絡。擎科生物能夠迅速響應客戶需求,為全球近30萬用戶提供穩定、高效的產品與服務。無論客戶身處何地,我們都能確保高品質的產品和及時的技術支持。
四、全產業鏈優勢——一站式解決方案,構筑"世界偉大基因工廠"的核心競爭力
擎科生物不僅在合成領域擁有獨特的技術優勢,還通過全產業鏈布局構建了一站式解決方案,從原料供應到設備制造,再到工藝優化,擎科生物的全產業鏈優勢為客戶提供了更加高效、可靠可控的服務。
擎科生物自主研發DNA合成試劑、合成單體、合成用原料酶等核心原材料,在自用的同時為行業客戶提供穩定的供應;此外公司在合成設備方面成功研制出高通量、高載量合成儀器以及配套設備,以滿足不同合成規格的客戶需求。
通過這一系列的技術積累與創新,"世界偉大基因工廠"的核心競爭力已逐步形成并成為行業內首屈一指的基因合成平臺型企業。
品質鑄就品牌,愿景引領未來
擎科生物通過科研實力、先進生產模式、嚴格質檢控制和完善的全產業鏈優勢,成功鑄就了品質壁壘,贏得了客戶的長期信賴。作為"基因工廠"概念的提出者與踐行者,擎科生物將繼續堅持"品質至上"的理念,推動技術創新,致力于為全球客戶提供更為優質的合成產品與服務,助力生命科學和生物制藥行業的快速發展,書寫更加輝煌的篇章。
擎科生物的基因合成智能化生產平臺能夠實現1.5 kb以內短片段的自動化生產,有效減少人工操作失誤,大幅提高生產效率。客戶可以根據不同的應用需求選擇合適的載體骨架。擎科生物建立了一個準確規范的載體庫,提供160多個免費載體供選擇,并按需制備合格的線性化載體。同時,我們對客戶自備載體進行NGS測序驗證,確保序列準確,并提供免費存儲服務,方便后續使用。
擎科生物自主研發的高品質重組酶、聚合酶和感受態細胞,確保載體構建過程高質高效。全流程試劑控制確保每個環節的質量。載體與PCR片段的連轉反應由自動移液工作站操作,復蘇液通過自動涂布儀進行樣品涂布,并利用全自動菌落挑選儀篩選陽性克隆,支持二維碼和條形碼管理,大幅提高生產效率,減少人工失誤。擎科生物還自主開發了"磁珠法測序平臺"用于Sanger測序,確保目的序列100%準確,并采用創新的NGS測序技術——Fast NGS,保障全質粒序列的準確性。在智能化基因合成生產線的支持下,基因合成交付率超過99.5%,最快可在3天內完成交付。
最后讓我們一起深入了解擎科生物的智能化產線。以下這段視頻將展示從自動化序列分析到篩選、測序和質檢,每一步都在精密的控制下進行,確保基因合成的高效率和高質量。
- 合成效率和合成長度
Oligo合成通常采用化學合成固相亞磷酰胺三酯法,通過每個【脫保護,偶聯,加帽,氧化】的循環逐個加入核苷酸單元,每一步反應效率都不能達到100%,且該過程會隨著引物長度的增加而變得復雜。每輪寡核苷酸的合成效率都會影響最終的總合成效率。隨著合成長度越長,總合成效率會降低,即使每個合成周期的效率高,但當鏈長增加到一定程度時,產物中的目標序列占比會顯著降低。假設每步反應效率是98%,合成100 nt長度時,產物中的目標序列占比降至13.26%(98%的100次方),且較難純化出目標的Oligo。而且較長的鏈會增加內部錯誤配率對和二級結構形成的可能性,這也將導致合成效率下降和錯誤率上升。
引物合成的耦合效率高低與多種因素相關,包括人員專業性、機器先進性、原料穩定性、規章制度的精細性以及環境控制的嚴格性。2024年年初擎科生物從"人機料法環"5個方面進行了全面升級,并嚴格執行周期質量跟蹤。擎科生物Oligo合成每步耦合效率高達99.5%,這為總效率提供了保障,合成長度可達200 nt。
- 合成純度
純度指目標序列占全部序列的百分比,Oligo的純度對于確保實驗的準確性和可靠性至關重要。從實驗的準確度來說,Oligo的純度越高,實驗結果通常越可靠。但在實際應用中,綜合考慮成本、時間和實驗需求,合理選擇純度是關鍵。常見的純化方式有DSL 純化、OPC 純化、PAGE 純化、HPLC 純化等。擎科生物子公司梓熙生物是業內為數不多支持CE檢測的企業,精度可達1 nt的分辨率。
- 合成修飾
為了提高Oligo在不同應用場景下的穩定性、細胞攝取效率以及特定實驗的靈敏度和特異性,可以進行核苷酸變體、熒光基團、淬滅基團、化學連接基團、生物素等不同修飾。
擎科生物子公司梓熙生物,在北京和蘇州布局了高質量修飾引物/探針的生產工廠,可提供百余種修飾基團,客戶可根據需要進行選擇,修飾位置包括5'端修飾、3'端修飾、雙標修飾、中間修飾與核苷酸堿基修飾,按照功能可劃分為以下幾類:
擎科生物具備卓越的Oligo合成能力,不僅顯著提升了基因合成的成功率和成本控制,還為mRNA疫苗研發、抗體藥物制備、基因編輯、分子診斷及基礎科研等領域提供了高品質的Oligo產品,為各領域客戶的研究和開發提供了有力支持。同時不斷優化流程與配送時效,全國20個合成基地附近均可提供次日早晨送達服務,部分基地快至當日達。
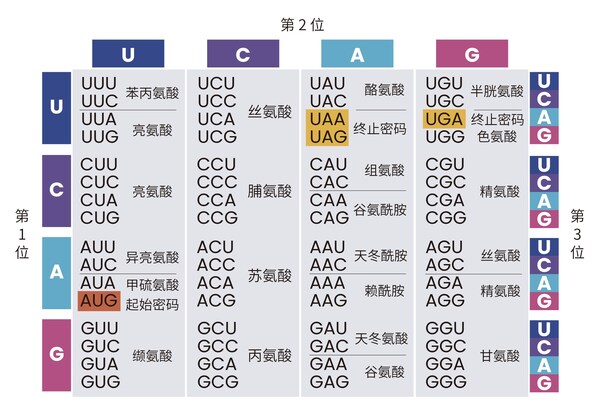
在理解密碼子優化的重要性之前,需先了解密碼子在基因表達中的作用。DNA序列通過轉錄和翻譯產生蛋白質,而每個密碼子由三個核苷酸組成,指定一個特定的氨基酸。這種對應關系在密碼子表中明確列出,例如,密碼子"ATG"編碼甲硫氨酸(Met),開始蛋白質的合成。苯丙氨酸(Phe)對應的密碼子有UUU和UUC,而終止密碼子包括UAA、UAG和UGA。這種精確的編碼方式確保了蛋白質合成的準確性和特異性?。
雖然不同的密碼子可編碼相同的氨基酸,但不同生物體對密碼子的使用存在偏好。這種偏好與每個生物體內特定tRNA的豐度相關。基因表達水平與密碼子偏好性之間存在強相關性,同一氨基酸在不同宿主中,其對應的密碼子會表現出不同程度的偏好[1]。因此,直接使用未優化的基因序列可能導致外源基因在宿主,特別是異源宿主中的表達效率低下。
密碼子優化(codon optimization)是在不改變基因編碼蛋白質的前提下,通過調整基因編碼序列中的密碼子使用頻率,使用物種偏好密碼子并避免稀有密碼子得到優化序列,來提高外源基因在宿主細胞中表達水平的技術[2]。
對于自己構建載體的客戶來說,是無法進行密碼子優化的,因此采用基因合成方法來構建載體就成為了首選。
序列優化涉及更廣泛的序列調整,包括優化GC含量、避免重復序列、消除不利的mRNA二級結構等,目的是提高整個基因的穩定性和表達效率,同時不改變最終編碼的氨基酸序列。
- 優化原則
(1)密碼子偏好性
密碼子適應指數CAI是指異源mRNA序列中密碼子和宿主細胞最佳密碼子使用頻率相符合的程度,理論上此值越接近1,外源mRNA在宿主細胞中的蛋白表達越高,通常CAI<0.8時,被認為需要進行密碼子優化。使用宿主細胞中使用頻率高的同義密碼子替換外源mRNA序列中的密碼子,例如,在大腸桿菌中,某些密碼子如TAA和TAG可能很少使用,而GCA(編碼丙氨酸)的使用頻率較高。且避免出現稀有密碼子,稀有密碼子可能導致翻譯停頓,增加翻譯時的錯誤率,從而降低蛋白質產量。同時考慮高頻和次高頻的密碼子組合。
注意CAI值過高可能導致外源基因在宿主細胞中過度表達,進而使得蛋白質在合成過程中積累過快,無法正確折疊,從而形成包涵體。包涵體是指在細胞內形成的不溶性蛋白質聚集物,通常是因為蛋白質未能正確折疊或是由于蛋白質表達水平過高。適當的密碼子優化可以幫助調控蛋白質的表達速率,減少包涵體的形成,提高目標蛋白的正確折疊和可溶性表達。
(2)GC含量
理想的GC含量通常在40%-60%之間。過高的GC含量可能導致mRNA二級結構過于穩定,過低則可能影響轉錄效率。
(3)mRNA二級結構
復雜和穩定的二級結構會影響翻譯效率,特別是序列中有和核糖體結合位點或翻譯起始位點互作的序列,會阻止翻譯的進行,合理優化翻譯起始區的mRNA二級結構,可提高蛋白表達水平。
- 免費密碼子及序列優化
擎科生物獨有的 GeneOptimizer 軟件密碼子優化算法是不僅局限于密碼子層面的序列深度優化技術。支持上萬種宿主優化和定制化服務。優化的主要參數包括:密碼子偏好性、GC 含量、減少poly(A) 結構、重復序列、核糖體結合位點、酶切位點等。在保證密碼子適應指數CAI和GC含量處在合理范圍內,盡可能減少其他負面因素的影響,求得帕累托最優解,進而完成對基因表達的優化。擎科生物可為基因合成客戶提供免費的密碼子及序列優化服務。
通過自動化序列分析評估軟件在不到一次眨眼的時間就能完成一個準確的序列優化(0.1s/個)。
- 自動化方案設計
擎科生物自主開發的自動化方案設計軟件,根據載體和序列特點可批量設計多種高效構建方案,提高載體構建成功率。
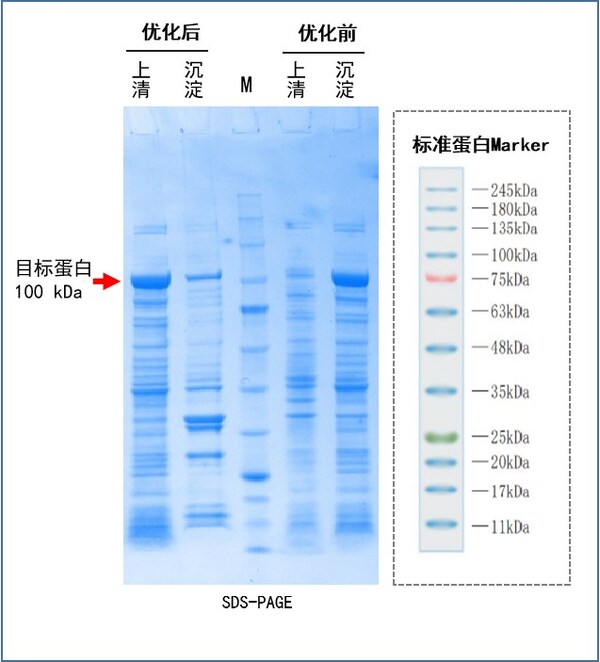
案例分享:
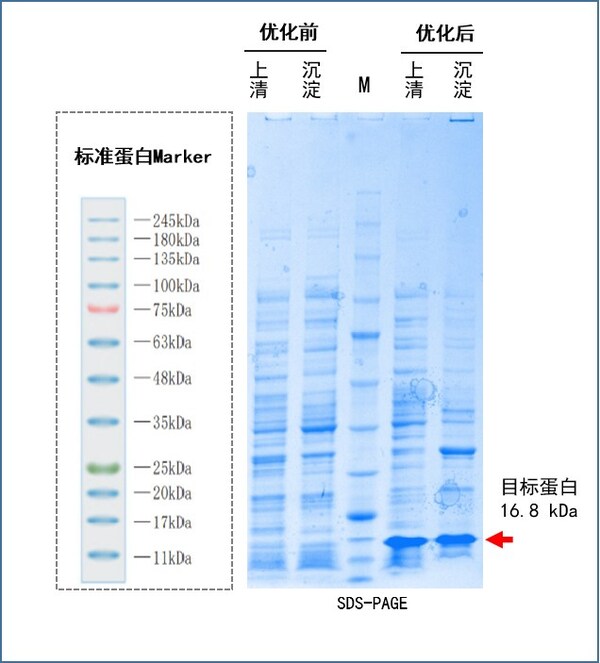
(1)目標蛋白16.8 kDa,密碼子優化前蛋白不表達,密碼子優化后蛋白大量表達。
(2)目標蛋白100 kDa,密碼子優化前包涵體表達,密碼子優化后上清可溶表達75%。
[1] Sharp, P. M., & Li, W. H. (1987). "The Codon Adaptation Index—a measure of directional synonymous codon usage bias, and its potential applications." Nucleic Acids Research, 15(3), 1281-1295.
[2] Gustafsson, C., Govindarajan, S., & Minshull, J. (2004). "Codon bias and heterologous protein expression." Trends in Biotechnology, 22(7), 346-353.
擎科生物突破技術壁壘形成基因合成自主全產業鏈的基因工廠,并向下游多個應用領域拓展,以此推動生物技術和生物經濟發展。
基因工廠是以基因合成要素中的合成原料、合成設備及合成工藝進行自動化自我聚集,搭建出合成要素的生產平臺,實現穩定、高效、自主研發、自動化的基因合成智能生產系統。
基因工廠生產的基因合成產品類型從300 bp到5 kb甚至更長,廣泛應用于各個領域,從科學研究到工業生產。例如,Oligo合成在分子生物學研究、分子診斷、基因編輯和核酸藥物等多個領域中具有廣泛應用,不僅為科學研究和技術創新提供了關鍵工具,還為拓展疾病治療方法開辟了新途徑。基因合成的應用涵蓋核酸、氨基酸和蛋白質等多個領域,在基礎科研中發揮著關鍵作用,同時也廣泛應用于核酸疫苗、基因細胞療法等領域。而基因組合成和最簡基因組合成的應用,則包括生物育種、菌種改造以及代謝改造等領域的應用,將對未來食品和材料領域產生積極影響。
為揭開基因工廠的神秘面紗,擎科生物推出"云探秘基因工廠"系列文章,帶領大家深入了解。
基因合成的起點是寡核苷酸合成,寡核苷酸合成為基因合成提供了至關重要的原材料。在這個過程中,合成原料是寡核苷酸合成的基礎,正如俗話所說:"巧婦難為無米之炊",合成原料的質量直接決定了最終產品的準確性和可靠性。同時,合成儀作為核心裝備,其通量、載量、長度和效率也顯著影響合成的成本和質量。因此,我們首先聚焦于"基因工廠"的核心基礎——合成原料和合成儀。
01 合成原料
- 化學合成固相亞磷酸三酯法
盡管酶促合成法近年來有了顯著的發展,亞磷酰胺三酯化學合成法仍然是寡核苷酸合成的主流技術。寡核苷酸的化學合成始于20世紀40年代末,1987年美國Marvin H.Caruthers 教授研發出DNA單鏈合成的固相亞磷酰胺法(Phosphoramidite Synthesis,SPS),并通過固相技術和自動化合成儀,使得寡核苷酸合成效率大幅增加。
合成原料包括核苷亞磷酰胺單體(如腺苷、胞苷、鳥苷、胸苷)、脫保護和偶聯試劑、固相載體、保護基團、洗脫和純化試劑、溶劑及緩沖液,以及反應催化劑,這些原料和試劑共同保證了合成過程的效率和最終產品的質量。
磷酰胺三酯合成法由脫保護、偶聯、加帽和氧化四步化學反應組成循環,在每個循環中,(1)脫保護,通過酸處理去除新引入的核苷酸5'-羥基上的DMT保護基團,使其暴露出來,為下一個核苷酸的連接做好準備;(2)偶聯,使用活化的磷酰胺三酯核苷酸與已固定在固相載體上的核苷酸鏈進行化學偶聯,形成磷酸二酯鍵,將新的核苷酸添加到鏈的3'端;(3)加帽,未偶聯的5'-羥基會被加帽以防止它們在后續循環中反應,確保只有偶聯成功的鏈繼續延長;(4)氧化,最后通過氧化劑將不穩定的三價磷原子氧化為更穩定的五價磷,從而使鏈上的磷酸二酯鍵得到鞏固。以此循環,直到完成指定寡核苷酸序列的合成。
- 合成后處理
合成完成后,寡核苷酸鏈仍固定在固相載體上,需使用裂解液打斷固相載體與寡核苷酸之間的連接,將合成好的寡核苷酸從固相載體上氨解切割下來,并去除寡核苷酸上的各種保護基團,包括堿基上的保護基和糖基2'位的TBDMS基團,最后通過高效液相色譜(HPLC)或其他純化方法,分離并純化目標寡核苷酸序列,以去除未反應的殘留物和副產物。
擎科生物子公司迪納興科,專注于DNA和RNA修飾單體的研發和生產,合成原材料年產量達200噸。自主研發了包括修飾單體&CPG、DNA合成試劑、條狀分子篩、合成柱在內的一系列合成產品,已成為國內DNA合成試劑的主要供應商之一,為擎科生物實現"基因工廠"生產要素的自我聚集,提供了合成原料的支撐。擎科生物依托高品質的合成原料進行寡核苷酸合成,進而提供高品質基因合成服務,最終推動抗體藥物研發、生物育種等應用領域的發展。同時,這些合成原料也能滿足核酸藥物開發更高質量要求的需求。
- 自主研發合成試劑
含水量低:完全能夠能達到ppm級別;
純度高:完全能夠替代同類進口產品,確保合成的高效率;
包裝靈活:根據客戶需求提供100 mL~200 L的不同包裝。
- 自主研發合成單體/修飾單體/CPG
含水量低、純度高;
產品種類豐富、應用廣泛;
可定制化合成。
- 自主研發合成耗材
oligo純度高,突變率低;
降低整體合成成本;
合成柱容量大,可裝載更多試劑。
02 合成儀
合成儀作為基因工廠的"心臟",是DNA和RNA合成的底層核心裝備,其通量、載量、長度和效率等關鍵參數決定了合成的成本和質量。它不僅需要高度自動化和精密控制,還需具備處理復雜序列的能力,以確保每一個堿基的準確插入。現代合成儀顯著提高了合成效率和準確性,減少了人工操作的誤差,能夠同時合成多個不同的DNA序列,滿足大規模生產需求。高性能的合成儀能減少錯誤率,提高合成速度和產量。
基于擎科生物多年的合成領域研究經驗以及原始數據累積分析,擁有高質量、高載量、高通量3個技術平臺,在2014年成功研制出單鏈核酸合成儀-192B,并在隨后的幾年開發出可應用于不同領域具備差異化功能的產品系列:單鏈核酸合成儀-12P、單鏈核酸合成儀-24P、單鏈核酸合成儀-192P/B、單鏈核酸合成儀-768B,并在2023年4月發布擎核TsiKer®高載量合成儀。
擎科生物憑借自主研發的合成原材料和先進的合成設備,突破了基因合成領域的技術壁壘,建立了自主全產業鏈的"基因工廠"。未來,擎科生物也將繼續創新和拓展,推動科技進步和產業升級。
- 重構生產模式,實現更高效服務
基因合成作為合成科學的引擎發動機,推動生物技術和醫學的進步,并在生物經濟中發揮著至關重要的作用。擎科生物始終以客戶需求為導向,為確保產品穩定性與交付質量,重構了對人員依賴嚴重、信息流轉困難的傳統的小組式生產模式,轉化為工廠化流水線生產模式,細化生產環節,按標準流程操作,并引入MES系統管理,建立基因工廠數字總部、搭建可視化看板,實現從接單到交付的全流程智能管控,保障信息流轉準確,每個產品穩定交付,交付率≥99.5%、快至3天交付,全面滿足客戶需求。
- 強化生產標準,實現高質量交付
作為自主全產業鏈的基因合成平臺型企業,擎科生物嚴格把控產品品質,建設10萬級潔凈間局部萬級生產環境,打造標準化實驗室、嚴格遵守GB/T 19001-2016/ISO 9001:2015品質標準、 通過標準流程指導生產、嚴格執行并持續改進,確保了產品的一致性與穩定性,提升了交付的及時性和可靠性,滿足生命科學研究、生物制藥等領域的高標準需求。
- 打造智能化基因工廠,實現科技領先
擎科生物通過重構生產模式和強化精益管理系統,完成了工廠化模式升級。同時,利用自主研發的高效基因合成儀器設備,以及擎科生物獨有的 GeneOptimizer 軟件密碼子優化算法、序列分析和方案設計、寡核苷酸合成及修飾、PCR產物制備及基因組裝、采用Sanger測序和NGS雙重驗證等工序,打造了標準化、自動化、信息化的基因合成智能化產線,成功攻克了基因合成的高成本、耗時長、大片段基因合成技術難度高等難題,特別針對困難訂單、毒性基因、復雜片段、大片段合成等具有成熟的解決方案,顯著提升了生產效率,降低了運營成本,實現了技術領先,確保了產品的高質量交付。
- 基因合成在生物經濟中的作用
基因合成作為生物經濟的重要組成部分,通過促進新藥開發、提高農作物產量、改善環境等方面的應用,顯著推動了生物經濟的發展。擎科生物的基因合成技術為生物醫藥、生物農業、環境修復等領域提供了關鍵支持,助力解決全球糧食安全、環境保護和疾病治療等重大挑戰。
- 展望未來
擎科生物將繼續立足于"世界偉大的基因工廠"的企業愿景,專注于優化工廠化生產模式,帶領"基因工廠"由國內走向世界。基因合成作為合成科學的引擎發動機,將繼續推動科學研究和產業應用的發展,為全球產業高質量發展貢獻力量,成為合成科學的重要驅動力。
此次儀式由擎科生物副總裁杜軍和智慧綠洲未來健康實驗室副主任陳麒先共同主持,眾多來自科研界、產業界的領導嘉賓出席,體現了雙方合作的高規格和廣泛關注。
杜軍副總裁和陳麒先副主任代表雙方簽署了共建"北京擎科生物科技股份有限公司——浙江大學長三角智慧綠洲創新中心核酸藥物遞送系統聯合實驗室"合作協議,并共同為聯合實驗室揭牌。
杜軍副總裁表示:擎科生物一直致力于利用基因合成技術推進產業的快速發展,此次與智慧綠洲的合作,是公司在小核酸藥物遞送研究方面邁出的重要一步。我們希望通過雙方的資源整合和優勢互補,共同推動這一領域的創新發展。
陳麒先副主任表示,智慧綠洲作為浙江大學服務國家戰略和區域創新發展的重要科創平臺,始終以創新為驅動、以產品為導向。與擎科生物的深入合作,將有助于推動未來健康實驗室在核酸藥物遞送系統的創新研究和成果轉化落地,為人類健康事業貢獻更多的科技成果。
會上還舉行了聯合實驗室領導班子的任命和專家聘用儀式,進一步明確了聯合實驗室的組織架構和合作雙方的責任分工。陳麒先副主任擔任聯合實驗室主任,杜軍副總裁擔任聯合實驗室副主任。未來健康實驗室還聘請了擎科生物的多位高管為兼職研究員,旨在通過校企合作,聯合培養高水平的科技創新人才。
會上,陳麒先主任匯報了聯合實驗室的建設規劃和研究方向,詳細介紹了聯合實驗室未來的研究重點,主要包括開發高效、精準的小核酸藥物遞送系統,以及構建相關新型技術平臺。他表示聯合實驗室將聚焦于解決當前核酸藥物遞送面臨的關鍵技術難題,力爭在國際上取得領先地位。
隨后,擎科生物子公司梓熙生物總經理余大伍介紹了公司在小核酸藥物領域的發展歷程和最新技術以及產業化進展。他表示擎科生物已經在合成方面具備全產業鏈的優勢,原料、設備以及合成技術相輔相成,形成了基因工廠的生產模式,可以有效地將創新技術產業化。聯合實驗室的共建,將進一步提升公司的技術創新能力和市場競爭力。
這次簽約揭牌儀式不僅是雙方合作的開端,更是擎科生物在小核酸藥物遞送領域的戰略升級。面向未來,擎科生物與智慧綠洲將充分發揮各自優勢,依托聯合實驗室,努力在小核酸藥物遞送研究領域取得突破性成果,攜手推動小核酸藥物的臨床應用和產業化進程,更好的服務生命大健康產業高質量發展。
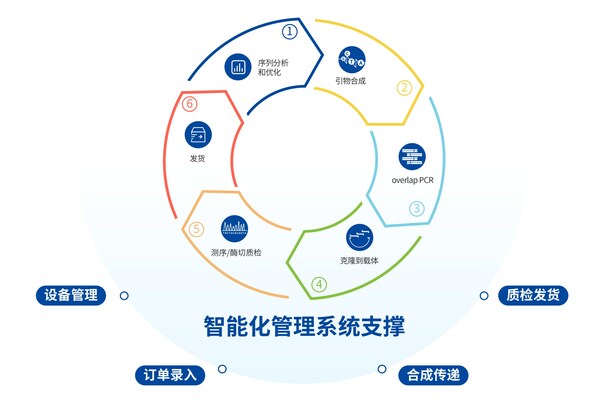
數字化管理賦能底層技術,支撐擎科智能化基因工廠生產
"基因工廠"是以基因合成要素中的合成原料、合成設備及合成工藝進行聚集,搭建出自動化的合成生產平臺,搭載自主研發搭建的基因合成智能生產系統實現穩定、高效的生產。2020年擎科生物啟動數字化中心建設,利用IT思路重構生產架構,完成從生產到財務的全流程數字化,實現生產和運營的效率倍數級增長。隨著近年生產規模的急速擴張,原有的單體應用架構無法抵御業務峰值,單庫架構的數據庫也難以保障業務穩定和安全,擎科生物選擇全面上云,以云上數字化中心實現"降本增效"。通過靈活的線上管理系統與線下智能設備進行配合生產,實現層層信息流控制和生產管控。在這個過程中,數據的產生、分發和處理流程都可以在阿里云端完成,即便基地分散在全國各地,都能通過云上系統控制線下設備,實現"無人化生產"。擎科生物將進一步結合云算力和IOT技術,對螺旋槳系統(TSINGKE HELIXTECH)進行迭代升級,以實現真正的無人工廠。
智能管理系統上線,基因合成服務快至72 h交付
螺旋槳系統(TSINGKE HELIXTECH)是客戶服務系統、生產管理系統、精益管理系統等的集成、在生產層面代表著基因合成全周期管理系統,由智能AI算法平臺,線上管理平臺,線下自動化生產平臺串聯。
基因合成定制化服務包含了密碼子優化、引物設計合成、PCR擴增、連接轉化、菌檢、測序、QC酶切驗證等流程。早期主要依賴人工操作的實驗模式進行,生產的自動化和信息化水平低,存在生產效率低、產品穩定性不足等問題。
為了更好的提升基因合成產品品質、服務質量,擎科生物于今年3月啟動基因合成生產改革,歷時3個月完成模塊化與流程化生產模式升級,智能管理系統全面上線。目前擎科基因合成已達到穩定、快速的交付,短片段合成快至72 h交付。
智能化基因工廠推動產業發展
隨著生物經濟和生物技術的發展,對基因合成提出高效、快速、低成本的三大要求,因此,"基因工廠"成為未來發展的必然趨勢。未來,擎科生物將全力發揮智能化基因工廠優勢,在基因合成領域打造"DBLT"(Design、Build、Learn、Test)智能化合成系統,進一步推進生物技術(BT)與信息技術(IT)的融合應用,為生物技術,生物經濟服務。
歷時5年傾情打造,多項專利支撐的擎科生物高通量核酸提取儀(HR-Z-II)重磅上線,通過自動化、磁珠分離等核心技術的整合,擺脫人工操作的限制,提高效率;"樣本進,結果出"的一體化封閉提取理念設計,有效規避污染;廢液安全回收,降低樣本污染的風險;搭配實驗室自動化移液加樣、自動化切膠回收等系統,有助于實現樣本提取的自動化方案。
產品優勢
- 全自動化:無需人員干預,一鍵啟動,提取速度快,兼容各種設備儀器實現實驗室全自動化流程;
- 降低污染:核酸提取全流程無需引入其他耗材,無需預分裝試劑,有效控制污染率;
- 程序靈活:自由程序編輯,一鍵啟動,真正做到樣本進-結果出的自動流程;
- 超高通量:4×96個平行樣本的高通量處理,單日可達上萬樣本的提取。30 min完成384個樣本的提取/純化反應;
- 應用廣泛:適用于多種類型樣本,如DNA或RNA、質粒、病毒等樣本的提取,PCR產物的純化等。
產品特點
- 設備一體機,試劑有效存儲,節省實驗室空間;
- 8通道同時移液加樣,X、Y軸獨立運動,快速精準并兼顧不同需求;
- 4×96個樣品/30 min,單日可達上萬樣本的提取;
- 程序編輯靈活,操作簡單便捷,實現"一鍵啟動";
- 封閉提取,減少污染源引入;
- 廢液自動回收,安全環保;
- 自清功能,實驗結束實現紫外消毒;
- 試劑支持全套定制。
擎科生物自主研發的自動化引物合成平臺、自動化基因合成平臺相繼投入使用,結合近期上線的高通量核酸提取儀,基因工廠自動化生產產能進一步提升。設備由智能AI算法平臺,線上管理平臺,線下自動化生產平臺串聯的螺旋槳系統(TSINGKE HELIXTECH)支撐,數字賦能自動化生產。我們不斷探索創新,以降低人工操作風險、減少操作污染,提高生產效率、提升產品品質。旨在將產業自動化推向新高度,為客戶帶來更優質的服務以及產品。
擎科生物副總裁杜軍博士擔任本次會議秘書長,受邀在"創新創業論壇"進行主題為《合成生物學綜述-從格物致知到建物致知》的主題報告,并受邀主持"政策與資本論壇"圓桌會議。
擎科展位
作為自主全產業鏈基因合成平臺型企業,擎科生物也將攜專業技術團隊在10月28日-30日專家報告廳外的20號展位進行相關產品及服務的展出,助力下游合成生物學相關研究。
大會信息
大會日期:2023年10月27日-30日
大會地點:湖北省武漢市東湖路167號楚天粵海國際大酒店
會議注冊:https://www.biodesign-conference.com/
作為"基因工廠"概念的提出者與踐行者,擎科生物完成生產要素的自我聚集之后,正大步跨越,產品和服務覆蓋范圍從實驗室走入工業界,系統性地打通產業轉化的路徑。
在擎科生物副總裁杜軍博士看來,通過基因編輯與合成的底層技術,可以實現生物制造、生命科學應用的延伸。這一觀點,暗含了對趨勢的判斷。麥肯錫預計全球經濟活動中60%的物質產品可依托生物技術進行生產,在2030年至2040年期間,合成生物學技術每年將為全球帶來2萬億至4萬億美元的直接經濟效益。
想要抓住生物經濟的發展機遇,企業必須在關鍵的產業化節點具備成本優勢、技術優勢,繼而對各個領域進行顛覆性創新。擎科生物也拾階而上,從基因合成技術的點,串聯起基因工廠服務平臺的面。
4月8日,擎科生物合成生物學金壇產業基地建設啟動,標志著"基因工廠"又一重點項目的實施。該項目將通過基因合成的技術優勢,為生物醫藥和合成生物學領域高效發展提供原動力,推動核酸藥物技術的研發和應用。這一基地的落成,意味著其開啟了擴圍之路。
"擎科生物現在處于一個由點及面整體串聯的高速發展階段。"杜軍博士總結道,這個發展階段中,會更強調服務的綜合性和衍生性。
在合成生物學炙手可熱的今天,擎科生物的商業模式和競爭壁壘如何讓其征服一眾投資機構?未來又會有哪些技術新突破?杜軍博士接受了億歐大健康的專訪,并從多個維度做出解答。
一、技術"點金手"串聯成基因生產工廠
一個被業內公認的觀點為,在生命科學領域,無論是研究、診斷、治療還是制造,都將全面邁入以基因為主導的分子生物學時代。具備先進底層自主研發能力的企業,勢必成為行業新秀。
擎科生物立足于基因合成賽道,扎下的第一個錨點便是全自主產業鏈,確保整條產業鏈的自主可控。
從上游來看,基因合成配套儀器有 DNA/RNA系列合成儀,核酸純化儀、氨解儀、分裝儀、稀釋儀等多種合成系列及配套儀器設備,基因合成原材料有CPG、合成單體、修飾原料和溶劑、合成柱、合成試劑等。
越往上游,越"卡脖子",是一個不爭的事實。擎科生物通過原始創新、集成創新、消化吸收再創新三種創新模式實現合成的所有要素的積累,實現了基因工廠生產要素的自我聚集,擁有顯著的技術和成本優勢。
以可控微孔玻璃珠(CPG)為例,其為熒光探針合成過程中的關鍵反應載體,但一直為海外公司所壟斷。擎科生物通過自主研發攻克了這一難點,一舉打破基因合成上游四面環壁的境況,并且具有孔道均一、不易堵塞、溶劑利用效率高、產品參數穩定等優點。
就儀器設備而言,擎科生物在2014年成功研制出首臺單鏈核酸合成儀-192,并在隨后的幾年開發出系列可應用于不同領域具備差異化功能的關鍵儀器設備,如不同規格合成儀、純化儀、溶解儀、分裝儀等儀器。
"我們圍繞著高質量、高通量、高載量三個維度進行技術研發,圍繞著全應用體系開發相應的技術。"杜軍博士說道,在全自主的產業鏈中,需要儀器系統、原材料、合成工藝共同支撐,以此匯集成"基因工廠"的全要素。
緊抓創新機遇,突破關鍵核心技術。擎科生物高度重視科技研發投入,目前已成為國內少有的實現了集原料、酶、底盤細胞、基因元件等要素為一體、分離純化技術等工藝完全自主的基因合成智能化生產企業。
這位專家型的管理者頗有戰略直覺,在他看來,回歸生物經濟和基因經濟的底層邏輯,基因合成端還是要以低成本、高效智能化方式生產。
也正是這種判斷,讓"基因工廠"走上了智能化生產道路。擎科生物打通了從基因合成設備、合成原材料、新合成工藝到基因組裝的分子生物學試劑的產業鏈條,通過將原料、設備、工藝串聯起來,搭建起智能化生產線,極大提高了基因合成的成功率和交付率。
如今,擎科生物已經成為基因合成領域的"佼佼者",寡核苷酸合成快至次日達,DNA片段合成最短2個工作日,基因合成交付時間最快可至5個工作日,最長合成長度可達200 kb,Sanger/Fast NGS測序驗證,100%準確。
二、拓展服務半徑,基因合成平臺輻射多場景業務
拓展服務半徑,平臺型企業的華麗轉身。
依托現有的基因合成全產業鏈,擎科生物打造基因工廠服務模式,承接國內生物經濟發展浪潮中對基因合成的需求,為整個產業提供平臺型技術與服務,扮演"賣水人"角色。
"從基因合成技術到合成平臺,再到全生產要素自主構建的智能化‘基因工廠',擎科生物的發展路徑正在往合成生物學下游延伸,輻射多場景業務。"杜軍博士一針見血指出,這背后是他所窺得的行業發展機遇與前景。
近年來合成生物學日漸升溫,頻頻出現在政策頂層設計中。2022年5月,國家發展改革委更是印發《"十四五"生物經濟發展規劃》,提出包括合成生物學在內的生物經濟是未來中國經濟轉型的新動力,重要性不言而喻。
立足政策熱點,行業規模也令人心向神往。據國家發改委創新驅動中心預測,到2025年,生物經濟的總量有望達到22萬億人民幣。作為生物經濟重要的底層技術,Markets and Markets Research大膽預測,全球基因合成的市場規模在2026年將超千億人民幣。
擎科生物突破技術壁壘形成基因合成全自主產業鏈的基因工廠,并向下游多個應用領域拓展,以此推動生物技術和生物經濟發展。
在杜軍博士看來,合成生物應用領域主要有三大類:一類是生物醫藥,從以前的小分子藥到現在的大分子藥、蛋白藥、核酸藥物,是人類逐漸揭開基因神秘面紗的過程;第二類是生物制造,比如合成生物學菌種改造;第三類是育種存儲,應用在環境、農業、食品類當中。
目前該公司業務范圍涵蓋合成基因組學產品及服務、生命科學研究設備及原料、生物制造CXO三大方向。同時圍繞應用體系進行布局,涉足生物醫藥如IVD原料、核酸藥物、蛋白、CGT、疫苗等,合成生物制造、基因儲存、生物育種等領域,為生物技術和生物經濟服務。
以炙手可熱的寡核苷酸藥物(又名小核酸藥物)為例,千億市場規模在前,但受限于現有工藝設備、生產速度和成本等多方面因素而踟躕不前。常規的DNA合成儀只能合成毫克級的寡核苷酸,大規模核酸合成儀和純化設備十分昂貴,且只能被少數大型跨國公司所壟斷。
寡核苷酸規模化生產過程中存在諸多困難,高精密的固相合成設備及可放大的線性合成工藝是其中兩個關鍵核心技術。擎科生物歷時15個月成功研發出了高載量寡核苷酸合成儀——擎核TsiKer?,用以解決寡核苷酸制造的源頭合成技術問題,可以高效、快速地合成寡核苷酸,最高載量可達12 mmol,耦合效率99.5%以上。
擎核TsiKer?高載量合成儀不再受限于毫摩爾級合成量,單次可合成克級以上的產品,集成專業的合成程序、精密的液路系統、智能的控制系統、穩定的硬件系統等諸多優勢,有望助推我國核酸藥物進入創新和突破的發展新階段。
打破工藝放大和質量控制的壁壘同時,擎科生物還可以提供ASO、siRNA、miRNA、saRNA、sgRNA等多種產品合成服務,并提供IND申報支持,為核酸藥物企業提供高標準、高質量的核心原料。
三、基因工廠驅動降本增效 基因平臺加速應用拓展
對于擎科生物的未來發展構想,杜軍博士將它設定為"平臺型",按照"萬物皆可合"與"合完即可用"的發展思路,公司具備往下游延伸應用的技術基礎。
全生產要素自主的"基因工廠",多年積累的基因合成技術和設備成果,可以讓擎科在面對客戶需求時游刃有余,針對不同應用場景對應不同合成方式,實現高效、低成本的化學合成。這種能力可在不同場景復制,延展空間巨大。
"擎科生物生產體系結構完備,可以衍生下游應用的服務,正由被動型服務的提供者向主動型合成平臺跨越。"杜軍博士規劃道。依托于已有全自主產業鏈的基因工廠,擎科生物在核酸藥物、CGT、生物制造等方向持續深耕,反哺行業的發展。
基因合成相當于生物醫藥產業的底層支撐,手握著底層技術的底牌向下游延伸,發展邏輯水到渠成。可以確定的是,基因工廠打開了擎科生物"構建服務平臺"大門的鑰匙,也拉高了其未來盈利的天花板。
原文鏈接:https://www.iyiou.com/interview/202306051046241
億歐網]]>
金壇區區委副書記胥亞偉,擎科生物創始人、董事長兼總裁馬石金先生以及國內合成生物學、核酸藥物領域的眾多專家、企業代表等200余位嘉賓出席。
產研融合 落子金壇
核酸藥物因其高特異性、高效性、長效性等明顯優勢,研究前景廣闊,是未來生物制藥最具臨床潛力的前沿領域之一。
產業的蓬勃發展離不開科研創新驅動,中國工程院院士、生物化工專家鄭裕國院士、大連理工大學特聘研究員、博士生導師陳麒先研究員、華大工程生物生物學長蕩湖研究所所長沈玥博士等領域專家、企業高管以主題報告、高峰對話等形式,共同深刻研討核酸藥物領域的機遇與挑戰,為核酸藥物領域的創新與發展,提供了有力的理論及技術支撐。
共聚常州·金壇,共話核酸藥物產業化的發展與未來。擎科落子金壇,是擎科生物打造“基因工廠”的關鍵部署,是未來全力打造全中國高規格、大規模小核酸藥物的CDMO生產基地的重要一步,同時為推動長三角生物醫藥產業高質量發展聚力賦能。
通過產業鏈與科研創新鏈的產研雙向融合,將共同為合成生物學領域高效發展提供原動力,并助力核酸藥物產業化的發展。
擎核TsiKer?重磅發布,助推實現核酸藥物設備國產化目標
隨著核酸藥物產業蓬勃發展,市場需求增加,保證核酸藥物的及時供應成為產品開發和商業化成功的重要性指標。作為國內自主全產業鏈基因合成平臺型企業,擎科不斷創新突破,致力于突破寡核苷酸合成的關鍵技術壁壘。
基于擎科生物十余年合成設備的豐富研發經驗,本次會議重磅推出“擎核TsiKer?高載量合成儀”。擎核TsiKer?高載量合成儀不再受限于毫摩爾級合成量,單次可合成克級以上的產品,具有專業的合成程序、精密的液路系統、智能的控制系統、穩定的硬件系統等諸多優勢,有望助推我國核酸藥物,進入創新和突破的發展新階段。
擎核TsiKer? Syn HL-12的問世,錨定寡核苷酸藥物合成領域,提供實驗室規模和小試規模的合成設備,及配套的合成工藝、載體和試劑,保障合成高效、穩定地進行。
合成儀產品布局將以“基因工廠”為載體,以突破高質量、高載量、和高通量的核心技術為目標,助推實現核酸藥物領域合成設備及工藝技術國產化的目標。
未來,擎科生物將聚焦核酸藥物領域,發揮基因工廠智能化、定制化、規模化的優勢,加速拓展基因工廠在不同場景的應用,為生命科學、醫療健康等產業貢獻力量。