益普生中國總經理戴紀堯、益普生中國商業卓越運營部負責人薛櫻花,上海醫藥執行董事兼執行總裁李永忠、上藥控股副總經理唐鵬程、張燕、宋潞潞等雙方管理層代表出席儀式。
作為全球領先的生物制藥公司,益普生已深耕中國市場30余年。秉持對中國市場的長期承諾,益普生始終致力于將優質產品引入中國。達菲林®作為常用的促性腺激素釋放激素類藥物(GnRHa),在前列腺癌、中樞性性早熟、子宮內膜異位癥、女性不孕癥、子宮肌瘤的術前治療等多種疾病中被廣泛應用。
作為行業領先的醫藥健康服務企業,上藥控股以科技創新與數智化引領發展,嚴守合規運營底線,深耕專業化服務內核,通過創新服務模式,構建覆蓋醫藥健康全鏈條的智慧服務體系。上藥控股藥品CSO團隊已有近10年行業經驗,形成了覆蓋全國范圍的醫療機構服務網絡布局,積累了深厚的市場底蘊。
此次合作雙方將依托達菲林®良好的臨床認可度與上藥控股專業的醫學推廣,深化產品在合作渠道的廣域覆蓋,推動優質產品和服務的廣泛可及。
益普生中國總經理戴紀堯表示:"與上藥控股的合作是益普生在提升藥物可及性、改善患者福祉方面取得的又一重大里程碑,充分體現了益普生‘在中國,為中國'的堅定承諾。秉承‘聚焦、共贏、服務患者與社會'的使命,益普生始終以患者為中心,專注于特藥領域,持續推出創新藥物滿足患者亟待解決的治療需求。依托與上藥控股的創新合作模式,我們致力于整合藥物研發優勢與渠道覆蓋能力,提高創新藥物可及性,為健康中國貢獻更多力量。"
上海醫藥執行董事兼執行總裁李永忠表示:"此次上藥控股與益普生的戰略攜手,標志著雙方將資源與優勢深度融合,開啟協同發展的新篇章。益普生核心治療領域的卓越品牌影響力與上藥控股成熟的全國終端覆蓋網絡以及專業化的學術推廣矩陣形成優勢互補。上藥控股將始終秉持‘服務為榮’的理念,依托對產品核心領域的深入理解和創新能力,在當前外部環境不確定的情況下,加大對創新業務CSO的推進力度,攜手益普生共同推動達菲林®在中國市場的廣泛覆蓋,為患者帶來更精準的健康服務,助力醫療行業高質量發展。"
關于益普生中國
作為全球性生物制藥公司,益普生致力于延長患者的生命并改善患者的生活。集團在全球擁有5000余名員工,在超過80個國家藥品注冊銷售。益普生于1992年進入中國,2019年在上海設立創新中心,并于2021年在上海成立中國區總部,專注于腫瘤學、罕見病和神經科學領域,持續推出創新治療方案以滿足中國患者亟待解決的治療需求。
關于上藥控股
上藥控股是一家以醫藥健康服務為核心的全國性現代醫藥供應鏈服務企業。公司已發展成為中國規模大、網絡廣、實力強的醫藥經營企業之一。上藥控股以建立全國性的終端網絡為基礎,著力推進醫院供應鏈服務,構建新的產業優勢。公司深化服務創新,加快產業突破,致力于構建國家級的醫藥供應鏈服務平臺。
 ]]>
]]>中樞性性早熟是較為常見的一種兒科內分泌疾病,由于下丘腦-垂體?性腺軸功能提前啟動、促性腺激素釋放激素(GnRH)增加,導致女孩7.5歲前出現乳房發育或10.0歲前出現月經初潮,男孩9歲前出現睪丸增大[1],影響患兒生長潛能及心理健康。作為目前國內中樞性性早熟治療領域首個超長效劑型,達菲林®六月劑型長效持續釋放的特性[2]能夠以一定的速率釋放藥物,以維持有效血藥濃度,減少給藥次數[3]。臨床研究顯示,達菲林®六月劑型相較三月劑型,療效無明顯差異[4],給藥耐受性良好,減少注射頻率有可能改善患兒注射體驗和提高治療依從性[5]。一項國際多中心III期研究結果表明,達菲林®六月劑型使 93.2% 的患兒在 6 個月時達到青春期前的 LH 水平(LH激發值≤5IU/L),12 個月時為 97.7%,從而延遲了患兒青春期臨床體征的進展[5]。相較于短效制劑,長效緩釋制劑可以實現數月的藥物持續釋放,患兒及家屬只需每六個月來醫院接受注射治療及隨訪觀察,有效減少注射次數和門診時間,盡可能降低長期治療給患兒及家屬日常生活帶來的不利影響。
成都市婦女兒童中心醫院兒童遺傳與內分泌代謝科主任程昕然教授表示:"中樞性性早熟患兒的依從性對于疾病的長期規范化管理至關重要。隨著達菲林®六月超長效劑型逐步進入臨床應用,有助于進一步改善治療依從性和滿意度,減少就醫次數、降低就醫時間,期待更多患兒能從中獲益,無憂成長。"
益普生中國總經理Guillaume DELMOTTE表示:"自7月9日達菲林®六月劑型在中國正式獲批以來,益普生加速推動這一創新藥物覆蓋更多地區,致力于為中樞性性早熟患兒提供更便捷、更可及的治療方案。秉承‘聚焦、共贏、服務患者與社會'的使命,益普生將持續聚焦特藥領域,深耕患者需求,加快創新產品在中國的引入和上市,更好惠及中國患者。"
關于益普生
益普生是一家全球性的生物制藥公司,專注于在腫瘤、罕見病和神經科學三個治療領域為患者提供革新型藥物。我們的研發管線以外部創新為動力,有近百年的開發經驗以及美國、法國、英國的全球中心作為有力的支持。分布于40多個國家的全球團隊,共同與我們在世界各地的合作伙伴關系,為100多個國家的患者提供藥物。益普生在巴黎(泛歐交易所:IPN)上市并通過贊助的I級美國存托憑證項目(ADR:IPSEY)在美國上市交易。有關益普生的更多信息,請訪問 ipsen.com.
關于益普生中國
益普生集團于1992年進入中國,2019年在上海設立創新中心,是全球四個研發中心之一。益普生于2021年在上海成立中國區總部,并于2022年根據集團業務變動,同步剝離多元健康業務,專注于特藥領域,針對三大疾病領域(腫瘤、罕見病、神經科學)攜手上海創新中心持續推出創新治療方案以滿足中國患者亟待解決的治療需求。
益普生 - 有關前瞻性聲明的警示說明
本文所含前瞻性聲明、目的和目標基于集團的管理戰略、當前觀點和假設。此類聲明涉及已知和未知的風險和不確定性,可能導致實際結果、業績或事件與本文所預期的大不相同。上述所有風險均可能影響集團在未來實現其財務目標的能力,財務目標是基于現今可用信息在合理的宏觀經濟條件下設定的。"相信"、"期望"和"期待"等詞語和類似表述的使用是為了明確前瞻性聲明,包括集團對未來事件的期望,此類事件包括監管文件和決定。此外,本文所述目標的制定未考慮外部增長假設和潛在未來收購,而這兩者可能會使指標發生變化。目的的依據是集團認為合理的數據和假設。目標取決于將來可能發生的條件或事實,而不僅取決于歷史數據。考慮到某些風險和不確定性的發生,實際結果可能與這些指標有很大出入,明顯表現為在早期研發階段或臨床試驗中有前景的產品可能最終永遠不會投放市場或達到其商業目標,尤其是由于注冊或競爭原因。集團必須面對或可能面對來自仿制藥的競爭,這可能會轉化為市場份額的損失。此外,研發過程涉及多個階段,每個階段都涉及重大風險,即集團可能無法實現其目的并被迫放棄就自身已投入大量資金的產品所做的努力。因此,集團不能確定在臨床前試驗中獲得的有利結果是否會在隨后的臨床試驗中得到確認,也不能確定臨床試驗的結果是否足以證明相關產品的安全性和有效性。不能保證產品將獲得必要的注冊批準或該產品將被證明在商業上是成功的。如果基本假設證明不準確或確實出現風險或不確定性,則實際結果可能與前瞻性聲明中的結果有很大不同。其他風險和不確定性包括但不限于一般行業條件和競爭;一般經濟因素,包括利率和貨幣匯率波動;制藥行業法規和醫療保健立法的影響;全球醫療成本抑制趨勢;競爭對手獲得技術進步、新產品和專利;新產品研發中固有的挑戰,包括獲得監管部門的批準;集團準確預測未來市場狀況的能力;生產困難或延誤;國際經濟的金融不穩定和主權風險;對集團專利的有效性和創新產品的其他保護的依賴;以及可能面臨的訴訟,包括專利訴訟和/或監管訴訟。此外,集團依賴第三方來研發和銷售某些產品,這些產品可能會產生大額特許權使用費用;這些合作伙伴的行為可能會對集團的活動和財務結果造成損害。集團不能確定其合作伙伴將履行各自的義務。集團可能無法從這些協議中獲得任何利益。集團任何合作伙伴違約均會產生低于預期的收益。此類情況可能會對集團的業務、財務狀況或業績產生負面影響。集團明確聲明,除非適用法律有所要求,否則其不承擔更新或修訂本新聞稿中所包含的任何前瞻性聲明、目標或假設的任何義務,以反映此類聲明所依據的事件、條件、假設或情況的任何變化,也不會就此作出任何承諾。集團的業務受制于其在法國金融市場監管機構備案的注冊文件中概述的風險因素。該文件中所列風險和不確定性并非詳盡無遺,建議讀者參閱集團網站(www.ipsen.com)上集團的最新通用注冊文件。
[1] 中樞性性早熟診斷與治療專家共識(2022)[J]. 中 華 兒 科 雜 志 , 2023, 61(1): 16-22. DOI: 10.3760/cma. j. |
[2] 丁源等. 中國藥科大學學報,2020,51(4),433-440. |
[3] 張芳等. 中國新藥雜志,2013,22(5),547-555. |
[4] Lydia Lake et al,. Endocrine Abstracts (2022) 85 OC6.3 | DOI: 10.1530/endoabs.85.OC6.3. |
[5] Karen Klein et al,.J Pediatr Endocrinol Metab . 2016 Nov 1;29(11):1241-1248. |
胃腸胰神經內分泌腫瘤是一種罕見疾病,被納入2023年公布的中國第二批罕見病目錄,中國發病率為1.14/10萬[2],患者平均需要4.8年方可確診[3]。胃腸胰神經內分泌腫瘤的治療方式涵蓋了多種手段,生長抑素類似物(SSA)是針對不可切除和/或轉移性胃腸胰神經內分泌腫瘤的一線藥物治療選擇[4]。索馬杜林®作為目前全球唯一獲批可進行深部皮下自我注射的生長抑素類似物(SSA)類藥物,確切的療效、良好的安全性以及便捷舒適的注射體驗為胃腸胰神經內分泌腫瘤患者帶來更好的治療選擇,提升患者滿意度[5],[6]。
復旦大學附屬腫瘤醫院神經內分泌腫瘤多學科首席專家、神經內分泌腫瘤中心主任、神經內分泌腫瘤內科主任陳潔教授表示:"隨著醋酸蘭瑞肽緩釋注射液(預充式)胃腸胰神經內分泌腫瘤適應癥和自我注射用法正式獲批,期待更多患者獲益,延續生命,活出精彩。"
益普生中國總經理Guillaume DELMOTTE表示:"自從3月29日索馬杜林®胃腸胰神經內分泌腫瘤適應癥和自我注射用法在中國正式獲批以來,益普生加速推進藥物臨床使用及上市進程,以早日惠及患者。秉承‘以患者為中心'的理念,未來益普生將積極攜手各方力量,不斷擴大索馬杜林®在更多省份和醫院的覆蓋,為胃腸胰神經內分泌腫瘤患者提供更便捷的治療方案,促進患者治療依從性的加強,從而進一步改善患者生活質量。"
[1] Pavel M et al.Neuroendocrinology2016;103:172–85 NCCN神經內分泌腫瘤和腎上腺瘤(2023.V1) |
[2] Incidence and survival of neuroendocrine neoplasms in China with comparison to the United States |
[3] Dureja S, McDonnell M, Van Genechten D, et al. Global challenges in access to diagnostics and treatment for neuroendocrine tumor (NET) patients. J Neuroendocrinol. 2023;35(6):e13310. |
[4] Pavel M et al.Neuroendocrinology2016;103:172–85 NCCN神經內分泌腫瘤和腎上腺瘤(2023.V1) |
[5] Salvatori Ret al. Pituitary 2010; 13:115–122 |
[6] Johanson Vet al. Patient Prefer Adherence2012;6:703-10 |
作為全球唯一獲批可進行深部皮下自我注射的生長抑素類似物(SSA)類藥物,索馬杜林®確切的療效、良好的安全性以及便捷舒適的注射體驗為胃腸胰神經內分泌腫瘤患者帶來更好的治療選擇,提升患者滿意度[1],[2] 。
神經內分泌腫瘤(NENs)是一類起源于胚胎的神經內分泌細胞、具有神經內分泌標記物和可以產生多肽激素的罕見腫瘤。其中胃腸胰神經內分泌瘤(GEP-NETs)約占所有神經內分泌腫瘤的55%-70%[3]。在中國,GEP-NETs發病率為1.14/10萬[4],患者平均需要4.8年方可確診[5]。在 2023年公布的中國第二批罕見病目錄中,胃腸胰神經內分泌腫瘤被收錄其中,進一步提升了公眾對于疾病的認知和關注,推動疾病早診早治,為患者帶來更多獲益 。
胃腸胰神經內分泌腫瘤的治療方式涵蓋了多種手段,生長抑素類似物(SSA)是針對不可切除和/或轉移性胃腸胰神經內分泌腫瘤的一線藥物治療選擇[6]。索馬杜林®是歐洲神經內分泌腫瘤學會(ENETS)及國內權威指南一致推薦的SSA治療藥物[1],可顯著延長患者的無進展生存期(PFS)達38.5個月[7],疾病復發風險降低53%[7],適用人群廣,臨床證據全,循證等級高[8],[9]。
蘭瑞肽中國III期臨床研究主要研究者,北京大學腫瘤醫院消化腫瘤內科主任沈琳教授表示:"神經內分泌腫瘤是一類少見疾病,但其發病率正逐漸增高,隨著臨床診斷水平的提升及影像學檢查的發展,檢出率也在不斷上升。在針對中國胃腸胰神經內分泌腫瘤患者的注冊研究(PALACE)中,蘭瑞肽顯示出積極結果。作為ENETS和NCCN指南一致認定的長效生長抑素類似物,我很高興見證蘭瑞肽胃腸胰神經內分泌腫瘤適應癥的獲批,有望幫助腫瘤患者實現疾病治療目標,降低神經內分泌腫瘤對生活帶來的負面影響,其自我注射將提升治療依從性,改善患者的生活質量,助力神經內分泌腫瘤患者規范化診療。"
益普生中國總經理Guillaume DELMOTTE表示:"作為一家專注于罕見病、腫瘤和神經科學領域的生物制藥公司,益普生致力于將罕見病領域創新藥物加速引入中國市場。受益于罕見病藥物研發和審評的利好政策,可進行深部皮下自我注射的索馬杜林®獲批用于胃腸胰神經內分泌腫瘤的治療,為患者提供了更便捷的治療方案,有效改善患者無進展生存期,助力疾病長程管理,提高患者生活質量。隨著胃腸胰神經內分泌腫瘤被納入《第二批罕見病目錄》,未來益普生將積極攜手各方力量提升公眾對于這一罕見疾病的認知,滿足患者亟待解決的治療需求,履行益普生‘聚焦、共贏、服務患者與社會'的使命。"
成立于1929年,益普生在90余年的歷史中始終秉持創新精神,不斷進取。在罕見病領域,益普生多年持續深耕產品管線,致力于改善罕見病患者無藥可醫的困境。2019年12月,索馬杜林®正式在中國獲批用于肢端肥大癥治療,并被納入國家醫保目錄。2023年,在國家衛健委發布的《第二批罕見病目錄》中,益普生罕見病產品管線所覆蓋疾病均納入其中,包括肢端肥大癥、胃腸胰神經內分泌腫瘤、進行性骨化性纖維發育不良、先天性膽道閉鎖、Alagille綜合征、原發性膽汁性膽管炎、原發性胰島素樣生長因子-1缺乏癥等。
[1] Salvatori Ret al. Pituitary 2010; 13:115–122 |
[2] Johanson Vet al. Patient Prefer Adherence2012;6:703-10 |
[3] Dasari A, Mehta K,Byers LA, et al. Comparative study of lung and extrapulmonary poorly differentiated neuroendocrine carcinomas: a SEER database analysis of 162,983 cases[J]. Cancer,2018,124(4):807-815.D01:10.1002/cncr.31124. |
[4] Incidence and survival of neuroendocrine neoplasms in China with comparison to the United States |
[5] Dureja S, McDonnell M, Van Genechten D, et al. Global challenges in access to diagnostics and treatment for neuroendocrine tumor (NET) patients. J Neuroendocrinol. 2023;35(6):e13310. |
[6] Pavel M et al.Neuroendocrinology2016;103:172–85 NCCN神經內分泌腫瘤和腎上腺瘤(2023.V1) |
[7] Caplin ME et al. Endocrine2021; 71(2):502–513 |
[8] Sandostatin LAR. Summary of product characteristics, 2018. |
[9] Sandostatin LAR Depot. Prescribing information, 2019. |
關于益普生
益普生是一家全球性的生物制藥公司,專注于在腫瘤、罕見病和神經科學三個治療領域為患者提供革新型藥物。我們的研發管線以外部創新為動力,有近百年的開發經驗以及美國、法國、英國的全球中心作為有力的支持。分布于40多個國家的全球團隊,共同與我們在世界各地的合作伙伴關系,使我們為100多個國家的患者提供藥物。益普生在巴黎(泛歐交易所:IPN)上市并通過贊助的I級美國存托憑證項目(ADR:IPSEY)在美國上市交易。有關益普生的更多信息,請訪問 ipsen.com.
關于益普生中國
益普生集團于1992年進入中國,2019年在上海設立創新中心,是全球四個研發中心之一。益普生于2021年在上海成立中國區總部,并于2022年根據集團業務變動,同步剝離多元健康業務,專注于特藥領域,針對三大疾病領域(腫瘤、罕見病、神經科學)攜手上海創新中心持續推出創新治療方案以滿足中國患者亟待解決的治療需求。
益普生 - 有關前瞻性聲明的警示說明
本文所含前瞻性聲明、目的和目標基于集團的管理戰略、當前觀點和假設。此類聲明涉及已知和未知的風險和不確定性,可能導致實際結果、業績或事件與本文所預期的大不相同。上述所有風險均可能影響集團在未來實現其財務目標的能力,財務目標是基于現今可用信息在合理的宏觀經濟條件下設定的。"相信"、"期望"和"期待"等詞語和類似表述的使用是為了明確前瞻性聲明,包括集團對未來事件的期望,此類事件包括監管文件和決定。此外,本文所述目標的制定未考慮外部增長假設和潛在未來收購,而這兩者可能會使指標發生變化。目的的依據是集團認為合理的數據和假設。目標取決于將來可能發生的條件或事實,而不僅取決于歷史數據。考慮到某些風險和不確定性的發生,實際結果可能與這些指標有很大出入,明顯表現為在早期研發階段或臨床試驗中有前景的產品可能最終永遠不會投放市場或達到其商業目標,尤其是由于注冊或競爭原因。集團必須面對或可能面對來自仿制藥的競爭,這可能會轉化為市場份額的損失。此外,研發過程涉及多個階段,每個階段都涉及重大風險,即集團可能無法實現其目的并被迫放棄就自身已投入大量資金的產品所做的努力。因此,集團不能確定在臨床前試驗中獲得的有利結果是否會在隨后的臨床試驗中得到確認,也不能確定臨床試驗的結果是否足以證明相關產品的安全性和有效性。不能保證產品將獲得必要的注冊批準或該產品將被證明在商業上是成功的。如果基本假設證明不準確或確實出現風險或不確定性,則實際結果可能與前瞻性聲明中的結果有很大不同。其他風險和不確定性包括但不限于一般行業條件和競爭;一般經濟因素,包括利率和貨幣匯率波動;制藥行業法規和醫療保健立法的影響;全球醫療成本抑制趨勢;競爭對手獲得技術進步、新產品和專利;新產品研發中固有的挑戰,包括獲得監管部門的批準;集團準確預測未來市場狀況的能力;生產困難或延誤;國際經濟的金融不穩定和主權風險;對集團專利的有效性和創新產品的其他保護的依賴;以及可能面臨的訴訟,包括專利訴訟和/或監管訴訟。此外,集團依賴第三方來研發和銷售某些產品,這些產品可能會產生大額特許權使用費用;這些合作伙伴的行為可能會對集團的活動和財務結果造成損害。集團不能確定其合作伙伴將履行各自的義務。集團可能無法從這些協議中獲得任何利益。集團任何合作伙伴違約均會產生低于預期的收益。此類情況可能會對集團的業務、財務狀況或業績產生負面影響。集團明確聲明,除非適用法律有所要求,否則其不承擔更新或修訂本新聞稿中所包含的任何前瞻性聲明、目標或假設的任何義務,以反映此類聲明所依據的事件、條件、假設或情況的任何變化,也不會就此作出任何承諾。集團的業務受制于其在法國金融市場監管機構備案的注冊文件中概述的風險因素。該文件中所列風險和不確定性并非詳盡無遺,建議讀者參閱集團網站(www.ipsen.com)上集團的最新通用注冊文件。
巴黎2024年2月23日 /美通社/ -- 益普生公布其2023年全年及2023年最后一個季度的財務業績。
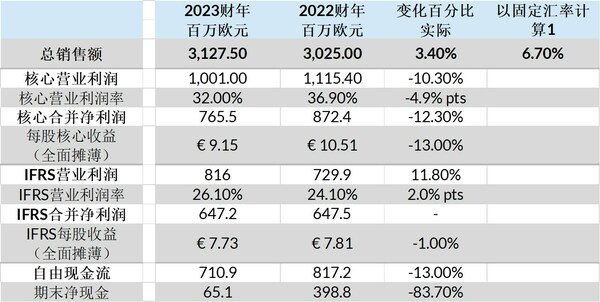
2023財年和2022財年合并業績摘錄[6]:
益普生首席執行官David Loew表示:"這一年的良好業績為益普生在2024年的發展奠定了良好基礎,2024年將是激動人心的一年,我們預計將上市四款新產品及適應癥,并有機會進一步擴大研發管線。隨著益普生的轉型,我們的執行力在不斷提高,這為銷售額的持續增長提供了堅實保障,與此同時,我們不斷前進的研發管線也為患者持續帶來更加鼓舞人心的消息。
在強大的資產負債表的支持下,我們的外部創新戰略正在擴大三個治療領域的潛在藥物數量。繼2023年收購Albireo并成功推出Bylvay之后,我們期待在今年創造更多里程碑,并將通過額外的外部創新交易不斷豐富研發管線。我有信心,這一戰略將為患者帶來更多的藥品,并確保益普生的可持續增長。"
2023年成果
2023年,益普生繼續成功推進公司戰略"聚焦、共贏、服務患者與社會"。增長平臺實現了兩位數增長,其中Cabometyx和Dysport的銷售額增長分別高達22.9%[7]和14.5%[7]。新藥Bylvay®(odevixibat)、Sohonos®(palovarotene)和Tazverik®(tazemetostat)也為銷售額的增長做出了貢獻,而Somatuline®(蘭瑞肽)的銷售額則繼續逐步下滑(-10.4%[7]),僅占總銷售額的34%(2022財年:40%)。
核心營業利潤率下降至32.0%(2022財年:36.9%),反映出收購Albireo和Epizyme帶來的投資增加,包括為新產品管線提供資金所導致的研發費用增加。益普生年末凈現金為6510萬歐元,這主要得益于7.109億歐元的穩定自由現金流。
2023年3月,益普生收購了一家治療兒童和成人膽汁淤積性肝病的膽汁酸調節劑的領先創新者Albireo,從而進一步擴充其罕見病產品組合和研發管線。交易的主要焦點是Bylvay,這是一種強效、每日一次口服的非全身性回腸膽汁酸轉運抑制劑。
2023年的研發管線進展包括Elafibranor治療原發性膽汁性膽管炎(PBC)和Cabometyx治療前列腺癌的Ⅲ期試驗分別獲得積極結果。Onivyde(用于一線胰腺導管腺癌[1L PDAC]治療)和Elafibranor的監管提交得到受理。這一年,美國食品和藥物管理局(FDA)還批準了Sohonos和Bylvay的上市許可申請,分別用于治療進行性骨化性纖維發育不良(FOP)和Alagille綜合征。
2024年優先事項和財務指引
益普生預計將在2024年上市四款新產品及適應癥,此前,Onivyde在美國(H1)用于治療1L PDAC、Elafibranor在美國(H1)和歐盟(H2)用于治療二線PBC以及Odevixibat在歐盟(H2)用于治療Alagille綜合征的上市申請均已獲得監管部門批準。Sohonos近期在美國上市,用于治療FOP。
公司將利用現有平臺,繼續推動全球增效計劃,為新產品的推出和管線提供大量的進一步投資。
益普生為2024財年制定了以下財務指引,其中排除了未來外部創新交易的任何潛在影響:
- 以固定匯率計算,總銷售額增長超過6.0%。基于2024年1月的平均匯率水平,預計匯率將對總銷售額產生約1%的不利影響
- 核心營業利潤率約為總銷售額的30%,其中包括預期的早期和中期外部創新機會帶來的額外研發費用
總銷售額指引包括對在美國和歐盟進一步推出Somatuline蘭瑞肽仿制藥的預期。
資本市場日與中期財務展望
益普生在2023年12月舉行的資本市場日上概述了下一階段的增長情況。除了目前和近期可能推出的幾款新產品外,在中期還將推出許多具有里程碑意義的新藥,以加強公司的多元化業務,包括七款預期藥物和現有藥物的組合,每款藥物的預期峰值銷售額至少為5億歐元。此外,還將采取積極的外部創新戰略,旨在為推動研發管線的可持續增長提供平臺。
公司概述了以下中期財務展望[8]:
- 按固定匯率計算,2023-2027年期間,總銷售額平均每年增長至少7%
- 2027年核心營業利潤率至少為總銷售額的32%
環境、社會和治理:Generation Ipsen
在上述資本市場日上,益普生提出了一個雄心勃勃的可持續發展路線圖,該戰略以Generation Ipsen為基礎,重點關注四大支柱:環境、患者、員工和治理。于2023年取得良好進展。
益普生致力于在整個價值鏈中科學減少溫室氣體排放。與2019年基線相比,公司在2023年實現了范圍1和范圍2排放減少36%。與同一基線年相比,2023年范圍3降幅達29%。益普生有信心在2025年底實現碳中和,到2045年實現凈零排放。
公司以患者為中心,將臨床試驗結果與非FDA/EMA[9]監管申請之間的時間縮短了25%。2023年,53%的GLT由女性組成,而2022年為48%;2023年,43%的同事從事醫療保健或環境項目。
ISO37001反賄賂管理體系認證獲得續期。
欲獲得完整信息,請點擊【閱讀原文】,查看益普生于2024年2月8日發布的報告。
說明:
所有財務數據均以百萬歐元為單位。除非另有說明,本報告的業績涵蓋2023年12月31日之前的12個月期間(2023財年)和2023年12月31日之前的3個月期間(2023年第四季度),而進行數據對比的對象為2022年12月31日之前的12個月期間(2022財年)和2022年12月31日之前的3個月期間(2022年第四季度)。此外,除非另有說明,否則所有評論皆基于2023財年的表現。
關于益普生
益普生是一家全球性的生物制藥公司,專注于在腫瘤、罕見病和神經科學三個治療領域為患者提供革新型藥物。
我們的研發管線以外部創新為動力,有近百年的開發經驗以及美國、法國、英國的全球中心作為有力的支持。分布于40多個國家的全球團隊,共同與我們在世界各地的合作伙伴關系,使我們為100多個國家的患者提供藥物。
益普生在巴黎(泛歐交易所:IPN)上市并通過贊助的I級美國存托憑證項目(ADR:IPSEY)在美國上市交易。有關益普生的更多信息,請訪問 ipsen.com.
關于益普生中國
益普生集團于1992年進入中國,2019年在上海設立創新中心,是全球四個研發中心之一。益普生于2021年在上海成立中國區總部,并于2022年根據集團業務變動,同步剝離多元健康業務,專注于特藥領域,針對三大疾病領域(腫瘤、罕見病、神經科學)、六大適應癥攜手創新中心持續推出創新治療方案以滿足中國患者亟待解決的治療需求。
益普生—有關前瞻性聲明的警示說明
本文所含前瞻性聲明、目的和目標基于集團的管理戰略、當前觀點和假設。此類聲明涉及已知和未知的風險和不確定性,可能導致實際結果、業績或事件與本文所預期的大不相同。上述所有風險均可能影響集團在未來實現其財務目標的能力,財務目標是基于現今可用信息在合理的宏觀經濟條件下設定的。"相信"、"期望"和"期待"等詞語和類似表述的使用是為了明確前瞻性聲明,包括集團對未來事件的期望,此類事件包括監管文件和決定。此外,本文所述目標的制定未考慮外部增長假設和潛在未來收購,而這兩者可能會使指標發生變化。目的的依據是集團認為合理的數據和假設。目標取決于將來可能發生的條件或事實,而不僅取決于歷史數據。考慮到某些風險和不確定性的發生,實際結果可能與這些指標有很大出入,明顯表現為在早期研發階段或臨床試驗中有前景的產品可能最終永遠不會投放市場或達到其商業目標,尤其是由于注冊或競爭原因。集團必須面對或可能面對來自仿制藥的競爭,這可能會轉化為市場份額的損失。此外,研發過程涉及多個階段,每個階段都涉及重大風險,即集團可能無法實現其目的并被迫放棄就自身已投入大量資金的產品所做的努力。因此,集團不能確定在臨床前試驗中獲得的有利結果是否會在隨后的臨床試驗中得到確認,也不能確定臨床試驗的結果是否足以證明相關產品的安全性和有效性。不能保證產品將獲得必要的注冊批準或該產品將被證明在商業上是成功的。如果基本假設證明不準確或確實出現風險或不確定性,則實際結果可能與前瞻性聲明中的結果有很大不同。其他風險和不確定性包括但不限于一般行業條件和競爭;一般經濟因素,包括利率和貨幣匯率波動;制藥行業法規和醫療保健立法的影響;全球醫療成本抑制趨勢;競爭對手獲得技術進步、新產品和專利;新產品研發中固有的挑戰,包括獲得監管部門的批準;集團準確預測未來市場狀況的能力;生產困難或延誤;國際經濟的金融不穩定和主權風險;對集團專利的有效性和創新產品的其他保護的依賴;以及可能面臨的訴訟,包括專利訴訟和/或監管訴訟。此外,集團依賴第三方來研發和銷售某些產品,這些產品可能會產生大額特許權使用費用;這些合作伙伴的行為可能會對集團的活動和財務結果造成損害。集團不能確定其合作伙伴將履行各自的義務。集團可能無法從這些協議中獲得任何利益。集團任何合作伙伴違約均會產生低于預期的收益。此類情況可能會對集團的業務、財務狀況或業績產生負面影響。集團明確聲明,除非適用法律有所要求,否則其不承擔更新或修訂本新聞稿中所包含的任何前瞻性聲明、目標或假設的任何義務,以反映此類聲明所依據的事件、條件、假設或情況的任何變化,也不會就此作出任何承諾。集團的業務受制于其在法國金融市場監管機構備案的注冊文件中概述的風險因素。該文件中所列風險和不確定性并非詳盡無遺,建議讀者參閱集團網站(www.ipsen.com)上集團的最新通用注冊文件。
[1]以固定匯率(CER)計算,即通過應用前一時期使用的匯率重新計算相關時期的業績,排除任何外匯影響。 |
[2]Dysport®(A型肉毒毒素)、Decapeptyl®(曲普瑞林)、Cabometyx®(cabozantinib)和Onivyde®(伊立替康)。 |
[3]排除未來外部創新交易增量的任何潛在影響。 |
[4]納入了對Somatuline在美國和歐盟的其他蘭瑞肽仿制藥的預期,并排除了基于2024年1月平均匯率水平判斷的貨幣對總銷售額約1%的不利預期影響。 |
[5]納入了預期的早期和中期外部創新機會產生的額外研發費用。 |
[6]合并業績摘錄。公司審計師已對合并財務報表進行審計。 |
[7]以CER計算,即通過應用前一時期使用的匯率重新計算相關時期的業績,排除任何外匯影響。 |
[8]排除任何潛在的額外未來(Ⅲ期臨床開發或之后)外部創新機會的影響。 |
[9]歐洲藥品管理局。 |
進行性骨化性纖維發育不良(Fibrodysplasia Ossificans Progressiva,FOP),是一種由于ACVR1基因突變,導致患者身體的肌肉以及結締組織逐漸骨化并累及全身的罕見常染色體顯性遺傳性結締組織疾病[1],[2]。FOP已被納入國家衛生健康委員會等六部門聯合發布的《第二批罕見病目錄》[3]。目前關于我國FOP患者的研究多為小樣本的病例回顧,而關于患者的生命質量、經濟負擔信息的報告幾乎沒有。因此,迫切需要對我國FOP患者開展社會學調查,掌握我國FOP患者的基本數據。
《進行性骨化性纖維發育不良患者社會學調查報告》旨在全面掌握中國進行性骨化性纖維發育不良患者的基本特征、診療現狀和疾病負擔,以幫助支持臨床實踐和相關罕見病政策的制定。為創新藥物的研發審批和相關醫療保障政策的制定提供了充分的真實世界數據支持。
該調查應用中國罕見病綜合云服務平臺線上同步調研系統完成,兩天內收集調研問卷67份,遠超預計數量,經數據質控后,最終所有問卷都作為有效問卷納入分析,高效率完成了對進行性骨化性纖維發育不良患者的社會學調查。
天津大學藥物科學與技術學院賀小寧副教授對《進行性骨化性纖維發育不良患者社會學調查報告》進行了解讀:"本研究共收集到患者問卷67例,FOP患者發病年齡早,首次平均發病年齡為4.9歲。患者診斷現狀不佳,平均確診年齡為8.0歲,延遲診斷時間長達3.1年,其中最長延遲診斷時間可達18年。殘疾程度高,98.5%的患者因病致殘。95.5%的患者都需要親友提供照護。59.7%的患者當前未接受藥物治療。61.2%的患者過去一年既沒有在門診就診也沒有進行住院治療。幾乎所有患者(97.0%)當前都有異位骨生成。高達92.5%的患者伴有因FOP產生的合并癥或并發癥。患者整體健康相關生命質量差[4]。FOP患者疾病負擔非常的沉重,希望推動創新藥物研發審批,完善罕見病患者醫療保障體系,降低患者疾病負擔以改善FOP患者生存現狀。"
中國罕見病聯盟執行理事長李林康表示,《進行性骨化性纖維發育不良患者社會學調查報告》的發布將喚起社會各界對FOP患者的關注,為罕見病診療服務的改善提供思考,同時,也為相關政策制定提供參考依據。加速新藥審批以及完善醫療保障制度,讓罕見病患者病有所醫,醫有所保。
上海交通大學醫學院附屬新華醫院小兒內分泌遺傳代謝科主任醫師、罕見病研究室主任顧學范教授介紹,新生兒篩查是預防罕見病的重要措施。近20多年來,隨著我國串聯質譜法多種遺傳代謝病篩查的逐步普及,40余種遺傳代謝病可以得到篩查和診斷。
北京協和醫院內分泌科主任夏維波教授介紹,大多數罕見的內分泌疾病都跟遺傳相關,臨床醫生認知度不高,診斷困難,基礎研究和臨床研究欠缺,缺乏有效的治療藥物,治愈率很低。罕見病病例登記系統對于我們了解罕見病,特別是內分泌罕見病是一個非常重要的手段。FOP患者異位骨化,致殘率高,臨床預后差。該調查報告的發布可以提供數據參考,幫助國家衛生政策的制定和實施。
天津大學藥物科學與技術學院副院長吳晶教授表示,該報告從疾病基本特征、診療現狀、社會學和經濟學等多個維度進行摸底調查和了解,全面了解患者疾病負擔與生存現狀,從而切實推動各項保障措施的發展,為未來的政策調整提供了可借鑒的實證依據。
益普生作為一家中型國際生物制藥公司,專注于腫瘤、罕見病和神經科學領域的革新型藥物,益普生上海創新中心將持續推出創新治療方案以滿足中國患者亟待解決的治療需求。隨著《進行性骨化性纖維發育不良患者社會學調查報告》的發布,益普生將繼續充分發揮自身在罕見病領域的優勢,發揮企業影響力,為罕見病患者提供創新藥物和治療方案,改善患者生命質量。
中國罕見病聯盟執行理事長李林康,上海交通大學醫學院附屬新華醫院小兒內分泌遺傳代謝科主任醫師、罕見病研究室主任顧學范教授,天津大學藥物科學與技術學院副院長吳晶教授、廣州市婦女兒童醫療中心主任劉麗教授、北京協和醫院內分泌科主任夏維波教授、北京協和醫院內分泌科主任醫師朱惠娟教授,北京兒童醫院內分泌遺傳代謝科主任、罕見病研究室主任鞏純秀教授,河北醫科大學第二醫院內分泌科副主任張松筠教授、天津大學藥物科學與技術學院賀小寧副教授、天使的珊瑚(FOP)關愛之家負責人張見蓬先生共同出席了本屆大會的內分泌遺傳代謝罕見病分論壇暨《進行性骨化性纖維發育不良患者社會學調查報告》發布儀式。
參考文獻
[1] Akesson LS, Savarirayan R. Fibrodysplasia Ossificans Progressiva. 2020 Jun 11. In: Adam MP, Ardinger HH, Pagon RA, et al., editors. GeneReviews® [Internet]. |
[2] Zhang, JM., Li, CF., Ke, SY. et al. Analysis of clinical manifestations and treatment in 26 children with fibrodysplasia ossificans progressiva in China. World J Pediatr 16, 82–88 (2020). |
[3] 國家衛健委《關于公布第二批罕見病目錄的通知》國衛醫政發〔2023〕26號 |
[4] 《進行性骨化性纖維發育不良患者社會學調查報告》 |
關于益普生
益普生集團是一家中型國際生物制藥公司,專注于腫瘤、罕見病和神經科學領域的革新型藥物。2022財年,益普生在特藥的總銷售額超過30億歐元,銷售網絡遍布全球100多個國家。除了外部創新戰略外,公司的研發工作還在位于領先的生物技術和生命科學中心——法國巴黎薩克萊、英國牛津、美國劍橋、中國上海——的創新和差異化技術平臺上開展。益普生(不含多元健康業務)在全球擁有約5200名員工,并通過贊助的 I 級美國存托憑證計劃(ADR:IPSEY)在巴黎(泛歐證券交易所代碼:IPN)和美國上市。更多詳細信息,請訪問 ipsen.com。
關于益普生中國
益普生集團于1992年進入中國,2019年在上海設立創新中心,是全球四個研發中心之一。益普生于2021年在上海成立中國區總部,并于2022年根據集團業務變動,同步剝離多元健康業務,專注于特藥領域,針對三大疾病領域(腫瘤、罕見病、神經科學)、六大適應癥,益普生上海創新中心將持續推出創新治療方案以滿足中國患者亟待解決的治療需求。
益普生—有關前瞻性聲明的警示說明
本文所含前瞻性聲明、目的和目標基于集團的管理戰略、當前觀點和假設。此類聲明涉及已知和未知的風險和不確定性,可能導致實際結果、業績或事件與本文所預期的大不相同。上述所有風險均可能影響集團在未來實現其財務目標的能力,財務目標是基于現今可用信息在合理的宏觀經濟條件下設定的。"相信"、"期望"和"期待"等詞語和類似表述的使用是為了明確前瞻性聲明,包括集團對未來事件的期望,此類事件包括監管文件和決定。此外,本文所述目標的制定未考慮外部增長假設和潛在未來收購,而這兩者可能會使指標發生變化。目的的依據是集團認為合理的數據和假設。目標取決于將來可能發生的條件或事實,而不僅取決于歷史數據。考慮到某些風險和不確定性的發生,實際結果可能與這些指標有很大出入,明顯表現為在早期研發階段或臨床試驗中有前景的產品可能最終永遠不會投放市場或達到其商業目標,尤其是由于注冊或競爭原因。集團必須面對或可能面對來自仿制藥的競爭,這可能會轉化為市場份額的損失。此外,研發過程涉及多個階段,每個階段都涉及重大風險,即集團可能無法實現其目的并被迫放棄就自身已投入大量資金的產品所做的努力。因此,集團不能確定在臨床前試驗中獲得的有利結果是否會在隨后的臨床試驗中得到確認,也不能確定臨床試驗的結果是否足以證明相關產品的安全性和有效性。不能保證產品將獲得必要的注冊批準或該產品將被證明在商業上是成功的。如果基本假設證明不準確或確實出現風險或不確定性,則實際結果可能與前瞻性聲明中的結果有很大不同。其他風險和不確定性包括但不限于一般行業條件和競爭;一般經濟因素,包括利率和貨幣匯率波動;制藥行業法規和醫療保健立法的影響;全球醫療成本抑制趨勢;競爭對手獲得技術進步、新產品和專利;新產品研發中固有的挑戰,包括獲得監管部門的批準;集團準確預測未來市場狀況的能力;生產困難或延誤;國際經濟的金融不穩定和主權風險;對集團專利的有效性和創新產品的其他保護的依賴;以及可能面臨的訴訟,包括專利訴訟和/或監管訴訟。此外,集團依賴第三方來研發和銷售某些產品,這些產品可能會產生大額特許權使用費用;這些合作伙伴的行為可能會對集團的活動和財務結果造成損害。集團不能確定其合作伙伴將履行各自的義務。集團可能無法從這些協議中獲得任何利益。集團任何合作伙伴違約均會產生低于預期的收益。此類情況可能會對集團的業務、財務狀況或業績產生負面影響。集團明確聲明,除非適用法律有所要求,否則其不承擔更新或修訂本新聞稿中所包含的任何前瞻性聲明、目標或假設的任何義務,以反映此類聲明所依據的事件、條件、假設或情況的任何變化,也不會就此作出任何承諾。集團的業務受制于其在法國金融市場監管機構備案的注冊文件中概述的風險因素。該文件中所列風險和不確定性并非詳盡無遺,建議讀者參閱集團網站(www.ipsen.com)上集團的最新通用注冊文件。
重點回顧
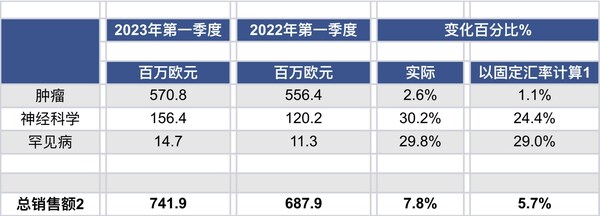
- 受增長平臺[3]增長14.7%[1]的推動,以固定匯率計算(CER)[1]的總銷售額增長5.7%,或如財務報告顯示為7.8% 。其中,吉適®(A型肉毒毒素)和Cabometyx®(卡博替尼)分別增長25.2%[1]和31.0%[1],這一業績涵蓋了新收購的產品Tazverik®(tazemetostat)和Bylvay®(odevixibat)
- 益普生完成收購Albireo的最終并購協議,擴展罕見病領域的產品組合
- 在美國,Bylvay用于治療Alagille綜合征和Palovarotene用于治療進行性骨化性纖維發育不良(FOP)的監管決定日期已確定
- 2023年全年指引確認,以固定匯率計算1的總銷售額增長超過4.0%,核心營業利潤率約為總銷售額的30%
David Loew,益普生全球首席執行官:
"益普生在轉型方面繼續取得卓越進展。受吉適和Cabometyx強勁業績的推動,我們在本季度進一步實現了銷售額強勁增長。基于這一銷售勢頭,我們正在確認2023年全年指引。成功收購Albireo,使得我們的研發管線、產品組合和組織架構都得以進一步強化,對此我感到非常高興。通過在全球的布局,我們將持續滿足患者亟待解決的醫療需求。通過加強研發管線和執行近期并購計劃,我們預期將達到以下幾個業務里程碑,包括elafibranor的III期數據讀出以及Onivyde、Palovarotene和Bylvay的預期監管進展。"
2023年全年指引
益普生已確認其2023年財年的財務指引[4]:
- 以固定匯率計算,總銷售額增長超過4.0%。基于2023年第一季度的平均匯率水平,預計匯率將對總銷售額產生約2%的不利影響
- 核心營業利潤率約占總銷售額的30%,不包括未來外部創新交易的增量投資的任何潛在影響
業務發展
2023年3月,益普生宣布完成了對Albireo Pharma, Inc.的收購,Albireo Pharma, Inc.是一家開發罕見肝病治療藥物膽汁酸調節劑的創新領導企業。益普生以42.00美元/股的價格收購了所有已發行的股份和流通股,外加一項10.00美元/股的不可轉讓或有價值權(CVR)。
研發管線進展
2023年2月,益普生宣布美國食品藥品監督管理局已受理關于Bylvay用于治療Alagille綜合征患者的第二個適應癥的補充新藥申請。管理局還發布了《處方藥使用者付費法案》(PDUFA),生效日期為2023年6月15日。
2023年3月,對于重新提交的palovarotene作為FOP潛在治療藥物的新藥申請,益普生宣布其在美國的PDUFA生效日期為2023年8月16日。益普生近期還要求重新審查2023年1月收到的人用藥品委員會(CHMP)對palovarotene的否定意見。[5]
說明
所有財務數據均以百萬歐元(€m)為單位。除非另有說明,本報告的業績涵蓋2023年3月31日之前的3個月第一季度或2023年第一季度),而進行數據對比的對象為2022年3月31日之前的3個月(2022年第一季度)。
關于益普生
益普生集團是一家中型國際生物制藥公司,專注于腫瘤、罕見病和神經科學領域的革新型藥物。2022財年,益普生在特藥的總銷售額超過30億歐元,銷售網絡遍布全球100多個國家。除了外部創新戰略外,公司的研發工作還在位于領先的生物技術和生命科學中心——法國巴黎薩克萊、英國牛津、美國劍橋、中國上海——的創新和差異化技術平臺上開展。益普生(不含多元健康業務)在全球擁有約5000名員工,并通過贊助的 I 級美國存托憑證計劃(ADR:IPSEY)在巴黎(泛歐證券交易所代碼:IPN)和美國上市。更多詳細信息,請訪問 ipsen.com。
關于益普生中國
益普生集團于1992年進入中國,2019年在上海設立創新中心,是全球四個研發中心之一。益普生于2021年在上海成立中國區總部,并于2022年根據集團業務變動,同步剝離多元健康業務,專注于特藥領域,針對三大疾病領域(腫瘤、罕見病、神經科學)、六大適應癥攜手創新中心持續推出創新治療方案以滿足中國患者亟待解決的治療需求。
益普生—有關前瞻性聲明的警示說明
本文所含前瞻性聲明、目的和目標基于集團的管理戰略、當前觀點和假設。此類聲明涉及已知和未知的風險和不確定性,可能導致實際結果、業績或事件與本文所預期的大不相同。上述所有風險均可能影響集團在未來實現其財務目標的能力,財務目標是基于現今可用信息在合理的宏觀經濟條件下設定的。"相信"、"期望"和"期待"等詞語和類似表述的使用是為了明確前瞻性聲明,包括集團對未來事件的期望,此類事件包括監管文件和決定。此外,本文所述目標的制定未考慮外部增長假設和潛在未來收購,而這兩者可能會使指標發生變化。目的的依據是集團認為合理的數據和假設。目標取決于將來可能發生的條件或事實,而不僅取決于歷史數據。考慮到某些風險和不確定性的發生,實際結果可能與這些指標有很大出入,明顯表現為在早期研發階段或臨床試驗中有前景的產品可能最終永遠不會投放市場或達到其商業目標,尤其是由于注冊或競爭原因。集團必須面對或可能面對來自仿制藥的競爭,這可能會轉化為市場份額的損失。此外,研發過程涉及多個階段,每個階段都涉及重大風險,即集團可能無法實現其目的并被迫放棄就自身已投入大量資金的產品所做的努力。因此,集團不能確定在臨床前試驗中獲得的有利結果是否會在隨后的臨床試驗中得到確認,也不能確定臨床試驗的結果是否足以證明相關產品的安全性和有效性。不能保證產品將獲得必要的注冊批準或該產品將被證明在商業上是成功的。如果基本假設證明不準確或確實出現風險或不確定性,則實際結果可能與前瞻性聲明中的結果有很大不同。其他風險和不確定性包括但不限于一般行業條件和競爭;一般經濟因素,包括利率和貨幣匯率波動;制藥行業法規和醫療保健立法的影響;全球醫療成本抑制趨勢;競爭對手獲得技術進步、新產品和專利;新產品研發中固有的挑戰,包括獲得監管部門的批準;集團準確預測未來市場狀況的能力;生產困難或延誤;國際經濟的金融不穩定和主權風險;對集團專利的有效性和創新產品的其他保護的依賴;以及可能面臨的訴訟,包括專利訴訟和/或監管訴訟。此外,集團依賴第三方來研發和銷售某些產品,這些產品可能會產生大額特許權使用費用;這些合作伙伴的行為可能會對集團的活動和財務結果造成損害。集團不能確定其合作伙伴將履行各自的義務。集團可能無法從這些協議中獲得任何利益。集團任何合作伙伴違約均會產生低于預期的收益。此類情況可能會對集團的業務、財務狀況或業績產生負面影響。集團明確聲明,除非適用法律有所要求,否則其不承擔更新或修訂本新聞稿中所包含的任何前瞻性聲明、目標或假設的任何義務,以反映此類聲明所依據的事件、條件、假設或情況的任何變化,也不會就此作出任何承諾。集團的業務受制于其在法國金融市場監管機構備案的注冊文件中概述的風險因素。該文件中所列風險和不確定性并非詳盡無遺,建議讀者參閱集團網站(www.ipsen.com)上集團的2022年通用注冊文件。
注解:
- 以固定匯率(CER)計算,即通過應用前一財務期間使用的匯率重新計算相關時期的業績以排除任何外匯影響。
- 本報告中的總銷售額為未經審計的IFRS合并銷售額。
- Dysport, Decapeptyl® (triptorelin), Cabometyx 和 Onivyde® (irinotecan) 。
- 所有評論和較之前業績的比較均不包括2022年7月剝離的消費者保健業務的業績。
- 人用藥品委員會,負責人用藥品的歐洲藥品管理局。
《泌尿外科疾病與學科發展藍皮書》是一本全面介紹中國泌尿外科學科建設和疾病發展狀況的權威性著作,由中國泌尿外科學會主編。該藍皮書涵蓋中國泌尿外科疾病在臨床診斷、治療和基礎研究等方面的最新成果,凝聚了業內專家們的集體智慧與共識。作為國內第一本專科發展藍皮書,具有重要的行業首創性意義。
中國人民解放軍總醫院泌尿外科醫學部主任、中國科學院院士,中華醫學會泌尿外科分會侯任主任委員張旭院士指出:“在過去二三十年醫療衛生事業快速發展中,泌尿外科作為傳統重點學科之一,經歷一輪快速蓬勃的發展。在新技術和新服務模式支撐下,微創化、精準化、智慧化也正在成為泌尿系統學科發展的大趨勢。”
作為藍皮書編寫項目參與者,益普生見證了藍皮書啟動、研討、編撰、修改的過程。 “我們很高興參與和見證泌尿外科疾病與學科發展藍皮書的發布。” 益普生中國總經理Guillaume DELMOTTE在論壇致辭中表示,“我們希望與醫學專家、患者、社會建立更多連接和協作,推動全社會對于泌尿系統疾病防治,尤其是泌尿腫瘤防治的關注。”
益普生一直秉承以患者為中心的理念,聚焦泌尿外科的重要分支 -- 前列腺癌的治療。作為全球特藥領域生物制藥公司,益普生也專注于腫瘤、罕見病和神經科學方面的革新型藥物,始終將在特藥領域的研發作為集團戰略的核心。2019年,益普生在上海設立創新中心,是全球四個研發中心之一。2021年在上海成立特藥中國區總部,并于2022年全面轉型,專注于腫瘤、罕見病和神經科學領域。益普生中國致力于推出創新治療方案以滿足中國患者亟待解決的治療需求。
此外,復旦大學醫院管理研究所所長高解春教授,中華醫學會泌尿外科分會主任委員、中山大學孫逸仙紀念醫院泌尿外科主任黃健教授,中國臨床腫瘤學會前列腺癌專家委員會主任委員、復旦大學附屬腫瘤醫院葉定偉教授,中國醫師學會泌尿外科醫師分會名譽會?、北京大學第一醫院泌尿外科周利群教授,上海交通?學泌尿外科研究所所?、上海交通大學醫學院附屬第一人民醫院夏術階教授,中華醫學會老年醫學分會主任委員、北京醫院王建業教授,中華醫學會男科學分會副主委、華中科技大學同濟醫學院附屬同濟醫院劉繼紅教授等數十位泌尿外科權威專家亦出席論壇并發表演講。
作為活動支持單位之一,益普生希望以此助力臨床專科能力建設提升,推動行業的高質量發展。本次以泌尿外科為先導開啟臨床專科能力建設的藍皮書項目,將為整個行業帶來更多思考和沉淀。
關于益普生
益普生集團是一家中型國際生物制藥公司,專注于腫瘤、罕見病和神經科學領域的革新型藥物。2022財年,益普生在特藥的總銷售額為30億歐元,銷售網絡遍布全球100多個國家。除了外部創新戰略外,公司的研發工作還在位于領先的生物技術和生命科學中心 -- 法國巴黎薩克萊、英國牛津、美國劍橋、中國上海 -- 的創新和差異化技術平臺上開展。益普生(不含多元健康業務)在全球擁有約5000名員工,并通過贊助的I級美國存托憑證計劃(ADR:IPSEY)在巴黎(泛歐證券交易所代碼:IPN)和美國上市。更多詳細信息,請訪問ipsen.com。
關于益普生中國
益普生集團于1992年進入中國,2019年在上海設立創新中心,是全球四個研發中心之一。益普生于2021年在上海成立中國區總部,專注于腫瘤、罕見病和神經科學領域,攜手創新中心持續推出創新治療方案以滿足中國患者亟待解決的治療需求。
益普生 -- 有關前瞻性聲明的警示說明
本文所含前瞻性聲明、目的和目標基于集團的管理戰略、當前觀點和假設。此類聲明涉及已知和未知的風險和不確定性,可能導致實際結果、業績或事件與本文所預期的大不相同。上述所有風險均可能影響集團在未來實現其財務目標的能力,財務目標是基于現今可用信息在合理的宏觀經濟條件下設定的。“相信”、“期望”和“期待”等詞語和類似表述的使用是為了明確前瞻性聲明,包括集團對未來事件的期望,此類事件包括監管文件和決定。此外,本文所述目標的制定未考慮外部增長假設和潛在未來收購,而這兩者可能會使指標發生變化。目的的依據是集團認為合理的數據和假設。目標取決于將來可能發生的條件或事實,而不僅取決于歷史數據。考慮到某些風險和不確定性的發生,實際結果可能與這些指標有很大出入,明顯表現為在早期研發階段或臨床試驗中有前景的產品可能最終永遠不會投放市場或達到其商業目標,尤其是由于注冊或競爭原因。集團必須面對或可能面對來自仿制藥的競爭,這可能會轉化為市場份額的損失。此外,研發過程涉及多個階段,每個階段都涉及重大風險,即集團可能無法實現其目的并被迫放棄就自身已投入大量資金的產品所做的努力。因此,集團不能確定在臨床前試驗中獲得的有利結果是否會在隨后的臨床試驗中得到確認,也不能確定臨床試驗的結果是否足以證明相關產品的安全性和有效性。不能保證產品將獲得必要的注冊批準或該產品將被證明在商業上是成功的。如果基本假設證明不準確或確實出現風險或不確定性,則實際結果可能與前瞻性聲明中的結果有很大不同。其他風險和不確定性包括但不限于一般行業條件和競爭;一般經濟因素,包括利率和貨幣匯率波動;制藥行業法規和醫療保健立法的影響;全球醫療成本抑制趨勢;競爭對手獲得技術進步、新產品和專利;新產品研發中固有的挑戰,包括獲得監管部門的批準;集團準確預測未來市場狀況的能力;生產困難或延誤;國際經濟的金融不穩定和主權風險;對集團專利的有效性和創新產品的其他保護的依賴;以及可能面臨的訴訟,包括專利訴訟和/或監管訴訟。此外,集團依賴第三方來研發和銷售某些產品,這些產品可能會產生大額特許權使用費用;這些合作伙伴的行為可能會對集團的活動和財務結果造成損害。集團不能確定其合作伙伴將履行各自的義務。集團可能無法從這些協議中獲得任何利益。集團任何合作伙伴違約均會產生低于預期的收益。此類情況可能會對集團的業務、財務狀況或業績產生負面影響。集團明確聲明,除非適用法律有所要求,否則其不承擔更新或修訂本新聞稿中所包含的任何前瞻性聲明、目標或假設的任何義務,以反映此類聲明所依據的事件、條件、假設或情況的任何變化,也不會就此作出任何承諾。集團的業務受制于其在法國金融市場監管機構備案的注冊文件中概述的風險因素。該文件中所列風險和不確定性并非詳盡無遺,建議讀者參閱集團網站(www.ipsen.com)上集團的2021年注冊文件。