濟南2024年9月30日 /美通社/ -- 9月27-28日,2024年美國臨床腫瘤學會優質護理專題研討會(ASCO QCS)年會召開,齊魯制藥注射用羅普司亭N01(瑞立升®)用于腫瘤化療相關性血小板減少癥(CIT)的2/3期臨床試驗最新數據在會上發布。
羅普司亭是第二代血小板生成素(TPO)受體激動劑,用于治療原發慢性免疫性血小板減少癥(ITP)。今年4月,齊魯制藥瑞立升®獲得國家藥監局上市批準,適用于對其他治療(例如皮質類固醇、免疫球蛋白)反應不佳的成人(≥18周歲)慢性免疫性血小板減少癥患者。
本研究招募發生CIT的實體瘤或淋巴瘤患者,牽頭研究者為同濟大學附屬東方醫院的李進教授。研究的A部分為開放標簽臨床試驗,根據不同基線血小板計數水平(100~200×109/L或<100×109/L)和羅普司亭N01起始劑量(1μg/kg或2μg/kg)將受試者分為3組,探索羅普司亭N01在CIT患者中的最佳給藥方案。其主要終點為化療周期最后一天的有效反應率。研究的B部分為雙盲、隨機、安慰劑對照臨床試驗,評價羅普司亭N01用于預防CIT發生的療效和安全性。其主要終點為雙盲期產生有效性反應的患者比例。
A部分共納入50例受試者,第1組(基線血小板計數100~200×109/L;起始劑量1μg/kg)、第2組(基線血小板計數100~200×109/L;起始劑量2μg/kg)、第3組(基線血小板計數<100×109/L;起始劑量2μg/kg)分別為15、15、20例。三組的有效反應率分別為66.7%、53.3%和90.0%。僅1例患者(第3組)發生化療延遲≥4天或化療劑量降低≥20%。三組的治療相關不良事件(TRAE)的發生率分別為26.7%、20.0%、20.0%。未發生治療相關的嚴重不良事件。無治療相關出血或死亡事件發生。
B部分共計63例受試者被隨機分配到羅普司亭N01組(41例)或安慰劑組(22例)。兩組產生有效性反應的患者比例分別為68.3%和40.9%,校正后率差為27.6%。羅普司亭N01組和安慰劑組中分別有75.6%和40.9%的患者未發生因血小板減少導致的化療延遲或劑量降低或停藥。無需挽救治療的患者比例在羅普司亭N01組和安慰劑組中分別為78.0%和63.6%。任何等級的TRAE在羅普司亭N01組和安慰劑組中的發生率分別為41.5%和54.4%,其中羅普司亭N01組中有1例(2.4%)≥3級TRAE。無治療相關出血或死亡事件發生。
此外,匯總A、B研究部分患者的療效數據結果顯示,羅普司亭N01組和安慰劑組中的產生有效性反應的患者比例分別為73.3%(55/75)和40.9%(9/22),校正后率差為37.7%。
綜上,羅普司亭N01能有效升高CIT患者的血小板計數水平,降低化療延遲或化療劑量減少的發生率,整體的給藥安全性和耐受性良好。

濟南2024年9月10日 /美通社/ -- 9月07-10日,肺癌領域的年度盛會世界肺癌大會(WCLC)在美國圣迭戈舉辦。當地時間8日,齊魯制藥伊魯阿克片(啟欣可®)在克唑替尼耐藥的間變性淋巴瘤激酶(ALK)陽性非小細胞肺癌患者中II期臨床試驗(INTELLECT研究)的最新數據以壁報形式展示。
伊魯阿克是由齊魯制藥研發的新一代ALK/ROS1激酶抑制劑,2023年6月獲批用于治療既往接受過克唑替尼治療后疾病進展或對克唑替尼不耐受的ALK陽性的局部晚期或轉移性非小細胞肺癌患者,并于今年1月獲批用于一線治療ALK陽性的非小細胞肺癌患者。
本研究的牽頭研究者為中國醫學科學院腫瘤醫院的石遠凱教授。INTELLECT研究的目的是評價伊魯阿克在克唑替尼耐藥的ALK陽性晚期非小細胞肺癌患者中的療效和安全性。該INTELLECT研究結果曾于2023年在著名期刊《BMC Medicine》上發表,本次WCLC會議報告的是延長兩年隨訪時間的更新數據。
本研究共入組146例受試者,截至2023年12月29日,中位隨訪時間為42.41個月,中位總生存期(OS)達到41.79個月。研究者評價的客觀緩解率(ORR)和疾病控制率(DCR)分別為63.7%和94.5%,中位緩解持續時間(DoR)和無進展生存期(PFS)分別為14.06個月和14.55個月。
根據RECIST v1.1評價標準,基線有中樞神經系統轉移亞組(90例)的ORR和DCR分別為55.6%和93.3%,中位DoR和PFS均為17.25個月,中位OS為43.01個月。
根據RANO-BM評價標準,在90例基線有中樞神經系統轉移的患者中,有17例(18.9%)達到顱內完全緩解(CR)。在42例基線有顱內可測量病灶的受試者中,顱內客觀緩解率(iORR)和顱內疾病控制率(iDCR)分別為64.3%和95.2%。
安全性方面,治療相關不良事件(TRAE)的發生率為93.8%(137例),3級或4級TRAE的發生率為30.8%(45例)。最常見的TRAE為天門冬氨酸氨基轉移酶升高(45.2%)、高膽固醇血癥(37.7%)和丙氨酸氨基轉移酶升高(37.0%),未發現新的安全性信號。
INTELLECT研究的長期隨訪結果顯示,伊魯阿克為克唑替尼耐藥的ALK陽性晚期非小細胞肺癌患者帶來了OS獲益,且無新的安全性信號。
參考文獻:
- Shi Y, et al. Efficacy and safety of iruplinalkib (WX-0593) in ALK-positive crizotinib-resistant advanced non-small cell lung cancer patients: a single-arm, multicenter phase II study (INTELLECT). BMC Med 2023;21(1):72.
- Shi Y, et al. Iruplinalkib (WX-0593) Versus Crizotinib in ALK TKI-Naive Locally Advanced or Metastatic ALK-Positive NSCLC: Interim Analysis of a Randomized, Open-Label, Phase 3 Study (INSPIRE). J Thorac Oncol. 2024;19(6):912-927.

濟南2024年6月7日 /美通社/ -- 2024年5月31日至6月4日,2024年美國臨床腫瘤學會(ASCO)年會在美國芝加哥以線上結合線下的形式召開。齊魯制藥有3項臨床研究結果入選ASCO大會壁報展示,研究涉及的新藥包括靶向PD-L1/4-1BB的雙特異性抗體QLF31907,靶向PD-1/CTLA-4的組合抗體艾帕洛利托沃瑞利單抗(艾托組合抗體),以及靶向PD-1的艾帕洛利單抗。研究領域分別涉及晚期實體瘤和淋巴瘤、鼻咽癌、以及DNA錯配修復缺陷(dMMR)或高度微衛星不穩定(MSI-H)的實體瘤。
QLF31907由齊魯制藥自主研發。一方面通過阻斷PD-L1恢復TCR信號,另一方面通過與4-1BB結合,為T細胞活化提供共刺激信號,從而促進T細胞的增殖、活化,產生顯著的抗腫瘤免疫作用。本次入選的研究為PD-1/4-1BB雙抗(QLF31907)在晚期實體瘤和淋巴瘤患者的I期劑量遞增/擴展研究(摘要編號:2534),主要研究者為四川省腫瘤醫院林桐榆教授。
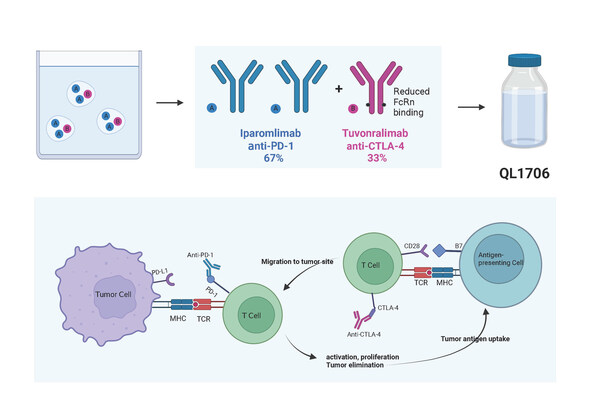
艾帕洛利托沃瑞利單抗(艾托組合抗體)由PD-1抗體IgG4和CTLA-4抗體IgG1按照固定的比例組成。藥物中的CTLA-4抗體成分經過改造,半衰期縮短。因此,艾托組合抗體可以在體內維持正常PD-1抗體暴露量的同時,降低CTLA-4抗體的暴露量,有望成為毒性更低、耐受性更佳的雙免疫療法。在1期研究中,艾托組合抗體單藥在晚期鼻咽癌患者中顯示出積極的抗腫瘤活性。本次入選的研究為艾帕洛利托沃瑞利單抗聯合吉西他濱和順鉑一線治療復發性或轉移性鼻咽癌患者的一項多中心、單臂、II期試驗(DUBHE-N-302)(摘要編號:6026),主要研究者為中山大學腫瘤防治中心黃巖教授。
研究共納入29例患者,其中7例(24%)患者基線ECOG PS評分為1。至數據截止,中位隨訪時間為15.5個月。18例(62%)患者發生3-4級治療相關不良事件(TRAE),最常見的3-4級TRAE為中性粒細胞計數降低(41%)。共28例患者至少有1次基線后腫評,客觀緩解率(ORR)為82.1%(95% CI:63.1%-93.9%)。中位無進展生存期(mPFS)為12.5個月(95% CI:5.7-NE)。在13例PD-L1高表達(CPS≥50)的患者中,mPFS為16.2個月(95% CI:9.9-NE)。中位總生存尚未達到。研究表明,艾托組合抗體聯合化療一線治療復發/轉移鼻咽癌安全性可耐受且顯示出良好的抗腫瘤活性。
艾帕洛利單抗是一種與PD-1結合的高選擇性人源化單克隆抗體。本次入選的研究為艾帕洛利單抗單藥治療不可切除或轉移性dMMR/MSI-H實體瘤的單臂、II期、關鍵臨床研究更新結果(摘要編號:3578),主要研究者為復旦大學附屬腫瘤醫院郭偉劍教授和四川大學華西醫院畢鋒教授。末例患者入組1年后的更新結果表明,艾帕洛利單抗單藥治療不可切除或轉移性dMMR/MSI-H實體瘤具有良好的療效。在標準治療失敗的實體瘤患者中,獨立影像評估委員會(IRRC)評估的客觀緩解率(ORR)達到50.0%,超過預設的主要終點,其中結直腸癌患者ORR達到57.9%。至數據截止時間,中位DOR、mPFS和中位總生存均未達到。結果表明,艾帕洛利單抗標準治療失敗的dMMR/MSI-H晚期實體瘤患者中顯示出良好且持久的療效,同時長時間治療仍具有良好的安全性和耐受性,無新的特有的安全性信號。

濟南2024年3月12日 /美通社/ -- 當地時間3月8日,在西班牙舉辦的第25屆歐洲婦科腫瘤學大會(ESGO 2024)上,齊魯制藥以口頭報告形式公布了艾帕洛利托沃瑞利單抗注射液(iparomlimab and tuvonralimab,QL1706)在一線標準治療失敗的復發/轉移宮頸癌患者中的II期臨床試驗(DUBHE-C-206)研究結果。報告人為中山大學腫瘤防治中心的劉繼紅教授。
研究背景和設計
宮頸癌是女性最常見的惡性腫瘤之一,也是最常見的癌癥相關死亡原因之一。對于一線標準治療失敗的患者,現有治療手段的效果都不甚滿意。帕博利珠單抗的客觀緩解率(ORR)、中位無進展生存期(PFS)、中位總體生存期(OS)分別為12.2%、2.1個月和9.4個月。其中PD-L1陰性人群的ORR為0%[1]。西米普利單抗的ORR、中位PFS、中位OS分別為16.4%、2.8個月和12.0個月[2]。因此,對于一線治療失敗的宮頸癌患者而言,目前還亟需安全有效的臨床治療手段。艾帕洛利托沃瑞利單抗由齊魯制藥自主研發,能夠靶向并抑制兩種免疫檢查點通路(抗PD-1 IgG4和抗CTLA-4 IgG1),且安全性良好,在前期研究中展現出了對宮頸癌患者的初步療效。DUBHE-C-206研究的主要目的是探索QL1706在經治復發/轉移宮頸癌患者中的療效和安全性。
本研究為多中心單臂開放標簽II期臨床試驗,納入一線含鉑化療±貝伐珠單抗失敗且未接受過免疫治療的復發/轉移宮頸癌患者。受試者接受艾帕洛利托沃瑞利單抗5.0 mg/kg Q3W注射治療。主要終點是獨立評價委員會(IRC)評價的ORR,次要終點是研究者評價的ORR、IRC和研究者評價的緩解持續時間(DoR)、IRC和研究者評價的疾病控制率(DCR)、PFS以及6個月和12個月PFS率、OS以及12個月OS率、安全性、藥代動力學和免疫原性。
研究結果
截至2023年4月28日,共計納入148例受試者,中位年齡為53.0歲。其中包括鱗癌患者132例(89.2%)。109(73.6%)例受試者的ECOG PS評分為1。105例(70.9%)受試者CPS≥1,43例(29.1%)受試者CPS<1。其中39.9%的患者曾有貝伐珠單抗治療史,37.2%的患者既往接受過≥2線治療。中位隨訪時間為11.0個月。
療效方面,IRC評價的ORR為33.8%(95% CI: 26.2%-42.0%),DCR為64.9%(95% CI: 56.6%-72.5%),中位PFS達到5.4個月(95% CI: 3.9-6.9),6個月和12個月PFS率分別為45.0%和16.1%,中位OS尚未達到,6個月和12個月OS率分別為83.9%和65.4%。亞組分析中,CPS≥1和CPS<1受試者的ORR分別為37.1%和25.6%;接受過貝伐珠單抗治療和未接受過貝伐珠單抗的受試者ORR分別為28.8%和37.1%。
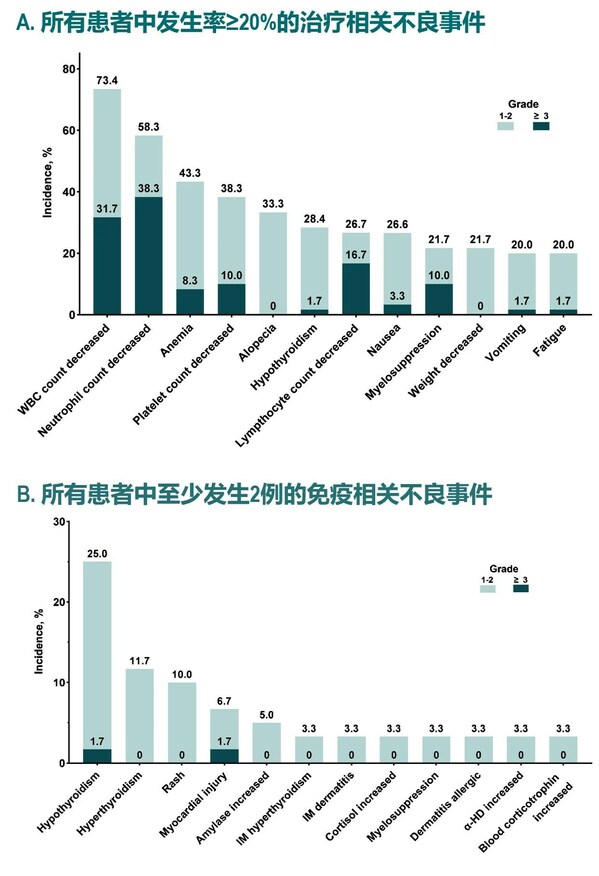
安全性方面,共計104例(70.3%)受試者發生了治療相關不良事件(TRAE),最常見的是甲狀腺功能減退癥(20.9%)和甲狀腺功能亢進癥(18.9%)。其中36例(24.3%)發生了≥3級TRAE,最常見的是貧血(4.1%)、GGT升高(2.7%)、脂肪酶升高(2.7%)。3例受試者(2.0%)因為TRAE停止治療。無導致死亡的TRAE發生。共65例(43.9%)受試者發生免疫相關不良事件(irAEs),其中21例(14.2%)發生≥3級irAE。
綜上,艾帕洛利托沃瑞利單抗(QL1706)在一線標準治療失敗的復發/轉移宮頸癌患者中表現出良好的療效和安全性,無論PD-L1表達情況如何,患者均可從中獲益。艾帕洛利托沃瑞利單抗有望成為宮頸癌患者的后線治療更加有效且安全的選擇。目前,艾帕洛利托沃瑞利單抗聯合化療±貝伐珠單抗作為一線治療的III期研究正在進行中。
中山大學腫瘤防治中心劉繼紅教授表示,"DUBHE-C-206的研究結果為雙免療法用于復發或轉移性晚期宮頸癌的后線治療提供了新的循證醫學證據,也證實了艾帕洛利托沃瑞利單抗是晚期宮頸癌患者一種新的治療選擇。研究結果表明了艾帕洛利托沃瑞利單抗在晚期宮頸癌全人群中的療效優勢,同時也顯示出明顯的安全性優勢。這些表明艾帕洛利托沃瑞利單抗能夠顯著提高患者的生活質量,為患者帶來更好的臨床獲益。目前,艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗作為復發或轉移性晚期宮頸癌一線治療的3期研究正在全力推進中,我們也非常期待這項III期研究的結果。"
浙江省腫瘤醫院樓寒梅教授表示,"對于一線治療失敗的晚期宮頸癌患者,目前治療手段仍然有限,并且療效未能令人滿意,還存在巨大的未滿足的臨床需求。DUBHE-C-206研究的療效及安全性數據令人鼓舞。與既往已報道過的PD-1聯合CTLA-4的雙免聯合治療相比,艾帕洛利托沃瑞利單抗毒性顯著降低,具有明顯的安全性和療效優勢,進一步支持雙免療法用于治療復發或轉移性晚期宮頸癌。因此,DUBHE-C-206的研究數據具有重要的臨床應用價值及意義。"
齊魯制藥臨床研發中心常務副總經理、腫瘤CMO康曉燕表示,"艾帕洛利托沃瑞利單抗是全球首個抗PD-1和抗CTLA-4的雙功能組合抗體,針對這一創新藥產品已經有多項臨床研究的數據發布。此次臨床研究成果入選ESGO會議口頭報告,再次體現了國際學術界對這一創新藥產品臨床應用前景的關注和認可。目前,艾帕洛利托沃瑞利單抗的多項III期臨床研究正在開展,涵蓋多個疾病領域,我們將繼續推進艾帕洛利托沃瑞利單抗臨床研發的步伐,讓這一創新藥產品早日惠及更多患者。"
參考文獻:
1. J Clin Oncol. 2019;37(17):1470-1478.
2. N Engl J Med. 2022;386(6):544-555.

濟南2024年3月1日 /美通社/ -- 近日,歐洲婦科腫瘤學會(European Society of Gynaecological Oncology,ESGO)2024會議在線公布了所有入選摘要。其中,齊魯制藥艾帕洛利托沃瑞利單抗注射液(iparomlimab and tuvonralimab,QL1706)宮頸癌2期臨床試驗(DUBHE-C-206)研究結果的摘要(#251)入選口頭報告(報告時間:當地時間3月8日)。
摘要鏈接:https://emma.events/site/programme/?a=esgo2024&trackid=548#!
本研究于國內的38家中心開展,牽頭研究者為中山大學腫瘤防治中心劉繼紅教授和浙江省腫瘤醫院樓寒梅教授。該研究為多中心、單臂II期臨床試驗,納入一線含鉑化療±貝伐珠單抗失敗且未接受過免疫治療的復發/轉移宮頸癌患者,給予艾帕洛利托沃瑞利單抗5.0 mg/kg Q3W注射治療。本研究共計納入148例受試者。至數據截止,中位隨訪時間為11.0個月。主要終點獨立評價委員會(IRC)評價的客觀緩解率(ORR)為33.8%,達預設主要終點。次要終點中,DCR為64.9%,PFS達到5.4個月,OS未達到。共計104例(70.3%)受試者發生了治療相關不良事件(TRAE)。36例(24.3%)受試者發生了≥3級TRAE,其中最常見的是貧血(4.1%)。3例受試者(2.0%)因為TRAE停止治療。無導致死亡的TRAE。
本研究結果表明,艾帕洛利托沃瑞利單抗作為復發/轉移宮頸癌的后線治療有效且安全。去年8月,艾帕洛利單抗托沃瑞利單抗注射液的上市申請獲CDE受理,為全球首款申報上市的PD-1/CTLA-4靶向組合抗體,有望將為宮頸癌患者帶來新希望。

濟南2024年1月30日 /美通社/ -- 近日,齊魯制藥伊魯阿克片一線治療局部晚期或轉移性間變性淋巴瘤激酶(ALK)陽性非小細胞肺癌的III期INSPIRE研究中期分析結果在國際肺癌研究協會官方期刊《胸部腫瘤學雜志》(Journal of Thoracic Oncology,IF=20.4)發表。伊魯阿克INSPIRE研究結果在國際權威期刊的發表,體現了國際學術界對于本項研究成果臨床意義的高度認可,也進一步加深學界對INSPIRE研究和伊魯阿克的認識。
伊魯阿克是新一代ALK受體酪氨酸激酶抑制劑(TKI),對野生型和突變型ALK融合基因均有抑制作用。這項研究在全國40家中心開展,牽頭研究者為中國醫學科學院腫瘤醫院石遠凱教授。研究結果顯示,與對照組相比,伊魯阿克顯著延長無進展生存期(PFS),同時顯示出更優的顱內抗腫瘤活性。
INSPIRE研究是一項隨機、開放、多中心的Ⅲ期臨床試驗,旨在評估伊魯阿克與克唑替尼對比在既往未接受過ALK抑制劑治療的ALK陽性局部晚期或轉移性非小細胞肺癌(NSCLC)患者中的療效與安全性。此前,部分數據在2023年世界肺癌大會上以口頭報告形式發表。
2019年9月4日至2020年12月2日,研究共入組292例ALK陽性的局部晚期或轉移性NSCLC患者,其中包括81例有中樞神經系統(CNS)轉移的患者。
基于此次《胸部腫瘤學雜志》發表的結果,截至2022年11月13日,IRC評估的研究結果顯示,伊魯阿克組與克唑替尼組的中位PFS分別為27.7個月和14.6個月,風險比(HR)為0.34(98.02% 置信區間CI, 0.23-0.52)。與克唑替尼組相比,伊魯阿克組患者的疾病進展或者死亡風險降低了66%。研究者評估的PFS結果與IRC評估結果一致。至數據截止,伊魯阿克組OS的中位隨訪時間是26.7個月,對照組的中位隨訪時間是25.9個月。中位OS尚未達到。
亞組分析及其他次要終點也支持伊魯阿克的優異療效。伊魯阿克與對照組相比所產生的腫瘤緩解更持久(中位DoR, 26.8個月 vs. 12.9個月;HR,0.31)。在基線有CNS轉移的患者中,伊魯阿克組的CNS客觀緩解率更高(顱內ORR,57.9% vs. 25.6%;顱內CR,31.6% vs. 2.6%);在基線有可測量CNS轉移灶的患者中,伊魯阿克組的顱內ORR達90.9%。
安全性方面,盡管伊魯阿克組的患者比對照組患者接受治療的時間更長(23.9個月 vs. 12.9個月),兩組重度不良反應(3級或4級)的發生率相當(51.7% vs.49.7%)。
基于INSPIRE研究的結果,伊魯阿克于今年1月被國家藥監局批準單藥用于ALK陽性的局部晚期或轉移性NSCLC患者的治療。目前該研究的長期隨訪仍在進行中,新的數據將陸續在各大學術會議上公布。
原文鏈接:https://www.jto.org/article/S1556-0864(24)00033-9/fulltext
]]>
濟南2023年12月8日 /美通社/ -- 12月6-8日,歐洲腫瘤內科學會免疫腫瘤學(ESMO Immuno-Oncology)大會在瑞士日內瓦召開,齊魯制藥以壁報形式報告了QLS31905在晚期實體瘤患者中的I期臨床試驗最新研究結果(壁報編號:132P)。主要研究者為北京大學腫瘤醫院的沈琳教授。
QLS31905是由齊魯制藥自主研發的靶向Claudin18.2的雙特異性T細胞銜接器(Bispeific T cell Engager)。本研究的主要目的是探索QLS31905在晚期實體瘤患者中安全性、耐受性,以及初步的抗腫瘤活性。
研究背景和設計:
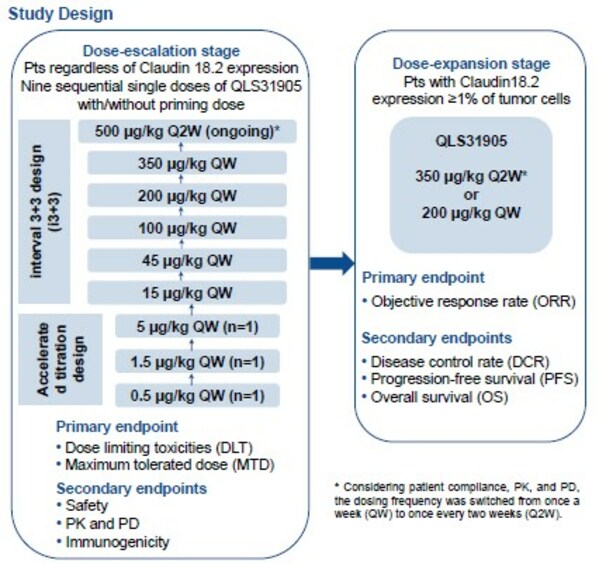
Claudin18.2是具有高度特異性的細胞表面分子,其異常激活表達常見于原發性胃癌以及胰腺癌、食管癌等實體瘤[1],[2]。QLS31905與腫瘤細胞表面的Claudin18.2和T細胞表面的CD3結合,通過募集和激活腫瘤細胞附近的T細胞,對腫瘤細胞進行持續地殺傷裂解。本研究納入標準治療失敗或不適用或無標準治療的晚期實體瘤患者。研究分為劑量遞增和劑量拓展兩個階段。劑量遞增階段采用加速滴定和i3+3的研究設計,QLS31905單次給藥劑量按照0.5μg/kg QW、1.5μg/kg QW、5μg/kg QW、15μg/kg QW、45μg/kg QW、100μg/kg QW、200μg/kg QW、350μg/kg QW、500 μg/kg Q2W遞增,主要終點是劑量限制毒性(DLT)和最大耐受劑量(MTD),次要終點是安全性、藥代動力學和藥效動力學、免疫原性。劑量拓展階段的主要終點是客觀緩解率(ORR),次要終點是疾病控制率(DCR)、無進展生存期(PFS)、總體生存期(OS)。
研究結果:
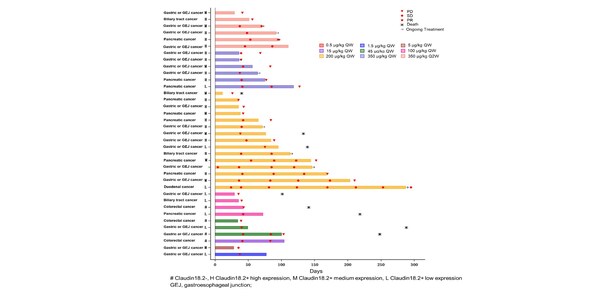
截止2023年7月17日,共計納入52例受試者,包括31例胃癌和12例胰腺癌患者。劑量遞增階段,共計22例受試者從0.5μg/kg QW爬坡到350 μg/kg QW隊列,目前500 μg/kg Q2W劑量水平正在進行中。劑量拓展階段采用了200μg/kg QW和350μg/kg Q2W兩個劑量水平,共計納入30例受試者。
安全性方面,DLT未發生,尚未確定MTD。共計21例(40.4%)受試者發生了≥3級的治療相關不良事件(TRAE)。10例(19.2%)受試者發生了治療相關的嚴重不良事件。2例受試者(3.8%)發生了導致停止治療的TRAE。最常見的TRAE是發熱(30例,57.7%)、惡心(26例,50.0%)、白細胞計數降低(18例,34.6%)。350 μg/kg QW隊列中的2例患者發生3級及以上的細胞因子釋放綜合征。
療效方面,在療效可評價的27例受試者中,ORR為11.1%,DCR為63.0%。達到部分緩解(PR)的3例患者中,2例為胰腺癌,1例為膽囊癌,Claudin18.2表達水平均為中/高表達。在14例疾病穩定(SD)的患者中,8例靶病灶縮小,其中7例為Claudin18.2中/高表達。
綜上,QLS31905在晚期實體瘤患者中展現出良好的安全性、耐受性、以及初步的抗腫瘤活性。目前QLS31905的II期臨床試驗正在進行中。
【參考文獻】
1. Sahin U, et al. Clin Cancer Res. 2008;14(23):7624-34. |
2. Singh P, et al. J Hematol Oncol. 2017;10(1):105. |

濟南2023年12月6日 /美通社/ -- 12月1至3日,在2023年歐洲腫瘤內科學會亞洲年會(ESMO Asia)上,齊魯制藥以壁報形式報告了1類新藥艾帕洛利單抗(QL1604)單藥治療不可切除或轉移性dMMR/MSI-H實體瘤的單臂、II期關鍵臨床研究最新結果。主要研究者為復旦大學附屬腫瘤醫院郭偉劍教授和四川大學華西醫院畢鋒教授。
艾帕洛利單抗是一種與PD-1結合的高選擇性人源化單克隆抗體。研究結果顯示,艾帕洛利單抗單藥治療不可切除或轉移性dMMR/MSI-H實體瘤具有良好的療效,獨立影像評估委員會(IRRC)評估的全人群客觀緩解率(ORR)為45.8%(95%CI, 36.7-55.2),超過預設主要研究終點。
一、研究背景
DNA錯配修復缺陷(dMMR)或高度微衛星不穩定(MSI-H)是實體瘤的獨特表型[1]。DNA復制過程中,微衛星序列最易發生錯配,需要進行錯配修復,dMMR可導致移碼突變,引起微衛星不穩定(MSI)。dMMR/MSI-H實體瘤對免疫檢查點抑制劑治療反應良好,程序性死亡受體-1(PD-1)或程序性死亡配體-1(PD-L1)抑制劑治療dMMR/MSI-H實體瘤具有較高的客觀緩解率(ORR),并且緩解持續時間長[2-3]。
艾帕洛利單抗治療晚期實體瘤的I期研究表現出良好的安全性和抗腫瘤活性,在接受艾帕洛利單抗0.3-3 mg/kg Q3W的所有患者中,ORR達到20%[4]。本關鍵研究旨在評估艾帕洛利單抗單藥治療不可切除或轉移性dMMR/MSI-H實體瘤的療效和安全性。
二、研究設計和方法
本研究為單臂、II期關鍵臨床研究,納入不可切除或轉移性經組織病理學或細胞學確認的dMMR/MSI-H實體瘤患者,接受艾帕洛利單抗單藥治療,給藥方案為200mg固定劑量(如果受試者體重<40kg,給藥劑量為3mg/kg),靜脈滴注,每3周給藥1次。患者接受艾帕洛利單抗治療直至疾病進展、出現不可耐受的毒性、開始新的抗腫瘤治療、死亡、撤回知情同意等原因,最長治療時間不超過2年。治療結束后,對患者進行生存隨訪。研究的主要終點為IRRC根據實體腫瘤療效評價標準(1.1版)評估的ORR。研究設計如下圖所示。
三、研究結果
從2020年6月至2023年1月,研究共納入120例dMMR/MSI-H實體瘤患者,其中結直腸癌患者80例(66.7%),胃癌患者18例(15.0%),其它實體瘤患者22例(18.3%);97.5%的患者在入組時疾病分期為IV期,中位治療線數為2.0(范圍,0–6)。
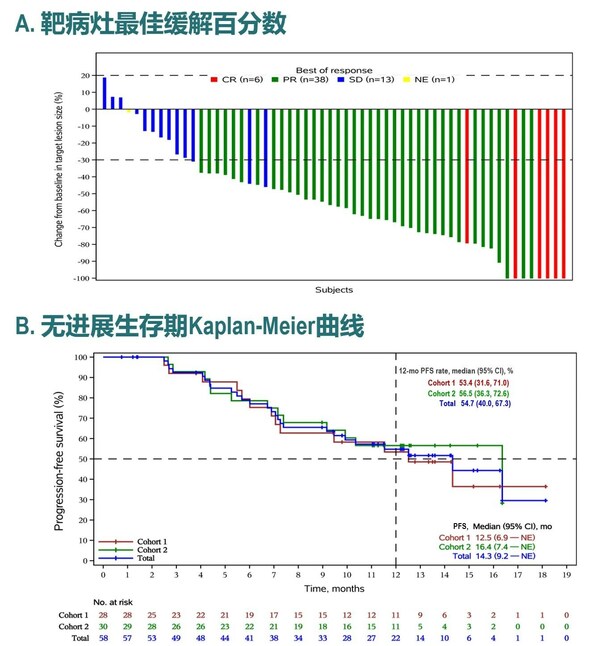
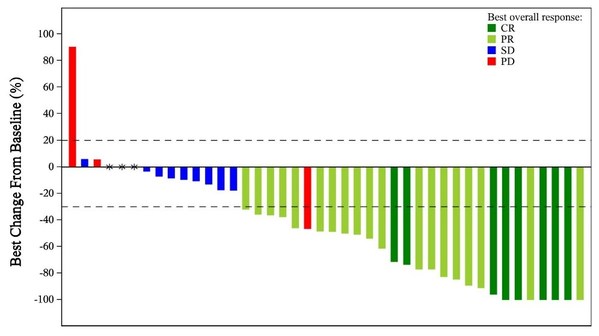
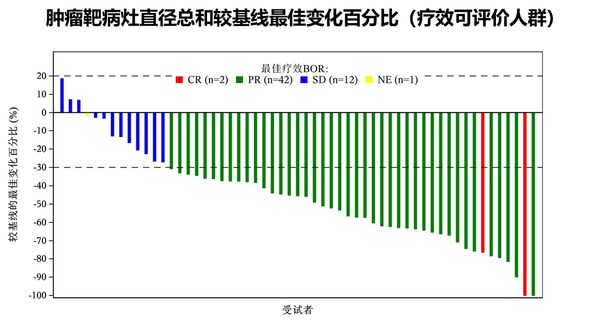
在療效方面,截至2023年7月20日,中位隨訪時間為13.6個月,有11例患者達到完全緩解(CR),44例患者達到部分緩解(PR),ORR為45.8%(95% CI: 36.7%–55.2%),疾病控制率(DCR)為77.5%(95% CI: 69.0%–84.6%)。在結直腸癌患者中,ORR和DCR分別為42.5%(95% CI: 31.5%–54.1%)和77.5%(95% CI: 31.5%–54.1%)。中位緩解持續時間(DoR)尚未達到,6個月和12個月DoR率分別為100%和97.4%;中位無進展生存期(PFS)和中位總生存期(OS)未達到。緩解患者的靶病灶最佳變化情況如下圖所示。
四、小結
艾帕洛利單抗單藥治療不可切除或轉移性dMMR/MSI-H實體瘤具有良好的療效和安全性。齊魯制藥艾帕洛利單抗上市申請已于今年9月獲得CDE受理。
參考文獻:
1. Bhamidipati D, Subbiah V. Tumor-agnostic drug development in dMMR/MSI-H solid tumors. Trends Cancer. 2023;9(10):828-839.
2. Le DT, et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med. 2015;372(26):2509-20.
3. Li J, et al. Subcutaneous envafolimab monotherapy in patients with advanced defective mismatch repair/microsatellite instability high solid tumors. J Hematol Oncol. 2021;14(1):95.
4. Huang Z, et al. A first-in-human, open-label, dose-escalation and dose-expansion phase I study to evaluate the safety, tolerability, pharmacokinetics/pharmacodynamics, and antitumor activity of QL1604, a humanized anti-PD-1 mAb, in patients with advanced or metastatic solid tumors. Front Immunol. 2023;14:1258573.

濟南2023年11月2日 /美通社/ -- 近日,齊魯制藥艾帕洛利單抗(研發代號:QL1604)I期研究結果在線發表于學術期刊《免疫學前沿》《Frontiers in Immunology》(2022年影響因子:7.3)。論文題目為《評估人源化抗PD-1單克隆抗體QL1604在晚期或轉移性實體瘤患者中的安全性、耐受性、藥代動力學/藥效學和抗腫瘤療效的首次人體、開放、劑量遞增和劑量擴展的I期研究》。該研究是艾帕洛利單抗首次人體研究,由浙江省腫瘤醫院范云教授團隊牽頭開展。
艾帕洛利單抗為齊魯制藥開發的一款重組抗PD-1人源化單克隆抗體,研究結果表明,這款創新型生物藥具有良好的安全性、耐受性及藥代動力學(PK)/藥效學(PD)特征,并顯示出抗腫瘤活性,為進一步開展艾帕洛利單抗臨床研究提供了證據。
(官網原文鏈接:https://www.frontiersin.org/articles/10.3389/fimmu.2023.1258573/full )
一. 研究背景和目的
本研究是艾帕洛利單抗在晚期或轉移性實體瘤患者中開展的開放標簽、I期臨床研究。研究的主要目的是觀察艾帕洛利單抗的安全性、耐受性,確定后續臨床研究的推薦劑量。
二. 研究設計和患者分布
本研究包括劑量遞增和劑量擴展兩個階段。2019年5月29日至2020年7月24日,共35例患者入組并接受艾帕洛利單抗治療。至數據截止時間(2022年7月14日),仍有4例患者在接受治療。
三. 安全性、耐受性和療效結果
在艾帕洛利單抗3 mg/kg每2周1次(Q2W)組的6例患者中,1例(16.7%)患者(胸腺癌)發生劑量限制性毒性(DLT),為3級重癥肌無力和免疫介導的肌炎。在擬定最高遞增劑量10 mg/kg水平未出現DLT,因此未找到明確的最大耐受劑量(MTD),耐受性良好。
共有94.3%(33/35)的患者發生不良事件(AEs),其中82.9%(29/35)為藥物相關不良事件(TRAEs)。安全性特征與既往報道的PD-1單克隆抗體一致。最常見的TRAEs(≥10%)為疲勞(37.1%)、貧血(22.9%)、血促甲狀腺激素增加(17.1%)、天門冬氨酸氨基轉移酶(AST)升高(17.1%)、丙氨酸氨基轉移酶(ALT)升高(14.3%)、白細胞計數減少(11.4%),皮疹(14.3%)和瘙癢(14.3%)。大多數TRAEs為1至2級。3級及以上TRAEs發生率為17.1%(6/35)。未發生5級TRAE。
共有17例(48.6%)患者發生免疫相關不良事件(irAEs),最常見的irAEs為血促甲狀腺素升高(17.1%);4例(11.4%)患者發生3級及以上irAEs,3例(8.6%)患者發生輸注相關不良事件(均為1-2級)。
安全性數據顯示,艾帕洛利單抗安全可管理,未觀察到新的安全性信號
共有7例(20.0%)患者達到部分緩解(PR),5例(14.3%)患者達到疾病穩定(SD)。客觀緩解率(ORR)為20.0%(7/35),疾病控制率(DCR)為34.3%(12/35)。緩解患者的中位緩解持續時間(DOR)為26.64個月(95% CI,2.79-不可評估)。
四. 藥動/藥效學結果
在0.3 mg/kg至10 mg/kg劑量范圍內,艾帕洛利單抗的半衰期(T1/2)為3至11天,藥物暴露與劑量呈線性關系。
藥效學結果顯示,艾帕洛利單抗3 mg/kg Q2W, 3 mg/kg Q3W, 10 mg/kg Q2W和200 mg Q3W固定劑量給藥后,在給藥后的1個周期內,PD-1平均受體占有率(RO)均大于80%。
五. 總結
艾帕洛利單抗單藥治療晚期或轉移性實體瘤的安全性和藥代動力學特征良好,顯示出明確的抗腫瘤療效信號。3 mg/kg Q3W和200 mg固定劑量Q3W確定為后續臨床研究的推薦劑量。
目前艾帕洛利單抗治療經過標準治療失敗的、不可切除或轉移性錯配修復缺陷型(dMMR)或高度微衛星不穩定型(MSI-H)晚期實體瘤患者的臨床研究已達到主要研究終點,新藥上市申請已于2023年9月17日獲得國家藥品監督管理局藥品審評中心受理。
]]>
濟南2023年10月26日 /美通社/ -- 10月22日,在2023年歐洲腫瘤內科學會(ESMO)年會上,齊魯制藥公布了艾帕洛利托沃瑞利單抗(QL1706)聯合化療加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌(r/mCC)的多中心、單臂II期臨床研究最新研究結果,報告人為遼寧省腫瘤醫院王丹波教授。
艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗一線治療復發/轉移性宮頸癌顯示出良好的客觀緩解率和生存獲益,安全性可控且未觀察到新的安全信號,有望成為復發/轉移性宮頸癌一線治療的新選擇。
一、研究背景
目前r/mCC的標準一線治療優選方案為順鉑或卡鉑聯合紫杉醇加貝伐珠單抗,同時要考慮療效和安全性;對PD-L1表達陽性的r/mCC患者,推薦采用PD-1抑制劑帕博利珠單抗聯合化療加或不加貝伐珠單抗作為一線標準治療。[1-2] 免疫聯合化療已成為復發/轉移性宮頸癌的標準治療。根據KEYNOTE-826研究最新結果,聯合帕博利珠單抗后,免疫聯合化療加或不加貝伐珠單抗一線治療PD-L1陽性(CPS≥1)r/mCC的中位無進展生存期(PFS)從8.2個月延長到10.4個月,中位總生存期(OS)從16.5個月延長到28.6個月。[3-4] 盡管PD-1抑制劑聯合化療與化療相比顯著改善了患者生存,患者的生存獲益仍然較有限,存在未滿足的臨床需求。
二、研究設計
本次研究納入未接受過系統治療的復發或轉移性宮頸癌患者,分別接受艾帕洛利托沃瑞利單抗聯合化療(隊列1)或再聯合貝伐珠單抗(隊列2)治療,直至疾病進展、出現不可耐受的毒性,或患者撤回知情同意。研究的主要終點為安全性,次要終點包括研究者根據實體瘤反應評價標準(RECIST)v1.1評估的ORR、緩解持續時間(DOR)、疾病控制率(DCR)和PFS,以及OS。研究設計如圖1所示。
三、研究結果
研究共入組60例患者,隊列1和隊列2各30例,分別接受艾帕洛利托沃瑞利單抗聯合順鉑/卡鉑加紫杉醇或再加貝伐珠單抗治療。所有患者的平均年齡為52.0歲,58.3%的患者ECOG行為學評分為1;78.3%的患者的病理類型為鱗癌,86.7%的患者為復發性宮頸癌。
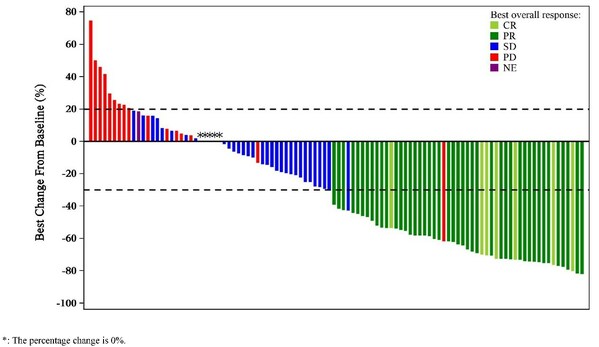
截至2023年4月24日,中位隨訪時間為14.0個月,共有58例患者至少接受1次基線后療效評估,客觀緩解率ORR為81.0% (95% CI, 68.6–90.1),其中有8例患者達到完全緩解(CR),39例患者達到部分緩解(PR);DCR為98.3% (95% CI,90.8–100.0)。中位PFS達到14.3個月(95% CI,9.2個月–不可評估),中位OS未達到。聯合貝伐珠單抗隊列2的中位PFS達到16.4個月。(圖2)
在安全性方面,所有患者發生治療相關不良事件(TRAEs),其中3級及以上不良事件的發生率為71.7%;最常見的TRAEs為白細胞計數減少 (71.3%)、中性粒細胞計數減少(68.3%)和貧血(43.3%)。治療相關嚴重不良事件的發生率為30%;免疫相關不良事件(irAEs)的發生率為13.3%;導致治療停止的TRAEs的發生率為26.7%;治療相關死亡的發生率為1.7%(可能為貝伐珠單抗相關)。(圖3)
三、小結
本研究結果顯示,艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗一線治療r/mCC具有良好的療效和安全性,且不區分PD-L1表達水平,患者均顯示獲益。
基于此項研究結果,艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗治療持續性、復發性或轉移性宮頸癌的III期臨床研究正在進行中。艾帕洛利托沃瑞利單抗用于治療經過至少一線含鉑標準治療失敗的復發性或轉移性的宮頸癌患者的新藥上市申請已于今年8月獲得CDE受理。
參考文獻:
1.中國臨床腫瘤學會指南工作委員會. 宮頸癌診療指南[M]. 2023. 北京:人民衛生出版社, 2023:70.
2.Tewari KS, et al. Improved survival with bevacizumab in advanced cervical cancer. N Engl J Med. 2014 Feb 20;370(8):734-43. doi: 10.1056/NEJMoa1309748. Erratum in: N Engl J Med. 2017 17;377(7):702.
3.Colombo N, et al. Pembrolizumab for Persistent, Recurrent, or Metastatic Cervical Cancer. N Engl J Med. 2021 11;385(20):1856-1867.
4.J Clin Oncol 41, 2023 (suppl 16; abstr 5500) .

濟南2023年10月18日 /美通社/ -- 齊魯制藥創新型雙功能組合抗體艾帕洛利托沃瑞利單抗(QL1706)臨床數據將以簡短口頭報告形式,在2023年歐洲腫瘤內科學會(ESMO)年會上亮相。ESMO大會是腫瘤內科領域的世界頂尖學術會議,將于10月20日-24日在西班牙馬德里舉行。本次報告的內容為艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌的多中心、單臂II期臨床研究的最新進展。
此外,齊魯制藥帕妥珠單抗生物類似藥(QL1209)聯合曲妥珠單抗和多西他賽新輔助治療早期或局晚期HER2陽性、激素受體陰性乳腺癌的多中心、隨機、雙盲、平行對照III期臨床研究將在ESMO大會上以壁報形式展出。
一、艾帕洛利托沃瑞利單抗II期臨床研究
免疫聯合化療已成為復發/轉移性宮頸癌的一線治療策略,齊魯1類新藥艾帕洛利托沃瑞利單抗是雙功能抗體,同時靶向PD-1和CTLA-4,發揮協同抗腫瘤作用。艾帕洛利托沃瑞利單抗治療晚期實體瘤的Ib期臨床研究證實,該藥物單藥治療晚期宮頸癌有突出的療效,在未經免疫治療的晚期宮頸癌患者中,客觀緩解率(ORR)達到28.3%。[1] 為進一步探討雙免疫聯合化療在復發/轉移性宮頸癌患者中的療效,齊魯制藥開展了艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌患者的多中心、單臂II期臨床研究。
研究納入未接受過系統治療的復發或轉移性宮頸癌患者,分別接受艾帕洛利托沃瑞利單抗聯合化療(隊列1)或再聯合貝伐珠單抗(隊列2)治療,直至疾病進展、出現不可耐受的毒性,或患者撤回知情同意。研究的主要終點為安全性,次要終點包括研究者根據實體瘤反應評價標準(RECIST)v1.1評估的ORR、緩解持續時間(DOR)、疾病控制率(DCR)和無進展生存期(PFS),以及總生存期(OS)。
研究結果表明,截至2023年4月24日,中位隨訪時間為14.0個月,共有58例患者至少接受1次基線后療效評估,ORR為81.0% (95% CI, 68.6-90.1),其中有8例患者達到完全緩解(CR),39例患者達到部分緩解(PR);DCR為98.3% (95% CI,90.8-100.0)。中位PFS達到14.3個月(95% CI,9.2個月-不可評估),中位OS未達到。因此,艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗治療復發或轉移性宮頸癌療效突出,艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗治療持續性、復發性或轉移性宮頸癌的III期臨床研究正在進行中。
QL1209 III期臨床研究
為評價QL1209與原研藥聯合曲妥珠單抗和多西他賽新輔助治療早期或局晚期HER2陽性、激素受體陰性乳腺癌的臨床等效性,開展了一項多中心、隨機、雙盲平行對照III期臨床研究。
研究納入早期或局晚期HER2陽性、雌激素受體(ER)和孕激素受體(PR)均為陰性的乳腺癌患者,以1:1的比例隨機分配到QL1209試驗組或原研藥對照組。兩組分別接受QL1209/原研藥 +曲妥珠單抗+多西他賽(THP)新輔助治療4周期,并在術后進行病理反應評價。隨后兩組均接受氟尿嘧啶+表阿霉素+環磷酰胺(FEC)輔助化療(第5-7周期);QL1209+曲妥珠單抗(第8-20周期)。研究的主要終點指標為獨立評審委員會評估的總體病理完全緩解率(tpCR)。
研究共入組517例患者,其中516例接受治療。有效性方面,試驗組和對照組中IRC評估的tpCR率分別為42.7%和45.2%,兩組間的tpCR率比為0.946(90%CI:0.80-1.11),率比的90%CI落在等效界值(0.76-1.32)內。安全性方面,試驗組和對照組治療期間出現的不良事件(TEAEs)的發生率為94.6%和96.1%;3級以上TEAEs的發生率為31.9%和34.7%;治療相關不良事件(TRAEs)發生率為77.4%和78.0%。免疫原性方面,試驗組和對照組的抗藥抗體(ADA)和中和抗體(NAb)發生率相似(2.3%和3.1%;0.8%和0.8%),同時ADA陽性對有效性、藥代動力學和安全性無影響。提示兩組臨床療效相似、安全性和免疫原性無明顯差異。由此認為QL1209是帕妥珠單抗生物類似藥。
參考文獻:
[1]. Zhao Y, et al. First-in-human phase I/Ib study of QL1706 (PSB205), a bifunctional PD1/CTLA4 dual blocker, in patients with advanced solid tumors. J Hematol Oncol. 2023 May 8;16(1):50. doi: 10.1186/s13045-023-01445-1. |
]]>

濟南2023年8月17日 /美通社/ -- 2023年8月16日,2023世界肺癌大會(WCLC)公布了全部入選摘要,其中齊魯制藥伊魯阿克III期臨床研究(INSPIRE)結果入選本次大會口頭報告。
伊魯阿克INSPIRE研究是一項隨機、開放、多中心的III期臨床研究,旨在既往未接受過ALK TKI治療的ALK陽性晚期非小細胞肺癌(NSCLC)患者中評價伊魯阿克(口服180 mg,每日一次;前7天導入期內為60 mg每日一次)對比克唑替尼(口服250 mg每日兩次)的有效性和安全性。主要研究終點為獨立影像評估委員會(IRC)評估的無進展生存期(PFS)。本研究的主要研究者是中國醫學科學院腫瘤醫院石遠凱教授,研究在全國共40家醫院開展。
2019年9月4日至2020年12月2日之間,共292例患者入組并接受治療(伊魯阿克組143例;克唑替尼組149例)。本次發表結果為基于獨立數據監察委員會(IDMC)審核的期中分析結果(期中分析數據截止日期:2022年11月13日)。伊魯阿克組與克唑替尼組的中位隨訪時間分別為23.98個月和24.54個月。結果顯示,主要研究終點PFS(IRC基于RECIST v1.1)達到預設標準,伊魯阿克組較克唑替尼組PFS得到顯著改善,兩組的中位PFS分別為27.70個月和14.62個月(風險比,0.344 [98.02%置信區間0.226-0.523]。在次要終點緩解持續時間(DoR)和顱內疾病控制上,伊魯阿克組也顯著優于克唑替尼組。在本研究中伊魯阿克的安全性與伊魯阿克既往研究安全性特征一致,安全性良好,較克唑替尼治療未增加安全性風險。
今年6月28日,國家藥品監督管理局批準伊魯阿克片(商品名:啟欣可®)上市,用于既往接受過克唑替尼治療后疾病進展或對克唑替尼不耐受的ALK陽性的局部晚期或轉移性NSCLC患者的治療。目前,伊魯阿克一線治療ALK陽性、晚期NSCLC患者的新藥上市申請已經遞交并獲CDE受理,伊魯阿克有望為患者提供新的治療選擇。

濟南2023年6月7日 /美通社/ -- 近日,在2023年美國臨床腫瘤學會年會(ASCO 2023)上,齊魯制藥展示了免疫治療組合抗體QL1706(艾帕洛利單抗/托沃瑞利單抗)兩項3期非小細胞肺癌(NSCLC)臨床研究的壁報(Trials in Progress)。
研究一:
題目:DUBHE-L-304: A randomized, double blinded, multicenter phase 3 study of platinum-based chemotherapy with or without QL1706 as adjuvant therapy in completely resected stage II-IIIB NSCLC
壁報編號:TPS8606
壁報展示日期:2023年6月4日
在所有NSCLC患者中,約有30%初診時診斷為可切除的早期NSCLC。對于早期NSCLC患者,手術是主要治療方法,對于可切除的局部晚期NSCLC患者輔助化療是常用治療方法。既往的3期臨床研究表明,PD-1/PD-L1抑制劑在NSCLC的輔助治療中顯示出良好的療效。然而,對于PD-L1表達陰性的NSCLC患者,PD-1/PD-L1抑制劑輔助治療的療效仍然有限。
DUBHE-L-304研究(NCT05487391)是一項雙盲、隨機、安慰劑對照III期臨床研究。研究計劃入組632例完全手術切除后、II-IIIB期、無EGFR敏感突變和ALK融合基因的NSCLC患者。患者分別接受QL1706或安慰劑治療16個周期,同時接受輔助化療2-4個周期。主要研究終點為在PD-L1≥1%人群中,研究者評估的無病生存期(disease-free survival, DFS),和全人群中研究者評估的DFS。研究于全國61家研究中心開展,首例患者于2022年12月8日入組。
研究二:
題目:DUBHE-L-303: A phase III, multicenter, double-blinded, randomized, active-controlled study on the efficacy and safety of QL1706 with chemotherapy (CT) as First-line (1L) therapy for PD-L1 negative advanced or metastatic non-small-cell lung cancer (NSCLC)
壁報編號:TPS9139
壁報展示日期:2023年6月4日
對于局部晚期或轉移性且驅動基因陰性的非小細胞肺癌(NSCLC)患者,免疫檢查點抑制劑聯合含鉑化療已經成為一線標準治療。在中國NSCLC患者中,PD-L1表達陰性(TPS<1%)的患者約占40%-50%。現有的標準治療在這部分人群中療效欠佳,存在未被滿足的治療需求。
DUBHE-L-303研究(NCT05690945)是一項雙盲、隨機、活性對照III研究。研究計劃入組650例PD-L1陰性、無EGFR/ALK突變的IIIB-IV期NSCLC患者,分別接受4個周期QL1706或替雷利珠單抗聯合化療治療,之后轉為QL1706或替雷利珠單抗維持治療(對于非鱗癌,給與QL1706或替雷利珠單抗加培美曲塞維持治療)。主要研究終點為研究者評估的無進展生存期(progression-free survival, PFS)(RECIST 1.1),和總生存期(overall survival, OS)。研究于全國68家研究中心開展,首例患者于2023年2月16日接受治療。
]]>
濟南2023年5月30日 /美通社/ -- 近日,美國臨床腫瘤學會(ASCO)官方網站公布了ASCO 2023年會入選的摘要。齊魯制藥免疫治療組合抗體QL1706(艾帕洛利單抗/托沃瑞利單抗)有四項臨床研究摘要入選,其中兩項摘要為QL1706在廣泛期小細胞肺癌及晚期肝癌中的最新臨床研究進展。
研究一 QL1706聯合卡鉑和依托泊苷一線治療廣泛期小細胞肺癌單臂、多中心的II期臨床研究
本研究是一項開放標簽、單臂、多中心II期臨床研究,旨在評估QL1706聯合卡鉑和依托泊苷一線治療廣泛期小細胞肺癌的安全性和有效性。研究共入組40例患者,中位年齡為58.5歲(范圍,38-73)。87.5%的患者為男性,80%的患者有吸煙史,90%的患者ECOG評分為1。
至數據截止時間(2023年1月16日),QL1706的中位治療時長為5.9個月(范圍,0.7-8.9)。全部患者均至少發生一次不良事件(TEAE)。共有32例(80%)患者至少發生一次與QL1706相關的不良事件(TRAE)。15例(37.5%)患者發生3至4級TRAE,未發生5級TRAE,未發生導致治療中止的不良事件。
共有39例患者至少進行一次基線后腫瘤評估,其中37例發生部分緩解(PR)(包含2例未確認PR),1例疾病穩定(SD)。根據RECIST標準,確認的客觀緩解率(ORR)為89.7%(35/39),疾病控制率(DCR)為97.4%(38/39)。中位緩解持續時間(mDoR)為4.5個月,中位無進展生存期(mPFS)為5.7個月。總生存期(OS)的隨訪時間為6.2個月,中位OS尚未達到。
結果顯示,QL1706聯合卡鉑和依托泊苷一線治療廣泛期小細胞耐受性良好,并顯示出良好的療效。
研究二 一項評價QL1706或QL1604注射液聯合貝伐珠單抗注射液在晚期肝癌患者中的安全性、藥代動力學和初步療效的Ⅰb/II期臨床研究
QL1604為PD-1單抗,QL1706中的PD-1單抗組分的分子序列、宿主細胞、構建、轉染及單克隆篩選過程與QL1604單抗相同。即QL1706是在獲得QL1604單克隆的基礎上,進一步將抗CTLA-4抗體重組質粒轉染至QL1604單克隆中,通過篩選最終獲得QL1706單克隆細胞株。臨床前已進行過二者初步的析因分析試驗。
本研究是一項多中心、開放、Ib/II期臨床試驗,分為三個部分。第一部分為安全性導入期和擴展期。在第二部分,患者隨機接受QL1604或QL1706(5mg/kg,Q3W)聯合貝伐珠單抗治療。在第三部分,患者接受QL1706(7.5mg/kg,Q3W)聯合貝伐珠單抗治療。根據第一部分和第二部分的析因分析研究結果,決定第三部分研究是否啟動。主要研究終點為安全性,次要研究終點為客觀緩解率(ORR)、疾病控制率(DCR)、無進展生存期(PFS)等。
至數據截止時間(2022年11月18日),第一部分和第二部分研究共入組76例患者(QL1706組,50例;QL1604組,26例)。兩組間患者的基線特征均衡。QL1706組和QL1604組治療相關不良事件(TRAEs)的發生率分別為86%和88.5%,兩組最常見的TRAEs均為蛋白尿(32.0% vs 30.8%),其次為血小板計數降低(26.0% vs 23.1%)和天門冬氨酸氨基轉移酶升高(22% vs 19.2%)。治療相關嚴重不良事件的發生率分別為16%和23.1%。免疫相關不良事件的發生率為分別50%和19.2%。
在療效可評估人群中,QL1706組和QL1604組的ORR分別為38.3% (18/47)和15.4% (4/26),DCR分別為74.5%和69.2%。QL1706組和QL1604組的中位無進展生存期(mPFS)分別為6.7個月和5.4個月。中位總生存期尚未達到。
結果顯示,與PD-1單抗聯合貝伐珠單抗相比,QL1706聯合貝伐珠單抗一線治療晚期肝癌顯示出更高的ORR和更長的PFS,此項研究的結果支持進一步開展QL1706聯合貝伐珠單抗一線治療晚期肝癌的III期臨床研究。
世界范圍內,宮頸癌的發病率和死亡率在女性中位居第四。R/M宮頸癌患者預后較差,5年生存率低于20%。盡管免疫檢查點抑制劑(ICIs)二線治療R/M宮頸癌患者顯示出臨床效果,其用于一線治療的研究結果仍然有限。
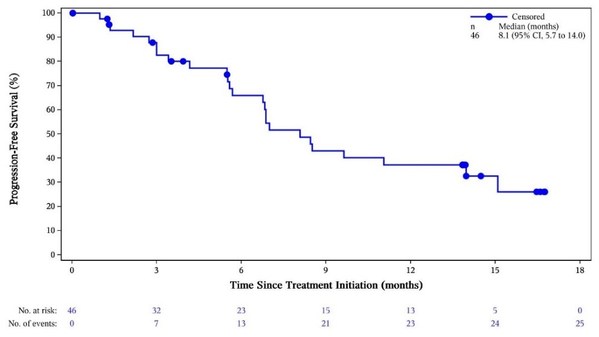
QL1604是一種與PD-1結合的高選擇性人源化單克隆抗體。本次報告的是一項QL1604聯合化療治療R/M宮頸癌患者的II期、單臂、開放研究(NCT04864782)。入組的患者接受QL1604 200mg聯合化療(紫杉醇和順鉑/卡鉑)治療,每3周一次(Q3W),最多6個周期,隨后接受QL1604 200mg Q3W維持治療,直至疾病進展或其他停藥事件。
數據截止時,中國12個研究中心共納入46例R/M宮頸癌初治患者。其中,20例(43.5%)患者既往接受過手術治療,40例(87%)患者既往接受過放療。39例(84.8%)為復發性患者,7例(15.2%)為IV期患者。
中位隨訪時間為12.91個月。8例(17.4%)患者達到完全緩解,19例(41.3%)患者達到部分緩解,客觀緩解率為58.7%(27/46)。疾病控制率為84.8%(39/46)。中位緩解持續時間為9.6個月(95% CI: 5.5, NE)。中位無進展生存期為8.1個月(95% CI: 5.7, 14.0)。總生存期尚未達到。
QL1604聯合化療顯示出良好的安全性特征,其安全譜與化療或抗PD-1治療報告的結果一致。最常見的治療相關不良事件為白細胞計數下降。
齊魯制藥臨床研究中心負責人康曉燕女士表示:"我們很高興公布QL1604聯合化療一線治療晚期宮頸癌患者的最新研究結果,QL1604聯合化療一線治療R/M宮頸癌女性顯示出積極的抗腫瘤活性和可控的安全性。這一方向的進一步研究正在進行中。"
QL1706是一種新型抗PD-1 IgG4和抗CTLA-4 IgG1組合抗體,可同時阻斷PD-1和CTLA-4兩個靶點。I期研究中,QL1706在包括非小細胞肺癌患者在內的晚期實體瘤患者中顯示出良好的抗腫瘤療效。本次報告的是一項QL1706聯合化療+/-貝伐治療晚期非小細胞肺癌患者的II期、開放、單中心臨床研究(NCT05329025)。研究對象為表皮生長因子受體(EGFR)野生型和突變型的晚期非小細胞肺癌患者。
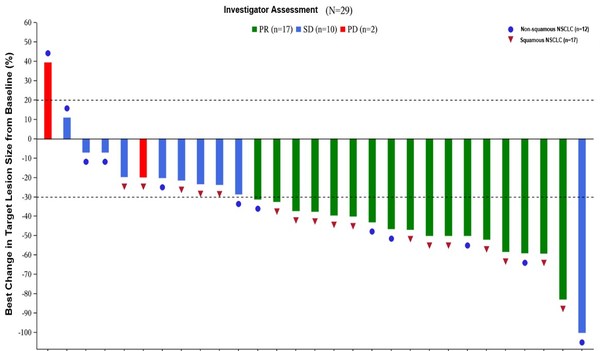
至數據截止時,共有29例EGFR野生型的晚期非小細胞肺癌患者入組并接受QL1706 5mg/kg聯合化療(紫杉醇加卡鉑或培美曲塞加卡鉑)治療,每3周給藥一次(Q3W),持續2個周期后接受QL1706 5mg/kg Q3W維持治療,直至疾病進展或其他停藥事件。中位隨訪時間為9.17個月。客觀緩解率(ORR)為58.6%(其中鱗狀NSCLC:70.6%;非鱗狀NSCLC:41.7%)。疾病控制率(DCR)為93.1%(27/29)。中位無進展生存期(mPFS)為6.97個月。
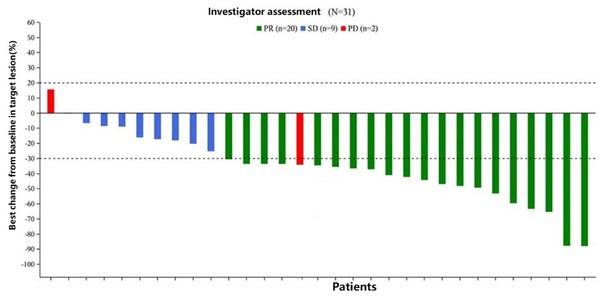
共有31例EGFR突變型的晚期非小細胞肺癌患者入組,全部患者為表皮生長因子(EGFR)酪氨酸激酶抑制劑+/-貝伐珠單抗/安羅替尼治療不耐受或接受治療后出現疾病進展。患者接受QL1706 5mg/kg聯合化療(培美曲塞加卡鉑)和貝伐珠單抗治療,每3周給藥一次(Q3W)進行4個周期,之后接受QL1706 5mg/kg聯合培美曲塞和貝伐珠單抗維持治療(Q3W),直到疾病進展或其他停藥事件。中位隨訪時間為5.75個月。ORR為64.5%(20/31),DCR為93.5%(29/31)。PFS尚未達到,6個月的PFS率為61.3%。
總體上,QL1706聯合化療顯示出良好、可控的安全性特征,其安全譜與化療或抗PD-1聯合抗CTLA-4治療的報告一致。
齊魯制藥臨床研究中心負責人康曉燕女士表示:"我們很高興公布QL1706聯合化療+/-貝伐治療晚期非小細胞肺癌的最新研究結果。基于這項研究數據,我們正在計劃和布局更多QL1706治療NSCLC的III期臨床研究,未來希望為晚期非小細胞肺癌患者帶來更多的治療選擇"。
在全世界范圍內,宮頸癌的發病率及死亡率在女性中位居前列。超過一半的患者在確診時已經發生疾病進展而失去根治性手術的機會,需要接受系統性抗腫瘤治療。QL1706是齊魯制藥MabPair技術平臺研發的同時靶向程序性死亡受體1(PD-1)和細胞毒性T淋巴細胞相關蛋白4(CTLA-4)的雙免疫檢查點的新型治療用組合抗體。前期臨床研究結果顯示,QL1706單藥治療復發/轉移性宮頸癌初步顯示出良好的療效和安全性。
此次報告的研究為一項開放、非隨機、多中心II期研究。研究對象為既往未接受過系統性治療的復發或轉移性宮頸癌患者。共有60例患者參加研究并接受了治療,分為2個隊列:QL1706聯合化療與QL1706聯合化療+貝伐珠單抗。每3周給藥1次。完成6個周期的化療后,可以停止化療繼續接受QL1706加或不加貝伐珠單抗治療,直至疾病進展或毒性不能耐受等。
研究結果表明,QL1706聯合化療加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌安全性可控且符合預期。最常見的不良反應為白細胞計數降低(48.3%),其次為貧血(33.3%)。嚴重不良反應的發生率為20%。免疫相關不良反應的發生率為23.3%。
QL1706聯合化療加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌顯示出優秀的抗腫瘤活性。共有57例患者納入療效分析,ORR為77.2%,疾病控制率為98.2%。至數據截止時,中位無進展生存期(PFS)和總生存期(OS)數據尚未成熟。目前,基于這項研究結果,已開展一項旨在評價QL1706聯合紫杉醇-順鉑/卡鉑加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌的有效性和安全性的Ⅲ期臨床研究。
更多精彩:
2022年ASCO年會上QL1706相關研究報告刊登于美國臨床腫瘤學會《Journal of Clinical Oncology》期刊
https://ascopubs.org/doi/abs/10.1200/JCO.2022.40.16_suppl.5535