濟南2024年9月30日 /美通社/ -- 9月27-28日,2024年美國臨床腫瘤學會優質護理專題研討會(ASCO QCS)年會召開,齊魯制藥注射用羅普司亭N01(瑞立升®)用于腫瘤化療相關性血小板減少癥(CIT)的2/3期臨床試驗最新數據在會上發布。
羅普司亭是第二代血小板生成素(TPO)受體激動劑,用于治療原發慢性免疫性血小板減少癥(ITP)。今年4月,齊魯制藥瑞立升®獲得國家藥監局上市批準,適用于對其他治療(例如皮質類固醇、免疫球蛋白)反應不佳的成人(≥18周歲)慢性免疫性血小板減少癥患者。
本研究招募發生CIT的實體瘤或淋巴瘤患者,牽頭研究者為同濟大學附屬東方醫院的李進教授。研究的A部分為開放標簽臨床試驗,根據不同基線血小板計數水平(100~200×109/L或<100×109/L)和羅普司亭N01起始劑量(1μg/kg或2μg/kg)將受試者分為3組,探索羅普司亭N01在CIT患者中的最佳給藥方案。其主要終點為化療周期最后一天的有效反應率。研究的B部分為雙盲、隨機、安慰劑對照臨床試驗,評價羅普司亭N01用于預防CIT發生的療效和安全性。其主要終點為雙盲期產生有效性反應的患者比例。
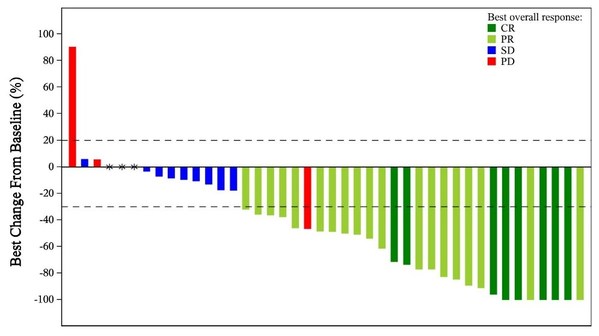
A部分共納入50例受試者,第1組(基線血小板計數100~200×109/L;起始劑量1μg/kg)、第2組(基線血小板計數100~200×109/L;起始劑量2μg/kg)、第3組(基線血小板計數<100×109/L;起始劑量2μg/kg)分別為15、15、20例。三組的有效反應率分別為66.7%、53.3%和90.0%。僅1例患者(第3組)發生化療延遲≥4天或化療劑量降低≥20%。三組的治療相關不良事件(TRAE)的發生率分別為26.7%、20.0%、20.0%。未發生治療相關的嚴重不良事件。無治療相關出血或死亡事件發生。
B部分共計63例受試者被隨機分配到羅普司亭N01組(41例)或安慰劑組(22例)。兩組產生有效性反應的患者比例分別為68.3%和40.9%,校正后率差為27.6%。羅普司亭N01組和安慰劑組中分別有75.6%和40.9%的患者未發生因血小板減少導致的化療延遲或劑量降低或停藥。無需挽救治療的患者比例在羅普司亭N01組和安慰劑組中分別為78.0%和63.6%。任何等級的TRAE在羅普司亭N01組和安慰劑組中的發生率分別為41.5%和54.4%,其中羅普司亭N01組中有1例(2.4%)≥3級TRAE。無治療相關出血或死亡事件發生。
此外,匯總A、B研究部分患者的療效數據結果顯示,羅普司亭N01組和安慰劑組中的產生有效性反應的患者比例分別為73.3%(55/75)和40.9%(9/22),校正后率差為37.7%。
綜上,羅普司亭N01能有效升高CIT患者的血小板計數水平,降低化療延遲或化療劑量減少的發生率,整體的給藥安全性和耐受性良好。

濟南2024年9月10日 /美通社/ -- 9月07-10日,肺癌領域的年度盛會世界肺癌大會(WCLC)在美國圣迭戈舉辦。當地時間8日,齊魯制藥伊魯阿克片(啟欣可®)在克唑替尼耐藥的間變性淋巴瘤激酶(ALK)陽性非小細胞肺癌患者中II期臨床試驗(INTELLECT研究)的最新數據以壁報形式展示。
伊魯阿克是由齊魯制藥研發的新一代ALK/ROS1激酶抑制劑,2023年6月獲批用于治療既往接受過克唑替尼治療后疾病進展或對克唑替尼不耐受的ALK陽性的局部晚期或轉移性非小細胞肺癌患者,并于今年1月獲批用于一線治療ALK陽性的非小細胞肺癌患者。
本研究的牽頭研究者為中國醫學科學院腫瘤醫院的石遠凱教授。INTELLECT研究的目的是評價伊魯阿克在克唑替尼耐藥的ALK陽性晚期非小細胞肺癌患者中的療效和安全性。該INTELLECT研究結果曾于2023年在著名期刊《BMC Medicine》上發表,本次WCLC會議報告的是延長兩年隨訪時間的更新數據。
本研究共入組146例受試者,截至2023年12月29日,中位隨訪時間為42.41個月,中位總生存期(OS)達到41.79個月。研究者評價的客觀緩解率(ORR)和疾病控制率(DCR)分別為63.7%和94.5%,中位緩解持續時間(DoR)和無進展生存期(PFS)分別為14.06個月和14.55個月。
根據RECIST v1.1評價標準,基線有中樞神經系統轉移亞組(90例)的ORR和DCR分別為55.6%和93.3%,中位DoR和PFS均為17.25個月,中位OS為43.01個月。
根據RANO-BM評價標準,在90例基線有中樞神經系統轉移的患者中,有17例(18.9%)達到顱內完全緩解(CR)。在42例基線有顱內可測量病灶的受試者中,顱內客觀緩解率(iORR)和顱內疾病控制率(iDCR)分別為64.3%和95.2%。
安全性方面,治療相關不良事件(TRAE)的發生率為93.8%(137例),3級或4級TRAE的發生率為30.8%(45例)。最常見的TRAE為天門冬氨酸氨基轉移酶升高(45.2%)、高膽固醇血癥(37.7%)和丙氨酸氨基轉移酶升高(37.0%),未發現新的安全性信號。
INTELLECT研究的長期隨訪結果顯示,伊魯阿克為克唑替尼耐藥的ALK陽性晚期非小細胞肺癌患者帶來了OS獲益,且無新的安全性信號。
參考文獻:
- Shi Y, et al. Efficacy and safety of iruplinalkib (WX-0593) in ALK-positive crizotinib-resistant advanced non-small cell lung cancer patients: a single-arm, multicenter phase II study (INTELLECT). BMC Med 2023;21(1):72.
- Shi Y, et al. Iruplinalkib (WX-0593) Versus Crizotinib in ALK TKI-Naive Locally Advanced or Metastatic ALK-Positive NSCLC: Interim Analysis of a Randomized, Open-Label, Phase 3 Study (INSPIRE). J Thorac Oncol. 2024;19(6):912-927.

濟南2024年6月7日 /美通社/ -- 2024年5月31日至6月4日,2024年美國臨床腫瘤學會(ASCO)年會在美國芝加哥以線上結合線下的形式召開。齊魯制藥有3項臨床研究結果入選ASCO大會壁報展示,研究涉及的新藥包括靶向PD-L1/4-1BB的雙特異性抗體QLF31907,靶向PD-1/CTLA-4的組合抗體艾帕洛利托沃瑞利單抗(艾托組合抗體),以及靶向PD-1的艾帕洛利單抗。研究領域分別涉及晚期實體瘤和淋巴瘤、鼻咽癌、以及DNA錯配修復缺陷(dMMR)或高度微衛星不穩定(MSI-H)的實體瘤。
QLF31907由齊魯制藥自主研發。一方面通過阻斷PD-L1恢復TCR信號,另一方面通過與4-1BB結合,為T細胞活化提供共刺激信號,從而促進T細胞的增殖、活化,產生顯著的抗腫瘤免疫作用。本次入選的研究為PD-1/4-1BB雙抗(QLF31907)在晚期實體瘤和淋巴瘤患者的I期劑量遞增/擴展研究(摘要編號:2534),主要研究者為四川省腫瘤醫院林桐榆教授。
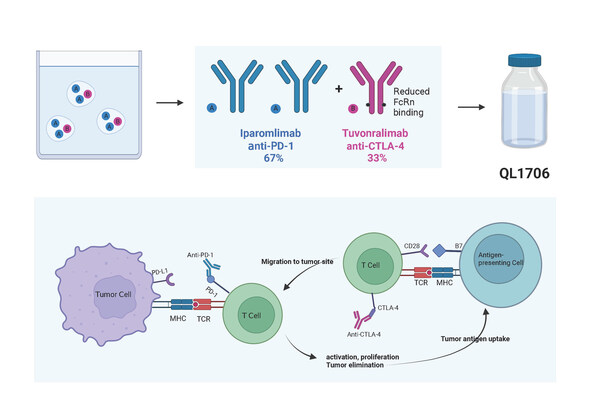
艾帕洛利托沃瑞利單抗(艾托組合抗體)由PD-1抗體IgG4和CTLA-4抗體IgG1按照固定的比例組成。藥物中的CTLA-4抗體成分經過改造,半衰期縮短。因此,艾托組合抗體可以在體內維持正常PD-1抗體暴露量的同時,降低CTLA-4抗體的暴露量,有望成為毒性更低、耐受性更佳的雙免疫療法。在1期研究中,艾托組合抗體單藥在晚期鼻咽癌患者中顯示出積極的抗腫瘤活性。本次入選的研究為艾帕洛利托沃瑞利單抗聯合吉西他濱和順鉑一線治療復發性或轉移性鼻咽癌患者的一項多中心、單臂、II期試驗(DUBHE-N-302)(摘要編號:6026),主要研究者為中山大學腫瘤防治中心黃巖教授。
研究共納入29例患者,其中7例(24%)患者基線ECOG PS評分為1。至數據截止,中位隨訪時間為15.5個月。18例(62%)患者發生3-4級治療相關不良事件(TRAE),最常見的3-4級TRAE為中性粒細胞計數降低(41%)。共28例患者至少有1次基線后腫評,客觀緩解率(ORR)為82.1%(95% CI:63.1%-93.9%)。中位無進展生存期(mPFS)為12.5個月(95% CI:5.7-NE)。在13例PD-L1高表達(CPS≥50)的患者中,mPFS為16.2個月(95% CI:9.9-NE)。中位總生存尚未達到。研究表明,艾托組合抗體聯合化療一線治療復發/轉移鼻咽癌安全性可耐受且顯示出良好的抗腫瘤活性。
艾帕洛利單抗是一種與PD-1結合的高選擇性人源化單克隆抗體。本次入選的研究為艾帕洛利單抗單藥治療不可切除或轉移性dMMR/MSI-H實體瘤的單臂、II期、關鍵臨床研究更新結果(摘要編號:3578),主要研究者為復旦大學附屬腫瘤醫院郭偉劍教授和四川大學華西醫院畢鋒教授。末例患者入組1年后的更新結果表明,艾帕洛利單抗單藥治療不可切除或轉移性dMMR/MSI-H實體瘤具有良好的療效。在標準治療失敗的實體瘤患者中,獨立影像評估委員會(IRRC)評估的客觀緩解率(ORR)達到50.0%,超過預設的主要終點,其中結直腸癌患者ORR達到57.9%。至數據截止時間,中位DOR、mPFS和中位總生存均未達到。結果表明,艾帕洛利單抗標準治療失敗的dMMR/MSI-H晚期實體瘤患者中顯示出良好且持久的療效,同時長時間治療仍具有良好的安全性和耐受性,無新的特有的安全性信號。

濟南2024年3月1日 /美通社/ -- 近日,歐洲婦科腫瘤學會(European Society of Gynaecological Oncology,ESGO)2024會議在線公布了所有入選摘要。其中,齊魯制藥艾帕洛利托沃瑞利單抗注射液(iparomlimab and tuvonralimab,QL1706)宮頸癌2期臨床試驗(DUBHE-C-206)研究結果的摘要(#251)入選口頭報告(報告時間:當地時間3月8日)。
摘要鏈接:https://emma.events/site/programme/?a=esgo2024&trackid=548#!
本研究于國內的38家中心開展,牽頭研究者為中山大學腫瘤防治中心劉繼紅教授和浙江省腫瘤醫院樓寒梅教授。該研究為多中心、單臂II期臨床試驗,納入一線含鉑化療±貝伐珠單抗失敗且未接受過免疫治療的復發/轉移宮頸癌患者,給予艾帕洛利托沃瑞利單抗5.0 mg/kg Q3W注射治療。本研究共計納入148例受試者。至數據截止,中位隨訪時間為11.0個月。主要終點獨立評價委員會(IRC)評價的客觀緩解率(ORR)為33.8%,達預設主要終點。次要終點中,DCR為64.9%,PFS達到5.4個月,OS未達到。共計104例(70.3%)受試者發生了治療相關不良事件(TRAE)。36例(24.3%)受試者發生了≥3級TRAE,其中最常見的是貧血(4.1%)。3例受試者(2.0%)因為TRAE停止治療。無導致死亡的TRAE。
本研究結果表明,艾帕洛利托沃瑞利單抗作為復發/轉移宮頸癌的后線治療有效且安全。去年8月,艾帕洛利單抗托沃瑞利單抗注射液的上市申請獲CDE受理,為全球首款申報上市的PD-1/CTLA-4靶向組合抗體,有望將為宮頸癌患者帶來新希望。

濟南2023年12月8日 /美通社/ -- 12月6-8日,歐洲腫瘤內科學會免疫腫瘤學(ESMO Immuno-Oncology)大會在瑞士日內瓦召開,齊魯制藥以壁報形式報告了QLS31905在晚期實體瘤患者中的I期臨床試驗最新研究結果(壁報編號:132P)。主要研究者為北京大學腫瘤醫院的沈琳教授。
QLS31905是由齊魯制藥自主研發的靶向Claudin18.2的雙特異性T細胞銜接器(Bispeific T cell Engager)。本研究的主要目的是探索QLS31905在晚期實體瘤患者中安全性、耐受性,以及初步的抗腫瘤活性。
研究背景和設計:
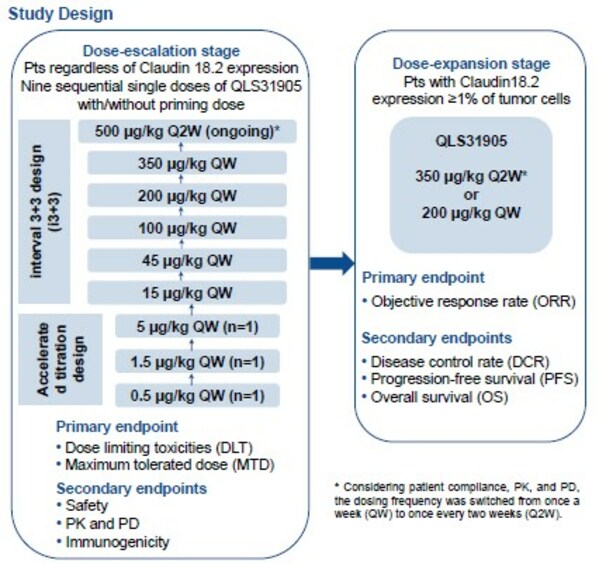
Claudin18.2是具有高度特異性的細胞表面分子,其異常激活表達常見于原發性胃癌以及胰腺癌、食管癌等實體瘤[1],[2]。QLS31905與腫瘤細胞表面的Claudin18.2和T細胞表面的CD3結合,通過募集和激活腫瘤細胞附近的T細胞,對腫瘤細胞進行持續地殺傷裂解。本研究納入標準治療失敗或不適用或無標準治療的晚期實體瘤患者。研究分為劑量遞增和劑量拓展兩個階段。劑量遞增階段采用加速滴定和i3+3的研究設計,QLS31905單次給藥劑量按照0.5μg/kg QW、1.5μg/kg QW、5μg/kg QW、15μg/kg QW、45μg/kg QW、100μg/kg QW、200μg/kg QW、350μg/kg QW、500 μg/kg Q2W遞增,主要終點是劑量限制毒性(DLT)和最大耐受劑量(MTD),次要終點是安全性、藥代動力學和藥效動力學、免疫原性。劑量拓展階段的主要終點是客觀緩解率(ORR),次要終點是疾病控制率(DCR)、無進展生存期(PFS)、總體生存期(OS)。
研究結果:
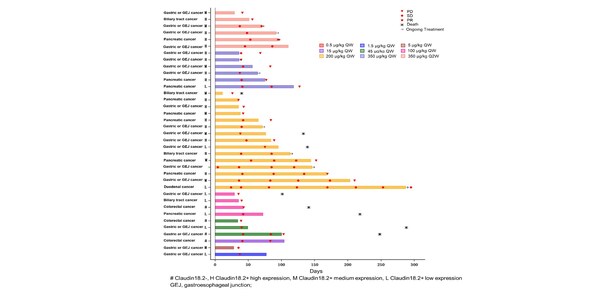
截止2023年7月17日,共計納入52例受試者,包括31例胃癌和12例胰腺癌患者。劑量遞增階段,共計22例受試者從0.5μg/kg QW爬坡到350 μg/kg QW隊列,目前500 μg/kg Q2W劑量水平正在進行中。劑量拓展階段采用了200μg/kg QW和350μg/kg Q2W兩個劑量水平,共計納入30例受試者。
安全性方面,DLT未發生,尚未確定MTD。共計21例(40.4%)受試者發生了≥3級的治療相關不良事件(TRAE)。10例(19.2%)受試者發生了治療相關的嚴重不良事件。2例受試者(3.8%)發生了導致停止治療的TRAE。最常見的TRAE是發熱(30例,57.7%)、惡心(26例,50.0%)、白細胞計數降低(18例,34.6%)。350 μg/kg QW隊列中的2例患者發生3級及以上的細胞因子釋放綜合征。
療效方面,在療效可評價的27例受試者中,ORR為11.1%,DCR為63.0%。達到部分緩解(PR)的3例患者中,2例為胰腺癌,1例為膽囊癌,Claudin18.2表達水平均為中/高表達。在14例疾病穩定(SD)的患者中,8例靶病灶縮小,其中7例為Claudin18.2中/高表達。
綜上,QLS31905在晚期實體瘤患者中展現出良好的安全性、耐受性、以及初步的抗腫瘤活性。目前QLS31905的II期臨床試驗正在進行中。
【參考文獻】
1. Sahin U, et al. Clin Cancer Res. 2008;14(23):7624-34. |
2. Singh P, et al. J Hematol Oncol. 2017;10(1):105. |

濟南2023年12月6日 /美通社/ -- 12月1至3日,在2023年歐洲腫瘤內科學會亞洲年會(ESMO Asia)上,齊魯制藥以壁報形式報告了1類新藥艾帕洛利單抗(QL1604)單藥治療不可切除或轉移性dMMR/MSI-H實體瘤的單臂、II期關鍵臨床研究最新結果。主要研究者為復旦大學附屬腫瘤醫院郭偉劍教授和四川大學華西醫院畢鋒教授。
艾帕洛利單抗是一種與PD-1結合的高選擇性人源化單克隆抗體。研究結果顯示,艾帕洛利單抗單藥治療不可切除或轉移性dMMR/MSI-H實體瘤具有良好的療效,獨立影像評估委員會(IRRC)評估的全人群客觀緩解率(ORR)為45.8%(95%CI, 36.7-55.2),超過預設主要研究終點。
一、研究背景
DNA錯配修復缺陷(dMMR)或高度微衛星不穩定(MSI-H)是實體瘤的獨特表型[1]。DNA復制過程中,微衛星序列最易發生錯配,需要進行錯配修復,dMMR可導致移碼突變,引起微衛星不穩定(MSI)。dMMR/MSI-H實體瘤對免疫檢查點抑制劑治療反應良好,程序性死亡受體-1(PD-1)或程序性死亡配體-1(PD-L1)抑制劑治療dMMR/MSI-H實體瘤具有較高的客觀緩解率(ORR),并且緩解持續時間長[2-3]。
艾帕洛利單抗治療晚期實體瘤的I期研究表現出良好的安全性和抗腫瘤活性,在接受艾帕洛利單抗0.3-3 mg/kg Q3W的所有患者中,ORR達到20%[4]。本關鍵研究旨在評估艾帕洛利單抗單藥治療不可切除或轉移性dMMR/MSI-H實體瘤的療效和安全性。
二、研究設計和方法
本研究為單臂、II期關鍵臨床研究,納入不可切除或轉移性經組織病理學或細胞學確認的dMMR/MSI-H實體瘤患者,接受艾帕洛利單抗單藥治療,給藥方案為200mg固定劑量(如果受試者體重<40kg,給藥劑量為3mg/kg),靜脈滴注,每3周給藥1次。患者接受艾帕洛利單抗治療直至疾病進展、出現不可耐受的毒性、開始新的抗腫瘤治療、死亡、撤回知情同意等原因,最長治療時間不超過2年。治療結束后,對患者進行生存隨訪。研究的主要終點為IRRC根據實體腫瘤療效評價標準(1.1版)評估的ORR。研究設計如下圖所示。
三、研究結果
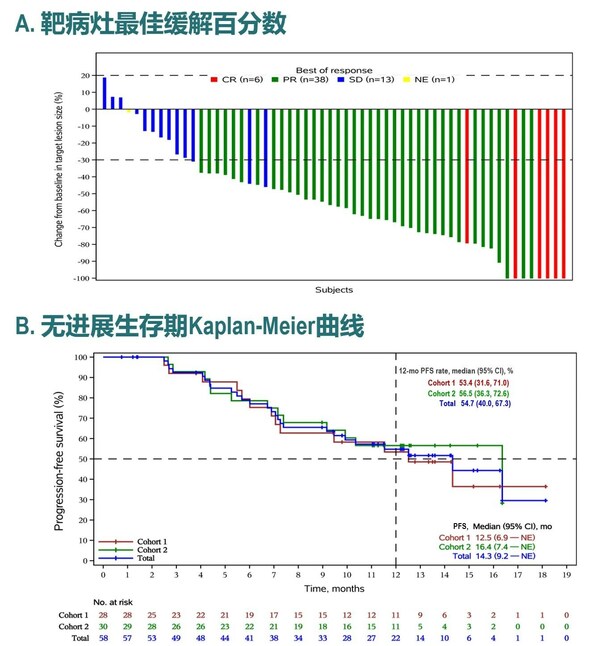
從2020年6月至2023年1月,研究共納入120例dMMR/MSI-H實體瘤患者,其中結直腸癌患者80例(66.7%),胃癌患者18例(15.0%),其它實體瘤患者22例(18.3%);97.5%的患者在入組時疾病分期為IV期,中位治療線數為2.0(范圍,0–6)。
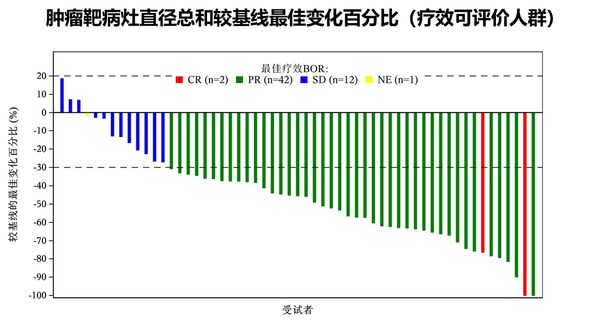
在療效方面,截至2023年7月20日,中位隨訪時間為13.6個月,有11例患者達到完全緩解(CR),44例患者達到部分緩解(PR),ORR為45.8%(95% CI: 36.7%–55.2%),疾病控制率(DCR)為77.5%(95% CI: 69.0%–84.6%)。在結直腸癌患者中,ORR和DCR分別為42.5%(95% CI: 31.5%–54.1%)和77.5%(95% CI: 31.5%–54.1%)。中位緩解持續時間(DoR)尚未達到,6個月和12個月DoR率分別為100%和97.4%;中位無進展生存期(PFS)和中位總生存期(OS)未達到。緩解患者的靶病灶最佳變化情況如下圖所示。
四、小結
艾帕洛利單抗單藥治療不可切除或轉移性dMMR/MSI-H實體瘤具有良好的療效和安全性。齊魯制藥艾帕洛利單抗上市申請已于今年9月獲得CDE受理。
參考文獻:
1. Bhamidipati D, Subbiah V. Tumor-agnostic drug development in dMMR/MSI-H solid tumors. Trends Cancer. 2023;9(10):828-839.
2. Le DT, et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med. 2015;372(26):2509-20.
3. Li J, et al. Subcutaneous envafolimab monotherapy in patients with advanced defective mismatch repair/microsatellite instability high solid tumors. J Hematol Oncol. 2021;14(1):95.
4. Huang Z, et al. A first-in-human, open-label, dose-escalation and dose-expansion phase I study to evaluate the safety, tolerability, pharmacokinetics/pharmacodynamics, and antitumor activity of QL1604, a humanized anti-PD-1 mAb, in patients with advanced or metastatic solid tumors. Front Immunol. 2023;14:1258573.

濟南2023年10月26日 /美通社/ -- 10月22日,在2023年歐洲腫瘤內科學會(ESMO)年會上,齊魯制藥公布了艾帕洛利托沃瑞利單抗(QL1706)聯合化療加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌(r/mCC)的多中心、單臂II期臨床研究最新研究結果,報告人為遼寧省腫瘤醫院王丹波教授。
艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗一線治療復發/轉移性宮頸癌顯示出良好的客觀緩解率和生存獲益,安全性可控且未觀察到新的安全信號,有望成為復發/轉移性宮頸癌一線治療的新選擇。
一、研究背景
目前r/mCC的標準一線治療優選方案為順鉑或卡鉑聯合紫杉醇加貝伐珠單抗,同時要考慮療效和安全性;對PD-L1表達陽性的r/mCC患者,推薦采用PD-1抑制劑帕博利珠單抗聯合化療加或不加貝伐珠單抗作為一線標準治療。[1-2] 免疫聯合化療已成為復發/轉移性宮頸癌的標準治療。根據KEYNOTE-826研究最新結果,聯合帕博利珠單抗后,免疫聯合化療加或不加貝伐珠單抗一線治療PD-L1陽性(CPS≥1)r/mCC的中位無進展生存期(PFS)從8.2個月延長到10.4個月,中位總生存期(OS)從16.5個月延長到28.6個月。[3-4] 盡管PD-1抑制劑聯合化療與化療相比顯著改善了患者生存,患者的生存獲益仍然較有限,存在未滿足的臨床需求。
二、研究設計
本次研究納入未接受過系統治療的復發或轉移性宮頸癌患者,分別接受艾帕洛利托沃瑞利單抗聯合化療(隊列1)或再聯合貝伐珠單抗(隊列2)治療,直至疾病進展、出現不可耐受的毒性,或患者撤回知情同意。研究的主要終點為安全性,次要終點包括研究者根據實體瘤反應評價標準(RECIST)v1.1評估的ORR、緩解持續時間(DOR)、疾病控制率(DCR)和PFS,以及OS。研究設計如圖1所示。
三、研究結果
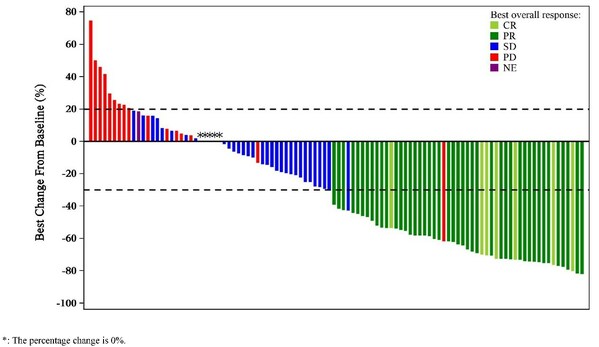
研究共入組60例患者,隊列1和隊列2各30例,分別接受艾帕洛利托沃瑞利單抗聯合順鉑/卡鉑加紫杉醇或再加貝伐珠單抗治療。所有患者的平均年齡為52.0歲,58.3%的患者ECOG行為學評分為1;78.3%的患者的病理類型為鱗癌,86.7%的患者為復發性宮頸癌。
截至2023年4月24日,中位隨訪時間為14.0個月,共有58例患者至少接受1次基線后療效評估,客觀緩解率ORR為81.0% (95% CI, 68.6–90.1),其中有8例患者達到完全緩解(CR),39例患者達到部分緩解(PR);DCR為98.3% (95% CI,90.8–100.0)。中位PFS達到14.3個月(95% CI,9.2個月–不可評估),中位OS未達到。聯合貝伐珠單抗隊列2的中位PFS達到16.4個月。(圖2)
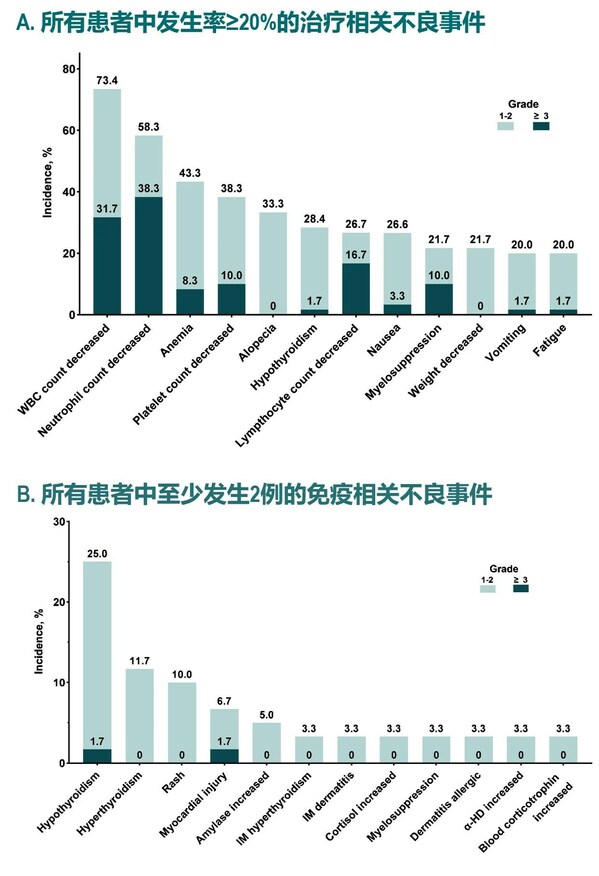
在安全性方面,所有患者發生治療相關不良事件(TRAEs),其中3級及以上不良事件的發生率為71.7%;最常見的TRAEs為白細胞計數減少 (71.3%)、中性粒細胞計數減少(68.3%)和貧血(43.3%)。治療相關嚴重不良事件的發生率為30%;免疫相關不良事件(irAEs)的發生率為13.3%;導致治療停止的TRAEs的發生率為26.7%;治療相關死亡的發生率為1.7%(可能為貝伐珠單抗相關)。(圖3)
三、小結
本研究結果顯示,艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗一線治療r/mCC具有良好的療效和安全性,且不區分PD-L1表達水平,患者均顯示獲益。
基于此項研究結果,艾帕洛利托沃瑞利單抗聯合化療加或不加貝伐珠單抗治療持續性、復發性或轉移性宮頸癌的III期臨床研究正在進行中。艾帕洛利托沃瑞利單抗用于治療經過至少一線含鉑標準治療失敗的復發性或轉移性的宮頸癌患者的新藥上市申請已于今年8月獲得CDE受理。
參考文獻:
1.中國臨床腫瘤學會指南工作委員會. 宮頸癌診療指南[M]. 2023. 北京:人民衛生出版社, 2023:70.
2.Tewari KS, et al. Improved survival with bevacizumab in advanced cervical cancer. N Engl J Med. 2014 Feb 20;370(8):734-43. doi: 10.1056/NEJMoa1309748. Erratum in: N Engl J Med. 2017 17;377(7):702.
3.Colombo N, et al. Pembrolizumab for Persistent, Recurrent, or Metastatic Cervical Cancer. N Engl J Med. 2021 11;385(20):1856-1867.
4.J Clin Oncol 41, 2023 (suppl 16; abstr 5500) .
世界范圍內,宮頸癌的發病率和死亡率在女性中位居第四。R/M宮頸癌患者預后較差,5年生存率低于20%。盡管免疫檢查點抑制劑(ICIs)二線治療R/M宮頸癌患者顯示出臨床效果,其用于一線治療的研究結果仍然有限。
QL1604是一種與PD-1結合的高選擇性人源化單克隆抗體。本次報告的是一項QL1604聯合化療治療R/M宮頸癌患者的II期、單臂、開放研究(NCT04864782)。入組的患者接受QL1604 200mg聯合化療(紫杉醇和順鉑/卡鉑)治療,每3周一次(Q3W),最多6個周期,隨后接受QL1604 200mg Q3W維持治療,直至疾病進展或其他停藥事件。
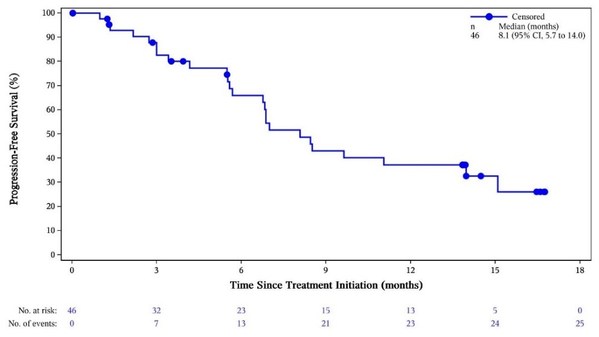
數據截止時,中國12個研究中心共納入46例R/M宮頸癌初治患者。其中,20例(43.5%)患者既往接受過手術治療,40例(87%)患者既往接受過放療。39例(84.8%)為復發性患者,7例(15.2%)為IV期患者。
中位隨訪時間為12.91個月。8例(17.4%)患者達到完全緩解,19例(41.3%)患者達到部分緩解,客觀緩解率為58.7%(27/46)。疾病控制率為84.8%(39/46)。中位緩解持續時間為9.6個月(95% CI: 5.5, NE)。中位無進展生存期為8.1個月(95% CI: 5.7, 14.0)。總生存期尚未達到。
QL1604聯合化療顯示出良好的安全性特征,其安全譜與化療或抗PD-1治療報告的結果一致。最常見的治療相關不良事件為白細胞計數下降。
齊魯制藥臨床研究中心負責人康曉燕女士表示:"我們很高興公布QL1604聯合化療一線治療晚期宮頸癌患者的最新研究結果,QL1604聯合化療一線治療R/M宮頸癌女性顯示出積極的抗腫瘤活性和可控的安全性。這一方向的進一步研究正在進行中。"
QL1706是一種新型抗PD-1 IgG4和抗CTLA-4 IgG1組合抗體,可同時阻斷PD-1和CTLA-4兩個靶點。I期研究中,QL1706在包括非小細胞肺癌患者在內的晚期實體瘤患者中顯示出良好的抗腫瘤療效。本次報告的是一項QL1706聯合化療+/-貝伐治療晚期非小細胞肺癌患者的II期、開放、單中心臨床研究(NCT05329025)。研究對象為表皮生長因子受體(EGFR)野生型和突變型的晚期非小細胞肺癌患者。
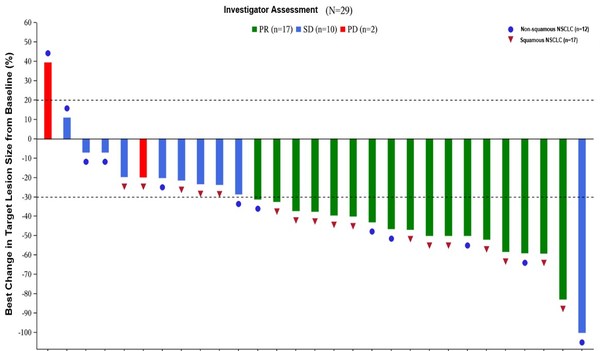
至數據截止時,共有29例EGFR野生型的晚期非小細胞肺癌患者入組并接受QL1706 5mg/kg聯合化療(紫杉醇加卡鉑或培美曲塞加卡鉑)治療,每3周給藥一次(Q3W),持續2個周期后接受QL1706 5mg/kg Q3W維持治療,直至疾病進展或其他停藥事件。中位隨訪時間為9.17個月。客觀緩解率(ORR)為58.6%(其中鱗狀NSCLC:70.6%;非鱗狀NSCLC:41.7%)。疾病控制率(DCR)為93.1%(27/29)。中位無進展生存期(mPFS)為6.97個月。
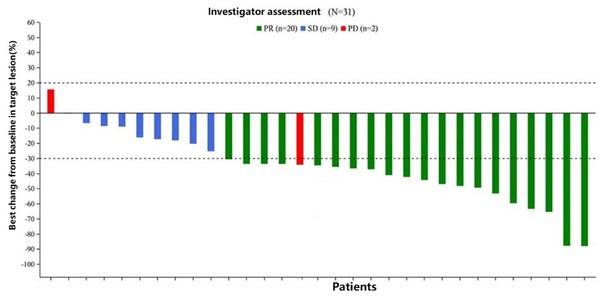
共有31例EGFR突變型的晚期非小細胞肺癌患者入組,全部患者為表皮生長因子(EGFR)酪氨酸激酶抑制劑+/-貝伐珠單抗/安羅替尼治療不耐受或接受治療后出現疾病進展。患者接受QL1706 5mg/kg聯合化療(培美曲塞加卡鉑)和貝伐珠單抗治療,每3周給藥一次(Q3W)進行4個周期,之后接受QL1706 5mg/kg聯合培美曲塞和貝伐珠單抗維持治療(Q3W),直到疾病進展或其他停藥事件。中位隨訪時間為5.75個月。ORR為64.5%(20/31),DCR為93.5%(29/31)。PFS尚未達到,6個月的PFS率為61.3%。
總體上,QL1706聯合化療顯示出良好、可控的安全性特征,其安全譜與化療或抗PD-1聯合抗CTLA-4治療的報告一致。
齊魯制藥臨床研究中心負責人康曉燕女士表示:"我們很高興公布QL1706聯合化療+/-貝伐治療晚期非小細胞肺癌的最新研究結果。基于這項研究數據,我們正在計劃和布局更多QL1706治療NSCLC的III期臨床研究,未來希望為晚期非小細胞肺癌患者帶來更多的治療選擇"。
在全世界范圍內,宮頸癌的發病率及死亡率在女性中位居前列。超過一半的患者在確診時已經發生疾病進展而失去根治性手術的機會,需要接受系統性抗腫瘤治療。QL1706是齊魯制藥MabPair技術平臺研發的同時靶向程序性死亡受體1(PD-1)和細胞毒性T淋巴細胞相關蛋白4(CTLA-4)的雙免疫檢查點的新型治療用組合抗體。前期臨床研究結果顯示,QL1706單藥治療復發/轉移性宮頸癌初步顯示出良好的療效和安全性。
此次報告的研究為一項開放、非隨機、多中心II期研究。研究對象為既往未接受過系統性治療的復發或轉移性宮頸癌患者。共有60例患者參加研究并接受了治療,分為2個隊列:QL1706聯合化療與QL1706聯合化療+貝伐珠單抗。每3周給藥1次。完成6個周期的化療后,可以停止化療繼續接受QL1706加或不加貝伐珠單抗治療,直至疾病進展或毒性不能耐受等。
研究結果表明,QL1706聯合化療加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌安全性可控且符合預期。最常見的不良反應為白細胞計數降低(48.3%),其次為貧血(33.3%)。嚴重不良反應的發生率為20%。免疫相關不良反應的發生率為23.3%。
QL1706聯合化療加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌顯示出優秀的抗腫瘤活性。共有57例患者納入療效分析,ORR為77.2%,疾病控制率為98.2%。至數據截止時,中位無進展生存期(PFS)和總生存期(OS)數據尚未成熟。目前,基于這項研究結果,已開展一項旨在評價QL1706聯合紫杉醇-順鉑/卡鉑加或不加貝伐珠單抗一線治療復發或轉移性宮頸癌的有效性和安全性的Ⅲ期臨床研究。
更多精彩:
2022年ASCO年會上QL1706相關研究報告刊登于美國臨床腫瘤學會《Journal of Clinical Oncology》期刊
https://ascopubs.org/doi/abs/10.1200/JCO.2022.40.16_suppl.5535