北京2024年6月17日 /美通社/ -- 2024年6月16日,由中國抗癌協會(CACA)康復分會發起、百濟神州支持的“濟愈”腫瘤整合康復科普教育及患者關愛行動(以下簡稱“‘濟愈’行動”)全國啟動會暨首場乳腺癌專場活動在上海舉行。
該行動致力于打造新型腫瘤患者關愛模式,整合腫瘤防治、運動康復、心理疏導等多學科資源,攜手各疾病領域權威專家、具有影響力的患者代表、患者組織及社會愛心組織,通過舉辦趣味性的專場演講和互動體驗,傳遞科學的抗癌理念和積極向上的抗癌信念,讓各方力量“濟濟一堂”,共同為癌癥患者和家屬提供專業知識和精神支持,鼓勵和幫助他們獲得更長的生存獲益和更高質量的生活,“共赴治愈”。
百濟神州總裁、首席運營官吳曉濱博士表示:“腫瘤治療已進入慢病化管理時代,這就需要凝聚并發揮患者和家庭、行業和社會等各界力量來共同支持。百濟神州非常認同中國抗癌協會提出的‘整合康復’理念,我們希望在探索更有效、更安全的抗癌藥物之余,也能和各方‘濟濟一堂’,持續助力提升從篩查到康復隨訪的全生命周期管理,最終與癌癥患者‘共赴治愈’。”
“在中國抗癌協會理事長樊代明院士的領導下,CACA秉承‘防篩診治康、評扶控護生’十字方針,制定出首部《中國腫瘤整合診治指南》,其中特別強調腫瘤綜合治療要增強對于‘整合康復’的關注。腫瘤治療不僅是抗癌治療,還包括康復治療,如心理康復、護理、營養治療等”,中國抗癌協會康復分會主任委員師建國教授表示,“我們很高興看到像百濟神州這樣的愛心企業認同我們的理念。希望在百濟神州的支持下,通過‘濟愈’行動,能夠在醫患間樹立‘整合康復’的新觀念,患者抗癌的積極性和依從性得以提高。”
首場“濟愈”活動聚焦乳腺癌領域。乳腺癌是威脅全球女性健康的第一大惡性腫瘤1,也是中國女性群體的高發癌癥2,且晚期或轉移性乳腺癌以骨轉移的發生率最高,高達75%3,嚴重影響生活質量。此外,近年來乳腺癌發病年齡呈年輕化趨勢4,患者對于治療體驗、心理關愛、回歸社會等方面提出了更高、更個性化的需求。
復旦大學附屬腫瘤醫院大外科主任兼乳腺外科主任邵志敏教授表示:“抗癌之路漫長曲折,不僅是醫患間的院內診治這么簡單。所以我們醫生要做的,不僅是幫助病人實現‘活得長’,還要‘少吃苦’。復旦大學附屬腫瘤醫院終身教授沈鎮宙教授早在2003年就建立了全國首個以醫院為主體的乳腺癌患者康復俱樂部,增進醫患之間、患患之間的交流互助。隨著腫瘤治療理念和技術不斷進步,我們也希望通過這次‘濟愈’活動,提供專業而具有人文關懷的支持,能積極促進患者健康的恢復。”
活動現場,多位乳腺癌領域的權威專家以趣味科普的方式介紹了乳腺癌疾病的常見誤區、最新治療手段和康復管理的注意事項,強調定期篩查和定期隨訪有利于評控疾病進程。尤其是針對晚期乳腺癌患者高發的骨轉移,更要加強定期檢查和關注,從而盡早發現,及時干預。患友代表則通過分享自身患癌抗癌的心路歷程,講述自己與癌共存、活出精彩的動人細節,鼓勵更多患友如常生活,找回自信和樂觀的人生。
關于乳腺癌
在全球范圍內,乳腺癌已成為女性最常見的癌癥,2022年新發乳腺癌病例近230萬,超過66萬例死亡,是威脅女性健康的第一大惡性腫瘤1。在中國,乳腺癌是女性群體中最常見的癌癥之一,2022年新發乳腺癌病例約36萬,死亡人數接近7.5萬2,嚴重威脅女性健康。
關于“濟愈”腫瘤整合康復科普教育及患者關愛行動
“濟愈”腫瘤整合康復科普教育及患者關愛行動(簡稱“‘濟愈’行動”)是由中國抗癌協會康復分會發起、百濟神州獨家支持的大型公益科普與患者關愛項目。響應中國抗癌協會提出的“防篩診治康、評扶控護生”十字方針,“濟愈”行動整合腫瘤防治、運動康復、心理疏導等多學科資源,協同患者平臺、公眾媒體等各方力量“濟濟一堂”,以創新的醫患科普形式,傳遞科學的抗癌理念和積極向上的抗癌信念,使全國廣大腫瘤患者家庭從中獲得知識和精神的支持,“共赴治愈”。
[1] GLOBOCAN 2022-World. https://gco.iarc.who.int/today, accessed [13 June 2024]. |
[2] GLOBOCAN 2022-China. https://gco.iarc.who.int/today, accessed [13 June 2024]. |
[3] 中國抗癌協會乳腺癌專業委員會, 中華醫學會腫瘤學分會乳腺腫瘤學組. 中國抗癌協會乳腺癌診治指南與規范(2024年版)[J]. 中國癌癥雜志, 2023, 33(12): 1092-1187. |
[4] 中國抗癌協會乳腺癌專業委員會. 中國早期乳腺癌卵巢功能抑制臨床應用專家共識(2024年版)[J]. 中國癌癥雜志, 2024, 34(3): 316-333. |
]]>
《萬物可視》是一本系統介紹數據可視化如何應用于醫藥臨床研究的實操型工具書,由醫、研、學、企各方行業資深力量共同撰寫和校審,經科學技術文獻出版社出版,以期為中國臨床研究數字化轉型提供參考。該書從醫藥臨床上的十大應用場景出發,貫穿早期研發、臨床試驗到上市后真實世界研究的藥物全生命周期,從可視化需求、技術現狀及可及性、可視化的應用場景和通用原則等多維度進行理論闡釋與實踐案例分享,幫助臨床人員更快速、準確地辨析數據價值與趨勢,從而有助于臨床試驗的策略制定和療效結果審閱等。
百濟神州總裁、首席運營官吳曉濱博士表示:"很高興看到由百濟神州參與的又一本臨床科研工具書面世。作為一家在研發、生產、商業化全產業鏈均有全球布局的腫瘤治療創新公司,我們始終思考如何運用公司獨特優勢支持醫藥行業的發展。我們希望這本以數據可視化為切入點的工具書,能幫助廣大醫生和科研人員提升臨床研究效率、促進前沿交流,創造高質量的科研成果,更好滿足癌癥患者的未盡之需。"
DIA全球高級副總裁、中國董事總經理王彤焱博士表示:"《萬物可視》的出版是一次匯聚行業智慧、展現行業碩果、反哺行業轉型發展的突破性嘗試,一路見證這本書從洞察需求、共同編審到集結成冊,我也倍感榮幸和驚喜。醫藥產業要走向高質量發展,必須堅持研發創新,在這點上DIA與百濟神州不謀而合、攜手同行。我們會繼續與各界聚力合作,促進科學、研究和社會的進步,并最終改善全球患者的治療效果。"
為推動腫瘤疾病臨床診療和研究水平可持續提升、支持醫院實現高質量發展,百濟神州依托公司全球研發優勢、聯動強大的商業化網絡,于2022年在中國建立"百濟?星"創新專項,下設臨床科研能力培訓、臨床科研學術交流、臨床科研工具書開發三大模塊。
作為"百濟?星"臨床科研工具書開發模塊的成果輸出,第一本自著的臨床科研工具書《統心協力》于2023年12月上市,3個月內銷量破萬,體現了行業對培養醫學創新人才、實現臨床科研成果轉化的迫切需求。(相關新聞稿鏈接)
《萬物可視》即日起可在各大購書渠道購買,《統心協力》亦在售。
關于百濟神州
百濟神州是一家全球腫瘤治療創新公司,專注于為全世界的癌癥患者研發創新抗腫瘤藥物。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線和產品組合,致力于為全球更多患者全面提升藥物可及性和可負擔性。在全球五大洲,我們有超過10,000人的團隊。如需了解更多信息,請訪問www.beigene.com.cn或關注"百濟神州"微信公眾號。
關于百濟?星
為推動腫瘤疾病臨床診療和研究水平可持續提升、支持醫院實現高質量發展,百濟神州設立"百濟?星"創新專項,為中國臨床科研能力提升搭建行業賦能和交流的平臺。項目依托公司全球研發優勢,聚焦真實世界的臨床需求與挑戰,目前已建立臨床科研能力培訓、臨床科研學術交流、臨床科研工具書開發三大模塊,旨在全面助力培養高素質的醫學創新人才、實現臨床科研成果轉化,最終惠及患者未盡之需。
關于藥物信息協會(DIA)與DIA中國數字健康社區(DHC)
DIA(藥物信息協會)成立于1964年,是全球知名的非營利性、多學科、會員主導的醫藥專業協會,是推動藥物創新、藥學發展的全球學術平臺。在全球醫藥研發領域享有很高聲譽。自2009年起,DIA中國持續以全球監管和藥物開發頂級資源為依托,為中國藥物創新提供了一個全球性中立的全生命周期藥物研發學術溝通平臺,以應對創新挑戰,鼓勵思想領袖和監管者進行公開對話。
DIA中國數字健康社區(Digital Health Community,DHC)是DIA中國目前十大專業社區之一,致力于提供行業領先技術、各環節最佳實踐的交流平臺,推動臨床研究質量和效率的提高。
關于《萬物可視:臨床研發可視化應用十大場景》書籍
《萬物可視:臨床研發可視化應用十大場景》(簡稱:《萬物可視》)是一本系統介紹數據可視化如何應用于醫藥臨床研究的實操型工具書,由百濟神州和藥物信息協會(DIA)中國數字健康社區(DHC)組織編寫,經科學技術文獻出版社出版,以期為中國臨床研究數字化轉型提供參考。該書從醫藥臨床上的十大應用場景出發,貫穿早期研發、臨床試驗到上市后真實世界研究的藥物全生命周期,從可視化需求、技術現狀及可及性、可視化的應用場景和通用原則等多維度進行理論闡釋和實踐案例分享,幫助臨床人員更快速、準確地辨析數據價值與趨勢,從而有助于臨床試驗的策略制定和療效結果審閱等。
免責聲明:《萬物可視》提供信息、知識的分享,不應被視為任何醫療咨詢意見。讀者可將本書籍提供的內容或服務用于個人學習、研究或欣賞,以及其他非商業性用途,但同時應遵守著作權法及其他相關法律的規定,不得侵犯本書籍及相關權利人的合法權利。
中國北京2024年5月13日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160;上交所代碼:688235)是一家全球腫瘤治療創新公司,今日宣布,其BTK抑制劑澤布替尼(中文商品名:百悅澤®;英文商品名:BRUKINSA®)獲得中國國家藥品監督管理局(國家藥監局)附條件批準注冊,新增以下適應癥:聯合奧妥珠單抗,適用于既往接受過至少二線系統性治療的復發或難治性濾泡性淋巴瘤(FL)成人患者。
此次澤布替尼獲得國家藥監局的附條件批準,是基于一項全球性、隨機、開放、多中心的2期研究ROSEWOOD試驗(NCT03332017),該研究旨在比較澤布替尼聯合奧妥珠單抗和奧妥珠單抗單藥治療在217例既往接受過至少二線系統性治療的復發或難治性FL患者中的治療效果。該適應癥后續的常規批準將取決于確證性臨床試驗,即一項在復發/難治性濾泡性或邊緣區淋巴瘤患者中比較澤布替尼聯合抗CD20抗體與來那度胺聯合利妥昔單抗的3期隨機對照研究(BGB-3111-308)的臨床試驗結果。
百濟神州高級副總裁、全球研發負責人汪來博士表示:"濾泡性淋巴瘤是一種惰性腫瘤,目前尚無法被治愈,但患者通過規范化的長期治療可以實現長期生存。澤布替尼是迄今為止全球首款且目前唯一獲批用于濾泡性淋巴瘤的BTK抑制劑,我們很高興該適應癥在中國獲批,讓患者有高質量的治療方案,確保用藥安全,從而惠及更多亟需治療的濾泡性淋巴瘤患者。"
濾泡性淋巴瘤是第二常見非霍奇金淋巴瘤(NHL)類型,占所有非霍奇金淋巴瘤病例的22%,五年生存率約為90%,約一半被診斷為FL的患者可存活近20年[2,3,4]。大多數濾泡性淋巴瘤患者在診斷時為晚期疾病,該惰性腫瘤隨著時間的推移會變得更具侵襲性;其中,首次復發難治患者mOS可達10年,因此長期病程中,治療藥物的安全性至關重要;常規免疫化療方案存在較為嚴重的血液學毒性及感染風險,亟需更為安全的靶向治療藥物滿足患者的無化療治療需求[5]。
北京大學腫瘤醫院朱軍教授表示:"在中國,濾泡性淋巴瘤的發病率呈逐年上升的趨勢,平均發病年齡為60-65歲,多見于中老年患者。對于復發或難治性濾泡性淋巴瘤患者來說,澤布替尼是一個無需化療的口服治療選擇,我們相信隨著本次獲批,該治療方案將成為改變臨床實踐的治療方案,開啟濾泡性淋巴瘤治療無化療的新時代,有望大幅提升患者的治療依從性和生活質量。"
2023年11月,澤布替尼獲歐盟委員會(EC)批準用于治療復發或難治性濾泡性淋巴瘤,成為歐盟地區適用患者人群最廣泛的BTK抑制劑。(獲批新聞稿鏈接)
2024年3月,澤布替尼濾泡性淋巴瘤相關適應癥獲得美國食品藥品監督管理局(FDA)加速批準。該加速批準標志著澤布替尼在美國的第五項B細胞惡性腫瘤適應癥獲批。(獲批新聞稿鏈接)
關于濾泡性淋巴瘤
濾泡性淋巴瘤(FL)是第二常見非霍奇金淋巴瘤(NHL)類型,占所有NHL病例的22%[2]。在歐洲,每年有超過122,000人被診斷為NHL[6]。FL是一種惰性腫瘤,但隨著時間的推移會變得更具侵襲性。雖然FL仍無法治愈,但患有該疾病的患者可以長期存活。五年生存率約為90%,約一半被診斷為FL的患者可存活近20年[3,7]。
關于澤布替尼
澤布替尼(中文商品名:百悅澤®;英文商品名:BRUKINSA®)是一款布魯頓氏酪氨酸激酶(BTK)小分子抑制劑,通過優化生物利用度、半衰期和靶點選擇性,實現對BTK蛋白完全、持續的抑制。憑借與其它獲批BTK抑制劑存在差異化的藥代動力學特征,澤布替尼已被證明能在多個疾病相關組織中抑制惡性B細胞增殖。
關于百濟神州
百濟神州是一家全球腫瘤治療創新公司,專注于為全世界的癌癥患者研發創新抗腫瘤藥物。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線和產品組合,致力于為全球更多患者全面提升藥物可及性和可負擔性。在全球五大洲,我們有超過10,000人的團隊。如需了解更多信息,請訪問www.beigene.com.cn或關注"百濟神州"微信公眾號。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律定義的前瞻性聲明,包括百濟神州為全球更多患者提供澤布替尼治療的能力和承諾;澤布替尼聯合奧妥珠單抗治療復發或難治性濾泡性淋巴瘤(R/R FL)患者的臨床獲益;百濟神州推進澤布替尼(尤其是用于治療R/R FL)未來臨床開發、注冊申報和商業化;以及在"關于百濟神州"副標題下提及的百濟神州計劃、承諾、抱負和目標。由于各種重要因素的影響,實際結果可能與前瞻性聲明有重大差異。這些因素包括:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產、商業化和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發和實現并保持盈利的能力;百濟神州在最近季度報告10-Q表格中"風險因素"章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該等信息。
本新聞稿不對任何產品進行推薦或推廣,藥品處方請參考國家藥品監督管理局批準的藥品說明書。
[1] 截至2024年5月13日。 [2] Leukemia & Lymphoma Society. Treatment for Indolent NHL Subtypes. Available at: https://www.lls.org/lymphoma/non-hodgkin-lymphoma/nhl-subtypes/treatment-indolent-nhl-subtypes. [3] American Cancer Society. Survival Rates and Factors That Affect Prognosis (Outlook) for Non-Hodgkin Lymphoma. Available at: https://www.cancer.org/cancer/types/non-hodgkin-lymphoma/detection-diagnosis-staging/factors-prognosis. [4] Cartron G and Trotman J. Time for an Individualized Approach to First-Line Management of Follicular Lymphoma. Haematologica. 2022;107(1):7-18. [5] 李小秋, 李甘地, 高子芬, 周小鴿, 朱雄增. 中國淋巴瘤亞型分布:國內多中心性病例10002例分析[J]. 診斷學理論與實踐, 2012, 11(02): 111-115. [6] World Health Organization. Non-Hodgkin Lymphoma. Available at: https://gco.iarc.fr/today/data/factsheets/cancers/34-Non-hodgkin-lymphoma-fact-sheet.pdf. [7] Cartron G and Trotman J. Time for an Individualized Approach to First-Line Management of Follicular Lymphoma. Haematologica. 2022;107(1):7-18. |
]]>
北京2024年4月30日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160;上交所代碼:688235)是一家全球腫瘤治療創新公司,今日宣布,其PD-1抑制劑百澤安®(替雷利珠單抗)正式獲得中國國家藥品監督管理局(國家藥監局)批準,聯合氟尿嘧啶類和鉑類藥物化療用于局部晚期不可切除的或轉移性的胃或胃食管結合部(G/GEJ)腺癌的一線治療。
本次獲批基于RATIONALE-305試驗(NCT03777657)的最終分析結果。該結果同時刷新全球全人群和中國人群的晚期胃癌生存紀錄,其顯示:在全球意向性治療(ITT)人群中,替雷利珠單抗聯合化療組的中位總生存期(mOS)達15.0個月,顯著降低死亡風險20%,其中中國人群的mOS達15.7個月。
此前于2023年2月,替雷利珠單抗就已獲批用于聯合氟尿嘧啶類和鉑類藥物化療用于PD-L1高表達的局部晚期不可切除的或轉移性的胃或胃食管結合部腺癌的一線治療(點擊這里了解更多)。本次獲批進而驗證了無論PD-L1表達如何,替雷利珠單抗聯合化療作為晚期胃癌的一線治療均可使患者獲益。
胃癌是中國第五大常見惡性腫瘤,中國胃癌新發病例約占全球胃癌新發病例的40%[i],[ii]。腺癌是胃癌的主要組織學亞型[iii]。在中國新發胃癌患者中,70%以上在確診時已處于進展期或晚期[iv],化療既往作為一線標準治療效果仍待改善,患者mOS僅為一年[v]。包括免疫療法在內的多種新治療方案正持續提升中國晚期胃癌患者的生存預后[vi]。
百濟神州全球研發負責人汪來博士表示:"晚期胃癌仍是中國癌癥患者死亡的主要原因之一。我們相信在本次獲批后,更廣泛的胃癌患者人群將獲得免疫治療選擇,我們期待替雷利珠單抗能為腫瘤患者帶來更多生存獲益。作為全球腫瘤治療創新公司,百濟神州將繼續尊崇初心,為全世界的癌癥患者提供可及、可負擔的高品質創新藥。"
中山大學腫瘤防治中心主任、RATIONALE-305試驗全球主要研究者徐瑞華教授指出:"作為該研究的全球首席研究者,我很榮幸牽頭并見證了替雷利珠單抗在胃癌領域的探索前行,憑借優異的療效和安全性,為全球全人群晚期胃癌患者爭取了更長生存,樹立了創新藥業界新典范。此次新適應癥的獲批,無疑將惠及更多中國胃癌患者,同時我也期待全人群適應癥將如期在美國乃至全球其它市場陸續獲批。"
在中國,替雷利珠單抗已有13項適應癥申請(共涉及12項適應癥)獲得國家藥監局批準。總計11項已納入國家醫保藥品目錄,是目前納入國家醫保藥品目錄獲批適應癥數量最多的PD-1抑制劑。
在全球,替雷利珠單抗已在歐盟、英國、美國、韓國、瑞士獲批,并在今年2月獲美國食品藥品監督管理局(FDA)受理其聯合含氟尿嘧啶類和鉑類藥物化療用于治療局部晚期不可切除或轉移性胃或胃食管結合部(G/GEJ)腺癌患者的新藥上市許可申請(BLA)。
關于RATIONALE-305(NCT03777657)
RATIONALE-305是一項隨機、雙盲、安慰劑對照、全球3期試驗,入組了997例局部晚期不可切除或轉移性G/GEJ腺癌患者。該試驗的主要終點為總生存期(OS),根據預先規定的分級檢驗策略先后對PD-L1高表達人群和意向性治療(ITT)人群進行檢驗。ITT人群的最終分析結果已在2023年歐洲腫瘤內科學會(ESMO)大會期間以最新突破口頭報告的形式進行展示。
關于替雷利珠單抗
替雷利珠單抗(中文商品名:百澤安®,英文商品名:TEVIMBRA®)是一款人源化IgG4抗PD-1單克隆抗體,對PD-1具有高親和力和結合特異性,設計目的旨在最大限度地減少與巨噬細胞中的Fcγ受體結合,幫助人體免疫細胞識別并殺傷腫瘤細胞。
百濟神州已開展超過17項替雷利珠單抗的潛在注冊性臨床試驗,其中已有11項3期隨機試驗和4項2期試驗取得積極結果。這些試驗結果表明,替雷利珠單抗作為單藥治療,或與其他藥物聯用,有為多種癌癥類型的數十萬例患者帶來安全的、具有臨床意義的生存獲益和生活質量改善的潛力,且很多情況下,患者無論其PD-(L)1表達狀態如何均可獲益。截至目前,全球已有超過90萬例患者接受了替雷利珠單抗的治療。
關于百濟神州
百濟神州是一家全球腫瘤治療創新公司,專注于為全世界的癌癥患者研發創新抗腫瘤藥物。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線和產品組合,致力于為全球更多患者全面提升藥物可及性和可負擔性。在全球五大洲,我們有超過10,000人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。如需了解更多信息,請訪問www.beigene.com.cn或關注"百濟神州"微信公眾號。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律定義的前瞻性聲明,包括百濟神州為全球更多患者提供替雷利珠單抗的能力;替雷利珠單抗未來在百濟神州實體瘤開發項目中的意義;替雷利珠單抗成為G/GEJ重要治療方案的潛力;以及在"關于百濟神州"副標題下提及的百濟神州計劃、承諾、抱負和目標。由于各種重要因素的影響,實際結果可能與前瞻性聲明有重大差異。這些因素包括:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產、商業化和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發和實現并保持盈利的能力;百濟神州在最近年度報告的10-K表格中"風險因素"章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該等信息。
本新聞稿不對任何產品進行推薦或推廣,藥品處方請參考國家藥品監督管理局批準的藥品說明書。
[i] https://gco.iarc.who.int/media/globocan/factsheets/cancers/7-stomach-fact-sheet.pdf. |
[ii] https://gco.iarc.who.int/media/globocan/factsheets/populations/160-china-fact-sheet.pdf . |
[iii] Lordick F, Carneiro F, Cascinu S, et al; ESMO Guidelines Committee. Gastric cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022;33(10):1005-20. |
[iv] Song Z, et al. Progress in the treatment of advanced gastric cancer. Tumour Biol. 2017. |
[v] Nakamura Y, et al. Biomarker-targeted therapies for advanced-stage gastric and gastro-oesophageal junction cancers: an emerging paradigm. Nat Rev Clin Oncol. 2021. |
[vi] https://www.cde.org.cn/main/xxgk/postmarketpage?acceptidCODE=f1a61b9035381b8816fc888421252aae; https://www.cde.org.cn/main/xxgk/postmarketpage?acceptidCODE=457d62d01a141c8fca2e536b49f16296 |
]]>
中國北京2024年4月3日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160;上交所代碼:688235)是一家全球腫瘤創新公司,今日宣布,由中國抗癌協會科普專業委員會和中國抗癌協會血液腫瘤整合康復專委會共同主辦、百濟神州支持的"奏響生命凱歌,醫路相髓"國際骨髓瘤關愛月全國科普公益系列活動已圓滿結束。
"國際骨髓瘤關愛月"是由國際骨髓瘤基金會(IMF)于2009年3月首次設立,倡議醫務人員、患者及相關護理人員行動起來,提升社會對骨髓瘤的認識。本屆"奏響生命凱歌,醫路相髓"國際骨髓瘤關愛月全國科普公益系列活動,分別在北京、上海、天津、重慶、成都、杭州、武漢、濟南等十城陸續開展,旨在提高全國公眾對多發性骨髓瘤的認識,呼吁各方關注多發性骨髓瘤可長生存的新趨勢,建立慢病化全程管理的新觀念,為患者爭取最大生存獲益。
中國醫學科學院血液病醫院淋巴瘤診療中心主任、中國抗癌協會血液腫瘤整合康復專委會主任委員邱錄貴教授表示:"隨著診療技術發展和創新藥物的應用,多發性骨髓瘤治療取得顯著進展,已進入長生存、慢病化管理時代。各方亟需更新觀念,推動疾病全程管理和整體治療水平的提升,助力患者實現規范治療和整合康復。我們期待通過本次系列科普宣傳活動,在普及疾病知識的同時,推動行業為腫瘤患者的全程管理提供更好的服務與支持。"
多發性骨髓瘤作為血液系統第二大常見的惡性腫瘤[1],好發于老年群體、臨床診斷困難、不可治愈且終將面臨復發。患者骨髓內漿細胞惡性增殖,分泌大量異常免疫球蛋白,俗稱"壞蛋白",常造成骨髓、骨骼、腎臟等相關器官的損害。此外,該疾病也被稱之為"吃骨頭的血液病",很多初診患者伴有溶骨性損害、骨質疏松和/或壓縮性骨折等骨相關事件。
百濟神州總裁兼首席運營官吳曉濱博士表示:"本著 ‘百創新藥,濟世惠民' 的初心,我們始終以患者為先,持續關注腫瘤患者的未盡之需,積極推動腫瘤慢病化全程管理。作為一家全球創新腫瘤創新公司,百濟神州將繼續與專家和患者一起努力,讓患者在接受更高質量的治療同時,提升長期生存質量,為患者和家屬的生活帶來積極的改變。"
關于多發性骨髓瘤
多發性骨髓瘤(multiple myeloma,MM)是一種克隆漿細胞異常增殖的惡性疾病,在很多國家是血液系統第2位常見惡性腫瘤,多發于老年,目前仍無法治愈。MM常見的癥狀包括骨髓瘤相關器官功能損傷的表現,即"CRAB"癥 狀[血 鈣 增 高(Calcium elevation)、腎功能損害(Renal insufficiency)、貧血(Anemia)、骨病(Bone disease)]以及繼發淀粉樣變性等相關表現[2]。
多發性骨髓瘤(multiple myeloma,MM)是一種不可治愈且復發率高的腫瘤,在男性及較年長人群的發病率更高[3]。隨著社會老齡化程度的加劇,中國MM呈現逐年增高趨勢[4],不僅給患者家庭帶來沉重的疾病負擔,也造成了極大的社會經濟損失。
關于百濟神州
百濟神州是一家全球腫瘤創新公司,專注于為全世界的癌癥患者研發創新抗腫瘤藥物。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線和產品組合,致力于為全球更多患者全面提升藥物可及性和可負擔性。在全球五大洲,我們有超過10,000人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。如需了解更多信息,請訪問www.beigene.com.cn或關注"百濟神州"微信公眾號。
[1] https://www.dzrmyy.cn/d/file/content/2022/05/62731b168b6af.pdf |
[2] https://www.dzrmyy.cn/d/file/content/2022/05/62731b168b6af.pdf |
[3] 2011年《中國藥物與臨床》 |
[4]《2018年WHO全球腫瘤調研報告》 |
]]>
中國北京、美國麻省劍橋和瑞士巴塞爾2024年3月11日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160;上交所代碼:688235)是一家全球腫瘤創新公司,近期宣布,其公益支持的"醫時三刻"乳腺癌患者關愛項目(以下簡稱"醫時三刻"),已正式發布中國首部醫患同期聲有聲讀物系列節目"醫時三刻 -- 為美好發聲",并值此"三八"國際婦女節期間開展"醫時三刻 -- ‘三八'節特別行動",旨在通過開展包括有聲讀物現場演繹、跨界對話等活動,攜手全國數十位乳腺癌領域的中青年醫生,聯動多方跨界力量,共同關注年輕乳腺癌患者的心理及精神需求。
"醫時三刻"是由北京白求恩公益基金會發起、百濟神州支持的患者關愛項目。該項目洞悉我國乳腺癌發病呈年輕化的現狀,聚焦年輕乳腺癌患者在承擔家庭、社會多種角色時的切實心理及精神需求,通過"醫患同期聲"有聲讀物的制作和宣發,以聲音為媒介,探索醫患之間具有人文關懷的創新溝通模式,助力患者提振抗癌信心,以更積極向上的心態面對治療,回歸生活。
據世界衛生組織(WHO)的最新數據,2020年乳腺癌已取代肺癌成為全球癌癥發病第一位的癌癥,在中國更是居女性癌癥發病首位[1]。其中,中國等東亞國家的乳腺癌中位發病年齡為45~49歲,美國乳腺癌的中位發病年齡則為62~64歲,因此中國乳腺癌患者的中位發病年齡早于歐美國家,年輕乳腺癌占比更多。同時,年輕的乳腺癌患者有著獨特的醫療和心理社會需求,包括生育、卵巢保護、生活質量等[2]。
"醫時三刻"發起方代表、北京白求恩公益基金會秘書長樊燕榮女士表示:"現代女性不僅追求生活的品質,更注重身心健康。很多乳腺癌患者正值青壯年,是萬千家庭和單位中的中堅力量,她們擔負更多。患者的真實需求,特別是在心理和精神層面,應獲得更多各方關注。‘三八國際婦女節'是屬于全體女性的節日,此次借節日之際開展特別行動,是希望將‘醫時三刻'作為一個平臺和‘醫患交流模板',匯聚眾多專家和愛心人士的力量,切實關注年輕乳腺癌患者在人文關懷上未被滿足的需求,共同呼吁對年輕乳腺癌患者的關愛和支持。"
截至目前,"醫時三刻 -- 讓美好發聲"有聲讀物欄目已在上海廣播電視臺旗下全國資、全國性的移動社交音頻平臺阿基米德客戶端上線三期,共獲超過80萬次的收聽。節目內容由上海人民廣播電臺上海新聞廣播《直通990》欄目組專業制作呈現,已獲得了十多位中青年骨干專家傾情支持。
中國抗癌協會乳腺專業委員會秘書長、中華醫學會腫瘤學分會乳腺學組副組長、復旦大學附屬腫瘤醫院余科達教授表示:"乳腺癌醫生的職責,應不僅限于提供患者有效的治療方案,更要懂得患者真實需求,提供包括心理、人文關懷等的各方位支持,探索創新醫患溝通方式。本次的有聲讀物系列,便是我們的一次創新嘗試。我有幸參與該節目錄制,感受到跨越時空的醫患共鳴,在期待自己聲音能被更多患者聽到的同時,更希望未來有越來越多的醫患朋友關注和參與‘醫時三刻'項目,賦能和支持更多患者。"
在"醫時三刻 -- ‘三八'節特別行動"的跨界對話中,復旦大學附屬腫瘤醫院乳腺外科楊犇龍教授與多位乳腺癌專科醫生、跨界嘉賓一道,探討了年輕乳腺癌患者在治療過程不同階段中的差異化需求,以及承擔社會及家庭多種角色時會面臨的多樣化壓力和挑戰。楊教授分享道:"在‘醫時三刻'項目中,醫生和患者得以拋開慣常的醫患關系和互動模式,共同就國內外經典的文學作品分享感悟,這是一個雙向增進的過程。我時常覺得這不只是我們在療愈患者,更是患者在賦能我們。"
作為項目支持方,百濟神州高級副總裁、大中華區醫學事務部負責人錢洪宇女士表示:"在百濟神州,我們始終以患者之需為先,密切關注乳腺癌等癌癥患者的未盡之需。對年輕乳腺癌患者來說,她們在治療和預后方面有著特定訴求,對生活質量也有著更高要求。支持‘醫時三刻'公益項目是我們履行‘以患者為先'的行動之一。我們將繼續探索更多創新、貼切的形式,攜手社會各界開展患者關愛公益行動,呼吁全社會共同合力,為乳腺癌患者在家庭、工作和心靈上,給予多維度的支持。"
關于"醫時三刻"乳腺癌患者關愛項目
"醫時三刻"乳腺癌患者關愛項目是由北京白求恩公益基金會發起、百濟神州支持的患者關愛項目。該項目洞悉到我國乳腺癌發病呈年輕化的特征以及相對年輕的患者未被滿足的心理需求,通過醫患共錄有聲讀物的方式傳遞社會溫度,鼓勵乳腺癌患者,特別是相對年輕的患者群體,在接受治療的同時緩解情緒壓力,同時也嘗試探索醫患之間具有人文關懷的創新溝通模式。
關于乳腺癌
在全球范圍內,乳腺癌已成為女性最常見的癌癥,2020年有超過200萬的乳腺癌患者,近68.5萬例死亡,是威脅女性健康的第一大惡性腫瘤[1]。在中國,乳腺癌是女性群體中最常見的癌癥,2020年確診乳腺癌病例已接近42萬[3],死亡人數接近12萬,約占全球乳腺癌死亡人數的18%[1]。另一方面,中國乳腺癌患者的中位發病年齡為45~49歲[2],而美國乳腺癌的中位發病年齡則為62~64歲,相比來說中國乳腺癌發病年齡更低,年輕乳腺癌占比較高,呈年輕化趨勢[2]。
關于百濟神州
百濟神州是一家全球腫瘤創新公司,專注于為全世界的癌癥患者研發創新抗腫瘤藥物。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線和產品組合,致力于為全球更多患者全面提升藥物可及性和可負擔性。在全球五大洲,我們有超過10,000人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。如需了解更多信息,請訪問www.beigene.com.cn 或關注"百濟神州"微信公眾號。
| [1] Cao, Wei; Chen, Hong-Da; Yu, Yi-Wen; Li, Ni; Chen, Wan-Qing. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020. Chinese Medical Journal 134(7):p 783-791, April 5, 2021. |
| [2] 中國臨床腫瘤學會乳腺癌專家委員會,中國抗癌協會乳腺癌專業委員會,中華醫學會外科學分會乳腺外科學組. 中國年輕乳腺癌診療專家共識(2022)[J]. 中華醫學雜志,2023,103(6):387-403. DOI:10.3760/cma.j.cn112137-20220907-01895. |
| [3] 劉威, 王黎君, 齊金蕾, 等. 1990-2017年中國女性乳腺癌疾病負擔分析 [J] . 中華流行病學雜志, 2021, 42(7) : 1225-1230. DOI: 10.3760/cma.j.cn112338-20200908-01139. |
本次sBLA的申報基于RATIONALE 315(NCT04379635)的臨床試驗數據。該研究是一項在可切除II期或IIIA期非小細胞肺癌患者中比較替雷利珠單抗或安慰劑聯合含鉑雙藥化療作為新輔助治療,后續輔以替雷利珠單抗或安慰劑輔助治療的有效性和安全性的隨機、雙盲、安慰劑對照的3期研究。
RATIONALE 315在2023年10月的歐洲腫瘤內科學會(ESMO)大會上公布的最新數據顯示,其雙重主要終點皆已達到:盲態獨立病理學審查(BIPR)評估的主要病理學緩解(MPR)和盲態獨立中心審查(BICR)評估的無事件生存期(EFS),關鍵次要終點病理學完全緩解(pCR)方面也顯示出具有統計學顯著性的改善。與安慰劑聯合化療相比,替雷利珠單抗聯合化療作為新輔助治療顯著提高了MPR率(56.2% vs 15.0%)和pCR率(40.7% vs 5.7%)。EFS數據將在近期的學術會議公布。替雷利珠單抗聯合化療的總體耐受性良好,未發現新的安全性警示。
肺癌是世界范圍內常見的惡性腫瘤,死亡率居全球第一[1]。在中國,肺癌亦是第一大癌種,其發病率和死亡率都位居惡性腫瘤的"雙首"[2]。其中非小細胞肺癌約占所有肺癌病例的85%,而可切除非小細胞肺癌患者中半數以上在5年內復發,復發模式多為軀體遠端或器官轉移,對于已出現軀體遠端或器官轉移的晚期NSCLC患者,其相對5年生存率約為6%[3],未盡治療需求巨大。
百濟神州高級副總裁、全球研發負責人汪來博士表示:"非小細胞肺癌是肺癌中最常見的組織學亞型,其可手術率和術后治療備受關注。我們很高興看到免疫治療聯合化療能為該患者人群的手術治療創造更多機會,并進一步減少患者術后的復發風險。百濟神州將繼續與國家藥監局保持積極溝通,以期盡快為亟需新輔助和輔助治療的非小細胞肺癌圍手術期患者,帶來新治療選擇和更多術后治愈可能。"
在中國,替雷利珠單抗已累計提交15項適應癥申請獲藥審中心受理,其中12項適應癥獲得國家藥監局批準,11項適應癥納入國家醫保藥品目錄[4],是目前獲批及納入國家醫保藥品目錄適應癥數量最多的PD-1抑制劑。
關于RATIONALE 315(NCT04379635)
RATIONALE 315是一項在可切除的II期或IIIA期非小細胞肺癌(NSCLC)患者中比較替雷利珠單抗或安慰劑聯合含鉑雙藥化療作為新輔助治療,隨后接受手術,后續以替雷利珠單抗或安慰劑作為輔助治療的有效性和安全性的隨機、雙盲、安慰劑對照的3期臨床試驗。RATIONALE 315的主要終點為盲態獨立中心評估(BIPR)的主要病理緩解率(MPR)和BICR評估的無事件生存期(EFS)。關鍵次要終點為病理學完全緩解(pCR)。其他次要終點包括總生存期(OS)、客觀緩解率(ORR)、BICR的無病生存期(DFS)和研究者評估的EFS。這一試驗共入組453例患者,以1:1的比例隨機接受替雷利珠單抗聯合化療或安慰劑聯合化療的治療。
關于百澤安®
百澤安®(替雷利珠單抗)是一款人源化IgG4抗PD-1單克隆抗體,設計旨在最大限度地減少與巨噬細胞中的Fcγ受體結合,幫助人體免疫細胞識別并殺傷腫瘤細胞。臨床前數據表明,巨噬細胞中的Fcγ受體結合之后會激活抗體依賴細胞介導殺傷T細胞,從而降低了PD-1抗體的抗腫瘤活性。
替雷利珠單抗的全球臨床開發項目已在超過30個國家和地區開展21項注冊性臨床試驗。截至目前,百濟神州已宣布10項3期關鍵性研究的積極結果,這些研究涉及多種腫瘤類型和疾病階段,如非小細胞肺癌、小細胞肺癌、胃癌、食管鱗狀細胞癌、肝細胞癌和鼻咽癌。更多替雷利珠單抗臨床試驗項目的相關信息,請訪問:https://www.beigene.com.cn/our-science-and-medicines/pipeline/。
關于百濟神州
百濟神州是一家全球生物科技公司,專注于為全世界的癌癥患者研發創新抗腫瘤藥物。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線和產品組合,致力于為全球更多患者全面提升藥物可及性和可負擔性。在全球五大洲,我們有超過10,000人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。如需了解更多信息,請訪問www.beigene.com.cn或關注"百濟神州"微信公眾號。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律中定義的前瞻性聲明,包括有關百濟神州對替雷利珠單抗惠及全球患者未盡治療之需的開發能力;百濟神州推進替雷利珠單抗研發、藥政、商業化的進展;以及百濟神州在"關于百濟神州"副標題下提及的百濟神州計劃、承諾、抱負和目標。由于各種重要因素的影響,實際結果可能與前瞻性聲明中的結果存在實質性差異。這些因素包括:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發、商業化及實現并保持盈利的能力;以及百濟神州在最近季度報告10-Q表格中"風險因素"章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該等信息。
本新聞稿不對任何產品進行推薦或推廣,藥品處方請參考國家藥品監督管理局批準的藥品說明書。
[1] Latest global cancer data 2020 |
[2] Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016 [J]. Journal of the National Cancer Center, 2022, 2(1): 1-9. |
[3] U.S National Institute of Health (NIH) National Cancer Institute Surveillance, Epidemiology, and End Results Program (SEER) Cancer Stat Facts. Available at https://seer.cancer.gov/statfacts/html/lungb.html; accessed May 2021. |
[4] 國家醫保局 人力資源社會保障部關于印發《國家基本醫療保險、工傷保險和 |
生育保險藥品目錄(2023年)》的通知at http://www.nhsa.gov.cn/art/2023/12/13/art_104_11673.htm4l |
肝癌是中國常見的高發惡性腫瘤。2020年中國肝癌新發病例約41萬,約占全球總數的一半;死亡病例約39.1萬,是中國第二大腫瘤致死病因[1]。70%-80%的肝癌患者在診斷時已經是中晚期[2],失去了手術或其他局部治療機會,臨床預后較差,5年生存率僅為12.1%[3],亟需更多治療手段改善患者生存。
百濟神州高級副總裁、全球研發負責人汪來博士表示:"中國的HCC發病率近年來持續上升,存在較大的未被滿足的臨床需求。此次獲批是替雷利珠單抗在肝癌領域的又一突破性進展,豐富了晚期HCC患者的一線治療選擇。我們期待這一全新的治療方案能夠惠及更多肝癌患者,進一步提升肝癌患者的生存獲益。"
本次獲批是基于RATIONALE 301(NCT03412773)的臨床試驗數據。該試驗是一項隨機、開放性的全球3期臨床研究,從亞洲、歐洲和美國各研究中心共入組674例患者,旨在評估替雷利珠單抗對比索拉非尼作為不可切除的HCC成人患者一線治療的效果。
此前,RATIONALE 301試驗結果以最新突破口頭報告的形式,公布于2022年在法國巴黎舉辦的歐洲腫瘤內科學會(ESMO)大會,并于今年榮登腫瘤領域著名期刊《美國醫學會雜志-腫瘤學》(JAMA Oncology)。研究結果顯示:與索拉非尼相比,替雷利珠單抗展示出在總生存期(OS)上的非劣效性結果。替雷利珠單抗的中位OS為15.9個月,而索拉非尼的OS為14.1個月;替雷利珠單抗具有更高的客觀緩解率(ORR)(14.3% vs 5.4%)和更持久的緩解(中位緩解持續時間DoR分別為36.1個月和 11.0個月);替雷利珠單抗和索拉非尼治療的安全性特征與既往研究一致。
中國藥科大學附屬南京天印山醫院消化系統腫瘤首席專家和RATIONALE 301 試驗的全球牽頭研究者(Leading PI)秦叔逵教授表示:"RATIONALE 301是一項由中國專家主導的、具有前瞻性的、隨機對照、全球多中心3期注冊臨床試驗。在設計和優化研究方案階段,就兼顧東、西方肝癌的高度異質性,同時充分結合中國國情、病人特點和實踐經驗;試驗過程中科學實施,嚴格質控,數據翔實,從而獲得了預期的結果,為晚期肝細胞癌患者的一線免疫治療提供了新的選擇和可靠的依據。"
秦教授進一步表示,"替雷利珠單抗在本項試驗中,單藥一線治療肝癌即展現出優良的有效性、安全性和耐受性,帶來了明顯的生存獲益,具有重要的臨床價值。可以相信此次替雷利珠單抗獲批一線治療晚期肝細胞癌適應癥后,除了可以單藥使用,還將推動含替雷利珠單抗聯合方案的臨床應用及研究進展,為眾多的肝癌患者帶來生的希望。"
至此,替雷利珠單抗已有12項適應癥獲得NMPA批準,是目前在中國獲批適應癥數量最多的PD-1抑制劑,其中11項適應癥已全部納入國家醫保藥品目錄,也是納入國家醫保藥品目錄獲批適應癥數量最多的PD-1抑制劑。
關于肝癌
2020年中國肝癌新發病例約41萬,占全球總數約45%;死亡病例約39.1萬,是中國第二大腫瘤致死病因[1],5年生存率僅為12.1%[3],疾病負擔沉重,嚴重威脅中國肝癌患者生命。
中國肝癌患者的數量龐大,且在發病原因、流行病學特征、臨床表現、治療策略以及預后等方面,都與歐美國家存在著明顯的不同,具有高度異質性。比如,中國的HCC患者,大多數存在基礎肝病,即乙型肝炎、肝硬化、肝功能異常和相關的并發癥等特征。
關于百澤安®
百澤安®(替雷利珠單抗)是一款人源化IgG4抗PD-1單克隆抗體,設計旨在最大限度地減少與巨噬細胞中的Fcγ受體結合,幫助人體免疫細胞識別并殺傷腫瘤細胞。臨床前數據表明,巨噬細胞中的Fcγ受體結合之后會激活抗體依賴細胞介導殺傷T細胞,從而降低了PD-1抗體的抗腫瘤活性。
替雷利珠單抗的全球臨床開發項目已在超過30個國家和地區開展21項注冊可用臨床試驗。截至目前,百濟神州已宣布10項3期關鍵性研究的積極結果,這些研究涉及多種腫瘤類型和疾病階段,如非小細胞肺癌、小細胞肺癌、胃癌、食管鱗狀細胞癌、肝細胞癌和鼻咽癌。更多替雷利珠單抗臨床試驗項目的相關信息,請訪問:https://www.beigene.com.cn/our-science-and-medicines/pipeline/。
關于百濟神州
百濟神州是一家全球生物科技公司,專注于為全世界的癌癥患者研發創新抗腫瘤藥物。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線和產品組合,致力于為全球更多患者全面提升藥物可及性和可負擔性。在全球五大洲,我們有超過10,000人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。如需了解更多信息,請訪問www.beigene.com.cn或關注"百濟神州"微信公眾號。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律中定義的前瞻性聲明,包括有關百濟神州向HCC患者提供有效治療選擇的能力;百澤安®的潛在治療獲益;以及百濟神州在"關于百濟神州"副標題下提及的百濟神州計劃、承諾、抱負和目標。由于各種重要因素的影響,實際結果可能與前瞻性聲明中的結果存在實質性差異。這些因素包括:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發、商業化及實現并保持盈利的能力;以及百濟神州在最近季度報告10-Q表格中"風險因素"章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該等信息。
[1] WHO International Agency for Research on Cancer. China Fact Sheet (2020).
[2] 全國多中心前瞻性肝癌極早期預警篩查項目專家組,中國肝癌早篩策略專家共識,《中華肝臟病雜志》2021年6月第29卷第6期
[3] Zeng, Hongmei et al. "Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries." The Lancet. Global health vol. 6,5 (2018): e555-e567. doi:10.1016/S2214-109X(18)30127-X
]]>
區別于以往大多面向藥物開發人員的學術理論型著作,《統心協力》選擇聚焦醫學臨床科研領域,旨在從統計分析解決臨床試驗問題的視角出發,為廣大臨床醫生和醫學機構研究者深入理解和熟練運用統計學方法提供參考。全書18個章節針對不同類型和不同階段的臨床試驗分別闡釋了相應的統計方法和應用課題,并輔以大量臨床醫學統計案例,以期成為臨床醫生在設計和分析科研項目時所需要的實用指南。書中每一章節還配備了視頻講解,進一步增加了可讀性和可理解性。
該書由百濟神州研發部統計和數據科學團隊獨立撰寫。所有作者在生物統計行業平均工作經驗十年以上,曾領導和參與多項新藥或生物類似藥研究、開發、注冊申報及上市后工作,涉及腫瘤、免疫、神經、病毒、心血管等多個疾病領域。
百濟神州聯合創始人、科學顧問委員會主席王曉東博士表示:"科學性與全球化是百濟神州的創始之本,我很高興看到百濟神州的統計團隊能在工作之余,編撰出這樣一本幫助臨床醫生方便使用統計方法的工具書。希望這本理論與實踐相結合的工具書能夠成為廣大臨床醫生在臨床研究中的好助手。"
]]>本次sBLA的申報基于RATIONALE 312(NCT04005716)的臨床試驗數據。此前公布結果顯示:相較于化療,替雷利珠單抗聯合化療在未經治療的廣泛期小細胞肺癌患者中展現出總生存期(OS)優效性。試驗未發現新的安全性警示。
RATIONALE 312是一項對比替雷利珠單抗聯合化療和安慰劑聯合化療作為廣泛期小細胞肺癌患者一線治療有效性的隨機、雙盲、安慰劑對照、多中心3期臨床試驗,共納入全國51家中心的457例患者。其主要終點為總生存期,次要終點包括無進展生存期(PFS)、客觀緩解率(ORR)、緩解持續時間(DoR)和安全性。此項研究的結果以最新突破口頭報告的形式公布于2023年在新加坡舉辦的世界肺癌大會(WCLC)。
百濟神州高級副總裁、全球研發負責人汪來博士表示:"小細胞肺癌是一種致死率尤為高的肺癌類型,其5年生存率僅為7%,全球患者迫切需要新治療選擇。在這一治療需求亟待滿足的癌癥中,我們很高興看到替雷利珠單抗聯合化療在總生存期方面優于化療。本次獲得受理也預示著我們離為中國小細胞肺癌患者帶來更有利的一線治療選擇又近了一步。我們將繼續與國家藥監局保持積極溝通,以盡快滿足未盡患者之需。"
在中國,替雷利珠單抗目前已被國家藥監局批準用于11項適應癥的治療,其中9項適應癥已全部納入國家醫保藥品目錄,是獲批納入國家醫保藥品目錄適應癥數量最多的PD-1抑制劑。此外,替雷利珠單抗的如下新適應癥上市許可申請正在接受藥審中心的技術審評:用于治療一線不可切除或轉移性肝細胞癌(HCC);聯合氟尿嘧啶類和鉑類藥物化療用于一線治療局部晚期不可切除的或轉移性的胃或胃食管結合部(G/GEJ)腺癌患者。
在全球,替雷利珠單抗用于治療既往接受過化療的晚期或轉移性食管鱗狀細胞癌(ESCC)上市許可申請已獲歐盟委員會(EC)批準,且正接受美國食品藥品監督管理局(FDA)審評。此外,歐洲藥品監管局(EMA)正在審評替雷利珠單抗用于治療既往接受過化療的局部晚期或轉移性非小細胞肺癌(NSCLC),以及聯合化療用于初治晚期或轉移性非小細胞肺癌的上市許可申請。英國、澳大利亞、新西蘭、巴西、韓國、瑞士、以色列和印度尼西亞的監管當局均在審評替雷利珠單抗的注冊申請。
關于百澤安®(替雷利珠單抗)
百澤安®是一款人源化IgG4抗PD-1單克隆抗體,設計旨在最大限度地減少與巨噬細胞中的Fcγ受體結合,幫助人體免疫細胞識別并殺傷腫瘤細胞。臨床前數據表明,巨噬細胞中的Fcγ受體結合之后會激活抗體依賴細胞介導殺傷T細胞,從而降低了PD-1抗體的抗腫瘤活性。
替雷利珠單抗的全球臨床開發項目已在超過30個國家和地區開展21項注冊可用臨床試驗。截至目前,百濟神州已宣布10項3期關鍵性研究的積極結果,這些研究涉及多種腫瘤類型和疾病階段,如非小細胞肺癌、小細胞肺癌、胃癌、食管鱗狀細胞癌、肝細胞癌和鼻咽癌。更多替雷利珠單抗臨床試驗項目的相關信息,請訪問:https://www.beigene.com.cn/our-science-and-medicines/pipeline/。
關于百濟神州
百濟神州是一家全球性生物科技公司,專注于為全球癌癥患者發現和開發創新抗腫瘤藥物,提高藥物可及性和可負擔性。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線。我們致力于為全球更多患者全面改善藥物可及性。百濟神州在全球五大洲打造了一支超過10,000人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。欲了解更多信息,請訪問http://www.beigene.com.cn。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律中定義的前瞻性聲明,包括關于百濟神州對替雷利珠單抗惠及全球患者未盡治療之需的開發能力,百濟神州推進替雷利珠單抗研發、藥政、商業化的進展,以及百濟神州和在"關于百濟神州"標題下提及的計劃、承諾、愿望和目標。由于各種重要因素的影響,實際結果可能與前瞻性聲明中的結果存在實質性差異。這些因素包括:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產、商業化和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發及實現并保持盈利的能力;以及百濟神州在最近季度報告的 10-Q 表格中"風險因素"章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該等信息。
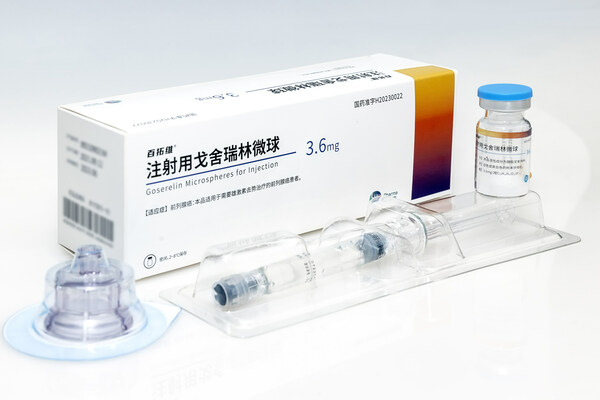
]]>自今年6月30日百拓維®在中國獲批用于前列腺癌的治療以來,百濟神州便與綠葉制藥攜手,快速開啟該產品惠及患者的整體進程,第一時間投入臨床使用。此次新適應癥的獲批,意味著百拓維®覆蓋的患者群體將進一步擴大。
乳腺癌是威脅全球女性健康的第一大惡性腫瘤,也是中國女性群體的高發癌癥。2020年中國確診乳腺癌病例已達42萬例[1],不同年齡段的乳腺癌發病率均持續上升[2];同時,中國乳腺癌發病年齡較歐美國家呈更年輕的趨勢[3],絕經前癌癥患者比例約占1/2;此外,與年長乳腺癌患者相比,絕經前乳腺癌患者復發風險高,總體生存較差[4]。
浙江省腫瘤醫院乳腺內科主任醫師、CSCO乳腺癌專家委員會副主任委員王曉稼教授表示:“絕經前乳腺癌患者對生育保護、乳房外形保留,以及治療體驗、生活質量、心理關愛、回歸社會等方面有更高、更個性化的需求,因此在臨床治療時要多維度考量并給予更多關懷。百拓維®升級的微球劑型和改良的注射方式,能兼顧療效、安全和患者體驗,為女性患者提供更高質量的治療,降低治療相關的心理壓力,提升治療信心及依從性,更有助于乳腺癌患者盡早克服心理障礙和回歸正常生活。”
百拓維®是全球首個且目前唯一獲批上市的戈舍瑞林微球制劑,通過創新微球技術,在保障治療效果與安全性的同時大幅改善患者用藥體驗。該產品用于乳腺癌治療的3期臨床試驗結果表明:其臨床療效與對照藥相當,安全性方面與對照藥特征相似,并可減少注射部位不良反應發生率和嚴重程度。其改良的注射針頭直徑僅0.8毫米,有效降低患者治療相關心理負擔,具有明顯的臨床優勢。
百濟神州大中華區首席商務官殷敏女士表示:“當代女性患者在社會、家庭、職場等各領域扮演著多元角色,她們在治療和預后方面有著特定訴求,對生活質量有著更高要求。我們很高興看到百拓維®獲批乳腺癌適應癥,同時也看到了大量患者的未盡之需和明確的產品臨床價值,期待它能夠為中國乳腺癌患者帶來更高質量的治療,幫助她們減輕身心負擔,支持她們更好地回歸生活。百濟神州也將繼續與綠葉制藥強強聯手,讓更多患者更快用上有效、安全且用藥體驗更佳的全球好藥。”
綠葉制藥集團總裁楊榮兵先生表示:“我們非常自豪地看到,百拓維®在商業化上市后的不久再添新適應癥。這一里程碑的達成再次驗證了公司通過持續高效地交付各項創新成果,服務于臨床所需的承諾與決心。憑借該產品在前列腺癌、乳腺癌治療領域的臨床優勢,綠葉制藥與百濟神州將繼續拓寬雙方的商業化合作廣度,助推該產品社會價值與商業價值的加速轉化,為提升廣大患者的用藥可及性持續努力。”
此前,百拓維®首個適應癥于2023年6月30日獲NMPA批準,用于需要雄激素去勢治療的前列腺癌患者(請點擊查看相關獲批新聞)。該產品在獲批后19天內實現商業化供貨,同步在全國多家醫院投入臨床使用,快速惠及中國前列腺癌患者(請點擊查看相關新聞)。
IQVIA數據顯示:2022年中國促性腺激素釋放激素(GnRH)激動劑產品的市場總值約為人民幣95億元,2018年至2022年的復合年均增長率為17.7%。基于大量未被滿足的患者需求,預計百拓維®將擁有廣闊的市場前景。
關于乳腺癌
乳腺癌是最常見的癌癥,也是威脅全球女性健康的第一大惡性腫瘤。在全球范圍內,2020年有超過200萬的乳腺癌患者,近68.5萬例死亡[1]。在中國,乳腺癌是女性群體中最常見的癌癥,2020年確診乳腺癌病例已接近42萬[2],死亡人數接近12萬,約占全球乳腺癌死亡人數的18%。[1]
臨床上,目前普遍將乳腺癌分為Luminal A、Luminal B、HER2陽性、三陰性四種亞型[5]。其中,Luminal A、Luminal B為激素受體陽性分型,其發病和預后與雌激素高度相關,約占乳腺癌患者總數的70%[4]。卵巢功能抑制(OFS)是通過手術或藥物手段達到抑制卵巢產生雌激素目的的治療方法,是絕經前激素受體陽性乳腺癌的治療基石。以促性腺激素釋放激素類似物(GnRHa)為代表的內分泌治療是OFS治療的重要手段,可抑制卵泡刺激素和黃體生成素的分泌,使絕經前女性體內雌激素達到絕經后水平,也可抑制與雌激素相關的腫瘤生長,同時使卵巢功能處于可逆性抑制狀態。[6]
《中國早期乳腺癌卵巢功能抑制臨床應用專家共識(2021年版)》建議將促性腺激素釋放激素激動劑(GnRHa)作為絕經前激素受體陽性的早期乳腺癌OFS治療的首選;此外,無論激素受體陽性或陰性的絕經前乳腺癌患者,均推薦在(新)輔助化療前和化療過程中使用OFS藥物保護卵巢功能,減少生育能力損害。[7]
關于百拓維®(注射用戈舍瑞林微球)
百拓維®(注射用戈舍瑞林微球)是綠葉制藥自主研發的化學藥品2.2類新藥,已在中國獲批上市,用于需要雄激素去勢治療的前列腺癌患者,以及用于可用激素治療的絕經前期及圍絕經期婦女的乳腺癌患者。該創新制劑依托“先進藥物遞釋系統全國重點實驗室”微球技術平臺,以及符合中國GMP、美國cGMP及歐洲GMP的國際化生產質量體系開發和生產。2022年12月,百濟神州與綠葉制藥就百拓維®達成商業合作,獲得該產品在中國大陸地區研究、開發及商業化的獨家權利;綠葉制藥將作為該產品上市許可持有人(MAH),并將基于百濟神州預估的需求供應和生產該產品。
關于百濟神州
百濟神州是一家全球性生物科技公司,專注于為全球癌癥患者發現和開發創新抗腫瘤藥物,提高藥物可及性和可負擔性。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線。我們致力于為全球更多患者全面改善藥物可及性。百濟神州在全球五大洲打造了一支超過10,000人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。欲了解更多信息,請訪問http://www.beigene.com.cn。
關于綠葉制藥集團
綠葉制藥集團是致力于創新藥物的研發、生產和銷售的國際化制藥公司。綠葉制藥在中國、美國和歐洲設有研發中心,擁有超過30個中國在研藥物和10多個海外在研藥物。綠葉制藥在微球、脂質體、透皮釋藥等先進藥物遞送技術領域達到國際先進水平,在新分子實體、生物抗體領域收獲多項創新成果,并在細胞治療、基因治療等領域進行了積極布局和開發。
綠葉制藥深度布局全球供應鏈體系,已在全球建有8大生產基地,并建立了與國際接軌的GMP質量管理和控制體系。公司現有30余個上市產品,產品覆蓋腫瘤、中樞神經、心血管、消化與代謝等治療領域;業務遍及全球80多個國家和地區,其中包括中國、美國、歐洲、日本等全球主要醫藥市場,以及高速增長的各地新興市場。
如需了解更多內容,請訪問www.luye.cn。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律中定義的前瞻性聲明,包括有關百拓維®的商業化以及潛在治療獲益的表述;百濟神州對于與綠葉制藥商業化合作的預期;以及百濟神州在“關于百濟神州”副標題下提及的百濟神州計劃、承諾、抱負和目標。由于各種重要因素的影響,實際結果可能與前瞻性聲明中的結果存在實質性差異。這些因素包括:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發、商業化及實現并保持盈利的能力;以及百濟神州在最近季度報告10-Q表格中“風險因素”章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該等信息。
[1] Cao, Wei; Chen, Hong-Da; Yu, Yi-Wen; Li, Ni; Chen, Wan-Qing. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020. Chinese Medical Journal 134(7):p 783-791, April 5, 2021. |
[2] 劉威, 王黎君, 齊金蕾, 等. 1990-2017年中國女性乳腺癌疾病負擔分析 [J] . 中華流行病學雜志, 2021, 42(7) : 1225-1230. DOI: 10.3760/cma.j.cn112338-20200908-01139. |
[3] 蔣瀟婷, 劉強, 宋爾衛. 我國年輕乳腺癌診治的若干問題與思考 [J] . 中華醫學雜志, 2022, 102(36) : 2823-2827. DOI: 10.3760/cma.j.cn112137-20220708-01512. |
[4] 中國年輕乳腺癌診療專家共識(2022) |
[5] 江思源, 宋麗萍, 于世博, 等. 乳腺癌患者分子分型與改良根治術后局部復發、遠處轉移及預后的關系 [J] . 腫瘤研究與臨床, 2021, 33(6) : 408-413. DOI: 10.3760/cma.j.cn115355-20200806-00439. |
[6] 曉林, 俞洋, 宗祥云. 促性腺激素釋放激素類似物在乳腺癌治療中的應用及前景,2019 |
[7] 中國早期乳腺癌卵巢功能抑制臨床應用專家共識(2021年版) |
北京2023年7月24日 /美通社/ -- 2023年7月23日國際Castleman病日,《Castleman病(鈴鐺病)患者關愛倡議書》在北京協和醫院正式發布,旨在通過多方攜手共同為罕見病Castleman病患者發聲,更是對罕見病患者的生命呵護。
該倡議書的發布是由中華醫學會罕見病分會、中華醫學會血液學分會血液罕見病學組、中國Castleman病協作組(CCDN)、中國卡斯特曼之家聯合指導,百濟神州進行公益支持。
中華醫學會罕見病分會主任委員、北京協和醫院院長張抒揚教授,中華醫學會罕見病分會秘書長田莊教授,中華醫學會血液學分會主任委員、蘇州大學附屬第一醫院吳德沛教授,中華醫學會血液學分會罕見病學組副組長張磊教授,中國Castleman病協作組組長、北京協和醫院血液內科主任李劍教授,"卡斯特曼之家"主理人林琳女士和百濟神州血液腫瘤事業部負責人朱晶巖女士,以及眾多行業專家、學者、患者和媒體共同見證了倡議書的發布。
倡議書從"知-診-治-愛"四個維度共同應對Castleman病患者所面臨的挑戰。"知",倡議提升公眾對Castleman病的認知;"診",倡議加強Castleman病診斷能力;"治",倡議建立多層次Castleman病診療體系,促進規范治療;"愛",倡議持續關注和支持Castleman病患者。
知 -- 提升疾病認知,了解患者困境
Castleman病是血管濾泡性淋巴結增生癥或巨大淋巴結病,是一種淋巴結過度增生,炎癥反應相關的血液系統的罕見病,以單個或者多個部位的淋巴結腫大為特點,部分患者可伴有全身癥狀和(或)多系統受累,并于2018年被納入《中國第一批罕見病目錄》[1]。
Castleman病的臨床和病理表現缺乏特異性。據2023年卡斯特曼之家調研數據顯示,72%的Castleman病患者表現為淋巴結腫大,54%的患者表現為疲勞乏力、39%出現貧血、37%發生盜汗、33%出現體重下降、32%出現發熱、22%有食欲下降等癥狀[2],還有肝、腎功能不全、脾大、胸水、腹水等器官并發癥。因其多種多樣的臨床表現,極易與其他疾病混淆,造成誤診和漏診。
多中心型Castleman病(MCD)是一種全身性、進行性且可致命的疾病,伴有多部位淋巴結腫大[3],治療和治愈面臨著較多的困難。尤其是特發性多中心型CD(iMCD)更是一種罕見且危及生命的淋巴組織增生的疾病[4],是Castleman病的診治重點。中國MCD患者5年生存率為51%,而2020美國血液學會發表的文章顯示,真實世界中特發性多中心型Castleman病(iMCD)平均生存僅2.57年[5]。
因此患者關愛宣言倡議,加強全社會對疾病的科普工作,提升公眾對疾病的認知和關注,幫助早期病患和潛在患者及時得到確診,避免錯過治療黃金期。張抒揚教授表示,中國人口眾多,目前罕見病患者群體已超過2,000萬[6],而患者一直面臨著診治困難和缺乏藥物的現狀。要解決這樣的困境,其復雜性和艱巨性前所未有,需要來自全社會的投入和支持,才能幫助患者盡早得到規范診治。
診 -- 建立多層次診療體系,滿足患者未盡之需
罕見病因發病率低,病種繁多且患者分散,很多醫務人員缺乏相關的醫學知識和診斷能力,導致罕見病的臨床診斷能力不足,確診難、診斷周期長。且因為區域醫療資源分配不均,患者異地就醫情況普遍。據卡斯特曼之家調研顯示,45%的Castleman病患者需要輾轉3家以上醫院才得到確診;41%的患者從初次發病到確診時間超過6個月;64%的患者常往返就診于多個科室;58%的Castleman病患者曾經被誤診為其他疾病;67%的患者需要進行多次病理檢測才能確診[2]。
在患者關愛宣言中,特別強調要加強對罕見病Castleman病的診斷能力,減少誤診漏診,促進早診早治。2021年中國Castleman病協作組(CCDN)成立后,不斷培養和擴大Castleman專病醫生隊伍,推動血液科、病理科等相關科室的醫務工作者對Castleman病的關注,加強醫生對疾病的鑒別及診斷能力,并發布《中國Castleman病診斷與治療專家共識(2021年版)》(后簡稱《共識》),建立了相關的診療流程和規范。對此,吳德沛教授表示,"依托于像CCDN這樣的專病診療協作組,將推動包括血液科在內的廣大多學科醫生對血液罕見病的重視和研究,對于包括Castleman病在內的罕見病規范化診療有著重要意義,不僅能切實縮短患者確診時間,還能改善疾病的誤診和漏診率,讓更多患者獲益"。
罕見病因其病因復雜,發病機制不明、診斷困難的特性決定它需要跨專業的臨床專家、醫學遺傳專家進行多學科會診才能得出精準診斷。在患者關愛宣言中,倡議以CCDN覆蓋的45個診療中心為相應區域的牽頭單位,輻射其所在區域的其他醫院,促進更多醫院建立多層次、多學科的Castleman病診療體系,幫助患者實現就近治療、促進Castleman病在全國范圍內的規范診治。張抒揚教授認為,建立多層次診療體系,進行多學科會診能夠實現罕見病患者從診斷治療到追蹤管理的"一站式"服務,為患者提供更高效、便捷的"組團"診療,真正實現"以患者需求為導向"的目標。
治 -- 促進規范治療,患者獲益最大化
一直以來,包括Castleman病在內的罕見病患者還面臨著用藥難、身體痛苦、生活狀態差的現狀,無論是在治療方案,藥物可及性,還是患者的生存質量方面都亟待改善。據卡斯特曼之家調研顯示,在接受常規治療后,仍有36%的Castleman病患者存在3項以上血液指標異常,17%的患者有 3項以上疾病癥狀,且近三分之一的采用常規療法的患者表示副作用嚴重影響生活[2]。
患者關愛宣言指出,2021年《共識》的發布大大推動了疾病規范化診療,改善了患者的生存質量。尤其是《共識》將司妥昔單抗推薦為一線iMCD治療方案,打破了之前中國iMCD患者無標準化治療困局。
目前國內現有大部分治療方案針對iMCD的復發率和治療失敗率高,且不良反應明顯,無法很好地滿足患者治療需求。在全球多中心的臨床研究中,司妥昔單抗在iMCD中獲得了尤為顯著的療效,34%患者可達18周癥狀和腫瘤持續緩解,6年疾病控制率高達97%,生存率100%[7],有效地延長了患者生存,改善了患者生存質量。對此李劍教授表示,未來的治療之路不僅要立足當前,還需要以發展的眼光放眼未來,需要對更多的患者進行研究,尋找背后的發病機制,各診療中心將在CCDN的框架下繼續開展合作,研究出更多前瞻性、規范性的治療方案,惠及更多Castleman病患者。
愛 -- 關愛支持患者,帶來新生希望
每一個罕見病患者及其家庭在疾病、心理、社交等方面均承受了巨大的壓力。患者關愛宣言倡議,學術團體、醫療機構、醫藥企業與患者群體和公益組織緊密合作,幫助患者應對疾病挑戰和持續開展患者關愛行動,為患者提供人文關懷和心理撫慰,幫助患者以積極健康的心態面對疾病與生活。
對此,林琳女士表示,作為Castleman 病的患者組織,卡斯特曼之家目前已有900余位患者及家屬加入。在成立后就和CCDN緊密合作,并在愛心企業百濟神州的支持下,在公益患教、疾病科普、患者調研和綠色就醫通道等方面進行了大量工作,并連續三年發起全國患者生存調研活動,今年的調研主要聚焦在真實地反饋患者從發病、診斷到治療的整個過程,了解疾病造成的影響,挖掘患者未被滿足的希望。
朱晶巖女士認為,針對Castleman病在內的罕見病患者面臨的挑戰,需要多方攜手合作。百濟神州將繼續秉承‘患者為先'的宗旨,與醫療機構、患者組織、專家學者以及社會各界持續合力護佑每一位患者,推動相關領域的研究和創新,密切關注包括Castleman病在內的少數患者群體的未盡之需,以期為患者的生活帶來更多積極改變。
通過全社會的努力和支持,未來才能讓罕見病不再"罕見"。《Castleman病(鈴鐺病)患者關愛倡議書》的發布在匯聚社會力量,共建罕見病精準診療體系、提升Castleman病診療水平、促進患者早診早治、改善患者生存質量等方面都具有積極的意義。它唱響了Castleman病患者充滿生機的未來,推動更多的人"看見"Castleman病,推動未來Castleman病診療領域的進步,從而讓更多的患者得到救助,沖破困境,迎接新生。
參考文獻
[1]《關于公布第一批罕見病目錄的通知》. 國衛醫發〔2018〕10號. |
[2] 2023年Castleman病患者診療現狀調研 |
[3] https://www.cn-healthcare.com/articlewm/20230517/content-1551707.html |
[4]《EUSA Pharma 和百濟神州宣布 SYLVANT®(注射用司妥昔單抗)在中國的上市申請已獲受理》 |
[5] https://mp.weixin.qq.com/s?__biz=MzA4OTI5MDkwNg==&mid=2447819318&idx=1&sn=af75ba588f4d0b29abae04f7be4ec6c7&chksm=840f43c3b378cad58b99f41d6cddc6d1d82862ecd892b3ca0d6e678f79c69b719531dc8c8bd1&scene=27 |
[6] https://baijiahao.baidu.com/s?id=1759054316287887849&wfr=spider&for=pc |
北京2023年7月19日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160;上交所代碼:688235)是一家全球性生物科技公司,公司今日與綠葉制藥集團(香港聯交所代碼:02186)聯合宣布,雙方商業化戰略合作的注射用戈舍瑞林微球(中文商標:百拓維®)已于獲批后19天內實現商業化供貨,并同步在全國多家醫院投入臨床使用,快速惠及中國前列腺癌患者。
百拓維®是目前全球首個且當前唯一獲批上市的戈舍瑞林長效微球制劑,通過綠葉制藥全球引領的創新微球技術,在給藥周期內可實現更平穩的藥物釋放,使睪酮控制效果更穩定,兼具治療效果與安全性;其改良的注射針頭直徑僅0.8毫米,可極大改善患者注射體驗。6月30日,注射用戈舍瑞林微球獲得中國國家藥品監督管理局批準,用于需要雄激素去勢治療的前列腺癌患者。(請點擊查看相關獲批新聞)
百濟神州大中華區首席商務官殷敏女士表示:"百拓維®從獲批到投入臨床使用歷時僅19天,這是百濟神州和綠葉制藥雙方強強聯合、無間協作的又一里程碑,也再次印證了百濟神州團隊在供應鏈、市場推廣等環節成熟且高效的商業化能力。未來,我們期待通過百濟神州已證的商業化實力,不但為中國患者帶來最好的治療選擇,也作為中國人給全世界帶來最好的創新藥物。"
綠葉制藥集團總裁楊榮兵先生表示:"百拓維®獲批后的第一時間,我們立即整合各部門的資源,全面加速生產和供應鏈保障,致力于以更快的速度、更優質的產品、更廣闊的覆蓋服務于廣大患者的治療所需。我們將與百濟神州保持緊密協作,持續提升百拓維®的用藥可及性,為更多患者帶去福音。"
本次百拓維®高效供應的實現,也得益于百濟神州強勁的商務能力,以及其旗下具有藥品經營質量管理規范(GSP)資質的子公司蘇濟(蘇州)醫藥有限公司(以下簡稱"蘇濟")的領先供應鏈水平和冷鏈運輸能力,僅用2天就完成了從產品接收、調撥到配送至相關醫院的全過程,以最快速度實現新產品可及。此前,蘇濟僅用1個多月成功申請到蛋肽類產品經營資格,為百拓維®的供銷做好充足準備。此舉也同時為深化百濟神州"研、產、銷"全產業價值鏈布局,滿足更多維度的產品商業化需求打好樣板。
關于前列腺癌
前列腺癌是全球第二大常見的男性癌癥,位列男性癌癥死亡數第五位,2020年新發病例約140萬例,死亡約37.5萬例[1]。近年來,中國前列腺癌發病率呈持續上升趨勢,發病率年增速為7.1%,位列男性腫瘤發病率增速首位。中國前列腺癌患者的五年生存率約為66.4%[2],相較于發達國家地區患者95%以上的五年生存率仍不理想[3]。由于前列腺癌早期癥狀并不典型,以及前列腺特異性抗原篩查的覆蓋率尚低,我國約40%~70%的前列腺癌患者在初診時已發生區域或遠處轉移[4]。以促性腺激素釋放激素激動劑為代表的雄激素剝奪治療藥物去勢是前列腺癌患者的基石治療方案,貫穿患者治療的各階段[5]。
關于百拓維®(注射用戈舍瑞林微球)
百拓維®(注射用戈舍瑞林微球)是綠葉制藥自主研發的化學藥品2.2類新藥。該創新制劑依托"先進藥物遞釋系統全國重點實驗室"微球技術平臺,以及符合中國GMP、美國cGMP及歐洲GMP的國際化生產質量體系開發和生產。2022年12月,綠葉制藥與百濟神州就百拓維®達成商業合作,后者獲得該產品在中國大陸地區研究、開發及商業化的獨家權利。綠葉制藥作為該產品上市許可持有人(MAH),并基于百濟神州預估的需求供應和生產該產品。
關于百濟神州
百濟神州是一家全球性生物科技公司,專注于為全球癌癥患者發現和開發創新抗腫瘤藥物,提高藥物可及性和可負擔性。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線。我們致力于為全球更多患者全面改善藥物可及性。百濟神州在全球五大洲打造了一支超過9,400人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。欲了解更多信息,請訪問 http://www.beigene.com.cn。
關于綠葉制藥集團
綠葉制藥集團是致力于創新藥物的研發、生產和銷售的國際化制藥公司。綠葉制藥在中國、美國和歐洲設有研發中心,擁有超過30個中國在研藥物和10多個海外在研藥物。綠葉制藥在微球、脂質體、透皮釋藥等先進藥物遞送技術領域達到國際先進水平,在新分子實體、生物抗體領域收獲多項創新成果,并在細胞治療、基因治療等領域進行了積極布局和開發。
綠葉制藥深度布局全球供應鏈體系,已在全球建有8大生產基地,并建立了與國際接軌的GMP質量管理和控制體系。公司現有30余個上市產品,產品覆蓋腫瘤、中樞神經、心血管、消化與代謝等治療領域;業務遍及全球80多個國家和地區,其中包括中國、美國、歐洲、日本等全球主要醫藥市場,以及高速增長的各地新興市場。
如需了解更多內容,請訪問:www.luye.cn
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律中定義的前瞻性聲明,包括有關百拓維®的商業化以及潛在治療獲益的表述;百濟神州對于與綠葉制藥商業化合作的預期;以及百濟神州在"關于百濟神州" 副標題下提及的百濟神州計劃、承諾、抱負和目標。由于各種重要因素的影響,實際結果可能與前瞻性聲明中的結果存在實質性差異。這些因素包括:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發、商業化及實現并保持盈利的能力;新冠肺炎疫情對百濟神州的臨床開發、監管、商業化運營、生產以及其他業務帶來的影響;以及百濟神州在最近季度報告10-Q表格中"風險因素"章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該等信息。
[1] 《2020全球癌癥報告》,國際癌癥研究機構(IARC) |
[2] Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003–15: a pooled analysis of 17 population-based cancer registries[J]. The Lancet Global Health, 2018, 6(5): e555-e567. |
[3] 《2022年全國癌癥報告》,國家癌癥中心 |
[4] 《2022年度前列腺癌基礎研究及臨床診療新進展》,潘劍,朱耀,戴波,葉定偉,復旦大學附屬腫瘤醫院泌尿外科 |
[5]《前列腺癌診療指南》(2022年版),國家衛健委 |
中國北京,美國麻省劍橋和瑞士巴塞爾2023年7月12日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160;上交所代碼:688235)是一家全球性生物科技公司,公司今日宣布美國食品藥品監督管理局(FDA)已受理布魯頓氏酪氨酸激酶抑制劑(BTKi)百悅澤®(中文通用名:澤布替尼)在美國的第5項新適應癥上市許可申請(sNDA)。
該新適應癥為澤布替尼聯合奧妥珠單抗用于治療既往至少經過二線治療后復發或難治性(R/R)濾泡性淋巴瘤(FL)成人患者。此前,該適應癥已獲得FDA授予的"快速通道"資格和"孤兒藥"認定。根據《處方藥使用者付費法案》,美國FDA預計將于2024年第一季度對該項申請做出決定。
百濟神州血液學首席醫學官Mehrdad Mobasher醫學博士及公共衛生碩士表示:"濾泡性淋巴瘤是最常見的惰性非霍奇金淋巴瘤,若患者經過二線治療后病情繼續惡化,其治療選擇往往變得非常有限。澤布替尼是首款在濾泡性淋巴瘤患者中顯示出有效性的BTK抑制劑,這令我們倍感欣慰。"
本次新適應癥的上市許可申請,是基于2期ROSEWOOD臨床試驗(NCT03332017)的結果。在該試驗的主要分析中,中位隨訪時間為12.5個月;澤布替尼與奧妥珠單抗聯合治療相較奧妥珠單抗單藥治療,在有效性方面展現出優效性,總緩解率(ORR)分別為68.3%和45.8%(p = 0.0017);18個月緩解持續時間(DOR)的無事件率可達69.3%。
此外,已遞交的澤布替尼R/R FL適應癥申請相關申報材料,已于近期開始接受歐盟和中國藥監機構的審評,并已于早先在ACCESS聯盟(ACCESS consortium)下的瑞士、英國和加拿大接受審評。
澤布替尼已在全球超過65個市場獲批多項適應癥,其中包括美國、中國、歐盟和英國、加拿大、澳大利亞、韓國、瑞士等國家和地區。其全球臨床試驗項目已在29個國家和地區入組超過4,900例受試者。
關于ROSEWOOD試驗
ROSEWOOD是一項隨機、開放性的2期臨床研究,旨在評估澤布替尼聯合奧妥珠單抗與奧妥珠單抗單藥治療既往接受過二線或以上治療的R/R FL患者。該試驗的主要終點是總緩解率(ORR),由獨立評審中心(ICR)根據盧加諾(Lugano)分類標準評估;該實驗選定的次要終點包括:研究者評估的ORR、ICR審查和研究者評估的緩解持續時間(DOR)和無進展生存期(PFS)、總生存期(OS)和安全性分析。
關于百悅澤®(澤布替尼)
澤布替尼是一款由百濟神州科學家自主研發的布魯頓氏酪氨酸激酶(BTK)小分子抑制劑,目前正在全球進行廣泛的臨床試驗項目,作為單藥和與其他療法進行聯合用藥治療多種B細胞惡性腫瘤。由于新的BTK會在人體內不斷合成,澤布替尼的設計通過優化生物利用度、半衰期和選擇性,實現對BTK蛋白完全、持續的抑制。憑借與其他獲批BTK抑制劑存在差異化的藥代動力學特征,澤布替尼已被證明能在多個疾病相關組織中抑制惡性B細胞增殖。
關于百濟神州
百濟神州是一家全球性生物科技公司,專注于為全球癌癥患者發現和開發創新抗腫瘤藥物、提高藥物可及性和可負擔性。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線。我們致力于為全球更多患者全面改善藥物可及性。百濟神州在全球五大洲打造了一支超過9,400人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。欲了解更多信息,請訪問www.beigene.com.cn。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律中定義的前瞻性聲明,包括關于百濟神州推進澤布替尼未來開發、藥政申報和批準,特別是用于R/R FL的治療的聲明、商業化和市場準入以及百濟神州在"關于百濟神州"標題下提及的計劃、承諾、抱負和目標。由于各種重要因素的影響,實際結果可能與前瞻性聲明中的結果存在實質性差異。這些因素包括:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發、商業化及實現并保持盈利的能力;新冠肺炎全疫情對百濟神州的臨床開發、監管、商業化運營、生產以及其他業務帶來的影響;以及百濟神州在最近季度報告10-Q表格中"風險因素"章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該些信息。
]]>
為中國前列腺癌患者帶來兼具療效、安全及用藥體驗的雄激素剝奪治療藥物新選擇
北京2023年7月4日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160;上交所代碼:688235)是一家全球性生物科技公司,公司今日與綠葉制藥集團(香港聯交所代碼:02186)宣布,綠葉制藥自主研發的創新制劑——注射用戈舍瑞林微球(中文商標:百拓維®)已于2023年6月30日獲得中國國家藥品監督管理局批準,用于需要雄激素去勢治療的前列腺癌[ET1] 患者。該產品為全球首個且當前唯一獲批上市的戈舍瑞林長效微球制劑;同時,百濟神州與綠葉制藥雙方將正式就該產品商業化開展戰略合作。
全球唯一,臨床優勢顯著
前列腺癌是全球發病率第二和死亡率第五的男性癌癥。中國前列腺癌呈逐年高發態勢,發病率年增速達7.1%,位列男性腫瘤首位[1],嚴重威脅男性健康與生活質量。
復旦大學附屬腫瘤醫院副院長、泌尿腫瘤MDT首席專家葉定偉教授表示:“以促性腺激素釋放激素(GnRH)激動劑為代表的雄激素剝奪治療是前列腺癌患者治療的基石方案,但使用皮下植入劑的傳統治療方案對注射環境以及醫護人員培訓有一定要求,注射難度較大,患者疼痛及心理護理工作量相對繁重,影響治療依從性。百拓維®升級的微球劑型和改良的注射方式,能夠兼顧療效、安全和患者體驗,為前列腺癌臨床治療提供了更便捷的新選擇[2]。”
百拓維®通過創新的微球技術,在給藥周期內可實現更平穩的藥物釋放,使睪酮控制效果更穩定,保證治療效果與安全性;其改良的注射針頭直徑僅0.8毫米,可極大改善患者注射體驗。百拓維®用于前列腺癌治療的3期臨床試驗結果表明,其臨床療效與對照藥相當,安全性方面與對照藥特征相似,可顯著減少注射部位不良反應發生率和嚴重程度,從而提升患者的耐受性和依從性,具有明顯的臨床優勢[2]。
強強聯合,重塑市場,服務更多患者所需
前列腺癌嚴重影響患者的身心健康,降低患者健康相關生活質量,約40%[3]的患者家屬患有抑郁或焦慮。目前,戈舍瑞林已上市的劑型為皮下植入劑。在確保藥物療效與安全性的前提下,患者期待更好的治療體驗。
為了盡快將這一新的治療選擇帶給更多有需要的患者,百濟神州與綠葉制藥就百拓維®達成商業合作,獲得該產品在中國大陸地區研究、開發及商業化的獨家權利;綠葉制藥將作為該產品上市許可持有人(MAH),并將基于百濟神州預估的需求供應和生產該產品。百濟神州是一家全球性生物科技公司,專注于為全球癌癥患者發現和開發創新抗腫瘤藥物,提高藥物可及性和可負擔性,其在中國已搭建了超過3000人的商業化團隊,擁有共17款全球引領的商業化產品,廣泛覆蓋實體瘤、血液瘤領域各高發瘤種。
百濟神州總裁、首席運營官兼中國區總經理吳曉濱博士表示:“我們很高興看到本次百拓維®獲批前列腺癌適應癥,并相信通過與綠葉制藥的強強聯手,百濟神州必將發揮其中國商業化團隊的已證實力,為更多中國患者提供有效、安全且用藥體驗更佳的全球好藥。作為全新一代的全球性生物科技企業,百濟神州專注于開發和商業化創新、可負擔的抗腫瘤藥物,并致力于通過強大的自主研發能力和外部戰略合作,借助不斷加強的產品組合優勢,為盡可能多的患者提供高品質的創新藥物。”
綠葉制藥集團執行主席劉殿波表示:“綠葉制藥致力于通過提供具有臨床價值的、差異化的創新產品,為改善患者的臨床獲益而不懈努力。百拓維®作為當前唯一獲批上市的戈舍瑞林微球制劑,再次印證了我們以領先的微球技術平臺服務于患者所需的決心與承諾。我們期待與百濟神州的緊密合作,共同助推這一創新治療選擇以更快的速度、更廣泛的覆蓋惠及更多有需要的人群。”
除了前列腺癌,百拓維®用于治療乳腺癌的新藥上市許可申請也在中國處于審評階段。IQVIA數據顯示:2022年中國促性腺激素釋放激素激動劑產品的市場總值約為人民幣95億元,2018年至2022年的復合年均增長率為17.7%。基于大量未被滿足的患者需求,預計百拓維®上市后將擁有廣闊的市場前景。
關于前列腺癌
前列腺癌是全球第二大常見的男性癌癥,位列男性癌癥死亡數第五位,2020年新發病例約140萬例,死亡約37.5萬例[4]。近年來,中國前列腺癌發病率呈持續上升趨勢,發病率年增速為7.1%,位列男性腫瘤首位。中國前列腺癌患者的五年生存率約為66.4%[5],相較于發達國家地區患者95%以上的五年生存率仍不理想[6]。由于前列腺癌早期癥狀并不典型,以及前列腺特異性抗原篩查的覆蓋率尚低,我國約40%~70%的前列腺癌患者在初診時已發生區域或遠處轉移[7]。以促性腺激素釋放激素激動劑為代表的雄激素剝奪治療藥物去勢是前列腺癌患者的基石治療方案,貫穿患者治療的各階段[8]。
關于百拓維®(注射用戈舍瑞林微球)
百拓維®(注射用戈舍瑞林微球)是綠葉制藥自主研發的化學藥品2.2類新藥。該創新制劑依托“先進藥物遞釋系統全國重點實驗室”微球技術平臺,以及符合中國GMP、美國cGMP及歐洲GMP的國際化生產質量體系開發和生產,也是目前全球唯一擁有前列腺癌適應癥中國人群療效及安全性3期隨機對照臨床數據的GnRH激動劑。
關于百濟神州
百濟神州是一家全球性生物科技公司,專注于為全球癌癥患者發現和開發創新抗腫瘤藥物,提高藥物可及性和可負擔性。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線。我們致力于為全球更多患者全面改善藥物可及性。百濟神州在全球五大洲打造了一支超過9,400人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。欲了解更多信息,請訪問http://www.beigene.com.cn。
關于綠葉制藥集團
綠葉制藥集團是致力于創新藥物的研發、生產和銷售的國際化制藥公司。綠葉制藥在中國、美國和歐洲設有研發中心,擁有超過30個中國在研藥物和10多個海外在研藥物。綠葉制藥在微球、脂質體、透皮釋藥等先進藥物遞送技術領域達到國際先進水平,在新分子實體、生物抗體領域收獲多項創新成果,并在細胞治療、基因治療等領域進行了積極布局和開發。
綠葉制藥深度布局全球供應鏈體系,已在全球建有8大生產基地,并建立了與國際接軌的GMP質量管理和控制體系。公司現有30余個上市產品,產品覆蓋腫瘤、中樞神經、心血管、消化與代謝等治療領域;業務遍及全球80多個國家和地區,其中包括中國、美國、歐洲、日本等全球主要醫藥市場,以及高速增長的各地新興市場。
如需了解更多內容,請訪問:www.luye.cn
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律中定義的前瞻性聲明,包括有關百拓維®的商業化以及潛在治療獲益的表述;百濟神州對于與綠葉制藥商業化合作的預期;以及百濟神州在“關于百濟神州” 副標題下提及的百濟神州計劃、承諾、抱負和目標。由于各種重要因素的影響,實際結果可能與前瞻性聲明中的結果存在實質性差異。這些因素包括:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發、商業化及實現并保持盈利的能力;新冠肺炎疫情對百濟神州的臨床開發、監管、商業化運營、生產以及其他業務帶來的影響;以及百濟神州在最近季度報告10-Q表格中“風險因素”章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該等信息。
[1] ZHENG R S,et al.Cancer incidence and mortality in China, 2016[J]. JNCC, 2022.2(1):1-9 |
[2] 注射用戈舍瑞林微球治療前列腺癌3期臨床結果,Chinese Medical Journal |
[3] 江濤、肖連珍、丁亞嵐、高靜、陳雪蓮、湛海倫,2022,“晚期前列腺癌患者家庭成員焦慮和抑郁狀態的調查研究“,廣州醫科大學學報,Vol. 50 No. 5 |
[4] 《2020全球癌癥報告》,國際癌癥研究機構(IARC) |
[5] Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003–15: a pooled analysis of 17 population-based cancer registries[J]. The Lancet Global Health, 2018, 6(5): e555-e567. |
[6] 《2022年全國癌癥報告》,國家癌癥中心 |
[7] 《2022年度前列腺癌基礎研究及臨床診療新進展》,潘劍,朱耀,戴波,葉定偉,復旦大學附屬腫瘤醫院泌尿外科 |
[8] 《前列腺癌診療指南》(2022年版),國家衛健委 |