北京2023年1月19日 /美通社/ -- 類風濕關節炎(RA)是一種以侵蝕性關節炎癥為主要臨床表現的慢性、高致殘性自身免疫病,患者往往表現為關節腫痛,病情多反復且逐漸加重,最終導致關節結構破壞進而致殘,嚴重影響患者的身體機能、生活質量和社會功能。
流行病學數據顯示,RA是我國最常見的系統性風濕病,患者總數約達500萬人,疾病負擔頗為沉重[1-2]。此外,由于診治延誤、中-重癥多、合并癥多等原因,我國RA患者的診療現狀并不理想,患者亟需更有效的治療手段。而近年來涌現的一些RA創新治療藥物,例如精準靶向清除B細胞的利妥昔單抗,有望改善RA的臨床治療結局,為患者帶來新的希望。
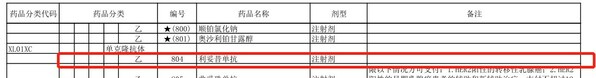
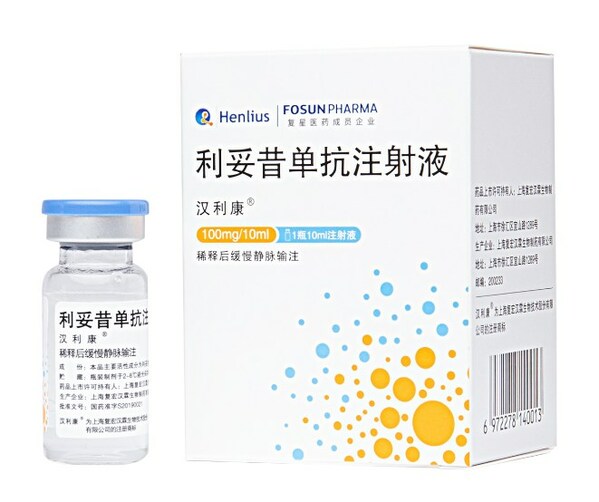
2023年01月18日,國家醫保局正式公布了《國家基本醫療保險、工傷保險和生育保險藥品目錄(2022年)》(下文簡稱"國家醫保目錄"),讓RA患者迎來了期盼已久的好消息:國內首個生物類似藥,也是國內目前唯一獲批RA適應癥的復星醫藥利妥昔單抗漢利康(HLX01)新增RA適應癥成功進入本次國家醫保目錄,將大幅減輕RA患者的治療負擔,讓這款強效安全的創新藥物惠及更多患者!
漢利康®2019年2月獲國家藥品監督管理局(NMPA)批準上市,用于非霍奇金淋巴瘤和慢性淋巴細胞白血病的治療,全面覆蓋了原研利妥昔單抗在中國獲批的所有適應癥。由于原研利妥昔單抗的RA適應癥在中國尚未獲批,漢利康®又針對類風濕關節炎治療進行了積極探索,并基于關鍵臨床研究結果于2022年3月正式獲NMPA批準,與甲氨蝶呤聯合用于對一種及以上TNF-α抑制劑療效不佳的中重度活動性RA成人患者。
強效安全、長效便捷,漢利康®強勢入局RA治療
漢利康®獲批治療中重度活動性RA適應癥,是基于隨機、雙盲、安慰劑對照臨床III期研究HLX01-RA03的結果,該研究評估了在甲氨蝶呤治療應答不完全(MTX-IR)的中重度活動性RA患者中,漢利康®聯合MTX治療對比安慰劑+MTX治療的有效性和安全性。
HLX01-RA03這項關鍵臨床III期研究證實,漢利康®聯合MTX相較于安慰劑,在MTX治療應答不完全的我國中重度活動性RA患者中,具有顯著的臨床療效和良好的安全性,是RA患者安全有效的治療選擇。
精準靶向清除B細胞,是漢利康®的制勝關鍵
漢利康®治療RA的作用機制,是通過與B細胞表面的CD20特異性結合,通過抗體依賴細胞介導的細胞毒性作用(ADCC)、補體依賴的細胞毒性作用(CDC)和誘導凋亡三種機制,精準靶向清除與RA發病有關的B細胞。 [5]。
目前國內外RA診療指南中,普遍推薦將利妥昔單抗用于RA三線治療,即用于對腫瘤壞死因子-α(TNF-α)抑制劑治療應答不佳人群;或用于特殊RA患者的治療,即類風濕因子(RF)/抗瓜氨酸抗體(CCP)陽性、合并間質性肺病(ILD)等情況。
漢利康®治療僅需每年給藥兩次,每次藥效持續可達6個月,而更低的用藥頻次往往意味著患者對治療的依從性更好、持續用藥比例更高,在HLX01-RA03研究中,有近85%的患者完成了為期48周的研究治療。因此漢利康®相較其他治療方案具備療效持久、用藥便捷的優勢,大大提升患者治療依從性。
漢利康®RA適應癥本次成功入圍國家醫保目錄,將為上述患者群體提供更加強效安全、長效便捷的治療選擇。作為國內首個且唯一獲批RA適應癥的利妥昔單抗,漢利康®開啟了中國B細胞靶向治療RA的新時代。此次新增RA適應癥納入國家醫保目錄,患者治療費用大幅降低,將讓更多患者享受到更加強效安全、長效便捷的創新治療藥物,滿足患者迫切的臨床需求,助力RA的"長治久安"!
參考文獻:
[1] 田新平, 李夢濤, 曾小峰. 我國類風濕關節炎診治現狀與挑戰:來自中國類風濕關節炎2019年年度報告[J]. 中華內科雜志, 2021, 60(07): 593-598. [2] 耿研, 謝希, 王昱, 等. 類風濕關節炎診療規范[J]. 中華內科雜志, 2022, 61(01): 51-59. [3] Zeng X, Liu J, Liu X, et al. Efficacy and safety of HLX01 in patients with moderate-to-severe rheumatoid arthritis despite methotrexate therapy: a phase 3 study[J]. Arthritis Research & Therapy, 2022, 24: 136. [4] Wu F, Gao J, Kang J, et al. B Cells in Rheumatoid Arthritis: Pathogenic Mechanisms and Treatment Prospects[J]. Frontiers in Immunology, 2021,12: 750753. [5] Xu Y, Xie L, Zhang E, et al. Physicochemical and functional assessments demonstrating analytical similarity between rituximab biosimilar HLX01 and the MabThera®[C]//MAbs, 2019, 11(3): 606-620. |
蘇可欣®創新選擇,開啟慢性肝病血小板減少癥治療新紀元
中國是肝病高發國家,眾多肝病患者,進展為肝纖維化,肝硬化,甚至發展為肝癌。據統計我國約700萬肝硬化患者,年新發46萬肝癌患者[1]。近年來,在廣大肝病醫務工作者的共同努力下,肝病診療及防治工作取得了長足進步,但仍面臨很多挑戰。臨床上,慢性肝病相關血小板減少癥是常見并發癥,其中肝硬化患者77%-85%合并血小板減少[2]。蘇可欣上市前沒有相關適應癥藥物,大多依靠血小板輸注,但輸血可及性差,感染風險高,多次輸注后,容易出現輸注無效現象。另外,近年來疫情肆虐,輸血僅僅能滿足部分危重患者,廣大慢性肝病合并血小板減少癥患者,急需更優且可及的治療方案。
生命所托,使命驅動。2020年,蘇可欣®在中國商業上市,獲批用于擇期行診斷性操作或者手術的慢性肝病相關血小板減少癥的成年患者治療,全面填補中國慢性肝病相關血小板減少癥治療領域用藥空白,成為中國首個且唯一獲批用于慢性肝病相關血小板減少癥的藥物,引起醫學界的廣泛關注,給患者帶來福音[3]。
蘇可欣®作為口服小分子TPO受體激動劑,極大提高患者服藥的便利性和依從性,解決慢性肝病相關血小板減少癥診療的臨床痛點。自上市以來,蘇可欣®先后獲得全球五大指南、中國一大指南、五大共識一致推薦,開啟慢性肝病相關血小板減少癥治療新紀元[4-14]。
蘇可欣®用心守護,成功續約醫保,造福中國患者
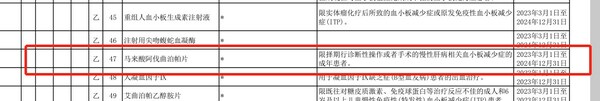
復星醫藥始終積極踐行企業社會責任,實時關注治療效果和經濟可及性。2020年12月28日,蘇可欣®正式納入國家醫保目錄,降價超過50%,并于2021年3月1日在全國正式實施,大大提升了患者的用藥可及性,幫助更多患者受益于國際領先的治療選擇,讓新治療方案觸手可及[15]。
在2022年度國家新一輪醫保談判中,蘇可欣®成功續約,繼續造福中國患者,幫助中國患者實現全民醫保、全程獲益,惠及更多中國人民,全力支持‘健康中國2030'美好藍圖早日實現!
參考文獻:
[1] Xiao J, et al. J Hepatol. 2019 Jul; 71(1): 212-221. [2] 韓美玲,陳平. 肝硬化并發血小板減少患者的抗病毒治療[J]. 實用肝臟病雜志, 2019,22(4):466-469. [3] 馬來酸阿伐曲泊帕片說明書. 2020.04.14. [4] Northup PG, et al. Gastroenterol Hepatol. 2019 Mar;17(4):595-606. [5] Simonetto DA, et al. Am J Gastroenterol. 2020 Jan;115(1):18-40. [6] Neuberger J, et al. Gut. 2020 Aug;69(8):1382-1403. [7] NCCN Guidelines Version 1. 2022. Hematopoietic Growth Factors. [8] Society for Immunotherapy of Cancer (SITC) clinical practice guideline on immune checkpoint inhibitor- related adverse events [9] 中國臨床腫瘤學會(CSCO). 腫瘤治療所致血小板減少癥診療指南(2022版) [10] 張華鵬,張嘉凱,胡博文.成人肝移植受者圍術期凝血功能管理專家共識(2021版)[J].實用器官移植電子雜志,2021,9(02):89-94. [11] 孫惠川,謝青,莢衛東,趙明,劉秀峰,畢新宇,黎功,白雪莉,紀元,徐立,王征,朱小東.肝癌轉化治療中國專家共識(2021版)[J].中國實用外科雜志,2021,41(06):618-632. [12] 肖亮.肝臟穿刺活檢湘雅專家共識[J].中國普通外科雜志,2021,30(01):1-8. [13] 陳韜 ,寧琴.終末期肝病合并感染診治專家共識(2021年版)[J].臨床肝膽病雜志,2022,38(02):304-310. [14] 中華醫學會腫瘤學分會腫瘤支持康復治療學組. 腫瘤治療相關血小板減少癥的臨床管理專家共識[J]. 腫瘤, 2021, 41(12):812-827. [15] 國家醫保局. 人力資源社會保障部關于印發《國家基本醫療保險、工傷保險和生育保險藥品目錄(2020年)》的通知. http://www.nhsa.gov.cn/art/2020/12/28/art_37_4220.html |
此次奈妥匹坦帕洛諾司瓊膠囊被納入醫保目錄意義重大,其作為全球唯一擁有5-HT3受體拮抗劑和NK1受體拮抗劑組合物專利,且迄今唯一國談成功的進口原研止吐藥物,配合其"強強聯合,一步到位"的特點3,4,將有力推動我國CINV規范化預防的發展。
起始規范 撥云見日
CINV是腫瘤化療最令患者恐懼的不良反應。國內外指南均指出:CINV重在預防,針對HEC/ MEC合并高危因素的患者,均推薦使用三聯方案(5-HT3RA+NK-1RA+地塞米松)進行急性、延遲性CINV的全程預防5,6。然而,由于三聯方案用藥繁瑣,每化療周期用藥次數多,給藥途徑復雜,以及之前NK1受體拮抗劑均未進入醫保目錄,可及性不足等問題,從而導致了中國指南依從性僅為21.5%11,三聯用藥比例低,進而大大影響了患者CINV的有效控制。研究顯示,目前臨床常規使用的5-HT3聯合地塞米松二聯方案普遍延遲性CINV CR率僅為45%~57%,大部分用藥后延遲性CINV發生率仍高達50%以上12。在化療起始階段, CINV標準預防未被正確、規范的應用會引發后續延遲性惡心嘔吐管理難、惡心嘔吐風險成倍增加13-14、由于控制不佳而增加額外治療成本等問題。故首個化療周期即規范預防CINV將極大解決目前的管理痛點。
強強聯合,一步到位
奈妥匹坦帕洛諾司瓊膠囊(奧康澤®)是新型長效NK1受體拮抗劑奈妥匹坦和唯一第二代5HT3受體拮抗劑帕洛諾司瓊的雙通道復方制劑2,是目前全球唯一被證實具有協同增效作用的止吐藥物組合,半衰期長達96h,"強強聯合"可以得到"1+1>2"的療效15-20。有研究結果顯示,奈妥匹坦帕洛諾司瓊膠囊對于CINV全程無挽救治療率高達96.6%,對于延遲性CINV無挽救治療率高達97.6%,每日無顯著惡心率達86%以上,第3-5天每日無爆發性CINV的發生率更低,顯著優于阿瑞匹坦+格拉司瓊組21。
顯然,奈妥匹坦帕洛諾司瓊膠囊(奧康澤®)是全球唯一1粒膠囊即可同時管理急性、延遲性CINV的藥物,輕松實現5天CINV保護,可起始即規范,全程強效,"一步到位"預防CINV。其此次被納入《2022版國家醫保目錄》有望改變我國CINV的防治現狀,是CINV起始即規范預防的優選藥物。
指南推薦,醫保在冊
基于奈妥匹坦帕洛諾司瓊膠囊在臨床試驗及真實世界的數據結果,在包括中國臨床腫瘤學會(CSCO)與美國國立綜合癌癥網絡(NCCN)等各大權威協會的止吐指南中,對HEC/MEC方案所致的CINV,均推薦使用奈妥匹坦帕洛諾司瓊膠囊進行預防5,6。
奈妥匹坦帕洛諾司瓊膠囊此次被納入國家醫保目錄,彰顯了國家對于腫瘤支持治療的重視與對患者生活質量的關注,納入醫保后,"起始即規范預防CINV"有望成為臨床實踐新標準,讓患者"一步到位",以更少的花費,更便捷的治療方案獲得性價比更高的CINV全程管理22-25。同時,奈妥匹坦帕洛諾司瓊膠囊可以有效減少腫瘤患者因化療所致不良反應而導致的治療延遲與額外的醫療支出,讓腫瘤患者實現延長生存時間與保證生活質量的"雙贏"。
期待奈妥匹坦帕洛諾司瓊膠囊進入國家醫保目錄后,進一步提高臨床可及性,真正讓每一位需要化療的腫瘤患者都能不懼化療,更早獲益,在確保患者能順利完成腫瘤治療的同時,提升患者的生命質量,助力我國腫瘤治療事業不斷進步,共同為實現"健康中國2030"的目標而努力前進。
【參考文獻】
1妥匹坦帕洛諾司瓊膠囊(奧康澤®)說明書2021年9月2日版. 2Navari RM and Aapro M. N Engl J Med 2016;374:1356-67. 3Thomas AG et al. Exp Brain Res. 2014 Aug;232(8):2637-44. 4Zhang L, et al. Ann Oncol. 2018;29(2):452-458. 5中國臨床腫瘤學會(CSCO)抗腫瘤治療相關惡心嘔吐預防及治療指南(2019). 6NCCN clinical practice guidelines in oncology, Antiemesis V1,2019. 7Roila F, et al. Ann Oncol. 2016; 27(suppl 5): v119-v133. 8Hesketh PJ, et al. J Clin Oncol. 2017; 35(28): 3240-3261. 9中國藥學會醫院藥學專業委員會. 中國醫院藥學雜志. 2022;42(5):457-473. 10中華醫學雜志 2022;102(39):3080-3094. 11Sun Y, et al. J Cancer Res Clin Oncol. 2021 Sep;147(9):2701-2708. 12Schwartzberg L,et al.Support Care Cancer. 2014 Feb;22(2):469-77. 13Molassiotis A, et al. J Pain Symptom Manage. 2016, 51(6) 987-993. 14Kim HK, et al. Support Care Cancer. 2015;23(1):293-300. 15Rojas C et Slusher BS. Eur J Pharmacol. 2012 Jun 5;684(1-3):1-7. 16Rojas C, et al. Eur J Pharmacol. 2010 Jan 25;626(2-3):193-9. 17Rojas C et al.J Pharmacol Exp Ther.2010 Nov;335(2):362-8. 18Stathis M et al. Eur J Pharmacol. 2012 Aug 15;689(1-3):25-30. 19Thomas AG et al. Exp Brain Res. 2014 Aug;232(8):2637-44. 20Lorusso V. Ther Clin Risk Manag. 2016 Jun 7;12:917-25. 21L Zhang, et al. Ann Oncol, 2018,29(2), 452-458. 22Park SH, et al. J Med Econ 2019;22:840-7. 23Restelli U, et al. BMJ Open. 2017,7(7):e015645. 24董涼涼, 等. 中國現代應用藥學. 2022;39(17): 2257-61. 25Lorusso V. Ther Clin Risk Manag. 2016 Jun 7;12: 917-25. |
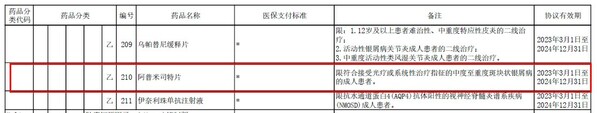
2023年01月18日,國家醫保局正式公布了《國家基本醫療保險、工傷保險和生育保險藥品目錄(2022年)》(下文簡稱"國家醫保目錄")。值得銀屑病患者振奮的是,阿普米司特成功進入國家醫保目錄,不僅充分反映了國家對該藥為患者帶來獲益的認可,更是大幅減輕了患者的治療負擔,進一步推動了醫療創新成果的可及性。
面面俱到:療效與安全性雙優,為進入醫保奠定堅實基礎
多年來,探索銀屑病的治療問題一直是臨床醫生和患者共同關注的難題。甲氨蝶呤、環孢素等傳統藥物雖可緩解病情但卻無法明顯改善癥狀,使其臨床應用受到限制。生物制劑的問世,為銀屑病患者帶來全新體驗,但仍面臨著長期使用導致療效衰減以及注射給藥不便等相關問題。對于如何實現對銀屑病快速、持久、安全的治療,PDE4抑制劑阿普米司特通過多項權威研究給出了滿意答案。
關鍵性臨床III期研究ESTEEM 1[1]和ESTEEM 2[2]納入了1255例中重度銀屑病患者,研究數據顯示,在ESTEEM 1研究中,連續接受阿普米司特治療52周的患者, PASI(銀屑病面積和嚴重程度指數)評分在第32~52周較基線改善了81%~88%,并且61%(47/77)在第52周時達到PASI 75;ESTEEM 2研究中持續接受阿普米司特治療的61例患者,則有80%在第52周時達到PASI 50,67%(2/3)達到PASI 75。
三年長期隨訪結果也顯示,阿普米司特治療銀屑病安全性良好,未出現肝腎毒性與骨髓抑制等嚴重不良反應,也未出現結核復發;常見的不良反應包括腹瀉與惡心等,大部分為輕中度,且多可于2~4周內緩解。
"特"立同行:聚焦特殊人群與特殊部位,助力疾病科學管理
銀屑病可見于任何年齡或時期,臨床上可以見到兒童銀屑病、老年銀屑病、孕婦銀屑病、哺乳期銀屑病等多種特殊人群銀屑病。另外,對于特殊部位的銀屑病患者,如頭面部、掌跖部位、指甲、隱私部位,嚴重影響患者的社交、工作等多方面,他們有著更為強烈的治療需求,追求更高的治療目標。針對銀屑病特殊人群和特殊部位,阿普米司特也積累了相當優秀的研究數據。
在2022年歐洲皮膚病與性病學會(EADV)年會上,阿普米司特3期SPROUT研究[4]結果提示,阿普米司特可有效改善中重度斑塊狀銀屑病兒童患者的病情,且未發現新的安全問題。老年銀屑病患者方面,Roberta教授在相關綜述中指出,阿普米司特由于其令人滿意的安全性和藥物相互作用的低風險,可作為一個合適的治療選擇[3]。
在改善特殊部位銀屑病的過程中,阿普米司特也展現出顯著的療效和良好的耐受性。分析結果顯示無論患者的性別和既往是否使用過系統治療或生物制劑治療,阿普米司特均能改善特殊部位[可見位置(手背、面部、發際線和頸部)、頭皮、指甲、生殖器區域和掌跖區域]銀屑病患者的生活質量[7]。
躬行實踐:從權威指南到口服應用,引領治療新方向
基于豐富的循證證據,阿普米司特先后得到多個國際指南的認可。《2020歐洲指南:尋常型銀屑病的系統治療—第1部分:治療和監測建議》指出,對于系統治療不足或有禁忌,希望使用口服藥治療的患者,推薦使用阿普米司特[4];《2020歐洲指南:尋常型銀屑病的系統治療—第2部分:臨床特殊及合并癥情況》,推薦阿普米司特用于有癌癥病史者,輕中度腎功能不全者,潰瘍性結腸炎,心力衰竭,潛伏期結核/結核病史患者[5]。除此之外,《2020 AAD-NPF指南》[6],《2019日本銀屑病生物治療指南》[7]及《2018德國S3指南》[8]也都一致推薦阿普米司特可作為成人中重度銀屑病的治療選擇。
不僅如此,在追求精準靶向、以患者為中心的個體化用藥需求的時代下,阿普米司特為那些更偏好口服藥物治療或者不耐受/不愿意使用生物制劑治療以及一部分特殊類型的銀屑病患者提供了更多選擇。尤其是在疫情放開的當下,阿普米司特口服給藥的形式,在便捷性、依從性方面都更具優勢。
中國醫科大學附屬第一醫院高興華教授表示,"銀屑病治療困難且尚無治愈方法,已成為一項嚴重的全球性難題。阿普米司特具有療效好、安全性和依從性高的優勢,是業界治療銀屑病"口服藥的天花板",值得在銀屑病患者中推廣使用。"安徽醫科大學第一附屬醫院張學軍教授也指出,"阿普米司特安全性好,用藥前無需進行篩查,患者依從性高,同時療效令人滿意,未來將會廣大的造福中國銀屑病人群。"
阿普米司特兼顧持久療效與良好安全性,給廣大特殊人群與特殊部位的銀屑病患者帶來了治療新思路。同時,阿普米司特還得到多個權威指南的推薦,再一次鞏固了其在銀屑病領域的地位。此次阿普米司特挺進國家醫保目錄,更是讓其用藥門檻進一步降低,價格優勢上也更為突出。相信在不久的將來,阿普米司特能夠"飛"進尋常百姓家,為廣大患者的健康護航。
參考文獻:
[1]Papp K, Reich K, Leonardi C L, et al. Apremilast, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: results of a phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1)[J]. Journal of the American Academy of Dermatology, 2015, 73(1): 37-49.
[2]Paul C, Cather J, Gooderham M, et al. Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in patients with moderate–to–severe plaque psoriasis over 52 weeks: a phase III, randomized controlled trial (ESTEEM 2)[J]. British Journal of Dermatology, 2015, 173(6): 1387-1399.
[3]Di Caprio R, Caiazzo G, Cacciapuoti S, Fabbrocini G, Scala E, Balato A. Safety concerns with current treatments for psoriasis in the elderly. Expert Opin Drug Saf. 2020;19(4):523-531.
[4]Mrowietz U, Barker J, Conrad C, et al. Efficacy and Safety of Apremilast in Patients With Limited Skin Involvement, Plaque Psoriasis in Special Areas, and Impaired Quality of Life: Results From the EMBRACE Randomized Trial[J]. Journal of the European Academy of Dermatology and Venereology, 2022,Oct 27.
[5]EuroGuiDerm Guideline on the systemic treatment of Psoriasis vulgaris - Part 1: treatment and monitoring recommendations.JEADV. 2020 Nov;34(11):2461-2498.
[6]EuroGuiDerm Guideline on the systemic treatment of Psoriasis vulgaris - Part 2: specific clinical and comorbid situations.JEADV 2021, 35, 281–317.
[7]Chat VS, Uppal SK, Kearns DG, Han G, Wu JJ. Translating the 2020 AAD-NPF Guidelines of Care for the Management of Psoriasis With Systemic Nonbiologics to Clinical Practice. Cutis. 2021;107(2):99-103.
[8]Saeki H, Terui T, Morita A, et al. Japanese guidance for use of biologics for psoriasis (the 2019 version). J Dermatol. 2020;47(3):201-222.