TNBC
9月27日下午,中國醫學科學院腫瘤醫院的徐兵河院士于創新藥物臨床數據專場就蘆康沙妥珠單抗(sac-TMT)對比研究者選擇的化療治療轉移性三陰性乳腺癌(TNBC)OptiTROP-Breast01 III期臨床研究結果進行了口頭報告和論文討論。
根據盲態獨立評審委員會(BICR)的評估結果,蘆康沙妥珠單抗組(130例)中位PFS為6.7個月,化療組(133例)為2.5個月,蘆康沙妥珠單抗相比化療發生疾病進展或死亡的風險降低68%(HR=0.32,95% CI:0.22~0.44)。與化療組相比,蘆康沙妥珠單抗組在各亞組中PFS均顯著延長,與總體人群獲益一致。在TROP2高表達(H評分>200)的患者中觀察到更好的PFS獲益趨勢,sac-TMT組和化療組的中位PFS分別為8.3和2.3個月(HR 0.29 ,95% CI: 0.19, 0.46)。OS期中分析顯示,sac-TMT組的中位OS尚未達到(95% CI:11.2,NE),化療組的中位OS為9.4個月(95% CI:8.5,11.7);HR為0.53(95% CI:0.36,0.78)(P=0.0005),sac-TMT相比化療發生死亡的風險降低47%。與研究者選擇的化療相比,sac-TMT治療轉移性TNBC患者的PFS和OS均顯示出統計學意義和臨床意義的顯著改善,且安全性可控,有望成為這類患者新的有效治療選擇。
徐兵河院士表示:"乳腺癌是全球高發的惡性腫瘤,威脅著女性的生命健康,其中,三陰性乳腺癌預后差,生存期短。晚期三陰性乳腺未來的治療發展方向是精準分層治療,蘆康沙妥珠單抗有助于滿足患者更多的治療需求,未來或有望成為晚期三陰性乳腺癌二線治療的新標準。對于ADC的研發,國內企業經歷了趕跑和并跑的階段,現如今已經成為全球ADC創新技術的重要力量,相信終有一日,晚期三陰乳腺癌患者可以通過ADC創新藥物獲得更加有效的治療。"
NSCLC
于9月28日下午,中山大學附屬腫瘤醫院的方文峰教授于創新藥物臨床數據專場口頭報告了蘆康沙妥珠單抗(sac-TMT)聯合KL-A167(抗PD-L1單抗)一線治療驅動基因陰性晚期非小細胞肺癌(NSCLC)患者:OptiTROP-Lung01 II期研究結果并進行了論文討論。
研究以非隨機方式接受sac-TMT 5 mg/kg Q3W + KL-A167 1200 mg Q3W(隊列1A,40例患者)或sac-TMT 5 mg/kg Q2W + KL-A167 900 mg Q2W(隊列1B,63例患者)治療。隊列1A 的中位隨訪時間為14.0個月,ORR為48.6%(18/ 37,2例待確認),DCR 為94.6%,中位PFS為15.4個月(95% CI: 6.7, NE),6個月PFS率為69.2%;隊列1B的中位隨訪時間為6.9個月,ORR為77.6%(45/58,5例待確認),DCR為100.0%,中位PFS未達到,6個月PFS率為84.6%。隊列1B亞組分析結果顯示,在不同PD-L1表達水平和組織學類型中均表現出積極的抗腫瘤療效。
方文峰教授表示:"ADC藥物的出現,具有劃時代意義。蘆康沙妥珠單抗聯合免疫治療的雙藥方案正在引領晚期NSCLC一線治療探索的新方向,初步研究數據觀察到了非常驚艷的療效。未來,蘆康沙妥珠單抗在NSCLC治療領域應用潛力值得期待,無論是在驅動基因陰性還是EGFR突變的患者群體中,蘆康沙妥珠單抗有望為更多患者提供多樣化的治療選擇,并帶來更好的生存獲益。"
CC
9月28日上午,湖南省腫瘤醫院的王靜教授在大會論文口頭報告專場分享了蘆康沙妥珠單抗(sac-TMT)聯合帕博利珠單抗(可瑞達®)治療復發或轉移性宮頸癌(CC)患者的療效及安全性臨床研究結果。研究納入了含鉑雙藥化療失敗的2線或3線復發或轉移性宮頸癌患者, 38例患者中位隨訪時間為6.2個月,ORR為57.9%(22/38,3例未確認)。在接受抗PD-1療法的患者中亦觀察到緩解(ORR為68.8%,11/16)。中位無進展生存期(PFS)未達到,6個月PFS率為65.7%。
王靜教授表示:"宮頸癌高表達TROP2,既往研究提示過表達比例達90%以上,TROP2高表達與腫瘤患者的不良預后密切相關,也可能和部分藥物治療敏感性相關,是一個很好探索靶點。相信隨著這些可喜成果的出現,未來婦科腫瘤領域會有更多的研究涌現來進一步驗證這些發現,并為更廣泛的癌癥患者帶來希望。"
EC/OC
9月28日上午,遼寧省腫瘤醫院的楊卓博士在口頭報告環節分享了蘆康沙妥珠單抗(sac-TMT)在既往接受過多線治療的晚期子宮內膜癌(EC)和卵巢癌(OC)中的研究結果。在44例子宮內膜癌隊列中,中位隨訪時間為7.2個月。52.3%的患者既往接受過二線或以上的治療,基線相對較差,蘆康沙妥珠單抗仍可取得34.1%(15/44,其中3例待確認)的客觀緩解率(ORR)和75%的疾病控制率(DCR),中位無進展生存期(PFS)則為5.7個月(95% CI:3.7,9.4),6個月PFS率為47.5%。在40例卵巢癌隊列中,中位隨訪時間長達28.2個月,且所有患者均接受過二線或以上治療,其中87.5%的患者為鉑類耐藥,蘆康沙妥珠單抗單藥治療取得了40%的ORR(14/40)和75%的DCR,中位PFS為6個月,mOS為16.1個月(95% CI:10.5,NE)。
點評環節,遼寧省腫瘤醫院王丹波教授表示:"卵巢癌與子宮內膜癌在流行病學上各具特色,我國發達城市的子宮內膜癌發病率亦逐年攀升,未來可能會成為中國女性婦科惡性腫瘤之首。相比之下,卵巢癌最為顯著的特征是發病隱匿、晚期發現率高及高死亡率,探索新的治療策略以克服鉑耐藥、提高卵巢癌患者生存率,是未來研究的重點方向。蘆康沙妥珠單抗在晚期子宮內膜癌和卵巢癌的治療中展現出了巨大的潛力。它不僅在療效上取得了顯著成果,而且安全性也得到了良好控制。我相信,在未來的研究和應用中,它將成為ADC創新藥研發領域的佼佼者,為更多婦科腫瘤患者帶來新希望。"
科倫博泰始終胸懷博愛之心,致力于解決中國乃至全球未滿足的臨床需求,通過聚焦自身技術優勢,為國內患者提供臨床價值顯著且性價比優異的新型ADC藥物,提升臨床患者獲益。未來,將不斷加速候選藥物的研發及臨床進度,提升一體化藥物開發能力,為實現健康中國2030添磚加瓦。
關于科倫博泰生物
四川科倫博泰生物醫藥股份有限公司(6990.HK)是科倫藥業控股子公司,專注于生物技術藥物及創新小分子藥物的研發、生產、商業化及國際合作。公司圍繞全球和中國未滿足的臨床需求,重點布局腫瘤、自身免疫、炎癥和代謝等重大疾病領域,建設國際化藥物研發與產業化平臺,致力于成為在創新領域國際領先的企業。在生物技術藥物領域,包括ADC、單抗、雙抗、新靶點創新小分子藥物的熱點技術等,均已取得重大進展。公司目前擁有33個用于治療腫瘤、自身免疫、炎癥、代謝等重大疾病的創新項目,其中14個項目正處于臨床階段,多個臨床試驗為全球多中心研究,在包括中國和歐美等多個國家同步開展。公司成功構建了享譽國際的ADC開發平臺OptiDC,已有4個ADC項目處于臨床研究階段(其中2個ADC項目處于NDA 階段),多個項目處于臨床前研究階段。更多訊息,敬請瀏覽http://kelun-biotech.com/
]]>中國原創TROP2-ADC勇攀高峰,挑戰經治HR+/HER2-轉移性乳腺癌治療困局
據國際癌癥研究機構(IARC)2020數據顯示,乳腺癌新發病例數已超過肺癌,成為全球第一大癌種。其中HR+/HER2-乳腺癌占比約為70%,是最常見的乳腺癌亞型。內分泌治療是HR+/HER2-乳腺癌治療的基石,而CDK4/6抑制劑極大延長了HR+/HER2-轉移性乳腺癌患者的生存時間。但對于內分泌和CDK4/6抑制劑治療失敗的HR+/HER2-轉移性乳腺癌患者,當前可選的治療方案療效有限,亟需更有效的治療藥物,改善臨床預后。
近年來,以TROP2-ADC為代表的新型ADC藥物,為HR+/HER2-乳腺癌患者帶來了新的選擇。戈沙妥珠單抗(SG)已獲FDA批準用于接受過內分泌治療和≥2線系統治療(針對轉移性疾病)的HR+/HER2-乳腺癌適應癥;此外,同樣靶向TROP2的Dato-DXd的Ⅲ期研究也在今年ESMO大會上公布。但目前尚無TROP2-ADC在國內獲批用于HR+/HER2-乳腺癌患者。
SKB264是由科倫博泰自主研發的創新TROP2-ADC,此次亮相2023 ESMO的研究,初步探索了SKB264在既往接受過至少一線化療的HR+/HER2-轉移性乳腺癌患者中的療效及安全性,其展示的卓有前景的療效數據,對臨床治療和后續探索的價值,成為本次入選ESMO口頭報告的主要因素。SKB264用于既往接受過至少二線系統化療的局部晚期或轉移性HR+/HER2-乳腺癌患者已獲得中國藥監局藥品審評中心(CDE)授予的突破性療法認定。
在乳腺癌領域,除了HR+/HER2-乳腺癌,SKB264治療局部晚期或轉移性TNBC也獲得CDE授予的突破性療法認定。SKB264治療局部晚期或轉移性TNBC的Ⅲ期注冊研究已達到主要研究終點,計劃年底申報上市,有望在中國成為首個完全獲批的TROP2-ADC。
SKB264療效數據亮眼,有望成為經治HR+/HER2-轉移性乳腺癌治療新選擇
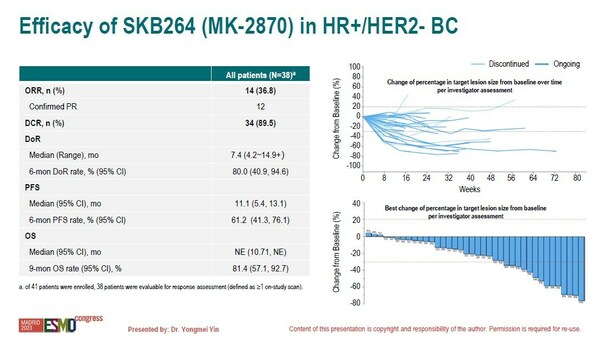
本次ESMO亮相的II期研究,旨在評估SKB264在既往接受過至少一線化療的HR+/HER2-轉移性乳腺癌患者中的療效和安全性。入組患者接受5mg/kg Q2W的SKB264治療,直至疾病進展或出現不能耐受的毒性。中位隨訪時間為8.2個月,共有38例患者療效可評估,其中47%的患者為原發性內分泌耐藥,79%的患者接受過≥2線化療,65.8%的患者既往接受過CDK4/6抑制劑治療。
在腫瘤緩解方面,SKB264治療后的客觀緩解率(ORR)為36.8%,疾病控制率(DCR)為89.5%, 6個月DoR率為80%;生存數據方面,中位無進展時間(PFS)為11.1個月。當前指南針對此類人群推薦的主要治療方案仍然是化療,但化療的ORR僅為15%左右,PFS只有4~5個月。而這項II期研究結果提示SKB264的療效遠超化療,能為患者帶來更多獲益,期待隨著隨訪時間延長,本研究的生存數據能夠帶來更多驚喜。尤其值得一提的是,所有亞組人群均可從SKB264治療中獲益,包括HER2低表達和零表達、原發和繼發內分泌耐藥、既往使用和未使用過CDK4/6抑制劑的患者。
安全性方面,研究中≥3級藥物相關不良事件(TRAE)的發生率較低,僅17.1%的患者因TRAE導致劑量降低,無TRAE導致停藥和死亡。主要不良事件為臨床常見的血液學毒性,無間質性肺病(ILD)發生。
SKB264獨特結構設計,兼顧強大抗腫瘤活性與安全性
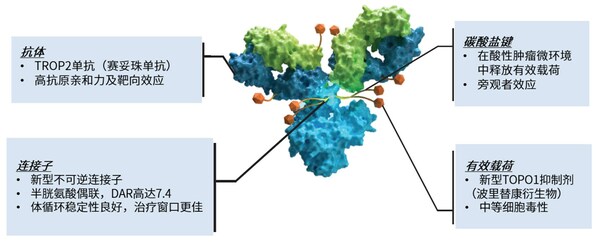
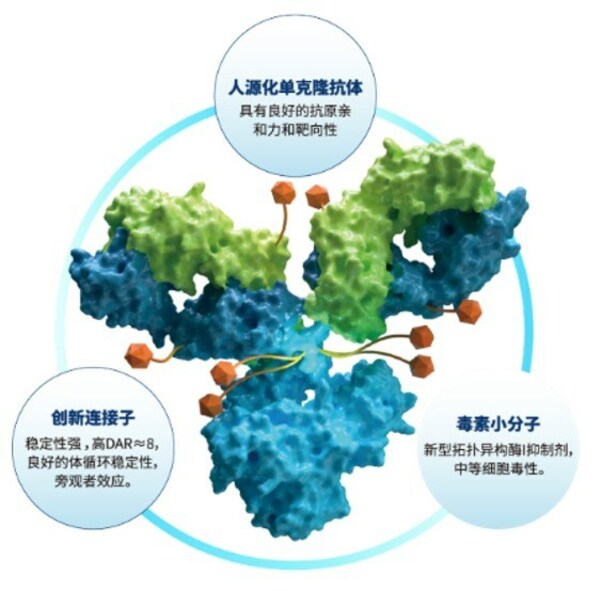
SKB264所展示出的良好抗腫瘤作用和安全性,得益于其ADC藥物的設計。SKB264由具有良好親和力和靶向性的人源化抗TROP2單抗,通過穩定性經過優化的CL2A連接子(連接子的抗體端采用甲磺酰基嘧啶實現與抗體不可逆偶聯),與自研毒素小分子T030(拓撲異構酶Ⅰ抑制劑)結合而成,藥物抗體比(DAR)平均高達7.4。T030活性與DXD相當,含有甲基砜結構,可與連接子的毒素端穩定結合,減少脫落。SKB264在血液循環中穩定性較高,半衰期較長,使更多藥物能到達表達TROP2的腫瘤細胞,發揮抗腫瘤作用。
SKB264具有三重抗腫瘤作用,首先,通過靶向TROP2的抗體到達腫瘤細胞后,對pH敏感的連接子在酸性腫瘤微環境即可裂解,釋放毒素小分子殺傷周圍腫瘤細胞。其次,SKB264被內吞進表達TROP2抗原的腫瘤細胞后,連接子的毒素端可被胞內溶酶體切割,釋放毒素小分子殺傷腫瘤細胞。最后,毒素小分子還能透出細胞膜,發揮"旁觀者效應",繼續殺傷周圍腫瘤細胞。
SKB264的藥物設計,在保證高效抗腫瘤活性的同時,很好地平衡了安全性。
深度布局HR+/HER2-轉移性乳腺癌,SKB264有望創造更多佳績
SKB264用于至少接受過一線化療的HR+/HER2-轉移性乳腺癌的中國多中心Ⅲ期注冊臨床研究已獲批開展;針對既往內分泌治療失敗但未接受過化療的HR+/HER2-轉移性乳腺癌患者的全球多中心Ⅲ期注冊臨床研究也即將開展;同時SKB264聯合或不聯合KL-A167(抗PD-L1單抗)用于HER2陰性(包括HR+/HER2-和TNBC) 乳腺癌患者一線治療的Ⅱ期研究正在進行中。期待這些研究能夠進一步證實SKB264在HR+/HER2-轉移性乳腺癌患者中的治療價值,為此類患者帶來更多治療選擇。
除了乳腺癌,SKB264在非小細胞肺癌(NSCLC)也展示出了卓有前景的療效,并在積極探索在其它實體瘤的應用(包括單藥、與免疫等藥物聯合),期待后續能讓更多患者獲益,成為國人引以為傲的中國原創ADC藥物。
中國創新藥研發實力不斷提升,期待未來惠及更多病患
近年來,我國創新藥物研發發展迅速,尤其是在抗腫瘤藥物研發領域,取得了令世界矚目的成績,這不僅提升了我國的臨床研究水平,同時也使得國際舞臺有了更多來自中國的聲音。抗腫瘤新藥的研發及獲批上市,為我國腫瘤患者帶來了可及性更好的治療選擇。未來,期待以科倫博泰為代表的創新藥企,能夠在腫瘤藥物研發領域不斷取得突破,造福我國乃至全球腫瘤患者。
]]>研究背景
TROP2在HR+/HER2-轉移性乳腺癌中過表達,且被證實與患者的不良預后有關。SKB264是一款精妙設計的靶向TROP2的ADC,由人源化抗TROP2單抗,通過穩定性經過優化的CL2A連接子(連接子的抗體端采用甲磺酰基嘧啶實現與抗體不可逆偶聯),與毒素小分子T030(拓撲異構酶Ⅰ抑制劑)結合而成,藥物抗體比(DAR)平均高達7.4。本研究是這一創新藥物用于HR+/HER2-轉移性乳腺癌患者II期隊列研究的首次公開報告。
研究方法
HR+/HER2-(包括HER2低表達和HER2零表達)轉移性乳腺癌患者接受SKB264 5mg/kg Q2W治療,直至疾病進展或出現不可耐受的毒性。研究納入的患者既往經內分泌治療失敗且至少接受過一次化療。腫瘤評估由研究者根據RECIST v1.1每8周評估一次。
研究結果
截止2023年4月12日,研究共入組41例患者,中位年齡50歲,其中61%的患者ECOG PS評分為1分。研究的中位隨訪時間為8.2個月。
主要不良反應以血液學毒性為主,最常見的≥3級治療相關不良事件(TRAE)為中性粒細胞計數降低(36.6%)、白細胞計數降低(22%)、貧血(14.6%)和血小板計數降低(9.8%)。大多數血液學毒性在治療的前兩個月內發生,并在接受G-CSF或促紅細胞生成素治療后得到恢復,無需輸血。17.1%(7/41)的患者因TRAE導致劑量降低,無TRAE導致的停藥或死亡。胃腸道TRAE發生率低,未觀察到與藥物相關的神經病變、間質性肺病/肺炎發生。
療效可評估的38例患者中,71%的患者為HER2低表達,47%的患者為原發內分泌耐藥,79%的患者既往接受了≥2線針對轉移性乳腺癌的化療,所有患者都接受過紫杉類藥物治療,65.8%的患者既往接受過CDK4/6抑制劑治療。客觀緩解率(ORR)為36.8%,疾病控制率(DCR)為89.5%,6個月持續緩解(DoR)率為80%,中位無進展生存期(PFS)為11.1個月。所有亞組均獲益,包括HER2低表達和零表達、原發和繼發內分泌耐藥、既往使用和未使用過CDK4/6抑制劑的患者。
研究結論
SKB264在HR+/HER2-轉移性乳腺癌患者中顯示出可控的安全性和令人鼓舞的抗腫瘤活性。目前在HR+/HER2-轉移性乳腺癌患者中正在計劃開展兩項III期臨床研究:一項國內研究針對轉移性階段至少接受過一線化療的患者。另一項全球研究針對既往在轉移性階段未接受過化療的患者。
小結
此前,SKB264在經過多線治療的轉移性三陰乳腺癌(TNBC)以及非小細胞肺癌(NSCLC)患者中展現出良好的療效及可控的安全性,本屆ESMO,其在HR+/HER2-轉移性乳腺癌患者中再次顯示出了巨大的治療潛力,無疑為后續領域內更多系列研究的開展增加了信心。
2022 SABCS年會,SKB264釋放了用于局部晚期或轉移性三陰乳腺癌(TNBC)患者Ⅱ期拓展研究數據。在55例療效可評估的患者中,ORR為 43.6% ,DCR為 80% ,其中TROP2高表達患者的ORR為 55.2%。mDoR為11.5個月,mPFS為5.7個月,中位總生存期(mOS)為14.6個月,12個月OS率為66.4%。
2023 ASCO年會,SKB264公布了用于經治的局部晚期或轉移性非小細胞肺癌(NSCLC)患者的Ⅱ期拓展研究數據。39例患者療效可評估,ORR為43.6%,DCR為94.9%,mDoR為9.3個月,6個月DoR率為77%,12個月OS率為70.6%。EGFR突變亞組人群的ORR為60%,DCR為100%,mDoR為9.3個月,mPFS為11.1個月,12個月OS率為80.7%。
已公布的研究數據表明,SKB264治療晚期三陰性乳腺癌、晚期HR+HER2-乳腺癌和TKI治療失敗的EGFR突變的NSCLC,在ADC藥物中具有同類最佳潛質。
基于乳腺癌和肺癌的亮眼的研究數據,SKB264已獲得CDE授予的三項突破性療法認定,分別為單藥用于治療局部晚期或轉移性三陰性乳腺癌(TNBC)、EGFR-TKI 治療失敗的局部晚期或轉移性EGFR 突變非小細胞肺癌(EGFRm NSCLC)和既往接受過至少二線系統化療的局部晚期或轉移性激素受體(HR)陽性、人表皮生長因子受體2陰性(HER2-)乳腺癌。
在乳腺癌領域,SKB264單藥用于既往經二線及以上系統治療的局部晚期或轉移性三陰乳腺癌患者的III期注冊研究已達到主要研究終點,計劃年底申報上市。SKB264單藥用于既往至少經一線化療失敗的局部晚期或轉移性HR+HER2-乳腺癌患者的III期注冊研究已獲批開展。SKB264聯合KL-A167(抗PD-L1單抗)用于HER2陰性乳腺癌患者一線治療的Ⅱ期研究正在進行中。另外還有多項肺癌注冊研究正在快速推進中,并在積極探索聯合用藥、以及在其它實體瘤的應用。期待更多研究結果公布,為全球腫瘤患者帶來福音!
ESMO大會期間,當地時間10月21日下午,科倫博泰與默沙東團隊在馬德里進行了親切會見,雙方管理層及臨床團隊出席本次會議。
會議上,雙方管理層及項目團隊就合作項目的研發進展進行討論,深入探討了緊密協同,開展合作項目的全球臨床研究的工作計劃,雙方團隊將共同加強臨床階段藥物和即將進入臨床階段的多款ADC藥物開發,包括適應癥快速拓展、從單藥到聯用、治療線程從后線到前線。通過此次友好會談,進一步增強了雙方的合作基礎,極大推動了既定項目的后續開發和商業化進程。此外,雙方可能探索對于其他全新靶點ADC項目的合作機會。
當地時間10月22日上午,ESMO大會上以口頭報告的形式公布由科倫博泰和默沙東共同開發的創新TROP2-ADC(SKB264,亦稱為MK-2870)用于治療激素受體陽性(HR+)和人表皮生長因子受體2陰性(HER2-)轉移性乳腺癌(mBC)患者的I/II期籃子研究的研究結果。
關于科倫博泰
四川科倫博泰生物醫藥股份有限公司(6990.HK)(簡稱“科倫博泰”)是科倫藥業控股子公司,專注于生物技術藥物及創新小分子藥物的研發、生產、商業化及國際合作。公司圍繞全球和中國未滿足的臨床需求,重點布局腫瘤、自身免疫、炎癥和代謝等重大疾病領域,建設國際化藥物研發與產業化平臺,致力于成為在創新領域國際領先的企業。在生物技術藥物領域,包括ADC、單抗、雙抗、新靶點創新小分子藥物的熱點技術等,均已取得重大進展。已成功構建享譽國際的ADC研發平臺OptiDC,已有4款ADC處于臨床研究階段(其中2個ADC項目分別處于注冊性III期或NDA 階段),多款處于臨床前研究階段。公司目前擁有33個用于治療腫瘤、自身免疫、炎癥、代謝等重大疾病的創新項目,14個項目正在推進臨床研究,其中多個臨床試驗為全球多中心研究,在包括中國和歐美等多個國家同步開展。更多訊息,敬請瀏覽http://kelun-biotech.com/。
]]>公告顯示,科倫博泰2023年上半年總收入約為10.46億元人民幣,較去年同期增長203.3%,該增加主要歸因于根據與默沙東訂立的開發多達七項用于治療癌癥的臨床前抗體藥物偶聯物資產的許可及合作協議,科倫博泰于2023年3月收取的1.75億美元不可退還的預付款項。得益于來自許可及合作協議以及提供研發服務的收入,期內虧損0.31億元人民幣,同比大幅收窄88.5%。
研發與商業化雙管齊下,助力長期價值積累
科倫博泰核心產品SKB264(TROP2 ADC)于2023年1月獲得了國家藥監局突破性療法認定(BTD),用于治療EGFR-TKI無效EGFR突變型局部晚期或轉移性非小細胞肺癌;6月再次獲得BTD,用于既往接受過至少二線系統化療的局部晚期或轉移性激素受體陽性和人表皮生長因子受體2陰性的乳腺癌。此外,SKB264的臨床開發在2023年上半年也獲得了諸多進展:科倫博泰于6月在2023年ASCO年會上發布了SKB264用于治療局部晚期或轉移性非小細胞肺癌(NSCLC)患者的II期研究數據,顯示出良好的療效及可控的安全性;7月在中國實現了SKB264治療EGFR突變型局部晚期或轉移性非鱗非小細胞肺癌(TKI無效)III期試驗的首例患者入組;8月,用于治療二線或以上既往標準治療失敗的不可切除局部晚期、復發或轉移性三陰乳腺癌患者的III期臨床試驗達到主要終點。
科倫博泰已就另一款核心產品A166(HER2 ADC)于2023年5月向國家藥監局提交了針對三線或以上晚期人表皮生長因子受體2陽性(HER2+)乳腺癌的新藥上市申請,并正在中國進行一項針對二線或以上晚期HER2+乳腺癌的確證性III期試驗以及多項Ib期臨床試驗,以探索A166用于包括胃癌及結直腸癌在內的其他晚期HER2+實體瘤的治療潛力。
此外,科倫博泰其他關鍵產品取得了重要進展。SKB315(Claudin 18.2 ADC)正在中國進行針對晚期實體瘤患者的Ia期臨床試驗;獲得國家藥監局IND批準的針對晚期實體瘤的ADC 產品SKB410于2023年7月實現了Ia期臨床試驗的首例患者入組;A167(PD-L1)已完成聯合化療作為一線療法治療復發轉移性鼻咽癌的III期試驗患者入組;A140(西妥昔單抗生物類似藥)已于2022年11月完成患者入組,預計2023年下半年向國家藥監局提交NDA申請;A400(RET抑制劑)于7月開始了針對晚期RET陽性非小細胞肺癌的關鍵試驗,并就晚期RET陽性甲狀腺髓樣癌取得了國家藥監局臨床試驗申請(IND)批準。
根據在研藥物的研發進度,科倫博泰正在組建一支成熟的商業化團隊,以籌備和實施重點產品的營銷和商業化,當前已在內部建立起相關部門架構,包括市場、準入與商務、醫學事務、銷售以及戰略及卓越運營等多個部門。
穩固全球戰略合作,錄得收入大幅增長
2023年1月,作為科倫博泰B輪融資的一部分,默沙東以對價1億美元認購科倫博泰股份;3月,根據與默沙東訂立的開發多達七項用于治療癌癥的臨床前抗體藥物偶聯物資產的許可及合作協議,科倫博泰收取了1.75億美元不可退還的預付款項。2023年上半年,雙方高層開展了多次互訪交流,全力推進項目進展,持續深化戰略合作成果。目前,與默沙東合作的SKB264、SKB315、A410等臨床階段產品及其他臨床前階段產品正在按計劃有序推進與開發。
科倫博泰向Ellipses授予了一項在大中華區、朝鮮、韓國、新加坡、馬來西亞及泰國之外的所有國家開發、制造及商業化A400的獨家、付特許權使用費、可授權的許可。報告期內,科倫博泰已從Ellipses收到一定的里程碑付款。2023年2月,西班牙藥品和醫療器械管理局 (AEMPS)批準了A400的臨床試驗申請。截止7月,在美國有七個臨床研究中心,歐洲有四個臨床研究中心開展A400的臨床試驗。
強力資本運營,推動創新戰略發展
2023年2月,科倫博泰完成了B輪融資,融資規模超2億美元。
2023年7月,科倫博泰在香港聯交所主板成功上市,上市所得款項及行使超額配股權獲得額外所得款項凈額共約為14.55億港元。
科倫博泰執行董事兼總經理葛均友博士表示:"2023年上半年實現營收大幅增長,是科倫博泰持續推進具有臨床價值及差異化的腫瘤及非腫瘤藥物管線、夯實藥物開發能力、積極尋求戰略合作伙伴、優化運營體系等一系列正確戰略策略的有力印證。展望下半年,科倫博泰將進一步推進各管線的研發進度,完善后期階段候選藥物的商業化策略,并在全球范圍內繼續采取靈活策略,通過在全球范圍內創造協同許可及合作機會,在主要國際市場獲得商業價值。"
關于四川科倫博泰生物醫藥股份有限公司
四川科倫博泰生物醫藥股份有限公司(簡稱"科倫博泰")是科倫藥業控股子公司,專注于生物技術藥物及創新小分子藥物的研發、生產、商業化及國際合作。公司圍繞全球和中國未滿足的臨床需求,重點布局腫瘤、自身免疫、炎癥和代謝等重大疾病領域,建設國際化藥物研發與產業化平臺,致力于成為在創新領域國際領先的企業。在生物技術藥物領域,包括ADC、單抗、雙抗、新靶點創新小分子藥物的熱點技術等,均已取得重大進展。已成功構建享譽國際的ADC研發平臺OptiDC,已有4款ADC處于臨床研究階段(其中2個ADC項目分別處于注冊性III期或NDA 階段),多款處于臨床前研究階段。公司目前擁有33個用于治療腫瘤、自身免疫、炎癥、代謝等重大疾病的創新項目,14個項目正在推進臨床研究,其中多個臨床試驗為全球多中心研究,在包括中國和歐美等多個國家同步開展。更多訊息,敬請瀏覽https://kelun-biotech.com/。
前瞻性陳述
本新聞稿包含前瞻性陳述。該等陳述乃基于公司管理層所信、管理層所作假設及目前所掌握的資料而作出。倘于本新聞稿使用"旨在"、"預計"、"相信"、"可能會"、"估計"、"預期"、"今后"、"擬"、"可能"、"或會"、"應當"、"計劃"、"潛在"、"預料"、"預測"、"尋求"、"應"、"將"、"會"等詞匯及該等詞匯的反義詞及其他類似表達,即指前瞻性陳述。該等陳述反映管理層目前對未來事件、營運、流動資金及資本資源的觀點,當中若干觀點可能不會實現或可能有所改變。
閣下應注意不應過分依賴本新聞稿所載任何前瞻性陳述。公司不能保證該等前瞻性陳述將會證實為正確。反映在該等前瞻性陳述的預期可能有變,公司概不承擔更新或修訂本新聞稿任何前瞻性陳述的義務。
]]>科倫博泰于近期召開了獨立數據監查委員會(IDMC)會議,對SKB264的III期臨床試驗期中分析數據進行了審閱,IDMC決議表明該研究達到了主要研究終點獨立評審委員(IRC)評估的無進展生存期(PFS)。在預先設定的期中分析中,與對照標準化療組相比,SKB264的無進展生存期具有統計學意義上的顯著改善。根據期中分析數據結果,科倫博泰計劃近期與國家藥品監督管理局(NMPA)藥品審評中心(CDE)溝通關于SKB264遞交上市申請的事宜。
科倫博泰執行董事兼總經理葛均友博士表示:"三陰乳腺癌是最具侵襲性和最普遍的乳腺癌亞型之一,目前二線及以后的三陰乳腺癌患者總生存期(OS)僅為5.2至8.4月[1],有著巨大的未被滿足的醫療需求。SKB264在治療局部晚期或轉移性三陰乳腺癌上已獲突破性治療品種認定,對納入該名單的藥物,藥品審評中心將優先配置資源進行溝通交流,加強指導并促進藥物研發,這將有望加速SKB264在該適應癥上的研發和上市,通過提供優質治療選擇,為晚期三陰乳腺癌患者帶來獲益。"
SKB264是科倫博泰擁有自主知識產權的核心產品之一,科倫博泰為其制定了廣泛的開發計劃。此次達到主要研究終點的臨床試驗為SKB264在中國的首個III期注冊性研究。此外,科倫博泰針對SKB264正在進行聯合或不聯合KL-A167(科倫博泰抗PD-L1單抗)作為晚期三陰乳腺癌一線治療的II期臨床試驗,并預期將于2023年下半年啟動評估SKB264單藥對比研究者選擇方案用于治療既往至少經一線化療失敗的不可手術切除的局部晚期、復發或轉移性激素受體陽性(HR+)且人表皮生長因子受體2陰性(HER2-)乳腺癌患者的隨機、開放性、多中心III期臨床試驗。
關于SKB264(MK-2870)
SKB264是由科倫博泰享譽國際的ADC研發平臺—OptiDC研發的具有代表性的靶向TROP2的創新ADC,采用專有毒素-連接子策略(Kthiol設計策略),該策略通過將新型不可逆的抗體偶聯技術、pH 敏感毒素釋放機制和均勻加載DAR 7.4 的中等活性毒素(新型拓撲異構酶I抑制劑)相結合,實現了ADC安全性和有效性的優化平衡[2]。
SKB264已獲得國家藥品監督管理局(NMPA)藥品審評中心(CDE)3項突破性療法認定(BTD),分別用于治療局部晚期或轉移性三陰乳腺癌(TNBC)、EGFR-TKI治療失敗的局部晚期或轉移性EGFR突變非小細胞肺癌(NSCLC)、既往接受過至少二線系統化療的局部晚期或轉移性激素受體陽性(HR+)和人表皮生長因子受體2陰性(HER2-)的乳腺癌。
基于初步臨床數據,SKB264目前正在開展針對多個瘤種的單藥/聯用的II期和III期臨床試驗。在國內,SKB264單藥治療至少經二線治療失敗的晚期或轉移性TNBC患者的III期注冊臨床研究進展順利,有望成為首個獲批上市的國產TROP2-ADC 。SKB264單藥用于TKI耐藥EGFR突變非小細胞肺癌患者III期臨床研究正快速推進中。多項聯合帕博利珠單抗(KEYTRUDA®,抗PD-1單抗)或KL-A167(科倫博泰抗PD-L1單抗)II期臨床研究正在開展。在國外,科倫博泰已有償獨家許可默沙東在大中華區(包括中國大陸、香港、澳門和臺灣)以外開發、使用、制造及商業化SKB264(MK-2870),海外臨床研究正在美國、加拿大、澳大利亞、法國、比利時和波蘭有序開展或準備開展中。多項全球多中心注冊性臨床研究在籌備中。
關于四川科倫博泰生物醫藥股份有限公司
四川科倫博泰生物醫藥股份有限公司(簡稱"科倫博泰")是科倫藥業控股子公司,專注于生物技術藥物及創新小分子藥物的研發、生產、商業化及國際合作。公司圍繞全球和中國未滿足的臨床需求,重點布局腫瘤、自身免疫、炎癥和代謝等重大疾病領域,建設國際化藥物研發與產業化平臺,致力于成為在創新領域國際領先的企業。在生物技術藥物領域,包括ADC、單抗、雙抗、新靶點創新小分子藥物的熱點技術等,均已取得重大進展。已成功構建享譽國際的ADC研發平臺OptiDC,已有4款ADC處于臨床研究階段(其中2個ADC項目分別處于注冊性III期或NDA 階段),多款處于臨床前研究階段。公司目前擁有33個用于治療腫瘤、自身免疫、炎癥、代謝等重大疾病的創新項目,14個項目正在推進臨床研究,其中多個臨床試驗為全球多中心研究,在包括中國和歐美等多個國家同步開展。更多訊息,敬請瀏覽https://kelun-biotech.com/。
參考資料: |
前瞻性陳述
本新聞稿包含前瞻性陳述。該等陳述乃基于公司管理層所信、管理層所作假設及目前所掌握的資料而作出。倘于本新聞稿使用"旨在"、"預計"、"相信"、"可能會"、"估計"、"預期"、"今后"、"擬"、"可能"、"或會"、"應當"、"計劃"、"潛在"、"預料"、"預測"、"尋求"、"應"、"將"、"會"等詞匯及該等詞匯的反義詞及其他類似表達,即指前瞻性陳述。該等陳述反映管理層目前對未來事件、營運、流動資金及資本資源的觀點,當中若干觀點可能不會實現或可能有所改變。
閣下應注意不應過分依賴本新聞稿所載任何前瞻性陳述。公司不能保證該等前瞻性陳述將會證實為正確。反映在該等前瞻性陳述的預期可能有變,公司概不承擔更新或修訂本新聞稿任何前瞻性陳述的義務。
該口頭報告的摘要標題為"SKB264 (MK-2870) in previously treated hormone receptor-positive (HR+)/ HER2-negative metastatic breast cancer (mBC): results from a phase I/II, single-arm, basket trial",報告編號為380MO。摘要具體內容預計將于當地時間2023年10月16日在ESMO大會官網上公布。
ESMO大會是歐洲最負盛名和最具影響力的腫瘤學會議,每年匯集來自世界各地的臨床醫生、研究人員、患者權益倡導者、記者和醫療健康行業代表,通過分享最前沿的數據,為腫瘤學家和其他利益相關者提供無與倫比的交流平臺和高質量的教育機會。
關于SKB264(MK-2870)
SKB264是由科倫博泰享譽國際的ADC研發平臺—OptiDC研發的具有代表性的靶向TROP2的創新ADC,采用專有毒素-連接子策略(Kthiol設計策略),該策略通過將新型不可逆的抗體偶聯技術、pH 敏感毒素釋放機制和均勻加載DAR 7.4 的中等活性毒素(新型拓撲異構酶I抑制劑)相結合,實現了ADC安全性和有效性的優化平衡[1]。
SKB264已獲得國家藥品監督管理局(NMPA)藥品審評中心(CDE)3項突破性療法認定(BTD),分別用于治療局部晚期或轉移性三陰乳腺癌(TNBC)、EGFR-TKI治療失敗的局部晚期或轉移性EGFR突變非小細胞肺癌(NSCLC)、既往接受過至少二線系統化療的局部晚期或轉移性激素受體陽性(HR+)和人表皮生長因子受體2陰性(HER2-)的乳腺癌。
基于初步臨床數據,SKB264目前正在開展針對多個瘤種的單藥/聯用的II期和III期臨床試驗。在國內,SKB264單藥治療至少經二線治療失敗的晚期或轉移性TNBC患者的III期注冊臨床研究進展順利,有望成為首個獲批上市的國產TROP2-ADC 。SKB264單藥用于TKI耐藥EGFR突變非小細胞肺癌患者III期臨床研究正快速推進中。多項聯合帕博利珠單抗(KEYTRUDA®,抗PD-1單抗)或KL-A167(科倫博泰抗PD-L1單抗)II期臨床研究正在開展。在國外,科倫博泰已有償獨家許可默沙東在中國以外(中國包括中國大陸,香港、澳門和臺灣)區域范圍內研發、生產與商業化SKB264(MK-2870),海外臨床研究正在美國、加拿大、澳大利亞、法國、比利時和波蘭有序開展或準備開展中。多項全球多中心注冊性臨床研究在籌備中。
關于四川科倫博泰生物醫藥股份有限公司
四川科倫博泰生物醫藥股份有限公司(簡稱"科倫博泰")是科倫藥業控股子公司,專注于生物技術藥物及創新小分子藥物的研發、生產、商業化及國際合作。公司圍繞全球和中國未滿足的臨床需求,重點布局腫瘤、自身免疫、炎癥和代謝等重大疾病領域,建設國際化藥物研發與產業化平臺,致力于成為在創新領域國際領先的企業。在生物技術藥物領域,包括ADC、單抗、雙抗、新靶點創新小分子藥物的熱點技術等,均已取得重大進展。已成功構建享譽國際的ADC研發平臺OptiDC,已有4款ADC處于臨床研究階段(其中2個ADC項目分別處于注冊性III期或NDA 階段),多款處于臨床前研究階段。公司目前擁有33個用于治療腫瘤、自身免疫、炎癥、代謝等重大疾病的創新項目,14個項目正在推進臨床研究,其中多個臨床試驗為全球多中心研究,在包括中國和歐美等多個國家同步開展。更多訊息,敬請瀏覽http://kelun-biotech.com/。
參考資料:
[1] Cheng Yezhe, et al. Preclinical profiles of SKB264, a novel anti-TROP2 antibody conjugated to topoisomerase inhibitor, demonstrated promising antitumor efficacy compared to IMMU-132. Frontiers in Oncology, Vol 12, 2022
前瞻性陳述
本新聞稿包含前瞻性陳述。該等陳述乃基于公司管理層所信、管理層所作假設及目前所掌握的資料而作出。倘于本新聞稿使用"旨在"、"預計"、"相信"、"可能會"、"估計"、"預期"、"今后"、"擬"、"可能"、"或會"、"應當"、"計劃"、"潛在"、"預料"、"預測"、"尋求"、"應"、"將"、"會"等詞匯及該等詞匯的反義詞及其他類似表達,即指前瞻性陳述。該等陳述反映管理層目前對未來事件、營運、流動資金及資本資源的觀點,當中若干觀點可能不會實現或可能有所改變。
閣下應注意不應過分依賴本新聞稿所載任何前瞻性陳述。公司不能保證該等前瞻性陳述將會證實為正確。反映在該等前瞻性陳述的預期可能有變,公司概不承擔更新或修訂本新聞稿任何前瞻性陳述的義務。
科倫博泰擬全球發售22,446,100股股份,其中2,244,700股(可予重新分配)將于香港公開發售,20,201,400股(可予重新分配及視乎超額配股權行使與否而定)將做國際發售,另有 3,366,900股超額配股權。此次招股期為2023年6月29日至7月4日,最高發售價為72.80港元,將以每手100股進行買賣。科倫博泰預計將于2023年7月11日在香港聯交所主板正式上市,股份代號為6990.HK。
通過本次全球發售,以招股章程所述指示性發售價范圍的中間價即每股66.70港元計,扣除公司就全球發售應付的包銷傭金、費用及估計開支后,科倫博泰預計將獲得募資凈額約1,375.3百萬港元。公司計劃將募資用于研發并商業化核心產品SKB264及A166;用于公司其他主要產品,包括A140、A167、A400及A223的研發及商業化;用于為ADC、大分子及小分子的技術平臺的持續開發提供資金,以推進公司其他現有管線資產,以及探索及開發新的候選藥物;用于為擴大公司的生產能力及質量控制系統提供資金;用于營運資金及其他一般公司用途。
高盛(亞洲)有限責任公司及中信證券(香港)有限公司為本次全球發售的聯席保薦人。高盛(亞洲)有限責任公司及中信里昂證券有限公司為本次全球發售的保薦人兼整體協調人。高盛(亞洲)有限責任公司、中信里昂證券有限公司及花旗環球金融亞洲有限公司為本次全球發售的聯席全球協調人。高盛(亞洲)有限責任公司、中信里昂證券有限公司、花旗環球金融亞洲有限公司、Citigroup Global Markets Limited、工銀國際證券有限公司及交銀國際證券有限公司為本次全球發售的聯席賬簿管理人、聯席牽頭經辦人及資本市場中介人。
本新聞稿僅供參考,不構成或包括向任何人提議或邀請收購、購買或認購四川科倫博泰生物醫藥股份有限公司的證券,也無意構成所出售的證券的推薦,或者任何收購、購買或認購證券的邀請或要約。
關于四川科倫博泰生物醫藥股份有限公司
四川科倫博泰生物醫藥股份有限公司(“科倫博泰”或“公司”)是一家生物醫藥公司,自2016年注冊成立以來,一直致力于腫瘤學、免疫學及其他治療領域的創新藥物的研發、制造及商業化。公司采用系統化、以適應癥為導向的方法來解決世界上普遍或難治療的癌癥以及患者人數眾多且醫療需求未得到滿足的其他疾病及病癥。歷經多年,公司已建立涵蓋全部主要藥物開發功能的端到端能力,包括研發、生產、質量控制及商業化,能夠戰略性地快速推進33款差異化且具有臨床價值的資產管線,截至最后實際可行日期,其中14款處于臨床階段。
科倫博泰是抗體藥物偶聯物(ADC)開發的先行者之一,在ADC開發方面積累了超過十年的經驗。公司也是中國首批和全球少數的建立內部開發的ADC平臺(“OptiDC”) 的生物制藥公司之一。公司管線的臨床價值及藥物開發能力得到了全球戰略合作伙伴的認可,包括公司與Merck Sharp & Dohme LLC訂立的三項開發用于癌癥治療的多達九項ADC資產的許可及合作協議,前期及里程碑付款合共高達118億美元。公司的戰略伙伴關系不僅證明了公司的研發和業務開發能力,也是公司持續創新、全球影響力和長期發展的主要驅動力。更多訊息,敬請瀏覽http://kelun-biotech.com/。
前瞻性陳述
本新聞稿包含前瞻性陳述。該等陳述及數據乃基于管理層所信、管理層所作假設及目前所掌握的資料而作出。倘于本新聞稿使用“旨在”、“預計”、“相信”、“可能會”、“估計”、“預期”、“今后”、“擬”、“可能”、“或會”、“應當”、“計劃”、“潛在”、“預料”、“預測”、“尋求”、“應”、“將”、“會”等詞匯及該等詞匯的反義詞及其他類似表達,即指前瞻性陳述。該等陳述反映管理層目前對未來事件、營運、流動資金及資本資源的觀點,當中若干觀點可能不會實現或可能有所改變。
閣下應注意不應過份依賴本新聞稿所載任何前瞻性陳述。公司不能保證該等前瞻性陳述將會證實為正確。反映在該等前瞻性陳述的預期可能有變,公司概不承擔更新或修訂本新聞稿任何前瞻性陳述的義務。