中國上海和美國達勒姆2022年1月17日 /美通社/ -- 科濟藥業(股票代碼:2171.HK),一家主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,今日公告,委任Richard John Daly(“Daly先生”)為其旗下美國公司CARsgen Therapeutics Corporation總裁,向科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士匯報。
Daly先生將領導科濟藥業美國團隊處理科濟藥業除中國以外地區的國際商業活動,包括臨床開發、制造運營、業務發展、商業化、投資者關系及公共關系。Daly先生也將對科濟藥業的總體戰略增長和業務計劃作出貢獻。Daly先生將常駐美國北卡羅來納州。
Daly先生在制藥領域深耕約30年,擁有豐富的跨國公司和生物技術公司的領導經驗。在加入科濟藥業前,Daly先生曾在多家納斯達克上市公司如Beyond Spring, Inc.、Neuralstem, Inc.等擔任首席運營官、首席執行官、總裁和董事長等重要職務,以及在阿斯利康美國子公司糖尿病事業部擔任總裁;并在武田制藥北美公司、TAP制藥公司等知名企業擔任高階領導職位。Daly先生目前是Catalyst Pharmaceuticals(納斯達克上市,股票代碼:CPRX)和Opiant Pharmaceuticals(納斯達克上市,股票代碼:OPNT)的董事會成員。
Daly先生擁有美國西北大學凱洛格管理學院的MBA學位,以及圣母大學的理學學士學位。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:
“代表董事會熱烈歡迎Daly先生加入科濟藥業!Daly先生已在醫藥行業深耕數十載,在市場營銷、業務發展和運營管理方面都頗有建樹,是擔任科濟美國公司領導者的上佳人選。在科濟藥業高速發展之際,我們幸得Daly先生共襄盛舉,助力科濟藥業在全球市場開疆拓土。我堅信Daly先生的加入將進一步加快我們的國際化進程,包括臨床開發、CMC運營、業務發展等。Daly先生將同科濟藥業團隊一起,為全球癌癥患者開發創新和差異化的細胞療法,為實現‘科創濟世’的愿景不懈努力。”
CARsgen Therapeutics Corporation總裁Daly先生表示:
“科濟藥業獨特的科學、臨床和生產制造平臺讓人深受震撼,并有潛力為癌癥患者提供更好的治療方法。能在這個關鍵的時刻加入科濟藥業,我感到不勝榮幸,期待與我們優秀的團隊通力合作,繼續夯實這個平臺,實現科濟藥業的使命,為患者提供更先進的療法,更重要的是,使癌癥可治愈。”
過去一年,科濟藥業持續增強管理團隊的力量,一批具有國際化背景的資深專業人士先后加入公司并擔任高級管理人員。相信在這群經驗豐富的學術專家和行業資深人士的帶領之下,科濟藥業的國際化進程將大大加快。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
聯系我們
更多信息,請訪問網站:https://www.carsgen.com/
截至公告日,CT041為全球唯一靶向CLDN18.2的、且已獲得美國食品藥品監督管理局、中國國家藥監局和加拿大衛生部IND批準、并正在進行臨床試驗研究的CAR-T細胞免疫治療方法。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:“CT041在加拿大臨床試驗的獲批,以及我們剛剛獲得的全球首個實體瘤CAR-T的PRIME資格,都充分證明了監管機構對CT041的認可,是實體瘤CAR-T發展的重要里程碑,我們期待CT041早日造福全球患者。”
關于CT041
CT041是一種潛在全球同類首創的、靶向CLDN18.2的自體CAR-T細胞候選產品,用于治療CLDN18.2陽性實體瘤,主要治療胃癌/胃食管結合部癌及胰腺癌。CT041在正在進行的臨床試驗中表現出有前景的療效及良好的安全性,有可能在未來成為胃癌和胰腺癌的骨干療法,并惠及全球大量患者群體。
除了在中國的研究者發起的試驗外,科濟藥業還在中國啟動了一項針對晚期胃癌/胃食管結合部癌和胰腺癌的Ib/II期臨床試驗,以及在北美啟動了一項針對晚期胃癌或胰腺癌的1b期臨床試驗。
CT041在2021年ESMO大會公布的研究者發起試驗的最新數據表明,在既往接受至少2線治療失敗、接受II期推薦劑量(RP2D) 2.5×10? CT041細胞治療的18例胃癌患者中,客觀緩解率達61.1%。歷史數據表明,至少2線治療失敗的胃癌患者,化療藥物的客觀緩解率約為4%~8%,抗PD-1單抗的有效率約為11%。因此,相比于胃癌末線患者的其他治療藥物,CT041在客觀緩解率上已經取得顯著提升。
CT041于2020年獲得美國FDA授予“孤兒藥”認定,用于治療胃癌/胃食管結合部癌,于2021年獲得EMA先后授予“孤兒藥產品”認定和優先藥品(PRIME)資格,用于治療胃癌。科濟藥業已向中國國家藥品監督管理局申請啟動關鍵II期臨床試驗所需的監管批準,亦擬于2022年在北美啟動關鍵II期臨床試驗。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
科濟自主研發的CT041為全球唯一獲得IND許可的靶向CLDN18.2的CAR-T細胞,目前在中國和美國進行臨床試驗。該品種在2020年獲得美國FDA授予的孤兒藥產品資格認定,用于治療胃癌/食管胃結合部腺癌,并于2021年獲得歐洲EMA授予“孤兒藥產品”認定,用于治療胃癌。
實體瘤CAR-T首次亮相ESMO 晚期胃癌臨床治療數據亮眼
本次亮相2021 ESMO口頭報告的研究是一項正在中國開展的、多中心、開放標簽的I期研究者發起的臨床試驗,以CT041治療CLDN18.2表達陽性(≥+,≥10%)的晚期消化系統腫瘤患者。臨床試驗分為劑量遞增階段和劑量擴展階段,主要目的是觀察CT041的安全性和耐受性,次要目的是觀察療效和藥代動力學。
截至2021年4月8日,37例CLDN18.2表達陽性的晚期消化系統腫瘤患者接受CT041輸注并完成至少12周的評估,包括28例胃癌/胃食管結合部癌、5例胰腺癌和4例其他類型的實體瘤,細胞輸注劑量分別為2.5×108,3.75×108和5×108 CAR-T細胞。約84%的患者既往接受過至少2線治療,中位轉移器官數量為3個。28名胃癌/胃食管結合部癌患者中,67.9%的患者有腹膜轉移,42.9%既往接受過抗PD-1/PD-L1單抗藥物治療,35.7%既往接受過TKI藥物治療。
從具體臨床數據來看,CT041總體耐受性良好,未發生治療相關死亡或免疫細胞治療相關神經系統毒性綜合征(ICANS)。約95%的患者發生細胞因子釋放綜合征(CRS),均為1級或2級。
療效方面,在36例具有腫瘤靶病灶的患者中,31例患者觀察到不同程度的目標病灶縮小,總客觀緩解率(ORR)為48.6%,疾病控制率(DCR)為73.0%。
在既往接受至少2線治療失敗、接受II期推薦劑量(RP2D) 2.5×108 CAR-T細胞治療的18例胃癌/胃食管結合部癌患者中,8例(44%)患者既往接受過抗PD-(L)1單抗治療。中位隨訪時間為輸注后7.6個月,ORR為61.1%,DCR為83.3%,中位PFS和中位OS分別為5.6個月和9.5個月。
在28例胃癌/胃食管結合部癌患者中,亞組分析顯示了ORR在CLDN18.2表達水平和既往抗PD-(L)1單抗治療等不同基線特征情況下均可維持在50%或以上。
歷史數據表明,胃癌至少2線治療失敗的患者,化療藥物的有效率約為4%~8%,抗PD-1單抗的有效率約為11%。因此,相比于胃癌末線患者的其他治療藥物,CT041在客觀緩解率上已經取得顯著提升。由于本期試驗中已有較多患者曾經接受過抗PD-(L)1單抗治療,本期療效數據,表明CT041有可能成為晚期胃癌患者新的治療手段。
此臨床試驗的更多數據后續會在學術期刊或學術會議中進行披露。
群雄逐鹿實體瘤CAR-T療法 科濟藥業全球化研發領先
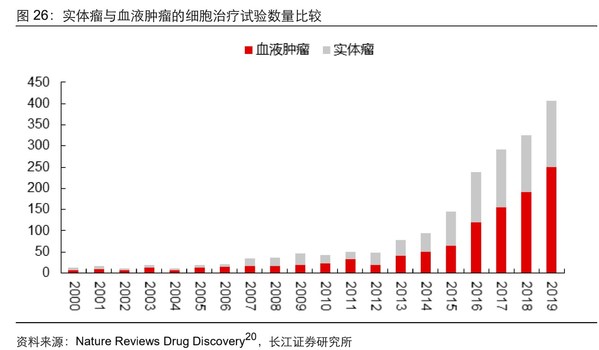
截至目前,全球獲批上市的CAR-T 產品的適應癥均為血液腫瘤,治療效果十分顯著。
根據 Nature Reviews Drug Discovery 發布的文章,全球約90%的癌癥病例是實體腫瘤,未滿足的臨床需求仍十分巨大。作為最有希望治愈癌癥的療法之一,CAR-T細胞療法在實體瘤領域的研發重要性不言而喻,然而不能忽視的是目前國內外CAR-T研發主要集中在血液瘤領域,真正在實體瘤領域勇于探索并且一直堅持的CAR-T治療公司屈指可數。
究其緣由,主要是因為實體瘤CAR-T細胞療法的發展面臨著諸多挑戰,比如實體瘤惡性的腫瘤微環境,腫瘤抗原的異質性和逃逸機制仍有待解決。其中最困難的挑戰是理想靶抗原的選擇,實體瘤具有顯著的抗原異質性、可轉移性,導致較難找到類似于CD19這樣特異性表達的血液瘤標志物,因此尋找有效靶點成為CAR-T治療實體瘤的關鍵突破點。
科濟藥業是全球第一個成功識別、驗證和報告CLDN18.2和GPC3可作為 CAR-T治療靶點的公司,初步臨床數據顯示公司相關CAR-T候選產品均有望實現實體瘤治療的突破。
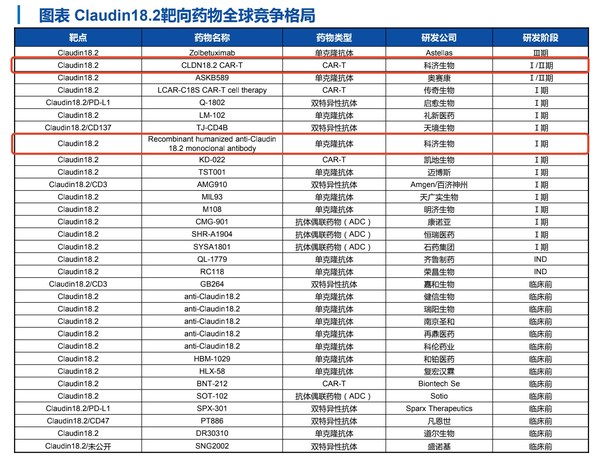
其中,CLDN18.2表達具有高度特異性,臨床研究數據確證了CLDN18.2治療胃癌、胰腺癌等實體瘤的巨大潛力,全球范圍內CLDN18.2靶向藥物研發迎來熱潮,形成單抗、雙抗、ADC及CAR-T藥物的全面布局。目前,科濟藥業已布局該靶點CAR-T療法和單抗產品,先發優勢明顯,特別是CAR-T候選產品研發進展領先全球,是唯一獲得IND臨床實驗許可的品種。
我國是胃癌的高發國家,大多數患者確診時已屬晚期,并有年輕化的趨勢。根據國泰君安研報,晚期胃癌藥物治療方式主要為化療和 HER2 靶向療法,但是HER2 在胃癌陽性比例僅為7~20%(中國胃癌患者 HER2陽性率12~13%),覆蓋患者不夠廣泛。雖然一直以來胃癌領域有多個靶點在研,但是近年來藥物治療的突破也還是主要集中在 PD-1 類藥物及HER2 靶點藥物,胃癌急需出現新靶點的突破,來延長現有的治療瓶頸。
科濟藥業已向中國國家藥監局遞交了啟動 CT041 關鍵 II 期臨床試驗的申請,預計公司將在 2022 年啟動美國的關鍵II期臨床研究。
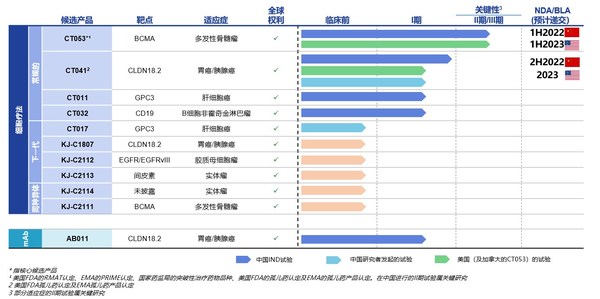
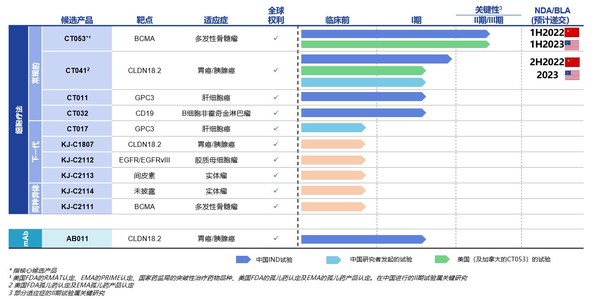
目前科濟藥業已擁有11款候選產品,均為自主研發且擁有全球權益,涵蓋常規型、新一代CAR-T 技術及同種異體療法,布局全面且富有前瞻性。科濟藥業已在中國、美國和加拿大獲得7項CAR-T療法的IND許可,在中國所有CAR-T公司中排名第一。
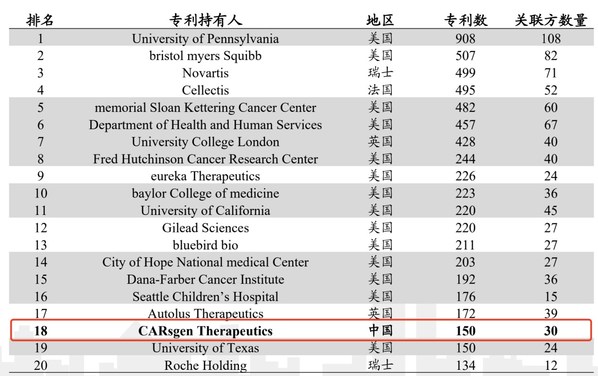
根據Nature Biotechnology文章數據,截至2019年底,按照CAR-T 專利總數統計,全球排名前20家機構及公司中,科濟藥業是唯一一家上榜的亞洲公司。據科濟藥業2021年中期業績報告披露,截至2021年8月15日,科濟藥業在超過19個國家或地區(包括中國、美國、歐洲及日本)擁有52項授權專利及231項專利申請。
在現有產品管線基礎之上,科濟將圍繞“實體瘤療效、安全性、患者可及性、靶點可用性”四大研發戰略方向,持續開發創新專有技術 (CycloCAR, THANK-uCAR等),以解決CAR-T療法領域的主要挑戰。未來,這些技術平臺也將為臨床階段持續提供更多自主研發候選產品。
北京大學腫瘤醫院副院長、消化腫瘤內科主任、Ⅰ期臨床病區主任、北京市腫瘤防治研究所副所長沈琳教授表示:胃癌是全球范圍高發的腫瘤,特別是在亞洲,中國的胃癌患者約占到全球胃癌患者數量的50%,而胃癌總體的藥物研究和治療手段與其他的實體瘤相比,是相對滯后的,如何改變現有胃癌治療的困境,一直是大家非常期待的。
這次在ESMO報道的研究結果顯示,在晚期胃癌治療中,CT041具有顯著的療效和良好的安全性,我們期待它能夠造福更多的癌癥患者。
科濟藥業創始人、董事會主席、CEO、CSO李宗海博士表示,感謝北京大學腫瘤醫院齊長松博士代表研究者團隊在ESMO大會上與業界分享CT041的臨床研究數據,感謝所有研究者為本項目的傾力付出。這樣具有開創性的工作沒有研究者的傾力付出是不可能有這樣的成果的。當然,為全球胃癌等腫瘤患者提供更好的治療手段是我們所有人的愿望,也值得我們為之奮斗。
關于CT041
CT041是科濟藥業自主開發的一種潛在全球同類首創的、靶向CLDN18.2自體CAR-T候選產品,用于治療CLDN18.2陽性實體瘤如胃癌/胃食管結合部癌及胰腺癌。科濟藥業在全球率先成功識別、驗證并報告CLDN18.2可作為實體瘤CAR-T的合理治療靶點。除了在中國的研究者發起的試驗外,科濟藥業還在中國啟動了針對晚期(不可切除或轉移性)胃癌/胃食管結合部癌和胰腺癌的Ib/II期臨床試驗,在美國啟動了針對晚期(不可切除或轉移性)胃癌或胰腺癌的Ib期臨床試驗。
關于科濟藥業
科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法并使癌癥可治愈的全球生物制藥領導者。
科濟藥業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:“這是科濟藥業繼2021年6月18日在香港交易所成功上市后的第一個中期業績報告。2021年上半年,科濟藥業在全社會各方的鼎力支持下,在產品管線推進、技術開發、對外合作、生產設施建設等方面取得多項重要進展。科濟將一如既往地努力在全球范圍內推進臨床候選產品,持續開發自主創新技術,為全球癌癥患者帶來更多創新和差異化的細胞療法,也為廣大投資者和社會創造更多價值。”
作為CAR-T細胞療法領域的主要參與者,科濟藥業自主開發了11款差異化候選產品,并擁有全球權益。
其中CT053作為升級版靶向B細胞成熟抗原(“BCMA”)的全人抗CAR-T產品,正在中國進行關鍵II期臨床試驗;2021年7月,CT053美國關鍵II期臨床試驗入組第一例患者。公司計劃于2022年上半年就CT053向中國國家藥監局(NMPA)提交新藥上市申請(NDA),并計劃在2023年上半年向美國FDA提交生物制品上市申請(BLA)。根據科濟藥業公開資料顯示,在中國進行的研究者發起的試驗、以及中國和北美進行的注冊臨床試驗中,顯示出令人鼓舞的療效和安全性。
另一款CT041 為全球唯一靶向CLDN18.2的且已獲得美國FDA和國家藥監局的IND批準并正在進行臨床試驗研究的CAR-T候選產品,用于治療胃癌和胰腺癌等實體瘤,已獲得FDA及EMA孤兒藥產品認定。有望實現CAR-T療法在實體瘤治療領域的突破。科濟藥業將于9月19日ESMO大會上對CT041 中國研究者發起試驗(IIT)數據進展進行口頭報告。此外,2021年上半年,科濟藥業已在中國向NMPA提交關鍵II期研究的咨詢申請,并計劃于2021年下半年啟動關鍵II期臨床試驗,2022年下半年就先前至少接受兩線系統治療失敗的胃癌患者的治療提交NDA。在美國,公司計劃于2022年對胃癌/ 食管胃結合部癌或胰腺癌患者進行關鍵的II期試驗,2023年向美國FDA提交BLA。CT041已獲得美國FDA授予“孤兒藥”認定,用于治療胃癌/胃食管結合部癌,并獲得EMA授予“孤兒藥產品”認定,用于治療胃癌。
根據科濟藥業控股有限公司(下稱“科濟藥業”)2021年中期業績報告顯示,科濟藥業旗下公司CAFA therapeutics與韓國HK inno.N(KOSDAQ: 195940)公司就人源化CD19 CAR-T(CT032)和全人抗BCMA CAR-T(CT053)兩款細胞療法產品進行開發和商業化達成許可及協議。根據協議條款,科濟藥業有權獲得的預付款和額外的里程碑付款總計達5000萬美元,科濟藥業還將有資格獲得基于合作約定產品在韓國未來凈銷售額至多兩位數百分比的特許權使用費。
此次對外授權合作是海外市場對科濟藥業CAR-T產品的肯定,也為公司未來在全球范圍內展開更多產品和技術合作打開了良好開端。
目前公司擁有11款候選產品,均為自主研發且擁有全球權益,涵蓋常規型、新一代CAR-T技術及同種異體療法,布局全面且富有前瞻性。
此外,本次中期業績發布,公司透露,在現有產品管線基礎之上,科濟將圍繞“實體瘤療效、安全性、患者可及性、靶點可用性”四大研發戰略方向,持續開發創新專有技術(CycloCAR, THANK-uCAR等),以解決CAR-T療法領域的主要挑戰。例如針對實體瘤療效問題,公司正在開發下一代CAR-T技術CycloCAR,該技術共同表達細胞因子IL-7和趨化因子CCL21,可能具有更高的臨床療效,并減少對清淋化療預處理的要求。未來,這些技術平臺也將為臨床階段持續提供更多自主研發候選產品。
科濟藥業已在中國、美國和加拿大獲得7項CAR-T療法的IND許可,在中國所有CAR-T公司中排名第一。除了國際化的產品研發布局,公司也在海外積極建設自有產能。
公司已經建立了符合GMP標準的內部制造能力,包括質粒、慢病毒載體和CAR-T細胞產品的端到端生產。位于中國上海金山區的商業化生產廠房,取得了中國第一張CAR-T細胞療法的藥品生產許可證,預計每年可支持多達2,000名患者的CAR-T治療。
2021年上半年,在美國北卡羅來納州達勒姆市,科濟藥業已啟動生產設施建設,用于臨床試驗和早期商業化的生產設施建設。
憑借豐富的自研產品管線、自有CAR-T產能及全球化市場布局,公司將持續提高CAR-T產品的生產規模效應,進一步降低每個患者的用藥成本,改善CAR-T療法可及性,最終為全球癌癥患者帶去創新、差異化、可負擔的的細胞療法。
上市儀式現場,科濟藥業聯合創始人、首席執行官、首席科學官、董事長李宗海博士表示:“此次在香港交易所成功上市,是公司發展道路上的重要里程碑。公司自成立以來,得到了政府相關部門及社會各界人士的大力支持。對于一家以治愈癌癥患者為使命的公司,上市是科濟一個新的起點。我們將以上市為契機,整合各方資源、快速推進現有臨床試驗候選產品上市;同時,通過持續的技術創新,開發更多有望治愈腫瘤患者的創新藥物。”
自2014年開始運營以來,科濟藥業已通過自主研發建立11款產品管線,并在CAR-T技術平臺、商業化能力以及全球化布局等方面展現出過“硬”實力,故此也吸引了眾多明星投資機構的投資。本次發行,科濟藥業引入包括禮來亞洲基金、新華人壽等9家基石投資者。
徐匯區常委副區長王宏偉表示:“此次科濟藥業成功上市,既是企業發展的里程碑和新起點,也將帶動和激發生命健康領域投資熱情,助推產業和經濟高質量發展。精準做好企業服務,始終是徐匯秉持的職責夙愿,圍繞打造最有營商環境,整合各方資源,發揮綜合優勢,徐匯已經集聚各類生命健康企業超過2700家,覆蓋創新藥物、醫療器械、健康服務等重點發展領域,2020年生命健康產業總產出達過707億元。”
金山區副區長何冬賓表示:“科濟藥業自成立以來,秉持“科創濟世”的理念,取得了令人矚目的發展成績。通過完全自主研發的新一代技術,擁有全球權益的產品管線,致力于為全球癌癥患者帶來創新和差異化的細胞療法,最終使癌癥可治愈。生物醫藥產業是上海市著力打造的戰略性新興產業,也是金山區加快培育發展的重點產業。科濟藥業作為其中一家張江孵化的優質企業,在為我區經濟發展、科技進步、促進就業和履行社會責任等方面都作出了積極貢獻。”
作為一家專注于CAR-T療法的本土創新藥企,科濟藥業已擁有11款候選產品,均為自主研發且擁有全球權益,涵蓋常規型、新一代CAR-T技術及同種異體療法,布局全面且富有前瞻性。
弗若斯特沙利文數據顯示,科濟藥業已在中國、美國和加拿大獲得7項CAR-T療法的IND許可,在中國所有CAR-T公司中排名第一。
目前,公司研發進展最快的是升級版全人抗靶向BCMA的CAR-T產品CT053,適應癥是多發性骨髓瘤(全球第二大常見血液惡性腫瘤),已經在中國進入關鍵II期臨床試驗,預計2022年上半年向中國藥監局提交NDA申請。CT053在中國和美國的臨床試驗中體現了良好的安全性和有前景的療效,比如在中國的I期臨床試驗中其客觀緩解率高達100%,且無一人出現嚴重細胞因子風暴或治療相關死亡。
值得一提的是,CT053已獲得中國突破性治療藥物品種資格認定、美國FDA再生醫學高級療法(RMAT)資格認定,歐洲藥監局(EMA)的優先藥物(PRIME)資格以及FDA及EMA的孤兒藥產品認定。CT053是目前唯一獲得美國RMAT資格認定的中國CAR-T候選產品。
公司另一款在研CAR-T產品CT041亦已獲得FDA及EMA孤兒藥產品認定。 CT041是全球唯一獲得IND臨床試驗批件的靶向Claudin18.2(CLDN18.2)的自體CAR-T候選產品。目前處于臨床I期,由于CLDN18.2靶點在胃癌及胰腺癌中廣泛表達,適應癥人群多,市場前景廣闊。
科濟藥業致力于用科技創新攻克實體瘤CAR-T細胞療法的挑戰,現有自主研發管線中,除CT053、CT032、KJ-C2111之外,其余7個CAR-T候選產品均用于治療實體瘤。
CT053和CT041共獲得7項資格認定,是對科濟藥業自主研發技術和創新能力的極大認可,也促進了這兩個產品在走向商業化進程中處于更有利的位置。目前,科濟藥業已于2019年在上海市建立了中國首個CAR-T細胞商業化GMP生產基地,預計每年可支持多達2000名患者的CAR-T治療;2021年下半年將進行二期擴建,每年可支持多達5000名患者。此外,科濟藥業也已經開始在美國北卡羅萊納州建設CAR-T細胞藥物商業化生產設施,以支持后續產品在美國市場的商業化上市。
自成立以來,科濟藥業的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法并使癌癥可治愈的全球生物制藥領導者。未來,面對龐大的未被滿足的癌癥治療需求,公司將堅持攻克CAR-T行業難題,通過持續的技術創新,開發更多有望治愈腫瘤患者的創新藥物。