上海,馬薩諸塞州劍橋和瑞士羅特2023年6月6日 /美通社/ -- 再鼎醫藥有限公司(納斯達克股票代碼:ZLAB;香港聯交所股份代號:9688)和Novocure(納斯達克股票代碼:NVCR)今日在2023年美國臨床腫瘤學會(ASCO)年會上,公布了一項評估TTFields聯合標準治療用于非小細胞肺癌(NSCLC)的 LUNAR 臨床III 期研究的陽性結果。當 TTFields 聯合標準治療,LUNAR 研究達到了其主要終點,中位總生存期(OS)有顯著統計學意義和臨床意義的3個月改善(HR:0.74,P = 0.035)。
隨機接受TTFields聯合標準治療的患者(n=137)的中位OS為13.2個月,而僅接受標準治療的患者(n=139)為9.9個月。
在免疫檢查點抑制劑(ICI)亞組中證明了TTFields對OS產生的巨大獲益。隨機接受TTFields和醫生選擇的ICI的患者(n=66)的中位OS為18.5個月,而僅接受ICI治療的患者的中位OS為10.8個月 (n=68;HR=0.63;P=0.03)。
隨機接受TTFields和多西他賽(n=71)治療的患者具有積極的生存趨勢,中位OS為11.1個月,而單獨接受多西他賽治療的患者(n=71)為8.7個月。
TTFields耐受性良好,沒有增加系統毒性,3 級(無4級或5級)設備相關不良事件發生率較低。
主要研究者、埃默里大學Winship癌癥研究所研究員和醫學腫瘤學專家、亞特蘭大埃默里大學醫學院血液與腫瘤學科胸部醫學腫瘤項目主任、Ticiana Leal副教授表示:"LUNAR研究的結果非常令人鼓舞。我對這一進展以及這種創新療法的潛力感到激動,它可以幫助許多在含鉑方案治療后需要新治療選擇的轉移性肺癌患者,且不會增加系統性毒性。"
中山大學腫瘤防治中心張力教授表示:"LUNAR研究展示出的對總生存期的顯著改善是極具突破性的。肺癌是中國癌癥相關死亡的主要原因,而非小細胞肺癌則是肺癌中最常見的類型。對于在一線使用含鉑方案治療后進展的患者,預后往往非常差。我很高興這種新型的非侵入性醫療器械可以為中國轉移性非小細胞肺癌患者帶來顯著獲益。"
各隊列之間患者基線特征達到了很好的平衡:中位年齡為64歲(范圍22-86);65%為男性;96%的ECOG表現狀態為0-1。患者在北美 (30%)、西歐 (30%)、東歐 (30%) 和東亞(9%)的研究中心入組。接受TTFields聯合標準治療的患者的一年生存率為53%,而僅接受標準治療的患者為42%(P=0.04)。一項具有里程碑意義的分析表明,接受過TTFields聯合標準治療的患者三年生存率提高了近三倍,達到18%,而僅接受標準治療的患者為7%(P=0.015)。接受TTFields聯合標準治療的患者的中位無進展生存期(PFS)為4.8個月,而單獨接受標準治療的患者為4.1個月。
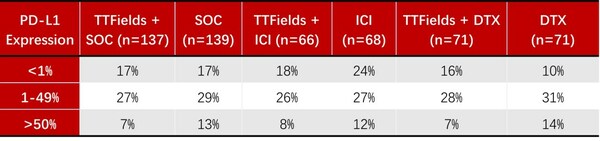
在隨機分組的患者中,89%的患者此前接受過一種系統性治療,31%接受過ICI 治療(58%的患者隨機分配至多西他賽隊列,2%的患者隨機分配至ICI 隊列)。2017年,在進行LUNAR研究期間,多個ICI被批準用于一線NSCLC的治療,隨后在接受ICI治療的區域收集了PD-L1表達數據。全球151名患者(55%)可評估腫瘤細胞PD-L1陽性細胞比例評分(TPS),并且在隊列中非常均衡。在接受ICI治療并測量腫瘤比例評分的所有患者中,63%的PD-L1表達 >1%,這與真實世界數據一致。PD-L1表達數據收集來自美國研究中心入組的83%的患者(83名患者中的 69名),并且在四個隊列中得到了很好的平衡。
PD-L1狀態:
DTX = 多西他賽;ICI = 免疫檢查點抑制劑;SOC = 標準治療 |
Novocure已遞交LUNAR臨床研究結果,發表在高級別同行審閱的醫學期刊上。LUNAR臨床研究數據有望作為2023年下半年向美國食品藥品監督管理局(FDA) 提交上市前批準(PMA)的基礎。再鼎醫藥為LUNAR研究的中國部分做出了貢獻,計劃在Novocure向FDA遞交后,向國家藥品監督管理局(NMPA)提交上市許可申請 (MAA)。
Novocure 執行主席 William Doyle表示:"感謝所有的患者及家屬以及護理人員參與LUNAR研究。感謝Leal博士和我們所有的研究人員,感謝他們在推進患者護理方面的專業知識和奉獻精神。LUNAR研究結果代表了轉移性非小細胞肺癌治療領域的巨大進步。LUNAR研究證明了 TTFields在提高癌癥患者生存率,解決亟需未得到滿足的需求上,具有廣泛和多用途的潛力。我們對LUNAR研究的結果備受鼓舞,并正在迅速向前推進,使 TTFields造福轉移性非小細胞肺癌患者。"
再鼎醫藥創始人、董事長兼首席執行官杜瑩博士表示:"中國每年約有74萬新發非小細胞肺癌患者,大多數患者確診時已是晚期。LUNAR 研究結果表明,TTFields具有顯著延長許多晚期鉑類耐藥NSCLC患者生存期的潛力。我們很高興能夠為LUNAR研究做出貢獻,我們期待與Novocure合作,盡快將TTFields帶給轉移性NSCLC患者。"
Novocure致力于持續推進TTFields用于實體腫瘤患者。LUNAR臨床研究是四項預計將于2024年底公布的臨床III期研究中的第一項,研究TTFields用于大腦、軀干和腹部實體瘤的治療。基于 LUNAR 數據的優勢,Novocure計劃啟動額外的III期研究,以評估TTFields作為前線治療,以及與ICI和其他標準治療的聯用。
除了LUNAR研究外,再鼎醫藥參與了2項Novocure正在開展的臨床III期研究,包括METIS(非小細胞肺癌腦轉移)、PANOVA-3(胰腺癌)。再鼎醫藥還與Novocure合作進行了EF-31胃癌臨床II期研究,探索TTFields在中國胃癌治療領域的應用。
關于LUNAR研究
LUNAR是一項III期研究,用于評估TTFields與ICI或多西他賽(實驗組)聯合使用與單獨使用 ICI或多西他賽(對照組)治療在含鉑治療期間或之后進展的轉移性NSCLC患者的安全性和有效性。該研究主要終點是接受TTFields聯合ICI或多西他賽治療的患者的總生存期優于單獨接受ICI或多西他賽治療的患者的總生存期。次要終點是接受TTFields治療聯合ICI治療的患者的總生存期優于ICI隊列,以及接受TTFields聯合多西他賽治療的患者總生存期優于單獨使用多西他賽的患者。TTFields主要用于與其他伴隨的標準治療一起使用,LUNAR設計預計出現多種臨床結果,Novocure認為這些均有臨床意義。
關于非小細胞肺癌在中國
肺癌是中國最常見的癌癥類型,也是癌癥死亡的主要原因。2022年中國肺癌新發病例約871,000例,死亡病例約767,000例1。非小細胞肺癌約占肺癌的85%,約 70%的非小細胞肺癌在初步診斷時為局部晚期或轉移。與全球臨床實踐相似,醫生根據疾病的階段使用不同的手術、放療和藥物療法組合來治療非小細胞肺癌。手術可能對一部分患者有療效,通常用于疾病的早期階段。自1991年以來,放療聯合鉑類化療藥物一直是局部晚期或轉移性非小細胞肺癌的一線標準治療。某些免疫檢查點抑制劑已被批準用于非小細胞肺癌的一線治療,并作為標準治療被快速應用。二線治療的標準治療也在不斷演變,可能包括對接受過免疫檢查點抑制劑作為一線治療方案的患者使用以鉑類為基礎的化療、培美曲塞、多西他賽或免疫檢查點抑制劑。
資料: (1) Changfa Xia, et al. Cancer statistics in China and United States, 2022: profiles, trends, and determinants.
關于再鼎醫藥
再鼎醫藥有限公司(納斯達克股票代碼:ZLAB;香港聯交所股份代號:9688)是一家以研發為基礎、處于商業化階段的創新型生物制藥公司,總部位于中國和美國,專注于為中國及全球患者提供治療腫瘤、自身免疫疾病、感染性疾病和中樞神經系統疾病的變革性藥物。我們的目標是利用我們的能力和資源努力促進全世界人類的健康福祉。
有關再鼎醫藥的更多信息,包括我們的產品,商業活動和合作伙伴關系,研究和其他事件或發展,請訪問www.zailaboratory.com或關注公司官微:再鼎醫藥。
中國初級衛生保健基金會副理事長胡寧寧女士,復旦大學附屬華山醫院神經外科秦智勇教授,小林漫畫作者林帝浣先生,南方都市報“最美逆行者”攝影記者鐘銳鈞先生,再鼎醫藥首席商務官兼大中華區總裁梁怡先生及數位來自長三角地區的腦膠質瘤領域專家和全國25個患者家庭共同出席了本次活動。由于疫情原因無法來到現場的港澳臺患者們,也通過視頻向本次活動送上了祝福。
腦膠質瘤起源于腦神經膠質細胞,是最常見的原發性顱內腫瘤,以惡性程度劃分為Ⅰ-Ⅳ級。膠質母細胞瘤(GBM)是惡性程度最高的Ⅳ級腦膠質瘤,占所有膠質瘤的56%。據統計,我國每年有超過45,000例新發膠質母細胞瘤患者,患者復發率100%,五年生存率4.7% ,僅為肺癌1/3,被認為是神經外科治療中最棘手的難治性腫瘤之一。因此在治療過程中,患者和家庭都背負著巨大的精神壓力。
復旦大學附屬華山醫院神經外科副主任秦智勇教授表示:“與肺癌、胃癌等高發癌腫相比,膠質母細胞瘤的患者相對較少,且治療方式相對匱乏。同時,由于預后差、生存期短等疾病特征,膠質母細胞瘤患者和家人通常對于疾病治療的信心不足。因此,除了臨床醫生做好手術、患者提供最佳的治療建議之外,如何幫助膠質母細胞瘤患者及家人建立積極治療的信心也至關重要。”
為了呼吁患者勇敢面對疾病、建立積極治療的抗癌信心,中國初級衛生保健基金會攜手社會各方成立“愛普新生-腦膠質瘤患者關愛之家”互助交流平臺,并在該平臺上發起“每一秒都值得守護”患者影像故事征集項目。該項目由腦膠質瘤公益宣傳使者、南方都市報攝影記者鐘銳鈞擔任拍攝,通過影像的方式為患者記錄下生活中的點點滴滴,將積極樂觀的精神面貌傳遞給更多家庭。
鐘銳鈞表示:“2019年香港的一場采訪,偶然間讓我了解到了腦膠質瘤是一種侵襲性極強的顱內惡性腫瘤,許多患者在治療過程中都會面臨巨大的精神壓力。但是有些患者卻可以以積極樂觀的生活態度面對疾病和生活,作為一名攝影記者,我希望能記錄下患者生活中那些的美好時刻,并將這些美好傳遞給更多的患者和家庭。哪怕只有一秒鐘,都讓我覺得特別有意義。”
除了該項目,下半年“愛普新生-腦膠質瘤關愛之家”還將會在全國多地舉辦患者交流分享會、義診等公益活動,呼吁社會各界關注腦膠質瘤,為患者提供更多的幫助和關愛。
中國初級衛生保健基金會副理事長胡寧寧代表主辦方在致辭中提到:“腦膠質瘤患者整體人數不多,國內認知度低。但其實自2019年起,國際上已經將每年7月的第三個周三定為世界膠質母細胞瘤關注日。很高興,在今天這個特殊的日子里,‘愛普新生-腦膠質瘤患者之家’成立了。希望通過該互助平臺的搭建,能夠在‘身’與‘心’兩方面給予病友支持,助力健康中國的建設。”
疫情期間,方艙醫院內展示的“小林漫畫”曾治愈了無數人。此次會議上,腦膠質瘤人文關愛大使林帝浣先生與患者家屬杭女士為腦膠質瘤患者帶來了一幅特殊的共創作品 -- 《每一秒都值得守護》。談到作畫的初衷,杭女士分享道:“畫畫的初衷原本是為了鼓勵母親,但在和母親共同對抗疾病的道路上,我反而被她勇敢、樂觀的心態所感染。希望這些作品能夠給更多像我們一樣的家庭帶來正能量,同時也希望更多的家庭愿意分享自己的故事,點滴分享,共抗病魔。”林帝浣表示:“一直以來,我都在嘗試用人文藝術的力量對患者提供心靈的療愈。這是我第一幅與患者家庭共同創作的作品,非常高興能與杭杭合作。我們希望看到這幅作品的每一位患者都能從作品中感受到愛與力量。”
再鼎醫藥首席商務官兼大中華區總裁梁怡表示,一直以來“以患者為中心”是再鼎不斷創新的源動力。今年7月21日是全球第三個膠質母細胞瘤關注日,我們希望通過此次活動的舉辦及 “愛普新生-腦膠質瘤患者關愛之家”互助交流平臺的成立,加強社會各界對腦質瘤疾病的關注,幫助患者重拾治療信心。在未來,我們將繼續支持基金會開展多項公益活動,將醫藥創新和人文關懷相結合,聯動社會各方為腦膠質瘤患者帶去福祉和希望,守護他們的每一秒。
再鼎醫藥創始人、董事長兼首席執行官杜瑩博士表示:“我們正在不斷拓展和加強公司在全球研發方面的領軍地位,非常高興Alan能在此刻加入再鼎。 作為腫瘤領域備受尊重的領軍人物,Alan在卓越的職業生涯中對醫藥行業、臨床實踐和學術研究都做出了重要貢獻,在諸多創新腫瘤療法的開發中發揮了關鍵作用。我們非常期待在Alan的領導下,公司的腫瘤管線可以快速推進,助力再鼎向全球領先的生物制藥公司的目標邁進。”
Sandler博士表示:“非常高興能夠加入再鼎醫藥。再鼎擁有強大的創新臨床產品管線,期待能和再鼎同仁攜手合作,加快公司諸多差異化腫瘤產品的開發,使其盡快通過藥物審評審批流程,惠及中國和世界各地亟需的患者。同時我也非常期待參與新候選藥物的評估工作,以進一步擴展公司的腫瘤產品管線。”
Sandler博士在腫瘤及藥物開發領域擁有近30年的經驗。在基因泰克/羅氏任職期間,他帶領團隊負責了多個創新藥物在全球的開發和審批,最近一個產品為PD-L1藥物Tecentriq®(泰圣奇®)。加入基因泰克/羅氏之前,Sandler博士曾擔任俄勒岡州健康與科學大學教授兼血液學/腫瘤學系主任。在此之前,他曾在印第安納大學和范德比爾特大學的醫學院任教。Sandler博士擁有拉什醫學院的醫學博士學位,并在耶魯大學 - 紐黑文醫學中心完成了內科培訓和腫瘤醫學研究員研究。他曾發表過300余篇經同行評議的出版物,包括文章、摘要及書籍中的章節。
關于再鼎醫藥
再鼎醫藥(納斯達克代碼:ZLAB;香港聯交所代碼:9688)是一家處于商業化階段的創新型生物制藥公司,致力于為中國及全球的腫瘤、自身免疫性及感染性疾病患者提供創新藥物。我們致力于滿足快速增長的醫藥市場所帶來的巨大未滿足的醫療需求。為達到這一目標,公司經驗豐富的團隊已與全球領先的生物制藥公司建立了戰略合作,打造起由創新藥物組成的廣泛產品管線。再鼎醫藥已建立起具有強大藥物研發和轉化研究能力的內部團隊,并將打造擁有國際知識產權的候選藥物管線。我們的遠景是成為一家全面整合的創新生物制藥公司,研發、生產并銷售創新產品,為促進全世界人類的健康福祉而努力。
有關公司的更多信息,請訪問www.zailaborary.com或關注官方微信公眾號:再鼎醫藥。
在新政策的支持下,博鰲超級醫院、成美醫療和再鼎醫藥合作,為國內急需患者引進了瑞普替尼這一創新藥物,這也將成為海南自由貿易港總體方案發布后,首個特批帶離先行區使用的臨床急需用藥;首個中國與全球患者同步使用的新藥;首個落地的離島患者管理項目。
胃腸道間質瘤(GIST)是發病率僅次于胃癌和結直腸癌的消化道腫瘤,中國每年約有30,000名新診斷和估計超過10萬名正在進行治療的胃腸道間質瘤患者,而惡性胃腸道間質瘤被認為是最難以治療的腫瘤之一。此次特批先行的瑞普替尼是全球首款用于四線胃腸道間質瘤治療的創新藥物,改變了三線治療進展后患者無藥可用的困境。瑞普替尼今年5月全球首次獲批后,僅2個月就進入海南樂城先行區惠及國內患者,是首個中國與全球患者同步使用的新藥,這也意味著受惠于海南自貿港政策,中國已經跟創新藥的“國際節奏”日趨一致。
博鰲樂城國際醫療旅游先行區管理局局長顧剛表示:“博鰲樂城國際醫療旅游先行區作為中國唯一的‘醫療特區’,惠及于海南自貿港新政,得以進一步加速國際最新上市、國內尚未獲批的創新療法以更快速度惠及國內患者。很高興能通過多方合作,為患者引進瑞普替尼這一最新藥物。先行區將繼續用好用活這些政策,加快打造醫療領域開放新高地,為海南自貿港建設貢獻力量。”
今年3月,《海南博鰲樂城國際醫療旅游先行區臨床急需進口藥品帶離先行區使用管理暫行辦法》(以下簡稱《暫行辦法》)發布,允許患者經過治療等前置程序后,將僅供自用、少量的口服臨床急需進口藥品帶離先行區使用。這一新政策出臺后,有效解決了患者每次使用臨床急需進口藥品必須住院的問題,大幅降低用藥費用,更加方便境內外患者診療。
海南省藥品監督管理局黨委書記、局長賈寧表示:“這一重大利好政策是海南自貿港建設制度創新的最新成果,體現了國家藥監局、省委省政府對先行區的高度關注和支持。未來將更加有力地推動先行區實現醫療技術、裝備、藥品與國際先進水平‘三同步’。”
作為海南自由貿易港建設的重大功能平臺之一,博鰲樂城國際醫療旅游先行區自2013年2月設立以來,通過“先行先試”政策,建設區域醫療高地,聚集了一批全球創新藥械,目前進口特許藥械品種已經突破100例。瑞普替尼將是《暫行辦法》公布后首個特批帶離先行區使用的臨床急需用藥。
這一引進項目將具體落地博鰲超級醫院。博鰲超級醫院常務副院長方丕華表示,“目前,博鰲超級醫院已經成立專門的醫療小組,為這一引進項目的順利落地提供保障并全面收集患者臨床使用中的具體反饋,醫院也將建檔立卡,統計詳實具體的應用數據,用于臨床應用的逐步優化。此外,我們也希望未來有更多先進的器械、藥品落地超級醫院,讓國內患者同步共享國際先進醫療技術。”
作為項目的具體引進牽頭單位,再鼎醫藥與博鰲超級醫院和成美醫療合作,為國內急需使用瑞普替尼的胃腸道間質瘤患者引進產品進行治療,并設計全流程患者管理項目,通過患教培訓、互聯網指導用藥、駐地醫療機構聯動等方式,確保患者用藥安全。保證患者全程安心、便利地使用救命藥。
再鼎醫藥首席商務官、大中華區總裁梁怡表示:“十分高興看到胃腸道間質瘤臨床急需藥品瑞普替尼被特批先行使用。作為第一個獲準帶離先行區特批使用的創新藥品,瑞普替尼國內患者與全球實現了同步使用。未來,再鼎將繼續秉承‘鼎力創新,再澤生命’的宗旨,與政府及社會各界通力合作,針對中國患者尚未得到滿足的醫療需求,盡早為中國患者帶來更多創新藥物,為‘健康中國’目標的實現貢獻力量。”
關于再鼎醫藥
再鼎醫藥(納斯達克代碼:ZLAB)是一家創新型生物制藥公司,致力于為中國及全球的腫瘤、自身免疫性及感染性疾病患者提供創新藥物。公司經驗豐富的團隊已與全球領先的生物制藥公司建立了戰略合作,打造了一系列的候選創新藥物,以滿足中國醫藥市場的快速增長和全球范圍內未滿足的醫療需求。再鼎醫藥已建立起具有強大藥物研發和轉化研究能力的內部團隊,旨在打造起擁有國際知識產權的候選藥物管線。再鼎醫藥的遠景是成為一家全面整合的創新生物制藥公司,研發、生產并銷售創新產品,為促進全世界人類的健康福祉而努力。
有關公司的更多信息,請訪問www.zailaborary.com或關注官方微信公眾號:再鼎醫藥。
]]>