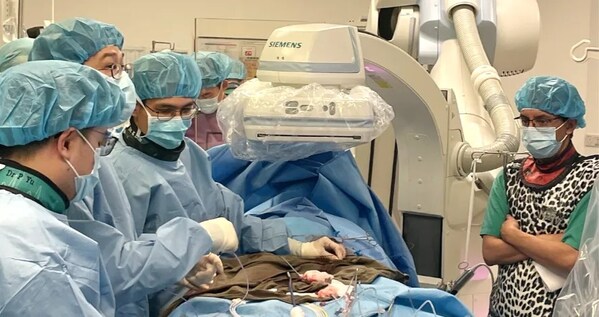
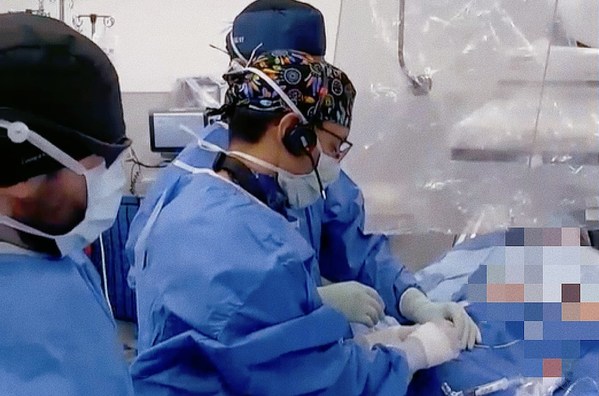
此次臨床試驗由該中心So Chak Yu Kent教授團隊,協同美國弗吉尼亞大學醫學中心Scott Lim教授及超聲科、麻醉科、影像科等多學科團隊共同完成。首兩例患者成功植入后,Venus-Vitae SMART-ALIGN關鍵性臨床將陸續在包含歐洲、北美、中國等全球約20家醫療中心啟動,并納入150例受試者,其研究數據將同時支持歐洲、加拿大、中國等多國的注冊申請。
Venus-Vitae SMART-ALIGN國際多中心臨床研究,全稱為Multicenter Pivotal Study to Evaluate the TreatMent of Severe AoRTic VALve StenosIs UsinG the VeNus-Vitae Transcatheter Heart Valve System(SMART-ALIGN),是針對重度主動脈瓣狹窄患者開展的一項前瞻性、多中心、非隨機、干預性研究。主要用于評估Venus-Vitae經導管主動脈瓣置換系統用于治療重度主動脈瓣狹窄的安全性及有效性。
Scott Lim教授在術后表示:"不久之前,我與Michael Hainstock教授在弗吉尼亞大學醫學中心完成了VenusP-Valve PROTEUS美國關鍵性臨床試驗首例患者植入;時隔兩個月,非常榮幸在威爾士親王醫院參與了Venus-Vitae SMART-ALIGN國際多中心關鍵性臨床首兩例患者的植入。VenusP-Valve與Venus-Vitae的首例患者成功植入是這兩項研究的里程碑式進程。實際上,在此之前VenusP-Valve與Venus-Vitae已順利完成多次臨床應用,效果優異。值得一提的是,Venus-Vitae的瓣架高度是迄今為止經導管主動脈瓣膜產品中最短的,有望在治療主動脈瓣狹窄疾病的同時預留冠脈通路。此外,其干瓣設計便于瓣膜儲藏運輸,縮短術前準備時間。期待其SMART-ALIGN國際多中心臨床入組的快速進展。"
So Chak Yu Kent教授在術后表示:"非常榮幸能夠和Dr Scott Lim在威爾斯親王醫院一同完成Venus-Vitae這款創新干瓣的首兩例確證性臨床患者植入。Vitae性能卓越,操作簡便,其主動防瓣周漏技術和短瓣架設計,能夠有效防止瓣周漏、降低阻擋冠脈的風險。期待SMART-ALIGN研究早日完成臨床入組,造福廣大患者。"
啟明醫療總經理兼首席執行官林浩昇表示:"Venus-Vitae是啟明醫療新一代球囊擴張式經導管主動脈瓣膜系統,擁有全球專利保護。我們對該系統的國際多中心臨床及全球策略充滿信心,此次首兩例患者成功植入,為后期歐洲、北美及中國的臨床試驗開展奠定了良好的基礎。接下來,我們將繼續推進Vitae的全球臨床和注冊,用前沿技術造福全球更多醫患。"
聲明
*本文披露內容僅作信息交流、學術討論之目的,在任何情況下均不得被視為醫療建議或超出前述目的之用途。我司對文中信息的完整性、準確性或及時性不做任何陳述或保證。
*本文提及的任何醫療器械,我司不對其在診療行為中的性能、臨床表現等做任何承諾及保證。
*中文啟明醫療,VENUSMEDTECH,設計過的圖形啟,Venus-Vitae,Venus-Endura等是杭州啟明醫療器械股份有限公司名下商標。
*Venus-Vitae尚未于中國上市。
Copyright 2024杭州啟明醫療器械股份有限公司版權所有。
這是繼2022年4月VenusP-Valve獲得歐洲CE MDR認證后,公司在國際化進程上取得的又一重大里程碑。此次臨床入組的成功植入,開辟了中國自主研發的心臟瓣膜在美國進行正式臨床應用的先河,標志著中國創新器械國際化邁向新高度。
VenusP-Valve是首個獲得美國FDA批準進行臨床研究的中國人工心臟瓣膜,也是首個在歐洲獲批上市的中國人工心臟瓣膜。此前,VenusP-Valve在尚未進入美國正式臨床研究的情況下,多次獲授權進行患者救治,并于美國成功完成多例人道主義使用。
VenusP-Valve PROTEUS臨床研究,全稱為Evaluation of the PerfoRmance Of The VEnUsP-Valve System in Patients with Native RVOT Dysfunction,是針對患有自體右心室流出道(RVOT)障礙伴有中度及以上肺動脈反流的患者開展的一項前瞻性、多中心、非隨機、干預性研究。該研究將納入60例受試者,其研究數據將同時支持美國FDA和日本PMDA的注冊申請。
23年底,VenusP-Valve PROTEUS臨床研究獲美國聯邦醫療保險和聯邦醫療補助服務中心(CMS)批準納入醫保,這意味著所有符合CMS相關醫療保險計劃的受益者,在參加該研究時均可以享受到接受VenusP-Valve治療所對應的報銷。
自2013年實施首例臨床手術至今,VenusP-Valve的臨床使用已有11年。目前,VenusP-Valve已相繼獲德國、法國等國家醫保納入,并在中國、德國、法國、英國、意大利、西班牙、加拿大、澳大利亞等五十余個主流國家注冊上市,持續在新覆蓋的醫療機構實現手術植入。
Scott Lim教授在術后表示:“非常榮幸能夠在弗吉尼亞大學醫學中心完成VenusP-Valve PROTEUS美國關鍵性臨床首例患者入組,手術非常成功。VenusP-Valve有望為嚴重肺動脈瓣膜疾病患者提供更優的臨床選擇。”
Michael Hainstock教授指出:“VenusP-Valve應用于此例青少年患者的手術非常順利,瓣膜部署及釋放位置優異,術后患者未出現肺動脈瓣反流。VenusP-Valve能夠為肺動脈瓣膜疾病治療提供更為廣泛的臨床選擇。”
啟明醫療總經理兼首席執行官林浩昇表示:“VenusP-Valve PROTEUS美國IDE臨床研究首例患者成功植入,是公司在全球關鍵市場邁出的重要一步。此前,美國食品藥品監督管理局(FDA)已授權多例VenusP-Valve人道主義應用,凸顯了該產品獨特的臨床優勢以及監管機構對其的高度認可。接下來,我們會全力推進該產品的臨床進程,加速其在美國FDA及日本PMDA的獲批上市。”
About VenusP-Valve
作為中國及歐洲首個獲批上市的自膨脹式TPVR產品,VenusP-Valve具備顯著的臨床價值。其獨特的雙喇叭口設計,流出端的裸支架設計保障分支血流,穩定的多部位錨定特點,釋放簡便,植入前無需預先放置固定支架。瓣膜尺寸規格多,適用范圍廣,在臨床上可以滿足超過85%大尺寸肺動脈瓣膜患者的需求。
優異的臨床數據證明了VenusP-Valve長期的安全性和有效性。VenusP-Valve歐洲三年隨訪數據顯示,81名接受TPVR手術的患者,手術成功率為100%,全因死亡率及手術再干預率均為0,右室功能顯著改善,僅1名患者出現重度肺動脈瓣反流。
聲明
*本文披露內容僅作信息交流、學術討論之目的,在任何情況下均不得被視為醫療建議或超出前述目的之用途。我司對文中信息的完整性、準確性或及時性不做任何陳述或保證。
*本文提及的任何醫療器械,我司不對其在診療行為中的性能、臨床表現等做任何承諾及保證。
*中文啟明醫療,VENUSMEDTECH,設計過的圖形啟,VenusP-Valve,等是杭州啟明醫療器械股份有限公司名下商標。
Copyright 2024杭州啟明醫療器械股份有限公司版權所有。
赴智利訪問期間,中國駐智利大使牛清報會見了四川大學華西醫院心內科主任陳茂教授及啟明醫療一行。陳茂教授向大使介紹了華西醫院、啟明醫療與智利醫療機構開展學術交流與合作情況,并表示愿進一步推動對智醫療學術交流與合作。牛大使表示智利是一帶一路合作倡議參與方,雙方合作是一帶一路民心相通的真實寫照,希雙方未來合作能為智利患者帶來更多實實在在的好處,促進兩國人民友好。
醫學創新無國界。此次中國專家聯合智利專家,成功應用啟明醫療新一代全釋放全回收干瓣產品Venus-PowerX救助智利患者,將極大促進兩國在結構性心臟病介入治療領域的交流與互惠,助力啟明醫療立足"一帶一路"發展藍圖,為全球心臟瓣膜病患者提供高質量的中國解決方案,開啟一帶一路醫學交流的嶄新篇章。
此行期間,陳茂教授在智利國家胸科研究所與Christian Dauvergne教授、Sandoval Jorge教授帶領的多學科團隊,成功運用啟明醫療新一代100%釋放全回收干瓣系統Venus-PowerX,完成2名心臟瓣膜疾病患者救助。
陳茂教授在術后表示:"非常榮幸來到智利國家胸科研究所與當地專家共同完成2名患者的救治。智利作為南美洲的重要國家,是最早與中國簽署共建"一帶一路"合作諒解備忘錄的國家之一。前不久,智利總統加夫列爾·博里奇對中國進行國事訪問期間,專程來訪四川大學華西醫院,深入交流醫療健康領域合作。Venus-PowerX是中國創新瓣膜技術,也是全球首款全釋放全回收的新一代干瓣產品,非常榮幸能夠將中國的創新技術帶去智利,造福智利的患者。"陳茂教授作為TAVR手術重點中心之一的主要術者,具有極其豐富的臨床經驗,同時擔任Venus-PowerX的主要研究者(PI)。
作為中國最大的TAVR(經導管主動脈瓣置換)中心之一,四川大學華西醫院心臟內科自2012年4月開展中國中西部地區首例TAVR以來,TAVR手術量已達1800余例,在主動脈瓣疾病的介入治療上積累了豐富的經驗。陳茂教授團隊充分發揮臨床經驗優勢,聯合行業龍頭企業杭州啟明醫療器械股份有限公司積極探索深度嘗試醫工交叉合作。此次在智利國家胸科研究所應用的來自中國的創新技術產品Venus-PowerX便是雙方深度醫工交叉"產學研用"結合的典范,更是"一帶一路"國際合作實踐中來自中國的創新醫療技術輸出的典范。
作為中國最早涉足結構性心臟病介入治療器械的企業之一,啟明醫療堅定聚焦以臨床價值為導向的產品創新,引領中國經導管主動脈瓣膜置換術的發展,也矢志不渝持續讓"中國無,世界新"的創新產品走向全球。目前,啟明醫療全系列「中國智造」瓣膜產品已在超過五分之一的"一帶一路"沿線國家上市,覆蓋全球30余個國家和地區。此前,公司多款瓣膜產品于阿根廷、烏拉圭等一帶一路沿線國家獲批上市。
今年是"一帶一路"倡議提出10周年。"一帶一路"國際合作已從基礎設施建設領域延伸至經濟、教育、科技、文化、醫療衛生健康等多個領域。2023年10月,第三屆"一帶一路"國際合作高峰論壇期間,智利共和國總統加夫列爾·博里奇訪問中國,并簽署"一帶一路"合作規劃,進一步明確了通過交流經驗和技術,促進兩國衛生健康合作。
在此背景下,陳茂教授受邀前往智利國家胸科醫院進行手術帶教、學術交流,將促進兩國在結構性心臟病介入治療領域的交流與合作,通過中國方案與技術造福更多智利心臟瓣膜疾病患者,開啟中智兩國"一帶一路"醫學交流的嶄新篇章。
About Venus-PowerX
Venus-PowerX是啟明醫療新一代自膨干瓣TAVR產品,適用于主動脈瓣狹窄患者的治療。Venus-PowerX采用啟明醫療自主研發的特制干瓣,膜片采用原創性的Venus-Endura技術,融合多元抗鈣化技術、去免疫原技術和三維力控干化技術,賦予了瓣膜優異的耐久性、生物相容性和抗鈣化性能,同時實現瓣膜的干態存儲。
此外,Venus-PowerX采用線控技術,在瓣膜100%完全釋放后,仍可進行回收,較常規釋放方式更具安全性。同時,該產品的輸送系統采用全新鞘管設計,優化了柔順性及過弓性。瓣架更為精簡,在保證徑向支撐力的同時,三個"V"口為冠脈介入預留了通路。
值得一提的是,Venus-PowerX配有自適應主動防瓣周漏技術,采用Seadapt裙邊,其具有高壓縮比、高回彈性、自膨脹性、自適應封堵特點,不增加輸送器入路尺寸,植入釋放后自膨脹,主動封堵,填補瓣周縫隙,防瓣周漏效果優異。
雙方將在DF獲批進入市場后,開展深入的商業化合作。德晉醫療會充分利用啟明醫療已經歷經多年建立的覆蓋近500家三甲醫院的市場銷售網絡,完善的市場準入渠道,以及健全的臨床技術培訓體系等優勢基礎展開獨家商業化合作,這也標志著啟明醫療在中國成功開展了TAVR術式推廣應用后,又將臨床培訓要求更高及操作更復雜的經股靜脈導管二尖瓣緣對緣修復技術在中國推廣普及。雙方將攜手并堅信本次合作一定會加速中國心臟瓣膜疾病診療事業發展,為打造未來中國結構性心臟病綜合診療平臺奠定堅實的基礎。
回顧TAVR發展歷程,從2010年中國首例進口品牌TAVR的植入后,到2017年首個國產品牌TAVR商業獲批,2022年全年商業化植入不足8,000例,累計至今商業化植入量不足20,000例。TAVR是中國創新技術引領的,必須改變傳統進口替代的零和博弈思路,啟明醫療作為中國領先的心臟瓣膜微創介入領域的領軍企業,更加專注市場培育與擴大。基于本次戰略營銷合作意向,雙方將本著共同的目標與期望,攜手解決創新技術在推廣普及中面臨的難點,普及中國心臟瓣膜疾病技術。
目前,啟明醫療已累積完成超15,000例的植入。通過此次合作,德晉醫療將借鑒啟明醫療在TAVR的資源積累和營銷經驗,探索更多的創新價值服務,進一步加速擴展二尖瓣市場,領航二尖瓣治療領域,造福更多中國患者。
董事會期待雙方進行營銷戰略合作,充分發揮各自的業務優勢,憑借強大的商業化能力,加速DF的商業化進程,持續增強啟明醫療的核心競爭力,進一步提升市場占有率。
聲明
*本文披露內容不保證所載關于本集團業務發展之任何前瞻性聲明,或任何事宜將可達成、將真實發生或將實現或屬完整。本文提及DF系統截至本文發布日尚未獲得中華人民共和國國家藥品監督管理局頒發的醫療器械注冊證。
*本文提及的任何醫療器械,我司不對其在診療行為中的性能、臨床表現等做任何承諾及保證。
*中文啟明醫療,VENUSMEDTECH,設計過的圖形啟,等是杭州啟明醫療器械股份有限公司名下商標。
Copyright 2023杭州啟明醫療器械股份有限公司版權所有。
財報顯示,2023年上半年,啟明醫療實現銷售收入2.56億元人民幣,同比增長21.74%,達成預期增長目標。基于"本土利潤化"戰略,公司通過優化銷售成本及費用,提升運營效率,在中國本土市場實現商業化正收益。截至目前,公司主營產品VenusA系列產品中國市場總植入量已超過15,000例。
上半年,啟明醫療海外銷售共錄得2249萬元人民幣,同比增長60.37%,主要得益于首個在歐洲上市的國產經導管肺動脈瓣置換(TPVR)系統VenusP-Valve的強勁增長。該產品在海外終端植入量大幅提升,環比增長80%,其中,以德國、法國等為代表的歐洲國家植入量占比約77%,體現出國際主流市場對VenusP-Valve的高度認可。
基于"國際本土化"戰略,啟明醫療成立國際先心病業務部門,并委任Shakeel Osman為國際先心病業務負責人,深入貫徹以本土人才推動國際商業化的營運策略。VenusP-Valve已相繼獲德國、法國等國家醫保納入,并在中國、德國、法國、英國、意大利、西班牙等三十余國注冊上市,實現了全球主流市場"全覆蓋"。
此外,VenusP-Valve于近期獲美國FDA批準IDE申請,成為首個獲FDA批準進行臨床研究的中國產人工心臟瓣膜,根據計劃,該產品將在下半年于美國及日本的十余個醫療中心啟動關鍵性臨床研究,入組病例數為60名。
2023年是啟明醫療多元產品管線創新突破的關鍵一年,多款產品已在全球主流市場進入關鍵性臨床研究階段,推動公司的研發創新躋身全球第一梯隊。包括可同時用于治療二尖瓣/三尖瓣反流的Cardiovalve,用于治療肥厚型心肌病的Liwen RF射頻消融系統,用于治療主動脈瓣狹窄的新一代TAVR產品Venus-Vitae和Venus-PowerX,以及用于治療頑固性高血壓的腎動脈交感神經消融系統(RDN)等。
其中,經導管介入瓣膜置換創新系統Cardiovalve國際多中心臨床進展迅猛,其針對三尖瓣反流的關鍵性臨床研究TARGET CE已完成近50例患者入組,覆蓋歐洲及北美幾十家知名心血管中心。Liwen RF于今年3月在中國成功完成關鍵性臨床研究入組,計劃年內在中國申報注冊。
新一代TAVR球擴干瓣產品Venus-Vitae于歐洲介入心臟病學大會期間成功召開國際臨床研究執行委員會會議,國際多中心關鍵性臨床研究即將啟動。今年5月,國際首款全回收干瓣產品Venus-PowerX于阿根廷獲批上市,并在美國心血管研究技術年度研討會(CRT),法蘭克福先天性、結構性和瓣膜性心臟病介入治療大會(CSI)多次亮相,吸引了瓣膜介入治療領域的諸多國際專家廣泛關注。
此外,公司基于雙模態超聲技術平臺開發的RDN產品,已進入動物試驗階段。近期,美國FDA醫療器械咨詢委員會針對超聲消融系統Paradise以高票數支持其上市前批準申請,大幅提升了超聲消融技術在RDN療法的應用前景。公司將推動該產品盡快進入人體研究。
啟明醫療聯合創始人、執行董事兼總經理訾振軍表示:"一直以來,啟明醫療堅持國際本土化,本土利潤化兩大核心戰略。下一個三年,啟明醫療將步入國際化戰略的收獲期,四瓣一體全系列解決方案將在歐美主流市場實現上市,這將開創中國高端醫療器械出海的新紀元。相信未來,中國醫療器械在全球舞臺必將占有一席之地。"
IDE是指對醫療器械免除對于以上市銷售為目的的器械產品的法律管治條件,以便其進行醫療器械的臨床試驗。IDE申請獲批意味著VenusP-Valve可以啟動在美國的關鍵性臨床研究,為上市前批準(Pre-Market Approval,PMA)提供支持。通過由美國FDA和日本PMDA共同設立的Japan-US Harmonization By Doing項目,本次臨床研究將在美國的10個醫療中心與日本的5個醫療中心同步開展,預計共入組60例患者。去年,VenusP-Valve已在美國完成兩例人道主義使用。
VenusP-Valve是公司國際化的拳頭產品,已于2022年4月8日獲得歐盟CE MDR認證,是首個在新法規下獲批的III類心血管植入類醫療器械。截至目前,VenusP-Valve已覆蓋中國、英國、意大利、西班牙、丹麥、希臘、法國、德國、波蘭、瑞士等三十余個主流國家,并持續在新覆蓋的醫療機構實現手術植入。
作為中國及歐洲首個獲批上市的自膨脹式TPVR產品,VenusP-Valve具備顯著的臨床價值。其獨特的雙喇叭口設計,流出端的裸支架設計保障分支血流,穩定的多部位錨定特點,釋放簡便,植入前無需預先放置固定支架。瓣膜尺寸規格多,適用范圍廣,在臨床上可以滿足超過85%大尺寸肺動脈瓣膜患者的需求。
VenusP-Valve歐洲三年期隨訪數據顯示,64名接受TPVR手術的患者(尚有部分患者由于新冠疫情未能計入)手術成功率為100%,全因死亡率及手術再干預率均為0,所有患者均未出現中度或重度肺動脈瓣反流;96.87%受試者的瓣周漏及三尖瓣反流在輕度以內。
根據計劃,VenusP-Valve將于今年下半年在美國入組患者,2024年初開始在日本入組患者,預計可于2026年左右在美國及日本同步獲批上市。除VenusP-Valve外,公司管線中的核心產品如二/三尖瓣置換系統Cardiovalve,新一代主動脈瓣膜系統Venus-Vitae,Venus-PowerX等,均預期于2026年開始陸續在中國及國際市場獲批上市。
啟明醫療聯合創始人,執行董事兼總經理訾振軍先生表示:"VenusP-Valve的IDE申請獲批,是公司國際化戰略的重大里程碑,充分展現了啟明人銳意進取,突破創新的精神。隨著創新產品陸續進入收獲期,2026年將成為啟明醫療國際化真正的騰飛之年,我們非常期待VenusP-Valve早日完成患者入組并獲得臨床隨訪結果,完成其在美國市場批準上市。"
2022年度,公司自主研發的經導管肺動脈瓣膜置換(TPVR)系統VenusP-Valve,作為首個獲得歐盟CE MDR批準的III類心血管植入器械,登陸歐洲市場,創造了中國瓣膜出海的歷史。銷售半年,即完成超4000萬元人民幣的收入,并已在英國、意大利、西班牙、丹麥、希臘、法國、德國、波蘭、瑞士等20余個國家及地區獲準上市,充分驗證了該產品的臨床及商業價值。目前,公司已向美國FDA遞交IDE申請,即將開啟VenusP-Valve在美國和日本的確證性臨床研究。同時,VenusP-Valve也在中國開啟了采用歐洲臨床數據注冊上市的先河,為后續產品采用境外數據在中國申報,以及開展國際多中心研究奠定了基礎。
過去一年,公司持續深耕全球創新市場,不斷完善全球化創新體系與產品布局。1月,完成對國際知名的二/三尖瓣置換系統創新公司Cardiovalve的收購, 隨后,又在以色列成立啟明醫療國際瓣膜創新中心,全球化運營團隊愈加壯大。去年全年,Cardiovalve在歐美完成了近20例患者的入組,并于美國境內完成首例三尖瓣置換手術。針對三尖瓣反流的國際多中心確證性臨床研究TARGET CE于22年底正式啟動,目前已順利完成近20例患者入組,預計可在2023年內完成絕大多數患者入組。此外,公司自主研發的新一代TAVR干瓣產品Venus-Vitae, Venus-PowerX等的國際多中心臨床研究推進順利,全球市場獲批上市穩步推進。
值得一提的是,國際首創用于治療肥厚型心肌病的Liwen RF射頻消融系統確證性臨床試驗入組已于2023年3月完成,中國上市銷售指日可待。臨床研究動態隨訪數據顯示,隨訪至術后6個月的38位受試者,治療成功率高達92.11%,相較于酒精消融成功率獲得大幅度提升。臨床終點中,最大室間隔厚度平均降至17.08mm,較術前下降25.61%;左室流出道壓力階差術后降至16.31mmHg,較術前下降76.25%,兩項重要指標均較術前獲得顯著改善,并呈現持續改善趨勢。Liwen RF為HCM治療提出了一種安全有效、精確微創的創新性治療策略,已吸引歐洲結構性心臟病資深專家深切關注。此前,該產品已通過NMPA創新醫療器械特別審批申請,獲準進入特別審查程序,充分證明了其創新性。
縱觀國內,啟明醫療作為唯一一家可提供四瓣一體全系列瓣膜解決方案的供應商,長期競爭壁壘穩固。公司已擁有三款獲批上市的TAVR產品、一款TPVR產品,豐富的產品管線為廣大醫患提供全面、優化的治療選擇,有利于鞏固公司的市場領先地位。
公司VenusA系列產品2022全年累計終端植入量約3500臺,繼續以50%的市場份額領跑全行業。截至目前,VenusA系列產品總植入超12,000例,使得公司成為國內首家TAVR產品植入破萬的企業,銷售覆蓋全國超400家醫院和診療中心。值得關注的是,今年以來,隨著疫情的逐漸消弭,國內TAVR市場逐步回暖,預計全行業將持續恢復。公司今年一季度銷售顯著增長,2月及3月國內植入量同比增長55%,并創出近三年來月度手術量新高。
公司參與投資的創新器械公司德晉醫療自主研發的的經股靜脈行二、三尖瓣緣對緣修復(TEER)的創新器械DragonFly,已完成針對退行性二尖瓣反流(DMR)中國確證性臨床的患者隨訪,已向中國NMPA遞交上市申請,有望成為首款獲批上市的國產經股靜脈二尖瓣緣對緣修復器械。
啟明醫療高度重視海內外營銷管理,打造特色學術生態,與醫生共成長。22年全年,公司自辦五大品牌會議,累計52場,覆蓋專家476人,累計觀看量24萬人次;參與專題會、手術直播、培訓工坊等多種學術活動40余場,覆蓋專家超1200人,其中涉及線上會議30余場,累計觀看量超70萬人次。同時,公司還參與如倫敦心臟瓣膜會議(PCR London Valves)、以色列國際心血管創新大會(ICI)等國際心臟病領域大會,與國際頂尖專家建立良好關系;構建海外創新生態與合作伙伴網絡,提升全球品牌力。
展望2023年,啟明醫療將持續推進基于全球、致力創新的可持續增長戰略。公司當前在手現金近19億元人民幣,充足的資金將為長期發展提供強有力的支持。放眼國際,公司將進一步推進國際銷售布局、加速推動全球多中心臨床研究;持續優化全球運營管理效率,提升海外商業利潤率。反觀國內,公司將堅定貫徹高質量利潤化商業目標,不斷優化銷售效率、降低生產成本、穩定產品供應鏈,聚焦頭部及腰部醫院,進一步提升單院手術量。
啟明醫療創始人、執行董事兼總經理訾振軍表示,"2022年是啟明醫療國際化不斷深化的一年。這一年,公司海外商業化取得量與質的全面增長,一款創新產品獲批上市、多款創新產品邁入國際多中心臨床的新階段。同時,公司的全球運營管理效率不斷提高,國際化利潤策略成果顯著。科技創新無國界,啟明醫療將繼續聚焦以臨床價值為導向的產品創新,持續開發"中國無,世界新"的技術,為全世界人民帶來福祉。"
Liwen RF®由啟明醫療全資子公司杭州諾誠醫療科技有限公司自主研發,是一款應用Liwen術式原理治療HCM的創新醫療器械。該確證性臨床試驗由空軍軍醫大學第一附屬醫院超聲醫學科劉麗文教授擔任主要研究者(PI), 復旦大學附屬中山醫院葛均波院士和山東大學齊魯醫院張運院士擔任共同PI。自2021年1月首例臨床入組起,該產品已在空軍軍醫大學第一附屬醫院、復旦大學附屬中山醫院、山東大學齊魯醫院、浙江大學醫學院附屬第二醫院、四川大學華西醫院、廣東省人民醫院、廈門大學附屬心血管病醫院、康復大學青島醫院青島市市立醫院、鄭州市第七人民醫院、大連醫科大學附屬第一醫院和山西省心血管病醫院等20個中心完成128例患者入組。
Liwen RF®具有創傷小、精準定位、不受靶血管限制、顯著減少室間隔厚度、降低傳導系統損傷等并發癥的技術優勢,為HCM治療提出了一種安全有效、精確微創的創新性治療策略。2022年8月,該產品通過國家藥品監督管理局的創新醫療器械特別審批申請,獲準進入特別審查程序。
早期探索性臨床試驗與傳統外科金標準手術的對照結果顯示,LiwenRF®的手術成功率高達88%,術后1年零死亡,患者臨床表現、心臟功能及生活質量顯著改善,且明顯優于外科手術及酒精消融術,有力地證明了其安全性和有效性以及器械性能的先進性。今年1月,該產品所屬的診療創新術式Liwen術式還獲得空軍軍醫大學2022年度臨床新技術診療類一級甲等項目等級評定。
除早期144例探索性臨床試驗外,去年3月,JAMA Cardiology期刊上發表劉麗文教授團隊最新研究,200例采用Liwen術式治療HCM患者的中長期隨訪結果顯示,Liwen術式能有效降低并發癥和死亡率,且無一例需植入永久起搏器,再次驗證該產品的長期安全性和有效性。此外,該術式榮獲國際CSI大會杰出創新獎、陜西省科技進步一等獎,并寫入《中國肥厚型心肌病指南2023年版》。
一分鐘了解HCM及療法
肥厚型心肌病(HCM)是全球范圍內常見的遺傳性心血管疾病,也是青少年和運動員心源性猝死(sudden cardiac death,SCD)的首要原因,美國、日本及歐洲流行病學研究表明患病率為0.17%-0.23%,據此估算全球約有2000萬例患者。我國患病率約為0.18%,按此估算中國有超過200萬例成人HCM患者.約40%-60%的HCM患者是由心肌肌小節蛋白基因突變所致,這意味著通過對現有患者群的治療,仍難以顯著減少未來發病人數。此外,由于缺乏規范的遺傳篩查體系及影像技術應用限制,HCM的患者數被顯著低估,臨床確診率僅有10%,這是中國SCD人數居高不下的重要原因。
全球范圍內對HCM尚無非常完善的療法,現有主流療法均是以通過改善患者臨床癥狀與心功能,控制并發癥與預防疾病進展為主。近年來HCM治療領域最受關注的藥物是Mavacamten。2020年10月,百時美施貴寶(BMS)宣布以131億美元現金、溢價60%收購MyoKardia,以獲得其在研新藥心肌肌球蛋白別構抑制劑Mavacamten,可用于梗阻性肥厚型心肌病(HOCM)患者的治療。臨床結果顯示,盡管Mavacamten達到了主要和次要臨床終點,但其主要作用為緩解梗阻,并未能減少室間隔厚度,對重度HOCM患者的治療效果有限。
外科室間隔旋切術需開胸,創傷大,風險高,易損傷傳導束,引起傳導阻滯,最終易導致心力衰竭,對術者要求高;酒精消融術對于第一間隔支與梗阻部位不匹配的患者不能徹底解除其左室流出道梗阻;植入型心律轉復除顫器(ICD)是目前唯一有效預防HCM患者SCD的治療方法,但ICD電擊影響患者生活質量,并發癥比例較高,且未能減少室間隔厚度。Liwen術式的出現為安全有效治療HOCM提供了可能。
劉麗文教授表示:"終于迎來Liwen RF®臨床入組收官這一激動人心的時刻,在此感謝啟明醫療像'滑輪'一般,大幅助推了臨床手術的入組和推廣;作為超聲科醫生,非常欣慰這個術式得到心內科與心外科的高度配合和支持認可。現階段HCM患者體量因篩查手段受限被嚴重低估,相信隨著Liwen術式的大力推廣,未來將造福更多患者。"
陳茂教授表示:"感謝劉麗文教授親臨現場,并選擇華西醫院進行Liwen RF®進行收官之作,這是對我們中心技術的高度認可;同時感謝啟明醫療,我們希望可以后發先至,在Liwen RF®這款產品的后期推廣上爭得頭部位置,讓更多HCM患者得到救治。"
啟明醫療創始人、執行董事兼總經理訾振軍也感慨萬分,他指出Liwen RF®應用于國際首創的超聲引導下經心肌室間隔射頻消融術,不久前也被歐洲資深專家深切關注并呼吁將該術式納入結構心解決方案的重要一環。不僅如此,我們還將本著真正解決患者問題的初心,持續探索擴張Liwen RF®適應癥,與現有產品線形成更強大的組合,憑借中國高速進展同步推進海外臨床研究和上市。
財報顯示,2022年上半年,啟明醫療實現銷售收入2.10億元人民幣,環比增長18.9%,毛利1.64億元人民幣,環比增長20.5%。其中,海外銷售錄得1,400萬元,同比增長150.9%。值得一提的是,今年在歐洲注冊上市的首個國產經導管肺動脈瓣置換(TPVR)系統VenusP-Valve,銷售僅2個月,即完成900萬元人民幣的銷售收入,體現出海外商業的巨大潛力。
2022年是啟明醫療國際化深化的關鍵一年,公司自主研發的創新TPVR系統VenusP-Valve在歐盟的獲批上市,實現國產瓣膜在歐洲市場上市"0"的突破。同時,VenusP-Valve也在中國開啟了采用歐洲臨床數據注冊上市的先河,為后續產品采用境外數據在中國申報,以及開展國際多中心研究奠定了基礎。VenusP-Valve在歐洲的獲批上市還促成該產品在美國的人道主義使用,成為首個在美國臨床使用的國產肺動脈瓣產品。目前,VenusP-Valve已召開美國臨床研究者會議,積極推進該產品在美國和日本的多中心臨床研究。
今年1月,公司通過對創新器械公司Cardiovalve的并購整合,完成了在結構性心臟病領域最具創新潛力的二尖瓣/三尖瓣疾病介入療法的布局。Cardiovalve是美國FDA批準的唯一一款可同時用于二尖瓣反流與三尖瓣反流的治療器械,用于三尖瓣反流已在美國獲得"突破性認證"資格。完成收購后,Cardiovalve在過去6個月內,在歐美完成了10多例患者的入組,手術均取得成功,患者恢復良好。該產品將于今年內在中國開展臨床研究,并在美、歐等地共同推進全球多中心臨床研究,為實現全球上市奠定扎實基礎,以期為全球患者帶來創新解決方案。
此外,公司還有多款全球創新產品處于臨床階段中,包括用于治療肥厚型心肌病的Liwen RF?射頻消融系統,用于治療主動脈瓣狹窄的新一代TAVR產品Venus-PowerX和Venus-Vitae,用于治療頑固性高血壓的腎動脈交感神經消融系統等。公司將繼續推進上述產品在中國及歐美發達國家的臨床研究。值得一提的是,Liwen RF?射頻消融系統于近日剛獲準進入創新醫療器械特別審查程序,將加速該產品在中國的上市進程。
反觀國內,今年上半年疫情影響仍有反復,對中國創新器械的放量造成持續的負面影響。在這種環境下,啟明醫療堅持以追求經營利潤為目標,尋求高質量增長,保證核心中高端醫院份額,確保毛利率的穩定。今年上半年,國內銷售錄得1.96億元,環比增長14.1%,主要來自中國首款獲批上市的第一代及第二代TAVR產品VenusA-Valve及VenusA-Plus的銷售貢獻,其中VenusA-Plus占比約為60%。
2022年上半年,VenusA系列產品累計終端植入量約1800臺,啟明醫療以約63%的市場份額領跑行業。截至目前,VenusA系列產品總植入超過10,000例,公司成為國內首家TAVR產品植入破萬的企業,銷售覆蓋全國超370家醫院和診療中心,VenusA系列產品的市場先發優勢也使其積累了豐富的臨床隨訪數據,器械的安全性、有效性得到充分驗證。VenusA-Valve是目前中國唯一具有七年以上長期安全性數據的TAVR產品。
展望下半年,公司將聚焦國際化、利潤化兩大目標,從國際市場來看,深化國際商業化能力,持續擴大海外收入占比,以此提升海外市場影響力;國內市場方面,公司將不斷優化銷售效率,提升中高等級醫院單院產出,并通過降低生產成本和費用提升利潤率水平。
啟明醫療創始人、執行董事兼總經理訾振軍表示,"縱觀全球,后疫情時代對企業的生存構成重大威脅,在當前這個資本謹慎、貿易環境惡劣、東西方惡性競爭的寒冬里,活下去是企業的第一要務。啟明醫療堅持國際化、利潤化兩大核心目標,只有夯實企業生存之本,才能邁向國際新征程。我們將提質增效,以強化自身造血能力為導向,唯此才能克服內卷,尋求國際化突破,度過寒冬,用生存確保未來的發展。"
這是繼6月中旬VenusP-Valve?首次成功植入美國患者后的第二例臨床使用。此次手術由弗吉尼亞大學高級心臟瓣膜中心的Scott Lim教授團隊,在中國醫學科學院阜外醫院張戈軍教授全程線上支持指導下共同完成。
患者為一名31歲男性,病例情況較為復雜。其患有先天肺動脈閉鎖,在多次手術后,再次出現重度肺動脈瓣反流且伴有嚴重鈣化和狹窄,同時有顯著的右心室、肺動脈擴張及左心室功能障礙。
術前,Scott Lim教授團隊與張戈軍教授就患者病情多次分析討論并制定詳盡的手術策略,并基于術中造影和球囊測量的結果,最終精準的選用P30-25(瓣膜腰部直徑30mm,長度25mm) VenusP-Valve?瓣膜完成植入,即刻進行造影和超聲情況綜合評估,顯示瓣膜植入位置完美,無反流,術后壓差降至10mmHg。
VenusP-Valve?于今年5月獲美國食品藥品監督管理局(FDA)批準,可在美國開展兩例人道主義使用。因此,盡管該產品尚未在美國進入正式臨床研究,仍可給予患有嚴重威脅生命疾病的患者緊急使用。
Scott Lim教授在術后表示:"患者的心臟解剖結構復雜,是極具挑戰的病例,但VenusP-Valve?易于操作,且釋放極為穩定,使得患者在術后的情況有顯著好轉,期待該產品盡快在美國進入正式臨床研究,造福更多患者。"
張戈軍教授指出,VenusP-Valve?作為國內第一款自膨脹經導管肺動脈置換瓣膜,已經獲得歐洲CE和中國NMPA認證上市,臨床數據充分表明該產品的安全性和有效性。本次手術的成功進一步為這款中國制造的瓣膜走向美國打下堅實基礎。
盡管美國市場已上市有幾款TPVR系統,但考慮到相當一部分患者存在右心室流出道及肺動脈顯著擴張等情況,仍處于"無械可用"的狀態。而VenusP-Valve?的大直徑優勢,在臨床上可以滿足超過85%的大尺寸肺動脈瓣患者的需求。
啟明醫療創始人,執行董事兼總經理訾振軍表示:"VenusP-Valve?兩例美國人道主義使用的開展,凸顯出患者對該產品迫切的臨床需求以及監管機構對公司產品的高度認可。VenusP-Valve?已在全球多個主流國家進入臨床或上市申請階段,是中國本土創新醫療器械進軍全球市場的典范。我們有充分的信心推動該產品在全球的快速上市,惠及世界患者。"
作為中國及歐洲首個獲批上市的自膨脹式TPVR產品,VenusP-Valve®具備顯著的臨床價值。其獨特的雙喇叭口設計,流出端的裸支架設計保障分支血流,穩定的多部位錨定特點,釋放簡便,植入前無需預先放置固定支架。瓣膜尺寸規格多,適用范圍廣,在臨床上可以滿足超過85%大尺寸肺動脈瓣膜患者的需求。
此次上市申報,VenusP-Valve®采用接受境外臨床試驗途徑進行立卷受理,也即利用了歐洲臨床試驗數據進行注冊。今年4月,該產品已在CE MDR獲批上市,并進行了多次商業化使用;5月即獲FDA批準在美國進行兩例人道主義使用,并于6月順利完成首例使用。此外,VenusP-Valve®已召開美國IDE臨床研究者會議,并通過Japan-US Harmonization By Doing項目,計劃同時在美國和日本開啟臨床試驗,加速在兩國的注冊上市。
自2013年首例臨床手術至今,VenusP-Valve®的臨床使用已有9年,出于人道主義救助的臨床使用近300例,覆蓋亞洲、歐洲、北美洲、南美洲,遍及20多個國家及地區。歐洲及中國臨床數據證明了該產品的長期安全性和有效性,并得到國內外專家的高度認可。
VenusP-Valve®歐洲三年期隨訪數據顯示,64名接受TPVR手術的患者(尚有部分患者由于新冠疫情未能計入)手術成功率為100%,全因死亡率及手術再干預率均為0,所有患者均未出現中度或重度肺動脈瓣反流;96.87%受試者的瓣周漏及三尖瓣反流在輕度以內;中國五年期臨床隨訪結果則顯示,術后患者五年期全因死亡率僅為3.64%。
值得一提的是,2021年3月,憑借微創介入自膨式肺動脈瓣膜系統關鍵材料及技術,公司榮獲2020年度高等學校科學研究優秀成果獎(科學技術)技術發明獎一等獎。該技術主要應用于VenusP-Valve®,為啟明醫療與四川大學共同開發,并獲"十三五"國家重點研發計劃立項支持。
復旦大學附屬中山醫院心內科主任葛均波院士作為VenusP-Valve®中國臨床研究PI,對該產品此次NMPA獲批上市表示祝賀。"2013年5月,我們開啟了該產品的全球首例臨床試驗,術后即刻效果非常優異;VenusP-Valve®多中心研究的整體臨床結果凸顯了該產品對于患者心功能的改善持續,有效和穩定,為自主研發的國產瓣膜深感驕傲!不久前該產品首登歐洲市場、并在美國率先完成首例人道主義使用,也充分印證國際醫學界給予的認可,這是一款真正造福全球醫患的創新產品。"
近年來,響應國務院關于藥品醫療器械審評審批制度改革的要求,國家藥品監督管理局醫療器械技術審評中心(簡稱"器審中心")通過持續改進創新政策、提高審評質量和效率,不斷優化審評工作,有效加快了國產創新器械的審評審批進度,助推產業高質量發展。器審中心先后發布了《創新醫療器械特別審批程序》《醫療器械優先審評程序》等政策,開通了臨床急需創新醫療器械綠色通道,建立了"接受境外臨床試驗數據"等指導原則,集中體現了"科學審評、鼓勵創新"的積極導向。
"此次VenusP-Valve®中國的快速獲批,離不開器審中心的大力支持,真正做到‘以患者為本',也推動了創新器械的快速發展。" 啟明醫療聯合創始人,執行董事兼總經理訾振軍表示,"作為中國最早涉足結構性心臟病介入治療器械的企業之一,啟明醫療堅定聚焦以臨床價值為導向的產品創新,引領中國創新技術的發展,矢志不渝堅持研發‘中國無,世界新'的創新產品。VenusP-Valve®的中國獲批上市,是繼該產品CE MDR獲批之后的重大里程碑,填補了國內TPVR市場的空白,也將造福更多中國醫患。"
該例手術是由弗吉尼亞大學高級心臟瓣膜中心的Scott Lim教授團隊,在中國四川大學華西醫院心內科馮沅教授現場指導及陳茂主任的線上指導下共同完成,這創造了中國自主開發的心臟瓣膜在美國臨床使用的先例,充分體現了VenusP-Valve?所具備的獨特臨床價值和全球創新意義。
盡管美國市場已上市有幾款用于經導管肺動脈瓣置換(TPVR)的系統,包括美敦力的Melody、Harmony及愛德華的SAPIEN系列等,但有相當一部分患者存在右心室流出道過度擴張等情況,仍處于"無械可用"的狀態。而VenusP-Valve?的大直徑優勢,在臨床上可以滿足超過85%的大尺寸肺動脈瓣患者的需求。此前,VenusP-Valve?于今年5月剛獲美國FDA批準進行兩例人道主義使用。
患者為一名21歲的男性,法洛氏四聯癥外科補片修復術后,患有重度肺動脈瓣反流且有顯著的右心室、肺動脈擴張及左心室功能障礙。手術采用局部麻醉方式,患者清醒狀態下經由右側股靜脈主入路,結合術前CT分析、術中造影及球囊測量,最終術中精準的選用P34-25(瓣膜腰部直徑34mm,長度25mm) VenusP-Valve?瓣膜完成植入。患者術后第一天,超聲檢查右室明顯變小,無任何肺動脈瓣反流,左室功能恢復正常。經評估患者術后恢復良好,并已于當地時間6月18日出院(術后24小時內)。
Scott Lim教授在術后表示,非常榮幸能和陳茂教授及馮沅教授一同完成VenusP-Valve?的美國首例人道主義使用。這款產品在使用過程中非常易于操作,產品的設計便于術者精準定位及釋放。患者在術后的情況有顯著好轉,期待VenusP-Valve?盡快在美國開展正式臨床研究,造福更多患者。
陳茂教授對VenusP-Valve?美國首例人道主義使用的成功植入表示祝賀。他指出,2013年全球首例VenusP-Valve?成功植入至今,該產品持續受到國際上相關領域專家的廣泛認可,尤其適用于伴有右室流出道顯著擴大的患者。此外,微創介入的治療方法減少患者手術創傷,術后恢復也快,為患者的家庭和社會生活質量都帶來了整體的提升。
馮沅教授表示:"VenusP-Valve?是一款優秀的經導管介入肺動脈瓣膜產品,獨特的雙喇叭狀設計,可以一次性植入支架和瓣膜,手術操作更便捷,是自體肺動脈瓣反流患者的微創介入治療的利器。這款國產自主研發產品的落地美國,是中國人的驕傲。"
今年4月,VenusP-Valve?成為全球首個由中國公司開發在歐洲獲得CE MDR批準的自膨脹TPVR產品,其獨特的雙喇叭口設計,流出端的裸支架設計保障分支血流,穩定的多部位錨定特點,釋放簡便,植入前無需預先放置固定支架。瓣膜尺寸規格多,適用范圍廣,在臨床上可以滿足超過85%患者的需求。該產品也已在中國處于上市審評中,預計將于今年內獲批上市銷售。
自2013年在中國開展首例臨床手術至今,VenusP-Valve?的臨床使用已有9年,出于人道主義救助的臨床使用近300例,覆蓋亞洲、歐洲、北美洲、南美洲,遍及20多個國家及地區。2021年3月,該產品還獲得英國藥品和醫療保健品管理局(MHRA)授予的特殊使用許可。
優異的臨床數據證明了VenusP-Valve?長期的安全性和有效性。歐洲兩年期臨床研究數據顯示,臨床手術操作成功率達100%,兩年內未出現再次手術或死亡。中度及重度肺動脈瓣反流分別從術前16.88%及83.12%大幅降至0%。數據表明,該產品性能優異,安全可靠,對于患者心功能的改善顯著、穩定且持續。
啟明醫療創始人,執行董事兼總經理訾振軍表示:"VenusP-Valve?首例人道主義使用的開展,凸顯出患者對該產品迫切的臨床需求以及監管機構對公司產品的高度認可。VenusP-Valve?已在全球多個主流國家進入臨床或上市申請階段,是中國本土創新醫療器械進軍全球市場的典范。我們有充分的信心推動該產品在全球的快速上市,惠及世界患者。"
這是繼Venus-Vitae和Venus-PowerX后,啟明醫療又一款進入臨床研究的新一代干瓣產品,標志著啟明醫療在提升生物瓣膜使用壽命的同時,實現主動脈瓣膜疾病解決方案的全布局,對于鞏固公司在中國心臟瓣膜病治療領域的領導者地位具有里程碑意義。
此次臨床試驗由武漢協和心臟大血管外科主任董念國教授,以及劉雋煒教授,王寅教授等組成的多科室團隊共同完成。
患者為女性,67歲,因長期咳嗽伴呼吸困難并于近期加重入院,超聲提示主動脈瓣中至重度關閉不全、三尖瓣輕至中度關閉不全、二尖瓣輕度關閉不全。經評估采用Venus-Neo實施外科主動脈瓣置換術(Surgical Aortic Valve Replacement, SAVR),術后瓣膜開合良好,無反流及瓣周漏;人工瓣膜流速1.4m/s, 平均跨瓣壓差7mmHg,血流動力學表現優秀。
作為啟明醫療首款外科生物瓣,Venus-Neo采用環上瓣設計,以牛心包組織作為瓣葉,通過優化瓣膜設計和獨特的抗鈣化干化處理技術(Venus-Endura),可置于無液體環境下保存,且不含醛殘留,在提升安全性的同時,便于臨床使用和儲藏運輸。此外,Venus-Neo的瓣膜支架采用可擴張設計,為未來需要接受“瓣中瓣”治療的患者提供更優選擇。2020年9月,啟明醫療與長春皓月清真肉業股份有限公司成立合資公司 -- 吉林啟明皓月生物科技有限公司,這一戰略合作確保了穩定及符合高標準要求的原材料供應體系。
心臟瓣膜病(valvular heart disease, VHD)是全球高齡人群主要疾病之一[1],全球患者超過4000萬人[2]。隨著中國人口老齡化,主動脈瓣疾病已經成為主要的心臟瓣膜疾病之一,主要為主動脈瓣狹窄(Aortic Stenosis, AS)和主動脈瓣反流(Aortic Regurgitation, AR)。而針對AS和AR的治療,SAVR仍是較為成熟的治療方式。然而,生物瓣衰敗后再次SAVR帶來的高風險也不容忽視。對于這類患者,經導管主動脈瓣置換術(transcatheter aortic valve replacement,TAVR)是再次SAVR的可行替代方案,瓣中瓣(Valve-in-Valve,ViV)TAVR已被逐步應用于外科生物瓣膜衰敗的治療。
最新發表的PARTNER2 ViV試驗5年的隨訪數據顯示,高手術風險主動脈瓣生物瓣衰敗患者行TAVR干預,臨床狀態和超聲心動圖結果均持續改善[3]。同時,研究提示ViV-TAVR在主動脈瓣生物瓣毀損的治療中行之有效,需基于兩個必要因素: 1. 應以植入最大可能尺寸的瓣膜為優先考慮,為未來的生物瓣衰敗行ViV打好基礎;2.改進傳統瓣架結構固定的生物瓣膜,為生物瓣膜衰敗后行ViV-TAVR帶來更好的治療效果,應用可擴張瓣膜。
董念國主任在術后表示:“很榮幸可以參與到Venus-Neo的全球首例FIM研究中。Venus-Neo的干瓣材料,可直接保存,有效避免通過戊二醛保存出現的醛基殘留,從而大幅提升瓣膜耐久性;瓣架的可擴張結構設計,也為患者未來的治療提供充分便利,是一款獨具匠心的創新產品。此次患者術后超聲顯示Venus-Neo的有效開口面積大,血流動力學表現優秀。”
啟明醫療聯合創始人,執行董事兼總經理訾振軍表示:“長期以來,啟明醫療一直致力于結構性心臟病醫療器械的研發和商業化,并秉持從生物材料源頭出發,解決生物瓣膜耐久性問題。此次Venus-Neo的順利FIM,助力公司實現主動脈瓣疾病解決方案全布局,不僅為臨床使用提供更多靈活性,令更多患者受益,同時也助力國產創新瓣膜邁向新的臺階。”
參考文獻:
[1]. 杜俁,劉巍,周玉杰.心臟瓣膜病治療:經導管瓣膜治療的適應人群 -- 2020年ACC/AHA瓣膜病管理指南解讀和思考[J].中國臨床新醫學,2021,14(06):534-539.
[2]. Davidson LJ, Davidson CJ. Transcatheter treatment of valvular heart disease: A review[J]. JAMA, 2021, 325(24): 2480-2494.
[3]. Hahn RT, Webb J, Pibarot P, et al. 5-Year Follow-Up From the PARTNER 2 Aortic Valve-in-Valve Registry for Degenerated Aortic Surgical Bioprostheses[J]. JACC Cardiovasc Interv. 2022, 15(7):698-708.
作為歐洲首個獲批上市的自膨脹式TPVR產品,VenusP-ValveTM具備顯著的臨床價值。其獨特的雙喇叭口設計,錨定穩定,釋放簡便,植入前無需預先放置固定支架。瓣膜尺寸規格多,適用范圍廣,在臨床上可以滿足超過 85% 患者的需求。自2013年由復旦大學附屬中山醫院心內科主任葛均波院士實施首例臨床手術至今,VenusP-ValveTM的臨床使用已有9年,出于人道主義救助的臨床使用近300例,覆蓋亞洲、歐洲、北美洲、南美洲,遍及20多個國家及地區。2021年3月,該產品獲得英國藥品和醫療保健品管理局(MHRA)授予的特殊使用許可,可在指定醫療機構進行使用。
中重度肺動脈瓣反流常見于先天性心臟病糾治術后,將導致右心室容量負荷增加,長期可引發心律失常甚至猝死。傳統的開胸植入人工肺動脈瓣手術難度大,風險大,死亡率較高。而歐洲已上市的TPVR產品,均為球囊擴張型瓣膜,僅能覆蓋特殊解剖結構的患者,且須預先植入固定支架,此外其瓣膜直徑較小,僅能解決約15%至20%的患者需求。在VenusP-ValveTM獲批之前,市場上尚無一款針對不同解剖形態、尺寸規格覆蓋范圍更廣的治療產品。
優異的臨床數據證明了VenusP-ValveTM長期的安全性和有效性。歐洲兩年期臨床研究數據顯示,臨床手術操作成功率達100%,兩年內未出現再次手術或死亡。中度肺動脈瓣反流從術前16.88%降至0%,重度肺動脈瓣反流從83.12%大幅降至1.54%。數據表明,該產品性能優異,安全可靠,對于患者心功能的改善顯著、穩定且持續。
尤其值得一提的是,根據歐盟官網公示信息,VenusP-ValveTM是首個在CE MDR新法規下獲批的III類心血管植入類醫療器械。歐盟自2021年5月實施CE MDR新法規,大幅提高和細化了技術評審及臨床評價等各方面的要求,并新增了臨床專家委員會(Expert Panel)審評等程序,此前尚未有任何III類心血管植入類醫療器械按照CE MDR批準上市。VenusP-ValveTM此次獲批,充分體現出啟明醫療的臨床研究、質量控制等體系已達到國際先進水平。
歐洲市場是啟明醫療國際化戰略的橋頭堡,針對VenusP-ValveTM的獲批上市,公司已提前進行了商業化部署及高端人才聘用,陸續任命了Shakeel Osman,David Breant等具有豐富營銷經驗的專家擔任高管。截至目前,VenusP-ValveTM已獲得數百萬歐元的預訂銷售金額。
除歐洲之外,該產品在中國也已處于NMPA注冊審評階段,有望2022年內獲批上市;同時還在籌備美國FDA IDE申報,計劃2023年在美國啟動正式臨床試驗。此次歐洲的順利獲批,也將顯著推動VenusP-ValveTM在中國、美國等市場的上市。
英國倫敦伊芙琳娜兒童醫院Shakeel Qureshi教授作為VenusP-ValveTM歐洲CE臨床研究PI,對VenusP-ValveTM在歐洲獲批上市表示祝賀。"依然記得2016年9月,我們在英國倫敦正式啟動VenusP-ValveTM CE 認證首臺臨床試驗,術后的即刻效果非常優異;在這之后,我們順利地持續入組病例,整體臨床結果凸顯了VenusP-ValveTM對于患者心功能的改善持續,有效和穩定,這是一款真正造福醫患的創新產品。"
啟明醫療聯合創始人,執行董事兼總經理訾振軍表示:"VenusP-ValveTM的CE MDR獲批上市,為公司進軍歐洲市場開啟嶄新篇章。我們將以VenusP-ValveTM為商業化抓手,促進海外市場營收上量,加速啟明醫療海外市場的蓬勃發展。公司也將繼續推進其它創新技術和產品的全球臨床和上市工作,將中國創新真正推向全球。"
2021年度,公司憑借中國首款獲批上市的第一代及第二代TAVR產品,VenusA-Valve及VenusA-Plus,在國內市場保持快速增長,全年共計完成手術約3600例。兩款產品已覆蓋全國360家醫院或診療中心,并積累了豐富的臨床隨訪數據,器械的安全性、有效性得到充分驗證。其中,VenusA-Valve也是目前中國唯一具有六年以上長期安全性數據的TAVR產品。
啟明醫療擁有心血管創新器械領域杰出的銷售團隊,目前團隊規模已壯大至220人。2021年,公司共協辦心臟瓣膜義診活動60多次,吸引義診醫生300余人,服務患者2000余名。通過積極參與公益義診等活動,啟明醫療作為唯一的高值醫用耗材企業,榮獲輕松籌2021年度企業公益貢獻先鋒獎。此外,公司還配備有自主高效的物流團隊,確保臨床手術及時安全開展。
作為本土最早涉足結構性心臟病介入治療的企業之一,啟明醫療不僅在中國持續保持商業化領先地位,同時也在國際市場迅速發展。憑借抗栓塞遠端腦保護裝置(CEP)TriGUARD3的銷售貢獻,公司國際市場營收達到1051萬元人民幣,同比大增160.5%。
歐洲市場是啟明醫療國際化戰略的"橋頭堡"。過去一年,公司發力配置歐洲商業團隊,陸續任命了David Breant,Shakeel Osman等具有豐富營銷經驗的專家擔任營銷高管。為即將上市的肺動脈瓣置換(TPVR)系統VenusP-Valve打下扎實基礎。該產品已在2021年通過歐盟CE MDR認證審核,目前已進入制證階段,將會成為歐盟批準的首款來自中國的瓣膜產品,今年有望實現可觀的海外營收。去年3月,VenusP-Valve已在英國獲得特殊使用許可提前進入市場,也充分印證了臨床醫患對于該產品的迫切需求。
通過對創新療法的持續開發和并購整合,啟明醫療已在歐美發達國家市場建立一系列新產品管線。2021年12月,公司宣布并購專注二尖瓣反流和三尖瓣反流創新療法的以色列創新公司Cardiovalve,并于2022年1月完成該并購。Cardiovalve是美國FDA批準的唯一一款可同時用于二尖瓣反流與三尖瓣反流的治療器械,用于三尖瓣反流已在美國獲得"突破性認證"資格。該產品預期于今年在中國開展臨床研究,為本土患者帶來創新解決方案。
此外,公司還有多款國際創新產品在去年進入臨床階段,包括用于治療肥厚型心肌病的Liwen RF?射頻消融系統,用于治療主動脈瓣狹窄的新一代TAVR產品Venus-PowerX和Venus Vitae,用于治療頑固性高血壓的腎動脈交感神經消融系統等。2022年,公司還將繼續推進上述產品在中國及歐美發達國家的臨床研究。
啟明醫療聯合創始人、執行董事兼總經理訾振軍表示,2021年是啟明醫療的國際化元年,這一年公司取得了長足進步。展望未來,公司將更為堅定地聚焦具有國際影響力的產品創新,持續追求開發"中國無,世界新"的硬科技,實現打造完整的結構性心臟病治療平臺的戰略愿景。
加入啟明醫療前,Shakeel Osman曾任職于一家知名結構性心臟病器械供應企業Occlutech,擔任中東、非洲、東亞及愛爾蘭銷售副總裁及英國Occlutech總經理。Shakeel Osman擁有20年醫療器械國際營銷經驗,長期深耕歐洲及中東市場,在心血管領域有著豐富的營銷推廣及經銷商管理經驗。
Shakeel Osman表示:“非常榮幸加入啟明醫療的歐洲商業化團隊。作為結構性心臟病領軍企業,啟明醫療創新管線擁有強大的國際競爭力,我將利用豐富的營銷經驗,與大家通力合作,為VenusP-Valve在歐洲的全面商業化推廣打下堅實基礎,推動公司國際戰略的落地。”
VenusP-Valve是目前在歐洲申報的唯一一個自膨式肺動脈瓣膜置換系統,也是啟明醫療繼遠端腦栓塞保護系統 TriGUARD3? 之后,有望在歐洲市場商業化的第二個創新醫療器械。該產品曾于2021年3月獲得英國藥監局授予的特殊使用許可。
啟明醫療創始人、執行董事兼總經理訾振軍對Shakeel Osman的加入表示熱烈歡迎。“很高興又有一位專業且資深的醫療器械營銷專家加入啟明醫療,相信憑借Shakeel Osman在豐富的市場推廣經驗,VenusP-Valve的歐洲商業化推廣將如虎添翼。這對于公司未來在歐洲的創新器械臨床開發,亦有重大價值。”
繼2020年TriGUARD3?在歐洲上市后,啟明醫療致力于不斷提升國際商業化力量,為全球化創新奠定扎實基礎,以期將更多結構心臟病產品投入國際臨床應用。此次,啟明醫療同時還任命David Breant為歐洲銷售副總裁,負責成人結構性心臟病業務,以及德國、法國等區域的直銷業務;任命Joyce Heo為銷售總監,負責新興市場的銷售業務。
啟明醫療將任命二尖瓣三尖瓣置換系統創新公司Cardiovalve Ltd.的CEO Amir Gross為全球心臟瓣膜創新中心負責人,對突破性創新治療技術進行本土孵化,包括利用Cardiovalve技術平臺研發新一代治療主動脈瓣反流技術,數字健康技術在瓣膜系統的應用等,并在適當時機技術轉移至中國和全球其它區域。同時,啟明醫療也將啟用此中心進行中國-以色列工程師交換培訓項目,以整合兩國獨特的資源深度培育創新人才,為長期發展奠定扎實基礎。
以色列以科技創新聞名全球,素有“創新之國”的美譽。其中,醫療器械行業是以色列最為發達、商業化程度最高的產業之一,以色列政府也一直在積極推動,吸引了眾多國際性的高科技醫療企業在以色列落地,形成了良好的醫療器械行業生態系統。
長期以來,啟明醫療對以色列醫療器械創新深度參與,積極協同構建醫療產業生態系統。2018年12月,公司收購了專注研發抗栓塞腦保護裝置TriGUARD3的以色列Keystone Heart;去年12月,公司又以近3億美元的對價收購Cardiovalve以擴大公司在二尖瓣置換、三尖瓣置換創新產品的布局。
啟明醫療創始人兼總經理訾振軍先生表示:“在以色列建立全球心臟瓣膜創新中心,將使啟明醫療更加緊密和高效地連接世界頂尖的醫生和高新技術人才,相信在Amir的領導下,啟明醫療的瓣膜治療技術將再上一個新臺階,并實現國際化跨越式發展。”
Cardiovalve公司CEO Amir Gross表示:“啟明醫療在以色列擁有良好的聲譽及長期的合作經驗,作為高速走向國際化的中國企業,啟明醫療大力投入資源,打造創新體系與產品,足見其致力于創新的決心與信心。我們將全力打造基于中以兩國特色資源的創新生態體系,為臨床醫生與患者帶去高價值的醫療器械。”
Cardiovalve成立于2010年,總部設于以色列。公司自主研發的Cardiovalve是一款同時可治療二尖瓣反流和三尖瓣反流的經導管介入瓣膜置換創新系統。其經股靜脈的入路方式有助于提升治療安全性,同時55mm的大瓣環設計適用約95%的患者群體,同時,獨特的短瓣架設計可有助于降低左室流出道梗阻風險。Cardiovalve已申報超過215項專利,其中83項已獲授權。
由于缺乏有效的創新療法,二尖瓣反流和三尖瓣反流患者數量與日俱增。在中國,2025年患者群體預計會超過2200萬人,而歐洲、美國的患者群體在2025年也將分別達到1400萬人與920萬人。龐大的患者群體對應廣闊的市場空間,根據全球瓣膜治療器械龍頭公司愛德華的預測,至2028年,二尖瓣反流和三尖瓣反流介入療法總價值將達到50億美金,相較2021年大增5倍。
二尖瓣反流、三尖瓣反流的介入治療一直以來都在國際上被列為技術難點,目前,美國FDA尚未批準任何二尖瓣、三尖瓣置換的產品上市,而Cardiovalve在臨床階段產品中定位獨特且進度領先,也是首家獲得美國FDA批準,同時進行二尖瓣反流及三尖瓣反流適應癥早期可行性研究的公司。
在治療二尖瓣反流適應癥上,Cardiovalve已在歐洲進入臨床研究階段,并在美國進入早期可行性研究階段。而在治療三尖瓣反流適應癥上,Cardiovalve于2020年1月獲美國FDA授予的“突破性設備”稱號,并已進入早期可行性研究(EFS)階段。
作為中國瓣膜疾病治療領域的先驅,啟明醫療致力于持續創新,通過構建完善的產品體系,全面服務于醫患。此次收購Cardiovalve,公司將持續推進其在歐洲、美國的臨床研究,同時加速其在中國市場的臨床開發和注冊上市。通過對Cardiovalve的收購,啟明醫療將成為中國二尖瓣反流和三尖瓣反流治療領域最完善的平臺公司之一,同時也為其創新國際化帶來新的機遇。
啟明醫療創始人兼總經理訾振軍表示:“此次跨國并購的順利完成,將對公司進一步國際化發展戰略產生至關重要的影響。我們將以此為契機,更堅定國際化創新、全球化布局的長期愿景。啟明醫療將會持續發力并提升整體瓣膜產品線,為全球的醫患提供創新產品與服務。”
Cardiovalve首席執行官Amir Gross指出:“攜手啟明醫療對于Cardiovalve加速在全球重點市場開發并上市至關重要。在過去的一段時間里,雙方建立了堅實的互信關系,并立志以此開創中以醫療器械創新產業合作新生態。面向未來,我們仍將致力于源源不斷開發創新優質研發產品。”
此次臨床應用由四川大學華西醫院心內科陳茂教授、馮沅教授,麻醉科朱濤教授、陳果教授,以及心外科蒙煒教授等組成的多學科團隊共同完成。該名患者為重度主動脈瓣狹窄,伴有反復胸悶和氣喘癥狀,術后主動脈瓣無瓣周漏及中心反流。
Venus-PowerX是啟明醫療新一代自膨干瓣TAVR產品,適用于主動脈瓣狹窄患者的治療。與第一代、第二代自膨瓣(VenusA-Valve®及VenusA-Plus®)相比,其瓣架較短,在臨床應用中存在獨特優勢。值得一提的是,Venus-PowerX采用啟明醫療自主研發的特制干瓣,運用先進的抗鈣化處理工藝,可直接在常溫中保存,且保存過程中瓣葉不會因脫水導致機械性能受損,具有較長的耐久性;另外,干瓣不含醛殘留,可進行預裝,在提升安全性的同時,便于臨床使用和瓣膜儲藏運輸。
此外,Venus-PowerX擁有線控技術,在瓣膜100%完全釋放后,仍可進行回收,較常規釋放方式更具安全性。同時,該產品的輸送系統采用全新鞘管設計,優化了柔順性及過弓性。瓣架更為精簡,在保證徑向支撐力的同時,三個”V”口為冠脈介入預留了通路。
主動脈瓣狹窄(AS)是最常見的心臟瓣膜病之一,容易導致冠狀動脈缺血、腦缺血等,從而引發心絞痛或者其他嚴重的并發癥,目前已經成為全球因瓣膜病導致死亡的主要病因。因全球老齡化人口不斷增長,主動脈瓣狹窄患病率不斷上升,TAVR市場方興未艾,仍存在巨大的、未被滿足的患者需求。
四川大學華西醫院陳茂教授表示:“非常榮幸可以參與到PowerX的全球首例FIM。作為啟明醫療自主研發的新一代TAVR產品,PowerX的過弓順暢,并延續了一代二代產品的顯影標記,在術中利于精準釋放。此次采用的干瓣技術,大幅減少手術準備時間,提升瓣膜耐久性,真正令醫患受益。”陳茂教授作為TAVR手術重點中心之一的主要術者,具有極其豐富的臨床經驗,同時擔任Venus-PowerX的主要研究者(PI)。
啟明醫療創始人兼總經理訾振軍先生表示:“對于TAVR手術,生物瓣膜的耐久性是我們長期致力解決的問題之一。2016年起,啟明醫療已著手布局干瓣領域,此次Venus-PowerX首例臨床應用的成功完成,意味著公司干瓣技術產品進入收獲期,我們將全力推進Venus-PowerX的國內和國際多中心臨床和注冊,讓中國智造惠及全球醫患。”
兩例手術由阿根廷科連特斯Instituto De Cardiologia醫院的Jorge Alberto Baccaro教授團隊,在美國俄亥俄州創世紀心血管醫療Rehman教授共同協作下順利完成。兩位患者為中重度鈣化主動脈瓣狹窄,術后超聲顯示患者跨瓣壓差即刻顯著下降,未見明顯瓣中反流及瓣周漏,血壓恢復正常。
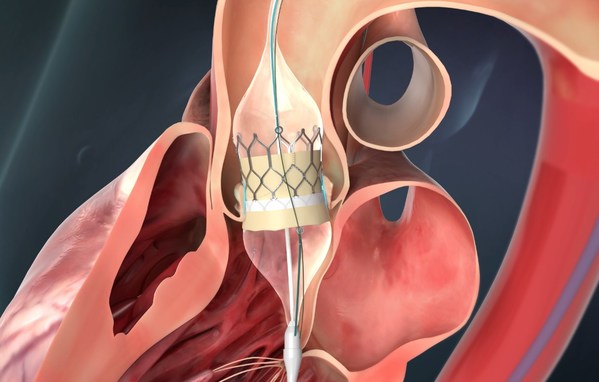
Venus Vitae是啟明醫療新一代球擴干瓣TAVR產品,適用于主動脈瓣狹窄患者的治療。球擴瓣,即球囊擴張瓣膜,有別于自膨式瓣膜,其瓣架較短,在臨床應用中存在獨特優勢。干瓣則是一種可以直接在空氣中保存的瓣膜,保存過程中瓣葉不會因脫水導致機械性能受損,具有較長的耐久性。
相較于國際同類產品,Venus Vitae運用先進的抗鈣化處理工藝提高瓣膜耐久性, 特制干化的瓣膜可進行預裝,且不含醛殘留,在提升安全性的同時,便于臨床使用和瓣膜儲藏運輸。此外,Vitae獨有的線鎖專利技術,可確保瓣膜在球囊導管上不移位,鎖線上黃金Mark點的設計,有效協助術者精準定位。同時,該產品為環上瓣設計,配合短瓣架及較小直徑的輸送系統,從而優化過弓性能。
主動脈瓣狹窄(AS)是最常見的心臟瓣膜病之一,容易導致冠狀動脈缺血、腦缺血等,從而引發心絞痛或者其他嚴重的并發癥,目前已經成為全球因瓣膜病導致死亡的主要病因。因全球老齡化人口不斷增長,主動脈瓣狹窄患病率不斷上升,TAVR市場方興未艾,仍存在巨大的、未被滿足的患者需求。
Baccaro教授和Rehman教授對Vitae高度評價,并表示:“非常榮幸可以參與Vitae的全球首兩例FIM。Vitae是啟明醫療自主研發的第三代TAVR產品,過弓極為順暢,顯影標記利于精準釋放,并配有自適應式防周漏裙邊,干瓣技術,線鎖設計,可識別瓣葉位置以定向冠脈口的旋轉釋放瓣膜。”
作為中國領先的結構性心臟病創新器械綜合平臺,啟明醫療致力于持續創新,并構建完整的產品體系,以全面服務于醫患。繼去年在歐洲上市TriGUARD3后,公司在全球的商業化布局正迅速展開,肺動脈瓣VenusP-Valve有望在歐洲獲批,近期收購的CardioValve更讓公司在歐美地區擁有了處于臨床階段的二尖瓣三尖瓣置換創新管線。Venus Vitae的臨床開展,將成為公司走向全球化的新引擎。
啟明醫療創始人兼總經理訾振軍先生表示:“Vitae首兩例FIM臨床試驗的順利完成,加速了該產品上市的腳步,多個國際專利保護的加持及其獨特的設計,為全球市場的拓展打下堅實基礎。一直以來,啟明醫療致力于成為全球結構性心臟病治療領域的領導者,堅持國際化創新和全球化布局的長期愿景。此次公司將全力推進Vitae中國和海外的臨床和注冊,用最新的前沿技術造福全球更多醫患。”