627是三生國健創新研發,擁有自主知識產權的重組抗TL1A人源化單克隆抗體。TL1A(TNF配體相關分子1A)是腫瘤壞死因子超家族的成員,主要由內皮細胞表達,可與DR3(死亡受體3)結合,為下游信號通路提供刺激信號,調節效應細胞的增殖、活化、凋亡和細胞因子、趨化因子的產生。作為粘膜免疫反應、過敏和自身免疫的中樞調節因子,TL1A/DR3在自身免疫和自身炎癥性疾病中發揮關鍵作用,抑制TL1A在治療自身免疫和炎癥性疾病中是一種有效的策略。
截止目前,SSGJ-627注射液已分別取得中國和美國的I期臨床試驗許可,是首款獲得IND批件的國產TL1A抗體。臨床前研究顯示,627 與 TL1A 具有高親和力及特異性的結合,在不同動物模型中展示了顯著的藥效,并具有良好的安全性和耐受性。
公司將積極推進627臨床試驗的入組工作,期待其在臨床試驗中展現出色的療效,為更多潰瘍性結腸炎患者帶去福音。
]]>內生增長動能強勁,上市產品繼續強勢增長
2024年,三生國健實現營業收入11.94億元,同比增長17.70%;歸屬于上市公司股東的凈利潤達到7.05億元,同比增長139.15%,歸屬于上市公司股東的扣非凈利潤達2.46億元,同比增長18.99%,展現出強大的內生增長動力。
核心產品中,益賽普在國內市場持續鞏固領先地位,公司通過積極的市場拓展,銷售規模成功實現穩中有升。賽普汀表現亮眼,其在臨床應用中的認可度不斷提升,患者用藥周期延長,共同推動了銷售的高速增長。健尼哌憑借在抗排異反應領域的優勢,進一步鞏固市場地位。
研發全周期高效產出,強科創平臺加速創新生長
2024年,三生國健憑借卓越的創新能力和市場競爭力成功入選科創100指數成分股,體現了市場對于公司科創實力的高度認可。今年,公司進一步被上海市政府認定為"上海市創新型企業總部"。
研發投入顯著提升,全力支持高強度研發。2024年全年,三生國健研發投入達5.41億元,同比增長72.06%。截至2024年底,公司研發管線中共開展22個自免項目。
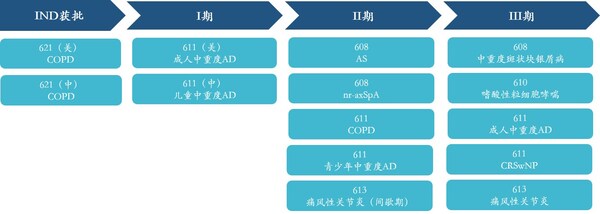
臨床速度加快,II、III期臨床數量不斷增長。抗IL-17A人源化單克隆抗體注射液(608)上市申請已獲得國家藥監局受理,用于治療成人中重度斑塊狀銀屑病;抗IL-5單抗610治療嗜酸性粒細胞哮喘、抗IL-4Rα單抗611單藥治療成人特應性皮炎、611聯合TCS治療成人特應性皮炎、611治療慢性鼻竇炎伴鼻息肉、抗IL-1β單抗613治療痛風性關節炎5個項目處于臨床III期。另外還有6個項目處于臨床II期、4個項目處于臨床I期,以及6個項目處于IND審核或獲批階段。
兩款自研產品拿下"國產首個",創新引領開辟新藍海賽道。抗BDCA2單抗626臨床試驗申請已獲國家藥監局批準,用于治療系統性紅斑狼瘡(SLE)及皮膚型紅斑狼瘡(CLE),是首個進入臨床的國產抗BDCA2單抗;抗TL1A單抗627臨床試驗申請已獲國家藥監局受理,成為首個申報臨床試驗并獲受理的國產抗TL1A單抗。不僅如此,626與627均為中美雙報產品,兩者在美國的IND申請均已獲批。
公司自免項臨床進展均處于同類國內產品前列。公司將持續加快臨床進度,力爭實現公司所有自免管線產品國內第一梯隊上市的目標。
ESG繼續保持行業領先
強直公益項目救治患者超2萬人
2024年,三生國健繼續將ESG理念融入公司戰略,致力于成為健康產業的長期開拓者、抗體藥物的可靠提供者、社會價值的穩定創造者和綠色力量的長期行動者。
公司成功入選2024年國家級綠色工廠名單、上海市綠色制造示范名單,在Wind ESG評級中獲評A級、商道融綠ESG 評級中獲評A-級,均位于行業前列。同時,公司榮膺中國醫藥上市公司ESG競爭力TOP20、中國上市公司英華獎A股ESG價值獎等重磅獎項,體現了公司在可持續發展領域的卓越表現。
強直性脊柱炎健康鄉村項目繼續大力推進。截至2024年12月底,項目已累計開展培訓和篩查1200余場,培訓4.5萬人次,篩查5萬人次,救治農村強直患者2.05萬人,突破2萬人大關,幫助他們恢復正常勞動力,為我國鞏固脫貧攻堅成果,發展鄉村振興做出有益貢獻。
三生國健董事長婁競博士表示:"2024年是公司發展的重要一年,我們在創新藥領域取得了顯著成就。通過聚焦自免戰略,我們不僅實現了業績的穩健增長,更在研發和管理上取得了長足進步。展望未來,我們將繼續以患者需求為導向,以技術創新為核心,繼續加大研發投入,加速臨床項目推進,提升公司的核心競爭力,加速開啟第二增長曲線。我們堅信,通過持續的努力和創新,三生國健將為患者、股東和社會創造更大的價值,助力健康中國2030目標早日實現。
營收規模向百億邁進
2024年,三生制藥營收增長強勁,公司整體收入規模向百億邁進。作為公司重點品種,全球唯一商業化的重組人血小板生成素(rhTPO)產品特比澳2024年銷售收入約50.62億元,同比增長20.4%。該產品被《中國臨床腫瘤學會(CSCO)腫瘤治療所致血小板減少癥診療(CTIT)指南(2024年版)》等多個臨床指南列為最高級別推薦的治療選擇。特比澳新增兒童ITP適應癥于2024年獲批,并順利續約醫保目錄2024年版。
促紅素雙品牌益比奧和賽博爾繼續保持市場主導地位;益賽普在國內市場持續鞏固領先地位,公司通過積極的市場拓展,銷售規模成功實現穩中有升;賽普汀表現亮眼,其在臨床應用中的認可度不斷提升,患者用藥周期延長,共同推動了銷售的高速增長。
脫發治療明星產品蔓迪2024年銷售收入13.37億元,同比增加約18.9%。2024年,蔓迪持續打造科學生發品牌,拓展數字化營銷體系,提升電商銷售規模。此外,蔓迪泡沫劑型產品成功獲批上市,為患者提供了多樣化的治療選擇,進一步鞏固了蔓迪在市場競爭格局中的優勢地位。
創新價值逐步兌現
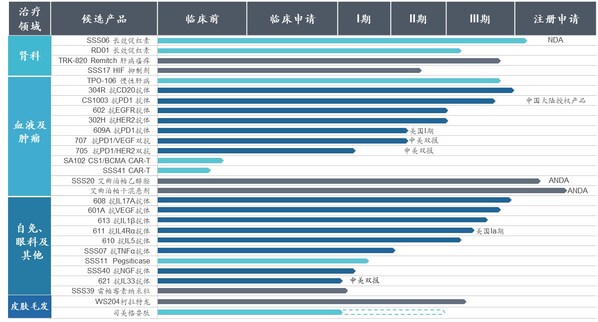
2024年,三生制藥獲得艾曲泊帕混懸劑等3款藥品獲批上市,并提交包括SSS06長效促紅素、608(抗IL-7單抗)等4款產品的上市申請。目前,三生制藥研發管線擁有30項在研產品,包含血液/腫瘤科13項,自身免疫及眼科11項,腎科3項,皮膚及減重領域3項。截至目前,已有10款新藥推進至臨床III期階段。
腫瘤管線優異數據讀出,創新價值凸顯。由公司CLF2雙抗平臺開發的靶向PD-1/VEGF的雙特異性抗體707在非小細胞肺癌、轉移性結直腸癌和婦科腫瘤方面已開展4項臨床研究,其中,707單藥一線治療PD-L1陽性的晚期非小細胞肺癌已獲批準進入III期臨床,其II期臨床的部分患者數據已讀出,顯示出優異的臨床治療效果,具備BIC的潛質。同時,公司還與百利天恒達成合作,將探索707雙抗和BL-B01D1(靶向EGFR×HER3的雙抗ADC)聯合用藥在腫瘤治療上未被發掘的潛在臨床價值。此外。705(抗PD-1/HER2雙抗)706(抗PD-1/PD-L1雙抗)等多款抗腫瘤產品也已進入針對晚期實體瘤的I期臨床試驗。
腎科領域圍繞促紅素及貧血適應癥,布局包括長效、小分子在內的多個產品及適應癥,提升臨床競爭力。其中,SSS06(重組紅細胞生成刺激蛋白注射液)的CIA適應癥已獲臨床批準,填補國內長效促紅素在腫瘤貧血領域的治療空白;SSS17作為目前在研同類產品中半衰期最長的HIF抑制劑,周度口服給藥將大幅提升患者依從性。
自免管線研發成果即將迎來收獲。2024年,抗IL-17A抗體(608)治療斑塊狀銀屑病的III期臨床試驗已成功達到所有療效終點,已向國家藥監局提交上市申請并獲受理。用于治療急性痛風性關節炎的抗IL-1β抗體(613)、用于治療重度嗜酸性粒細胞哮喘的抗IL-5抗體(610)和治療特應性皮炎的抗IL-4Rα抗體(611)均已完成III期臨床試驗患者入組。此外,公司還開發具有臨床需求和創新性的新靶點和新分子,著力打造國內具有競爭力的差異化自免管線。抗BDCA2單抗626治療系統性紅斑狼瘡(SLE)和皮膚型紅斑狼瘡(CLE)適應癥的中美新藥臨床試驗申請均已獲得批準,已在國內開展I期臨床;抗TL1A抗體627治療潰瘍性結腸炎(UC)適應癥已遞交美國臨床試驗申請并獲批準,中國臨床試驗申請已獲受理,均為同靶點上國內首個獲批臨床的國產創新藥物。
合作擴展商業化版圖
2024年,三生制藥對外合作項目取得多項成果落地。大健康領域,子公司三生蔓迪與深圳翰宇藥業就司美格魯肽注射液減重適應癥達成合作,以電商經驗賦能藥品的患者觸達;腫瘤領域,于24年10月與海和藥物達成合作,獲得紫杉醇口服溶液柏瑞素的商業化權益。作為全球唯一的紫杉醇口服制劑,柏瑞素已在中國獲批上市。三生制藥將通過自身專業的腫瘤學術能力,推動柏瑞素這一優效、便捷且更具安全性的化療創新藥物在更多患者中的可及性,引領腫瘤居家治療新模式。此外,三生制藥還在年內獲得東陽光藥業旗下克立福替尼、映恩生物旗下HER2 ADC藥物DB-1303的商業化權利,構建腫瘤板塊的多元化產品矩陣。
未來,三生制藥將繼續聚焦血液與腫瘤、腎科、自免、毛發皮膚等優勢領域,推動創新藥品的價值開發,強化創新藥管線競爭優勢。同時公司將持續踐行自主研發和對外合作雙軌并行的策略,以全球化視野,將創新藥物研發成果加速轉化為患者的臨床生存獲益。
三生制藥董事長兼首席執行官婁競博士表示:"2024年是三生制藥加速奔跑的一年。我們一如既往地堅持在創新藥領域耕耘不輟,取得了業界有目共睹的喜人成績。核心產品持續穩健放量,占據細分品類龍頭,展現出了雄厚的造血能力。核心管線608、707等讀出了令人振奮的臨床數據,未來可期。放眼未來,三生制藥將持續圍繞存在廣泛臨床需求的領域,積極開展靶點探索和藥物研發,同步推動創新速度和創新水平的提升,堅持發掘有潛力的創新藥合作標的。實踐的檢驗讓我們充分相信'夢雖遙,追則能達;愿雖艱,持則可圓。'三生制藥將牢記民族生物藥企業的責任與擔當,以高品質的創新藥產品回饋社會,為人類健康造福。"
綠色工廠是指實現用地集約化、原料無害化、生產潔凈化、廢物資源化、能源低碳化的企業,是綠色制造核心實施單元。去年,工業和信息化部辦公廳印發《綠色工廠梯度培育及管理暫行辦法》,其中指出:"加快構建綠色制造和服務體系,發揮綠色工廠在制造業綠色低碳轉型中的基礎性和導向性作用,加快形成規范化、長效化培育機制,打造綠色制造領軍力量"。本次入選國家級綠色工廠,標志著國家層面對三生國健在綠色制造領域取得卓越成就的重要認可。
三生國健自成立以來始終踐行綠色經營,嚴格遵守國家相關的環保法規要求,積極控制環境相關風險。公司依照法律規定排放,每年定期開展環境監測,并積極采取措施控制污染物排放,保護和改善生態環境。截至目前,公司未發生重大環保事故。與此同時,三生國健提倡綠色辦公,實時監測能源消耗、水資源消耗情況并積極開展節能項目,定期開展資源節約宣貫活動,通過設備升級、技術改造等方式,不斷優化資源使用方式,提高能源使用效率。
綠色制造關乎國計民生,是高質量發展的底色。未來,三生國健將充分發揮綠色工廠的引領示范作用,持續在生產經營的各個環節推動綠色低碳發展措施,帶動更多供應鏈上下游企業加入綠色環保行列,助力國家生物醫藥產業向可持續發展方向邁進,為健康中國建設貢獻力量。
關于三生國健
三生國健是中國第一批專注于抗體藥物的創新型生物醫藥高新技術企業之一。公司擁有研、產、銷一體化成熟平臺,專注于單抗、雙抗、多抗及多功能重組蛋白等新技術研究,擁有豐富的大規模抗體產業化和質量控制經驗。公司是"免疫與炎癥全國重點實驗室"依托單位、擁有抗體藥物國家工程研究中心、國家企業技術中心、上海市抗體技術創新中心、上海抗體工程技術研究中心等國家級和上海市級高新技術平臺,承擔過國家重大新藥創制、"863"計劃、國家發改委及上海市重大項目及各部委課題百余項,多次獲得上海市級和浦東新區科學技術獎。目前,公司擁有22個處于不同開發階段的自身免疫在研創新藥物項目,均為治療用生物制品1類藥品,部分在研藥物為中美雙報。公司是國家知識產權示范企業、上海市知識產權示范企業,累計申請發明專利近200件,獲得發明專利授權近百項,產品覆蓋國內31個省、自治區、直轄市,并銷往海外十余個國家。欲獲得更得信息,請訪問www.3s-guojian.com。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
]]>707是依托三生制藥CLF2專利平臺開發的靶向VEGF/PD-1雙抗, 具有Best-in-class(同類最優)潛力。707正在推進包括單藥一線治療PD-L1陽性的非小細胞肺癌(NSCLC)、聯合化療一線治療NSCLC、轉移性結直腸癌(mCRC)、以及包括子宮內膜癌、卵巢癌等在內的晚期婦科腫瘤等II期臨床研究,患者入組人數超過300人, 并已獲得FDA的IND批準。近期于JPM大會上披露的II期臨床階段性分析數據顯示,707在非小細胞肺癌(NSCLC)和轉移性結直腸癌(mCRC)患者的治療上展現出優異的客觀緩解率(ORR)和疾病控制率(DCR),尤其在NSCLC適應癥上,無論單藥還是與化療聯用,707均展示了顯著的抗腫瘤活性和良好的安全性。
BL-B01D1是百利天恒自主研發的全球首創也是唯一進入臨床階段的靶向EGFR×HER3的雙抗ADC。BL-B01D1正在中國和美國進行約30項針對多種腫瘤類型的臨床試驗,其中包括評估BL-B01D1單藥用于癌癥后線治療的7個III期臨床試驗,包括2個非小細胞肺癌適應癥、1個小細胞肺癌適應癥、2個乳腺癌適應癥、1個食管鱗癌適應癥、1個鼻咽癌適應癥;與PD-(L)1療法聯用于一線治療9種癌癥適應癥(小細胞肺癌、非小細胞肺癌、鼻咽癌、頭頸鱗癌、食管癌、胃癌、結直腸癌、乳腺癌及尿路上皮癌)的8個II期臨床試驗,與TKI聯用用于肺癌一線治療的2個II期試驗及6個Ib期臨床試驗。在美國,BL-B01D1正在開展2項臨床試驗,分別為單藥針對多種實體瘤的I期臨床試驗和BL-B01D1聯合奧希替尼/帕博利珠單抗針對晚期實體瘤的I/IIa期臨床試驗。BL-B01D1作為全球首創藥物,研究成果也已在ASCO、ESMO、SABCS等大會展示,展現出優秀的療效信號和良好的安全性。
三生制藥董事長兼首席執行官婁競博士表示,"此次合作是雙方基于對患者需求的深刻洞察和對創新療法的不斷追求,將各自具有BIC潛力的產品進行聯合研究的一次突破性嘗試。期待該合作未來可以為肺癌、腸癌等臨床需求巨大的治療領域開辟新的思路,通過雙方的緊密合作與優勢互補,為腫瘤治療領域帶去更大進展,為患者生命健康保駕護航。"
百利天恒創始人、董事長朱義博士表示,"目前ADC+免疫(IO)聯合治療是一種極具潛力的癌癥治療策略,通過聯合使用不同機制或不同靶點的藥物,提高腫瘤治療效果并克服耐藥性,從而有效提高患者的生存周期和生活質量。開展BL-B01D1與707聯合用藥的探索,有望為腫瘤患者帶來潛在的高效、安全的全新組合治療方案,我們對此充滿期待。"
]]>TL1A(TNF配體相關分子1A)是腫瘤壞死因子超家族的成員,主要由內皮細胞表達。它與DR3(死亡受體3)結合,為下游信號通路提供刺激信號,調節效應細胞的增殖、活化、凋亡和細胞因子、趨化因子的產生。作為粘膜免疫反應、過敏和自身免疫的中樞調節因子,TL1A/DR3在自身免疫和自身炎癥性疾病中發揮關鍵作用,抑制TL1A在治療自身免疫和炎癥性疾病中是一種有效策略。
SSGJ-627是三生國健創新研發,擁有自主知識產權的重組抗TL1A人源化單克隆抗體。臨床前研究顯示,SSGJ-627 與 TL1A 具有高親和力及特異性的結合,在不同動物模型中展示出顯著的藥效。同時,SSGJ-627 具備良好、可接受的安全性。
目前,全球尚無已上市的抗TL1A抗體藥物,正在臨床階段的同靶點候選藥物均由國外藥企研發。SSGJ-627作為首個申報臨床的國產抗TL1A單抗,期待為患者提供更優質的治療選擇。
]]>608是三生國健自主研發的抗IL-17A創新單抗。今年8月,608治療成人中重度斑塊狀銀屑病的關鍵注冊性III期臨床研究完成揭盲及最終統計分析,所有主要療效終點(PASI 75和sPGA 0/1)、關鍵次要療效終點(PASI 90、PASI 100和sPGA 0)和所有次要療效終點均成功達到。維持治療期給藥方案有望實現同類產品給藥間隔最長,且各種療效指標在維持治療期持續升高并保持穩定。相較于同靶點已上市產品,608的誘導治療(12周)和維持治療(52周)療效數據均具有有力的競爭優勢。
銀屑病是一種常見的、免疫相關的、慢性復發性炎癥性皮膚病,世界各地不同人群中的患病率有明顯差異,歐美的患病率約1%~3%,而我國約為0.5%左右,但我國人口基數大,故銀屑病患者絕對數較多,且正在逐年增加。銀屑病病程長、易復發、治療困難,患者需接受終生治療,同時與心血管疾病、糖尿病、代謝綜合征等慢性疾病也密切相關,給患者的身心健康和生活質量帶來了嚴重的影響。臨床雖然有多種治療方案可供選擇,但均有其局限性。生物制劑已經成為銀屑病的主要系統用藥,在治療中重度、難治性及特殊類型銀屑病方面發揮積極而有效的作用。
三生國健董事長婁競博士表示:"我們很高興看到公司自主創新研發的重組抗IL-17A人源化單克隆抗體608上市申請獲得國家藥品監督管理局受理。銀屑病患者數量眾多,存在巨大的未滿足臨床需求,我們期待該產品早日上市,為中國患者帶去高質量的國產生物制劑。同時,我們還在加緊608治療強直性脊柱炎、放射學陰性的中軸型脊柱關節炎等適應癥的開發,力爭為相關疾病患者提供更好的治療選擇。"
]]>MSCI評級報告顯示,三生制藥在醫療服務可及性、公司治理、污染物排放、產品質量與安全等方面呈現出行業領軍水平。
三生制藥將合規運營作為責任根基,恪守對股東、客戶及消費者、員工、公眾及社區、政府及監管部門等利益相關方的承諾,積極履行社會責任,為醫生提供可靠的治療工具,為患者提供可信賴的藥品,為員工獲得更多關愛,為貧困患者及家庭帶去生的希望。在此基礎上,2023年,三生制藥持續完善合規管理、反商業賄賂、產品質量管理等關鍵體系和制度,強化信息安全體系建設和日常管理,持續推進實施各項節能減排措施。
作為民族生物制藥企業,三生制藥高度擁護并積極投身國家鄉村振興戰略,結合自身優勢領域為基層患者送去關愛。2019年起,三生制藥大力參與并支持"強直性脊柱炎健康扶貧工程"并取得階段性攻堅扶貧成效。2022年起繼續投身于"強直性脊柱炎健康鄉村項目",截至2024年10月底,強直性脊柱炎健康鄉村項目累計開展培訓和篩查1200余場,培訓4.6萬人次,篩查4.8萬人次,救治農村強直患者1.85萬人。
本次蟬聯MSCI AA級評級,是國際評級機構對三生制藥ESG管理成效的重要認可。三生制藥將繼續堅定踐行ESG理念和目標,履行對所有利益相關方的責任,推動行業高質量可持續發展。
* THE USE BY 3SBIO OF ANY MSCI ESG RESEARCH LLC OR ITS AFFILIATES ("MSCI") DATA, AND THE USE OF MSCI LOGOS, TRADEMARKS, SERVICE MARKS OR INDEX NAMES HEREIN, DO NOT CONSTITUTE ASPONSORSHIP, ENDORSEMENT, RECOMMENDATION, OR PROMOTION OF 3SBIO BY MSCI. MSCI SERVICES AND DATA ARE THE PROPERTY OF MSCI OR ITS INFORMATION PROVIDERS, AND ARE PROVIDED 'AS-IS' AND WITHOUT WARRANTY. MSCI NAMES AND LOGOS ARE TRADEMARKSOR SERVICE MARKS OF MSCI.
]]>根據協議,沈陽三生將向諾邁西醫藥支付首付款、研發及銷售里程碑付款。諾邁西醫藥將繼續負責已開展的III期臨床試驗及產品后續的開發、臨床及注冊等工作。
紫杉醇是一種生物堿類化合物,具有顯著的抗癌活性,能夠通過干擾腫瘤細胞的有絲分裂和阻止其生長來發揮作用。臨床上,紫杉醇被廣泛用于胃癌、乳腺癌、非小細胞肺癌等多種惡性腫瘤的治療。紫杉醇口服溶液由韓國大化制藥基于脂質自乳化藥物遞送技術開發而成,已獲得韓國食品與藥品監督局(MFDS)上市批準,用于晚期或轉移性或局部復發性胃癌二線治療,是全球第一款獲批的口服劑型紫杉醇藥物。海和藥物自韓國大化制藥獲得了紫杉醇口服溶液在中國及泰國的研發、生產及銷售權利。
今年9月25日,海和藥物和韓國大化制藥共同宣布,雙方合作開發的紫杉醇口服溶液2024年9月19日獲得中國國家藥監局批準上市,適用于一線含氟尿嘧啶類方案治療期間或治療后出現疾病進展的晚期胃癌患者的治療。
一項在國內進行的開放、隨機平行對照、非劣效設計、多中心Ⅲ期研究(CTR20190050)顯示,紫杉醇口服溶液在經一線治療后的不可手術切除、復發或轉移性晚期胃癌患者中,療效優于紫杉醇注射液,中位總生存時間延長了2.59個月(HR:0.770, p=0.006),且整體安全耐受。
現階段,該藥作為一線化療(既往未接受系統化療)治療復發性或轉移性HER2陰性乳腺癌適應癥的國際多中心III期臨床研究也在順利進行中。
此前,國內紫杉醇的上市劑型均為注射劑,需經配制后在醫院經靜脈滴注給藥,患者需頻繁返院,且會有注射部位不良反應;口服劑型的紫杉醇藥物給患者帶來口服便捷的同時,提高了臨床療效,降低脫發、外周神經病變、疲乏和過敏反應等不良反應的發生率,顯著提高患者的生活質量。
三生制藥董事長兼首席執行官婁競博士表示:"紫杉醇在腫瘤治療中有廣泛的應用場景,口服溶液劑型是該經典藥物的又一次重大突破性創新,在提高相關疾病患者生存率的同時,為患者提供了更便利的給藥方式,大大降低了化療給患者造成的痛苦。海和藥物在引入該藥的基礎上進行了進一步的開發,不斷擴大口服劑型的使用范圍,已成功獲批胃癌二線治療適應癥。我們很高興能和海和藥物合作,一起讓更多患者用上這一新藥、好藥,共同增益患者的福祉,讓這款新藥為患者帶去更大的價值。"
海和藥物首席執行官董瑞平博士表示:"很高興與三生制藥達成戰略合作。海和藥物一直聚焦抗腫瘤治療領域,致力于給患者帶來更好的藥物。紫杉醇類藥物在實體瘤治療中應用廣泛,但一直沒有在劑型上得到突破。紫杉醇口服溶液作為中國首個上市的口服劑型紫杉醇類藥物,將顯著延長胃癌患者生存時間,讓患者更方便更安全地使用。三生制藥作為中國領先的生物技術公司,具有高效的推廣團隊和強大的商業化能力,與紫杉醇口服溶液巨大的臨床價值深度契合,將惠及廣大的腫瘤患者。同時,我們也期待雙方充分發揮各自的優勢,繼續推進藥物在研究、臨床開發等方面的潛在合作,為患者帶來創新的治療選擇。"
三季度中,公司自主創新研發的重組抗IL-17A人源化單克隆抗體注射液(608)治療成人中重度斑塊狀銀屑病的關鍵注冊性III期臨床研究已完成揭盲及最終統計分析,所有主要療效終點(PASI 75和sPGA 0/1)、關鍵次要療效終點(PASI 90、PASI 100和sPGA 0)和所有次要療效終點均成功達到。數據顯示,608在誘導治療(12周)期和維持治療(52周)期的療效數據均具有有力的競爭優勢。
同時,公司自主創新研發的重組抗IL-4Rα人源化單克隆抗體注射液(研發代號:611)治療慢性鼻竇炎伴鼻息肉(CRSwNP)II期臨床研究達到主要終點。研究結果顯示,611給藥后可明顯改善CRSwNP受試者的內鏡息肉評分(NPS)和鼻塞癥狀評分(NCS),在所有療效指標上起效迅速,應答明確,整體安全性良好,611的療效和安全性均具有相當的競爭力。
此外,公司其他各條研發管線也順利推進:
- 抗IL-17A單抗608強直性脊柱炎項目已完成臨床II期所有受試者入組;放射學陰性中軸型脊柱炎臨床II期受試者正在入組中。
- 抗IL-5單抗610重度嗜酸性粒細胞哮喘III期臨床正在受試者入組中。
- 抗IL-4Rα單抗611成人中重度特應性皮炎適應癥已完成臨床III期所有受試者入組;慢性鼻竇炎伴鼻息肉適應癥臨床III期已啟動;青少年中重度特應性皮炎適應癥已完成臨床II期所有受試者入組;兒童中重度特應性皮炎Ib期臨床、慢性阻塞性肺氣腫(COPD)適應癥臨床II期受試者持續入組中。
- 抗IL-1β單抗613急性痛風性關節炎適應癥已完成臨床III期所有受試者入組;痛風性關節炎間歇期適應癥已完成臨床II期所有受試者入組。
- 抗BDCA2單抗626系統性紅斑狼瘡及皮膚型紅斑狼瘡適應癥取得美國IND臨床批件,中國IND申請已獲受理。
三生國健董事長婁競博士表示:"2024年前三季度,公司各項經營指標健康向上,自免在研管線取得決定性突破。同時,公司憑借環保、節能、可持續的生產工藝成功入選《上海市2024年度(第一批)綠色制造示范名單》,體現出我們卓越的生產能力和高度的社會責任擔當。四季度,公司上下將繼續眾志成城,保持干勁,全力以赴實現全年圓滿收官。"
]]>綠色制造是指在產品的整個生命周期中,盡可能減少資源消耗和環境污染,實現經濟、環境和社會協調發展的生產活動。為加快推動上海市綠色制造體系建設,促進制造業高質量發展,根據《上海市綠色制造體系建設實施方案(2021-2025年)》,上海市組織開展了綠色制造示范名單評審工作,經第三方機構評價、專家評審、現場抽查等環節,確定了此次名單。
一直以來,三生國健堅持"以人為本、綠色經營、安全守法、持續發展"的方針,關注環境保護與可持續發展,嚴格遵守國家相關的環保法規要求,制定環保相關管理制度,有效控制環境相關風險。公司積極回應各方對氣候變化的關注,參考國際可持續準則理事會(ISSB)發布的《國際財務報告可持續披露準則第2號一氣候相關披露》相關要求,識別氣候變化相關的風險與機遇,并依據結果不斷完善管理,最大化減少運營活動產生的碳足跡。
同時,公司每年定期開展壞境監測,積極采取措施控制污染物排放,保護和改善生態環境。2023年,公司新建數字化工廠,新增危廢間排口和排氣筒,依據《排污許可管理條例》等國家相關法規標準要求更新《排污許可證》并獲得通過。此外,公司開展了水平衡測試,并在上海市節約用水促進中心進行備案。
綠色制造的核心理念是通過技術創新和管理優化,不斷降低生產過程中的能耗和廢物排放,促進資源的循環利用。隨著全球對環保要求的日益提高,綠色制造不僅成為企業競爭力的重要組成部分,也是國家經濟發展的新引擎、新動能。未來,三生國健將繼續踐行低碳、環保、可持續的發展方式,為推動國內生物醫藥產業可持續發展貢獻堅實力量。
]]>上半年,公司三款上市產品繼續保持穩健增長的勢頭,內部科學化、系統化、精細化管理獲得顯著成效;自免管線里程碑頻出,多項臨床試驗取得積極成果;ESG戰略不斷深化,多年來強直性脊柱炎健康鄉村項目已拓展至全國28個省、市、自治區,距覆蓋全國更近一步。
循證+口碑
上市產品保持強勁競爭力
益賽普受益于預充針劑型的推廣,患者依從性和接受度持續提升。上半年,益賽普國內銷售收入達3.3億元,同比增長9.4%。上市19年來,益賽普深得廣大醫患信賴,積累了良好的口碑。下一步,益賽普將利用多年確證的循證學證據,持續推進市場下沉策略,加強基層科室覆蓋,提升三四線城市風濕免疫生物制劑使用觀念,推廣早期生物治療長遠獲益的觀念,并積極拓展益賽普在中醫等多科室多領域的應用。
賽普汀醫院準入工作持續推進,臨床應用不斷增加,優秀的治療價值給患者帶來持續獲益。上半年,賽普汀實現銷售收入1.6億元,同比增長48.9%。不斷積累的循證醫學證據是賽普汀實現快速放量的重要因素,其在HER2陽性乳腺癌新輔助治療、晚期一線治療及HER2陽性肺癌、胃癌等泛HER2領域的應用均取得積極的研究進展,多項研究入選2024 ASCO年會。
健尼哌進一步加大在臨床應用方面的學術推廣,滿足相關患者的臨床用藥需求。上半年健尼哌收入同比增長47.8%。
創新+高效
重磅在研產品沖刺上市
上半年,三生國健繼續以"聚焦創新、臨床增益、合理布局、精準研發"為原則,根據產品管線的臨床需求特點,按照臨床價值進行研發資源分配,均衡公司長期、中期、短期管線布局,全力推動核心產品的臨床進度以實現快速上市。
抗IL-17A單抗608治療成人中重度斑塊狀銀屑病的關鍵注冊性Ⅲ期臨床研究已完成揭盲及最終統計分析,所有主要療效終點(PASI 75和sPGA 0/1)、關鍵次要療效終點(PASI 90、PASI 100和sPGA 0)和所有次要療效終點均成功達到,維持治療期給藥方案有望實現同類產品給藥間隔最長,且各種療效指標在維持治療期持續升高并保持穩定。相較于同靶點已上市產品,608的誘導治療(12周)和維持治療(52周)療效數據均具有有力的競爭優勢。安全性特征良好,且與既往結果一致。608計劃于近期遞交上市申請。
抗IL-4Rα單抗611治療慢性鼻竇炎伴鼻息肉(CRSwNP)的II期臨床研究達到主要終點。兩個劑量組(300mg Q2W、450mg Q4W)治療CRSwNP受試者均起效迅速,給藥第4周即顯示出較安慰劑組的應答差異趨勢。安全性良好,多數TEAE為1~2級,未發生藥物相關≥3級的TEAE和藥物相關SAE。
多項II、III期臨床研究快速入組。抗IL-5單抗610重度嗜酸性粒細胞哮喘適應癥臨床III期啟動并完成首例受試者入組;611成人中重度特應性皮炎適應癥臨床III期啟動并完成首例受試者入組,青少年特應性皮炎適應癥臨床II期完成首例受試者入組;抗IL-1β單抗613 啟動急性痛風性關節炎適應癥III期臨床研究并完成首例受試者入組,獲得痛風性關節炎(間歇期)適應癥的新藥臨床試驗申請(IND)批件并完成臨床II期所有受試者入組。
此外,公司還開發具有臨床需求和創新性的新靶點和新分子,著力打造國內具有競爭力的差異化自免管線。公司分別遞交了早研項目抗BDCA2單抗626治療系統性紅斑狼瘡(SLE)和皮膚型紅斑狼瘡(CLE)適應癥的中美新藥臨床試驗申請(IND),其中中國的新藥臨床試驗申請(IND)已獲國家藥監局受理。
目前,公司研發管線中共開展14個自免項目,其中包括5個臨床III期項目,5個臨床II期項目,2個臨床I期項目,2個處于IND獲批階段項目。未來,公司還將通過License-in、投資并購等多種模式,布局自免領域新技術、新產品和新平臺。
責任+堅守
"強直健康鄉村"碩果累累
2024年是強直性脊柱炎健康鄉村項目推進的第5年。截至目前,強直性脊柱炎健康鄉村項目累計篩查4.6萬人次,累計救治農村強直患者1.6萬人,累計開展培訓和義診活動1100余場,培訓基層醫護人員4.5萬人次,簽約醫院近1140家,在甘肅、上海等省市實現首次落地,覆蓋省、市、自治區數量達28個。
ESG成果繼續領跑行業。公司連續第3年發布ESG報告,ESG治理獲商道融綠A-評級、萬得ESG A級評級。此外,公司還榮膺《中國基金報》主辦的中國上市公司英華獎"A股ESG價值獎"、界面新聞2024金勛章獎"年度ESG實踐案例"等重磅榮譽。
三生國健董事長婁競博士表示,"2024上半年,三生國健財務表現優異,各項經營指標穩中向好,上市產品受市場廣泛認可,重磅在研產品讀出積極臨床數據。憑借前瞻的戰略布局和扎實的戰略定力,公司即將迎來自免創新藥的收獲期,重要在研產品均有望實現第一梯隊上市的目標。憑借卓越的技術與管理實力以及充沛、健康的現金流,公司將繼續致力于自免高潛產品的研發,確保后續自免新產品與新適應癥的開發源源不斷開展,形成兼具廣度和深度的國內一流自免管線矩陣,力爭推動更多自免新藥早日上市,為更多患者造福。"
生物藥板塊穩健成長
2024上半年,三生制藥不斷探索核心生物藥產品適應癥拓展,加強基層市場布局,積極提升藥品可及性。
全球唯一商業化的重組人血小板生成素(rhTPO)產品特比澳在上半年銷售收入約24.76億元,同比增長22.6%。該產品在今年4月獲批第三個適應癥,用于治療兒童或青少年的持續性或慢性原發免疫性血小板減少癥。
促紅素雙品牌益比奧和賽博爾2024上半年銷售收入約5.16億元,同比增長11.3%。2024年起,益比奧用于外科圍手術期的紅細胞動員獲醫保覆蓋。
用于治療類風濕性關節炎、強直性脊柱炎及銀屑病的益賽普2024上半年銷售收入3.29億元,同比增長9.5%。
用于治療HER2陽性轉移性乳腺癌的賽普汀2024上半年銷售收入為1.62億元,同比提升48.9%。
毛發健康產品持續豐富
2024年1月,蔓迪泡沫劑型獲批上市,以自主創新技術改良溶劑成分,填補敏感人群用藥空白,并相對第一代酊劑產品提升滲透速率,縮短起效時間。2024上半年,蔓迪全系列銷售收入5.50億元,同比增加約10.0%。作為首個獲批的OTC米諾地爾泡沫劑型,蔓迪泡沫劑與蔓迪小白瓶、精靈瓶等規格產品一同,為國內雄脫患者提供更多選擇,滿足不同人群的用藥習慣,進一步釋放蔓迪品牌的價值,擴大米諾地爾領導者的競爭優勢。
自免管線成果收獲在即
公告顯示,三生制藥研發管線擁有28項在研產品,包含血液及腫瘤科12項,自身免疫及眼科10項,腎科4項,皮膚科1項,代謝科1項。截至目前,已有12款新藥推進至臨床III期或新藥上市申請(NDA)申報階段,2款仿制藥品種處于仿制藥注冊申請(ANDA)申報的階段。
上市產品臨床價值持續擴大。2024上半年,特比澳用于治療兒童或青少年的持續性或慢性原發免疫性血小板減少癥獲CDE批準上市。此外,長效促紅素(SSS06)用于慢性腎衰竭貧血治療的III期臨床研究達到主要預設終點,公司已向國家藥監局遞交該產品新藥上市申請并獲受理。賽普汀在2024ASCO大會上發布多篇報告,為臨床應用擴展提供更多確證性數據。
自免管線研發成果即將迎來收獲。2024上半年,抗IL-17A抗體(608)治療斑塊狀銀屑病的III期臨床試驗已成功達到所有療效終點,預計將于今年完成該適應癥的生物制劑許可證(BLA)申報。用于治療急性痛風性關節炎的抗IL-1β抗體(613)、用于治療重度嗜酸性粒細胞哮喘的抗IL-5抗體(610)和治療特應性皮炎的抗IL-4Rα抗體(611)均已完成III期臨床試驗首例患者入組。此外,公司還開發具有臨床需求和創新性的新靶點和新分子,著力打造國內具有競爭力的差異化自免管線。公司分別遞交了早研項目抗BDCA2單抗626治療系統性紅斑狼瘡(SLE)和皮膚型紅斑狼瘡(CLE)適應癥的中美新藥臨床試驗申請(IND),其中中國的新藥臨床試驗申請(IND)已獲國家藥監局受理。
2024上半年,三生制藥各項對外合作持續深化拓寬。公司與合作伙伴Sobi合作推進的組合療法SEL-212用于慢性難治性痛風的三期臨床試驗已完成,Sobi已于今年7月向美國FDA申請滾動生物制劑許可證(BLA)。公司與COSMO合作產品1%濃度柯拉特龍乳膏劑(Winlevi®,研發代碼WS204)用于治療12歲以上患者面部尋常型痤瘡的III期橋接臨床試驗正在入組中。三生制藥旗下子公司三生蔓迪進軍減重領域,與深圳翰宇藥業就司美格魯肽注射液產品達成合作,該產品已在國內獲得臨床試驗批準。
未來,三生制藥將繼續聚焦腎科、血液與腫瘤、自免、毛發皮膚等優勢領域,持續踐行自主研發和對外合作雙軌并行的策略,積極發掘有潛力的創新藥合作標的,強化管線布局。公司還將憑借成熟的生物藥研發注冊、商業化生產以及銷售實力,為更多優質創新藥產品的研發上市進程以及市場價值發揮提供助力。
三生制藥董事長兼首席執行官婁競博士表示:"2024上半年,公司核心產品表現穩健,在研管線喜報頻傳,對外合作加速拓展。隨著多款新藥臨床數據讀出,其潛在治療價值逐漸展現。同時,公司核心產品的臨床應用受到更加廣泛的市場認可,不斷煥發出新的生命力。這些成績充分展現出了公司發展的強大韌勁和廣闊前景。展望未來,三生制藥將繼續發揮自身優勢,堅定不移地推動創新藥產品研發,抓住行業整合機遇和國家政策紅利,積極發掘優質合作標的,推動更多高質量創新藥產品走上市場,為建設健康中國貢獻民族生物藥企業的一份力量。"
關于三生制藥
三生制藥是一家集研發、生產和銷售為一體的生物制藥領軍企業,致力于以高品質的藥品提高患者生存質量,為人類健康造福。目前,公司擁有100余項國家發明專利授權,40余種上市產品,覆蓋腎科、腫瘤科、自身免疫性疾病、眼科及皮膚科等多種治療領域。公司擁有抗體藥物國家工程研究中心以及生物藥和化藥雙平臺的4大研發中心,共有28種在研產品,其中25種為國家新藥,并擁有符合GMP標準的5大生產基地。未來,三生制藥將繼續秉持"珍愛生命、關注生存、創造生活"的理念,全力打造全球領先的中國生物制藥企業。請訪問www.3sbio.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
研究共納入100例CRSwNP受試者,以1:1:1的比例被隨機分配至試驗藥物A組(611 300mg Q2W)、試驗藥物B組(611 450 mg Q4W)和安慰劑組,每個組別各分別納入33例、34例和33例受試者,共同主要療效終點為"第16周,雙側鼻內鏡下鼻息肉評分(NPS)及周平均鼻塞評分(NCS)較基線的變化"。
有效性方面,611兩個劑量組(300mg Q2W、450mg Q4W)治療CRSwNP受試者起效迅速,給藥第4周即顯示出較安慰劑組的應答差異趨勢。在主要終點指標上,NPS和NCS兩個終點均顯著優于安慰劑組,且差異具有統計學意義(P值均<0.05)。第16周時,兩個治療組NPS評分較基線變化分別為-2.12和-1.61,NCS評分較基線變化分別為-1.11和-1.16。國外已上市的同靶點藥物度普利尤單抗在治療成人CRSwNP受試者的臨床研究中(SINUS-24和SINUS-52兩個研究),第24周NPS較基線分別降低-1.89和-1.71。可以看出,611治療CRSwNP受試者,在第16周的療效應答,與度普利尤單抗第24周的應答相似甚至顯示較其有更高的療效趨勢(此非頭對頭對照研究),提示611有顯著改善CRSwNP疾病的潛力。
安全性方面,611在CRSwNP受試者中整體安全性和耐受性良好。多數TEAE為1~2級,未發生藥物相關≥3級的TEAE和藥物相關SAE,無導致死亡或退出的TEAE。與同靶點藥物相比,常見的不良事件類型和嚴重程度,均在預期范圍內,無新增的安全性風險提示,整體安全性良好、風險可控。
本II期臨床研究結果顯示,611給藥后可明顯改善CRSwNP受試者的NPS和NCS評分,在所有療效指標上起效迅速,應答明確,整體安全性良好,611的療效和安全性均具有有力的競爭優勢。
慢性鼻竇炎是一種病程超過12周、以鼻竇黏膜炎癥為特征的疾病,是常見的耳鼻咽喉科疾病之一。慢性鼻竇炎有著明顯的臨床癥狀,如鼻塞、流涕、嗅覺減退、面部疼痛或壓迫感及頭痛。在臨床上分為慢性鼻竇炎不伴鼻息肉和慢性鼻竇炎伴鼻息肉兩種類型。慢性鼻竇炎(CRS)在中國發病率估計約為13%,結合中國國情,預計中國CRSwNP現有患者量大約為0.28~0.35億。
目前推薦的治療方案,包括以糖皮質激素為核心的內科治療和以功能性內鏡鼻竇手術切除病變為核心的外科治療。一線治療藥物是鼻用糖皮質激素(INCS),但部分患者存在治療響應不足,而使用系統性糖皮質激素(SCS)治療CRSwNP的臨床療效難以維持,停藥后或可導致息肉復發。內鏡鼻竇手術作為CRS整體治療中的一部分,不能切除或改變鼻竇黏膜的炎癥本質。
CRSwNP主要由2型炎癥驅動。從病理機制來看,白細胞介素(IL)-4、IL-13、IL-5等細胞因子都有參與。IL-4與IL-13是該型炎癥反應的關鍵驅動因素,參與B細胞的類別轉換與免疫球蛋白(Ig)E產生、驅動嗜酸性粒細胞的分化和遷移、導致嗜堿性粒細胞和肥大細胞脫顆粒,釋放如2型細胞因子(IL-4、IL-5和IL-13)等。近年來,針對2型炎癥的單克隆抗體為代表的生物制劑進入CRSwNP治療領域(IL-4、IL?5、IL?13、IgE及其受體)。作為經INCS治療仍控制不佳的成人CRSwNP的輔助維持治療的藥物,包括奧馬珠單抗(IgE靶點)、美泊利單抗(IL-5靶點)、度普利尤單抗(IL-4靶點)在國外已批準上市,但尚未在國內獲批。對于長期使用INCS仍不能充分控制病情,或是對SCS治療有禁忌或不耐受的患者,仍存在未滿足的臨床需求,亟需可選擇的安全有效的長期治療方案。基于已完成的研究結果,與同類產品相比,611顯示出了積極的療效應答,預期將為CRSwNP提供更多治療選擇,滿足目標人群尚未滿足的臨床需求。
三生國健董事長婁競博士表示,"我們很高興看到611在慢性鼻竇炎伴鼻息肉受試者中進行的II期臨床研究獲得積極結果。未來,我們將加速推進該產品的臨床試驗進程,期待在大樣本人群中進一步確證611的積極療效。"
]]>本研究共納入458例中重度斑塊狀銀屑病(PsO)患者,按照2:2:1的比例被隨機分配至試驗藥物A組[160 mg W0+80 mg Q2W(前12周)+80mg Q4W]、試驗藥物B組[160 mg Q4W(前12周)+160mg Q8W]以及安慰劑組(前12周,之后將會隨機到不同的試驗組)。主要療效終點為給藥第12周達到PASI 75和sPGA 0/1的受試者比例,關鍵次要療效終點包括給藥第12周分別達到PASI 90、PASI 100和sPGA 0的受試者比例,次要療效終點包括療效維持情況、復發情況、瘙癢評分、生活質量評估等。
有效性方面,研究結果顯示,該研究的所有主要、關鍵/次要療效終點均成功達到。維持治療期給藥方案有望實現同類產品給藥間隔最長,且各種療效指標在維持治療期持續升高并保持穩定。相較于同靶點已上市產品,608的誘導治療(12周)和維持治療(52周)療效數據均具有有力的競爭優勢。
短期內快速起效、療效優勢明顯:第12周時,PASI 75應答受試者比例在試驗藥物A組和試驗藥物B組分別達到95.1%和93.4%,均顯著優于安慰劑組(PASI75: 8.8%,P<0.0001);sPGA0/1的應答受試者比例在試驗藥物A組和試驗藥物B組分別達到76.1%和67.2%,均顯著優于安慰劑組(sPGA0/1: 1.1%,P<0.0001);此外維持治療期給藥間隔延長至Q4W或Q8W,在第52周兩種給藥間隔給藥方案的受試者PASI75療效應答比例仍舊維持穩定及持久,sPGA0/1的療效應答比例在持續升高,因此該產品有望實現更長的給藥間隔。
病灶清除比例高,生活質量改善:所有關鍵次要終點均順利達成,包括第12周時達到PASI改善≥90%(PASI 90)的受試者比例、第12周時達到PASI改善100%(PASI 100)的受試者比例、第12周時達到sPGA 0分的受試者比例和第12周時皮膚病生活質量指數(DLQI)及瘙癢NRS評分等較基線變化等。608在上述指標的改善均顯著優于安慰劑組,并穩健維持至第52周。尤其是病灶完全清除指標也即PASI100的應答在52周試驗藥物A組和試驗藥物B組達到PASI100的應答比例分別為63.6%和56.8%,顯著高于同靶點藥物(可善挺在中國人群開展的研究數據:52周的PASI100應答為42.1%)。
安全性方面,608整體安全性和耐受性良好,藥物相關的不良事件嚴重程度多為1~2級(CTCAE分級),與前期臨床研究數據及同靶點藥物相比,常見的不良事件類型和嚴重程度,均在預期范圍,未發現新的安全性風險信號。總體上,安全性特征良好,且與既往結果一致。
三生國健計劃于近期遞交608用于治療成人中重度斑塊狀銀屑病的上市申請。
銀屑病是一種常見的、免疫相關的、慢性復發性炎癥性皮膚病,世界各地不同人群中的患病率有明顯差異,歐美的患病率約1%~3%,而我國約為0.5%左右,但我國人口基數大,故銀屑病患者絕對數較多,且正在逐年增加。銀屑病病程長、易復發、治療困難,患者需接受終生治療,同時與心血管疾病、糖尿病、代謝綜合征等慢性疾病也密切相關,給患者的身心健康和生活質量帶來了嚴重的影響。臨床雖然有多種治療方案可供選擇,但均有其局限性。生物制劑已經成為銀屑病的主要系統用藥,在治療中重度、難治性及特殊類型銀屑病方面發揮積極而有效的作用。
我國目前尚未有針對IL-17A靶點治療中重度斑塊狀銀屑病的國產藥物獲批。608是重組抗IL-17A人源化單克隆抗體注射液,屬于治療用生物制品1類,與同靶點已上市產品司庫奇尤單抗和依奇珠單抗作用機制類似,可特異性結合人IL-17A,并能阻斷IL-17A與其受體的結合,有效抑制炎性因子的釋放。
三生國健董事長婁競博士表示:"我們很高興看到三生國健自主創新研發的重組抗IL-17A人源化單克隆抗體608注射液關鍵注冊性Ⅲ期臨床研究獲得積極結果。未來,我們將加速推進該產品的研發進程,推進608新藥上市申請事宜。三生國健將繼續致力于探尋及開發更安全有效的治療性生物制劑,以應對迫切的醫療需求,為自身免疫性疾病患者提供重要的治療選擇。"
]]>本次科創板開市五周年評選聚焦新興產業領域,綜合企業自主申報信息和公開數據,從企業經營、研發、市場、知識產權等多維度評價,秉承客觀、公正的原則,表彰2023年度在科創板領域表現杰出、擁有卓越創新力的企業、機構和個人。其中,2024年科創板上市公司領軍人物TOP10的評選設置了五個維度,包括科創板上市公司市值情況、上市公司盈利能力及財務狀況、合規披露及監管機構評價、業內知名度與社會美譽度、個人資歷與能力評定等。
2020年,三生國健于科創板成功上市。4年來,在資本市場的助力與見證之下,公司秉承"讓創新抗體藥觸手可及"的企業使命,聚焦自身免疫性疾病領域,以"聚焦創新、臨床增益、合理布局、精準研發"為原則,均衡布局短、中、長期研發管線,多款自免創新藥物已進入臨床III期階段,臨床進展處于國內領先。公司擁有抗體藥物國家工程研究中心,是"免疫與炎癥全國重點實驗室"的重要依托單位之一,具備從藥物發現、臨床研究到商業化的綜合領先實力,有望實現所有自免管線產品國內第一梯隊上市的目標。憑借卓越的創新能力和高成長性,今年6月,三生國健成功入選科創100指數成分股。
公司高度重視投資者權益,堅持高質量信披,獲得監管機構和投資者的廣泛認可。2023年10月,三生國健榮獲上海證券交易所滬市上市公司信息披露工作A級評價,充分體現了上交所對公司信息披露質量的高度認可。
此外,三生國健也是科創板中最早開展ESG管理實踐,并對外披露ESG報告的上市公司之一。2023年,公司獲商道融綠 ESG A-評級,排名全部獲評企業前11.6%;獲中誠信ESG評級A級,排名全部獲評企業前10%;萬得ESG評級A級;排名行業前17%,并入選中國上市公司協會"上市公司ESG優秀實踐案例"。
三生國健董事長婁競博士表示:"熱烈祝賀科創板開市五周年。科創板的設立,對中國創新生物醫藥企業的發展具有非凡意義,其不僅提供了寶貴的融資平臺,更激發了企業的創新活力與潛力。一路走來,科創板見證了三生國健的堅持與蛻變,未來,我們將不斷提升公司治理水平,加強創新研發,堅持高質量發展、高品質生產、新型工業化建設,大力發展新質生產力,積極履行社會責任,助力資本市場健康發展,為廣大給予三生國健厚愛的投資者送上更多回報。
本Ⅲ期臨床研究的主要療效終點為驗證重組人血小板生成素注射液(rhTPO)在擬擇期行侵入性手術的慢性肝病相關血小板減少癥患者中維持圍手術期血小板計數≥50×109/L的效果優于安慰劑。研究結果顯示,試驗組(rhTPO)維持圍手術期血小板計數≥50×109/L的受試者比例為85.00%(95%CI:75.26,92.00),對照組為12.50%(95%CI:4.19,26.80),兩組之間(試驗組-對照組)的應答率差值(試驗組-對照組)為67.90%(95%CI:51.60,84.20;P <0.0001)。以上結果表明,與對照組相比,試驗組的應答率顯著增加,主要療效終點達到優效性結論。試驗組與對照組在不良事件的發生率及嚴重程度上無明顯差異。
血小板減少是慢性肝病常見的并發癥,其程度與肝病的嚴重程度相關。肝硬化患者中約78%發生不同程度的血小板減少。造成慢性肝病患者發生血小板減少的主要因素為血小板生成素(TPO)產生下降,其他因素包括脾功能亢進、血小板破壞增加以及病毒對骨髓的抑制等。對于需要手術治療的慢性肝病患者,血小板減少可導致其發生手術相關出血事件的風險增加。目前輸注血小板是降低手術出血風險的主要治療措施,但其來源緊缺,療效維持時間短,并且具有輸血反應和潛在的輸血感染等風險,限制了其應用。合并血小板減少癥的慢性肝病患者亟需更加高效、安全的替代療法。
特比澳®是由三生制藥自主研制的重組人血小板生成素注射液,已獲批成人實體瘤化療后血小板減少癥(CIT)、成人原發免疫性血小板減少癥(ITP)和兒童原發免疫性血小板減少癥(ITP)適應癥。本次III期臨床研究達到預設主要終點,標志著三生制藥在慢性肝病領域取得了一座新的里程碑,將更好地滿足廣大慢性肝病患者的臨床用藥需求。
三生制藥董事長兼首席執行官婁競博士表示:"特比澳®在長期的臨床實踐中已經被證明是一款值得醫生和患者信賴的藥物,我們相信其在慢性肝病患者的治療中也將繼續發揮出色的療效。血小板減少癥與諸多疾病有關,并影響相關的治療進程,公司將繼續努力拓展特比澳®的適應癥,挖掘藥物潛力,力爭為更多患者造福。"
關于三生制藥
三生制藥是一家集研發、生產和銷售為一體的生物制藥領軍企業,致力于以高品質的藥品提高患者生存質量,為人類健康造福。目前,公司擁有100余項國家發明專利授權,40余種上市產品,覆蓋腎科、腫瘤科、自身免疫性疾病、眼科及皮膚科等多種治療領域。公司擁有抗體藥物國家工程研究中心以及生物藥和化藥雙平臺的4大研發中心,共有29種在研產品,其中25種為國家新藥,并擁有符合GMP標準的5大生產基地。未來,三生制藥將繼續秉持"珍愛生命、關注生存、創造生活"的理念,全力打造全球領先的中國生物制藥企業。請訪問www.3sbio.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
]]>貧血是慢性腎臟病(chronic kidney disease,CKD)的常見并發癥。由于內源性促紅細胞生成素(EPO)主要在腎臟中產生,慢性腎衰發展過程中腎臟組織逐漸被破壞,導致內源性EPO分泌不足,從而引起腎性貧血。貧血的發生率隨腎臟功能的下降而逐漸增加。慢性腎臟病患者進入第5期,即終末期腎臟病(ESRD)時,貧血患病率達到98.2%。
血液透析的慢性腎衰竭患者腎性貧血的程度直接影響著患者的生存質量和生存率。對于血液透析的慢性腎衰竭患者而言,及時糾正血紅蛋白水平,可使患者的生存質量和生理功能得到顯著改善。近年來臨床數據顯示,由于人促紅細胞生成素(rHuEPO)半衰期短,給藥次數頻繁,給患者和醫護人員帶來不便。因此開發安全、穩定、高效且有更長體內消除半衰期的rHuEPO逐漸成為研究的熱點。
SSS06是一款高糖基化長效重組蛋白產品,在保留原有生物學活性的基礎上具有較長的穩定性和半衰期,能減少用藥次數,方便臨床使用。
三生制藥董事長兼首席執行官婁競博士表示:"三生制藥自1998年推出首款EPO產品以來,持續深耕腎科領域,得到了廣大醫生患者的廣泛認可。SSS06將進一步豐富三生制藥在腎性貧血領域的產品組合。同時,作為新一代長效促紅素產品,SSS06將為患者提供更加便利的用藥選擇。期待該產品早日走上市場,為腎性貧血患者造福。"
關于三生制藥
三生制藥是一家集研發、生產和銷售為一體的生物制藥領軍企業,致力于以高品質的藥品提高患者生存質量,為人類健康造福。目前,公司擁有100余項國家發明專利授權,40余種上市產品,覆蓋腎科、腫瘤科、自身免疫性疾病、眼科及皮膚科等多種治療領域。公司擁有抗體藥物國家工程研究中心以及生物藥和化藥雙平臺的4大研發中心,共有29種在研產品,其中25種為國家新藥,并擁有符合GMP標準的5大生產基地。未來,三生制藥將繼續秉持"珍愛生命、關注生存、創造生活"的理念,全力打造全球領先的中國生物制藥企業。請訪問www.3sbio.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
]]>
2024中國上市公司英華示范案例評選由中國基金報發起,旨在秉承新"國九條"精神,從長期投資、價值投資視角出發,全面客觀地評估企業的綜合實力與價值,評選出獲得機構投資者認可的上市公司。
三生制藥一直踐行ESG管理理念,致力于持續優化在環境、社會及公司治理方面的綜合表現,并不斷提升ESG績效水平,成為生物制藥行業ESG領先者。2023年,三生制藥循環用水總量達46,651.00立方米,同比上漲27.26%;有害廢棄物產生密度1.30千克/萬元,同比下降10.96%。員工人均培訓小時數20.90小時,董事會成員反貪污培訓覆蓋率100%,MSCI ESG評級穩居AA。
展望未來,三生制藥將繼續提升公司治理水平,打造有韌性的供應鏈,不斷完善環境管理體系,保障員工權益,通過開展慈善公益項目等形式提高創新藥品及醫療服務的可及性,為推動我國醫藥行業高質量發展貢獻力量。
2024中國上市公司英華示范案例評選由中國基金報發起,旨在秉承新"國九條"精神,從長期投資、價值投資視角出發,全面客觀地評估企業的綜合實力與價值,評選出獲得機構投資者認可的上市公司。
三生國健厚植ESG文化土壤,將ESG理念融入企業管理的每一個環節。公司在實現自身的合規經營與穩健增長的同時,立足"惠及中國,面向全球,為人類健康造福"的愿景,識別出自身在可持續發展領域中能夠積極貢獻并大力推動的關鍵策略,積極制定相應的方針與行動規劃。通過實際行動與持續優化,有力推動全球可持續發展目標的達成。
三生國健自登陸A股科創以來堅持披露ESG報告,并持續優化關鍵績效水平。2023年,三生國健通過環境、勞工、道德等方面評估的供應商比例達100%,女性員工占比51.71%,員工培訓覆蓋率100%,員工人均培訓時長45.2小時,污染物100%達標排放,處于行業領先水平。