內生增長動能強勁,上市產品繼續強勢增長
2024年,三生國健實現營業收入11.94億元,同比增長17.70%;歸屬于上市公司股東的凈利潤達到7.05億元,同比增長139.15%,歸屬于上市公司股東的扣非凈利潤達2.46億元,同比增長18.99%,展現出強大的內生增長動力。
核心產品中,益賽普在國內市場持續鞏固領先地位,公司通過積極的市場拓展,銷售規模成功實現穩中有升。賽普汀表現亮眼,其在臨床應用中的認可度不斷提升,患者用藥周期延長,共同推動了銷售的高速增長。健尼哌憑借在抗排異反應領域的優勢,進一步鞏固市場地位。
研發全周期高效產出,強科創平臺加速創新生長
2024年,三生國健憑借卓越的創新能力和市場競爭力成功入選科創100指數成分股,體現了市場對于公司科創實力的高度認可。今年,公司進一步被上海市政府認定為"上海市創新型企業總部"。
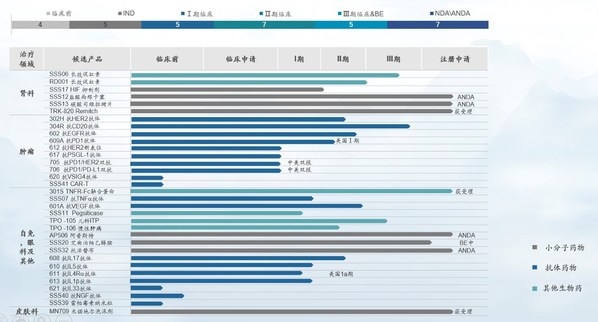
研發投入顯著提升,全力支持高強度研發。2024年全年,三生國健研發投入達5.41億元,同比增長72.06%。截至2024年底,公司研發管線中共開展22個自免項目。
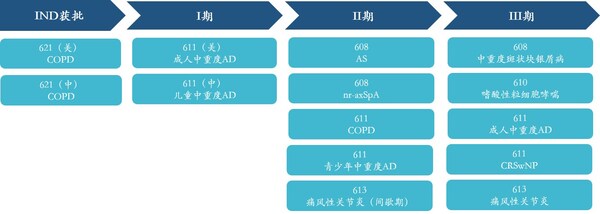
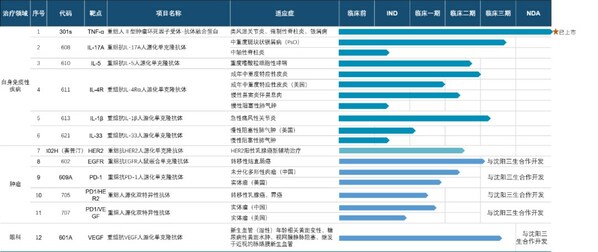
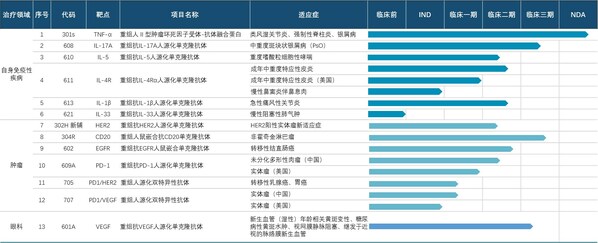
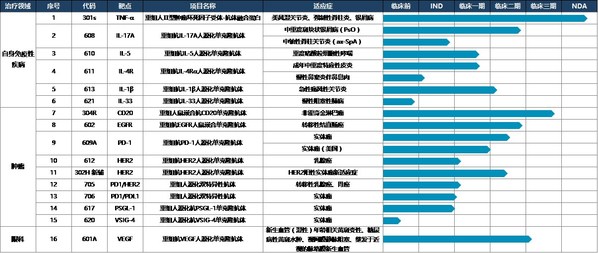
臨床速度加快,II、III期臨床數量不斷增長。抗IL-17A人源化單克隆抗體注射液(608)上市申請已獲得國家藥監局受理,用于治療成人中重度斑塊狀銀屑病;抗IL-5單抗610治療嗜酸性粒細胞哮喘、抗IL-4Rα單抗611單藥治療成人特應性皮炎、611聯合TCS治療成人特應性皮炎、611治療慢性鼻竇炎伴鼻息肉、抗IL-1β單抗613治療痛風性關節炎5個項目處于臨床III期。另外還有6個項目處于臨床II期、4個項目處于臨床I期,以及6個項目處于IND審核或獲批階段。
兩款自研產品拿下"國產首個",創新引領開辟新藍海賽道。抗BDCA2單抗626臨床試驗申請已獲國家藥監局批準,用于治療系統性紅斑狼瘡(SLE)及皮膚型紅斑狼瘡(CLE),是首個進入臨床的國產抗BDCA2單抗;抗TL1A單抗627臨床試驗申請已獲國家藥監局受理,成為首個申報臨床試驗并獲受理的國產抗TL1A單抗。不僅如此,626與627均為中美雙報產品,兩者在美國的IND申請均已獲批。
公司自免項臨床進展均處于同類國內產品前列。公司將持續加快臨床進度,力爭實現公司所有自免管線產品國內第一梯隊上市的目標。
ESG繼續保持行業領先
強直公益項目救治患者超2萬人
2024年,三生國健繼續將ESG理念融入公司戰略,致力于成為健康產業的長期開拓者、抗體藥物的可靠提供者、社會價值的穩定創造者和綠色力量的長期行動者。
公司成功入選2024年國家級綠色工廠名單、上海市綠色制造示范名單,在Wind ESG評級中獲評A級、商道融綠ESG 評級中獲評A-級,均位于行業前列。同時,公司榮膺中國醫藥上市公司ESG競爭力TOP20、中國上市公司英華獎A股ESG價值獎等重磅獎項,體現了公司在可持續發展領域的卓越表現。
強直性脊柱炎健康鄉村項目繼續大力推進。截至2024年12月底,項目已累計開展培訓和篩查1200余場,培訓4.5萬人次,篩查5萬人次,救治農村強直患者2.05萬人,突破2萬人大關,幫助他們恢復正常勞動力,為我國鞏固脫貧攻堅成果,發展鄉村振興做出有益貢獻。
三生國健董事長婁競博士表示:"2024年是公司發展的重要一年,我們在創新藥領域取得了顯著成就。通過聚焦自免戰略,我們不僅實現了業績的穩健增長,更在研發和管理上取得了長足進步。展望未來,我們將繼續以患者需求為導向,以技術創新為核心,繼續加大研發投入,加速臨床項目推進,提升公司的核心競爭力,加速開啟第二增長曲線。我們堅信,通過持續的努力和創新,三生國健將為患者、股東和社會創造更大的價值,助力健康中國2030目標早日實現。
營收規模向百億邁進
2024年,三生制藥營收增長強勁,公司整體收入規模向百億邁進。作為公司重點品種,全球唯一商業化的重組人血小板生成素(rhTPO)產品特比澳2024年銷售收入約50.62億元,同比增長20.4%。該產品被《中國臨床腫瘤學會(CSCO)腫瘤治療所致血小板減少癥診療(CTIT)指南(2024年版)》等多個臨床指南列為最高級別推薦的治療選擇。特比澳新增兒童ITP適應癥于2024年獲批,并順利續約醫保目錄2024年版。
促紅素雙品牌益比奧和賽博爾繼續保持市場主導地位;益賽普在國內市場持續鞏固領先地位,公司通過積極的市場拓展,銷售規模成功實現穩中有升;賽普汀表現亮眼,其在臨床應用中的認可度不斷提升,患者用藥周期延長,共同推動了銷售的高速增長。
脫發治療明星產品蔓迪2024年銷售收入13.37億元,同比增加約18.9%。2024年,蔓迪持續打造科學生發品牌,拓展數字化營銷體系,提升電商銷售規模。此外,蔓迪泡沫劑型產品成功獲批上市,為患者提供了多樣化的治療選擇,進一步鞏固了蔓迪在市場競爭格局中的優勢地位。
創新價值逐步兌現
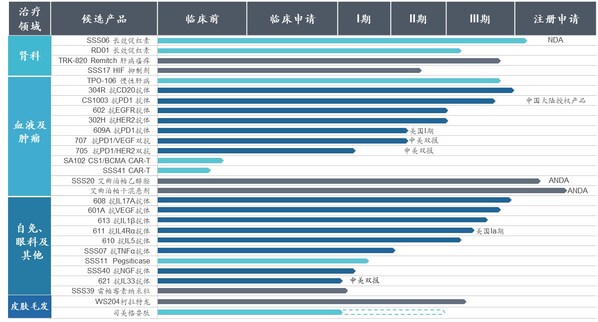
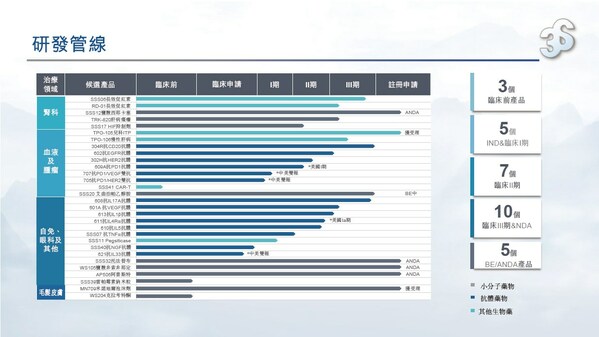
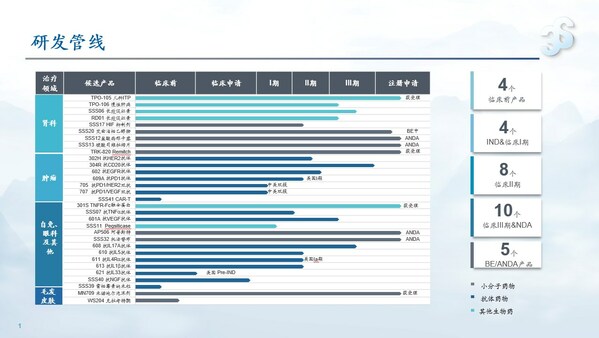
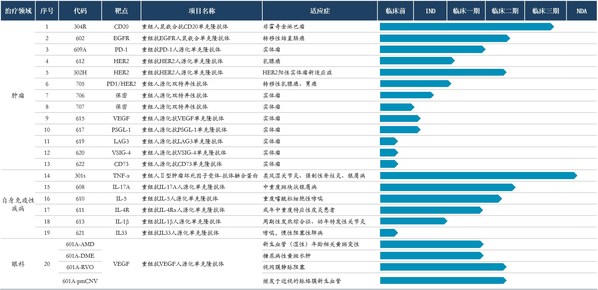
2024年,三生制藥獲得艾曲泊帕混懸劑等3款藥品獲批上市,并提交包括SSS06長效促紅素、608(抗IL-7單抗)等4款產品的上市申請。目前,三生制藥研發管線擁有30項在研產品,包含血液/腫瘤科13項,自身免疫及眼科11項,腎科3項,皮膚及減重領域3項。截至目前,已有10款新藥推進至臨床III期階段。
腫瘤管線優異數據讀出,創新價值凸顯。由公司CLF2雙抗平臺開發的靶向PD-1/VEGF的雙特異性抗體707在非小細胞肺癌、轉移性結直腸癌和婦科腫瘤方面已開展4項臨床研究,其中,707單藥一線治療PD-L1陽性的晚期非小細胞肺癌已獲批準進入III期臨床,其II期臨床的部分患者數據已讀出,顯示出優異的臨床治療效果,具備BIC的潛質。同時,公司還與百利天恒達成合作,將探索707雙抗和BL-B01D1(靶向EGFR×HER3的雙抗ADC)聯合用藥在腫瘤治療上未被發掘的潛在臨床價值。此外。705(抗PD-1/HER2雙抗)706(抗PD-1/PD-L1雙抗)等多款抗腫瘤產品也已進入針對晚期實體瘤的I期臨床試驗。
腎科領域圍繞促紅素及貧血適應癥,布局包括長效、小分子在內的多個產品及適應癥,提升臨床競爭力。其中,SSS06(重組紅細胞生成刺激蛋白注射液)的CIA適應癥已獲臨床批準,填補國內長效促紅素在腫瘤貧血領域的治療空白;SSS17作為目前在研同類產品中半衰期最長的HIF抑制劑,周度口服給藥將大幅提升患者依從性。
自免管線研發成果即將迎來收獲。2024年,抗IL-17A抗體(608)治療斑塊狀銀屑病的III期臨床試驗已成功達到所有療效終點,已向國家藥監局提交上市申請并獲受理。用于治療急性痛風性關節炎的抗IL-1β抗體(613)、用于治療重度嗜酸性粒細胞哮喘的抗IL-5抗體(610)和治療特應性皮炎的抗IL-4Rα抗體(611)均已完成III期臨床試驗患者入組。此外,公司還開發具有臨床需求和創新性的新靶點和新分子,著力打造國內具有競爭力的差異化自免管線。抗BDCA2單抗626治療系統性紅斑狼瘡(SLE)和皮膚型紅斑狼瘡(CLE)適應癥的中美新藥臨床試驗申請均已獲得批準,已在國內開展I期臨床;抗TL1A抗體627治療潰瘍性結腸炎(UC)適應癥已遞交美國臨床試驗申請并獲批準,中國臨床試驗申請已獲受理,均為同靶點上國內首個獲批臨床的國產創新藥物。
合作擴展商業化版圖
2024年,三生制藥對外合作項目取得多項成果落地。大健康領域,子公司三生蔓迪與深圳翰宇藥業就司美格魯肽注射液減重適應癥達成合作,以電商經驗賦能藥品的患者觸達;腫瘤領域,于24年10月與海和藥物達成合作,獲得紫杉醇口服溶液柏瑞素的商業化權益。作為全球唯一的紫杉醇口服制劑,柏瑞素已在中國獲批上市。三生制藥將通過自身專業的腫瘤學術能力,推動柏瑞素這一優效、便捷且更具安全性的化療創新藥物在更多患者中的可及性,引領腫瘤居家治療新模式。此外,三生制藥還在年內獲得東陽光藥業旗下克立福替尼、映恩生物旗下HER2 ADC藥物DB-1303的商業化權利,構建腫瘤板塊的多元化產品矩陣。
未來,三生制藥將繼續聚焦血液與腫瘤、腎科、自免、毛發皮膚等優勢領域,推動創新藥品的價值開發,強化創新藥管線競爭優勢。同時公司將持續踐行自主研發和對外合作雙軌并行的策略,以全球化視野,將創新藥物研發成果加速轉化為患者的臨床生存獲益。
三生制藥董事長兼首席執行官婁競博士表示:"2024年是三生制藥加速奔跑的一年。我們一如既往地堅持在創新藥領域耕耘不輟,取得了業界有目共睹的喜人成績。核心產品持續穩健放量,占據細分品類龍頭,展現出了雄厚的造血能力。核心管線608、707等讀出了令人振奮的臨床數據,未來可期。放眼未來,三生制藥將持續圍繞存在廣泛臨床需求的領域,積極開展靶點探索和藥物研發,同步推動創新速度和創新水平的提升,堅持發掘有潛力的創新藥合作標的。實踐的檢驗讓我們充分相信'夢雖遙,追則能達;愿雖艱,持則可圓。'三生制藥將牢記民族生物藥企業的責任與擔當,以高品質的創新藥產品回饋社會,為人類健康造福。"
根據協議,沈陽三生將向諾邁西醫藥支付首付款、研發及銷售里程碑付款。諾邁西醫藥將繼續負責已開展的III期臨床試驗及產品后續的開發、臨床及注冊等工作。
紫杉醇是一種生物堿類化合物,具有顯著的抗癌活性,能夠通過干擾腫瘤細胞的有絲分裂和阻止其生長來發揮作用。臨床上,紫杉醇被廣泛用于胃癌、乳腺癌、非小細胞肺癌等多種惡性腫瘤的治療。紫杉醇口服溶液由韓國大化制藥基于脂質自乳化藥物遞送技術開發而成,已獲得韓國食品與藥品監督局(MFDS)上市批準,用于晚期或轉移性或局部復發性胃癌二線治療,是全球第一款獲批的口服劑型紫杉醇藥物。海和藥物自韓國大化制藥獲得了紫杉醇口服溶液在中國及泰國的研發、生產及銷售權利。
今年9月25日,海和藥物和韓國大化制藥共同宣布,雙方合作開發的紫杉醇口服溶液2024年9月19日獲得中國國家藥監局批準上市,適用于一線含氟尿嘧啶類方案治療期間或治療后出現疾病進展的晚期胃癌患者的治療。
一項在國內進行的開放、隨機平行對照、非劣效設計、多中心Ⅲ期研究(CTR20190050)顯示,紫杉醇口服溶液在經一線治療后的不可手術切除、復發或轉移性晚期胃癌患者中,療效優于紫杉醇注射液,中位總生存時間延長了2.59個月(HR:0.770, p=0.006),且整體安全耐受。
現階段,該藥作為一線化療(既往未接受系統化療)治療復發性或轉移性HER2陰性乳腺癌適應癥的國際多中心III期臨床研究也在順利進行中。
此前,國內紫杉醇的上市劑型均為注射劑,需經配制后在醫院經靜脈滴注給藥,患者需頻繁返院,且會有注射部位不良反應;口服劑型的紫杉醇藥物給患者帶來口服便捷的同時,提高了臨床療效,降低脫發、外周神經病變、疲乏和過敏反應等不良反應的發生率,顯著提高患者的生活質量。
三生制藥董事長兼首席執行官婁競博士表示:"紫杉醇在腫瘤治療中有廣泛的應用場景,口服溶液劑型是該經典藥物的又一次重大突破性創新,在提高相關疾病患者生存率的同時,為患者提供了更便利的給藥方式,大大降低了化療給患者造成的痛苦。海和藥物在引入該藥的基礎上進行了進一步的開發,不斷擴大口服劑型的使用范圍,已成功獲批胃癌二線治療適應癥。我們很高興能和海和藥物合作,一起讓更多患者用上這一新藥、好藥,共同增益患者的福祉,讓這款新藥為患者帶去更大的價值。"
海和藥物首席執行官董瑞平博士表示:"很高興與三生制藥達成戰略合作。海和藥物一直聚焦抗腫瘤治療領域,致力于給患者帶來更好的藥物。紫杉醇類藥物在實體瘤治療中應用廣泛,但一直沒有在劑型上得到突破。紫杉醇口服溶液作為中國首個上市的口服劑型紫杉醇類藥物,將顯著延長胃癌患者生存時間,讓患者更方便更安全地使用。三生制藥作為中國領先的生物技術公司,具有高效的推廣團隊和強大的商業化能力,與紫杉醇口服溶液巨大的臨床價值深度契合,將惠及廣大的腫瘤患者。同時,我們也期待雙方充分發揮各自的優勢,繼續推進藥物在研究、臨床開發等方面的潛在合作,為患者帶來創新的治療選擇。"
上半年,公司三款上市產品繼續保持穩健增長的勢頭,內部科學化、系統化、精細化管理獲得顯著成效;自免管線里程碑頻出,多項臨床試驗取得積極成果;ESG戰略不斷深化,多年來強直性脊柱炎健康鄉村項目已拓展至全國28個省、市、自治區,距覆蓋全國更近一步。
循證+口碑
上市產品保持強勁競爭力
益賽普受益于預充針劑型的推廣,患者依從性和接受度持續提升。上半年,益賽普國內銷售收入達3.3億元,同比增長9.4%。上市19年來,益賽普深得廣大醫患信賴,積累了良好的口碑。下一步,益賽普將利用多年確證的循證學證據,持續推進市場下沉策略,加強基層科室覆蓋,提升三四線城市風濕免疫生物制劑使用觀念,推廣早期生物治療長遠獲益的觀念,并積極拓展益賽普在中醫等多科室多領域的應用。
賽普汀醫院準入工作持續推進,臨床應用不斷增加,優秀的治療價值給患者帶來持續獲益。上半年,賽普汀實現銷售收入1.6億元,同比增長48.9%。不斷積累的循證醫學證據是賽普汀實現快速放量的重要因素,其在HER2陽性乳腺癌新輔助治療、晚期一線治療及HER2陽性肺癌、胃癌等泛HER2領域的應用均取得積極的研究進展,多項研究入選2024 ASCO年會。
健尼哌進一步加大在臨床應用方面的學術推廣,滿足相關患者的臨床用藥需求。上半年健尼哌收入同比增長47.8%。
創新+高效
重磅在研產品沖刺上市
上半年,三生國健繼續以"聚焦創新、臨床增益、合理布局、精準研發"為原則,根據產品管線的臨床需求特點,按照臨床價值進行研發資源分配,均衡公司長期、中期、短期管線布局,全力推動核心產品的臨床進度以實現快速上市。
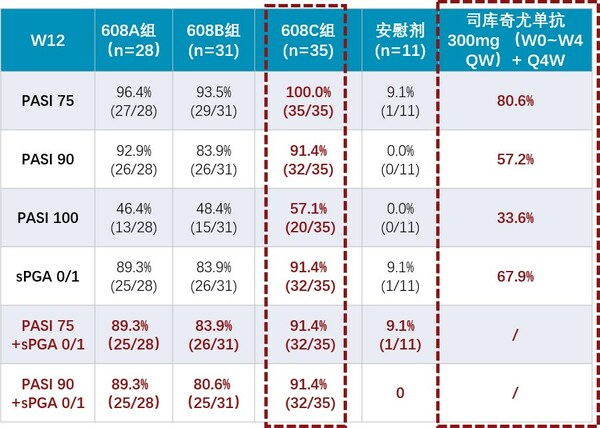
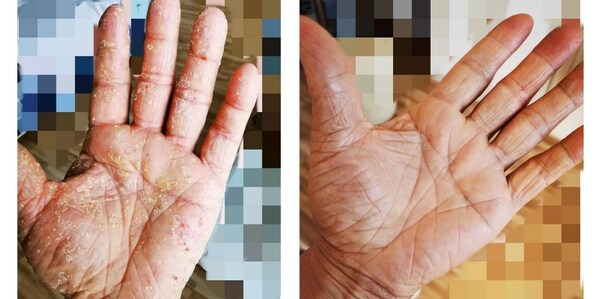
抗IL-17A單抗608治療成人中重度斑塊狀銀屑病的關鍵注冊性Ⅲ期臨床研究已完成揭盲及最終統計分析,所有主要療效終點(PASI 75和sPGA 0/1)、關鍵次要療效終點(PASI 90、PASI 100和sPGA 0)和所有次要療效終點均成功達到,維持治療期給藥方案有望實現同類產品給藥間隔最長,且各種療效指標在維持治療期持續升高并保持穩定。相較于同靶點已上市產品,608的誘導治療(12周)和維持治療(52周)療效數據均具有有力的競爭優勢。安全性特征良好,且與既往結果一致。608計劃于近期遞交上市申請。
抗IL-4Rα單抗611治療慢性鼻竇炎伴鼻息肉(CRSwNP)的II期臨床研究達到主要終點。兩個劑量組(300mg Q2W、450mg Q4W)治療CRSwNP受試者均起效迅速,給藥第4周即顯示出較安慰劑組的應答差異趨勢。安全性良好,多數TEAE為1~2級,未發生藥物相關≥3級的TEAE和藥物相關SAE。
多項II、III期臨床研究快速入組。抗IL-5單抗610重度嗜酸性粒細胞哮喘適應癥臨床III期啟動并完成首例受試者入組;611成人中重度特應性皮炎適應癥臨床III期啟動并完成首例受試者入組,青少年特應性皮炎適應癥臨床II期完成首例受試者入組;抗IL-1β單抗613 啟動急性痛風性關節炎適應癥III期臨床研究并完成首例受試者入組,獲得痛風性關節炎(間歇期)適應癥的新藥臨床試驗申請(IND)批件并完成臨床II期所有受試者入組。
此外,公司還開發具有臨床需求和創新性的新靶點和新分子,著力打造國內具有競爭力的差異化自免管線。公司分別遞交了早研項目抗BDCA2單抗626治療系統性紅斑狼瘡(SLE)和皮膚型紅斑狼瘡(CLE)適應癥的中美新藥臨床試驗申請(IND),其中中國的新藥臨床試驗申請(IND)已獲國家藥監局受理。
目前,公司研發管線中共開展14個自免項目,其中包括5個臨床III期項目,5個臨床II期項目,2個臨床I期項目,2個處于IND獲批階段項目。未來,公司還將通過License-in、投資并購等多種模式,布局自免領域新技術、新產品和新平臺。
責任+堅守
"強直健康鄉村"碩果累累
2024年是強直性脊柱炎健康鄉村項目推進的第5年。截至目前,強直性脊柱炎健康鄉村項目累計篩查4.6萬人次,累計救治農村強直患者1.6萬人,累計開展培訓和義診活動1100余場,培訓基層醫護人員4.5萬人次,簽約醫院近1140家,在甘肅、上海等省市實現首次落地,覆蓋省、市、自治區數量達28個。
ESG成果繼續領跑行業。公司連續第3年發布ESG報告,ESG治理獲商道融綠A-評級、萬得ESG A級評級。此外,公司還榮膺《中國基金報》主辦的中國上市公司英華獎"A股ESG價值獎"、界面新聞2024金勛章獎"年度ESG實踐案例"等重磅榮譽。
三生國健董事長婁競博士表示,"2024上半年,三生國健財務表現優異,各項經營指標穩中向好,上市產品受市場廣泛認可,重磅在研產品讀出積極臨床數據。憑借前瞻的戰略布局和扎實的戰略定力,公司即將迎來自免創新藥的收獲期,重要在研產品均有望實現第一梯隊上市的目標。憑借卓越的技術與管理實力以及充沛、健康的現金流,公司將繼續致力于自免高潛產品的研發,確保后續自免新產品與新適應癥的開發源源不斷開展,形成兼具廣度和深度的國內一流自免管線矩陣,力爭推動更多自免新藥早日上市,為更多患者造福。"
生物藥板塊穩健成長
2024上半年,三生制藥不斷探索核心生物藥產品適應癥拓展,加強基層市場布局,積極提升藥品可及性。
全球唯一商業化的重組人血小板生成素(rhTPO)產品特比澳在上半年銷售收入約24.76億元,同比增長22.6%。該產品在今年4月獲批第三個適應癥,用于治療兒童或青少年的持續性或慢性原發免疫性血小板減少癥。
促紅素雙品牌益比奧和賽博爾2024上半年銷售收入約5.16億元,同比增長11.3%。2024年起,益比奧用于外科圍手術期的紅細胞動員獲醫保覆蓋。
用于治療類風濕性關節炎、強直性脊柱炎及銀屑病的益賽普2024上半年銷售收入3.29億元,同比增長9.5%。
用于治療HER2陽性轉移性乳腺癌的賽普汀2024上半年銷售收入為1.62億元,同比提升48.9%。
毛發健康產品持續豐富
2024年1月,蔓迪泡沫劑型獲批上市,以自主創新技術改良溶劑成分,填補敏感人群用藥空白,并相對第一代酊劑產品提升滲透速率,縮短起效時間。2024上半年,蔓迪全系列銷售收入5.50億元,同比增加約10.0%。作為首個獲批的OTC米諾地爾泡沫劑型,蔓迪泡沫劑與蔓迪小白瓶、精靈瓶等規格產品一同,為國內雄脫患者提供更多選擇,滿足不同人群的用藥習慣,進一步釋放蔓迪品牌的價值,擴大米諾地爾領導者的競爭優勢。
自免管線成果收獲在即
公告顯示,三生制藥研發管線擁有28項在研產品,包含血液及腫瘤科12項,自身免疫及眼科10項,腎科4項,皮膚科1項,代謝科1項。截至目前,已有12款新藥推進至臨床III期或新藥上市申請(NDA)申報階段,2款仿制藥品種處于仿制藥注冊申請(ANDA)申報的階段。
上市產品臨床價值持續擴大。2024上半年,特比澳用于治療兒童或青少年的持續性或慢性原發免疫性血小板減少癥獲CDE批準上市。此外,長效促紅素(SSS06)用于慢性腎衰竭貧血治療的III期臨床研究達到主要預設終點,公司已向國家藥監局遞交該產品新藥上市申請并獲受理。賽普汀在2024ASCO大會上發布多篇報告,為臨床應用擴展提供更多確證性數據。
自免管線研發成果即將迎來收獲。2024上半年,抗IL-17A抗體(608)治療斑塊狀銀屑病的III期臨床試驗已成功達到所有療效終點,預計將于今年完成該適應癥的生物制劑許可證(BLA)申報。用于治療急性痛風性關節炎的抗IL-1β抗體(613)、用于治療重度嗜酸性粒細胞哮喘的抗IL-5抗體(610)和治療特應性皮炎的抗IL-4Rα抗體(611)均已完成III期臨床試驗首例患者入組。此外,公司還開發具有臨床需求和創新性的新靶點和新分子,著力打造國內具有競爭力的差異化自免管線。公司分別遞交了早研項目抗BDCA2單抗626治療系統性紅斑狼瘡(SLE)和皮膚型紅斑狼瘡(CLE)適應癥的中美新藥臨床試驗申請(IND),其中中國的新藥臨床試驗申請(IND)已獲國家藥監局受理。
2024上半年,三生制藥各項對外合作持續深化拓寬。公司與合作伙伴Sobi合作推進的組合療法SEL-212用于慢性難治性痛風的三期臨床試驗已完成,Sobi已于今年7月向美國FDA申請滾動生物制劑許可證(BLA)。公司與COSMO合作產品1%濃度柯拉特龍乳膏劑(Winlevi®,研發代碼WS204)用于治療12歲以上患者面部尋常型痤瘡的III期橋接臨床試驗正在入組中。三生制藥旗下子公司三生蔓迪進軍減重領域,與深圳翰宇藥業就司美格魯肽注射液產品達成合作,該產品已在國內獲得臨床試驗批準。
未來,三生制藥將繼續聚焦腎科、血液與腫瘤、自免、毛發皮膚等優勢領域,持續踐行自主研發和對外合作雙軌并行的策略,積極發掘有潛力的創新藥合作標的,強化管線布局。公司還將憑借成熟的生物藥研發注冊、商業化生產以及銷售實力,為更多優質創新藥產品的研發上市進程以及市場價值發揮提供助力。
三生制藥董事長兼首席執行官婁競博士表示:"2024上半年,公司核心產品表現穩健,在研管線喜報頻傳,對外合作加速拓展。隨著多款新藥臨床數據讀出,其潛在治療價值逐漸展現。同時,公司核心產品的臨床應用受到更加廣泛的市場認可,不斷煥發出新的生命力。這些成績充分展現出了公司發展的強大韌勁和廣闊前景。展望未來,三生制藥將繼續發揮自身優勢,堅定不移地推動創新藥產品研發,抓住行業整合機遇和國家政策紅利,積極發掘優質合作標的,推動更多高質量創新藥產品走上市場,為建設健康中國貢獻民族生物藥企業的一份力量。"
關于三生制藥
三生制藥是一家集研發、生產和銷售為一體的生物制藥領軍企業,致力于以高品質的藥品提高患者生存質量,為人類健康造福。目前,公司擁有100余項國家發明專利授權,40余種上市產品,覆蓋腎科、腫瘤科、自身免疫性疾病、眼科及皮膚科等多種治療領域。公司擁有抗體藥物國家工程研究中心以及生物藥和化藥雙平臺的4大研發中心,共有28種在研產品,其中25種為國家新藥,并擁有符合GMP標準的5大生產基地。未來,三生制藥將繼續秉持"珍愛生命、關注生存、創造生活"的理念,全力打造全球領先的中國生物制藥企業。請訪問www.3sbio.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
本次科創板開市五周年評選聚焦新興產業領域,綜合企業自主申報信息和公開數據,從企業經營、研發、市場、知識產權等多維度評價,秉承客觀、公正的原則,表彰2023年度在科創板領域表現杰出、擁有卓越創新力的企業、機構和個人。其中,2024年科創板上市公司領軍人物TOP10的評選設置了五個維度,包括科創板上市公司市值情況、上市公司盈利能力及財務狀況、合規披露及監管機構評價、業內知名度與社會美譽度、個人資歷與能力評定等。
2020年,三生國健于科創板成功上市。4年來,在資本市場的助力與見證之下,公司秉承"讓創新抗體藥觸手可及"的企業使命,聚焦自身免疫性疾病領域,以"聚焦創新、臨床增益、合理布局、精準研發"為原則,均衡布局短、中、長期研發管線,多款自免創新藥物已進入臨床III期階段,臨床進展處于國內領先。公司擁有抗體藥物國家工程研究中心,是"免疫與炎癥全國重點實驗室"的重要依托單位之一,具備從藥物發現、臨床研究到商業化的綜合領先實力,有望實現所有自免管線產品國內第一梯隊上市的目標。憑借卓越的創新能力和高成長性,今年6月,三生國健成功入選科創100指數成分股。
公司高度重視投資者權益,堅持高質量信披,獲得監管機構和投資者的廣泛認可。2023年10月,三生國健榮獲上海證券交易所滬市上市公司信息披露工作A級評價,充分體現了上交所對公司信息披露質量的高度認可。
此外,三生國健也是科創板中最早開展ESG管理實踐,并對外披露ESG報告的上市公司之一。2023年,公司獲商道融綠 ESG A-評級,排名全部獲評企業前11.6%;獲中誠信ESG評級A級,排名全部獲評企業前10%;萬得ESG評級A級;排名行業前17%,并入選中國上市公司協會"上市公司ESG優秀實踐案例"。
三生國健董事長婁競博士表示:"熱烈祝賀科創板開市五周年。科創板的設立,對中國創新生物醫藥企業的發展具有非凡意義,其不僅提供了寶貴的融資平臺,更激發了企業的創新活力與潛力。一路走來,科創板見證了三生國健的堅持與蛻變,未來,我們將不斷提升公司治理水平,加強創新研發,堅持高質量發展、高品質生產、新型工業化建設,大力發展新質生產力,積極履行社會責任,助力資本市場健康發展,為廣大給予三生國健厚愛的投資者送上更多回報。
2024中國上市公司英華示范案例評選由中國基金報發起,旨在秉承新"國九條"精神,從長期投資、價值投資視角出發,全面客觀地評估企業的綜合實力與價值,評選出獲得機構投資者認可的上市公司。
三生制藥一直踐行ESG管理理念,致力于持續優化在環境、社會及公司治理方面的綜合表現,并不斷提升ESG績效水平,成為生物制藥行業ESG領先者。2023年,三生制藥循環用水總量達46,651.00立方米,同比上漲27.26%;有害廢棄物產生密度1.30千克/萬元,同比下降10.96%。員工人均培訓小時數20.90小時,董事會成員反貪污培訓覆蓋率100%,MSCI ESG評級穩居AA。
展望未來,三生制藥將繼續提升公司治理水平,打造有韌性的供應鏈,不斷完善環境管理體系,保障員工權益,通過開展慈善公益項目等形式提高創新藥品及醫療服務的可及性,為推動我國醫藥行業高質量發展貢獻力量。
2024中國上市公司英華示范案例評選由中國基金報發起,旨在秉承新"國九條"精神,從長期投資、價值投資視角出發,全面客觀地評估企業的綜合實力與價值,評選出獲得機構投資者認可的上市公司。
三生國健厚植ESG文化土壤,將ESG理念融入企業管理的每一個環節。公司在實現自身的合規經營與穩健增長的同時,立足"惠及中國,面向全球,為人類健康造福"的愿景,識別出自身在可持續發展領域中能夠積極貢獻并大力推動的關鍵策略,積極制定相應的方針與行動規劃。通過實際行動與持續優化,有力推動全球可持續發展目標的達成。
三生國健自登陸A股科創以來堅持披露ESG報告,并持續優化關鍵績效水平。2023年,三生國健通過環境、勞工、道德等方面評估的供應商比例達100%,女性員工占比51.71%,員工培訓覆蓋率100%,員工人均培訓時長45.2小時,污染物100%達標排放,處于行業領先水平。
核心生物藥生命力強勁,板塊收入再創新高
2023上半年,三生制藥生物藥板塊營收穩步提高,繼續保持市場領先地位。全球唯一商業化的重組人血小板生成素(rhTPO)產品特比澳銷售收入20.19億元,同比增長28.2%。該產品已于年初順利續約醫保,并被《中國臨床腫瘤學會(CSCO)腫瘤治療所致血小板減少癥診療(CTIT)指南(2022版)》列為最高級別推薦。
促紅素雙品牌益比奧和賽博爾保持市場龍頭地位,2023上半年銷售收入4.63億元,市場份額42.9%穩居第一。
用于治療類風濕性關節炎、強直性脊柱炎及銀屑病的益賽普2023上半年銷售收入3億元,同比增長25.0%。益賽普預充針劑型已于今年3月獲批上市。
用于治療HER2陽性轉移性乳腺癌的賽普汀2023上半年銷售收入1.09億元,同比增加60.5%。在《CSCO版乳腺癌診療指南(2022年版)》中,賽普汀被推薦為晚期患者一線用藥,顯著提升賽普汀在臨床覆蓋的患者數量。
拓展數字化營銷,毛發健康產品快速增長
治療雄激素性脫發和斑禿的OTC產品蔓迪繼續保持快速增長趨勢。2023蔓迪上半年銷售收入4.96億元,同比增加35.3%。米諾地爾作為科學、有效、安全、便捷的生發手段,受認可程度不斷提升,市場規模逐年擴大。作為米諾地爾龍頭品牌,蔓迪在醫療機構市占率70%,穩居米諾地爾市場第一。2023年上半年,蔓迪持續推進患者教育,拓展數字化營銷,與頭部平臺深度合作的同時切入新媒體運營平臺,擴展電商營銷渠道,上半年電商領域銷售增速達到64%,充分發揮OTC產品的市場潛力。
CDMO加快成長步伐
2023年上半年,三生制藥CDMO業務進一步增長,板塊收入約9500萬元,同比增長71.6%,海外基地收入同比增長29%,國內基地收入同比增長246%。目前集團CDMO業務合計已簽訂的在手訂單金額約1.6億元,聚焦商業化品種的CDMO差異化定位體現出良好效果。
臨床加速推進,管線價值持續提升
2023上半年,集團擁有30項在研產品,包含血液/腫瘤科10項,自身免疫及眼科13項,腎科5項,皮膚毛發領域2項。截至目前,已有10款新藥推進至臨床III期或NDA申報階段,5款仿制藥品種處于BE及ANDA申報的階段。
2023上半年,三生制藥兩款重要產品獲批上市:益賽普預充針劑型為患者提供了更加便利的治療選擇,顯著提高使用環節的便利性;鹽酸納呋拉啡口腔崩解片麗美治®是國內第一款上市的針對血液透析患者瘙癢的藥物,同時該產品用于改善慢性肝病患者瘙癢癥(僅限現有治療療效不理想的情況)的III期臨床試驗申請已獲批準,有望覆蓋更大規模的患者人群;SSS06是公司自主研發的長效重組人促紅細胞生成素,II期臨床顯示在延長給藥間隔至2周的同時保證了良好的安全性,目前III期臨床已完成最后的患者出組,預計即將于下半年獲得研究報告,進行上市申報準備。
以子公司三生國健為平臺的多款自免產品研發提示,上半年達成多項里程碑事件。目前,用于治療斑塊狀銀屑病的抗IL-17A抗體(608)治療斑塊狀銀屑病的三期臨床入組已完成;用于治療急性痛風性關節炎的抗IL-1β抗體(613)和治療特應性皮炎、慢性鼻竇炎伴鼻息肉和中重度慢性阻塞性肺氣腫的IL-4Rα抗體(611)II期臨床成功達到主要終點;用于治療哮喘的抗IL-5抗體(610)已完成重度嗜酸性粒細胞哮喘的II期臨床的患者入組。公司創新產品的商業化大潮已至,預計未來每年都將有重磅管線產品推進至商業化階段。
此外,公司與Cosmo合作的克拉考特酮乳膏Winlevi®用于痤瘡適應癥的橋接臨床申報工作正在積極推進中,作為FDA 40年來批準的首個新機制痤瘡用藥,Winlevi®在美國獲得皮膚科醫生的廣泛認可,自2021年12月上市以來有1.5萬名醫生開具超過67萬張處方,已成為美國處方量最大的痤瘡治療用藥,有望在三生制藥的推動下,成為中國大陸首款上市的針對尋常痤瘡治療的AR拮抗劑,為國內數以億計的痤瘡患者帶來新的治療選擇。
展望三生制藥未來的研發方向,公司一方面將繼續聚焦腎科、自身免疫、血液、腫瘤及毛發皮膚等優勢領域,另一方面將著眼全球,推進優質產品的合作開發。公司將堅持自主研發和對外合作雙軌并行,全力推進具有臨床真需求,真價值的藥品盡早上市。
三生制藥董事長兼首席執行官婁競博士表示:"2023年,在'讓創新生物藥觸手可及'的使命驅動之下,三生制藥已進入了成立的第30年。當前公司各項業務蓬勃發展,業績保持平穩增長的良好勢頭。不忘初心,方得始終。未來我們將堅持聚焦重點領域的探索創新,積極推動公司各業務線發展,持續踐行企業社會責任,促進更多創新生物藥產品走上市場,為患者造福。"
關于三生制藥
三生制藥是一家集研發、生產和銷售為一體的生物制藥領軍企業,致力于以高品質的藥品提高患者生存質量,為人類健康造福。目前,公司擁有100余項國家發明專利授權,40余種上市產品,覆蓋腎科、腫瘤科、自身免疫性疾病、眼科及皮膚科等多種治療領域。公司擁有抗體藥物國家工程研究中心以及生物藥和化藥雙平臺的4大研發中心,共有30種在研產品,其中25種為國家新藥,并擁有符合GMP標準的5大生產基地。未來,三生制藥將繼續秉持"珍愛生命、關注生存、創造生活"的理念,全力打造全球領先的中國生物制藥企業。請訪問www.3sbio.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥,我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
上半年,三生國健在業務運營及在研產品開發方面取得諸多重大進展:益賽普穩定增長,預充針劑型獲批上市;賽普汀三項重磅研究入選ASCO年會,同時2022年獲CSCO指南HER2+乳腺癌晚期一線I級推薦,與曲妥珠單抗具有相同治療地位;研發管線進一步聚焦,核心在研產品臨床試驗快速推進;CDMO客戶范圍不斷擴大,收入大幅增長。
上市產品持續增長,市場地位穩固
2023年上半年度,隨著診療需求逐步恢復,益賽普實現銷售收入3億元,同比增長24.98%。益賽普在國內上市已逾18年,藥物療效與安全性相較于其他同類產品在國內市場得到了更加廣泛的臨床驗證與認可,在臨床運用中具備較強的品牌效應。3月,益賽普預充針劑型獲批上市,增加了患者使用的便捷性。
賽普汀加快醫院覆蓋,積極推進HER2陽性晚期乳腺癌的一線治療地位,取得積極成果。1-6月,賽普汀實現銷售收入1.09億元,同比增加60.46%,惠及更多患者。在2023年美國臨床腫瘤學會(ASCO)年會中,賽普汀三項重要臨床研究成功入選。在2022年CSCO乳腺癌指南中,伊尼妥單抗成為HER2+乳腺癌晚期一線治療I級推薦,與曲妥珠單抗具有相同治療地位。
健尼哌收入同比增長34.27%。作為目前國內唯一獲批上市的人源化抗CD25單抗,健尼哌具有免疫原性更低的特點,可用于預防腎移植引起的急性排斥反應,與常規免疫抑制方案聯用,能顯著提高移植器官存活率,改善患者生存質量。
打造國內最具競爭力的自免管線
上半年,三生國健持續貫徹聚焦自免的戰略方向。1-6月,三生國健研發投入達1.65億元,同比增長11.6%,占營收比重達34.56%。
在聚焦自免戰略的推進下,公司自免管線研發進展迅速,取得多項重要成果:
2023年3月:①益賽普預充針獲批上市;②伊尼妥單抗用于HER2陽性乳腺癌新輔助治療II期臨床試驗完成首例患者入組;③抗IL-4Rα人源化單克隆抗體(611)治療中重度特應性皮炎II期臨床試驗完成全部患者入組。
2023年4月:①重組抗IL-4Rα人源化單克隆抗體注射液(611)用于治療慢性鼻竇炎伴鼻息肉獲NMPA批準進入臨床;②抗IL-17A人源化單克隆抗體(608)治療中重度斑塊狀銀屑病III期臨床試驗完成全部受試者入組。
2023年7月:①抗IL-5人源化單抗(610)治療嗜酸性粒細胞增高的重度哮喘II期臨床試驗完成全部受試者入組;②重組抗IL-1β人源化單克隆抗體注射液(613)治療急性痛風性關節炎的II期臨床試驗達到主要終點;③重組抗IL-4Rα人源化單克隆抗體注射液(611)用于治療慢性鼻竇炎伴鼻息肉完成首例患者入組;④抗IL-33人源化單抗(621)用于治療COPD獲FDA批準進入臨床;⑤重組抗IL-4Rα人源化單克隆抗體注射液(611)用于治療COPD的II期IND申請獲得受理。⑥抗IL-33人源化單抗(621)用于治療COPD獲FDA批準進入臨床;
2023年8月:①重組抗IL-4Rα人源化單克隆抗體注射液(611)用于治療中重度特應性皮炎II期臨床試驗達到主要臨床終點。②抗IL-33人源化單抗(621)用于治療COPD的IND申請獲得受理。
截至目前三生國健研發管線如下:
CDMO深度挖潛獲業內充分認可
上半年,三生國健CDMO業務穩步推進,客戶范圍不斷擴大,同比增長191.69%。
公司CDMO業務以晟國醫藥為獨立平臺,覆蓋生物藥物發現、開發、生產、注冊全流程,利用卓越的生物藥研發和生產技術平臺,已為客戶提供了從分子構建至超大規模原液生產、制劑開發、制劑生產等高效、高質量、個性化的精準服務,并利用具有自主知識產權的培養基和填料,切實為客戶產品提高成本優勢。
未來,晟國醫藥將積極擴大業務接洽范圍,全方位接觸長三角以外的優質客戶,包括小型的創新生物藥企業,同時為新興和規模化的生物藥企業提供CDMO服務,深挖共同成長的潛能,充分發揮國健生產基地的商業化經驗優勢,拓展CDMO市場,打造一流的生物藥研發生產平臺。
三生國健董事長婁競博士表示,"2023年上半年,生物醫藥行業同質化內卷逐步出清,醫藥產業迎來新周期,真正具有創新能力和資源整合能力的企業會逐漸脫穎而出。中國自身免疫生物藥品市場空間巨大,已上市產品近年來開始快速放量,但種類有限,市場仍有許多未滿足的需求。三生國健聚焦于自身免疫性疾病領域,基于自身資源和能力體系持續不斷進行有臨床價值的創新。同時。公司還具有成熟的商業化體系,未來將繼續進行差異化競爭,不斷提升經營效率,早日推進藥品上市,為患者帶去更多選擇。"
關于三生國健
三生國健是中國首批專注于創新型抗體藥物研究并持續積極創新,擁有研、產、銷一體化成熟平臺,專注于單抗、雙抗、多抗及多功能重組蛋白等新技術研究。公司擁有豐富的大規模抗體產業化和質量控制經驗,并多維度布局CDMO業務,鞏固和增強創新型治療藥物企業的領導地位。目前,公司擁有12個處于不同開發階段的在研創新藥物,其中大部分在研藥物為治療用生物制品1類,部分在研藥物為中美雙報。請訪問www.3s-guojian.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
上海2023年3月31日 /美通社/ -- 中國抗體先行者三生國健(證券代碼:688336.SH)宣布,益賽普® (重組人II型腫瘤壞死因子受體-抗體融合蛋白注射液)預充針劑型今日正式獲得國家藥品監督管理局(NMPA)的上市批準,適應癥為:(1)中度及重度活動性類風濕關節炎(2)18歲及18歲以上成人中度及重度斑塊狀銀屑病(3)活動性強直性脊柱炎。
益賽普®預充針劑型將注射藥品直接灌裝在注射器中,無需經過配液復溶,可直接注射使用,有效提高了注射效率,使患者用藥更加便捷。同時,益賽普®預充針劑型進一步改進了生產工藝,較同類產品雜質含量更低,提升了藥品的有效性及安全性。
作為“863”計劃中生物技術領域第一個產業化的全人源抗體類藥物,18年前,益賽普®開啟了中國風濕免疫治療的生物制劑時代。臨床實踐表明,益賽普®起效快,免疫原性弱,不容易產生抗藥物抗體,已被證明可以長期維持患者ACR應答率。同時,融合蛋白不會誘導單核細胞凋亡,在抵抗結核等感染方面具有優勢,且不增加心血管、惡性腫瘤和嚴重感染的風險,較其他TNF抑制劑更能實現“精準抗炎”,獲得了國內外指南的一致推薦。
我國有近2000萬類風濕關節炎、強直性脊柱炎和銀屑病患者。經過十余年的不斷努力,生物制劑被逐步廣泛應用,但總體滲透率與歐美發達國家相比還有差距。對此,益賽普®不斷致力于提升藥物的可及性,減輕患者的經濟負擔,讓更多患者享受到更好的治療,此次預充針劑型的上市,將進一步幫助患者提升依從性,從而獲得更好的療效。
三生國健董事長婁競博士表示:“非常高興看到,益賽普®在18歲‘成年’之際迎來了預充針劑型的上市,這是益賽普®助力中國風濕免疫疾病診療發展的一項重要的里程碑。18年來,益賽普®扎根風濕領域,從治療到預防、從控制到康復,已惠及國內50余萬風濕患者。未來,我們將繼續與學科共成長,逐未來,共同探索更優的風濕慢病管理解決方案,為患者帶來更好的產品,幫助患者管理疾病,重獲健康,享受美好生活!”
關于三生國健
三生國健是中國首批專注于創新型抗體藥物研究并持續積極創新,擁有研、產、銷一體化成熟平臺,專注于單抗、雙抗、多抗及多功能重組蛋白等新技術研究。公司擁有超過18年大規模抗體產業化和質量控制經驗,并多維度布局CDMO業務,鞏固和增強創新型治療藥物企業的領導地位。目前,公司擁有13個處于不同開發階段的在研創新藥物,其中大部分在研藥物為治療用生物制品1類,部分在研藥物為中美雙報。請訪問www.3s-guojian.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
上海2023年3月22日 /美通社/ -- 今日,中國抗體藥物先行者三生國健(證券代碼:688336)公布2022年度報告。截止2022年12月31日,公司實現營業收入8.25億元,歸屬于上市公司股東的凈利潤4930萬元,同比增加173%;經營性現金流量凈額達2.33億元,年末資金存量25.8億元,資金儲備充裕,將有效支持公司未來長期穩健發展。
三生國健董事長婁競博士表示,"三生國健在2022年扛住了來自社會和行業的雙重壓力,應對有度,取得了多項重要的成果。作為中國最早的創新藥企之一,我們有幸見證了創新藥在國內從不聞于世到眾星捧月,也經歷了行業從無序生長到有序發展。我們堅信,未來具有研產銷一體化能力的創新藥企將具有更大的發展空間。三生國健將繼續進行差異化競爭,聚焦自免這一優勢領域,快速推進臨床,做好短期經營與長期創新上的平衡,不斷提升企業研發、管理效率,為患者、醫生、股東帶去更大的回報。"
商業化能力優勢凸顯,CDMO業務初見成效
2022年,面對充滿挑戰的外部環境,三生國健發揮商業化能力優勢,創新藥品銷售收入保持穩定,CDMO業務初見成效。
益賽普的療效與安全性繼續在國內得到醫生與患者的廣泛認可。作為一款在國內已上市18年的經典藥品,相較于其他同類產品,益賽普在臨床運用中已具備較強的品牌效應。2022 年,因大環境影響,國內患者的就診率有所下降,對于以門診處方為主的慢病治療藥物造成不利影響。對此,益賽普依靠專業的營銷團隊與完整的銷售體系,通過多年的學術推廣積累與廣泛的終端銷售覆蓋,將益賽普在國內TNF-α市場的份額穩定在27%。
賽普汀全力推進醫院覆蓋,積極推進一線用藥,2022年銷售收入同比增長138%,覆蓋的醫院終端數量超過1300家,較去年同期增加710家,并于年底成功續約國家醫保,報銷標準解除與長春瑞濱聯合使用的限制,不限化療方案用于晚期乳腺癌治療。同時,賽普汀臨床方面再添新證:多項臨床試驗分別入選ASCO和SABCS等國際頂尖學術盛會,HOPES研究亞組結果榮登《TBCR》雜志。在2022年的CSCO乳腺癌診療指南中,賽普汀繼續保持HER2+晚期乳腺癌H敏感患者抗HER2治療的I級推薦用藥地位。
健尼哌業務持續增長,2022年收入同比增長45%。健尼哌是目前國內唯一獲批上市的人源化抗CD25單抗,可用于預防腎移植引起的急性排斥反應,免疫原性更低且安全性更高,與常規免疫抑制方案聯用,能顯著提高移植器官存活率,改善患者生存質量。
CDMO業務成為公司業務的重要補充和新增長點,2022年實現銷售收入1億元,同比增長160%。晟國醫藥作為公司CDMO業務的載體,擁有卓越的生物藥研發和生產技術平臺,可進行各種類型的藥物開發,為客戶提供從DNA到IND再到NDA的全流程一站式服務。自2021年底對外推出以來,晟國醫藥的品牌被客戶逐漸認可和熟知。2022年6月,晟國醫藥上海張江基地憑借抗體藥物研發平臺和200L-5000L的產業化能力,助力客戶上海津曼特順利提交新藥NDA申請,展現了高度的專業性和強大的平臺綜合實力。
重點臨床項目進展迅速,自免管線劍指國內第一梯隊
2022年,公司持續貫徹聚焦自免的戰略方向,持續進行優化,提升研發效率,通過多種方式進一步完善、均衡公司長、中、短管線布局,全年研發投入合計3.30億元。公司臨床團隊克服多重困難,通過多種方式保障核心自免臨床試驗順利推進,基本達成全年臨床進展目標:608項目II期數據讀出,達到臨床終點,并啟動III期臨床;610、611、613項目均完成II期啟動和首例受試者入組,其中截至年報發布日,611和613的II期臨床已經完成全部受試者的入組。當前,公司自免項目的臨床進展均處于同類國內產品前列,公司將持續加快臨床進度,力爭實現所有自免管線產品國內第一梯隊上市的目標。
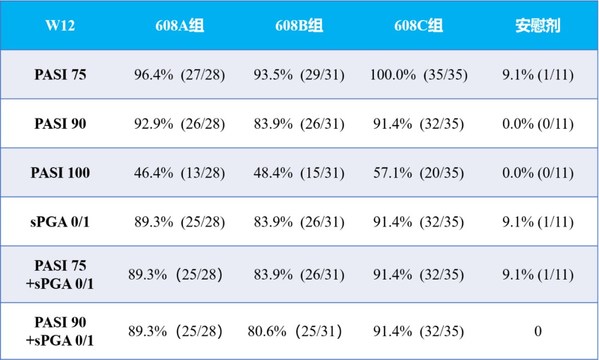
公司自主研發的抗IL-17A單抗608在用于治療中重度斑塊狀銀屑病患者的II期臨床試驗中顯示出潛在同類更優的療效。在12周誘導治療期,608三個劑量組分別可使89.3%、80.6%、91.4%的受試者同時實現PASI 90和sPGA 0/1,46.4%、48.4%和57.1%的患者可實現皮損完全清除(PASI 100),而安慰劑組則無應答(0)。研究顯示,608藥物起效快,首次給藥后2~4周開始起效,持續至整個治療周期,且安全性良好可控。
注:T=試驗藥物,P=安慰劑組 |
608 A組代表:160mg LD(loading dose)+80mg Q2W,608 B組代表:160mg Q2W;608 C組代表:160mg Q4W |
PASI75, PASI90,PASI100分別定義為PASI較基線改善≥75%,≥90%和≥100% |
sPGA 0/1定義為sPGA為0分或1分,且較基線降低≥2分;sPGA 0定義為銀屑病皮損完全消退 |
目前,三生國健研發管線中共有13個產品,其中國內涉及17個臨床研發項目,包括1個臨床前研發項目;1個項目在申報IND;4個項目進入臨床I期;7個項目進入臨床II期,3個項目進入臨床III期,1個項目已申報NDA。
公司部分處于臨床階段產品2022年主要研發進展如下:
- 重組人II型腫瘤壞死因子受體-抗體融合蛋白注射液("301S"):NDA審評中(截至目前,評審工作已經全部完成)。
- 抗IL-17A人源化單克隆抗體("608"):獲得中重度斑塊狀銀屑病II期臨床核心數據;獲得中重度斑塊狀銀屑病臨床III期臨床方案CDE的審批意見;獲得組長單位倫理審批通過意見,并完成了首家中心的啟動。
- 抗IL-5人源化單克隆抗體注射液("610"):完成重度嗜酸性粒細胞哮喘患者的臨床Ib期研究入組;完成重度嗜酸性粒細胞哮喘患者的臨床II期研究啟動和首例受試者入組。
- 抗IL-4Rα人源化單克隆抗體藥物("611"):完成在中重度特應性皮炎患者臨床Ib期入組;完成在中重度特應性皮炎患者臨床II期首例受試者入組;重新提交慢性鼻竇炎伴鼻息肉適應癥的IND申請。
- 抗IL-1β人源化單克隆抗體注射液("613"):完成在急性痛風性關節炎患者臨床Ib期研究所有受試者的入組;完成在該適應癥的臨床II期研究的首例受試者入組。
- 抗IL-33人源化單克隆抗體注射液("621"):Pre-IND申報準備。
License-out喜迎重要突破 ESG成果同業領跑
2022年,三生國健進一步加強國際合作,自有產品 License-out 實現突破。1 月,將研發品種 609A(抗 PD-1 人源化單克隆抗體注射液)用于腫瘤免疫聯合療法 syncrovax?的全球權益授權給美國 Syncromune 公司。6 月,公司與成都西嶺源藥業有限公司全資子公司成都科嶺源醫藥技術有限公司簽署許可合作協議,將賽普汀抗體序列用于抗體偶聯藥物(ADC)開發和商業化的全球權益授權給科嶺源,公司將有望獲得包括首付款、研發里程碑付款及銷售里程碑付款以及未來產品上市后的銷售分成。
此外,三生國健高度重視ESG,秉承"珍愛生命、關注生存、創造生活"的理念,致力于成為健康產業的長期開拓者、抗體藥物的可靠提供者、社會價值的穩定創造者、綠色力量的長期行動者,構建環境保護、社會責任與公司治理的閉環管理體系。公司在最新一期商道融綠 ESG 評級中獲評A-,排名所有A股公司的前 6.1%,在最新CDP評級中獲評B,處于參評企業前列。
公司繼續積極踐行 "讓創新抗體藥觸手可及" 的企業使命,扎實推進"強直性脊柱炎健康鄉村項目"。截止去年末,該項目已在全國23個省實施,大批省市醫療專家深入一線,幫助縣級醫院開展救治工作,2022年新增篩查1715人、救治3161人,累計篩查12,499人,救治8,666人,開展培訓和義診活動601場,培訓醫護人員22,521人,鞏固健康扶貧成果,有效銜接鄉村振興,幫助眾多基層患者減輕病痛,回歸正常生活。
展望未來 產品組合峰值超百億 研產銷一體奮進新征程
展望未來,經濟復蘇、重拾信心已成為全社會的共識,隨著國內生物醫藥產業在經歷同質化內卷后逐步出清,真正具有創新能力和資源整合能力的企業將在藥物創新、商業化表現等方面全面體現出優勢。同時,創新藥的支付環境迎來邊際改善,更有利于具有較高臨床價值的藥品取得更好的市場表現。三生國健戰略聚焦自免領域,展望2025年會有近百億峰值自有自免產品儲備,同時公司多平臺發力,多維度增長,將依托研產銷一體化的綜合優勢,邁上發展的新臺階。
2023年,益賽普仍將渠道下沉作為重要方向,著眼于地、縣級市場擴大覆蓋面,同時加大益賽普在中醫科室的推廣力度,通過重磅循證醫學證據開拓市場。益賽普預充針劑型評審工作已經全部完成,將進一步改善患者的依從性,相對同類產品形成差異化競爭優勢。賽普汀銷量預計將保持良好的增長勢頭,隨著循證的不斷增加,賽普汀將進一步鞏固全程抗HER2治療基礎藥物的地位。
同時,公司將以臨床需求為導向,加快推進臨床速度,提升研發投入效率,遵從"聚焦創新、臨床增益、合理布局、精準研發"的原則,合理分配研發資源,實現長、中、短管線均衡發展。2023年,公司預計將有多個核心項目取得重要臨床進展:608項目預計將在下半年獲得III期臨床主要終點數據;611項目預計將取得青少年與兒童中重度特異性皮炎兩個適應癥,及慢性鼻竇炎及鼻息肉適應癥的IND批件,AD適應癥將在下半年獲得II期主要終點結果;610項目預計將在下半年完成II期入組;613項目預計將在下半年取得II期數據結果。
此外,晟國醫藥在建總部園項目預計將于2023年正式驗收使用。晟國總部園布局了三條500L、1000L原液產線,和一條多規格高速制劑生產線,建設完成后,將快速補充公司緊缺的中小規模產線,加固產業鏈中薄弱環節,加快生物制品放大和產業化進度。同時,晟國醫藥將積極擴大業務接洽范圍,全方位接觸長三角以外的優質客戶,包括小型的創新生物藥企業,為新興的和規模化的生物藥企業提供CDMO服務,充分發揮國健生產基地的商業化經驗優勢,打造一流的生物藥研發生產平臺。
關于三生國健
三生國健是中國首批專注于創新型抗體藥物研究并持續積極創新,擁有研、產、銷一體化成熟平臺,專注于單抗、雙抗、多抗及多功能重組蛋白等新技術研究。公司擁有超過18年大規模抗體產業化和質量控制經驗,并多維度布局CDMO業務,鞏固和增強創新型治療藥物企業的領導地位。目前,公司擁有13個處于不同開發階段的在研創新藥物,其中大部分在研藥物為治療用生物制品1類,部分在研藥物為中美雙報。請訪問www.3s-guojian.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
香港2023年3月22日 /美通社/ -- 今天,中國領先的生物制藥公司三生制藥(01530.HK)公布了2022年年度業績。2022年,三生制藥核心生物藥產品增長強勁,毛發健康產品增速亮眼,CDMO業務展露潛力,新藥商業化大潮將至,產品出海及優質品種引進加快。2022年,三生制藥共實現營業收入人民幣約68.59億元,比去年同期增長7.5%;毛利約人民幣56.72億元,比去年同期增長7.5%;正常化EBITDA人民幣約27.96億元,比去年同期增長27.7%;正常化歸母凈利潤人民幣約21.63億元,比去年同期增長25.2%。穩健的業績增長支撐可持續的分紅派息政策,根據董事會決議,三生制藥每股派息0.1元港幣。今年是三生制藥成立30周年,一路走來,除了穩健的業績增長外,公司還堅持履行企業社會責任,不斷精進ESG管理。2022年,三生制藥MSCI(明晟)ESG評級從A躍升至AA級,超越全球88%生物科技公司。未來,三生制藥將進一步擴大其研發、生產、銷售和對外合作的一體化綜合平臺優勢,鞏固和提升生物制藥龍頭企業地位。
核心生物藥產品增長強勁
公司核心產品特比澳、益賽普、益比奧和賽博爾、蔓迪在2022年繼續保持中國市場的領導地位,賽普汀提升顯著。IQVIA數據顯示:用于治療血小板減少癥的特比澳作為當今全球唯一商業化的重組人血小板生成素(rhTPO)產品,2022年銷售收入33.97億元,同比增長10.3%。2022年,特比澳順利續約醫保目錄,被《中國臨床腫瘤學會(CSCO)腫瘤治療所致血小板減少癥診療(CTIT)指南(2022版)》列為最高級別推薦。作為重組人促紅素市場20年的龍頭,益比奧和賽博爾保持領先地位,2022年銷售收入11.29億元,市場份額為44.5%,穩居主導地位。用于治療類風濕性關節炎、強直性脊柱炎及銀屑病的益賽普銷售收入5.12億元。其安全性和有效性已經過中國市場18年的驗證。相比歐美發達國家,中國內地風濕疾病生物制劑滲透率還處于較低水平,該產品未來仍具備廣闊增長潛力。用于治療HER2陽性的轉移性乳腺癌的賽普汀銷售收入1.59億元,同比增加138.1%,銷售覆蓋醫院及患者數量較2021年有顯著增長。2022年順利續約醫保并解除與長春瑞濱聯用的報銷限制,被《中國臨床腫瘤學會(CSCO)乳腺癌診療指南(2022年版)》列為HER2陽性晚期乳腺癌患者的最高級別I級推薦的治療選擇。
毛發健康產品增速亮眼
公司毛發健康領域增速亮眼。重點產品蔓迪(通用名為米諾地爾酊)2022年銷售收入8.91億元,同比增長48.1%。其中,零售藥店收入同比增長65%,電商渠道收入同比增長58%,繼續保持高速增長勢頭,帶動蔓迪品牌滲透率持續提升。作為科學有效的生發治療藥物,在《中國人雄激素性脫發診療指南》和《女性雄激素性脫發診斷與治療中國專家共識(2022版)》中,蔓迪(5%米諾地爾)均獲得最高推薦等級。三生制藥將致力于加大蔓迪品牌在脫發人群中的教育,提升藥品治療在脫發治療環節中的應用周期。未來隨著教育的深入,將促進該產品滲透率提高,從而使其市場空間得到進一步擴大。
CDMO業務展露潛力
公司CDMO業務取得顯著進展。2022年三生制藥共完成CDMO業務客戶訂單1.66億元,同比增長49.6%,首年運營成果顯著。CDMO業務已簽訂的客戶訂單超過1億元,合作客戶包括國內外知名藥企和生物科技公司,服務內容涵蓋藥品臨床前到商業化的各個環節。三生制藥CDMO業務具備多方面競爭優勢,包括多年來生物藥產品研發-生產全流程技術優勢;單體萬升生物反應器對商業化生產的規模化成本優勢;培養基和層析填料等原料自產能力帶來的生產成本優勢等。三生制藥將著眼于提供國產自主可控、高性價比的生物藥CDMO服務,加速客戶優質新藥上市,推動自身CDMO業務的發展。
厚積薄發,新藥商業化大潮將至
2022年,三生制藥研發成本約6.93億元。三生制藥有31項在研產品,其中26種創新藥物,涵蓋腫瘤科7項、自身免疫性疾病及其他疾病13項、腎科9項、皮膚科2項。其中,自免領域管線包括抗IL-4Rα抗體、抗IL-5抗體,抗IL-1β抗體及抗IL-17A抗體等臨床進度處于國內第一梯隊的產品。
在研產品中包含多個即將上市的重量級產品。其中包括三款核心產品的新劑型、新適應癥上市申請已獲受理:抗TNF-α預充式益賽普水針劑(301S),打破了粉針劑型的使用限制,能夠為數十萬醫患提供用藥便利,極大地提高患者依從性;米諾地爾泡沫劑型(MN709)作為國內獨家的米諾地爾泡沫劑型,為頭皮敏感的患者提供更多選擇;特比澳兒童ITP適應癥的III期臨床研究達到預設的主要終點,將更好地滿足兒童ITP患者的治療需求。此外,外部引進品種也即將迎來收獲期:鹽酸納呋拉啡口腔崩解片(TRK820)用于治療維持性血液透析患者難治性瘙癢癥的NDA申請已獲受理,有望填補國內透析瘙癢領域的治療空白,為數百萬腎病及肝病患者帶來顯著的臨床獲益。
三生制藥將繼續聚焦腎科、自免、毛發皮膚、腫瘤等四大優勢領域,加速推進處于國內研發進度領先地位的品種,并且全力推進具備極大市場潛力、覆蓋海量患者人群的Remitch肝病瘙癢適應癥、克拉考特酮乳膏痤瘡適應癥的橋接臨床試驗。8個品種預期2023年上市,未來3年預計提交10多個產品的上市申請,迎來新藥上市熱潮。
加快產品出海及優質品種引進
2022年,三生制藥對外合作的步伐繼續加快,引進國際優質產品的同時大力推動自身在研產品出海,包括:授權美國Syncromune公司將609A(抗PD-1人源化單克隆抗體注射液)用于其腫瘤免疫療法的Syncrovax?的全球開發及商業化;與科嶺源簽署合作協議,將賽普汀®(伊尼妥單抗)抗體序列用于抗體偶聯藥物(ADC)開發和商業化的全球權益授權給科嶺源;與Cosmo Pharmaceuticals N.V. 簽訂合作協議,獲得其子公司Cassiopea旗下用于治療痤瘡適應癥的全球首款外用雄激素受體抑制劑Winlevi®在大中華區開發和商業化的獨家權利。今后,三生制藥還將持續選擇性地尋找并購及合作機會,以豐富現有產品組合,為未來增長儲備后繼力量。
三生制藥董事長兼首席執行官婁競博士表示:"三生制藥成立30年來,集團業績再創新高,新藥研發持續推進,四大業務領域齊頭并進,共同賦能公司未來可持續發展。在未來,三生制藥將更加聚焦精細化管理,全力推進各業務條線健康發展和新藥研發的落地,始終履行社會責任,以高質量、高標準的藥品惠及更多患者。"
關于三生制藥
三生制藥是一家集研發、生產和銷售為一體的生物制藥領軍企業,致力于以高品質的藥品提高患者生存質量,為人類健康造福。目前,公司擁有100余項國家發明專利授權,30余種上市產品,覆蓋腎科、腫瘤科、自身免疫性疾病、眼科及皮膚科等多種治療領域。公司擁有抗體藥物國家工程研究中心以及生物藥和化藥雙平臺的4大研發中心,共有31種在研產品,其中26種為國家新藥,并擁有符合GMP標準的5大生產基地。未來,三生制藥將繼續秉持"珍愛生命、關注生存、創造生活"的理念,全力打造全球領先的中國生物制藥企業。請訪問www.3sbio.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
- 靶點簡介
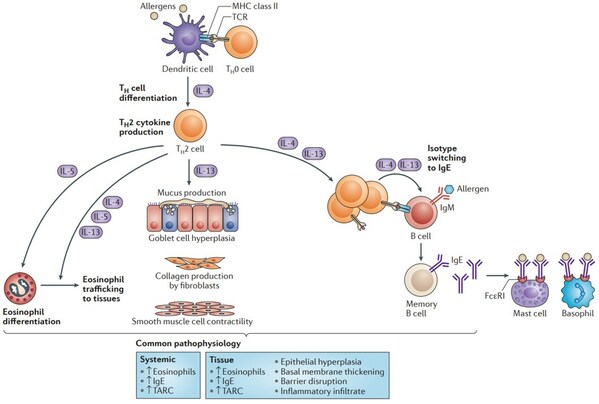
在過敏性疾病的發病機理中,Th2扮演關鍵角色,在Th2細胞介導的2型免疫反應中,可見IL-4/13處于中樞位置(見圖1),IL-4Rα是IL-4與IL-13受體的共同亞基,也是目前開發最為火熱的靶點之一。
IL-4是1980年代發現的一種細胞因子,由于翻譯后修飾的不規則模式,特別是糖基化,其分子量在12至20KDa之間變化。其分子結構具有球狀疏水核心,由三個二硫鍵和四個α-螺旋連接在一起,呈左旋束狀。IL-4Rα作為其受體由兩個纖連蛋白結構域(fnIII)連接,每個結構域由六個β片組成,紅色的環區域表示IL-4配體結合的區域。
IL-4主要由活化的CD4+T細胞產生,但它也由NKT細胞、巨噬細胞、嗜酸性粒細胞、嗜堿性粒細胞、肥大細胞和2型先天性淋巴細胞(ILC2)產生。IL-4可以誘導初始CD4+T細胞分化成Th2細胞,進而產生更多細胞因子,啟動2型炎癥反應,此外,IL-4和IL-13還共同誘導分化后的嗜酸性粒細胞向炎癥部位移動、誘導B細胞中IgM同種型轉換為IgE以啟動IgE/FcεRI通路。而且,IL-4及IL-13還可誘導巨噬細胞替代性活化,在誘導粘液產生、杯狀細胞產生、平滑肌收縮及誘導肥大細胞增多癥方面也有多種作用。總的來說,IL-4可以作用于廣泛的靶細胞,包括巨噬細胞、造血前體細胞、基質細胞、NK細胞和成纖維細胞以及未列出的其他細胞。
IL-4的這些生物學活性均通過與位于靶細胞膜上的特異性受體IL-4R結合來發揮。IL-4R由802氨基酸殘基組成,分子量為140kDa,屬于紅細胞生成素受體超家族成員。存在兩種IL-4R類型,每一種都由兩個蛋白質亞基組成,這些亞基在IL4與IL4Rα亞基結合時形成異二聚體。其中I型IL-4受體由IL-4Rα亞基和γc亞基組成,II型IL-4受體由IL-4Rα和IL-13Rα1組成。I型受體主要在造血細胞中表達,幾乎是T細胞、嗜堿性粒細胞、肥大細胞和小鼠B細胞中唯一的IL-4受體。相比之下,II型受體的表達僅限于非造血細胞,其不表達常見的γc亞基。IL-4Rα、γc和IL-13Rα1的差異表達決定了每種細胞對IL-4和IL-13的敏感性。
- 信號通路
IL-4能夠與兩種受體結合,與I型IL-4R結合激活JAK1和JAK3,而JAK1和TYK2是通過II型IL-4R參與。I型受體僅與IL-4結合,而II型受體同時與IL-4和IL-13結合。IL-4Rα細胞質結構域的磷酸化導致信號傳導和轉錄因子Stat6的募集和磷酸化;因此,IL-4的大部分功能是通過Stat6執行的。IL-4Rα作為2型炎癥通路中I型受體和II型受體的關鍵組成部分,阻斷IL-4Rα可同時阻斷兩個2型免疫反應的強效調節因子——IL-4和IL-13,通過I型受體和II型受體發揮作用,阻斷Th2炎癥的中樞通路,實現"雙靶點"的作用機制。
- IL-4/IL-4R適應癥
通過分析Th2通路中相關靶點代表性藥物的主要獲批的適應癥布局,目前IL-4Rα的適應癥譜最為廣闊,涵蓋了多種過敏性疾病:
除了目前已獲批的適應癥外,Dupilumab還在開發慢性阻塞性肺病(COPD)、大皰性類天皰瘡(BP)等適應癥,另外大量研究和文獻也表明IL-4/IL-4R在其他疾病中也發揮重要作用。
實體瘤中:現有研究已經通過幾種疾病研究了IL-4與腫瘤進展之間的關系,除了癌癥患者中IL-4的表達增強外,各種癌細胞中IL-4受體的數量也有所增加,而正常細胞IL-4R的數量要少得多。在乳腺癌、膀胱癌等組織切片上也觀察到大量IL-4R表達。Sachin puri等人在腦膜瘤方面的研究表明,大多數人腦膜瘤大量顯示IL-4受體,并且證明了大多數腦膜瘤顯示II型IL-4受體而不是I型,通過多項研究證實,惡性腦腫瘤細胞系和高級別腦腫瘤標本表達的IL-4R較正常腦腫瘤細胞系增強。
B細胞慢性淋巴細胞白血病(B-CLL)中:多項研究表明,CLL患者的B和T細胞及其培養物中含有高水平的IL-4。IL-4由共刺激T細胞或CLL B細胞合成。T細胞合成的IL-4對腫瘤B細胞的體外進展和生長有重要意義。此外,IL-4、IFN-γ和IFN-α等因子刺激白血病細胞的生存能力、存活和凋亡抑制。
艾滋病毒感染中:IL-4也可以在HIV感染和疾病進展中發揮作用。它啟動HIV共受體表達,即CXCR-4和DC-SIGN,并刺激HIV執行,從而加速疾病發病。向Th2反應的轉變在艾滋病的發病機制中具有重要意義,與此同時,Th0狀態或細胞因子產生的非典型系統也被揭示。通過細胞內染色和原位雜交,在HIV-1感染患者的Th2表型T細胞克隆中檢測到IL-4的產生增強。此外,一項研究探索了感染兒童淋巴結中IL-4水平高時病毒復制增加。
炎癥性關節炎中:炎癥性關節炎構成一組以滑膜關節炎癥以及全身表現為特征的各種風濕性疾病。類風濕性關節炎(RA)、銀屑病關節炎(PsA)和強直性脊柱炎(AS)是炎癥性關節炎最普遍的亞型。大量研究表明IL-4 / IL-13細胞因子參與減少促炎細胞因子(IL-1β,IL-6,IL-8,TNF)和金屬蛋白酶的產生。它們還抑制活化FcγR和炎性MIP-3蛋白表達,以及抑制中性粒細胞活性并保護滑膜細胞免于凋亡。從動物和離體關節炎模型獲得的結果表明,IL-4/IL-13抗炎特性在炎癥性關節炎治療的背景下可能是有益的。誘導IL-4 / IL-13信號通路可能構成治療炎癥性關節炎的新型強效方法。
- 靶點藥物研發情況
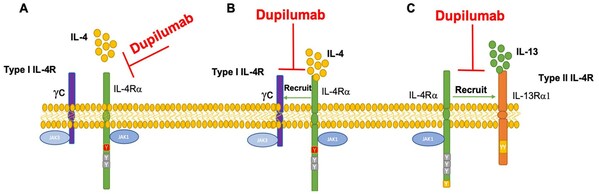
Dupilumab(Dupixent®)是全球首個上市的針對IL-4Rα全人體單克隆抗體,由賽諾菲和再生元公司共同開發,目前已先后被批準用于特應性皮炎(AD)、哮喘、慢性鼻竇炎伴鼻息肉病(CRSwNP)、嗜酸性食管炎(EoE)、結節性癢疹(PN)等5個適應癥,2021年銷售額已達到64億美金。
Dupilumab可通過以下途徑發揮作用:(A)Dupilumab可能抑制IL-4與IL-4Rα的結合,和/或(B)抑制γc募集到IL-4Rα鏈和/或(C)抑制IL-4Rα募集到IL-13Rα1。
AD是一種慢性、容易反復發作的疾病,在非致命性疾病中,這是疾病負擔第一的皮膚病,發作時患者身上的多處皮疹會產生劇烈瘙癢,嚴重影響生活質量。在靶向藥物上市之前,國內外并沒有一個可以長期安全、有效的治療方法,IL-4Rα靶點藥物給特應性皮炎治療帶來了新的選擇,臨床數據展示了其優異的治療效果。
三生國健認為,藥物研發最終考驗的是臨床價值,能否滿足未被滿足的臨床需求,期待IL–4Rα未來有更加驚喜的臨床數據出現,造福國內外過敏性疾病患者。(作者:三生前沿)
參考文獻:
【1】 Gandhi NA, Bennett BL, Graham NM, Pirozzi G, Stahl N, Yancopoulos GD. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016 Jan;15(1):35-50. doi: 10.1038/nrd4624.
【2】 Matsunaga K, Katoh N, Fujieda S, Izuhara K, Oishi K. Dupilumab: Basic aspects and applications to allergic diseases. Allergol Int. 2020 Apr;69(2):187-196. doi: 10.1016/j.alit.2020.01.002.
【3】 Ul-Haq Z, Naz S, Mesaik MA. Interleukin-4 receptor signaling and its binding mechanism: A therapeutic insight from inhibitors tool box. Cytokine Growth Factor Rev. 2016 Dec;32:3-15. doi: 10.1016/j.cytogfr.2016.04.002.
【4】 Ho IC, Miaw SC. Regulation of IL-4 Expression in Immunity and Diseases. Adv Exp Med Biol. 2016;941:31-77. doi: 10.1007/978-94-024-0921-5_3.
【5】 Harb H, Chatila TA. Mechanisms of Dupilumab. Clin Exp Allergy. 2020 Jan;50(1):5-14. doi: 10.1111/cea.13491
【6】 Keegan AD, Leonard WJ, Zhu J. Recent advances in understanding the role of IL-4 signaling. Fac Rev. 2021 Sep 7;10:71. doi: 10.12703/r/10-71
【7】 Iwaszko M, Bia?y S, Bogunia-Kubik K. Significance of Interleukin (IL)-4 and IL-13 in Inflammatory Arthritis. Cells. 2021 Nov 3;10(11):3000. doi: 10.3390/cells10113000
【8】 Song X, Traub B, Shi J, Kornmann M. Possible Roles of Interleukin-4 and -13 and Their Receptors in Gastric and Colon Cancer. Int J Mol Sci. 2021 Jan 13;22(2):727. doi: 10.3390/ijms22020727
【9】 Bieber T. Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov. 2022 Jan;21(1):21-40. doi: 10.1038/s41573-021-00266-6
【10】 Shi J, Song X, Traub B, Luxenhofer M, Kornmann M. Involvement of IL-4, IL-13 and Their Receptors in Pancreatic Cancer. Int J Mol Sci. 2021 Mar 15;22(6):2998. doi: 10.3390/ijms22062998.
【11】 Daines JM, Schellhardt L, Wood MD. The Role of the IL-4 Signaling Pathway in Traumatic Nerve Injuries. Neurorehabil Neural Repair. 2021 May;35(5):431-443. doi: 10.1177/15459683211001026
三生制藥董事長兼首席執行官婁競博士榮膺第十五屆"談家楨生命科學產業化獎"。
婁競博士是三生制藥聯合創始人、董事長兼首席執行官,擁有30余年生物制藥領域的專業經驗,牽頭研發了包括特比澳在內的多款國家一類新藥。在婁競博士的帶領下,公司從無到有、從小到大,技術水平不斷升級,產業化規模不斷擴大,現已發展成為國內領先、全球知名的集研發、生產、銷售為一體的中國生物制藥領軍企業。
2016-2021年,三生制藥連續6年蟬聯中國醫藥工業百強,并躋身中國醫藥研發20強。公司的核心產品包括全球唯一成功商業化的促血小板生成素產品——特比澳、兩款人促紅素產品——益比奧與賽博爾、抗TNF-α受體融合蛋白——益賽普,以及米諾地爾酊——蔓迪,分別在其治療領域占據主導地位。
根據IQVIA數據,"特比澳"2021年在中國內地血小板減少癥治療領域的市場份額達72.1%;公司兩種人促紅素產品益比奧和賽博爾合計占內地促紅素市場份額達42.4%;益賽普占中國內地TNF-α市場份額達29.5%;蔓迪據中國藥學會的數據,占中國內地米諾地爾市場份額達71.2%,并穩坐京東、天貓等電商渠道頭把交椅。
目前,三生制藥擁有位于沈陽(2個)、上海、杭州、深圳、東莞和意大利的7個生產基地,全球員工五千余名。公司生產品質符合國內外最高生產質量標準,生產規模和質量國內領先,保證了國內龐大患者群體的生物制劑的可及性和可負擔性,產品覆蓋國內32個省、海外20余個國家。2021年,三生制藥實現營業收入63.8億元,同比增長14.2%;凈利潤16.3億元,同比增長111%。
談家楨是世界著名遺傳學家、中國現代遺傳學奠基人之一。談家楨生命科學獎2008年至今已評選十五屆,共有30位科學家獲得"談家楨生命科學獎成就獎",3位科學家獲得"談家楨生命科學獎國際合作獎",16位臨床醫生獲得"談家楨臨床醫學獎",12位專家獲得"談家楨生命科學產業化獎",142位青年學者獲得"談家楨生命科學創新獎"。其中,共有24位中國科學院和中國工程院院士獲得成就獎,4位中國工程院院士獲得臨床醫學獎。談家楨生命科學獎經過15年的工作,已成為與陳嘉庚獎、何梁何利獎、光華獎并列的中國生命科學領域最具影響力的獎項之一。
"談家楨生命科學產業化獎",旨在傳承談家楨先生對生命科學事業的奉獻精神,獎勵在中華人民共和國境內對生命科學科技成果產業化過程有突出貢獻的人士,促進中國生命科學研究原創性和科研成果產業化,推進中國生命科學領域學術交流,激勵中國生命科學工作者不斷創新,為建設創新型國家做出貢獻。
婁競博士表示:"非常榮幸獲得第十五屆‘談家楨生命科學產業化獎'。談家楨獎是我國生命科學領域中最具權威性的獎項之一,為促進中國的生命科學科研進步和學術成果轉化做出了突出貢獻。身為一名生命科學領域的科研工作者,同時也是一家集研產銷于一體的規模化藥企的負責人,打通科學與產業的壁壘,將前沿的創新技術轉化為實實在在解決患者需求的創新產品是我畢生所追求的事業。三生制藥過去一步一個腳印為中國的患者帶來了特比澳、益比奧、益賽普、蔓迪等療效和可及性優異的產品,未來,我們將繼續秉承制藥為人的初心,為患者創造更豐富的價值,引領中國的生物醫藥產業向著更高的水平不斷邁進。"
根據排名信息,2022年上半年蔓迪在網上藥店銷售額同比增長率達到253.15%,單品牌銷售額占據中國網上藥店終端化學藥銷售總額的2.56%。
隨著互聯網的普及,外部環境和政策環境的加速聚集,網上藥店迎來高速發展的黃金期。近年來中國網上藥店終端藥品(化學藥、中成藥、藥品組合)銷售規模逐年上漲,從2019年的100多億擴容至2021年的300多億,2022上半年已突破230億元。然而根據米內網對行業監管政策的梳理顯示,國家政策互聯網藥品銷售的監管從未放松。蔓迪作為資質優異,經營合規,需求大、粘性強的國產毛發健康OTC藥品,在互聯網平臺的發展中抓住了機遇。
在三生制藥數字化營銷思路下,蔓迪充分借助電商平臺的便利性,不但在購買環節對客戶提供更加便利的產品觸達,還持續提供購買后陪伴式的服務,通過客服團隊的高頻次回訪,引導患者堅持療程化使用,收獲滿意發量,建立充分的品牌信任度,在2022年"雙十一"電商購物節中,蔓迪品牌取得了天貓和京東毛發皮膚用藥乃至全品類單品TOP1的佳績,充分見證了三生制藥在推進數字化營銷上的突破性進展。
作為一款有著超過20年的醫院用藥考驗,唯一獲得美國FDA、中國NMPA和《中國人雄激素性脫發診療指南》共同認證的安全、有效、便利的外用OTC生發防脫藥物,蔓迪不但在網上藥店取得問鼎榜首的榮耀,也始終堅持科學的傳達,和全方位的渠道覆蓋,服務各年齡層次的需求人群。目前蔓迪已覆蓋全國約9萬家零售藥店,進入全國2000家公立醫療機構,700多家毛發專診,并成為國內多個植發連鎖機構的合作伙伴。
2022年上半年,蔓迪為三生制藥貢獻銷售收入3.7億元,同比增幅42%。根據CPA數據,蔓迪在同類產品中市占率71.9%,市場地位持續保持領先。而從品牌價值擴展的角度來看,蔓迪也已經開始了全方位的布局。浙江萬晟申報的米諾地爾泡沫劑是國內唯一進行臨床研究和上市申報的米諾地爾泡沫劑產品,目前上市申請已獲國家藥監局受理,預計將成為國內首個獲批上市的同類劑型;而針對女性患者的蔓迪小白瓶、方便外出攜帶的蔓迪Pro隨身裝、幫助毛發蓬松站立的蔓迪洗發水等一系列產品形態也始終圍繞定位患者需求,力求在各個場景下幫助患者解決毛發問題。
縱然蔓迪的高增長得益于國內毛發需求爆發的"天時"、互聯網平臺發展的"地利",其最核心的競爭力仍然是能夠把握機遇,厚積薄發的"人和"。三生制藥始終秉承合規運營,擁抱數字化、專業化的營銷思路,以及萬晟基地提供全球領先的自動化生產線作為供應保障,相信蔓迪品牌將不斷再創巔峰。
此項臨床研究包含了多次給藥劑量遞增(Part 1)和多次給藥劑量擴展(Part 2)兩部分。
Part 1為隨機、雙盲、安慰劑對照、多次給藥、劑量遞增的試驗設計,共納入32例受試者,在3個劑量組(40mg Q2W,80mg Q2W和160mg Q2W)中探索了SSGJ-608的安全性、藥代動力學特征、免疫原性和初步療效。
Part 2為隨機、雙盲、安慰劑對照、多次給藥、劑量擴展的試驗設計,共納入107例受試者,在三種給藥方案【608A組:160mg W0(負荷劑量)+80mg Q2W、608B組:160mg Q2W組、608C組:160mg Q4W組】下評估了SSGJ-608的有效性、安全性、藥代動力學特征以及免疫原性。
研究總周期為52周,其中,第12周進行主要療效終點評估。截至數據分析時,Part 1受試者完成了16周至56周訪視,Part 2受試者完成了12周訪視。
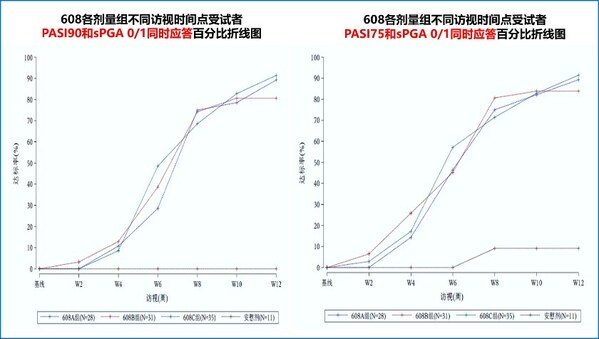
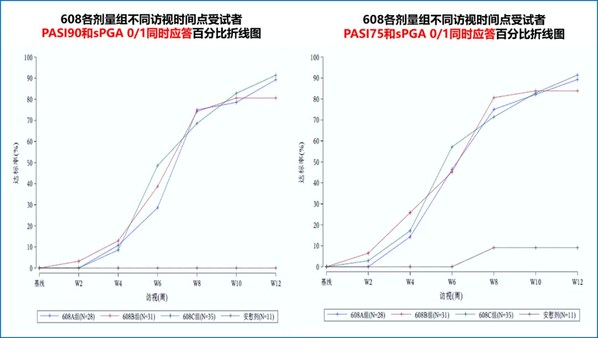
- 有效性方面,第12周時,Part 2各劑量組達到PASI 75、PASI 90和sPGA 0/1的受試者比例顯著高于安慰劑組(P值均小于0.0001),達到PASI 100的受試者比例也較安慰劑組顯著增高(P值小于0.01),詳見下表。在12周誘導治療期,608三個劑量組分別可使80.6%、89.3%、91.4%的受試者同時實現PASI 90和sPGA 0/1,46.4%、48.4%和57.1%的患者可實現皮損完全清除(PASI 100),而安慰劑組則無應答(0)。608藥物起效快,首次給藥后2~4周開始起效,且持續至整個治療周期,Part 1各劑量組第40周時,同時達到PASI 90和sPGA 0/1的受試者比例維持在70%、100%、100%,皮損完全清除(PASI 100)的受試者比例維持在40%、50%和87.5%。
- 安全性方面,SSGJ-608整體安全性良好,較前期臨床研究及同類的IL-17單抗藥物,未發現新的安全性信號。銀屑病患者中最常報告的不良事件為代謝類疾病如高尿酸血癥等、感染類疾病如尿路感染等,嚴重程度多為1-2級(CTCAE),整體不良事件發生率與同靶點藥物類似。
此臨床研究結果顯示,SSGJ-608可顯著改善中重度斑塊狀銀屑病患者的臨床癥狀。尤其值得關注的是,在不同劑量組的給藥方案下,PASI和sPGA 0/1的療效應答均快速、持續,臨床上有望實現較長周期(如Q4W)的給藥頻率,保證臨床療效的基礎上,提高銀屑病患者的治療依從性。目前,該研究的給藥和隨訪仍在進行中,研究相關完整數據將隨研究進展進行披露。
銀屑病是一種常見的免疫相關的慢性復發性炎癥性皮膚病,是一種多基因遺傳和環境相互作用下,主要由細胞免疫異常介導的慢性炎癥性增殖性皮膚病。銀屑病病情頑固、易反復發作,同時與心血管疾病、糖尿病、肥胖病和代謝綜合征等慢性疾病也密切相關,給患者的身心健康和生活質量帶來了嚴重的影響。銀屑病在世界各地不同人群中的患病率有明顯差異,歐美的患病率約1%~3%,而我國約為0.47%,但我國人口基數大,故銀屑病患者絕對數較多,且正在逐年增加。
全球范圍內針對IL-17A靶點治療中重度斑塊狀銀屑病的上市藥物有諾華制藥的COSENTYX®(Secukinumab)、禮來制藥的TALTZ®(Ixekizumab),且二者均已在國內上市。而我國目前尚未有針對IL-17A靶點治療中重度斑塊狀銀屑病的國產藥物獲批。截至目前的研發數據提示,SSGJ-608與已上市藥物Secukinumab和Ixekizumab在靶點、有效性、安全性等方面有一定的相似性,在對中重度斑塊狀銀屑病治療方面具有較大的潛力。
三生國健董事長婁競博士表示,"我們很高興看到SSGJ-608獲得了積極的結果。未來,我們將加速推進該產品的臨床試驗進程,并期待在大樣本人群中進一步確證SSGJ-608的積極療效。三生國健將繼續致力于探尋及開發更安全有效的治療性生物制劑,以應對迫切的醫療需求,為自身免疫性疾病患者提供重要的治療選擇。"
]]>核心業務持續增長,潛力產品申報上市
2021年,三生制藥主營業務收入連續5年保持增長,年復合增長率達14.3%,核心產品銷售收入均實現兩位數強勁增長,毛利率穩定在80%以上,現金流充裕,自我造血能力突出。
特比澳實現銷售收入30.8億元,同比增長11.5%,市場份額占比達72.1%。去年,特比澳覆蓋醫院數量持續增加,新醫保支付價格下患者支付壓力減輕帶動銷量提升,產品在療效和安全性方面的優勢促使其在臨床上持續取代傳統白介素類升血小板藥物。據估計,特比澳在中國內地CIT和ITP適應癥上的滲透率約為27%至35%。在海外,特比澳已獲菲律賓及泰國等9個國家批準,在歐洲上市的申報工作已啟動。
益比奧和賽博爾合計實現銷售收入11.2億元,同比增長15%,市場份額達42.4%,繼續在國內促紅素市場保持領先。2021年,益比奧覆蓋的基層醫療機構數目繼續增加,隨著益比奧被納入《國家基本藥物目錄》,基層用藥意愿增強,臨床上相對口服品種的性價比及安全性優勢進一步凸顯。目前,益比奧已獲包括泰國及巴基斯坦等國家在內的23個國家批準。
益賽普以價換量效果顯著,實現銷售收入7.9億元,同比上漲28%,銷量同比增長90%。作為中國內地市場推出的首個TNF-α抑制劑產品,2021年益賽普在中國內地覆蓋逾3,700家醫院,其中三家醫院近1,700家三級醫院。目前,中國內地風濕疾病生物制劑使用率遠低于北美等發達國家水平,還有廣闊的增長空間,過去一年中,益賽普持續拓面下沉,共覆蓋670 余個縣級市場,900多家縣級醫院。
潛在核心產品Remitch已提交上市申請并獲受理。2021年12月,三生制藥與日本東麗合作產品鹽酸納呋拉啡口腔崩解片(研發代碼:TRK-820,于日本以「Remitch」上市)的NDA獲國家藥監局受理,目前正積極籌備產品上市。Remitch是東麗開發的高選擇性κ受體激動劑,中國橋接臨床研究證實了其用于治療維持性血液透析慢性腎功能衰竭患者難治性瘙癢癥的有效性和安全性,5μg和2.5μg組均橋接成功,達到臨床研究終點。Remitch是中國內地第一款有望盡快上市的針對血液透析患者瘙癢的藥物,有望緩解這類患者的瘙癢癥狀,并改善其生活質量,可使中國內地人數眾多的血液透析瘙癢癥患者獲益。
毛發健康業務增長強勁,各個渠道齊頭并進
在當下“顏值經濟”的帶動下,脫發問題成為越來越多人關注的焦點,毛發健康市場孕育了巨大的市場潛能。
三生制藥旗下治療脫發產品蔓迪近年來增長迅猛。蔓迪通用名為米諾地爾酊,于2001年作為中國內地首個非處方脫發藥品上市,治療雄激素性脫發和斑禿,是全球唯一獲美國食品藥品監督管理局及中國國家藥監局批準上市的用于治療男女脫發的外用非處方藥物。2021年,蔓迪實現銷售收入6億元,同比增長63.7%。連續六年保持高速增長。根據中國藥學會數據,蔓迪2021年占中國內地市場米諾地爾市場份額達71.2%,處于絕對領先的地位。
蔓迪2021年的高速增長得益于多個方面。
首先,醫療機構的覆蓋范圍不斷擴大。蔓迪于國內覆蓋超過700家活躍的毛發專診并持續擴大,在醫療機構擁有超過十年的安全和有效性驗證,覆蓋治療患者超過百萬,且在進一步增加。蔓迪醫療機構收入占蔓迪總收入約20%,同比增長約35%;
其次,零售藥店的覆蓋進一步擴展。蔓迪目前在零售藥店渠道的覆蓋度較低,具有潛在提升空間。蔓迪零售藥店收入占蔓迪總收入約23%,同比增長150%。未來通過營銷推動,預計將有更多的零售藥店覆蓋。
第三,電商渠道高速增長。蔓迪在線布局阿里大藥房、京東大藥房、品牌旗艦店等,數字化營銷體系精準觸達和轉化潛在意向客戶。站內站外的精細化運營將繼續提升電商平臺的消費規模。蔓迪電商收入占蔓迪總收入約57%,同比增長55%;
第四,同時,蔓迪的新劑型產品也即將上市。蔓迪泡沫劑在男性脫發患者中與美國領先的米諾地爾藥劑Rogaine®的頭對頭III期臨床研究已經圓滿結束,結果顯示蔓迪泡沫劑具有同等療效以及相似安全性及耐受性。2021年,蔓迪泡沫劑的上市申請已獲國家藥監局受理,未來如獲批上市,將是國內唯一獲批上市米諾地爾泡沫劑型,對蔓迪的市場競爭增加明顯優勢。
中國內地有2.5億脫發人群,目前蔓迪滲透率僅占1%–2%。公司將繼續致力于增加蔓迪的品牌宣傳,提升藥品治療在脫發治療環節中的認知程度。隨著宣傳推廣的增加和滲透率的提升,蔓迪及其相關產品的市場空間有望得到持續提升。
研發進展屢獲突破,license-out迎里程碑
2021年,三生制藥研發進展進一步加快,全年投入研發費用共計7.5億元,相比去年增加近28%。在研發布局上,公司一貫追求創新與技術的卓越表現。目前研發管線包括33項在研產品,其中26項在研產品為國家創新藥物開發,腫瘤產品10項,自免產品16項,腎科產品6項,皮膚科產品1項。
提交新藥申請及III期臨床試驗階段的重點項目進展包括:
- 抗TNF-α預充式益賽普水針劑(301S)已于2021年7月向國家藥監局重新提交NDA生產批件,并獲受理。
- 米諾地爾泡沫劑型(MN709)完成在男性脫發患者中頭對頭比較MN709與Rogaine®的多中心、隨機及雙盲III期研究,獲陽性結果,向國家藥監局提交的NDA已獲受理。
- 鹽酸納呋拉啡口腔崩解片(TRK820)用于治療維持性血液透析患者難治性瘙癢癥的III期臨床試驗達到預設終點, 與日本III期試驗結果一致性結論成立,向國家藥監局提交NDA并獲受理。
- 特比澳(TPO)開始用于兒童ITP的III期臨床試驗;用于有血小板減少風險的慢性肝功能障礙患者在圍手術期的動員的I期臨床試驗已完成,Ib /II期臨床試驗正在進行中。
- NuPIAO (EPO, SSS06)完成II期臨床試驗及取得數據結果,已于2021年11月啟動產品的III期臨床試驗,并于2021年年底前開始患者入組工作。
II期臨床試驗的重點項目進展包括:
- Peg-EPO (RD-01)已完成RD-01于健康志愿者的劑量遞增的安全性和藥代動力學I期臨床研究。II期臨床試驗的患者入組工作已于2021年12月末前完成。
- 抗PD1單抗(609A)完成用于治療多類癌癥患者的609A的美國I期臨床試驗。中國內地II期臨床試驗正在進行中。
- 抗IL17A單抗(608)治療斑塊狀銀屑病的II期試驗已完成患者入組工作,預期將于2022年年底前啟動III期試驗。公司已于2022年3月就608用于治療中軸性脊柱關節炎(SpA)適應癥提交IND申請。
- 抗VEGF單抗(601A)已在推進601A用于BRVO患者的三期臨床試驗。
- 抗EGFR單抗(602)已完成分別用于健康志愿者及結直腸癌癥患者的兩項臨床I期臨床試驗,并已啟動該產品用于結直腸癌患者的II期臨床試驗,患者入組工作已經于2021年10月完成。
- 抗IL1β單抗(613)用于急性痛風的適應癥獲國家藥監局批準,Ib ╱二期試驗正在啟動中
- 抗HER2單抗(伊尼妥單抗,302H)2021年5月公司就進行302H聯合602于HER2陽性、KRAS/NRAS/BRAF野生型結直腸癌患者的I/II期臨床試驗獲國家藥監局批準;302H聯合IMM01(宜明昂科目前正在開發的靶向CD47的SIRPα-Fc融合蛋白)治療HER2陽性實體瘤的臨床試驗也獲的批準。
I期研發及IND申請的重點項目進展包括:
- HIF-117(SSS17)治療貧血的I期臨床試驗正在進行中。
- 抗IL5單抗(610)治療哮喘的Ib期試驗正在進行患者入組工。;
- 抗IL4Rα單抗(611)對健康志愿者進行的劑量遞增Ia期臨床試驗已于美國完成,于中國內地的特應性皮膚炎患者的Ib期研究將于近期完成患者入組工作。
- 抗HER2單抗(612)獲得國家藥監局的IND批件。
- 抗PSGL-1單抗(617)獲得國家藥監局的IND批件,用于治療晚期實體瘤。
- 抗PD1xHER2雙特異性抗體(705)的IND申請分別獲FDA和NMPA批準。
- 抗PD1x抗PD-L1雙特異性抗體(706) )的IND申請分別獲FDA和NMPA批準。
日后,公司將繼續把資源集中投入于自身免疫疾病、腫瘤科、腎科及皮膚科四大核心治療領域。其中,自免領域管線包括抗IL-4Rα抗體、抗IL-5抗體,抗IL-1β抗體及抗IL-17A抗體等處于國內第一梯隊的產品。
同時,公司的海外合作不斷深化: 2021年,公司從美國Verseau公司引進的PSGL-1抗體向CDE提交了IND申請并于2022年3月取得IND批件;年底,公司從瑞士Numab公司引入一款潛在first-in-class,二價靶向間皮素的CD3 T cell engager。這些對外合作將是公司未來邁向國際化的重要基石。2022年1月4日,三生制藥與美國Syncromune公司達成協議,將其研發的抗PD-1單抗609A用于腫瘤免疫聯合療法syncrovax?的全球權益授權給美國Syncromune公司。根據協議,三生國健將有望基于609A的臨床價值前景、重要監管及銷售里程碑,以及其他商業化價值,獲得數億美元的首付款、里程碑付款及其他的激勵 ,并繼續保有609A全球任何syncrovax?療法以外的權益,實現了公司創新藥物license-out里程碑的突破。
CDMO業務穩中有進,后續產能蓄勢待發
三生制藥是中國最早進行生物藥研發與生產的企業之一,發展29年來積累了豐富的質量控制經驗和優秀的產能設施及生產工藝。近年來,公司不斷拓展CDMO業務,為更多生物醫藥公司賦能。2021年,公司CDMO業務實現收入與1.1億元,同比增長4.6%,以歐洲子公司Sirton及其他海外客戶服務構成的海外CDMO業務占比較高,但國內客戶收入大幅增長。
目前,公司CDMO業務由北方藥谷德生(沈陽)生物科技有限責任公司(德生生物)、上海晟國醫藥發展有限公司(晟國醫藥)和意大利Sirton等子公司共同構成。其中,德生生物總規劃面積500畝,旨在建成一個符合中國、歐盟和美國相關藥品生產質量管理規范(GMP)法規要求的國內領先,面向國際市場的生物藥CDMO基地、生物制藥原輔材料和耗材制造基地以及生物制藥核心工藝裝備基地。德勝生物I期工程占地面積超過110畝,規劃建設19.9萬升的原液生產線及累計1億劑年注射劑產能,首期7.6萬升產能預計將于2022年開始投產。集團CDMO具有蛋白藥物原液(DS)與成品(DP)豐富的開發經驗和從實驗室到超大規模生產的產能配套,可為客戶提供從DNA到IND再到BLA和商業化生產的全流程一站式CDMO服務。
未來,三生制藥將依托公司多年來在生物藥產品從研發到生產的全流程技術優勢、單體萬升生物反應器所帶來的規模化成本優勢、培養基和層析填料等原料自產能力所具有的生產成本優勢、以及高自動化水平的質控管理優勢,進一步拓展CDMO業務版圖,致力于建設成為覆蓋大分子生物藥,基因治療和細胞治療的全方位生物醫藥CDMO。
三生制藥董事長婁競博士表示:“2021年,盡管外部環境時有波動,但集團經營治理有條不紊,嚴謹高效,四大業務領域齊頭并進,集團全年業績再創新高,也為股東帶來了切實的回報。展望未來的發展戰略,集團在市場營銷上將繼續深耕基層市場,推動慢病用藥結構優化;在業務拓展方面,圍繞腎科、自身免疫和皮膚毛發等領域擴充產品矩陣;在對外合作上,積極尋求產品出海,迎接全球市場的競爭與回報。三生制藥集團以滿足未被滿足的臨床需求為目標,致力于滿足中國老齡化社會的切實需求和人民群眾對美好生活的殷切向往,力爭實現社會責任與公司業績的共同成長,為股東和社會創造更大的價值。”
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
三生國健董事長婁競博士表示,"2021年是一個難忘的發展之年。面對行業的激烈競爭,我們成功抵御住了壓力,公司成熟產品煥發新生,創新和國際化的速度不斷加快,在業績上成功扭虧為盈,實現了股東利益的最大化。作為一家Biotech企業,三生國健不僅擁有行業稀缺的‘研產銷'綜合能力,更是目前少數能僅依靠自我造血,而非外部融資就能實現高速、高質量發展的創新生物藥企。在當前生物醫藥行業大變局的環境下,公司強勁的造血能力將助力我們穿越波動和周期,堅守制藥為人的初心不動搖,在以臨床需求為中心的前提下,找到創新與經營之間的最佳平衡點,最終讓股東、患者、全社會均能因我們的不懈奮斗而受益。"
益賽普以價換量成效顯著,多產品實現銷售大幅增長
2021年,三生國健三款上市產品都取得了亮眼的市場表現。主力產品益賽普以價換量策略取得良好效果;賽普汀在納入醫保后積極推進入院工作,銷售收入同比大幅增長;健尼哌滲透率持續提升,仍處在快速增長階段。
2021年,在益賽普以價換量、渠道下沉以及以患者為中心的推廣模式等多重因素的推動下,益賽普的銷售收入大幅增長。益賽普(國內)的銷量達到288.44萬支(折合25mg),同比增長89.81%。銷售收入達到7.89億元,同比增長28.18%。作為一款已經上市16年的產品,相較于其他同類產品,益賽普的藥物療效與安全性在國內市場得到了廣泛的臨床驗證與認可,在臨床運用中已具備較強的品牌效應。除產品特性以外,公司擁有專業的營銷團隊與完整的銷售體系,通過多年對益賽普的學術推廣及銷售經驗的積累與沉淀,在國內終端銷售的覆蓋方面收獲了良好的成果。
賽普汀在2021年3月1號開始醫保報銷后,快速推進醫院準入,完成核心市場布局。2021年度,賽普汀覆蓋的等級醫院數量超過500家,銷售收入較去年同期同比增長356.03%。2020年6月19日,賽普汀獲得國家藥品監督管理局(NMPA)批準,用于治療HER2陽性的轉移性乳腺癌,是中國第一個Fc段修飾,生產工藝優化的創新抗HER2單抗,與化療藥物聯合,已被證明可以延緩HER2陽性的轉移性乳腺癌患者病情進展。2020年12月底,賽普汀通過了醫保談判,首次被納入《國家醫保目錄》。2021年,伊尼妥單抗(賽普汀通用名)先后被納入中國臨床腫瘤學會(CSCO)、中國抗癌協會(CACA)乳腺癌診療指南,成為晚期乳腺癌患者全程抗HER2治療基礎藥物。
健尼哌在市場部等各部門的協同支持下,加大了臨床應用方面的學術推廣,推進對全國各地醫院的銷售覆蓋,2021年度銷售收入同比增長106.31%。健尼哌是目前國內唯一獲批上市的人源化抗CD25單抗,可用于預防腎移植引起的急性排斥反應,顯著提高移植器官存活率,改善患者生存質量。
在此基礎上,三生國健結合自身的經營情況以及當前醫藥行業的發展趨勢,于2022年初制定了聚焦具有先發優勢的自免領域、各平臺發力,多維度貢獻增長的發展戰略:
- 第一,加快自免領域的管線推進和布局。一方面,集中臨床資源,對自免管線中的重點項目加快臨床進展;另一方面,加快新適應癥拓展進程。
- 第二,多維增長,CDMO業務全面升級。公司的CDMO業務改變過去僅被動接單的狀態,全面升級為由上海晟國作為獨立CDMO運營平臺。
- 第三,進一步夯實鞏固公司自免領域的商業化平臺優勢。
- 第四,加強國際合作,尋找自有產品的License-out機會。
自免疾病領域前景廣闊,多款重磅產品研發進展喜人
自身免疫性疾病市場是僅次于腫瘤市場的全球第二大醫藥市場。根據Frost & Sullivan數據,預計全球自免市場將從2020年1206億美元增長到2025年1461億美元,至2030年將增長至1752億美元,生物藥占比超80%,生物藥增速高于整體。
自身免疫及炎癥總體患者規模巨大,存在巨大的未被滿足的臨床需求。類風濕性關節炎、強直性脊柱炎、銀屑病、銀屑病關節炎、哮喘、特應性皮炎、慢性鼻炎伴鼻息肉、痛風等是國內最常見的自身免疫及炎癥疾病,其中哮喘、特應性皮炎、慢性鼻炎伴鼻息肉、痛風等患者數均超過千萬,類風濕性關節炎、強直性脊柱炎、銀屑病這三種疾病的患者數超過1500萬人。
三生國健在自身免疫性疾病領域有具有絕對的先發優勢。主力產品益賽普是中國第一個TNF-α抑制劑,也國內強直性脊柱炎、類風濕性關節炎和銀屑病領域的第一款生物制劑,市場份額曾一度高達70%,惠及患者超過50萬人。健尼哌在腎移植領域,也是中國第一個抑制相關急性排異反應的單克隆抗體。在過去20年的時間里,公司不僅積累了深厚的研產銷經驗和醫生患者資源,在未來的產品布局上也在不斷進行更加深入的探索。
2021年,三生國健研發費用達4.55億元,同比增長33.8%,多款在研藥物取得重要臨床進展。在目前國健的研發管線中,有多款有潛力的自免創新藥物,分別用于銀屑病、哮喘、特異性皮炎和痛風等自免疾病的治療,臨床開發的速度都居行業前列,未來有望以一年一個NDA的速度申報上市。
抗IL-17A單抗SSGJ-608針對斑塊狀銀屑病,與諾華制藥的司庫奇尤單抗和美國禮來公司的依奇珠單抗為相同靶點的同類藥物,但具有全新的氨基酸序列,在體外和體內動物模型中顯示出相當的生物活性。2021年SSGJ-608完成I期臨床試驗和IIa期所有受試者入組,并啟動了臨床IIb期臨床試驗入組。2022年初,該II期臨床試驗完成了全部132例受試者的入組。對IIa期試驗初步盲態下數據分析結果顯示:SSGJ-608的3個治療劑量組(40mg Q2W,80mg Q2W,160mg Q2W)均顯示出良好的療效。
抗IL-5單抗SSGJ-610針對18歲及以上重度嗜酸性粒細胞性哮喘維持治療的附加治療,具有全新的抗體可變區序列,目前尚無相同靶點抗體藥物在國內上市,2021年完成Ia期臨床試驗,啟動Ib/II期臨床試驗的入組。SSGJ-610與已在美國和歐盟上市的葛蘭素史克的美泊利珠單抗和梯瓦制藥的瑞替珠單抗在體外細胞水平和動物模型體內活性的表現相當。除重度嗜酸粒細胞哮喘以外,SSGJ-610的潛在適應癥還包括高嗜酸性粒細胞綜合癥、變應性肉芽腫性血管炎、嗜酸性食管炎等,未來可擇機啟動增加適應癥程序,覆蓋更多患者。
抗IL-4Rα單抗SSGJ-611是三生國健自主研發設計、篩選并人源化的抗IL-4Rα單克隆抗體,具有全新的氨基酸序列,能夠通過特異性地結合IL-4Rα,阻斷IL-4和IL-13的信號傳導達到緩解特應性皮炎等疾病的作用。2021年,SSGJ-611達成的在美國的臨床I期試驗順利完成,并完成了在中國特應性皮炎的Ib期臨床研究的啟動,受試者入組達到50%。同類型的藥物中,賽諾菲的度普利尤單抗2021年全球銷售額超過60億美元。
抗IL-1β單抗SSGJ-613與已上市的同靶點產品卡那單抗和吉伏組單抗具有完全不同的結合表位,目前國內尚無自主針對IL-1β的單克隆抗體上市,2021年,SSGJ-613獲得IND批件,并且完成I期臨床研究的第4個劑量組的受試者入組,較原計劃提前4個月,并完成新增急性痛風適應癥的IND遞交。近日,SSGJ-613的Ia期研究入組完成,新增急性痛風性關節炎適應癥也獲NMPA批準并將于近期開展Ib/II期臨床試驗。
多平臺發力貢獻收入,靈活選擇強化發展韌勁
在聚焦具有先發優勢的自身免疫疾病領域的基礎上,2021年三生國健還實現了多維度的發展。
CDMO業務全面升級為由上海晟國作為獨立CDMO運營平臺,改變過去僅被動接單的狀態,充分發揮公司現有的規模和成本優勢,多種類型靈活建設未來產能,打造更完善的端到端一體化平臺為客戶服務。
國際化上,2021年公司從美國Verseau公司引進的PSGL-1抗體向CDE提交了IND申請并于2022年3月取得IND批件;年底,公司從瑞士Numab公司引入一款潛在first-in-class,二價靶向間皮素的CD3 T cell engager。這些對外合作將是公司未來邁向國際化的重要基石。
同時,三生國健將還在積極尋找license-out和并購整合的機會。今年1月4日,三生國健宣布將自主研發的SSGJ-609A(抗PD-1人源化單克隆抗體注射液)用于腫瘤免疫聯合療法syncrovax?的全球權益授權給美國Syncromune公司。根據協議,公司將有望基于SSGJ-609A的臨床價值前景、重要監管及銷售里程碑,以及其他商業化價值,獲得數億美元的首付款、里程碑付款及其他的激勵。
此外,2021年三生國健的其他研發管線也多有收獲。例如,擁有全新HER2抗原結合表位的抗HER2抗體SSGJ-612于2021年成功獲得NMPA的IND批件;抗PD-1抗體SSGJ-609A完成在中國的I期臨床試驗,獲得多個II期聯合用藥 IND批件,并啟動單藥二線治療軟組織肉瘤UPS的II期臨床試驗;雙特異性抗體SSGJ-705和SSGJ-706依托公司自主研發的雙抗平臺,可有效避免抗體鏈錯配,分別都獲得了中美兩地的IND批件。
未來,三生國健將會采取更加靈活的方式進行發展,包括引入戰略投資者、對外授權與合作等,繼續對相關管線進行孵化。
深耕基層堅守企業責任讓創新抗體藥觸手可及
2021年,三生國健積極踐行"讓創新抗體藥觸手可及"的企業使命,在實現自身發展的同時,為社會各方創造共享價值,助力健康中國建設。
脫貧攻堅期間,三生國健全力支持由原國務院扶貧辦、國家衛生健康委聯合實施的"強直性脊柱炎健康扶貧工程",面向全國832個國家級貧困縣的貧困強直患者開展醫療救治,幫助貧困強直患者減輕病痛,實現正常生活,擺脫貧困。
2021年6月,"強直性脊柱炎健康扶貧工程"向"強直性脊柱炎健康鄉村項目"過渡,公司積極響應國家鄉村振興工程,鞏固拓展脫貧攻堅成果,支持"強直健康鄉村項目"。截至2021年底,"強直健康鄉村項目"已累計篩查10784人,救治患者5505人,累計開展培訓和義診活動409場、培訓醫護人員7509人。
作為一項面向全國農村開展強直健康鄉村項目,"強直健康鄉村項目"是保護農村青壯年勞動能力,鞏固"兩不愁三保障成果",促進共同富裕的一項重要舉措,意義深遠: 通過規范治療,減輕患者病痛,阻斷殘疾,提高生活自理和勞動能力;通過科普宣傳,提高群眾對疾病危害的認識和對疾病的辨別能力,促進早發現、早治療,主動防止因病返貧致貧;通過組織醫療專家深入一線開展篩查義診和醫療培訓,促進基層醫療機構專業科室和人才隊伍建設,提高基層強直醫療水平。
未來,三生國健將繼續秉承"珍愛生命、關注生存、創造生活"的理念,致力于成為健康產業的長期開拓者、抗體藥的可靠提供者、社會共享價值創造者和綠色力量的行動者,成長為一家惠及中國、面向全球的創新型治療性抗體藥物公司,持續創新發展,保持快速增長,不斷為患者、醫生、社會創造更多價值,回饋投資者及社會各界的信任與期待。
核心業務強勢增長,領跑行業
2021年上半年,三生制藥共實現營業收入人民幣約31.1億元,比去年同期增長15.3%;毛利約人民幣25.9億元,比去年同期增長16.7%;歸母凈利潤人民幣約9.0億元,同比增長28%;研發投入3.4億元,同比增長35.6%。
三生制藥多款核心產品取得了強勁增長,穩居行業領先地位。用于治療血小板減少癥的特比澳在2021年上半年銷售額15.21億元,同比增長10.7%,市場份額72.3%;公司兩種重組人促紅素產品益比奧和賽博爾銷售額升至5.43億元,同比增長17.6%,市場份額42.8%;用于治療類風濕性關節炎、強直性脊柱炎及銀屑病的益賽普銷售額4.29億元,同比大幅增長29.5%。伊尼妥單抗被納入《中國臨床腫瘤學會(CSCO)乳腺癌診療指南(2021年版)》,成為晚期乳腺癌患者抗HER2治療全過程的基礎藥物。
2021上半年,以蔓迪為核心的醫美生發類產品領域銷售額同比取得翻倍增長。其中,蔓迪(通用名:米諾地爾酊)銷售額2.58億元,同比增幅高達100.3%。根據CPA數據,蔓迪在同類產品中市占率71.5%,市場地位保持絕對領先。目前蔓迪的銷售渠道覆蓋國內約2,000多家醫療機構、近40,000家零售藥店以及天貓、京東等互聯網銷售平臺,并與植發連鎖機構雍禾植發達成戰略合作。在《中國人雄激素性脫發診療指南》(中國醫師協會發布)中,米諾地爾對于雄激素性脫發(AGA)的防脫及改善效果、安全性都優于其他種類治療藥物,獲得指南最高等級推薦。中國有2.5億脫發人群,目前蔓迪的滲透率僅占1-2%。未來隨著脫發治療需求的與日俱增,蔓迪作為外用OTC生發藥物龍頭,存在巨大的增長潛力。
此外,三生制藥通過合作引進的產品即將形成潛在收入貢獻。公司與日本東麗合作產品Remitch(鹽酸那呋拉非口崩片)III期臨床橋接試驗已獲成功,上市后將有望成為透析瘙癢治療領域的獨家品種。依托公司在腎科領域強大的銷售渠道能力,預計該產品將能夠為國內百萬患者帶來治療希望。
除了不斷增長的核心產品之外,三生制藥還通過布局合同開發與生產組織(CDMO)業務,增加收入規模。2021年上半年三生制藥CDMO業務收入增加至4,005萬元,與去年同期相比增加9.4%。目前三生制藥CDMO業務由德生生物(沈陽德生)、三生國健、意大利Sirton等子公司共同構成。其中,德生生物總規劃面積500畝,旨在建成一個符合中國、歐盟和美國相關藥品生產質量管理規范(GMP)要求的國內領先,面向國際市場的生物藥CDMO基地、生物制藥原輔材料和耗材制造基地以及生物制藥核心工藝裝備基地。德生生物一期工程占地面積超過110畝,規劃建設19.9萬升的原液生產線及累計1億劑/年注射劑產能,首期7.6萬升產能預計將在2022年投產。
在研產品進度加快
在研發方面,三生制藥通過自主研發和外部合作,持續加快管線推進速度。2021年上半年,三生制藥共計擁有35項在研產品,其中24項作為創新藥物開發。根據藥物類型包含21項單抗或雙抗產品,5項其他生物制品,9項小分子藥物。治療領域覆蓋腫瘤科14項,自身免疫科及其他疾病14項,腎科6項,皮膚科1項。
6項已提交NDA或在III期臨床階段的產品:
(1)預充式益賽普水針劑(301S)已于今年7月向國家藥監局提交NDA申請生產批件并獲受理。
(2)與日本東麗合作產品鹽酸納呋拉啡(TRK820)用于治療維持性血液透析患者難治性瘙癢癥的III期臨床試驗達到預設終點, 與日本III期試驗結果一致性結論成立。
(3)米諾地爾泡沫劑型(MN709)完成在男性脫發患者中與Rogaine®頭對頭比較的III期研究,結果預計今年三季度公布。
(4)特比澳用于兒童ITP的III期臨床試驗已啟動。此外特比澳用于血小板減少風險的慢性肝功能障礙患者在圍手術期的動員的Ib/II期臨床試驗已啟動。
(5)包含(SSS11)pegitiscase在內的組合療法SEL-212已在美國啟動用于慢性難治性痛風的III期臨床試驗。目前公司正在進行SSS11用于高尿酸水平的頑固性痛風患者的I期臨床試驗。
(6)抗CD20單抗(304R)已完成III期臨床試驗數據審核。公司已完成304R與利妥昔單抗(Rituximab, Rituxan®)在零腫瘤負荷非霍奇金淋巴瘤患者中的安全性及藥代動力學方面的I期頭對頭臨床試驗。
8項II期臨床開發階段的產品:
(1)長效促紅素(SSS06)已完成隨機II期臨床試驗患者招募工作。
(2)長效促紅素(RD001)已完成在健康志愿者中的劑量遞增的安全性和藥代動力學I期臨床研究。II期臨床試驗受試者入組正在進行中。
(3)抗IL-17A單抗(608)已完成健康志愿者的劑量遞增I期臨床試驗,并正在進行斑塊狀銀屑病患者的II期臨床試驗。
(4)抗IL-5單抗(610)已完成健康志愿者的劑量遞增I期臨床試驗,即將啟動哮喘患者Ib/II期試驗。
(5)抗TNF-α單抗(SSS07)已完成健康志愿者及類風濕關節炎患者I期臨床試驗。
(6)抗VEGF單抗(601A)已完成用于治療老年性黃斑變性(AMD)及糖尿病黃斑水腫(DME)患者的兩項劑量遞增的I/IIa期臨床試驗,已啟動視網膜分支靜脈阻塞(BRVO)、視網膜中央RVO(CRVO)及近視繼發的脈絡膜新生血管適應癥(pmCNV)患者的三項II期臨床試驗。
(7)抗EGFR單抗(602)已完成602分別用于健康志愿者及結直腸癌患者的兩項I期臨床試驗,并已啟動該產品用于結直腸癌患者的II期臨床試驗。
(8)抗HER2單抗(302H)聯合602在HER2陽性、KRAS/NRAS/BRAF野生型結直腸癌患者的I/II期臨床試驗獲國家藥監局批準,此外 302H聯合抗CD47融合蛋白IMM01治療HER2陽性實體瘤。
6項I期臨床開發及IND申請階段的產品:
(1)抗PD1單抗(609A)已完成用于多種癌癥患者的美國I期臨床試驗,中國I期臨床試驗已完成患者入組。該產品與302H、貝伐珠單抗、化療等聯合用于治療多種癌癥已向國家藥監局提出IND申請。
(2)抗IL-4Rα單抗(611)已在美國完成對健康志愿者的劑量遞增I期臨床試驗,正在中國對特應性皮炎患者啟動Ib/II期臨床試驗。
(3)治療貧血的HIF-117(SSS17)正在進行I期臨床試驗患者入組。
(4)用于治療HER2陽性癌癥的抗HER2單抗(612)已獲得國家藥監局IND批件。
(5)抗IL-1β單抗(613)已獲得國家藥監局兩項IND批件,在幼年特發性關節炎(JIA)和周期性發熱綜合癥患者中進行臨床試驗。
(6)抗PD1/HER2雙特異性抗體(705)已獲得美國FDA批準在HER2陽性實體瘤患者中進行臨床試驗,中國臨床試驗申請已遞交國家藥監局。
不斷提升的綜合平臺實力
2021年以來,三生制藥持續提升研發、生產、營銷、投資合作為一體的綜合實力。鞏固其在中國生物制藥行業的領先地位,并通過專注開發創新的生物制藥產品,解決未被滿足的醫療需求。
三生制藥繼續立足創新,重點打造內部臨床研發實力,目前擁有由近600名經驗豐富的科學家組成的研發團隊。三生制藥在自身免疫疾病領域擁有國內第一梯隊的抗IL-4Rα抗體、抗IL-5抗體及抗IL-17A抗體等研發管線,腫瘤領域聚焦研發新型的下一代生物療法包括程式設計CAR-T細胞療法、免疫檢查點抑制劑、巨噬細胞檢查點調節劑、雙特異性抗體及其他新型抗體、抗新靶點抗體、聯合療法。另一方面,三生制藥還積極尋求與全球領先的技術平臺和生物科技公司合作,共同開發優質藥品,同時將全球優質產品引進國內。合作伙伴包括Toray、三星Bioepis、Refuge Biotechnologies、Verseau、TLC、Gensight、Sensorion等。未來12個月內,三生制藥預計將提交多項IND申請。
同時,在CDMO業務領域,持續提升多方面競爭優勢。三生制藥能夠支持單抗、雙抗、中和抗體、疫苗及mRNA核酸藥物等多種生物藥的生產,滿足生物藥從早期的樣品結構分析到上市后商業化全流程的生產需求。產線配置多樣化的反應器規模,可滿足小批量樣品試驗和大批量商業化生產的不同需求場景。制劑產能合計超過2億劑,覆蓋西林瓶水針、凍干粉針、預充針等生物制劑。公司CDMO業務產線還獲得中國、巴西、哥倫比亞、烏克蘭、歐盟等多國GMP認證,并成功通過了監管部門的所有審查。三生制藥憑借多年來生物藥產品研發到生產全流程技術優勢;單體萬升生物反應器對商業化生產的規模化成本優勢;培養基和層析填料等原料自產能力帶來的生產成本優勢;以及高自動化水平的質控管理優勢,持續向市場提供高質量的生物藥產品和CDMO服務。
截止2021年6月31日,三生制藥擁有近3,000名銷售及營銷人員,業務遍及全國。此外特比澳、益賽普、益比奧、賽博爾等產品通過國際化推廣已遠銷至多個國家。
三生制藥董事長婁競博士表示:“2021年上半年,三生制藥在主要業務領域都取得了顯著的業績增長,為2021年全年的業績表現打下了良好的基礎。公司積極響應國家對于醫療保障下沉的導向,全面推動生物藥在基層患者中的可及性提升,同時加速推進自主創新生物藥的研發,并向市場提供安全有效的脫發治療產品。公司擁有多個自主研發的核心產品,以穩健的現金流和財務表現,為長期可持續發展奠定堅實基礎。三生制藥致力于解決未被滿足的臨床需求,持續提升創新研發能力,以高品質藥物造福患者,為股東和社會創造更大的價值。”
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥,我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。
2021年上半年,公司核心產品益賽普的以價換量、渠道下沉策略取得良好成果,銷量較去年同期成倍增長;賽普汀在納入醫保后積極推進進院工作,于4月被正式納入CSCO乳腺癌診療指南,并繼續開展多項臨床試驗。研發上,公司持續加大創新研發投入,上半年研發費用2.14億元,同比增長30.45%。同時加快臨床步伐,取得多項重要進展。此外,公司還積極履行社會責任,“強直性脊柱炎健康鄉村工程”取得顯著成效,為更多患者帶去了福音。
緊跟時代脈搏 重拾增長趨勢
隨著國家生物醫藥產業政策的不斷出臺,大力發展創新藥物已經成為生物醫藥行業發展的必然趨勢。一方面,創新藥審批制度正在逐步與國際接軌,大大加快了我國創新藥的上市速度。另一方面,以醫保談判為標志的一系列改革措施也在倒逼生物醫藥企業向真正的高水平創新轉型,對企業的綜合實力提出更高要求。
在風濕免疫領域,近年來我國不斷加大對于風濕免疫疾病的診療力度,鼓勵風濕科建設,國內風濕疾病的治療率正在不斷提升。為了更好地提高TNF-α抑制劑的可及性,提升風濕免疫藥物的滲透率和覆蓋面,益賽普于2020年底主動調整價格,并做好對縣域市場的渠道下沉,取得了良好的效果。
2021年上半年,益賽普共銷售約154萬支(折合25mg),同比增長153.15%,實現銷售收入4.28億元,同比增長29.54%。作為一款已經上市16年的產品,益賽普與國內同類產品相比,其藥物療效與安全性在國內市場得到了更加廣泛的臨床驗證與認可,在臨床運用中已具備較強的品牌效應。除此之外,公司專業的營銷團隊與完整的銷售體系也是益賽普銷量增長的重要原因。
2020年6月,由公司自主研發的我國首個國產抗HER2單抗賽普汀(注射用伊尼妥單抗)正式獲得國家藥品監督管理局(NMPA)批準上市,并于同年成功進入國家醫保目錄。2021年上半年,賽普汀再迎重要里程碑。在4月召開的中國臨床腫瘤學會指南會上(CSCO),賽普汀被納入《2021 CSCO乳腺癌診療指南》,成為晚期乳腺癌患者全程抗HER2治療的基礎藥物。
此外,公司今年還逐步加大了CD25人源化單抗健尼哌在臨床應用方面的學術推廣,滿足相關患者的臨床用藥需求,推進對全國各地醫院的銷售覆蓋。2021年上半年,新冠疫情影響減弱,全國腎移植手術量逐步恢復,帶動健尼哌的銷售大幅增長。報告期內,健尼哌銷售收入同比增長198.07%。
研發碩果累累 蓄力發展動能
上半年,公司繼續深耕自身免疫疾病、腫瘤、眼科等熱門疾病領域,以臨床價值為導向,持續加大創新研發投入,多個創新產品取得階段性成果,研發管線得到進一步充實,為未來發展奠定良好的基礎。
- 新獲得臨床批件3項:
(1) 抗HER2抗體(612)獲NMPA批準開展用于晚期實體瘤治療的臨床研究
(2) 抗EGFR抗體(602)獲NMPA批準開展聯合伊尼妥單抗及化療在HER2 陽性且KRAS、NRAS 和BRAF 野生型的轉移性結直腸癌患者中有效性和安全性的Ib/Ⅱ期臨床研究
(3) 抗HER2 x 抗PD1雙特異抗體(705)獲FDA批準開展治療晚期或轉移性 HER2 表達陽性的實體瘤的臨床研究
- 新遞交IND申請4項:
(1) 重組人源化抗IL-1β抗體(613)治療周期性發熱綜合征(NMPA)
(2) 重組人源化抗IL-1β抗體(613)治療全身性幼年特發性關節炎(NMPA)
(3) 重組人源化雙特異抗體(705)治療實體瘤(NMPA)
(4) 伊尼妥單抗聯合抗CD47融合蛋白IMM01 治療HER2陽性實體瘤(NMPA)
- 新增Pre-IND 申請1項:
(1) 重組人源化雙特異抗體(706)治療實體瘤(NMPA)
- 新增抗體立項3項:
(1) 重組人源化抗LAG-3單克隆抗體(619)
(2) 重組人源化抗 IL-33 抗體(621)
(3) 重組人源化抗CD73抗體(622)
管線內其他產品的研發進展也有序推進。
- 重組人鼠嵌合抗CD20單克隆抗體注射液(304R)是公司自主研發的針對非霍奇金淋巴瘤治療的抗體藥物,2021年至今已完成 III期臨床試驗核查
- 重組人II型腫瘤壞死因子受體-抗體融合蛋白注射液(301S)是益賽普的新劑型,也是相關藥品國內首個預充式劑型,2021年至今已重新遞交 NDA申請
- 重組抗VEGF人源化單克隆抗體注射液(601A)2021年至今已完成AMD和DME I/Ib期臨床試驗;BRVO II期臨床試驗入組完成;CRVO II期臨床試驗病人入組順利;CNV II期臨床試驗開始入組
- 重組抗EGFR人鼠嵌合單克隆抗體注射液(602)是公司自主研發的針對轉移性結直腸癌治療的抗體藥物,2021年至今II期臨床試驗入組率已達50%
- 抗IL-17A人源化單克隆抗體(608)是公司自主研發的治療斑塊狀銀屑病藥物,2021年至今已完成I期臨床試驗,II期臨床試驗開始入組
- 抗PD-1人源化單克隆抗體注射液(609A)2021年至今已完成在中國的I期臨床試驗,并遞交聯合用藥治療多種實體瘤II/III期臨床IND
- 抗IL-5人源化單克隆抗體注射液(610)針對18歲及以上重度嗜酸性粒細胞性哮喘維持治療的附加治療,2021年至今已完成Ia期臨床試驗,啟動Ib+II期臨床試驗
- 抗IL-4Rα人源化單克隆抗體藥物(611)針對中重度特應性皮炎及哮喘的治療,2021年至今已在美國完成I期臨床試驗,正在進行數據鎖庫分析,并在中國啟動Ib/II期試驗入組
國際化布局方面,公司也以“外部項目引進來、內部項目走出去”為基本原則,努力引進國際領先、國內稀缺且臨床需求高的藥物。同時,積極推動已上市產品在海外市場的注冊上市,對自主研發創新品種積極開展國際臨床試驗,尋求自主研發品種與國際合作的機會。目前,公司正與美國Verseau公司在巨噬細胞檢查點調節劑抗體領域開展合作,在腫瘤免疫治療領域選取PSGL-1靶點的單克隆抗體VTX-0811、VSIG-4靶點的單克隆抗體作為授權產品;與瑞士Numab公司在多特異性抗體領域開展合作,基于Numab的技術平臺開發和商業化一系列用于癌癥治療的新型多特異性抗體。
未來,公司將繼續以開發創新抗體藥物為方向,采取靈活多樣的創新手段,以自主研發為主、結合對外合作,持續推動技術創新與產學研相結合,布局包括免疫檢查點、巨噬細胞檢查點調節劑、雙特異性抗體等創新技術,加速創新藥以及新一代生物療法的進程。同時,公司也在積極推進免疫治療、靶點治療等聯合用藥的治療方式,用于傳統治療方式無法治療或治療效果不佳的疾病。
賦能基層醫療 用心回饋社會
自2019年起,三生國健便積極參與并支持“強直性脊柱炎健康鄉村工程”,幫助廣大基層強直患者接受治療,經過近兩年的努力,項目成效顯著。截止6月底,項目已在全國21個省出臺項目實施方案并落地執行,累計開展培訓和義診活動349場,培訓定點醫院項目相關醫務人員5275人,完成患者初篩10004人,實際救治2173名建檔立卡的中重度貧困強直患者,在改善患者健康水平,減輕患者家庭負擔的同時,推動風濕免疫疾病在基層醫療體系的治療水平不斷提高,獲得了受助群眾、定點醫院和地方政府的高度認可。
三生國健董事長婁競博士表示:“2021年上半年,三生國健積極應對市場變化,核心產品取得較快增長,凈利潤實現扭虧為盈。更重要的是,我們在扭虧的同時保持了高水平的研發投入,臨床步伐明顯加快,管線中的多個創新藥物取得重要研發進展,為公司的長期發展保留了強勁的動能。隨著醫療改革持續深入,對生物藥企綜合實力的要求也在不斷提高,尤其是對企業的創新提出了更高的挑戰。無創新則無未來,三生國健將保持創新的戰略不變,進一步鞏固公司自身免疫疾病領域的商業化優勢,積極推進自免、腫瘤、眼科領域的新藥研發進程。我們將繼續秉承‘珍愛生命、關注生存、創造生活’的理念,不斷強化公司核心競爭力,踐行‘讓創新抗體藥觸手可及’的使命,推動更多優質的創新藥早日上市,造福更多患者。”