淋巴瘤是我國最常見的血液系統腫瘤之一,具有分型復雜、起病隱匿、早期診斷難度大、病程長且易復發等特點,為患者及其家庭帶來了較為沉重的疾病負擔。近年來,隨著醫學技術不斷進步,淋巴瘤患者的平均五年生存率得以大幅提升,如何通過藥物創新和開展全病程的規范化診療,進一步助力淋巴瘤患者有信心實現更高質量的長生存,引發了活動現場醫患圓桌和主題分享的熱議。
淋巴瘤患者故事紀錄片《英雄》也在活動現場首映。影片講述了三位不同年齡、不同職業的淋巴瘤患者積極治療、熱愛生活的真實故事,激勵更多患友要做生活中的英雄。主辦方北京微愛公益基金會理事長孫麗娟表示:"‘健康中國行動——癌癥防治行動實施方案(2023—2030年)'強調,癌癥防治工作也要實現高質量發展。我們希望借助本次患者關愛活動,聚焦淋巴瘤當下的疾病挑戰,以科學嚴謹、與時俱進的診療觀念和真實可信的患友共鳴,來為淋巴瘤患者戰勝疾病加油打氣,相信未來能享有和悅人生。"
診療升級改善患者生存質量
隨著創新藥物不斷涌現,中國淋巴瘤診療發生諸多變革,治療手段愈發多元。侵襲性淋巴瘤有了更多治療方案,提升了患者臨床治愈的可能性,而惰性淋巴瘤進入慢病化管理階段,有望幫助更多患者實現高質量生活。數據顯示,我國淋巴瘤患者五年總體生存率從2015年的38.3%增長至2021年的40.8%[1]。
蘇州大學附屬第一醫院血液科金正明教授表示,淋巴瘤的傳統治療手段以化療為主,但近年來,諸如BTK抑制等創新治療方案不斷在臨床中取得突破,全面推動了淋巴瘤的治療邁入"無化療"時代,也提升了治療的安全性,改善了患者預后。
江蘇省人民醫院血液朱華淵教授認為,目前,中國淋巴瘤的長期治療目標為更長生存的同時且能提升生活質量。朱華淵教授說道,"通過醫保和商保降低淋巴瘤患者的用藥負擔,規范化診療和多學科的協作,借助全程管理模式和社會的支持維持患者的生理功能、社會角色和心理健康,這些最終都會有助于淋巴瘤患者實現從疾病控制到高質量生存的健康目標。"
創新療法 助力患者重獲新生
為幫助患者增強治療信心,本次活動中,與會專家還向在場的患者詳細介紹了當前淋巴瘤創新治療手段的持續突破和未來發展方向,幫助患者更好地了解了該治療領域的前沿進展,助力患者理解自身疾病的治療方向。
復旦大學附屬腫瘤醫院腫瘤內科張群嶺教授表示,目前中國淋巴瘤的診療方向逐步趨于個體化、精準化,臨床上也在開展如BTK抑制劑、CD20單抗和ADC藥物等聯合治療方案的相關研究和探索,旨在為不同亞型的淋巴瘤患者提供更具針對性且更高效的治療選擇。患者要有信心,展望未來,隨著這些研究的持續推進和創新藥物的不斷涌現,將有更多中國淋巴瘤患者從中獲益。
金正明教授補充道,隨著對BCL2抑制劑、BTK降解劑等更多創新靶點和藥物的深入研究,將有望推動有限治療模式,而且復發難治問題相信將會得到改善。他呼吁,醫患企各方共同努力,豐富和投入更多臨床研究方向,期待一同見證更多創新療法為淋巴瘤防治帶來的革命性突破。
本次患者關愛活動還通過線上直播,傳遞給無法到場的患友群體。活動現場還特別設置了專家健康科普咨詢環節,針對用藥安全、副作用應對、康復期護理等個性化問題,為淋巴瘤患者進行一對一細致解答,進一步幫助患者獲得更科學的治療方案,提高生存質量。
愛心企業百濟神州總裁兼首席運營官吳曉濱博士表示:"對于癌癥患者及臨床醫生而言,五年生存期的里程碑意義不言而喻。百濟神州作為一家專注于抗腫瘤藥物研發的全球創新藥企,淋巴瘤不僅是我們長期探索、立志攻克的疾病領域,同時我們也希望通過擴大藥物的可及性和可負擔性、支持一系列患者關愛活動,切實助力淋巴瘤患者實現更長生存獲益,踐行我們‘百創新藥,濟世惠民'的初心。"
關于百濟神州
百濟神州是一家注冊地位于瑞士的全球腫瘤治療創新公司,專注于為全世界的癌癥患者研發創新抗腫瘤藥物。通過在血液學和實體腫瘤領域豐富的產品組合,以及強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線,致力于為全球更多患者全面提升藥物可及性和可負擔性。在全球六大洲,我們擁有超過11,000人的團隊。如需了解更多信息,請訪問www.beigene.com.cn或關注"百濟神州"微信公眾號。
*本材料僅在于向公眾傳遞疾病相關知識及醫藥前沿信息,非廣告用途,不構成對任何藥物的商業推廣或對診療方案的推薦,亦不能代替醫療衛生專業人士的意見,如有任何問題請向醫療衛生專業人士咨詢。
參考文獻
[1] Allemani C, Matsuda T, Di Carlo V, Harewood R, Matz M, Nik?i? M, Bonaventure A, Valkov M, Johnson CJ, Estève J, Ogunbiyi OJ, Azevedo E Silva G, Chen WQ, Eser S, Engholm G, Stiller CA, Monnereau A, Woods RR, Visser O, Lim GH, Aitken J, Weir HK, Coleman MP; CONCORD Working Group. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37?513?025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018 Mar 17;391(10125):1023-1075. doi: 10.1016/S0140-6736(17)33326-3. Epub 2018 Jan 31. PMID: 29395269; PMCID: PMC5879496.
 ]]>
]]>中國北京2024年7月14日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160;上交所代碼:688235)是一家全球腫瘤治療創新公司,今日宣布,由北京整合醫學學會與百濟神州聯合舉辦的第八屆血液腫瘤大會在京召開。本屆大會以"解鎖血液腫瘤領域全新時代"為主題,旨在為廣大臨床醫生打造專業的學術交流平臺,傳遞血液腫瘤領域研究最新成就,圍繞新興的治療理念開展交流,為患者探索更精準、更高效的治療方案,進而推動中國血液腫瘤診療水平的整體提升。
北京大學人民醫院血液病研究所黃曉軍院士、上海交通大學附屬瑞金醫院沈志祥教授、中國醫學科學院血液學研究所血液病醫院王建祥教授、北京大學腫瘤醫院朱軍教授和哈爾濱血液病腫瘤研究所馬軍教授擔任本次大會的主席,國內外眾多腫瘤領域專家學者以及百濟神州總裁兼首席運營官吳曉濱博士、百濟神州大中華區首席商務官殷敏女士、百濟神州高級副總裁、大中華區醫學事務部負責人錢洪宇女士出席大會。
以持續創新,助力診療路徑優化升級
血液疾病在臨床上主要包括白血病、多發性骨髓腫瘤、惡性淋巴瘤三大類,其發病率和死亡率在我國常年居高不下,嚴重威脅人民健康。以淋巴瘤為例,根據2015年中國癌癥統計數據,我國淋巴瘤患者每年新發病例數約為8.82萬例,是血液腫瘤中發病率最高的腫瘤疾病,去除無法具體分類的腫瘤,我國淋巴瘤的死亡率在所有腫瘤疾病中排名第十位[1],[2]。
隨著在血液腫瘤臨床診療和靶向藥物研發等方面取得的進步,我國部分血液惡性腫瘤患者5年生存率已上升至60%~90%。血液腫瘤逐漸成為"可治愈"的疾病。
北京大學人民醫院血液病研究所黃曉軍院士指出:"隨著我國對血液腫瘤疾病發病機制的深入研究探索和創新藥產業的迭代研發,血液腫瘤的治療效果也得到了顯著改善。我相信這次會議為臨床醫生不斷學習和及時掌握國際前沿研究進展提供了一個很好的機會,從而有助于促進血液腫瘤診療水平的進一步提升,幫助患者獲得更好的治療效果,為更多患者帶來治愈的希望。"
哈爾濱血液病腫瘤研究所馬軍教授在視頻致辭中表示:"血液淋巴系統腫瘤是嚴重威脅人類健康生命的重大疾病,我國發病率和死亡率正在呈現逐年增加趨勢。創新治療方法和藥物的出現,引領我們從過去有醫沒有循、有病不能治的時代邁入了精準個體化治療的新紀元。如今,來自中國的研究成果已經在國際血液學占據了一席之地,我們盼望未來能有更多國內的臨床專家和學者,在世界學術舞臺上展現更強的科研實力,為全球血液腫瘤研究不斷注入澎湃的創新活力。"
百濟神州總裁兼首席運營官吳曉濱博士表示:"中國專家憑借豐富的臨床實踐經驗和扎實的科學研究能力,為全球血液學貢獻著重要的力量。學術交流是我們在血液腫瘤領域學習和積累經驗的關鍵,我們希望通過搭建血液腫瘤大會這個專業學術平臺,幫助臨床專家更好地掌握前沿進展,同時專注藥物研發,以期為廣大患者探索更精準、更有效和更可及的治療方案。"
血液腫瘤領域的疾病分型復雜、臨床表現各異。而科研及診治水平提升以及治療方案選擇多樣化為精準施治提供了堅實基礎,同時也有助于血液腫瘤診療路徑的優化升級。
與會專家認為,實現《健康中國2030規劃綱要》提出的中國在2030年達到惡性腫瘤五年生存率提升15%以上,血液腫瘤領域的診療水平規范化、個體精準化在未來若干年的推進至關重要。
上海交通大學附屬瑞金醫院沈志祥教授提到:"我國腫瘤患者基數龐大,新藥物、新療法和新技術的不斷涌現,已經為臨床格局帶來了重大改變,許多血液腫瘤疾病已經逐漸轉變為慢性病管理模式。對于臨床醫生而言,探索創新療法的同時更要嚴格規范開展臨床應用,確保患者能夠獲得安全有效的治療效果,進而提升我國血液疾病的整體診療水平和五年生存率。"
加速差異化創新研發,科學助力行業高質量發展
中國醫學科學院血液學研究所血液病醫院王建祥教授表示:"近年來,血液腫瘤領域涌現出許多針對不同靶點的新藥,不同藥物之間的聯合使用,使血液腫瘤的治療手段更加豐富,機制互補,療效改善顯著。這些創新藥物不僅為醫生提供了多樣化的治療選擇,讓臨床醫生擁有了更多有力的‘武器',也為患者帶來了新的生存希望。期待未來我國在差異化創新藥物研發方面能夠持續取得突破,讓更多患者有機會獲得更好的臨床獲益。"
北京大學腫瘤醫院朱軍教授表示:"在淋巴瘤的靶向治療方面,BTK抑制劑已經帶來了很好的治療效果。但在長期治療中依然會出現復發、難治或者產生耐藥的問題。而BCL-2抑制劑、BTK蛋白降解技術的出現,有望解決現有治療中存在的難題,為患者實現更好的治療效果。希望有更多創新藥企業,持續研發出高品質的創新藥物,共同解決臨床診療的難點,讓更多血液腫瘤患者從創新治療方案中獲益。"
百濟神州高級副總裁、大中華區醫學事務部負責人錢洪宇女士介紹道:"血液腫瘤一直以來都是百濟神州重點發力的核心領域,‘頭對頭'ALPINE研究的延長隨訪數據再次驗證了澤布替尼為‘同類最佳'潛力的BTK抑制劑;不僅如此,百濟神州自研的BCL-2抑制劑sonrotoclax和BTK CDAC也在研究中展現出了積極的臨床數據,這些數據結果進一步表明百濟神州力求為血液腫瘤患者帶來高品質創新方案的信心和決心。我們希望與專家們攜手開展更多科研探索,為患者帶來更多能夠抗擊癌癥的創新藥物,解鎖血液腫瘤診療中更多的可能性。"
百濟神州致力于加強血液學產品管線布局,打造滿足臨床需求的血液腫瘤產品組合。憑借澤布替尼令人鼓舞的研究數據,公司展現了在血液學領域的研發優勢,并基于澤布替尼的獨特臨床特征不斷加大對多種B細胞惡性腫瘤的研究。百濟神州的差異化在研BCL-2抑制劑sonrotoclax無論作為單藥還是與其他藥物聯用都極具前景,同時BTK CDAC也有望解決血液癌癥患者未被滿足的治療需求。
吳曉濱博士表示:"百濟神州致力于讓創新藥物惠及全球更多患者,并積極支持研究者開展醫學研究探索,加速成果轉化與臨床應用。我們將繼續與臨床專家攜手,聚焦改善臨床治療熱點問題、推動規范化診療下沉,不斷改善創新藥物的可及和可負擔性,推動創新成果造福更多患者及家庭。"
[1] CA CANCER J CLIN 2016;66;115-132 [2] 來源:Horner MJ et al., SEER Cancer Statistics Review, Kantar Health Patient Metrics, 2010 |
聲明:本文章目的在于傳遞醫藥領域前沿信息和學術進展,非廣告用途,不構成對任何藥物的商業推廣或對診療方案的推薦。本文章中涉及的信息僅供參考,與疾病治療有關信息請遵從醫生或其他醫療衛生專業人士的意見或指導。未經允許,不得轉載。
百濟神州總裁兼首席運營官吳曉濱博士表示:"廣州的生物醫藥產業在全國乃至全球都具有重要地位,我們非常高興能夠在這里建立并啟用ADC生產園區。百濟神州在廣州的發展不斷取得新的成果,離不開政策和產業各方的全面支持和密切合作。我們將繼續依托廣州和大灣區豐富的生物醫藥產業資源和人才優勢,致力于打造一個全國領先的生物醫藥全產業鏈卓越中心,加速創新藥物的研發、生產和商業化進程,為全球患者提供更多可及、可負擔的創新藥物。"
位于廣州生物藥生產基地(以下簡稱"廣州基地")南園的ADC生產園區,占地5.8萬平方米,將成為百濟神州ADC藥物研發和生產的核心基地。園區內建設了兩個主要生產車間及其附屬配套設施,遵循高標準、高質量的原則,前期已建成包括抗體偶聯、超濾純化和無菌灌裝凍干在內的生產線,并配備了ADC專用的QC分析實驗室,以及MST和工藝開發實驗室,以全面支持技術轉移和商業化生產。
ADC生產園區的建設充分考慮了生物醫藥產業的特殊需求,通過引進先進的生產設備、研發設施和運營管理系統,確保了ADC藥物在研發和生產過程中的高效、安全和質量可控。該車間計劃2024年二季度投入使用,并預留了未來擴展空間,可以擴大生產能力兩倍以上,充分滿足市場對創新藥物的需求。
百濟神州憑借全球腫瘤學領域的專業研究團隊以及端到端的ADC生產能力,為公司的創新藥物研發與生產奠定了堅實基礎,并進一步拓寬了百濟神州在行業內的合作渠道,為其拓展市場空間創造更多機遇。2023年7月,百濟神州與映恩生物達成獨家合作協議,獲得一款臨床前ADC藥物的全球開發、生產和商業化權利,有望為特定實體瘤患者提供治療選擇。隨著ADC園區的正式啟用,新園區將為這款及更多ADC藥物提供臨床和商業化生產支持,共同推動創新藥物的研發和上市進程。
廣州基地作為百濟神州的重要戰略布局,自2017年落戶廣州黃埔區中新知識城以來,已取得了令人矚目的成績。作為廣東省首家獲批進行商業化生產抗PD-1單克隆抗體的制藥企業,這里擁有一流的生物醫藥研發和生產設施,為大分子藥物的深入研究和生產提供了有力保障。通過持續優化生產工藝、提升生產效率,百濟神州得以為廣大患者提供更為安全、有效的創新藥物。同時,南園區的高效生產能力也將為百濟神州滿足市場需求、實現商業化目標提供有力保障。
展望未來,百濟神州將以廣州生產基地為重要支點,積極構建一個涵蓋基礎醫學探索、新藥研發、臨床與商業化生產、藥物商業化等多元領域的綜合性生物醫藥產業生態系統。我們致力于促進科技成果的轉化應用,推動創新藥物的發展,為醫療領域注入源源不斷的活力與生產力。在此過程中,百濟神州將始終堅守創新驅動、質量為本的發展理念,為生物醫藥產業的持續繁榮與進步貢獻更多的智慧與力量,為全球患者的健康福祉做出積極貢獻。
關于百濟神州
百濟神州是一家全球腫瘤創新公司,專注于為全世界的癌癥患者研發創新抗腫瘤藥物。通過強大的自主研發能力和外部戰略合作,我們不斷加速開發多元、創新的藥物管線和產品組合,致力于為全球更多患者全面提升藥物可及性和可負擔性。在全球五大洲,我們有超過10,000人的團隊,并在中國北京、美國麻省劍橋和瑞士巴塞爾設立了主要辦事處。如需了解更多信息,請訪問www.beigene.com.cn或關注"百濟神州"微信公眾號。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律定義的前瞻性聲明,包括百濟神州為全球更多患者提供替雷利珠單抗和抗體歐聯藥物的能力;替雷利珠單抗未來在百濟神州實體瘤開發項目中的意義;以及在"關于百濟神州"副標題下提及的百濟神州計劃、承諾、抱負和目標。由于各種重要因素的影響,實際結果可能與前瞻性聲明有重大差異。這些因素包括:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產、商業化和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發和實現并保持盈利的能力;百濟神州在最近年度報告的10-K表格中"風險因素"章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該等信息。
百濟神州聯合創始人、董事長兼首席執行官歐雷強(John V. Oyler)表示:“Dugan和Riva博士在公司發展的關鍵時期加入百濟神州董事會,為公司帶來重要的腫瘤學專業見解,并將推進高價值的臨床后期管線更快發展。兩位醫學博士在敏捷型的生物科技公司和大型制藥企業的從業經驗為我們帶來了互補的醫學和商業化經驗,支持我們努力成為行業領導者和行業變革的推動者。在此,我們也要感謝蘇敬軾在董事會任職期間給予的支持。”
Dugan博士目前擔任Dracen制藥公司的首席醫學官。該公司是一家位于紐約的私營制藥企業,專注于開發腫瘤領域的免疫代謝療法。她于2018年加入Dracen,擁有超過20年的腫瘤學經驗。此前,她在諾華腫瘤擔任多個高級管理職務,包括高級副總裁和全球項目負責人,致力于為患者開發創新藥物。Dugan博士還曾在先靈葆雅(現默沙東公司)和美國氰胺(現輝瑞公司)擔任多個研發職位。Dugan博士在紐約大學獲得文學學士學位和醫學學位,并接受了血液學和腫瘤學的相關培訓。
歐雷強表示:“Dugan博士因其在腫瘤學領域專業知識和致力于為全球患者帶來重要醫學突破而廣受認可。我們非常歡迎她加入董事會。她的專業知識將會在我們努力擴大研發管線以期更好造福患者的過程中,為我們提供寶貴價值。”
Dugan博士表示:“我很榮幸加入百濟神州董事會,也很高興能與這支才華橫溢又專注敬業的團隊共事,為全球更多患者帶來高質量的創新療法。百濟神州的很多方面都吸引著我:廣泛的自主研發能力、令人興奮的授權引進新產品,以及在全球產生持久影響的企業價值觀,即患者為先、銳意創新、無界協作、追求卓越。”
Riva博士目前擔任Intima Bioscience的首席執行官。該公司是一家臨床階段基因和細胞治療的私營公司。在加入Intima之前,Riva曾在Ichnos Sciences擔任首席執行官,這是一家專注于腫瘤領域雙特異性抗體和三特異性抗體,以及自身免疫性疾病領域生物制品的生物科技公司。加入Ichnos之前,Riva博士擔任吉利德科學公司的執行副總裁和腫瘤治療學、細胞和基因治療全球負責人,在收購Kite Pharma的項目中發揮了重要作用。加入吉利德之前,Riva博士是諾華制藥的執行副總裁和腫瘤學開發和醫學事務全球負責人,為腫瘤業務部門和細胞與基因治療部門做出了重大貢獻。在收購葛蘭素腫瘤期間,他還擔任諾華腫瘤的臨時總裁。Riva博士目前是Century Therapeutics的董事會成員。Century Therapeutics是一家在納斯達克上市的生物科技公司,開發創新的iPSC衍生NK和T細胞療法。此前他曾在Farmitalia Carlo Erba、Rhône-Poulenc Rorer和Aventis任職,共同創立了乳腺癌國際研究小組(BCIRG)和癌癥國際研究組(CIRG),并擔任首席執行官。Riva博士在米蘭大學獲得醫學和外科醫學博士學位,以及米蘭大學腫瘤學和血液學委員會認證的專科醫師執照。
歐雷強表示:“Riva博士為我們的董事會帶來了關鍵的行業見解和豐富的經驗,他也對我們致力于幫助全球患者的使命及公司秉持的價值觀有著非常堅定的信念。我們非常歡迎Riva博士加入董事會,期待在履行公司重要使命時更好地汲取他的洞察。”
Riva博士表示:“百濟神州正在行業內打造具有獨特能力的新一代全球生物技術公司。我很榮幸也很期待能夠在這一激動人心的時刻加入董事會,與其他同仁一道推進公司達成短期里程碑,為踐行公司的長期戰略目標貢獻力量。”
關于百濟神州
百濟神州是一家立足科學的全球性生物科技公司,專注于開發創新、可負擔的藥物,旨在為全球患者改善治療效果,提高藥物可及性。目前公司廣泛的藥物組合包括40多款臨床候選藥物。公司通過加強自主研發能力和合作,加速推進多元、創新的藥物管線開發。我們致力于在2030年前為全球20多億人全面改善藥物可及性。百濟神州在全球五大洲打造了一支超過8,000人的團隊。欲了解更多信息,請訪問http://www.beigene.com.cn。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律中定義的前瞻性聲明,包括關于新董事會成員的預期貢獻以及百濟神州未來的計劃和抱負的聲明。這些因素包括了以下事項的風險:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發和實現并保持盈利的能力;新冠肺炎全球大流行對百濟神州的臨床開發、監管、商業化運營以及其他業務帶來的影響;百濟神州在最近季度報告的10-Q表格中“風險因素”章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該等信息。
待開發計劃最終確認后,除購買土地外,百濟神州預計還將投資數億美元用于園區的初步建設。該生產基地和臨床研發中心將建成最高可達40萬平方英尺(約3.7萬平方米)的商業化階段的生物藥生產,其中包括至多16,000升生物制劑產能。與此同時,該基地還將為臨床研發和辦公提供場所。初期建設將于2022年啟動,并在2023年底或2024年竣工。此外,該基地還預留了超過100萬平方英尺(約9.29萬平方米)的可開發地產,以備進一步拓展。
百濟神州聯合創始人、董事長兼首席執行官歐雷強(John V. Oyler)表示:“通過此次收購,我們計劃在美國建立一個全新的生產基地和臨床研發中心,以豐富我們的全球供應鏈。能在實現為全球患者提供更先進、有影響力且更具可及性的創新療法這一愿景的道路上邁出堅實一步,我們倍感自豪。我們已經開始從新澤西州深厚的人才資源庫中招募英才,并期待成為普林斯頓—霍普韋爾地區蓬勃發展的商業的一份子。”
Phil Murphy州長表示:“我們非常高興百濟神州把全球創新抗癌藥物生產的下一步選在新澤西州。我們一直希望在新澤西州營造良好的環境,推動像百濟神州這樣的公司快速發展。期待百濟神州在這里發展得越來越好。”
霍普韋爾鎮長Julie Blake表示:“隨著更多如百濟神州這樣的公司落戶西普林斯頓創新園區,霍普韋爾鎮未來作為生物科技基地的優先地位將愈發穩固。百濟神州致力于開發抗腫瘤創新藥物,再加上其計劃中的設施將創造三方共贏的局面 -- 數以百萬計的癌癥患者有望通過百濟神州的藥物改善生活質量,而這些藥物正是從霍普韋爾研發和生產出來的。”
百濟神州從Lincoln Equities Group收購了霍普韋爾相關資產,并繼續保留DPR Construction作為其建設管理公司和IPS作為其建筑工程公司。
關于百濟神州
百濟神州是一家立足科學的全球性生物科技公司,專注于開發創新、可負擔的藥物,旨在為全球患者改善治療效果,提高藥物可及性。目前公司廣泛的藥物組合包括40多款臨床候選藥物。公司通過加強自主研發能力和合作,加速推進多元、創新的藥物管線開發。我們致力于在2030年前為全球20多億人全面改善藥物可及性。百濟神州在全球五大洲打造了一支超過7,700人的團隊。欲了解更多信息,請訪問www.beigene.com。
前瞻性聲明
本新聞稿包含1995年《私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法所定義的前瞻性聲明,包括百濟神州計劃和預計在新澤西建立一個新的生產和研發中心,以在該基地生產商業化藥物和候選藥物,使百濟神州全球供應鏈進一步多樣化,收購該地塊和設施建設預計的時間表,百濟神州為新生產和研發中心招募人才的預計投資,以及在“關于百濟神州”副標題下提及的百濟神州計劃、承諾、抱負和目標。這些因素包括了以下事項的風險:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發和實現并保持盈利的能力;新冠肺炎全球大流行對百濟神州的臨床開發、監管、商業化運營以及其他業務帶來的影響;百濟神州在最近季度報告的 10-Q 表格中“風險因素”章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該些信息。
一方有難,八方支援。百濟神州密切關注災區災情變化及救援所需物資,第一時間決定向河南省捐贈100萬元人民幣,用于支持受災地區人民群眾采購緊急救災物資,快速恢復生產生活秩序,以及支持鄭州受災嚴重的醫院恢復建設,鞏固災后公共衛生系統防疫工作。
災情發生后,百濟神州緊急成立了“河南暴雨災情”應急小組,積極進行員工排查和應急救援工作,確保每一位員工及家屬安全,全力應對此次災情。
百濟神州將持續關注災情變化,確保當地藥品正常供應的同時,盡我們所能助力救災。暴雨無情,人間有愛。河南加油!
早期無進展生存期和總生存期數據支持緩解率結果
百悅澤®在關鍵次要終點房顫或房撲事件率方面顯示出優效性,具有總體心臟安全性優勢
公司將于北京時間6月12日(周六)零點(美東時間6月11日中午12點)召開線上投資者會議
美國麻省劍橋和中國北京2021年6月11日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160)是一家全球化的生物科技公司,專注于在世界范圍內開發和商業化創新藥物。公司今日公布了其BTK抑制劑百悅澤®(澤布替尼)3期研究ALPINE的期中分析結果,結果顯示對比伊布替尼,百悅澤®用于治療患有復發或難治性(R/R)慢性淋巴細胞白血病(CLL)或小淋巴細胞淋巴瘤(SLL)的成年患者時,在研究主要終點,即研究者評估的總緩解率(ORR),和關鍵次要終點房顫或房撲事件率方面均顯示出了優效性。
這些結果已在2021年歐洲血液學會(EHA2021)第26屆線上大會的主席研討會上以口頭報告的形式發布,同時入選年會的線上新聞發布會。此次大會在線上召開,時間為2021年6月9日至17日。
ALPINE試驗的研究者,利茲大學實驗血液學教授Peter Hillmen博士、醫學學士說道:“雖然伊布替尼誕生之初改變了慢性淋巴細胞白血病(CLL)患者的生存前景,但并不是所有患者都能對它產生應答,而且長期使用時產生的毒性問題也仍然有待解決。ALPINE是CLL領域中針對伊布替尼的頭對頭研究,也是目前唯一一項在一款選擇性更強的BTK藥物中,顯示出比伊布替尼療效更佳的研究。相比伊布替尼,百悅澤®在復發或難治性CLL患者中取得了更優的經研究者評估的總緩解率。此外,百悅澤®在房顫或房撲事件率這項重要心臟毒性指標上的數值也顯著低于伊布替尼。”
百濟神州血液學首席醫學官Jane Huang博士表示:“ALPINE試驗期中分析取得了積極結果,百悅澤®顯示出了更優的總緩解率、無進展生存期和總生存期的支持性初步數據、并顯著降低了任何級別的房顫事件發生率。這使我們更加肯定,百悅澤®的差異化特征可以為CLL患者帶來臨床獲益。而公司開展的ALPINE和ASPEN兩項對比百悅澤®和一代BTK抑制劑伊布替尼的頭對頭試驗也印證了,百悅澤®具備成為同類最優藥物的潛力,能夠為患者帶來有臨床意義的疾病緩解,同時也有良好的、穩定的安全性。除了ALPINE,我們目前也在開展一項3期試驗SEQUOIA研究,評估百悅澤®在初治CLL患者中的有效性和安全性,該研究有望最早于今年晚些時候公布主要結果。”
在R/R CLL患者中對比百悅澤®和伊布替尼的ALPLINE試驗的期中分析
口頭報告;摘要代碼:LB1900
在EHA上公布的計劃中的期中分析結果均來自于首先入組ALPINE試驗的415例患者,其中207例患者接受百悅澤®治療,208例接受伊布替尼治療。
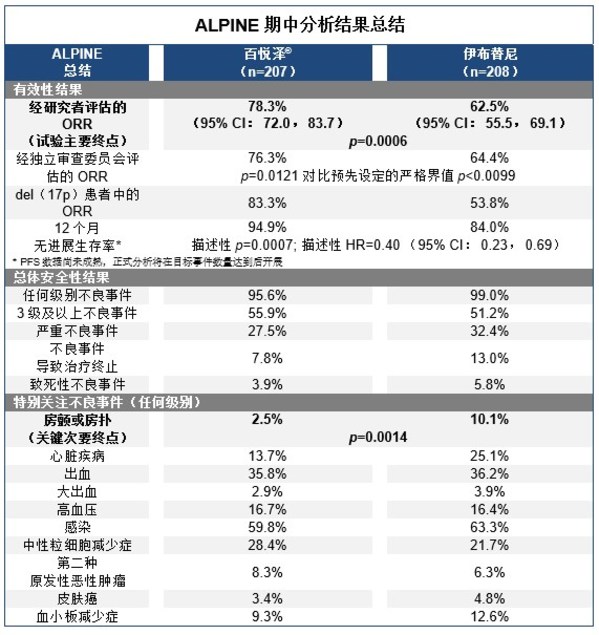
截止期中分析,在中位隨訪時間為15.3個月時,試驗已達到主要終點,相較伊布替尼,結果顯示百悅澤®經研究者評估的ORR(即,完全緩解[CR]和部分緩解[PR]患者相加比例)具優效性。而經研究者評估,百悅澤®的ORR展示了優效性。在期中分析中,百悅澤®取得了經獨立審查委員會(IRC)分析的ORR非劣性。試驗有效性結果如下:
- 經研究者評估,百悅澤®顯示出78.3%的ORR(95% CI: 72.0, 83.7),對比伊布替尼62.5%(95% CI:55.5,69.1),達到具有統計意義的改善(p=0.0006)
- 經IRC評估,百悅澤®顯示出76.3%的ORR,相比伊布替尼的64.4%,盡管數值上更高,但不具有統計意義的改善(p=0.0121,對比預先設定的嚴格界值p<0.0099)
- 經研究者評估,在腫瘤組織中染色體17p缺失,即del(17p)的患者中, 百悅澤®組患者獲得了83.3%的ORR,而伊布替尼組數據為53.8%
- PFS數據尚未成熟,正式分析將在目標事件數量達到后開展。經研究者評估,在12個月時,百悅澤®組的無進展生存率為94.9%,伊布替尼組為84.0%(描述性p=0.0007;描述性風險比[HR]= 0.40 [95% CI: 0.23, 0.69])
- 總生存期(OS)數據尚未成熟。在12個月時,百悅澤®組的總生存率為97.0%,伊布替尼組數據為92.7%(描述性p=0.1081; 描述性HR=0.54 [95% CI: 0.25, 1.16])
截止期中分析時,ALPINE同樣也達到了預定的有關安全性的關鍵次要終點,結果顯示百悅澤®相比伊布替尼顯著降低了房顫和房撲風險,同時在總體的心臟安全性指標上更有優勢。伊布替尼組更常發生患者治療終止的事件。試驗安全性結果如下:
- 百悅澤®組有195例患者(95.6%)發生至少1起任何級別的不良事件(AE),而伊布替尼組則有205例患者(99.0%)。最常見(≥ 10%)的AE包括貧血(百悅澤vs. 伊布替尼:13.2% vs. 15.0%)、關節痛(9.3% vs. 14.0%)、挫傷(10.3% vs. 8.7%)、咳嗽(12.7% vs. 6.3%)、腹瀉(16.7% vs. 19.3%)、高血壓(15.7% vs. 13.0%),肌肉痙攣(2.9% vs. 11.1%)、中性粒細胞減少癥(19.6% vs. 15.5%)、上呼吸道感染(21.6% vs. 14.0%)和尿路感染(10.8% vs. 8.2%)
- 百悅澤®組有114例患者(55.9%)發生了3級及以上AE,伊布替尼組有106例患者(51.2%)
- 百悅澤®組有56例患者(27.5%)發生了嚴重AE,伊布替尼組有67例患者(32.4%)
- 百悅澤®組分別有23例患者(11.3%)和81例患者(39.7%)因AE降低劑量或中斷給藥;而伊布替尼組分別有25例患者(12.1%)和84例患者(40.6%)因AE降低劑量或中斷給藥
- 16例患者(7.8%)因AE而終止百悅澤®治療,其中無心臟疾病AE發生;相比之下,27例患者(13.0%)因AE終止伊布替尼治療,其中7例由心臟疾病引起,包括2例房顫和心臟停搏、心力衰竭、心肌梗死、心悸和室顫各1例
- 百悅澤®組有8例患者發生致死性AE(3.9%),而伊布替尼組有12例(5.8%)
- 關鍵次要終點任何級別房顫或房撲事件率在百悅澤®組中為2.5%(5例患者),遠低于伊布替尼組的10.1%(21例患者,p=0.0014)
- 百悅澤®組有2例患者(1.0%)發生3級及以上房顫或房撲,而伊布替尼組則有4例患者(1.9%)
- 此外,特別關注的AE方面,兩組數據對比如下:心臟疾病(百悅澤®vs.伊布替尼:13.7% vs. 25.1%)、出血(35.8% vs. 36.2%)、大出血(2.9% vs. 3.9%)、高血壓(16.7% vs. 16.4%)、感染(59.8% vs. 63.3%)、中性粒細胞減少癥(28.4% vs. 21.7%)、第二種原發性惡性腫瘤(8.3% vs. 6.3%)、皮膚癌(3.4% vs. 4.8%)和血小板減少癥(9.3% vs. 12.6%)
- 特別關注的3級及以上AE,兩組數據對比如下:心臟疾病(百悅澤®vs.伊布替尼:2.5% vs. 6.8%)、出血(2.9% vs. 2.9%)、大出血(2.9% vs. 2.9%)、高血壓(10.8% vs. 10.6%)、感染(12.7% vs. 17.9%)、中性粒細胞減少癥(18.6% vs. 15.0%)、第二種原發性惡性腫瘤(4.9% vs. 1.9%)、皮膚癌(1.5% vs. 1.0%)和血小板減少癥(3.4% vs. 3.4%)
ALPINE期中分析結果總結
ALPINE |
百悅澤® |
伊布替尼 |
||
有效性結果 |
||||
經研究者評估的 ORR |
78.3% |
62.5% |
||
p=0.0006 |
||||
經獨立審查委員會評估的ORR |
76.3% |
64.4% |
||
p=0.0121 對比預先設定的嚴格界值p<0.0099 |
||||
del(17p)患者中的ORR |
83.3% |
53.8% |
||
12個月 |
94.9% |
84.0% |
||
描述性p=0.0007; 描述性HR=0.40 (95% CI: 0.23, 0.69) |
||||
* PFS數據尚未成熟,正式分析將在目標事件數量達到后開展 |
||||
總體安全性結果 |
||||
任何級別不良事件 |
95.6% |
99.0% |
||
3級及以上不良事件 |
55.9% |
51.2% |
||
嚴重不良事件 |
27.5% |
32.4% |
||
不良事件 |
7.8% |
13.0% |
||
致死性不良事件 |
3.9% |
5.8% |
||
特別關注不良事件(任何級別) |
||||
房顫或房撲 |
2.5% |
10.1% |
||
p=0.0014 |
||||
心臟疾病 |
13.7% |
25.1% |
||
出血 |
35.8% |
36.2% |
||
大出血 |
2.9% |
3.9% |
||
高血壓 |
16.7% |
16.4% |
||
感染 |
59.8% |
63.3% |
||
中性粒細胞減少癥 |
28.4% |
21.7% |
||
第二種 |
8.3% |
6.3% |
||
皮膚癌 |
3.4% |
4.8% |
||
血小板減少癥 |
9.3% |
12.6% |
||
欲了解更多百濟神州的研發和在EHA2021前后的活動,請訪問 https://beigenemedical.eu。
百濟神州EHA2021投資者電話會議和網絡直播信息
百濟神州將于北京時間6月12日(周六)零點(北美東部時間6月11日中午12點)舉行投資人及分析師電話會議和網絡直播,討論ALPINE臨床試驗在期中分析中獲得的結果、在EHA2021展示的其他數據及百悅澤®的臨床項目。
可通過百濟神州官方網站投資人版塊(http://ir.beigene.com或http://hkexir.beigene.com)收看本次電話會議的在線直播。會議結束兩小時后,可在90天內訪問官網投資人版塊觀看視頻回放。
關于慢性淋巴細胞白血病和小淋巴細胞淋巴瘤
慢性淋巴細胞白血病(CLL)是成年人中最常見的一種白血病,在2017年,全球范圍內約有114000起新增病例1,2。CLL導致患者骨髓中的白細胞及淋巴細胞持續增多,而腫瘤細胞在骨髓中不斷增殖將削弱患者抵抗感染的能力,并能夠進入患者血液,從而浸潤至淋巴結、肝臟、脾臟及身體其它器官1,3。BTK通路是惡性B細胞傳導信號的重要介質,能夠促進CLL發病4。小淋巴細胞淋巴瘤(SLL)是一種非霍奇金淋巴瘤,主要影響免疫系統中的B淋巴細胞。SLL與CLL相似,但腫瘤細胞主要蓄積于淋巴結中5。
關于ALPINE臨床試驗
ALPINE是一項隨機全球3期臨床試驗(NCT03734016),旨在評估百悅澤®對比伊布替尼用于治療先前接受過治療的復發或難治性(R/R)慢性淋巴細胞白血病(CLL)或小淋巴細胞淋巴瘤(SLL)患者。
該試驗中,652例患者被隨機至兩個試驗組接受治療,直至疾病進展或出現不可接受毒性;一個試驗臂中的患者接受劑量為每次160 mg、每日兩次的百悅澤®治療;另一試驗臂中的患者接受劑量為每次420 mg、每日一次的伊布替尼治療。總緩解率(ORR)的主要終點定義為百悅澤®對比伊布替尼達到預先設定的非劣效性。研究者及獨立審查委員會(IRC)基于國際慢性淋巴細胞白血病工作組(iwCLL)指導原則(2008年修訂版)評估CLL患者的緩解(但針對治療相關淋巴細胞增多CLL患者的評價標準有所調整),以及Lugano非霍奇金淋巴瘤分類標準評估SLL患者的緩解。經研究者和IRC評估的ORR將采用分級測試,首先評估非劣效性,隨后評估優效性。關鍵次要終點包括無進展生存期(PFS)和房顫或房撲事件率;其他次要終點包括持續緩解時間(DoR)、總生存期(OS)以及不良事件發生率。該項試驗目前正在進行中,將對經IRC評估的ORR優效性預先設定終點進行最終分析,以及在達到目標事件數量后對PFS進行正式分析。結果預期于2022年公布。
關于百悅澤®(澤布替尼)
百悅澤®(澤布替尼)是一款由百濟神州科學家自主研發的布魯頓氏酪氨酸激酶(BTK)小分子抑制劑,目前正在全球進行廣泛的臨床試驗項目,作為單藥和與其他療法進行聯合用藥治療多種 B 細胞惡性腫瘤。由于新的BTK會在人體內不斷合成,百悅澤®的設計通過優化生物利用度、半衰期和選擇性,實現對BTK蛋白完全、持續的抑制。憑借與其他獲批BTK抑制劑存在差異化的藥代動力學,百悅澤®能在多個疾病相關組織中抑制惡性B細胞增殖。
百悅澤®已在以下地區中獲批如下適應癥:
- 2019年11月,百悅澤®在美國獲批用于治療既往接受過至少一項療法的套細胞淋巴瘤(MCL)患者*;
- 2020年6月,百悅澤®在中國獲批用于治療既往至少接受過一種治療的成年套細胞淋巴瘤 (MCL)患者**;
- 2020年6月,百悅澤®在中國獲批用于治療既往至少接受過一種治療的成年慢性淋巴細胞白血病(CLL)/小淋巴細胞淋巴瘤(SLL) 患者**;
- 2021年2月,百悅澤®在阿拉伯聯合酋長國獲批用于治療復發或難治性MCL患者;
- 2021年3月,百悅澤®在加拿大獲批用于治療華氏巨球蛋白血癥(WM)成年患者
目前,除美國和中國以外,共有30多項百悅澤®針對多項適應癥的相關上市申請完成遞交工作,覆蓋歐盟以及其他20多個國家。
*該項適應癥基于總緩解率(ORR)獲得加速批準。針對該適應癥的完全批準將取決于驗證性試驗中臨床益處的驗證和描述。
**該項適應癥獲附條件批準。針對該適應癥的完全批準將取決于正在開展的確證性隨機、對照臨床試驗結果。
關于百濟神州腫瘤學
百濟神州通過自主研發或與志同道合的合作伙伴攜手,不斷推動同類最佳或同類第一的臨床候選藥物研發,致力于為全球患者提供有影響力、可及且可負擔的藥物。公司全球臨床研究和開發團隊已有約2300人,團隊規模還在不斷擴大。這支團隊目前正在全球范圍支持開展90多項臨床研究,已招募患者和健康受試者超過13000人。百濟神州自有的臨床開發團隊規劃并主導公司產品管線的研發和擴充,為覆蓋全球40多個國家/地區的臨床試驗提供支持和指導。公司特別關注血液腫瘤和實體腫瘤的靶向治療及腫瘤免疫治療,并重點研究單藥和聯合療法。目前,百濟神州自
主研發的三款藥物已獲批上市:百悅澤®(BTK 抑制劑,已在美國、中國、加拿大及其他國際市
場獲批上市)、百澤安®(可有效避免 Fcγ 受體結合的抗 PD-1 抗體,已在中國獲批上市)以
百匯澤®(PARP 抑制劑,已在中國獲批上市)。
同時,百濟神州還與其他創新公司合作,共同攜手推進創新療法的研發,以滿足全球健康需求。在中國,百濟神州正在銷售多款由安進和百時美施貴寶授權的腫瘤藥物。公司也通過與包括安進、百奧泰、EUSA Pharma、Mirati Therapeutics、Seagen以及Zymeworks在內的多家公司合作更大程度滿足當前全球范圍尚未被滿足的醫療需求。百濟神州還與諾華公司達成合作,授權諾華在北美、歐洲和日本開發、生產和商業化百澤安®。
關于百濟神州
百濟神州是一家立足科學的全球生物科技公司,專注于開發創新、可負擔的藥物,以為全球患者改善治療效果和提高藥物可及性。公司廣泛的藥物組合目前包括40多款臨床候選藥物,通過強化公司自主競爭力以及與其他公司開展合作,我們致力于加速現有多元、創新藥物管線的開發進程,希望能在2030年之前為全球20多億人全面改善藥物可及性。百濟神州在全球五大洲打造了一支近6000人的團隊。欲了解更多信息,請訪問www.beigene.com.cn。
前瞻性聲明
本新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律下定義的前瞻性聲明,包括關于ALPINE3期臨床試驗期中分析結果,百悅澤®與其他BTK抑制劑相比的潛在臨床獲益和優勢,ALPINE臨床試驗最終分析和SEQUOIA3期臨床試驗主要結果的預期時間表,百濟神州對百悅澤®的推進計劃、預期的臨床開發、藥政里程碑和商業化進程,在“百濟神州腫瘤學”和“關于百濟神州”副標題下提及的百濟神州計劃、承諾、抱負和目標。這些因素包括了以下事項的風險:ALPINE3期臨床試驗期中分析初步結果與最終分析可能不一致;ALPINE臨床試驗期中分析或最終分析結果可能無法支持百悅澤®用于治療CLL患者的相關藥物上市申請,以及此類上市申請和潛在獲批的時間表;臨床數據繼續支持百悅澤®的效益風險特征;百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發和實現并保持盈利的能力;新冠肺炎全球大流行對百濟神州的臨床開發、監管、商業化運營以及其他業務帶來的影響;以及百濟神州在最近季度報告的10-Q表格中“風險因素”章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該些信息。
- American Cancer Society. Cancer Facts & Figures 2021. Atlanta; American Cancer Society; 2021. Available here: Cancer Facts and Figures 2021
- Global Burden of Disease Cancer Collaboration. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-Years for 29 Cancer Groups, 1990 to 2017. JAMA Oncol. 2019;5(12):1749-1768.
- National Cancer Institute. Chronic Lymphocytic Leukemia Treatment (PDQ®)–Patient Version. Available here: Chronic Lymphocytic Leukemia Treatment (PDQ®)–Patient Version
- Haselager MV et al. Proliferative Signals in Chronic Lymphocytic Leukemia; What Are We Missing? Front Oncol. 2020; 10: 592205.
- Cancer Support Community. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma. Available here: https://www.cancersupportcommunity.org/chronic-lymphocytic-leukemiasmall-lymphocytic-lymphoma.
美國加州圣迭戈、美國麻省劍橋和中國北京2021年6月9日 /美通社/ -- Shoreline Biosciences, Inc.是一家生物科技公司,致力于運用智能技術,通過誘導多能干細胞(iPSC),設計開發同種異體即用型、標準化靶向自然殺傷(NK)細胞和巨噬細胞療法,用于治療癌癥和其他嚴重疾病。百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160)是一家全球化的生物科技公司。雙方今日宣布達成全球獨家戰略合作,聯動Shoreline的iPSC NK細胞技術與百濟神州的臨床前研發和臨床開發能力,開發并商業化一系列基于NK細胞療法的產品組合,用于治療各類惡性腫瘤。
Shoreline董事長兼CEO Kleanthis G. Xanthopoulos博士表示:“百濟神州是全球公認的生物科技領軍企業,對于今日宣布的合作,我們感到十分激動。我們期待將我們的iPSC NK細胞技術與百濟神州的研究和臨床開發能力結合,加速下一代細胞療法的開發,惠及全球患者。”
根據協議條款,Shoreline將從百濟神州處獲得4500萬美元的現金預付款,并有資格在達到特定研發、注冊、商業化里程碑時獲得研發資金、里程碑付款和特許權使用費。雙方已就此項多靶點合作達成共識,將共同合作,針對4個治療靶點中開發細胞療法,并有權在未來擴大合作。在合作框架下,百濟神州將牽頭全球臨床開發,Shoreline負責臨床生產。百濟神州將擁有有全球商業化權利,同時Shoreline有權保留2個靶點在美國和加拿大的商業化權利。連同本協議,在滿足特定條件的情況下,百濟神州有權在Shoreline下一輪股權融資時收購Shoreline部分股權。
百濟神州聯合創始人、董事長兼首席執行官歐雷強先生(John V. Oyler)表示:“我們很期待與Shoreline的合作,除了小分子和抗體療法,百濟神州的變革型藥物管線正在不斷拓展,現已進軍即用型細胞療法領域。目前這一治療領域在世界很多地方尚未得到普及,值得深入研發。我們希望通過與Shoreline這樣一家以iPSC為基礎的同種異體細胞療法領軍企業合作,將我們的蛋白工程修飾技術和他們的標準化NK細胞療法技術相結合。我們相信通過這樣的組合,加之我們在實體瘤和血液腫瘤領域的臨床開發能力,能夠將細胞療法帶給更多有需要的患者。”
關于Shoreline iPSC NK細胞技術
Shoreline通過精準、科學的基因改造,打造了基于iPSC開發NK細胞和巨噬細胞療法的研發專利技術。Shoreline的NK細胞、巨噬細胞療法設計旨在成為一項靶向、殺死腫瘤組織,恢復組織穩態的高效解決方案。這種療法基于Shoreline iPSC細胞修飾和擴增技術的優勢,形成了高效、可負擔、可放大的生產工藝流程,進而可用于通過更具成本效益、更省時高效的方式為患者帶來細胞療法。Shoreline的技術領跑再生醫學領域,正在用于開發針對癌癥、炎癥、和遺傳病等一系列適應癥的候選藥物。
關于Shoreline Biosciences
Shoreline 是一家生物科技公司,致力于運用智能技術,通過誘導多能干細胞(iPSC),設計開發同種異體即用型、標準化靶向細胞療法,用于治療癌癥和其他嚴重疾病。Shoreline目前著力通過其在iPSC細胞分化方法和疾病相關通路基因重編程方面的深厚經驗,建立一條自然殺傷 (NK) 細胞/巨噬細胞療法候選藥物管線。Shoreline 與 Advanced Cell Therapy Laboratory 有戰略生產合作,并得到包括 Boxer Capital、BVF、Commodore、Cormorant、Janus Henderson Investors、Logos、Kite(隸屬吉利德)、Wedbush Healthcare Partners、Stork Capital等優質機構投資者的支持。Shoreline Biosciences 總部位于加利福尼亞州圣地亞哥。
更多信息請訪問https://shorelinebio.com/ 或關注Shoreline領英頁面。
關于百濟神州
百濟神州是一家立足科學的全球生物科技公司,專注于開發創新、可負擔的藥物,以為全球患者改善治療效果和提高藥物可及性。公司廣泛的藥物組合目前包括40 多款臨床候選藥物,通過強化公司自主競爭力以及與其他公司開展合作,我們致力于加速現有多元、創新藥物管線的開發進程,希望能在2030 年之前為全球20多億人全面改善藥物可及性。百濟神州在全球五大洲打造了一支近6000人的團隊。欲了解更多信息,請訪問www.beigene.com。
百濟神州前瞻性聲明
本新聞稿包含 1995 年《私人證券訴訟改革法案》和其他聯邦證券法所定義的前瞻性聲明,涵蓋了百濟神州有關運用引進技術開發候選產品的未來的開發和潛在商業化計劃;向Shoreline Biosciences償付的潛在款項;引進技術的潛力;和協議雙方所作承諾和合作的潛在利益的聲明。由于各種重要因素的影響,實際結果可能與前瞻性聲明有重大差異。這些因素包括了以下事項的風險:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表和進展以及藥物上市審批;百濟神州的上市藥物及候選藥物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的知識產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發和實現并保持盈利的能力;新冠肺炎全球大流行對百濟神州的臨床開發、監管、商業化運營以及其他業務帶來的影響;百濟神州在最近季度報告的10-Q表格中“風險因素”章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該些信息。
百濟神州總裁、首席運營官兼中國區總經理吳曉濱博士表示:“為滿足預計供應需求,公司從2017年開始投入建設該商業規模生物藥生產基地。自那以來,百澤安®在中國已獲批用于多項適應癥的治療并被納入國家醫保藥品目錄(NRDL),我們同時與諾華公司就百澤安®達成在歐洲、北美和日本的授權合作。廣州生物藥生產基地獲批開展商業化生產將極大程度提高我們對百澤安®和公司研發管線中其他生物藥的生產能力,推動我們繼續履行對藥品生產質量、安全性和合規性的堅定承諾。”
百濟神州廣州生物藥生產基地的建設符合美國食品藥品監督管理局(FDA)、中國國家藥品監督管理局(NMPA)和歐洲藥品管理局(EMA)采用的現有藥品生產質量管理規范(cGMP)。該基地預計將成為中國第一家無紙化生產的生物藥生產基地,并引入包括三維建模、數字孿生、模塊化設計和人工智能等高新技術來提升生產質量和效率。
]]>王愛軍女士在生物科技、制藥、醫療設備、診斷系統和消費品行業都擁有豐富的全球金融經驗。她于2020年6月加入百濟神州,擔任企業優化高級副總裁兼副首席財務官,駐公司美國麻省劍橋辦公室。王愛軍女士通過跨組織建立合作關系與優化資源分配,在推動價值創造方面發揮了重要作用,并提升了財務部門的整體領導能力。與此同時,在百濟神州擔任Chief Business Executive一職的 Angus Grant博士將負責領導公司的戰略團隊。
百濟神州聯合創始人、董事長兼首席執行官歐雷強先生(John V. Oyler)表示:“近一年加入百濟神州以來,Julia已成為公司領導團隊中的關鍵成員,發揮重要作用。隨著百濟神州規模不斷擴大,逐漸成為一家擁有數千名員工且業務遍布全球的大型企業,我們慶幸能有Julia這樣資歷深厚的領導人帶領我們的財務運營。在此,我也想對梁恒博士道一聲感謝。自2015年加入百濟神州以來,他一直兢兢業業,不僅是業內有獨特見地的領導者,更是我們真摯的好友。我們祝他一切順利,也感謝他為公司所做的一切,包括正在進行的交接工作。”
王愛軍女士表示:“我很榮幸能夠擔任百濟神州首席財務官一職,和公司一起通過為全世界更多的患者創造具有影響力且可負擔、可及的藥物來革新生物科技行業。在百濟神州,服務患者的承諾貫穿公司上下,體現在每個人每一天的工作之中。梁恒博士為百濟神州成為一家兩地上市的商業化階段成長型公司打下了堅實的基礎,我的目標是繼續將現有資源投入到公司建設中,幫助完成我們重要的使命。”
加入百濟神州之前,王愛軍女士供職于Alexion Pharmaceuticals,擔任全球業務財務、企業財務及企業策劃高級副總裁。此前,她在Quest Diagnostics擔任多項領導職位,包括美國區財務兼企業商業部副總裁和財務價值創造副總裁。王愛軍女士還曾在強生集團擔任多項運營業務的首席財務官,包括強生在中國的制藥業務西安楊森。此前,她還在百事可樂公司領導財務業務。
王愛軍女士擁有杜克大學富卡(Fuqua)商學院的工商管理碩士學位和山東師范大學的英國語言文學學士學位。
]]>在2018 年3月至2020 年2月期間,Corsee Sanders博士擔任新基公司首席醫學官辦公室戰略顧問及百時美施貴寶公司過渡顧問,幫助將Juno Therapeutics研發組織分別與新基公司和百時美施貴寶公司進行有效整合。 Corsee Sanders博士曾為Juno Therapeutics執行委員會成員,擔任開發運營執行副總裁,負責公司戰略運營、定量科學、生物樣本及臨床運營。此前,Corsee Sanders博士曾在美國基因泰克公司(羅氏)供職約23年,擔任多項領導職位,其中包括全球生物統計負責人以及全球臨床運營負責人。在這項職位任職期間她曾領導全球近2500名員工,在70多個國家計劃和執行全球開發與本地臨床試驗。Corsee Sanders博士還曾擔任羅氏旗下日本中外制藥聯合投資組合管理委員會聯席主席。
百濟神州聯合創始人、董事長兼首席執行官歐雷強(John V. Oyler)先生表示:“Corsee Sanders博士是一位極富洞察力的業界領袖,她自身的科研優勢以及在業務運營方面的卓越能力能夠為臨床試驗開發工作帶來指導,進而幫助我們為全球患者帶來重要醫學突破。我們非常高興歡迎Corsee Sanders博士加入公司董事會,也十分期待她強大的專業背景能在百濟神州不斷擴大研發管線、為患者創造更大益處的道路上發揮巨大價值。”
Corsee Sanders博士曾直接參與或監管多款藥品的開發,包括美羅華®、赫賽汀®、TNKase®(替奈普酶)、Cathflo®(阿替普酶)、Xolair®(奧馬珠單抗)、安維汀®、特羅凱®、諾適得®、Zelboraf®(威羅菲尼)、帕捷特®、Erivedge®(維莫德吉)、Gazyva® (奧比妥珠單抗)、Kadcyla®(曲妥珠單抗)、Alecensa®(艾樂替尼)、Cotellic®(考比替尼)、Venclexta®(維奈托克)、泰圣奇®、Ocrevus®(奧美珠單抗)、Hemlibra®(重組艾米希組單抗)、開瑞坦®和lisocabtagene maraleucel(一款用于非霍奇金淋巴瘤的CAR-T細胞療法)。她曾擔任TransCelerate Biopharma(美國一個非盈利性的醫藥行業聯盟)董事會成員直至2016年,現任位于華盛頓州西雅圖市Fred Hutchinson癌癥研究中心以及以下生物科技公司董事會成員:Molecular Templates(納斯達克代碼: MTEM),傳奇生物“Legend Biotech Corporation”(納斯達克代碼: LEGN )和私有公司AltruBio(前身為AbGenomics)。
Corsee Sanders博士表示:“我很榮幸加入百濟神州董事會,也很高興能在公司的帶領下,秉承執著的創新精神以及渴望挑戰現狀的勇氣為億萬患者帶來高品質的創新療法,不斷推動行業發展。無論是公司廣泛的自主研發能力,還是其早期、后期研發管線以及商業化產品組合,百濟神州團隊都給我留下了深刻的印象。”
Corsee Sanders博士以優異的成績畢業于菲律賓大學,擁有統計學理學學士和理學碩士學位,并獲得賓夕法尼亞大學沃頓商學院統計學碩士和博士學位。
關于百濟神州
百濟神州是一家全球性、商業階段的生物科技公司,專注于研究、開發、生產以及商業化創新性藥物以為全世界患者提高療效和藥品可及性。百濟神州目前在中國大陸、美國、澳大利亞和歐洲擁有 4200 多名員工,正在加速推動公司多元化的新型療法藥物管線。目前,百濟神州兩款自主研發的藥物,BTK 抑制劑百悅澤®(澤布替尼膠囊)正在美國和中國進行銷售、抗 PD-1 抗體藥物百澤安®(替雷利珠單抗注射液)在中國進行銷售。此外,百濟神州在中國正在或計劃銷售多款由安進公司、新基物流有限公司(隸屬百時美施貴寶公司)以及 EUSA Pharma 授權的腫瘤藥物。欲了解更多信息,請訪問 www.beigene.cn。
前瞻性聲明
本新聞稿包含根據《1995 年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律中定義的前瞻性聲明,包括關于公司未來發展戰略的聲明。由于各種重要因素的影響,實際結果可能與前瞻性聲明有重大差異。這些因素包括了以下事項的風險:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支持進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時間表 和進展以及產品上市審批;百濟神州的上市產品及藥物候選物(如能獲批)獲得商業成功的能力;百濟神州對其技術和藥物知識產權保護獲得和維護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州有限的營運歷史和獲得進一步的營運資金以完成候選藥物開發和商業化的能力;新冠肺炎全球大流行對公司臨床開發、商業化運營以及其他業務帶來的影響;以及百濟神州在最近季度報告的 10-Q 表格中“風險因素”章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關于潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發布之日,除非法律要求,百濟神州并無責任更新該些信息。
圖片- https://photos.prnasia.com/prnh/20200825/2895796-1?lang=1
]]>