上海2022年2月9日 /美通社/ -- 2022年2月8日,Science 在線發表了中國科學院上海藥物研究所徐華強教授/尹萬超博士團隊與濟民可信鄧俗俊博士團隊合作的題為“Structures of the Omicron spike trimer with ACE2 and an anti-Omicron antibody”的最新成果(刊出地址:https://www.science.org/doi/10.1126/science.abn8863 )。 該研究解析了Omicron刺突蛋白與人源受體ACE2或廣譜抗新冠抗體JMB2002復合物的高分辨冷凍電鏡結構,闡述了Omicron變異株傳播迅速和免疫逃逸的分子機制,并揭示了治療抗體JMB2002全新的作用機制,為JMB2002對新冠病毒Omicron變異株仍具有中和功能及進一步開展臨床試驗研究提供了理論基礎。為廣譜抗新冠抗體的研發提供了新的思路,也可為全球新冠疫苗研發提供新的參考。
研究者發現Omicron刺突蛋白結合其受體ACE2相比于野生型提高6-9倍,通過解析Omicron變異株刺突蛋白與人源受體蛋白ACE2復合物的高分辨率冷凍電鏡結構(圖1A),從結構中觀察到Omicron刺突蛋白三聚體相鄰的RBD存在相互作用(圖1B),利于Omicron刺突蛋白的RBD持續處于開放狀態,增強了Omicron變異株的傳染性;結合熱動力學實驗發現Omicron刺突蛋白的RBD高度靈活且不穩定,其熱溶解溫度降了超過5攝氏度(圖1C),使得刺突蛋白更容易從閉合構象向開放構象轉換,進一步增強Omicron變異株的傳染性。簡而言之,Omicron刺突蛋白RBD的相互作用及不穩定性,促進Omicron刺突蛋白與ACE2的相互作用,從原子水平解釋了Omicron變異株傳染性增強的潛在機制。
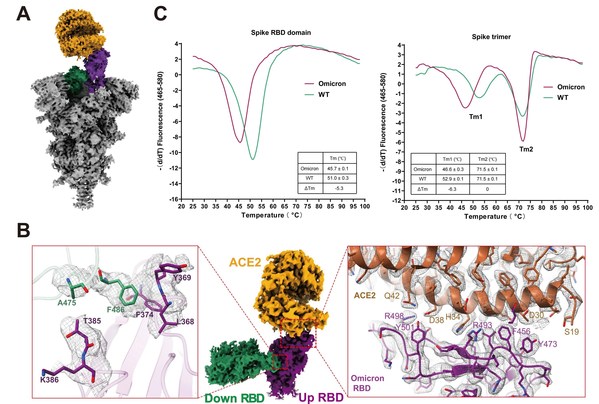
圖1 Omicron刺突蛋白結合人源受體ACE2的結構。A展示Omicron刺突蛋白結合人源ACE2結構的整體構象,B為RBD-RBD二聚體,以及RBD結合ACE2的相互作用界面,C為刺突蛋白的熱穩定結果。
從解析的結構中看到Omicron刺突蛋白的眾多突變位點位于蛋白表面,導致了大部分中和抗體對Omicron突變株失去了中和活性。值得慶幸的是,濟民可信自主研發的新冠中和抗體JMB2002對Omicron刺突蛋白的親和力是對野生型的4倍,展示出強大的抑制Omicron變異株的潛力。為闡述JMB2002抗Omicron變異株的分子機制,研究者解析了Omicron刺突蛋白與JMB2002復合物的結構(圖2A-C);從結構中發現Omicron刺突蛋白三聚體內同樣存在RBD相互作用(圖2D),JMB2002抗體結合Omicron刺突蛋白RBD后阻礙了人源受體蛋白ACE2與RBD的結合(圖2E);令人驚奇的是,JMB2002以一種全新的構象結合在RBD與人源ACE結合界面的背部,是一種全新的結合表位的中和抗體(圖2F)。
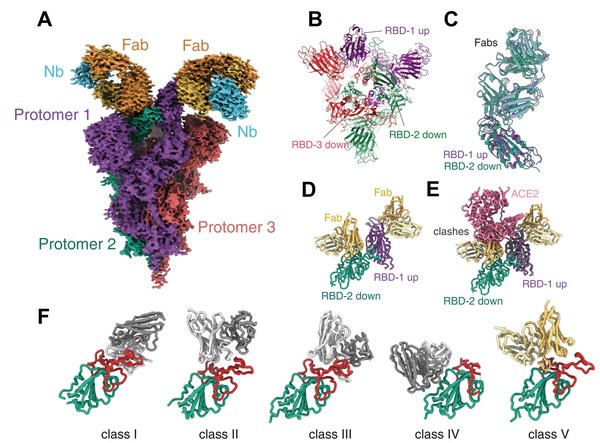
圖2 Omicron刺突蛋白結合抗體JMB2002的結構。A展示JMB2002抗體結合Omicron刺突蛋白的整體結構,B復合物中Omicron刺突蛋白的構象,C為與JMB2002抗體結合的兩個RBD的結構比較,D為JMB2002抗體結合Omicron刺突蛋白的結構中RBD-RBD的二聚體,E展示了JMB2002抗體結合Omicron的RBD后阻斷ACE2進一步結合,F為抗新冠病毒中和抗體的分類,JMB2002抗體為新型抗體,被歸為第五類。
在新冠病毒變異株Omicron大流行之際,本次研究成果極具原創性與新穎性,論文通過同行評審并在Science發表,將助力全球科研工作者充分了解Omicron變異株的特性,為JMB2002對新冠病毒Omicron變異株仍具有中和功能及進一步開展臨床試驗研究提供了理論基礎。為廣譜抗新冠抗體的研發提供了新的思路,也可為全球新冠疫苗研發提供新的參考。
上海藥物所徐華強教授團隊主要成員和濟民可信鄧俗俊博士團隊主要成員為該文的共同第一作者。上海藥物所徐華強教授、尹萬超研究員和濟民可信鄧俗俊博士為該文共同通訊作者。

